一种硝基呋喃类小分子化合物在制备诱导铁死亡和/或减缓胃癌化疗耐药药物中的应用
文献发布时间:2023-06-19 12:22:51
技术领域
本发明涉及医药技术领域,特别涉及一种硝基呋喃类小分子化合物在制备诱导铁死亡和/或减缓胃癌化疗耐药药物中的应用。
背景技术
胃癌是第五大恶性肿瘤,也是世界范围内癌症相关死亡的主要原因。中国是一个胃癌高发的国家,2015年中国新发胃癌病例数约为67.9万例,死亡病例数约为49.8万例。我国胃癌的疾病负担重,预后较差,严重威胁着人民群众的生命和健康,是肿瘤防治的重点。胃癌患者常常确诊较晚,经常在诊断晚期,丧失根治机会。目前,胃癌治疗方法主要包括手术治疗、化疗,放疗、免疫治疗以及分子靶向治疗。手术切除仍是治疗局部胃癌的唯一方法,然而,单纯手术的生存率较低,5年生存率约为20-50%,且术后复发率为50%-70%。在胃癌治疗中,化疗仍然是非常重要的治疗手段之一。五氟尿嘧啶(5-FU)作为一种抗代谢药物,是胃癌治疗的一线用药。但在临床实践中,5-FU时常发生化疗耐药,限制了其临床疗效。大多数胃癌患者在诊断时就已经存在广泛浸润、淋巴结转移和化疗耐药,这些是导致胃癌的预后不良和生存率较低的主要因素。虽然目前已有许多研究探讨了影响化疗耐药的作用机制,但对于胃癌化疗耐药的调节因素及其具体机制尚不完全清楚。胃癌的化疗耐药一直是困扰临床胃癌治疗成功的巨大障碍。
铁死亡是2012年由Brent R.Stockwell提出的一种铁依赖的脂质过氧化所驱动的细胞死亡方式,与多种疾病的生理病理进程有关。研究表明,铁死亡与其他类型的程序性细胞死亡方式依赖于不同的细胞信号转导通路,因而肿瘤细胞凋亡防御性机制并不影响铁死亡诱导剂致死性作用动物发挥。因此,铁死亡机制很可能会成为杀灭不同组织来源及病理类型恶性肿瘤细胞的理想方案。越来越多的证据表明,铁死亡与肿瘤耐药密切相关。耐药的肿瘤细胞在药物的毒性压力下,会进行胞内信号网络重构,能够抵抗化疗药物的杀伤。但是,信号网络重构后的细胞可能对铁死亡更加敏感。因此,小分子化合物诱导的铁死亡,可增强化疗药物敏感性。目前的研究显示,铁死亡通路中存在许多关键的代谢物和酶。一方面是谷氨酸(Glu)水平对胱氨酸(Cys)输入的调节,其中SLC7A11是xCT系统的重要转运体,它主要的功能是转运胱氨酸(Cystine),Cystine是谷胱甘肽(GSH)的合成底物,GSH促进谷胱甘肽过氧化物酶(GPX4)的合成。GPX4是铁死亡中非常核心的关键蛋白,通过减少膜磷脂过氧化物抑制铁死亡。研究发现,将GPX4抑制后会诱导细胞发生铁死亡。另一方面是铁死亡过程中脂质代谢的调节。此外,铁代谢以及铁催化自由基介导的脂质氧化连锁反应也是调节铁死亡的重要环节,一些影响铁离子产生、转运和储存的关键分子参与其中,如TFRC、IREB2、FTH1、FTL和DMT1等。其中,FTH1是铁蛋白重链多肽1,主要功能是介导亚铁离子的储存;研究表明如果细胞中FTH1被抑制,将会造成亚铁离子在细胞内的积累从而诱导铁死亡。目前,铁死亡有一些关键小分子调节剂,如铁死亡诱导剂Erastin和RSL4,铁死亡抑制剂Ferrostatin 1(Fer-1)和Liproxstatin-1。另外,也有多篇文献报道了铁死亡抑制剂,例如CN111870613A、CN109748884A等,但其并未对是否可减缓胃癌的化疗耐药进行研究。
因此,研发可增加癌症细胞对化疗药物的敏感性,减缓胃癌的化疗耐药的药物具有重要的研究意义和医学应用价值。
发明内容
本发明的目的在于克服现有的胃癌化疗药物(例如五氟尿嘧啶)存在化疗耐药的缺陷或不足,提供一种硝基呋喃类小分子化合物在制备诱导铁死亡和/或减缓胃癌化疗耐药药物中的应用。本发明研究发现硝基呋喃类小分子化合物具有较好的诱导铁死亡(特别是胃癌铁死亡)作用,同时还具有逆转胃癌耐药作用,在制备诱导铁死亡药物,及减缓胃癌化疗耐药药物中具有广泛的用途。
为了实现本发明的上述目的,本发明提供了如下技术方案:
一种硝基呋喃类小分子化合物在制备诱导铁死亡和/或减缓胃癌化疗耐药药物中的应用,所述硝基呋喃类小分子化合物具有如式(Ⅰ)所示结构:
本发明研究发现,特定结构的硝基呋喃类小分子化合物(一种小分子化合物,其分子式为C
经研究发现,本发明的硝基呋喃类小分子化合物可抑制胃癌细胞侵袭、浸润、生长、增殖和克隆。
优选地,所述硝基呋喃类小分子化合物在制备抑制胃癌细胞克隆药物中的应用。
优选地,所述硝基呋喃类小分子化合物在制备抑制胃癌细胞转移浸润药物中的应用。
优选地,所述硝基呋喃类小分子化合物在制备抑制胃癌细胞生长药物中的应用。
优选地,所述硝基呋喃类小分子化合物在制备降低铁死亡关键蛋白GPX4、SLC7A11和/或FTH1的mRNA和/或蛋白表达的药物中的应用。
优选地,所述硝基呋喃类小分子化合物在制备诱导胃癌铁死亡药物中的应用。
优选地,所述减缓胃癌化疗耐药药物为减缓5-FU耐药药物。
优选地,所述药物包括硝基呋喃类小分子化合物或其药学上可以接受的盐或溶剂合物,还包括5-FU。
将硝基呋喃类小分子化合物或其药学上可以接受的盐或溶剂合物与五氟尿嘧啶(5-FU)联用,可抑制5-FU耐药的胃癌细胞的生长,抑制5-FU耐药的胃癌细胞的克隆形成,有效减缓5-FU耐药;并且在发挥药效的剂量下表现出较低的毒性。目前晚期胃癌可应用的靶向药物十分有限,本发明为靶向铁死亡治疗胃癌的新药开发提供了重要参考,且为改善胃癌耐药提供了一定的治疗策略,具有良好的应用前景。
具体地,通过裸鼠皮下细胞移植瘤模型实验,硝基呋喃类小分子化合物和5-FU联用能够抑制5-FU耐药胃癌的生长。
通过人源化胃癌小鼠移植瘤模型(PDX)硝基呋喃类小分子化合物和5-FU联用能够抑制胃癌生长,诱导胃癌铁死亡。
优选地,所述药物包括硝基呋喃类小分子化合物或其药学上可接受的盐或溶剂合物,还包括一种或多种药学上可接受的载体、稀释剂或赋形剂。
术语“药学上可接受的”是指某载体、稀释剂或赋形剂,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
术语“可接受的盐”是指上述化合物或其立体异构体,与无机和/或有机酸和碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将上述化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。
更为优选地,所述药学上可以接受的盐为药学上可以接受的无机盐或有机盐。
具体地,药学上可以接受的盐包括但不限于:硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、鞣酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐,甲烷磺酸盐(甲磺酸盐)、乙烷磺酸盐、苯磺酸盐、对甲苯磺酸盐、和双羟萘酸盐;或者铵盐(例如伯胺盐、仲胺盐、叔胺盐、季铵盐)、金属盐(例如钠盐、钾盐、钙盐、镁盐、锰盐、铁盐、锌盐、铜盐、锂盐、铝盐)。
优选地,所述药物的剂型为注射剂、胶囊剂、片剂、丸剂或颗粒剂。
相对于现有技术,本发明具有如下的优点及效果:
本发明提供的硝基呋喃类小分子化合物具有较好的诱导铁死亡(特别是胃癌铁死亡)作用,同时还具有逆转胃癌耐药作用,在制备诱导铁死亡药物,及减缓胃癌化疗耐药药物中具有广泛的用途。
附图说明
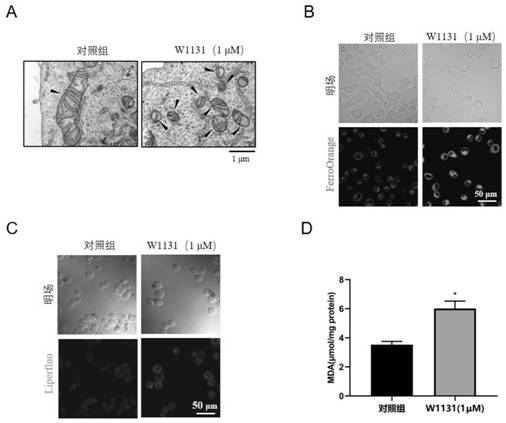
图1为W1131诱导胃癌细胞发生铁死亡结果图;图(1A)表示W1131处理后的胃癌细胞在电镜下的形态,表现为线粒体变小,线粒体嵴减少甚至消失以及线粒体膜密度增高;图(1B)表示W1131可以增加胃癌细胞细胞内Fe2+的产生;图(1C)表示W1131可以增加胃癌细胞脂质ROS的产生;图(1D)表示W1131可以增加胃癌细胞脂质过氧化物MDA的产生;
图2为W1131对铁死亡相关分子的影响;图(2A)表示W1131对胃癌细胞中铁死亡相关基因的mRNA的影响;图(2B)表示W1131对胃癌细胞中铁死亡相关蛋白的影响;
图3为W1131抑制胃癌细胞的增殖和转移结果图;图(3A)表示W1131对胃癌细胞的增殖抑制可以被铁死亡抑制剂Fer-1部分逆转;图(3B)表示W1131随着药物浓度的增加,胃癌细胞的克隆形成图;图(3C)表示W1131随着药物浓度的增加,胃癌细胞的克隆形成统计图;图(3D)W1131随着药物浓度的增加,胃癌细胞的侵袭图;图(3E)为W1131随着药物浓度的增加,胃癌细胞的侵袭统计图。
图4为W1131与5-FU联合用药在胃癌5-FU耐药株中抑制肿瘤生长结果图;图(4A)表示胃癌细胞MGC803和耐药型胃癌细胞MGC803/5-FU对5-FU的敏感性;图(4B)表示W1131与5-FU可以发挥协同作用抑制耐药细胞的细胞活力;图(4C)表示W1131与5-FU可以发挥协同作用抑制耐药细胞的克隆形成;
图5为W1131与5-FU联合用药在体内模型中抑制耐药肿瘤生长结果图;图(5A)表示在耐药胃癌小鼠移植瘤模型中,各组给药25天期间裸鼠的肿瘤体积统计图;图(5B)表示各组给药25天后处死小鼠,取材得到的皮下胃癌肿瘤外观图;图(5C)表示各组给药25天后处死小鼠,取材得到的皮下胃癌肿瘤重量统计图。
具体实施方式
以下结合实施例和附图进一步解释本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,本发明所用试剂和材料均为市购。
实施例1硝基呋喃类小分子化合物W1131的制备
4-(3-(4-(5-硝基呋喃-2-甲酰胺)苯基)咪唑并[1,2-a]吡啶-7-基)-3,6-二氢吡啶-1(2H)-羧酸叔丁酯(W1131)的结构及制备过程如下所示:
具体制备过程为:
步骤1:制备7-溴代咪唑并[1,2-a]吡啶(W1131a)
将4-溴吡啶-2-胺(8.0g,46.2mol)和2-氯乙醛(9.07g,39.1mol)溶解在100mL乙醇中的溶液。在78℃的室温下搅拌4小时,过滤,旋干溶剂后柱层析(二氯甲烷/甲醇=70:1,V/V)得到棕色油状纯物,得到所需产物(6.25g,69.0%)。
步骤2:7-溴-3-(4-硝基苯基)咪唑并[1,2-a]吡啶(W1131b)
在室温下将W1131b(1500mg,7.6mmol)、碳酸钾(5244mg,38mmol)和1-碘代-4-硝基苯(2.85g,11.48mmol)加入干净的烧瓶中,用20mL N,N-二甲基甲酰胺溶解,在氮气保护下将催化剂醋酸钯(85mg,0.38mmol)加入上述反应液中。在130℃下搅拌12h后,用100ml乙酸乙酯稀释溶液。用盐水冲洗有机层并用无水硫酸钠干燥。旋干所得溶液,用硅胶柱层析(石油醚/乙酸乙酯=65:1,V/V)纯化,得到所需产品((1200mg,49.6%)为棕红色固体。
步骤3:制备4-(3-(4-硝基苯基)咪唑并[1,2-a]吡啶-7-基)-3,6-二氢吡啶-1(2H)-羧酸叔丁酯(W1131c)
将化合物W1131b(736mg,2mmol)和N-Boc-1,2,5,6-四氢吡啶-4-硼酸频哪醇酯(679.8mg,2.2mmol)溶于10mL 1,4-二氧烷/水(3:1,V/V)的溶液中,在室温下,将碳酸钾(424mg,4mmol)和[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(81.6mg,0.1mmol)加入上述反应溶液中。在110℃下搅拌12h后,用100ml乙酸乙酯稀释反应液,用盐水洗有机层并用无水硫酸钠干燥。蒸发所得溶液,并通过硅胶柱层析法(二氯甲烷/甲醇=50:1,V/V)纯化,得到棕色固体545mg,产率,65%。
步骤4:4-(3-(4-氨基苯基)咪唑并[1,2-a]吡啶-7-基)-3,6-二氢吡啶-1(2H)-羧酸叔丁酯(W1131d)
将W1131c(390mg,1.0mmol)溶解在15mL乙醇中,在室温下,氯化铵(534.9mg,10mm
步骤5:制备4-(3-(4-(5-硝基呋喃-2-甲酰胺)苯基)咪唑并[1,2-a]吡啶-7-基)-3,6-二氢吡啶-1(2H)-羧酸叔丁酯(W1131e)
将W1131d(252mg,0.65mmol)溶于15mL N,N-二甲基甲酰胺之中,室温下,将5-硝基呋喃-2-羧酸(151.1mg,0.975mmol)、HATU(494mg,1.3mmol)及N,N-二异丙基乙胺(251.55mg,1.95mmol)加入其中。在室温下搅拌4小时后,用100ml乙酸乙酯稀释溶液。用盐水冲洗有机层并用无水硫酸钠干燥。蒸发所得溶液,并通过硅胶柱层析(二氯甲烷:甲醇=5:1,V/V)纯化,得到呈棕黄色固体的目标产物(80mg,61.1%)
步骤6:制备5-硝基-N-(4-(7-(1,2,3,6-四氢吡啶-4-基)咪唑并[1,2-a]吡啶-3-基)苯基)呋喃-2-甲酰胺(W1131)
将化合物W1131d(80mg,0.151mmol)溶于5mL二氯甲烷中的溶液中,室温下将1mL三氟乙酸滴加到上述反应溶液中。在室温下搅拌1小时后,用50mL二氯甲烷稀释溶液。在冰浴下加入饱和碳酸氢钠溶液,调节至pH=7。用盐水冲洗有机层并用无水硫酸钠干燥。蒸发所得溶液,并通过硅胶柱层析(二氯甲烷/甲醇=50:3,V/V)纯化,得到所需产物(42.1mg,65%),为黄棕色固体。
实施例2 W1131诱导胃癌细胞发生铁死亡
(1)细胞培养
本发明中所用AGS、MGC803细胞培养于含有10%胎牛血清与1%双抗青霉素与链霉素的RPIM-1640培养基中,置于37℃,5%CO2的细胞培养箱中。MGC803/5-FU细胞为在MGC803细胞中采用体外低浓度梯度递增的方法诱导肿瘤细胞对5-FU产生耐药性,获得对5-FU具有耐药性的MGC803细胞株,并将其继续维持培养在含5-FU的完全培养基中。
(2)透射电镜检测
1)取对数生长期的胃癌细胞,消化细胞,计数,以(20-40)×10
2)贴壁后,对照组加入相应的DMSO,给药组加入W1131(1μM),继续培养24h;
3)培养好的细胞弃培养基,加入2.5%的常温电镜固定液,常温固定5min左右,用细胞刮沿着一个方向轻轻刮下细胞,避免把细胞刮破;
4)接着用移液管把细胞液吸入离心管内,放入离心机,2000转,离心2min,细胞应有绿豆大小;
5)弃固定液后加入新的电镜固定液,把细胞团轻轻挑起,悬浮于固定液中;
6)室温避光固定30min,再转移至4℃保存,送检(电镜由武汉赛维尔生物公司代测)。
(3)MDA检测试验
1)样品的准备将细胞用细胞裂解液RIPA裂解后,4℃,10000g-12000g离心10min,取上清用于后续测定。
2)BCA定量
样品准备完毕后,用BCA蛋白浓度测定试剂盒测定蛋白浓度。
3)试剂盒的准备
①称取适量TBA,用TBA配制液配制成浓度为0.37%的TBA储存液,室温避光保存;
②根据待测定的样品数,按照1份样品用量为TBA稀释液:TBA储存液:抗氧化剂=150μL:50μL:3μL的配方,在检测前新鲜配制适量的MDA检测工作液,配制好的MDA检测工作液仅限当天使用;
③取适量标准品用蒸馏水稀释至1、2、5、10、20、50μM,用于后续制作标准曲线。
4)样品测定
①在离心管100μLPBS作为空白对照,加入100μL不同浓度标准品用于制作标准曲线,加入100μL样品用于测定;随后加入200μLMDA检测工作液;
②混匀后,100℃或沸水浴加热15min;
③水浴冷却至室温,1000g室温离心10min。取200μL上清加入到96孔板中,随后用酶标仪在532nm测定吸光度;
④将样品溶液的测定结果代入标曲,计算出样品溶液中的MDA含量后,结合BCA定量结果,通过单位重量的蛋白含量来表示最初样品中的MDA含量。
(4)FerroOrange探针荧光成像试验
FerroOrange是一种新型的荧光探针,可对活细胞内的Fe2+进行荧光成像。
1)将细胞接种于Confocol皿中,在37℃5%CO2培养箱中培养过夜;
2)去除上清液,并用HBSS洗涤细胞3次;
3)更换含有药物的培养基,在37℃5%CO2培养箱中培养24h;
4)FerroOrange工作溶液的准备
含有24μg FerroOrange的管中加入35μL DMSO,用移液器吹打混匀,配制得到1mmol/l FerroOrange溶液,于-20℃保存。临用之前用HBSS溶液稀释1mmol/l的FerroOrange溶液,制备得到1μmol/l的FerroOrange工作溶液,现配现用。
5)向细胞中加入浓度为1μmol/l的FerroOrange工作液,在37℃5%CO2培养箱中培养30min;
6)在荧光共聚焦显微镜下观察细胞。
(5)Liperfluo探针荧光成像试验
Liperfluo是Spy-LHP(一种脂质过氧化氢探针)的衍生物,可用于检测脂质过氧化物(LPO),当在乙醇等有机溶剂中发生脂质氧化过程时Liperfluo会被脂质过氧化物特异性氧化而发出很强的荧光,适用于活细胞中脂质过氧化物的荧光成像。
1)将细胞接种于Confocol皿中,在37℃5%CO2培养箱中培养过夜;
2)更换含有药物的培养基,在37℃5%CO2培养箱中培养24h;
3)Liperfluo工作液的配制
取60μL DMSO加入含有50μg Liperfluo的管子中,用移液器吹打混匀,配制成1mmol/l的Liperfluo溶液,用铝箔纸包裹,并在1天内用完;
4)在细胞中加入Liperfluo溶液,使其终浓度为10μmol,在37℃5%CO2培养箱中培养30min;
5)在荧光共聚焦显微镜下观察细胞。
(6)实验结果
实验结果如图1所示,图(1A)显示W1131处理后的胃癌细胞在电镜下的形态,表现为线粒体变小,线粒体嵴减少甚至消失以及线粒体膜密度增高;图(1B)显示W1131可以增加胃癌细胞细胞内Fe2+的产生;图(1C)显示W1131可以增加胃癌细胞脂质ROS的产生;图(1D)显示W1131可以增加胃癌细胞脂质过氧化物MDA的产生。
实施例3 W1131对铁死亡相关蛋白的影响
(1)荧光定量PCR
1)细胞总RNA提取
①细胞经不同浓度W1131处理48h后,吸去培养基,用PBS清洗两遍,在通风橱中加入Trizol,在5min内吹打细胞直至完全脱落,将细胞裂解液转移至无RNA酶的1.5mL离心管中;
②加入氯仿,上下震荡15s,室温静置10min,4℃,12000rpm离心15min,小心吸去上层透明液体至新的1.5mL离心管中,加入异丙醇,用移液枪轻柔吹打混匀后,室温静置10min;
③4℃,12000rpm离心15min,小心弃上清,加入75%新鲜配制预冷的乙醇溶液,轻轻地上下颠倒混匀,4℃,12000rpm离心15min;
④弃上清后,晾干,得到RNA沉淀,加入适量的DEPC水溶解RNA,使用Nanodrop测定RNA浓度,标记浓度后可于-80保存待用。
2)逆转录得到模板DNA。
3)根据RNA浓度,将DNA模板(2ug)、引物以及2XSYBR配制10μL样品体系,进行荧光定量PCR,随后对结果进行统计分析。
荧光定量PCR引物如下表1。
表1荧光定量PCR引物
(2)蛋白免疫印迹法(Western Blot)
细胞经不同浓度W1131处理48h后,吸去培养基,用PBS清洗两遍,加入含有蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液RIPA裂解细胞,再将裂解液在15000rpm,4℃条件下离心15min,取上清定量,加入5×loading buffer,煮沸变性。然后用聚丙烯酰胺凝胶SDS-PAGE电泳分离蛋白样品,然后转移至硝酸纤维素薄膜(PVDF膜)上,经5%BSA封闭1h后,分别用GPX4、SLC7A11、FTH1和β-Actin的一抗在4℃下孵育过夜,再分别用带有荧光标记的兔二抗、鼠二抗室温孵育1h,最后用Tanon显影仪检测蛋白的表达水平。
(3)实验结果
实验结果如图2所示,图(2A)显示W1131能够剂量依赖性地抑制铁死亡相关基因GPX4、SLC7A11和FTH1的mRNA表达;图(2B)显示W1131能够抑制GPX4、SLC7A11和FTH1的蛋白表达。
实施例4 W1131对抑制胃癌细胞的增殖和转移
(1)细胞计数测定细胞生长
1)取对数生长期的各细胞,消化细胞,计数,以(5-10)×10
2)贴壁后,对照组加入相应的DMSO,给药组加入W1131或(和)Fer-1;
3)药物处理72h后,在显微镜下观察细胞状态,进行细胞计数。
(2)平板克隆实验
1)取对数生长期的细胞,消化后计数,以每孔800个细胞均匀接种于六孔板中;
2)待细胞贴壁后,对照组加入含药物溶剂的培养基,给药组加入不同浓度的W1131,每组设置3个复孔;
3)每隔三天更换一次培养基,并加入相应浓度的W1131;
4)培养8-12天后,至对照组长出肉眼可见的白色细胞克隆团;
5)弃培养基,用常温PBS洗涤一次,加入4%多聚甲醛,室温固定细胞15min,吸取固定液,用PBS洗涤1次,避光加入结晶紫染料,避光染色30min,最后用流水缓慢洗去多余的染液,室温干燥后扫描平板,计算每孔中细胞克隆形成数量。
(3)Transwell小室侵袭实验
1)取出适量Transwell嵌套至新的24孔板中,加入空白培养基使多孔膜完全浸入,置于37℃预活化1h或过夜。
2)取对数生长期细胞,消化后计数,以每孔2×104个细胞均匀接种于Transwell小室的上室中,此时上下室均用含10%FBS的培养基,置于37℃,5%CO2培养箱中培养过夜;
3)待细胞贴壁后,取出细胞平板,吸去上下室培养基,用PBS洗涤一次。对照组上室加入含对应浓度药物溶剂(0.1%DMSO)的培养基,给药组上室分别给予不同浓度的小分子化合物,置于37℃,5%CO2培养箱中培养12-24h。其中,上室均用含2%FBS的培养基,下室均加入含20%FBS的培养基作为诱导因子。
4)弃培养基,PBS洗涤一次,用4%多聚甲醛固定15min;
5)用棉签轻轻刮去上层细胞(未侵袭的细胞);
6)PBS清洗两次后,用结晶紫避光染色30min;
7)PBS清洗两次,将未染色的结晶紫洗去,室温干燥后在显微镜下进行观察,拍照,再进行计数统计。
(4)实验结果
实验结果如图3所示。图(3A)显示W1131能够显著抑制胃癌细胞的生长,且这种生长抑制作用可以被铁死亡抑制剂Fer-1部分逆转;图(3B)显示W1131能够显著抑制胃癌细胞的克隆形成;图(3C)为克隆形成统计图;图(3D)显示W1131能够浓度依赖性地抑制胃癌细胞的侵袭能力;图(3E)为相应的统计图。
实施例5 W1131与5-FU联合用药在胃癌5-FU耐药株中抑制肿瘤生长
(1)CCK8法测定细胞活力同上
(2)平板克隆实验同上
(3)实验结果
实验结果如图4所示,图(4A)为MGC803与MGC803/5-FU细胞对5-FU敏感性不同,MGC803的IC50为5.045μM,MGC803/5-FU的IC50为55.62μM,耐药指数约为11,说明5-FU胃癌耐药株构建成功;图(4B)为W1131与5-FU联合用药能够更显著地抑制MGC803/5-FU细胞的生长;图(4C)为W1131与5-FU联合用药能够更显著地抑制MGC803/5-FU细胞的克隆形成。
实施例6W1131与5-FU联合用药在体内模型中抑制肿瘤生长
(1)小鼠皮下胃癌细胞移植瘤模型
1)取对数生长期胃癌耐药细胞,消化后计数,将预冷PBS与Matrigel按1:1比例混合,重悬细胞,得到2×10
2)待皮下肿瘤体积约为50mm
3)连续给药四周,每三天测量小鼠体重和肿瘤大小,绘制小鼠体重生长曲线;
4)给药四周后,处死小鼠进行解剖,剥离皮下肿瘤,称重。
(2)实验结果
实验结果如图5所示,图(5A)为在小鼠皮下胃癌细胞移植瘤模型中给药期间的肿瘤体积变化图,W1131或5-FU单用组均能够抑制裸鼠肿瘤的生长;W1131和5-FU联合用药组与单用组相比,能够更显著地抑制裸鼠肿瘤的生长,表明W1131与5-FU在体内具有较好的联合效果;图(5B)为给药25天后,剥离的耐药胃癌皮下肿瘤外观图;图(5C)显示W1131与5-FU联合使用能够显著减轻胃癌肿瘤重量,其中5-FU组的肿瘤抑制率约为23.31%,W1131组的肿瘤抑制率约为51.7%,两者联合组的肿瘤抑制率约为76.08%。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 一种硝基呋喃类小分子化合物在制备诱导铁死亡和/或减缓胃癌化疗耐药药物中的应用
- 千金藤碱及其盐作为铁死亡诱导剂在制备抗肿瘤药物中的应用
