一种具有排除非特异性荧光干扰的GAD65抗体检测系统
文献发布时间:2023-06-19 18:35:48
技术领域
本发明涉及基因工程技术领域,特别涉及一种具有排除非特异性荧光干扰的GAD65抗体检测系统。
背景技术
谷氨酸脱羧酶(GAD),是一种抑制性神经递质γ-氨基丁酸(GABA)合成的限速酶,表达于中枢神经系统突触前GABA能神经元及和周围神经系统的胰岛细胞。GAD有两种异构体,根据分子量不同命名为GAD65和GAD67,参与GABA合成、抑制性突触的细胞外吞。
GAD65是一胞内蛋白,其C端和N端均在胞内,编码区有1758bp,编码585个氨基酸,文献报道其抗体识别的抗原表位主要在催化区aa221-444,aa451-585,和aa308-365,在aa4-22可以识别线性表位。GAD65包含一个磷酸吡哆醛(PLP)结合域,C末端域(CTD),催化环和N末端域(NTD)。1988年,Solimena等认识到僵人综合征(SPS)是一种器官特异性自身免疫性疾病,他们发现许多患者具有GAD65特异性自身抗体,该抗体后来被认为是1型糖尿病(DM)的生物标志物。DQB1*0201是SPS和自身免疫性糖尿病患者中常见的易感性等位基因。
目前血清GAD 65抗体阳性与很多综合症相关,主要包括脑炎、I型糖尿病、SPS)、Batten's病、小脑性共济失调和一些难治性癫痫。
在I型糖尿病中,GAD65抗体结合的主要抗原表位是磷酸吡哆醛结合域和C末端,然而,用重组的单克隆抗体竞争性结合发现在30%-70%僵人综合征患者的抗GAD65抗体识别线性表位aa4-22,还有两个空间构象表位,aa308-365,aa451-585,但是这些抗原表位不被I型糖尿病患者的血清所识别。这就表明抗原表位在不同的疾病之间存在不同。另外,尽管这些患者的GAD65抗体均阳性,抗体表位存在的差异也一定程度上解释了患者的临床表型。
对于急性和慢性癫痫发作来说,自身免疫性脑炎作为一个逐渐被认识的病因学,它占成年人发作性和不明原因癫痫的20%以上。抗体相关的自身免疫性癫痫可以被分为两类:第一类抗神经元细胞表面和突触蛋白,如抗NMDAR,GABAR,LGI1;第二类是抗胞内抗原,如抗Hu,抗神经元核抗原I型(ANNA1),Ma/Ta,CV2,抗GAD65等。相比于神经元细胞表面和突触蛋白介导的自身免疫性癫痫,胞内抗原介导的自身免疫性癫痫通常都伴有副肿瘤,比较难治,且预后效果均不佳,但是单纯的GAD65抗体介导的癫痫是一个例外。高滴度的GAD65抗体与僵人综合征,小脑共济失调相关,最近报道,GAD65在17%的边缘叶脑炎和12.5%的不明原因的成人发作性癫痫患者中被检出。在GAD65介导的脑炎中,癫痫可能是主要或唯一临床表现,与GAD65抗体的沉积有关。抗GAD65抗体的水平或滴度与癫痫的持续时间,癫痫的发作频数,癫痫的严重程度不相关。抗体滴度的降低经常在临床治疗反应的患者中观察到,但是GAD抗体滴度可下降或持续,免疫治疗后极少消失。持续高滴度常与临床反应差有关。与低滴度GAD患者相比,高滴度GAD患者的其他自身抗体数量明显更高,如抗甲状腺抗体、抗GM1抗体、抗核抗体、抗甲状腺过氧化物酶抗体,提示共存在抗原,或激活B细胞的免疫因子。
目前国内采用的检测GAD65抗体的检测技术主要有ELISA、免疫印迹法、放射免疫分析法、免疫荧光法。ELISA、免疫印迹法采用抗原均为线性抗原,中枢神经系统自身抗体识别空间构象表位,因此该两种方法的特异性比较差。免疫荧光法是目前推荐的检测神经系统自身抗体的金标准,目前国内该方法被国外公司所垄断,且使用荧光为单色荧光,不能排除非特异性抗体的结合。为此,我们提出一种具有排除非特异性荧光干扰的GAD65抗体检测系统。
发明内容
本发明的主要目的在于提供一种具有排除非特异性荧光干扰的GAD65抗体检测系统,本发明利用分子克隆技术,构建pCMV-AC-GFP-GAD65真核表达载体,转染HEK293细胞。可以在检测抗体的时候通过对比双色荧光的位置及数量来排除非特异性荧光干扰,可以有效解决背景技术中的问题。
为实现上述目的,本发明采取的技术方案为:
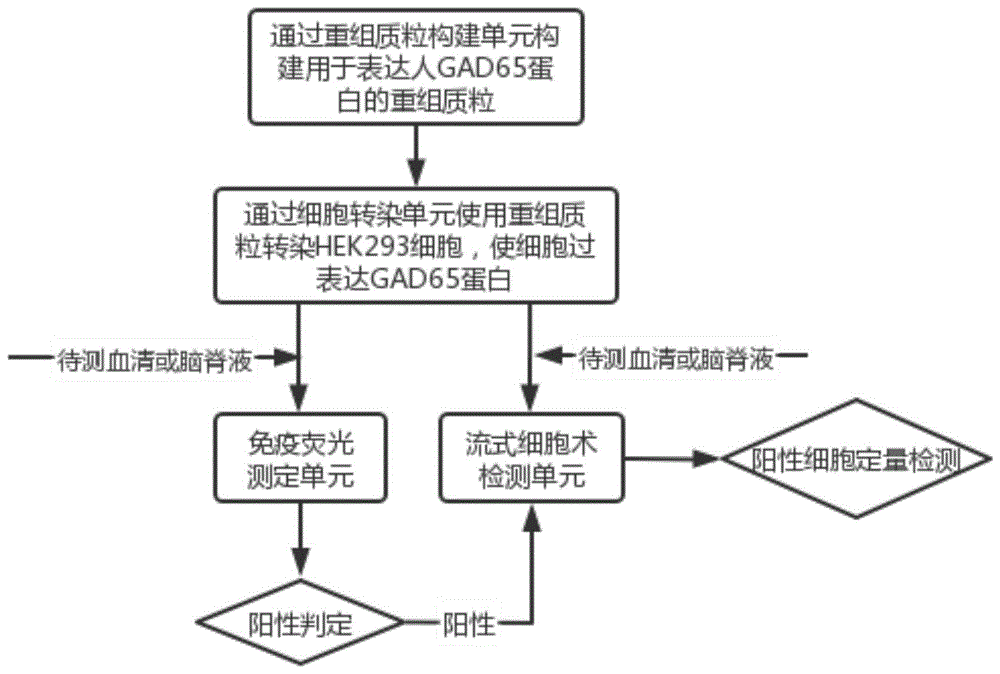
一种具有排除非特异性荧光干扰的GAD65抗体检测系统,包括重组质粒构建单元、细胞转染单元、免疫荧光测定单元和流式细胞术检测单元,所述的检测系统通过所述重组质粒构建单元采用PCR技术扩增获得全长GAD65的基因片段,通过双酶切、胶回收、T4 DNA酶连接,克隆至真核表达载体pCMV-AC-GFP上,构建用于表达人GAD65蛋白的重组质粒,通过所述细胞转染单元用构建的真核表达载体转染HEK293细胞,使细胞过表达GAD65蛋白,以转染的细胞作为基质,与待测血清或待测脑脊液中的抗体进行结合,通过所述免疫荧光测定单元采用免疫荧光法对待测血清或待测脑脊液进行阳性判定,并通过所述流式细胞术检测单元定量检测双阳性细胞的含量。
进一步的,所述表达人GAD65蛋白的重组质粒的构建步骤为:
S21.从pubmed检索人源GAD65蛋白基因序列,结合所选载体中的多克隆位点,选择合适的酶切位点Sgf I和Rsr II,利用Primer5.0设计引物;
S22.从人脑组织中提取总RNA,进行逆转录,获得cDNA,利用PCR技术扩增,然后将表达载体和所扩增的目标片段进行双酶切,胶回收试验以摩尔比例3:1的比例回收目的双酶切基因片段和的载体片段,将载体片段和目的基因片段利用T4连接酶进行连接;
S23.将连接产物转化大肠杆菌感受态细胞DH5α,涂布于含氨苄抗生素的LB平板上,37℃培养12-16小时,挑取单菌落至含有氨苄的LB液体培养基中,37℃恒温摇床培养过夜,提取质粒,即为表达GAD65的重组质粒;
S24.将重组质粒通过单、双酶切质粒序进行鉴定。
进一步的,所述引物序列为:
F:5’-AATGCGATCGCCATGGCATCTCCGG-3’
S:5’-CGTCGGTCCGCTTAAATCTTGTCCAAGGC-3’。
进一步的,所述转染HEK293细胞的操作步骤为:
S41.从-196℃的液氮罐中取出冻存的HEK293细胞,迅速放至37℃的水浴锅中,使其快速溶解,1000r/min离心5min,弃上清,用1ml含10%胎牛血清培养基重悬,然后加至5ml含10%胎牛血清培养基到25cm
S42.将长满瓶底的细胞用胰蛋白消化后,重悬,按细胞浓度为2~5×10
S43.待细胞生长至汇合度为60%右时进行细胞转染,480μl无血清培养基+14.4μl转染试剂共孵育5min,加入4.8μg重组质粒进行共孵育15min,然后分别按10μl/孔或80μl/孔加至48孔板和6孔板中,培养48h,并于荧光显微镜下观察表达情况;
S44.将48孔板中细胞用PBS洗涤次,4%甲醛4℃固定20分钟,PBS洗涤1次,用含0.5%Triton X100的PBS配制含5%牛血清白蛋白的封闭液进行通透封闭过夜;
S45.将6孔板中细胞用PBS洗涤1次,部分用胰蛋白酶消化后进行收集至1.5ml离心管中,均分两部分,一部分4%甲醛4℃固定20分钟,PBS洗涤1次,用含0.5%Triton X100的PBS配制含5%牛血清白蛋白的封闭液进行通透封闭过夜,另一部分用RIPA细胞裂解液进行冰上裂解30min,每孔细胞加300μlRIPA细胞裂解液和3μl的PMSF,离心,加入5×的loadingbuffer后煮沸5min,SDS-PAGE电泳后进行WB验证。
进一步的,所述免疫荧光法对待测血清进行阳性判定的操作步骤为:
将待测血清或待测脑脊液样本用0.5%Triton X100的PBS缓冲液进行1:10稀释,按100μl/孔加至48孔细胞培养板中,与步骤S44的封闭液混合,于37℃孵育2h,0.25%Triton X100的PBS缓冲液洗涤3次,加入用0.5%Triton X100的PBS缓冲液以1:1000的比例稀释得到Alexa Fluor
进一步的,所述待测血清或待测脑脊液样本阳性的判定方法为:当待测血清或待测脑脊液样本中存在GAD65抗体时,Merge时两者重叠呈黄色,可判为抗体阳性,若样本中不存在GAD65抗体时,Merge时只能看到GFP的绿色荧光,可判为抗体阴性。
进一步的,所述定量检测双阳性细胞的含量的操作步骤为:将待测血清用0.5%Triton X100的PBS缓冲液进行1:10稀释,按500ul/孔加至转染细胞的收集管中,与步骤S45胰蛋白酶消化后收集的溶液混合,于37℃孵育2h,0.25%Triton X100的PBS缓冲液洗涤3次,加入用0.5%Triton X100的PBS缓冲液以1:1000的比例稀释得到APC标记的羊抗人IgG,37℃孵育2h,0.25%Triton X100的PBS缓冲液洗涤3次,用PBS重悬,用含有488nm激发波长和633nm激发波长的流式细胞仪进行定量检测双阳性细胞的含量。
与现有技术相比,本发明具有如下有益效果:
(1)本发明利用分子克隆技术,通过构建pCMV-AC-GFP-GAD65真核表达载体转染HEK293细胞,表达蛋白为GAD65的全长蛋白,具有抗体识别的空间构象表位,保持了目标抗原蛋白的三维空间构象,最大程度还原了抗原抗体结合的天然状态,由于载体本身带有绿色荧光蛋白GFP标签,可在转染细胞后直接观察到细胞转染效率,在检测抗体的时候通过对比双色荧光的位置及数量来排除非特异性荧光,提高特异性;
(2)本发明结合免疫荧光测定法和流式细胞术,可以对抗体进行定性和定量检测,对患者治疗疗效的评估具有重要指导价值。
附图说明
图1为本发明一种具有排除非特异性荧光干扰的GAD65抗体检测系统的工作流程图。
具体实施方式
下面结合具体实施方式对本发明作进一步的说明,其中,附图仅用于示例性说明,表示的仅是示意图,而非实物图,不能理解为对本发明的限制,为了更好地说明本发明的具体实施方式,附图某些部件会有省略、放大或缩小,并不代表实际产品的尺寸。
实施例1
如图1所示,一种具有排除非特异性荧光干扰的GAD65抗体检测系统,包括重组质粒构建单元、细胞转染单元、免疫荧光测定单元和流式细胞术检测单元,检测系统通过重组质粒构建单元采用PCR技术扩增获得全长GAD65的基因片段,通过双酶切、胶回收、T4 DNA酶连接,克隆至真核表达载体pSJMY-GFP上,构建用于表达人GAD65蛋白的重组质粒,通过细胞转染单元用构建的真核表达载体转染HEK293细胞,使细胞过表达GAD65蛋白,以转染的细胞作为基质,与待测血清或待测脑脊液中的抗体进行结合,通过免疫荧光测定单元采用免疫荧光法对待测血清或待测脑脊液进行阳性判定,并通过流式细胞术检测单元定量检测双阳性细胞的含量。
表达人GAD65蛋白的重组质粒的构建步骤为:
S21.从pubmed检索人源GAD65蛋白基因序列,结合所选载体中的多克隆位点,选择合适的酶切位点Sgf I和Rsr II,利用Primer5.0设计引物;
S22.从人脑组织中提取总RNA,进行逆转录,获得cDNA,利用PCR技术扩增,然后将表达载体和所扩增的目标片段进行双酶切,胶回收试验以摩尔比例3:1的比例回收目的双酶切基因片段和的载体片段,将载体片段和目的基因片段利用T4连接酶进行连接;
S23.将连接产物转化大肠杆菌感受态细胞DH5α,涂布于含氨苄抗生素的LB平板上,37℃培养12-16小时,挑取单菌落至含有氨苄的LB液体培养基中,37℃恒温摇床培养过夜,提取质粒,即为表达GAD65的重组质粒;
S24.将重组质粒通过单、双酶切质粒序进行鉴定。
引物序列为:
F:5’-AATGCGATCGCCATGGCATCTCCGG-3’
S:5’-CGTCGGTCCGCTTAAATCTTGTCCAAGGC-3’。
转染HEK293细胞的操作步骤为:
S41.从-196℃的液氮罐中取出冻存的HEK293细胞,迅速放至37℃的水浴锅中,使其快速溶解,1000r/min离心5min,弃上清,用1ml含10%胎牛血清培养基重悬,然后加至5ml含10%胎牛血清培养基到25cm
S42.将长满瓶底的细胞用胰蛋白消化后,重悬,按细胞浓度为2~5×10
S43.待细胞生长至汇合度为60%右时进行细胞转染,480μl无血清培养基+14.4μl转染试剂共孵育5min,加入4.8μg重组质粒进行共孵育15min,然后分别按10μl/孔或80μl/孔加至48孔板和6孔板中,培养48h,并于荧光显微镜下观察表达情况;
S44.将48孔板中细胞用PBS洗涤次,4%甲醛4℃固定20分钟,PBS洗涤1次,用含0.5%Triton X100的PBS配制含5%牛血清白蛋白的封闭液进行通透封闭过夜;
S45.将6孔板中细胞用PBS洗涤1次,部分用胰蛋白酶消化后进行收集至1.5ml离心管中,均分两部分,一部分4%甲醛4℃固定20分钟,PBS洗涤1次,用含0.5%Triton X100的PBS配制含5%牛血清白蛋白的封闭液进行通透封闭过夜,另一部分用RIPA细胞裂解液进行冰上裂解30min,每孔细胞加300μl RIPA细胞裂解液和3μl的PMSF,离心,加入5×的loadingbuffer后煮沸5min,SDS-PAGE电泳后进行WB验证。
免疫荧光法对待测血清进行阳性判定的操作步骤为:
将待测血清或待测脑脊液样本用0.5%Triton X100的PBS缓冲液进行1:10稀释,按100μl/孔加至48孔细胞培养板中,与步骤S44的封闭液混合,于37℃孵育2h,0.25%Triton X100的PBS缓冲液洗涤3次,加入用0.5%Triton X100的PBS缓冲液以1:1000的比例稀释得到Alexa Fluor
待测血清或待测脑脊液样本阳性的判定方法为:当待测血清或待测脑脊液样本中存在GAD65抗体时,Merge时两者重叠呈黄色,可判为抗体阳性,若样本中不存在GAD65抗体时,Merge时只能看到GFP的绿色荧光,可判为抗体阴性。
定量检测双阳性细胞的含量的操作步骤为:将待测血清用0.5%Triton X100的PBS缓冲液进行1:10稀释,按500ul/孔加至转染细胞的收集管中,与步骤S45胰蛋白酶消化后收集的溶液混合,于37℃孵育2h,0.25%Triton X100的PBS缓冲液洗涤3次,加入用0.5%Triton X100的PBS缓冲液以1:1000的比例稀释得到APC标记的羊抗人IgG,37℃孵育2h,0.25%Triton X100的PBS缓冲液洗涤3次,用PBS重悬,用含有488nm激发波长和633nm激发波长的流式细胞仪进行定量检测双阳性细胞的含量。
通过采用上述技术方案:本发明利用分子克隆技术,通过重组质粒构建单元构建pCMV-AC-GFP-GAD65真核表达载体,并通过细胞转染单元转染HEK293细胞,由于表达蛋白为GAD65的全长蛋白,具有抗体识别的空间构象表位,保持了目标抗原蛋白的三维空间构象,最大程度还原了抗原抗体结合的天然状态,且载体本身带有绿色荧光蛋白GFP标签,可在转染细胞后直接观察到细胞转染效率,在检测抗体的时候通过对比双色荧光的位置及数量来排除非特异性荧光,提高特异性,结合免疫荧光测定法和流式细胞术,可以对抗体进行定性和定量检测,对患者治疗疗效的评估具有重要指导价值。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
