石杉碱的改良释放药物组合物以及其使用方法
文献发布时间:2023-06-19 18:37:28
本申请为国际申请号为PCT/US2018/033722、国际申请日为2018年5月21日、发明名称为“石杉碱的改良释放药物组合物以及其使用方法”的PCT申请于2019年12月19日进入中国国家阶段后申请号为201880040891.X的中国国家阶段专利申请的分案申请。
相关申请的交叉引用
本申请要求2017年5月19日提交的题为“EXTENDED RELEASE FORMULATIONS OFHUPERZINE AND METHODS OF USING THE SAME”的美国临时号62/508554的权益和优先权,其内容特此以引用的方式整体并入。
发明内容
石杉碱甲是在firmoss蛇足石杉中发现的天然存在的倍半萜生物碱化合物。它是乙酰胆碱酯酶的有效抑制剂。在若干国家,石杉碱甲作为记忆支持的膳食补充剂出售。在中国,石杉碱甲经批准用于治疗痴呆症。
石杉碱甲已在许多试验(许多在中国)中施用至健康志愿者和患者,从而证明在阿尔茨海默病、良性衰老性健忘症、血管性痴呆、重症肌无力、精神分裂症和可卡因依赖性中的可接受的安全性和耐受性以及功效。在这些试验中使用的剂量是经由经口施用或肌内注射的0.01与0.8mg/天之间。尽管这些研究显示出有利的安全性概况,但在一些研究中,在较高剂量水平下发生短暂的剂量相关的恶心。
申请人在耐药性癫痫患者中进行了剂量递增研究,以研究石杉碱甲的立即释放药物组合物的安全性和耐受性。在这项研究中,患者经历了严重的不良事件(恶心和呕吐),许多不良事件在前31小时内发生,最有可能是由于立即释放药物组合物的快速血清暴露。(参见下文)。
在医学或专利文献中,没有关于石杉碱甲在癫痫患者中的功效的可用公开数据。啮齿动物模型中的非临床数据表明石杉碱甲作为抗惊厥剂具有非常高的功效,其作用机制与可用的抗癫痫药物(AED)明显不同。然而,申请人已经预测,将需要比在临床试验中先前施用的更高剂量的石杉碱来实现在治疗患者的癫痫发作病症中的功效(参见下文)。
尽管石杉碱甲可在神经系统病症、癫痫发作病症、记忆和语言障碍领域潜在提供额外的有益作用,但是石杉碱甲的立即释放药物组合物不足以治疗由于剂量相关的不良事件而需要更高治疗阈值的病症,尤其是在患有慢性疾患的患者中。立即释放药物组合物还具有由于与这些药物组合物相关的快速t
Zhou等人在中国专利申请CN101081217中已经报告了含有石杉碱甲的缓释丸剂,然而,与立即释放药物组合物相比,这些药物组合物不能显著降低血浆峰值浓度,并且也不能延长t
本发明允许实现功效、同时维持用石杉碱的先前已知的药物组合物无法获得的所期望安全性概况所需的血浆暴露。
本发明的实施方案涉及用于经口递送石杉碱的药物组合物,所述药物组合物可用于治疗各种神经系统病症和疾病,例如疼痛、阿尔茨海默病和癫痫发作病症。本文所述的石杉碱的改良释放药物组合物允许石杉碱的最佳功效与降低的持续时间、严重性和/或与立即释放药物组合物相关的严重不良事件的风险,所述立即释放药物组合物是剂量限制性的或完全阻止石杉碱的继续使用。
本发明的实施方案涉及一种用于经口递送的药物组合物,所述药物组合物包含:(a)约74重量%至86重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约0.95重量%至约1重量%的石杉碱或相当于约0.95重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐和一种或多种赋形剂,其中赋形剂的总量是约5重量%至约9重量%;以及(c)包覆所述石杉碱层的约7重量%至16重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱。在一些实施方案中,石杉碱是石杉碱甲或其药学上可接受的盐。
本发明的一些实施方案涉及一种药物组合物,所述药物组合物包含:(a)约80重量%至约83重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约0.95重量%至约1重量%的石杉碱甲或相当于约0.95重量%至约1重量%石杉碱甲的石杉碱甲的药学上可接受的盐、约5重量%至约6重量%的羟丙基甲基纤维素和约0.95重量%至约1重量%的聚乙烯吡咯烷酮;以及(c)包覆所述石杉碱层的约8重量%至约12重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱甲。
本发明的一些实施方案涉及一种药物组合物,其特征在于在向人受试者经口施用治疗有效剂量的所述组合物后,石杉碱甲在血浆中的C
本发明的一些实施方案涉及一种药物组合物,所述药物组合物包含治疗有效量的石杉碱甲,其特征在于T
本发明的一些实施方案涉及一种药物组合物,当在37℃下在50mM磷酸盐(pH 6.8)中根据USP 1型设备以50转/分钟进行测试时,所述药物组合物表现出以下溶出概况:约36%至约46%的石杉碱在2小时后释放,约61%至约77%的石杉碱在4小时后释放,约84%至约97%的石杉碱在8小时后释放,并且不少于约89%的石杉碱在12小时后释放。
本发明的一些实施方案描述了一种治疗神经系统病症和/或癫痫发作病症的方法,所述方法包括施用根据本文所述的任何实施方案的药物组合物。在一些实施方案中,所述组合物每日一次或每日两次施用。在一些实施方案中,所述组合物施用至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少8天、至少9天、至少10天、至少11天、至少12天、至少13天、至少14天、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或持续受试者需要治疗的时间。在一些实施方案中,所述组合物以滴定方案施用,其中石杉碱的剂量以每两天或至多两周0.25mg或0.5mg的增量增加。在一些实施方案中,癫痫发作病症是癫痫或复杂部分性癫痫发作。
本发明的一些实施方案描述了一种治疗有需要的患者的选自由神经系统病症和癫痫发作病症组成的组的病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用石杉碱甲的一个或多个滴定剂量,然后施用石杉碱甲的维持剂量;其中石杉碱甲以石杉碱甲的改良释放药物1组合物施用。在一些实施方案中,所述改良释放药物是根据本文所述的任何实施方案的改良释放药物。
本发明的一些实施方案描述了一种治疗有需要的患者的神经系统病症和/或癫痫发作病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用选自a.至h.(如下文进一步描述)的至少一种给药方案的第一给药方案和施用选自a.至i.(如下文进一步描述)的至少一种给药方案的第二给药方案,条件是所述第二给药方案从所述第一给药方案递增,并且进一步条件是最后一个给药方案是维持剂量,并且因此将施用持续患者需要其治疗的时间:
a.施用约0.25mg剂量的石杉碱甲,每约12小时一次持续至少两天且至多两周;
b.施用约0.5mg剂量的石杉碱甲,每约12小时一次持续至少两天且至多两周;
c.施用约0.75mg剂量的石杉碱甲,每约12小时一次持续至少两天且至多两周;
d.施用约1mg剂量的石杉碱甲,每约12小时一次持续至少两天且至多两周;
e.施用约1.25mg剂量的石杉碱甲,每约12小时一次持续至少两天且至多两周;
f.施用约1.5mg剂量的石杉碱甲,每约12小时一次持续至少两天且至多两周;
g.施用约1.75mg剂量的石杉碱甲,每约12小时一次持续至少两天且至多两周;
h.施用约2mg剂量的石杉碱甲,每约12小时一次持续至少两天且至多两周;
i.施用约2.5mg剂量的石杉碱甲,每约12小时一次持续至少两天;
其中a.-i.的石杉碱甲以石杉碱甲的改良释放药物组合物施用。在一些实施方案中,所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。
一些实施方案描述了一种治疗有需要的患者的选自由神经系统病症和/或癫痫发作病症组成的组的病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用石杉碱甲的改良释放药物组合物,其中石杉碱甲的所述改良释放药物组合物的特征在于石杉碱甲在血浆中的选自由以下组成的组的C
一些实施方案描述了一种治疗有需要的患者的选自由神经系统病症和/或癫痫发作病症组成的组的病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用石杉碱甲的改良释放药物组合物,其中石杉碱甲的所述改良释放药物组合物的特征在于,当以治疗有效剂量施用时石杉碱甲在血浆中的C
一些实施方案描述了一种治疗有需要的患者的选自由神经系统病症和癫痫发作病症组成的组的病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用石杉碱甲的改良释放药物组合物,其中石杉碱甲的所述改良释放药物组合物的特征在于在向人受试者经口施用治疗有效剂量的所述药物组合物后,石杉碱在血浆中的C
一些实施方案描述了一种治疗有需要的患者的选自由神经系统病症和癫痫发作病症组成的组的病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用石杉碱甲的改良释放药物组合物,其中石杉碱甲的所述改良释放药物组合物的特征在于在向人受试者经口施用治疗有效剂量的所述药物组合物后,石杉碱在血浆中的C
附图说明
图1示出在一天两次2mg的示例性滴定时间表的立即释放给药后石杉碱甲的模拟血浆水平。
图2示出基于一天两次0.5mg石杉碱甲持续1-2天;一天两次1mg石杉碱甲持续3-4天;一天两次1.5mg石杉碱甲持续5-6天以及一天两次2mg持续7-11天的滴定时间表,石杉碱甲改良释放药物组合物4A的模拟血浆水平。
图3是本发明的组合物的示意图。白色内圆圈是糖球,中间圆圈是石杉碱层,并且外圆圈是增塑乙基纤维素聚合物。
图4示出药物组合物1A(具有小圆圈的实线)、组合物1B(具有小正方形的虚线)、组合物2A(具有小三角形的实线)、组合物2B(具有小三角形的虚线)、组合物2C(具有小三角形的实线)、组合物3A(具有大圆圈的实线)、组合物3B(具有大正方形的虚线)、组合物3C(具有大的尖头朝上的三角形的虚线)、组合物4A(具有大的、尖头朝下的三角形的实线)、组合物4B(具有小菱形的虚线)、组合物4C(具有星号的实线)的体外溶出概况。
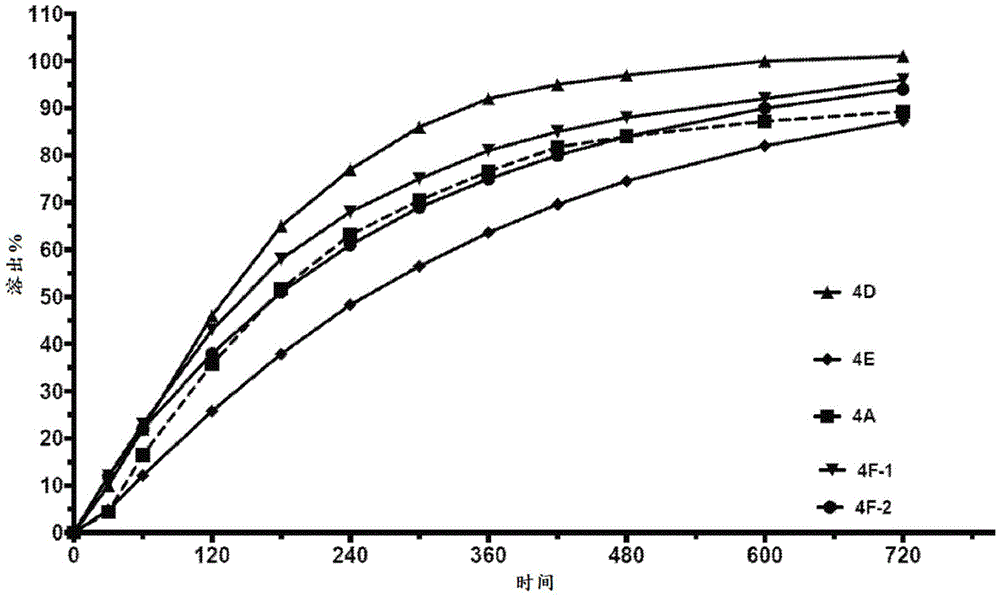
图5示出组合物4D(具有向上指向的三角形的实线)、组合物4E(具有小菱形的实线)、组合物4A(具有虚线的大正方形)、组合物4F-1(具有小的向下指向的三角形的实线)、组合物4F-2(具有圆圈的实线)的体外溶出概况。
图6示出对于药物组合物4A(具有尖头朝下的三角形的实线)和药物组合物2C(尖头朝上的三角形的实线)在0.49mg/kg剂量下狗中的体内血浆浓度。
图7示出在药物组合物4D的0.25mg(实心小圆圈)、0.5mg(大圆圈)、0.75mg(实心大正方形)、1mg(大正方形)、1.25mg(小实心三角形)、1.50mg(小三角形)、1.75mg(小实心菱形)、2.0(小菱形)和2.5mg(具有X的框)的剂量滴定期间随时间推移人的体内血浆浓度。
图8是在药物组合物4D的各种剂量下人的体内血浆浓度(C
图9示出三名人患者(圆圈、三角形和正方形)的体内血浆浓度以及在0.25mg、0.5mg、0.75mg、1.25mg的剂量滴定期间获取的平均血浆浓度(虚线菱形线)。
具体实施方式
本发明不限于所描述的特定过程、组合物或方法,因为这些可变化。在本说明书中使用的术语是出于仅描述特定版本或实施方案的目的,并且不意图限制本发明的范围。除非另外定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员通常所理解的相同的含义。本文提及的所有出版物以引用的方式整体并入。不应将本文的任何内容解释为承认本发明无权凭借现有发明而先于此公开。
还必须指出,如本文中和随附权利要求书中所用,单数形式“一个/种(a/an)”和“所述”包括多个指示物,除非上下文另外清楚地指明。因此,例如,提及一种“症状”是指一种或多种症状以及本领域技术人员已知的其等效物,等等。
如本文所用,术语“约”意指与它一起使用的数字的数值加或减10%。因此,约50mL意指在45mL-55mL的范围内。
术语“施用(administering)”或“施用(administration)”等是指向需要治疗的受试者提供本发明的组合物(例如,根据本文所述的任何实施方案的组合物)。优选地,受试者是哺乳动物,更优选是人。本发明包括单独或与另一种治疗剂联合施用根据本文所述的任何实施方案的药物组合物。当根据本文所述的任何实施方案的组合物与另一种治疗剂联合施用时,所述药物组合物和另一种治疗剂可在同时或不同时间施用。
如本文所用的“严重不良事件”是指以下任何不良事件:(a)引起受试者不适并中断受试者的日常活动,(b)对受试者的日常活动造成相当大的干扰,并且可能使人丧失能力或危及生命,(c)危及受试者的生命,(d)导致剂量限制性毒性,或(e)需要额外的药物来对抗不良事件,或它们的组合。例如,如果受试者在施用石杉碱药物组合物后经历恶心和/或呕吐,所述药物组合物需要施用止吐药以便继续服用石杉碱药物组合物,则所述受试者具有严重不良事件。
如本文所用,“淀粉样蛋白相关疾病”包括与淀粉样蛋白的累积相关的疾病,其可以限于一个器官,“局限性淀粉样变性”;或扩散至若干器官,“全身性淀粉样变性”。继发性淀粉样变性可能与慢性感染(如结核病)或慢性炎症(如类风湿性关节炎)相关,包括继发性淀粉样变性的家族形式,其也可见于家族性地中海热(FMF)和长期血液透析患者中发现的另一种类型的系统性淀粉样变性中。淀粉样变性的局限性形式包括但不限于II型糖尿病及其任何相关疾病、神经变性疾病如瘙痒病、牛海绵状脑炎、克罗伊茨费尔特-雅格布病(Creutzfeldt-Jakob disease)、阿尔茨海默病、老年性系统性淀粉样变性病(SSA)、脑淀粉样血管病、帕金森病以及朊病毒蛋白相关病症(例如朊病毒相关脑病)和类风湿性关节炎。
短语“更好的副作用概况”是指当与等效剂量的石杉碱的立即释放药物组合物相比时,在用石杉碱的改良释放药物组合物治疗后,患者或患者组所经历的副作用或严重不良事件(1)发生率较低,(2)持续时间较短,和/或(3)严重程度较低。
术语“C
如本文所用的术语“剂量”是指活性化合物的量,例如不含任何非活性成分或盐的石杉碱或石杉碱甲。
如本文所用,术语“有效量”是指将引发例如研究人员或临床医师)所寻求的组织、系统、动物或人的生物学或医学应答的药物或药剂的量,或药物或药剂的组合的量。
如本文所用,术语“癫痫”是指脑病症,其特征在于持久的易感性以产生癫痫性癫痫发作,以及这种疾患的神经生物学、认知、心理和社会后果。癫痫性癫痫发作是由于脑中异常、过度或同步神经元活动引起的病征和/或症状的短暂发生。
本领域技术人员将理解,术语“增塑乙基纤维素”也以非专有名称已知,例如,“增塑乙基纤维素(plasticized ethyl cellulose)”;同义词和若干品牌名称,例如
本领域技术人员将理解,术语“羟丙基甲基纤维素(hydroxyproylmethylcellulose)”也以许多非专有名称已知,例如,“HPMC”、“羟丙甲纤维素(hypromellose)”、“羟丙基甲基纤维素(hydroxypropylmethylcellulose)”、“羟丙甲纤维素(hypromellosum)”和“羟丙甲纤维素(hypromellose)”;同义词;以及若干品牌名称,例如Methocel
除非在特定实施方案中另外定义,否则术语“石杉碱”是指石杉碱甲、石杉碱乙或石杉碱丙或其药学上可接受的盐或溶剂合物。石杉碱甲是(1R,9S,13E)-1-氨基-13-亚乙基-11-甲基-6-氮杂三环[7.3.1.02,7]十三碳-2(7),3,10-三烯-5-酮。石杉碱乙是(4aR,5R,10bR)-2,3,4,4a,5,6-六氢-12-甲基-1H-5,10b-丙烯-1,7-菲咯啉-8(7H)-酮。石杉碱丙是(1R,9S,13R)-1-氨基-13-乙烯基-11-甲基-6-氮杂三环[7.3.1.02,7]十三碳-2(7),3,10-三烯-5-酮。
优选地,在本文所述的任何实施方案中,石杉碱是石杉碱甲。
如本文所述的术语“维持剂量”是指为维持血液中所需的药物水平而施用的石杉碱的剂量。在一些实施方案中,维持剂量是治疗作用量。
术语“石杉碱的改良释放药物组合物”是指石杉碱的任何经口药物组合物,其中选择时间、疗程和/或位置的石杉碱释放特性以实现立即释放石杉碱未提供的治疗或便利性目的。
术语“神经系统病症”包括但不限于癫痫发作病症、淀粉样蛋白相关病症,如阿尔茨海默病和本文所述的淀粉样蛋白病症、精神病症如图雷特综合征、创伤后应激障碍(PTSD)、恐慌症和焦虑症、强迫症和精神分裂症、发育障碍如脆性X综合征和自闭症、疼痛、药物成瘾如酒精中毒、神经变性疾病如帕金森病和亨廷顿病等以及中风和缺血性脑损伤、肌萎缩性侧索硬化和癫痫。“神经系统病症”还包括与暴露于神经毒素,包括但不限于诸如化学战剂的神经毒素相关或有关的任何病症、症状或效应。
术语“患者”或“受试者”可互换使用,并且在整个说明书中在上下文中用于描述用根据本文描述的任何实施方案的药物组合物对其进行治疗、包括预防性治疗(预防)的动物,通常是哺乳动物且优选人。为了治疗对特定动物如人患者具有特异性的那些感染、疾患或疾病状态,术语患者指所述特定动物。
“药学上可接受的”是指载体、稀释剂或赋形剂必须与药物组合物的其他成分相容并且对其接受者无害。
术语“相当于约1重量%的石杉碱的石杉碱的药学上可接受的盐”是指如果将盐转化为石杉碱,则将提供约1重量%的石杉碱游离碱的石杉碱的药学上可接受的盐。类似地,术语“相当于约0.5重量%至约1.5重量%石杉碱的药学上可接受的盐”、“相当于约0.9重量%至约1重量%石杉碱的药学上可接受的盐”、“相当于约0.95重量%至约1重量%石杉碱的药学上可接受的盐”等是指如果将盐转化为石杉碱,则将分别提供约0.5重量%至约1.5重量%、约0.9重量%至约1重量%、约0.95重量%至约1重量%石杉碱游离碱的石杉碱的药学上可接受的盐。例如,需要6克石杉碱甲来提供1重量%的600克药物组合物,但是需要6.89g石杉碱甲的HCl盐来提供1重量%石杉碱甲。
本领域技术人员将理解,术语“聚乙烯吡咯烷酮(polyvinylpyrrolidone)”也以若干非专有名称已知,例如,“PVP”、“聚乙烯吡咯烷酮(polyvinyl pyrrolidone)”、“聚维酮(povidone)”和“聚维酮(polyvidone)”。还应理解,聚乙烯吡咯烷酮用其k值表示,其k值指示聚乙烯吡咯烷酮的平均分子量。聚乙烯吡咯烷酮的实例包括但不限于聚乙烯吡咯烷酮K30、聚乙烯吡咯烷酮K10、聚乙烯吡咯烷酮K360、聚乙烯吡咯烷酮K40。
如本文所用,术语“癫痫发作病症”是指其中一种或多种癫痫发作是症状的任何疾患。如本文所用,癫痫发作可能是由于脑中的异常电活动所致,或者可能是非癫痫性癫痫发作,其没有伴随脑中的异常电活动。癫痫发作可由(例如但不限于)心理问题、心理压力、创伤、低血糖症、低血钠、发热、饮酒或药物使用或未知原因引起。癫痫发作和癫痫发作病症的类型包括但不限于癫痫(包括顽固性癫痫)、全身性癫痫发作、原发性全身性癫痫发作、失神性癫痫发作、肌阵挛性癫痫发作、部分性癫痫发作、伴或不伴有全身性的复杂部分性癫痫发作(例如,局灶性意识受损癫痫发作(FIAS))、兰诺克斯-盖索特综合征、德拉韦综合征和伴有高热癫痫发作附加症的全身性癫痫(GEFS+)。在一些实施方案中,癫痫发作是癫痫。
如本文中所用,术语“治疗剂”是指被利用来治疗、对抗、改善(ameliorate)、预防或改善(improve)患者的不想要的疾患或疾病的剂。部分地,本发明的实施方案涉及神经变性疾病的治疗,包括癫痫发作病症,如癫痫。
术语“治疗有效量”是指使得疾病、病症或副作用得到改善的治疗、治愈、预防或改善,或者疾病或病症的进展率降低的任何量。所述术语在其范围内还包括有效增强正常生理功能的量。
术语“t
“T
如本文所用的术语“治疗(treat)”、“治疗(treated)”或“治疗(treating)”是指治疗性治疗和预防性或防治性措施,其中目标是为了预防或减缓(减轻)不希望的生理疾患、病症或疾病,或为了获得有益或所续的临床结果。出于本发明的目的,有益或所需临床结果包括但不限于:症状的减轻;疾患、病症或疾病的程度减小;疾患、病症或疾病的状态稳定(即,没有恶化);疾患、病症或疾病的发作延迟或疾患、病症或疾病的进展减慢;疾患、病症或疾病状态的改善(amelioration);以及疾患、病症或疾病的缓解(无论部分还是全部)(无论可检测还是不可检测)或增强或改善(improvement)。治疗包括引发临床上显著的应答而没有过度水平的副作用。治疗还包括与不接受治疗情况下的预期存活期相比存活期延长。
在一些实施方案中,本文公开的化合物和方法可与需要这种治疗的受试者一起使用或用于所述受试者,所述受试者也可被称为“有需要的”。如本文所用,短语“有需要的”是指所述受试者已被鉴定为对特定方法或治疗具有需要,并且已经出于所述特定目的向所述受试者给予所述治疗。
一般来说,术语“组织”是指在特定功能的执行中联合在一起的类似特化细胞的任何聚集体。
本文阐述的实施方案是用“包含”来描述的,然而本文描述的任何实施方案也可用“由……组成(consists of)”或“由……组成(consisting of)”来描述,这意味着药物组合物或方法仅包括在具体要求保护的实施方案或权利要求以及本文所述的每个实施方案中具体叙述的要素、步骤或成分,也可用“基本上由……组成(consisting essentially of)”或“基本上由……组成(consists essentially of)”来描述,这意味着药物组合物或方法仅包括指定的材料或步骤以及不会实质性地影响要求保护的发明的基本和新颖特征的那些材料或步骤。
本发明的实施方案涉及石杉碱的改良释放经口药物组合物,并且更特别地涉及石杉碱甲。申请人已经发现了在每天两次给药情况下提供石杉碱的治疗有效血浆浓度并且克服与石杉碱的严重不良(和剂量限制性)副作用相关的快速高血清峰值水平的石杉碱的改良释放药物组合物。
为了说明石杉碱甲的改良释放药物组合物在治疗例如癫痫发作病症中的优点,申请人使用了非临床动物数据,申请人在狗中产生了药代动力学(参见下文)、异速生长缩放并且建模以确定石杉碱甲在血清中约16.5ng/mL(2mg剂量)的治疗阈值(C
申请人已经发现了与石杉碱的其他经口药物组合物相比具有出人意料的性质的石杉碱的经口药物改良释放药物组合物。这些药物组合物允许获得更高的治疗阈值而没有与高血清峰值水平相关的副作用,并且还允许每天两次给药。
在实施方案中,本发明的石杉碱的可经口施用的改良释放药物组合物包含可溶解核心;包覆所述可溶解核心的石杉碱层;和包覆所述石杉碱层的聚合物包衣层;其中所述石杉碱层包含治疗有效量的石杉碱。
在本发明的一些实施方案中,可溶解核心是完全可溶解的核心。在其他实施方案中,核心是糖球。在一些实施方案中,糖球包含蔗糖和淀粉。在一些实施方案中,蔗糖是至少62重量%蔗糖。在其他实施方案中,糖球是
在其他实施方案中,糖球占药物组合物的约74重量%至约86重量%。在一些实施方案中,糖球占药物组合物的约79重量%至约84重量%。在一些实施方案中,糖球占药物组合物的约80重量%至约86重量%。在一些实施方案中,糖球占药物组合物的约80重量%至约83重量%。在一些实施方案中,糖球占药物组合物的约81重量%至约83重量%。在一些实施方案中,糖球占药物组合物的约81重量%至约82.8重量%。在一些实施方案中,糖球占81.5重量%至83.0重量%。在一些实施方案中,糖球占药物组合物的约79.1重量%至约80重量%。在一些实施方案中,糖球占药物组合物的约80重量%至约81重量%。在一些实施方案中,糖球占药物组合物的约81重量%至约82重量%。在一些实施方案中,糖球占药物组合物的约81重量%至约81.9重量%。在一些实施方案中,糖球占药物组合物的约81.9重量%至约82.8重量%。在一些实施方案中,糖球占药物组合物的约82重量%至约83重量%。在一些实施方案中,糖球占药物组合物的约82.8重量%至约83.7重量%。
在一些实施方案中,药物组合物中糖球的重量百分比在约74重量%、约75重量%、约76重量%、约77重量%、约78重量%、约79重量%、约80重量%、约81重量%、约82重量%、约83重量%、约84重量%、约85重量%和约86重量%的下限与约86重量%、约85重量%、约84重量%、83重量%、82重量%、81重量%、80重量%、79重量%、78重量%、77重量%、76重量%、75重量%和74重量%的上限之间。
在一些实施方案中,药物组合物中糖球的重量百分比是约74重量%、约75重量%、约76重量%、约77重量%、约78重量%、约79重量%、约80重量%、约81重量%、约82重量%、约83重量%、约84重量%、约85重量%或约86重量%。
在本发明的一些实施方案中,石杉碱层包含石杉碱甲或其药学上可接受的盐。在一些实施方案中,石杉碱甲是蛇足石杉提取物。在一些实施方案中,蛇足石杉提取物是约99%石杉碱甲。
在一些实施方案中,药物组合物中石杉碱的重量百分比包括约0.5重量%至约1.5重量%的石杉碱或相当于0.5重量%至约1.5重量%石杉碱的石杉碱的药学上可接受的盐。在一些实施方案中,药物组合物中石杉碱的重量百分比包括约0.9重量%至约1重量%的石杉碱或相当于0.9重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐。在一些实施方案中,药物组合物中石杉碱的重量百分比包括约0.95重量%至约1重量%的石杉碱或相当于0.95重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐。在一些实施方案中,药物组合物中石杉碱的重量百分比包括约1重量%的石杉碱或相当于约1重量%石杉碱的药学上可接受的盐。在一些实施方案中,药物组合物中石杉碱的重量百分比包括在约0.5重量%、约0.6重量%、约0.7重量%、约0.8重量%、约0.9重量%、约1重量%、约1.1重量%、约1.2重量%、约1.3重量%、约1.4重量%和约1.5重量%的下限与约1.5重量%、约1.4重量%、约1.3重量%、1.2重量%、1.1重量%、1重量%、0.9重量%、0.8重量%、0.7重量%、0.6重量%和0.5重量%的石杉碱的上限之间,或相当于约0.5重量%、约0.6重量%、约0.7重量%、约0.8重量%、约0.9重量%、约1重量%、约1.1重量%、约1.2重量%、约1.3重量%、约1.4重量%和约1.5重量%的下限与约1.5重量%、约1.4重量%、约1.3重量%、1.2重量%、1.1重量%、1重量%、0.9重量%、0.8重量%、0.7重量%、0.6重量%和0.5重量%的石杉碱的上限的石杉碱的药学上可接受的盐。在一些实施方案中,药物组合物中石杉碱的重量百分比包括0.5重量%、约0.6重量%、约0.7重量%、约0.8重量%、约0.9重量%、约1重量%、约1.1重量%、约1.2重量%、约1.3重量%、约1.4重量%和约1.5重量%,或相当于0.5重量%、约0.6重量%、约0.7重量%、约0.8重量%、约0.9重量%、约1重量%、约1.1重量%、约1.2重量%、约1.3重量%、约1.4重量%和约1.5重量%的石杉碱的石杉碱的药学上可接受的盐。在其他实施方案中,石杉碱层包含治疗有效量的石杉碱。
在一些实施方案中,石杉碱层还包含一种或多种赋形剂。在一些实施方案中,赋形剂的总量是药物组合物的约5重量%至约10重量%。在一些实施方案中,赋形剂的总量是药物组合物的约5重量%至约9重量%。在一些实施方案中,赋形剂的总量是药物组合物的约5重量%至约7重量%。在一些实施方案中,石杉碱层中赋形剂的总量选自药物组合物的约5重量%、约6重量%、约7重量%、约8重量%、约9重量%或约10重量%。在一些实施方案中,赋形剂选自羟丙基甲基纤维素或聚乙烯吡咯烷酮以及它们的组合。
在一些实施方案中,羟丙基甲基纤维素是低粘度或非常低粘度的羟丙基甲基纤维素,例如像Methocel
在本发明的一些实施方案中,聚乙烯吡咯烷酮是适合用于经口药物组合物中的任何聚乙烯吡咯烷酮。在其他实施方案中,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30。在一些实施方案中,石杉碱层中聚乙烯吡咯烷酮的量是组合物的约0.5重量%至约1.5重量%。在一些实施方案中,石杉碱层中的聚乙烯吡咯烷酮是组合物的约0.95重量%至约1重量%。在一些实施方案中,石杉碱层中的聚乙烯吡咯烷酮是组合物的约0.90重量%至约1重量%。在一些实施方案中,石杉碱层中的聚乙烯吡咯烷酮是组合物的约1重量%。在其他实施方案中,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且石杉碱层中聚乙烯吡咯烷酮K30的量是组合物的约1重量%。
在一些实施方案中,石杉碱层中的一种或多种赋形剂是羟丙基甲基纤维素与聚乙烯吡咯烷酮的组合。在一些实施方案中,石杉碱层中的一种或多种赋形剂是约5重量%至约7重量%的羟丙基甲基纤维素和约0.5重量%至约1.5重量%的聚乙烯吡咯烷酮。在一些实施方案中,石杉碱层中的一种或多种赋形剂是约6重量%的羟丙基甲基纤维素和约1重量%的聚乙烯吡咯烷酮。
在本发明的一些实施方案中,聚合物包衣层是包覆石杉碱层的聚丙烯酰胺聚合物或乙基纤维素聚合物层。在一些实施方案中,聚合物包衣层是包覆石杉碱层的非聚丙烯酰胺聚合物包衣层。在一些实施方案中,聚合物包衣层是包覆石杉碱层的增塑乙基纤维素聚合物层。在其他实施方案中,增塑乙基纤维素是
在一些实施方案中,增塑乙基纤维素聚合物占组合物的约7重量%至约16重量%。在一些实施方案中,增塑乙基纤维素聚合物占组合物的约8重量%至约13重量%。在一些实施方案中,增塑乙基纤维素聚合物占组合物的约7重量%至约12重量%。在一些实施方案中,增塑乙基纤维素聚合物占组合物的约8重量%至约12重量%。在一些实施方案中,增塑乙基纤维素聚合物占组合物的约9重量%至约11重量%。在一些实施方案中,增塑乙基纤维素聚合物占组合物的约9重量%至约10重量%。在一些实施方案中,增塑乙基纤维素聚合物占药物组合物的约8.3重量%至约9.2重量%。在一些实施方案中,增塑乙基纤维素聚合物占药物组合物的约9.2重量%至约10.1重量%。在一些实施方案中,增塑乙基纤维素聚合物占药物组合物的约10.1重量%至约11重量%。在一些实施方案中,增塑乙基纤维素聚合物占药物组合物的约11重量%至约12重量%。在一些实施方案中,增塑乙基纤维素聚合物占药物组合物的约12重量%至约12.9重量%。在一些实施方案中,增塑乙基纤维素聚合物占药物组合物的约15重量%至约16重量%。
在一些实施方案中,组合物中增塑乙基纤维素聚合物的重量百分比在7重量%、8重量%、9重量%、10重量%、11重量%、12重量%、13重量%、14重量%、15重量%和16重量%的下限与16重量%、15重量%、14重量%、13重量%、12重量%、11重量%、10重量%、9重量%、8重量%和7重量%的上限之间。
在一些实施方案中,药物组合物包含:
a)根据本文针对可溶解核心所述的任何实施方案的可溶解核心;
b)包覆所述可溶解核心的根据本文针对石杉碱层所述的任何实施方案的石杉碱层,所述石杉碱层包含石杉碱或石杉碱的药学上可接受的盐;以及
c)根据本文所述的任何实施方案的包覆所述石杉碱层的聚合物包衣层。
在本发明的一些实施方案中,用于经口递送的药物组合物包含:(a)约74重量%至约86重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约0.95重量%至约1重量%的石杉碱或相当于约0.95重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐和一种或多种赋形剂,其中赋形剂的总量是约5重量%至约9重量%;(c)包覆所述石杉碱层的约7重量%至约16重量%的增塑乙基纤维素聚合物,其中所述石杉碱层包含治疗有效量的石杉碱。在其他实施方案中,石杉碱是石杉碱甲。在其他实施方案中,一种或多种赋形剂是羟丙基甲基纤维素与聚乙烯吡咯烷酮的组合。其他实施方案中,一种或多种赋形剂是约6重量%的羟丙基甲基纤维素与约1重量%的聚乙烯吡咯烷酮的组合。在一些实施方案中,羟丙基甲基纤维素是低粘度羟丙基甲基纤维素,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且增塑乙基纤维素是
在本发明的一些实施方案中,药物组合物包含:(a)约79重量%至约84重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约0.95重量%至约1重量%的石杉碱或相当于约0.95重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐、约6重量%的羟丙基甲基纤维素和0.95重量%至约1重量%的聚乙烯吡咯烷酮;以及(c)包覆所述石杉碱层的约8重量%至约13重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱。在其他实施方案中,石杉碱是石杉碱甲。在其他实施方案中,石杉碱是石杉碱甲,羟丙基甲基纤维素是低粘度羟丙基甲基纤维素,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且增塑乙基纤维素是
在本发明的一些实施方案中,药物组合物包含:(a)约80重量%至约83重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约0.95重量%至约1重量%的石杉碱或相当于约0.95重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐、约5重量%至约6重量%的羟丙基甲基纤维素和约0.95重量%至约1重量%的聚乙烯吡咯烷酮;以及(c)包覆所述石杉碱层的约8重量%至约12重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱。在其他实施方案中,石杉碱是石杉碱甲,羟丙基甲基纤维素是低粘度羟丙基甲基纤维素,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且增塑乙基纤维素是
在本发明的一些实施方案中,药物组合物包含:(a)约81重量%至约82重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约0.95重量%至约1重量%的石杉碱或相当于约0.95重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐、约5重量%至约6重量%的羟丙基甲基纤维素和约0.95重量%至约1重量%的聚乙烯吡咯烷酮;以及(c)包覆所述石杉碱层的约10重量%至约11重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱。在其他实施方案中,石杉碱是石杉碱甲,羟丙基甲基纤维素是低粘度羟丙基甲基纤维素,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且增塑乙基纤维素是
在本发明的一些实施方案中,药物组合物包含:(a)约81.5重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约1重量%的石杉碱或相当于1重量%石杉碱的石杉碱的药学上可接受的盐、约5.9重量%的羟丙基甲基纤维素和约1重量%的聚乙烯吡咯烷酮;以及(c)包覆所述石杉碱层的约10.7重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱。在其他实施方案中,石杉碱是石杉碱甲,羟丙基甲基纤维素是低粘度羟丙基甲基纤维素,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且增塑乙基纤维素是
在本发明的一些实施方案中,药物组合物包含:(a)约82重量%至约83重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约0.95重量%至约1重量%的石杉碱或相当于约0.95重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐、约5重量%至约6重量%的羟丙基甲基纤维素和约0.95重量%至约1重量%的聚乙烯吡咯烷酮;以及(c)包覆所述石杉碱层的约9重量%至约10重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱。在其他实施方案中,石杉碱是石杉碱甲,羟丙基甲基纤维素是低粘度羟丙基甲基纤维素,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且增塑乙基纤维素是
在本发明的一些实施方案中,药物组合物包含:(a)约83重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约1重量%的石杉碱或相当于1重量%石杉碱的石杉碱的药学上可接受的盐、约6重量%的羟丙基甲基纤维素和约1重量%的聚乙烯吡咯烷酮;以及(c)包覆所述石杉碱层的约9重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱。在其他实施方案中,石杉碱是石杉碱甲,羟丙基甲基纤维素是低粘度羟丙基甲基纤维素,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且增塑乙基纤维素是
在本发明的一些实施方案中,药物组合物还包含在石杉碱层与增塑乙基纤维素层之间的密封包衣层。
一些实施方案描述了一种药物组合物,其包含:(a)约75重量%至约76重量%的糖球核心,其中所述糖球核心具有约500-710μm的粒度;(b)包覆所述糖球的石杉碱层,其中所述石杉碱层包含约0.9重量%至约1重量%的石杉碱或相当于约0.9重量%至约1重量%石杉碱的石杉碱的药学上可接受的盐、约5重量%至约6重量%的羟丙基甲基纤维素和约0.9重量%至约1重量%的聚乙烯吡咯烷酮;(c)包覆所述石杉碱层的密封包衣层,所述密封包衣层包含约1重量%至约2重量%的羟丙基甲基纤维素;以及(d)包覆所述石杉碱层的约15重量%至约16重量%的增塑乙基纤维素聚合物层,其中所述石杉碱层包含治疗有效量的石杉碱。在其他实施方案中,石杉碱是石杉碱甲,羟丙基甲基纤维素是低粘度羟丙基甲基纤维素,聚乙烯吡咯烷酮是聚乙烯吡咯烷酮K30,并且增塑乙基纤维素是
本发明的实施方案包括根据本文所述的任何实施方案的药物组合物,所述药物组合物的特征在于在向人受试者经口施用治疗有效剂量的所述药物组合物后,石杉碱在血浆中的C
本发明的其他实施方案涵盖根据本文所述的任何实施方案的药物组合物,所述药物组合物包含治疗有效量的石杉碱,其特征在于T
一些实施方案描述了一种根据本文所述的任何实施方案的药物组合物,当在37℃下在50mM磷酸盐(pH 6.8)中根据USP 1型设备以50转/分钟进行测试时,所述药物组合物表现出以下溶出概况:约36%至约46%的石杉碱在2小时后释放,约61%至约77%的石杉碱在4小时后释放,约84%至约97%的石杉碱在8小时后释放,并且不少于约89%的石杉碱在12小时后释放。
一些实施方案描述了一种根据本文所述的任何实施方案的药物组合物,当在37℃下在50mM磷酸盐(pH 6.8)中根据USP 1型设备以50转/分钟进行测试时,所述药物组合物表现出以下溶出概况:约36%石杉碱在2小时后释放,约63%的石杉碱在4小时后释放,约84%的石杉碱在8小时后释放,并且不少于约89%的石杉碱在12小时后释放。
一些实施方案描述了一种根据本文所述的任何实施方案的药物组合物,当在37℃下在50mM磷酸盐(pH 6.8)中根据USP 1型设备以50转/分钟进行测试时,所述药物组合物表现出以下溶出概况:约46%石杉碱在2小时后释放,约77%的石杉碱在4小时后释放,约97%的石杉碱在8小时后释放,并且不少于约99%的石杉碱在12小时后释放。
一些实施方案描述了一种根据本文所述的任何实施方案的药物组合物,当在37℃下在50mM磷酸盐(pH 6.8)中根据USP 1型设备以50转/分钟进行测试时,所述药物组合物表现出以下溶出概况:约43%石杉碱在2小时后释放,约68%的石杉碱在4小时后释放,约88%的石杉碱在8小时后释放,并且不少于约96%的石杉碱在12小时后释放。
一些实施方案描述了一种根据本文所述的任何实施方案的药物组合物,当在37℃下在50mM磷酸盐(pH 6.8)中根据USP 1型设备以50转/分钟进行测试时,所述药物组合物表现出以下溶出概况:约38%石杉碱在2小时后释放,约61%的石杉碱在4小时后释放,约84%的石杉碱在8小时后释放,并且不少于约94%的石杉碱在12小时后释放。
本发明的一些实施方案的另一个实施方案是药物组合物,其特征在于,在向人受试者经口施用所述药物组合物后的前31小时内维持低于5ng/mL的血浆浓度。
在本文所述的任何实施方案中,石杉碱是石杉碱甲或其药学上可接受的盐。在任何实施方案中,石杉碱甲是蛇足石杉提取物。在任何实施方案中,蛇足石杉提取物是约99%石杉碱甲。
在本文描述的任何实施方案中,药物组合物用于经口递送。在实施方案中,本发明的药物组合物被配制用于经口施用,并且可例如呈片剂、喷洒剂、胶囊和丸剂的形式。在一个实施方案中,根据本文所述的任何实施方案的药物组合物被配制用于以胶囊的形式经口施用。在一些实施方案中,根据本文所述的任何实施方案的药物组合物被配制用于以片剂的形式经口施用。本发明的组合物可含有另外的无毒药学上可接受的载体和/或稀释剂和/或佐剂和/或赋形剂。此类介质和剂用于药物活性物质的用途是本领域众所周知的,并且包括片剂粘合剂、润滑剂、调味剂、防腐剂、润湿剂、乳化剂和分散剂。
如下所述以及在以下实施例中,申请人已经表明,本文所述的任何实施方案中描述的药物组合物具有出人意料的和不可预测的性质。
申请人制备了许多药物组合物,所述药物组合物包含惰性核心层、包覆所述核心层的石杉碱层和包覆所述石杉碱层的聚合物层,如表1中所示。
表1
*MCC=微晶纤维素球
**HPMC=羟丙基甲基纤维素;PVP=聚乙烯吡咯烷酮
如图4所示,组合物1A和1B具有如此快以致于它们与改良释放药物组合物相比与立即释放药物组合物更相似、从而在约30分钟内释放88%-92%的石杉碱的溶出概况。这一结果是出人意料的,因为本领域技术人员已知微晶纤维素球为用于药物的延长/改良释放的合适核心。此外,MCC组合物1A和1B含有包覆石杉碱层的Eudragit层。Eudragit将预计甚至进一步减慢溶出速率。此外,鉴于组合物1和2的溶出概况,本领域技术人员将不预期包含糖球的组合物提供相较于MCC球的优点。因为糖球是水溶性的,所以本领域技术人员将预期糖球组合物的溶出概况比具有水不溶性MCC球的组合物更快。尽管MCC组合物2A、2B、2C、3A、3B和3C具有更长的释放概况,但是它们具有太快的初始释放(快速释放)或它们释放太慢。然而,糖球组合物4A、4B、4D、4E、4F-1和4F-2、并且特别是4D、4F-1和4F-2出人意料地具有缓慢的初始溶出速率并在12小时后释放约85%-90%(或更高)的石杉碱,从而使它们成为石杉碱的改良释放药物组合物的理想选择(参见图5和表2)。
表2
一些实施方案描述了一种根据本文所述的任何实施方案的药物组合物,所述药物组合物表现出如表2中定义的溶出概况。在一些实施方案中,当与组合物4A、4D、4F-1和4F-2中的任一者相比时,溶出概况具有大于50%的F2。本领域技术人员将理解,F2是评估2条溶出曲线的相似性的因子,并由下式表示:F2-50x log{[1+(l/n)V(R-T)
在狗中的药代动力学研究进一步说明组合物4A的优点,例如相较于MCC组合物(参见图6)。在研究中观察到以下药代动力学参数(参见表3和实施例2)。
表3
*基于来自Chu D,Liu W,Li Y,Li P,Gu J,Liu K.Pharmacokinetics ofhuperzine A in dogs following single intravenous and oraladministrations.Planta Med.2006May;72(6):552-5的值,
**基于等效给药计算
如表3和图6所示,MCC组合物2C释放石杉碱,但是,石杉碱的释放和随后的吸收还不够快以至于无法跟上药物从体内的清除,从而仅产生t1/2从1.25小时小幅延长至2小时。因此,患者将不得不每天接受组合物2C中的石杉碱四至六次,从而与立即释放药物组合物相比几乎没有优势。然而,组合物4A具有对于每天两次给药来说理想的药代动力学概况,从而展示更高的总体吸收,而不会太快从体内清除。
在人中的1b期临床试验中,进一步说明组合物4D具有显示与立即释放制剂相比严重不良事件显著减少的有利药代动力学概况,证明每天两次给药并证明预计在需要更高剂量石杉碱的患者(例如患有癫痫发作病症的患者)中提供显著保护的可达到的药物血浆水平(参见实施例3)。
根据本文所述的任何实施方案的药物组合物可用于治疗有需要的患者的神经系统病症和/或癫痫发作病症。它们可治疗性地施用以治疗、预防或减缓神经功能障碍的发作速率。一些实施方案描述了治疗神经系统病症和/或癫痫发作病症的方法。一些实施方案描述用根据本文所述的任何实施方案的药物组合物治疗神经系统病症的方法,所述神经系统病症选自淀粉样蛋白相关病症如阿尔茨海默病和本文所述的淀粉样蛋白病症、精神病症如图雷特综合征、创伤后应激障碍(PTSD)、恐慌和焦虑病症、强迫症和精神分裂症、发育障碍如脆性X综合征和自闭症、疼痛、药物成瘾如酒精中毒、神经变性疾病如帕金森病和亨廷顿病以及中风和缺血性脑损伤、肌萎缩性侧索硬化、癫痫以及与暴露于神经毒素(包括但不限于诸如化学战剂的神经毒素)相关或有关的任何病症、症状或效应。
在实施方案中,本发明提供了治疗癫痫发作或癫痫发作病症的方法,所述癫痫发作或癫痫发作病症选自癫痫(包括顽固性癫痫)、全身性癫痫发作、原发性全身性癫痫发作、失神性癫痫发作、肌阵挛性癫痫发作、部分性癫痫发作、伴或不伴有全身性的复杂部分性癫痫发作(例如,局灶性意识受损癫痫发作(FIAS))、兰诺克斯-盖索特综合征、德拉韦综合征和伴有高热癫痫发作附加症的全身性癫痫(GEFS+)。在一些实施方案中,癫痫发作是癫痫。
根据本文所述的任何实施方案的药物组合物可治疗性地施用以治疗、预防或减缓诸如癫痫和癫痫发作的神经元功能障碍的发作速率;或者预防性地施用以保护免于与癫痫相关的进一步癫痫发作或避免或防止与其他病症相关的癫痫发作的发作。例如,根据本文所述的任何实施方案的药物组合物可预防性地施用以减缓或停止患有中风并且具有由于中风而发展癫痫发作的风险的患者的癫痫发作和癫痫的进展。
其他实施方案描述治疗癫痫、顽固性癫痫和FIAS的方法,所述方法包括向有需要的患者施用根据本文所述的任何实施方案的药物组合物。
在一些实施方案中,本发明的药物组合物以使癫痫发作减少至少10%的剂量施用,并且具有更好的副作用概况。优选地,减少是20%、50%、75%或消除癫痫发作。例如,根据本文所述的任何实施方案的药物组合物预防癫痫发作的发展或完全消除癫痫发作。
在其他实施方案中,本发明提供治疗与暴露于神经毒素(包括但不限于诸如化学战剂的神经毒素)相关或有关的任何病症、症状或效应的方法,所述方法包括向有需要的患者施用根据本文所述的任何实施方案的药物组合物。
在一些实施方案中,本发明的药物组合物中石杉碱的剂量优选不超过10mg/天。在一些实施方案中,剂量优选不超过6.5mg/天。在一些实施方案中,剂量是在约0.01mg/天、约0.05mg/天、约0.1mg/天、约0.25mg/天、约0.5mg/天、约0.75mg/天、约0.8mg/天、约1mg/天、约1.1mg/天、约1.25mg/天、约1.5mg/天、约1.75mg/天、约2mg/天、约2.2mg/天、约2.25mg/天、约2.5mg/天、约3.0mg/天、约3.5mg/天、约4.0mg/天、约4.5mg/天、约5.0mg/天、约5.5mg/天、约6.0mg/天和约6.5mg/天的下限与约6.5mg/天、约6.0mg/天、约5.5mg/天、约5mg/天、约4.5mg/天、约4.0mg/天、约3.5mg/天、约3.0mg/天、约2.5mg/天、约2.25mg/天、约2.2mg/天、约2mg/天、约1.75mg/天、约1.5mg/天、约1.25mg/天、约1.1mg/天、约1mg/天、约0.75mg/天、约0.8mg/天、约0.5mg/天、约0.25mg/天、约0.1mg/天、约0.05mg/天和约0.01mg/天的上限之间。在一些实施方案中,剂量是约0.01mg/天至约0.8mg/天。在其他实施方案中,剂量是约0.25mg/天至约5mg/天。在一些实施方案中,剂量是约0.25mg/天至约0.5mg/天。在一些实施方案中,剂量是约0.5mg/天至约0.75mg/天。在一些实施方案中,剂量是约0.75mg/天至约1mg/天。在一些实施方案中,剂量是约1mg/天至约1.25mg/天。在一些实施方案中,剂量是约1.25mg/天至约1.5mg/天。在一些实施方案中,剂量是约1.5mg/天至约1.75mg/天。在一些实施方案中,剂量是约1.75mg/天至约2.0mg/天。在一些实施方案中,剂量是约2.0mg/天至约2.25mg/天。在一些实施方案中,剂量是约2.25mg/天至约2.5mg/天。在一些实施方案中,剂量是约2.5mg/天至约2.75mg/天。在一些实施方案中,剂量是约2.75mg/天至约3.0mg/天。在一些实施方案中,剂量是约3.0mg/天至约3.25mg/天。在一些实施方案中,剂量是约3.25mg/天至约3.50mg/天。在一些实施方案中,剂量是约3.50mg/天至约3.75mg/天。在一些实施方案中,剂量是约3.75mg/天至约4.0mg/天。在一些实施方案中,剂量是约4.0mg/天至约4.25mg/天。在一些实施方案中,剂量是约4.25mg/天至约4.5mg/天。在一些实施方案中,剂量是约4.5mg/天至约4.75mg/天。在一些实施方案中,剂量是约4.75mg/天至约5mg/天。在一些实施方案中,剂量是约1mg/天至约5mg/天。在一些实施方案中,剂量是约0.5mg/天至约5mg/天。在一些实施方案中,剂量是约0.5mg/天至约2.2mg/天。在一些实施方案中,剂量是约5mg/天。在一些实施方案中,剂量是约0.5mg/天、约1mg/天、约1.1mg/天、约1.5mg/天、约2.0mg/天、约2.50mg/天、约3.0mg/天、约3.5mg/天或约3.6mg/天。在一些实施方案中,根据本文所述的任何实施方案的每日剂量每天两次施用。在一些实施方案中,剂量是每天两次约0.25mg至每天两次约2.5mg。在一些实施方案中,剂量是每天两次约0.25mg、每天两次约0.5mg、每天两次约0.75mg、每天两次约1.0mg、每天两次约1.1mg、每天两次约1.25mg、每天两次1.5mg、每天两次1.75mg、每天两次1.8mg、每天两次2.0mg、每天两次2.25mg或每天两次2.5mg。
在一些实施方案中,还可使用约0.05mg/天至约7mg/天、约05mg/天至约5mg/天、约0.05mg/天至约0.8mg/天、约0.05mg/天至约0.4mg/天、约0.05mg/天至约0.02mg/天或0.05mg/天至约0.01mg/天的剂量。在一些实施方案中,这些剂量可用于治疗任何神经系统病症。在一些实施方案中,这些剂量可用于治疗与暴露于诸如化学战剂的神经毒素相关或有关的症状或效应。
在一些实施方案中,本公开提供了一种治疗神经系统病症和/或癫痫发作病症的方法,所述方法包括向有需要的患者施用一个或多个滴定剂量的石杉碱的改良释放药物组合物,随后维持剂量的石杉碱的经口改良释放药物组合物,其中所述患者经历更好的副作用概况。在一些实施方案中,以滴定剂量施用的石杉碱的改良释放药物组合物是以维持剂量施用的石杉碱的相同改良释放药物组合物。在其他实施方案中,以滴定剂量施用的石杉碱的改良释放药物组合物与以维持剂量施用的石杉碱的改良释放药物组合物不同。在其他实施方案中,石杉碱是石杉碱甲。在一些实施方案中,石杉碱的改良释放药物组合物包含可溶解核心;包覆所述可溶解核心的活性石杉碱甲层;和包覆所述石杉碱甲层的聚合物包衣。在其他实施方案中,所述改良释放石杉碱药物组合物是根据本文所述的任何实施方案的药物组合物。在一些实施方案中,石杉碱的改良释放药物组合物是根据本文所述的任何实施方案的药物组合物,并且是滴定剂量和维持剂量的相同药物组合物。在一些实施方案中,石杉碱的经口改良释放药物组合物是根据本文所述的任何实施方案的包含石杉碱甲的药物组合物,并且是滴定剂量和维持剂量的包含石杉碱甲的相同药物组合物。在一些实施方案中,在几天至几周内将剂量从低剂量滴定至高剂量,直到达到维持剂量。
一些实施方案描述了一种治疗有需要的患者的神经系统病症和/或癫痫发作病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用选自a.至h.(如下文进一步描述)的至少一种给药方案的第一给药方案和施用选自a.至i.(如下文进一步描述)的至少一种给药方案的第二给药方案,条件是所述第二给药方案从所述第一给药方案递增,并且进一步条件是最后一个给药方案是维持剂量,并且因此将施用患者需要其治疗的时间:
a.施用约0.01mg至约0.25mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
b.施用约0.26mg至约0.5mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
c.施用约0.51mg至约0.75mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
d.施用约0.76mg至约1mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
e.施用约1.1mg至约1.25mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
f.施用约1.26mg至约1.5mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
g.施用约1.51mg至约1.75mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
h.施用约1.76mg至约2mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
i.施用约2.1mg至约2.5mg剂量的石杉碱,每约12小时一次持续至少两天;
其中a.-i.的石杉碱以改良释放药物组合物施用。在其他实施方案中,所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在其他实施方案中,在维持剂量之前的每个剂量施用2天至两周。
一些实施方案描述了一种治疗有需要的患者的神经系统病症和/或癫痫发作病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用选自a.至h.(如下文进一步描述)的至少一种给药方案的第一给药方案和施用选自a.至i.(如下文进一步描述)的至少一种给药方案的第二给药方案,条件是所述第二给药方案从所述第一给药方案递增,并且进一步条件是最后一个给药方案是维持剂量,并且因此将施用患者需要其治疗的时间:
a.施用约0.25mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
b.施用约0.5mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
c.施用约0.75mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
d.施用约1mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
e.施用约1.25mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
f.施用约1.5mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
g.施用约1.75mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
h.施用约2mg剂量的石杉碱,每约12小时一次持续至少两天且至多两周;
i.施用约2.5mg剂量的石杉碱,每约12小时一次持续至少两天;
其中a.-i.的石杉碱以改良释放药物组合物施用。在其他实施方案中,所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在其他实施方案中,在维持剂量之前的每个剂量施用2天至两周。应理解,至少一种选自a.至h.的给药方案与至少一种选自a.至i.的给药方案的任何组合允许给药方案的任何组合,并且因此描述最少两种给药方案(比维持剂量低的1个初始剂量和1个维持剂量)和最多9个给药方案(a至h的递增给药方案和维持剂量i)。
在一些实施方案中,所述方法包括施用选自以下的任何给药方案(其中最后指定的剂量是维持剂量):
在一些实施方案中,所述方法包括:
a.施用约0.25mg剂量的石杉碱甲,每约12小时一次持续两天至两周;
b.施用约0.5mg剂量的石杉碱甲,每约12小时一次持续两天至两周;
c.施用约0.75mg剂量的石杉碱甲,每约12小时一次持续两天至两周;以及
d.施用约1mg剂量的石杉碱甲,每约12小时一次持续至少两天。
在一些实施方案中,步骤d.施用持续患者需要治疗的时间。
在一些实施方案中,所述方法在步骤d.之后还包括:
e.施用约1.25mg剂量的石杉碱甲,每约12小时一次持续患者需要的时间。
在一些实施方案中,所述方法在步骤d.之后还包括:
e.施用约1.25mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
f.施用约1.5mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
在一些实施方案中,所述方法在步骤d.之后还包括:
e.施用约1.25mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
f.施用约1.5mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
g.施用约1.75mg剂量的石杉碱甲,每约12小时一次持续患者需要的时间。
在一些实施方案中,所述方法在步骤d.之后还包括:
e.施用约1.25mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
f.施用约1.5mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
g.施用约1.75mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
h.施用约2mg剂量的石杉碱甲,每约12小时一次持续患者需要的时间。
在一些实施方案中,所述方法在步骤d.之后还包括:
e.施用约1.25mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
f.施用约1.5mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
g.施用约1.75mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
h.施用约2mg剂量的石杉碱甲,每约12小时一次持续2天至2周;
i.施用约2.5mg剂量的石杉碱甲,每约12小时一次持续患者需要的时间。
本公开的一些实施方案涉及一种治疗有需要的患者的神经系统病症和/或癫痫发作病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用石杉碱的改良释放药物组合物,其中石杉碱的所述改良释放药物组合物的特征在于石杉碱在血浆中的C
在一些实施方案中,石杉碱在血浆中的Css是选自
在一些实施方案中,石杉碱在血浆中的Css是选自
在其他实施方案中,所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。
一些实施方案描述了一种治疗有需要的患者的神经系统病症和/或癫痫发作病症的方法,其中所述患者经历更好的副作用概况,所述方法包括施用石杉碱甲的改良释放药物组合物,其中石杉碱的所述改良释放药物组合物的特征在于,当以治疗有效剂量施用时石杉碱在血浆中的Css为约0.6ng/mL至约12ng/mL。在一些实施方案中,当以治疗有效剂量施用时,石杉碱在血浆中的Css是约2ng/mL至约12ng/mL。在一些实施方案中,当以治疗有效剂量施用时,石杉碱在血浆中的Css是约4ng/mL至约12ng/mL。在一些实施方案中,当以治疗有效剂量施用时,石杉碱在血浆中的Css是约6ng/mL至约12ng/mL。在一些实施方案中,当以治疗有效剂量施用时,石杉碱在血浆中的Css是约4ng/mL至约10ng/mL。在一些实施方案中,当以治疗有效剂量施用时,石杉碱在血浆中的Css是约4ng/mL至约8ng/mL。在一些实施方案中,当以治疗有效剂量施用时,石杉碱在血浆中的Css是约6.4ng/mL至约10ng/mL。在一些实施方案中,当以治疗有效剂量施用时,石杉碱在血浆中的Css是约8ng/mL。在一些实施方案中,当以治疗有效剂量施用时,石杉碱在血浆中的Css是至少8ng/mL。在其他实施方案中,所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。
本公开的一些实施方案涉及一种治疗神经系统病症或癫痫发作病症的方法,所述方法包括向有需要的患者施用石杉碱的改良释放药物组合物,其中在向人受试者经口施用治疗有效剂量的药物组合物后,所述药物组合物具有如表4中定义的药代动力学概况。在一些实施方案中,石杉碱的所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在一些实施方案中,改良的石杉碱药物组合物是药物组合物4D。
表4
在一些实施方案中,在向人受试者经口施用治疗有效剂量的药物组合物后,药代动力学概况是如表5中所定义。
表5
在一些实施方案中,在向人受试者经口施用治疗有效剂量的药物组合物后,药代动力学概况是如表6中所定义。
表6
本公开的一些实施方案涉及一种治疗神经系统病症或癫痫发作病症的方法,所述方法包括向有需要的患者施用石杉碱的改良释放药物组合物,其中在向人受试者经口施用治疗有效剂量的药物组合物后,所述药物组合物具有如表7中定义的药代动力学概况。在一些实施方案中,石杉碱的所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在一些实施方案中,改良的石杉碱药物组合物是药物组合物4E。
表7
在一些实施方案中,在向人受试者经口施用治疗有效剂量的药物组合物后,药代动力学概况是如表8中所定义。
表8
在一些实施方案中,在向人受试者经口施用治疗有效剂量的药物组合物后,药代动力学概况是如表9中所定义。
表9
本公开的一些实施方案涉及一种治疗神经系统病症和/或癫痫发作病症的方法,所述方法包括向有需要的患者施用石杉碱的改良释放药物组合物,其中在向人受试者经口施用治疗有效剂量的药物组合物后,所述药物组合物具有如表10中定义的药代动力学概况。在一些实施方案中,石杉碱的所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在一些实施方案中,改良的石杉碱药物组合物是药物组合物4D。
表10
在一些实施方案中,在向人受试者经口施用治疗有效剂量的药物组合物后,药代动力学概况是如表11中所定义。
表11
在一些实施方案中,在向人受试者经口施用治疗有效剂量的药物组合物后,药代动力学概况是如表12中所定义。
表12
本公开的一些实施方案涉及一种治疗神经系统病症和/或癫痫发作病症的方法,所述方法包括向有需要的患者施用石杉碱的改良释放药物组合物,其中在向人受试者经口施用治疗有效剂量的药物组合物后,所述药物组合物具有如表13中定义的药代动力学概况。在一些实施方案中,石杉碱的所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在一些实施方案中,改良的石杉碱药物组合物是药物组合物4E。
表13
在一些实施方案中,在向人受试者经口施用治疗有效剂量的药物组合物后,药代动力学概况是如表14中所定义。
表14
在一些实施方案中,在向人受试者经口施用治疗有效剂量的药物组合物后,药代动力学概况是如表15中所定义。
表15
本公开的一些实施方案涉及一种治疗神经系统病症或癫痫发作病症的方法,所述方法包括向有需要的患者施用石杉碱的改良释放药物组合物,其中在向人受试者经口施用治疗有效剂量的药物组合物后,所述药物组合物具有如表16中定义的药代动力学概况。在一些实施方案中,石杉碱的所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在一些实施方案中,改良的石杉碱药物组合物是药物组合物4F-1。
表16
本公开的一些实施方案涉及一种治疗神经系统病症或癫痫发作病症的方法,所述方法包括向有需要的患者施用石杉碱的改良释放药物组合物,其中在向人受试者经口施用治疗有效剂量的药物组合物后,所述药物组合物具有如表17中定义的药代动力学概况。在一些实施方案中,石杉碱的所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在一些实施方案中,改良的石杉碱药物组合物是药物组合物4F-1。
表17
本公开的一些实施方案涉及一种治疗神经系统病症和/或癫痫发作病症的方法,所述方法包括向有需要的患者施用石杉碱的改良释放药物组合物,其中在向人受试者经口施用治疗有效剂量的药物组合物后,所述药物组合物具有如表18中定义的药代动力学概况。在一些实施方案中,石杉碱的所述改良释放药物组合物是根据本文所述的任何实施方案的药物组合物。在一些实施方案中,改良的石杉碱药物组合物是药物组合物4F-1。
表18
本发明的药物组合物可与其他治疗剂组合施用。可与本发明的组合物共同施用的治疗剂的选择将部分取决于所治疗的疾患。例如,本发明的化合物可与用于治疗通常与癫痫或癫痫发作相关的其他症状和副作用,如昏厥、疲劳、肌肉痉挛、先兆、健忘症、焦虑症、抑郁症、头痛、嗜睡或神志恍惚的其他剂组合施用,所述其他剂如对乙酰氨基酚、乙酰唑胺、阿普唑仑、阿莫达非尼、苯并二氮杂卓、布瓦西坦、丁螺环酮、大麻素、卡马西平、卡立普多、利眠宁、氯唑沙宗、氯巴占、氯硝西泮、氯拉卓酸、地西泮、双丙戊酸、erenumab-aooe、艾司利卡西平、乙琥胺、依佐加滨、非尔氨酯、氟桂利嗪、磷苯妥英、加巴喷丁、羟嗪、布洛芬、拉科酰胺、拉莫三嗪、左乙拉西坦、劳拉西泮、美他沙酮、美索巴莫丙咪嗪、甲琥胺、莫达非尼、萘普生、硝西泮、奥卡西平、吡仑帕奈、苯巴比妥、苯妥英、普瑞巴林、普里米酮、普萘洛尔、卢非酰胺、司替戊醇、噻加宾、托吡酯、丙戊酸、氨己烯酸和唑尼沙胺或它们的组合。
可在根据本文所述的任何实施方案的石杉碱药物组合物的施用之前、同时或之后施用此类其他治疗剂。
虽然已参考本发明的某些优选实施方案相当详细地描述了本发明,但是其他变型也是可能的。因此,随附权利要求书的精神和范围应当不限于含在本说明书内的描述和优选变型。本发明的各种实施方案将参考以下非限制性实施例来说明。以下实施例仅出于说明性目的并且不应解释为以任何方式限制本发明。
在37℃下在50mM磷酸盐(pH 6.8)中根据USP 1型设备以50转/分钟对组合物进行测试。结果示于图4中。
研究目的
本研究的目的是确定改良释放石杉碱组合物4A在雄性比格犬中的血浆药代动力学。监测血浆中的石杉碱甲达24小时。
以5.45mg/kg改良释放石杉碱甲(组合物4A,相当于0.049mg/kg石杉碱甲)的标称剂量对动物给药
在研究中使用了称重≥6kg的三只非首次用于实验的雄性比格犬(MarshallBioresources,Beijing,China)。在分配至研究之前,由助理兽医官对动物进行一般健康状况的身体检查。在研究之前,使动物适应测试设施。
将动物圈养在房间中,所述房间以10至20次换气/小时针对相对湿度(靶向平均范围40%至70%)和温度(靶向平均范围18℃至26℃)进行控制和监测。除学习活动必需中断外,所述房间均处于12小时亮/暗周期。
将动物在一生中单独圈养在根据国家研究委员会“实验室动物的护理和使用指南”的不锈钢网笼中。
每天两次饲喂动物。每天向所述狗饲喂大约220克的认证狗饮食(Beijing VitalKeao Feed Co.,Ltd.Beijing,P.R.China)。这些量可基于组的食物消耗或组或个体的个体体重变化和/或认证饮食的变化而根据需要进行调整。
随意向所有动物提供RO(反渗透)水。
提供富集玩具。
经由胶囊递送经口施用改良释放石杉碱甲组合物4A。
a.技术人员用他/她的另一只手将下颚往下拉,并将胶囊放回到喉咙深处。然后通过使用拇指或食指将胶囊推动经过咽部。b.可用水润湿胶囊以促进给药,并且如果需要,可使用水来促进胶囊的吞咽。c.在施用剂量后,如果需要,可通过轻轻抚摸狗的喉咙或在下巴上敲打狗来诱导吞咽。d.在胶囊施用后立即以约10mL/动物的剂量体积向动物的嘴中给予水以帮助胶囊吞咽。e.在施用后,检查动物的口腔以确保剂量已被吞咽。
观察和检查
每天两次进行一般健康状况和外观的笼侧观察。
在给药日,在每个样品收集时间点之前和之后观察动物。原始数据中记录整个研究过程中注意到的一般状况、行为、活动、排泄、呼吸或其他异常观察结果。
体重
在给药日对所有动物称重,之后给药以确定待施用的剂量体积。
数据分析和报告
使用WinNonlin软件程序(6.3版,Pharsight,Mountain View,CA)通过非房室方法来分析血浆浓度对时间数据。C
报告了每种分析物的清除率、T
使用经口药物组合物4D进行了单中心、现场/门诊剂量递增研究。在各自2名受试者的4个群组(药物组合物4D)和总计3名受试者的2个群组(药物组合物4E)中每天两次(BID)向受试者给药,以评估血浆水平、安全性并允许在向任何后续受试者给药前进行必要的给药改变。所述研究是在剂量开始和剂量递增时在现场环境进行以评价安全性,并用于样本采集以进行常规实验室和药代动力学分析。受试者出院,并且工作人员通过每天两次电话监测BID给药的依从性。初始剂量是0.5mg BID,每2-3天剂量递增,直到观察到最大耐受剂量或获得最大2.5mg BID剂量。工作人员可酌情决定改变初始剂量和递增速率,以确保受试者的安全。
研究终点:血浆浓度数据用于生物利用度评估。获得的药代动力学参数包括:曲线下面积(AUC)、最大血清浓度(C
基于不良事件的发生以及研究指定的生命体征、神经系统和身体检查、ECG评价和临床实验室研究的结果,评估了安全性和耐受性参数。
给药时间表如下:
群组1和2(药物组合物4D):
群组3(药物组合物4D):
群组4(药物组合物4D):
群组5和6(药物组合物4E):
在整个研究中,对于群组1-4,在住院天的剂量滴定时获取的血浆水平在图7中示出。在整个剂量滴定时间表中发生血浆抽取,以评估总体血浆浓度。时间=0代表对应于给药时间表的滴定日的剂量前基线。平均值反映了对于8名受试者获得的所有数据。改变群组3和4的初始给药时间表,以适应较慢的滴定(0.25mg剂量增量)。
在整个研究期间在住院日在特定剂量下的平均血浆水平的图在图8中示出。药代动力学建模预测8.4ng/mL的平均血浆水平(Css)在50%的患者中实现100%的癫痫发作保护(约1.1-1.25mg BID的给药等效量。
当与立即释放制剂相比时,即使用先前使用的剂量的两倍,所述研究中的组合物也产生有利的药代动力学概况,证明每天两次给药并且证明不良事件的显著减少。药代动力学建模准确地预测整个剂量滴定的剂量-暴露关系。
不良事件是轻度和短暂的。测试表明,可实现预计用于显著癫痫发作控制的剂量的大约两倍;按两次/每天时间表给予产生更高的、稳定的石杉碱甲血浆水平,并且达到预计在患有成人和儿童顽固性癫痫的患者中提供显著癫痫发作保护的药物血浆水平。
这项研究的目的是在使用根据本文所述的任何实施方案的药物组合物的住院和门诊研究中检查安全性信号并证明在用石杉碱的改良释放药物组合物作为附加疗法治疗的患有FIAS的成人中癫痫发作减少。在一些实施方案中,药物组合物是4F1或4F-2。
每个参与者的剂量施用将以0.25mg BID开始,每4天依序递增至最大耐受剂量或1.75mg BID的目标剂量,在剂量递增期间不能耐受剂量的参与者将其剂量降低至先前可耐受剂量;如果不能耐受较低剂量,则参与者将退出研究。
16名参与者将被招募至研究中并完成研究。
此研究是在患有频繁的局灶性意识受损癫痫发作的在其他方面健康的参与者中的单中心、多位点、开放标签的附加研究。
已签署知情同意书的18岁及18岁以上的经预审的符合条件的参与者将被纳入研究。所述研究将包括96小时的基线连续VEM期、一个月的门诊剂量递增治疗期、随后第二96小时的连续VEM治疗期。
在基线期的第1天(在完成身体和神经系统检查、生命体征、心电图(ECG)、用于CBC和化学的血液样品、用于标准尿液分析(包括肌酐和电解质)的尿液样品收集之后),将开始每日癫痫发作计数并将通过带有标准引线放置的VEM收集。参加者将如由其治疗医师确定继续接受稳定的抗惊厥治疗方案。在完成基线期(5天住院VEM)后,经历至少5次局灶性意识受损癫痫发作的参与者将被立即招募至治疗中。他们将开始石杉碱的改良释放药物组合物的剂量递增至1.75mg BID的目标剂量或最大耐受剂量。石杉碱的改良释放药物组合物将在28天内滴定,每4天递增一次。在达到目标剂量或最大耐受剂量后,参与者将保持所述剂量以获得门诊滴定期的平衡,此后他们将开始96小时的住院VEM治疗期。对于门诊滴定期的持续时间,将保持每日癫痫发作日记,其中参与者或护理人员应注明癫痫发作类型和一天中的时间。不能达到1.75mg BID的目标剂量的参与者将被降低剂量至先前可耐受剂量。如果不能忍受较低剂量,则参与者可退出研究。将每天(每12小时)向参与者给予2次石杉碱的改良释放药物组合物,在早晨和晚上进行施用。除非患者选择参加开放标签延长期(在此期间他们将继续记录癫痫发作日记并将定期进行安全性评估),否则参与者将在住院VEM的最后一天停用石杉碱的改良释放药物组合物。
将在选定的门诊和住院研究日抽取用于药理学的血液样品。在整个研究过程中将记录不良事件(AE)和并行药物的使用。
接受至少一个剂量的石杉碱的改良释放药物组合物的所有参与者将被纳入在安全性分析中,所述安全性分析包括生命体征、临床实验室测试、身体和神经系统检查、心电图和不良事件监测。
主要功效变量:在基线(治疗前)与评价(治疗时)VEM期之间平均每日癫痫发作计数减少。
次要功效变量:
·与评价VEM期(治疗时)相比,平均每日癫痫发作计数从基线VEM期的减少百分比
·与滴定治疗期的最后一周相比,平均癫痫发作次数从基线期(筛选/回顾性日记)的减少百分比
·被认为是治疗应答者的参与者的百分比,所述治疗应答者被定义为与VEM治疗评价期相比,癫痫发作从基线VEM期减少≥25%、≥50%、≥75%的那些
·在延长期内的1、3、6、12个月,平均癫痫发作次数与基线/回顾性日记相比的减少百分比
·癫痫发作减少100%的受试者的比例
·需要不同剂量的挽救药物的受试者的比例
血浆浓度数据将用于确定剂量、血清水平和癫痫发作效应关系。
尿液样品将进行标准尿液分析,测试药物消除和潜在代谢物的存在。
迄今为止,如图9和表19所述,三名患者已接受2-3次剂量滴定。
表1
本文所述的药物组合物通常可如下制备:
利用流化床包覆设备(或类似的包覆颗粒制造设备),使用标准程序和操作条件来制造包覆颗粒。这些程序包括:
制备用于制造改良释放颗粒的溶液,例如含有石杉碱、粘合剂、抗结块剂等的溶液。
将未包覆的核心负载到流化床中
将所有操作参数喷嘴、压力调整至适当的范围,以用于适当的批次大小和所使用的设备
加工包覆的粒料以除去在所需粒度分布之外的附聚物或细颗粒。
一种示例性过程包括:
1.溶液制备
a.将预定量的蒸馏水加热至70摄氏度。
b.通过搅拌将石杉碱溶解在无水乙醇中。
c.在必要时,在连续搅拌下将HPMC添加到加热的水中。
d.将另一分配量的蒸馏水添加到上述溶液中;持续搅拌直到粉末完全溶解。
e.将PVP添加到HPMC溶液中,并同样地通过连续搅拌使其溶解。
f.将HMPC/PVP溶液与石杉碱乙醇溶液合并。使用蒸馏水冲洗容器,且小心地倒入溶液中直到达到最终重量,并再继续搅拌5分钟。
2.药物层包覆
a.将所需大小的蔗糖球转移到流化床加工器中,并且将1f.的上述石杉碱溶液在35C-45C的产品温度下包覆到蔗糖球上。
3.缓释层包覆
a.使用上述相同的产品温度范围,将预先制备的增塑乙基纤维素溶液包覆到所得石杉碱负载的糖球上,直到达到理论重量增加。
