一种具有调节菌群通便功能的榆黄菇多糖提取物及其制备方法和应用
文献发布时间:2024-04-18 19:53:33
技术领域
本发明属于生物技术领域,涉及一种具有调节菌群通便功能的榆黄菇多糖提取物及其制备方法和应用。
背景技术
榆黄菇(Pleurotus citrinopileatus)又名榆黄蘑、黄金菇、金顶侧耳,隶属于担子菌亚门(Basidiomycotina)、层菌纲(Hymenomycetes)、伞菌目(Agaricales)、侧耳科(Pleurotaceae)、侧耳属(Pleurotus),为珍贵的经济菌之一。榆黄菇具有较高的营养价值,子实体中含有丰富的粗蛋白、不饱和脂肪酸、17种氨基酸、维生素和多种微量元素,能够满足人体对必需氨基酸、维生素和有益微量元素的营养需求。榆黄菇具有较高的药用价值,有文献报道其有滋补强壮的功效,有利于病体康复,降低胆固醇,可以治疗肾虚阳萎和痢疾等病患。
便秘通常是由于粪便在消化道中移动太慢,或无法从直肠中有效清除时,导致粪便脱水、变硬和干燥,从而引发的便秘。便秘在所有人群中都很常见,发病率为2%-28%,随年龄增长,患病率明显增加,老年人群中15%-20%为有便秘症状者。便秘的治疗以缓解症状、恢复正常的肠道动力和排便功能为目的。
发明内容
本发明的目的是提供一种具有调节菌群通便功能的榆黄菇多糖提取物及其制备方法和应用。
本发明提供了榆黄菇提取物在制备药物中的应用;
所述药物的用途为如下(a1)、(a2)、(a3)、(a4)、(a5)和(a6)中的至少一种:
(a1)治疗和/或预防便秘;
(a2)促进肠道蠕动;
(a3)促进排便;
(a4)提高粪便含水量;
(a5)改善肠道菌群结构;
(a6)调节肠道菌群。
所述榆黄菇提取物具体可为后续任一所述的榆黄菇提取物。
所述榆黄菇提取物具体可为后续任一所述方法制备的榆黄菇提取物。
本发明提供了一种制备榆黄菇提取物的方法,依次包括如下步骤:
(1)以榆黄菇为原料,提取粗多糖;
(2)去除粗多糖中的蛋白质;
(3)依次进行阴离子交换柱层析分离纯化和分子筛层析分离纯化;
(4)获得榆黄菇提取物。
所述提取采用水提醇沉法。
所述“去除粗多糖中的蛋白质”采用Seveag法。
所述阴离子交换柱层析分离纯化中,阴离子交换层析柱的填料为纤维素DE-52,用于洗脱的流动相为NH
所述分子筛层析分离纯化中,分子筛层析柱为HiLoad 16/600Superdex,用于洗脱的流动相为水。
本发明还提供了一种榆黄菇提取物,其制备方法依次包括如下步骤:
(1)以榆黄菇为原料,提取粗多糖;
(2)去除粗多糖中的蛋白质;
(3)依次进行阴离子交换柱层析分离纯化和分子筛层析分离纯化;
(4)获得榆黄菇提取物。
所述提取采用水提醇沉法。
所述“去除粗多糖中的蛋白质”采用Seveag法。
所述阴离子交换柱层析分离纯化中,阴离子交换层析柱的填料为纤维素DE-52,用于洗脱的流动相为NH
所述分子筛层析分离纯化中,分子筛层析柱为HiLoad 16/600Superdex,用于洗脱的流动相为水。
“以榆黄菇为原料,提取粗多糖”,具体包括如下步骤:
①将冷冻干燥后的榆黄菇子实体粉碎,获得干粉;
②取步骤①获得的干粉,加入水,2-6℃静置提取;
③完成步骤②后,85-95℃振荡孵育,然后离心收集上清液;
④完成步骤③剩余的沉淀,加入水,85-95℃振荡孵育,然后离心收集上清液;
⑤将步骤③收集的上清液和步骤④收集的上清液合并,减压浓缩,获得浓缩液;
⑥取步骤⑤得到的浓缩液,加入无水乙醇,静置;
⑦完成步骤⑥后,离心收集沉淀,即为粗多糖。
“以榆黄菇为原料,提取粗多糖”,还包括如下步骤:将步骤⑦获得的沉淀烘干至恒重。
“以榆黄菇为原料,提取粗多糖”,还包括如下步骤:将步骤⑦获得的沉淀烘干至恒重,然后溶于水,得到粗多糖溶液。
“以榆黄菇为原料,提取粗多糖”,具体包括如下步骤:
①将冷冻干燥后的榆黄菇子实体粉碎,获得60-100目干粉(具体可为80目干粉);
②取10g步骤①获得的干粉,加入400mL去离子水,4℃静置10小时;
③完成步骤②后,摇匀,封口,然后置于水浴摇床中,90℃、100r/min振荡孵育4h,然后7000r/min离心30min,收集上清液;
④完成步骤③剩余的沉淀,加入200mL去离子水,摇匀,封口,然后置于水浴摇床中,90℃、100r/min振荡孵育4h,然后7000r/min离心30min,收集上清液;
⑤将步骤③收集的上清液和步骤④收集的上清液合并,减压浓缩(70℃,0.1MPa)至密度为1.2g/mL,即为浓缩液;
⑥取步骤⑤得到的浓缩液,加入其4倍体积的无水乙醇,搅拌均匀,然后盖上锡箔纸,静置12小时;
⑦完成步骤⑥后,7000r/min离心15min,收集沉淀,将沉淀转移至60℃的烘箱中烘干至恒重,研磨成粉末状,即为榆黄菇粗多糖。
“以榆黄菇为原料,提取粗多糖”,还包括如下步骤:将每1g榆黄菇粗多糖溶于50mL去离子水,得到粗多糖溶液。
去除粗多糖中的蛋白质,具体包括如下步骤:
①取粗多糖溶液,加入Seveag试剂,涡旋震荡,然后离心收集上清液;
②取前一步骤得到的上清液,加入Seveag试剂,涡旋震荡,然后离心收集上清液;
③按照步骤②进行重复多次操作,直至观察不到蛋白质层出现,收集此时的上清液;
④取步骤③得到的上清液,加入无水乙醇,静置,然后离心收集沉淀。
去除粗多糖中的蛋白质,还包括如下步骤:将步骤④获得的沉淀烘干至恒重,即为去除蛋白的榆黄菇多糖。
去除粗多糖中的蛋白质,还包括如下步骤:将步骤④获得的沉淀烘干至恒重,然后溶于水,得到榆黄菇多糖溶液。
去除粗多糖中的蛋白质,具体包括如下步骤:
①取粗多糖溶液,加入其三分之一体积的Seveag试剂,涡旋震荡5min,然后4500r/min离心15min,收集上清液;
②取前一步骤得到的上清液,加入其三分之一体积的Seveag试剂,涡旋震荡5min,然后4500r/min离心15min,收集上清液;
③按照步骤②进行重复多次操作,直至观察不到蛋白质层出现,收集此时的上清液;
④取步骤③得到的上清液,加入其4倍体积的无水乙醇,搅拌均匀,然后盖上锡箔纸,静置12小时,然后7000r/min离心15min,收集沉淀,将沉淀转移至60℃的烘箱中烘干至恒重,研磨成粉末状,即为去除蛋白的榆黄菇多糖。
去除粗多糖中的蛋白质,还包括如下步骤:将每1g去除蛋白的榆黄菇多糖溶于50mL去离子水,得到榆黄菇多糖溶液。
Seveag试剂:由4体积份三氯甲烷和1体积份正丁醇混匀获得。
阴离子交换柱层析的参数具体如下:填料为纤维素DE-52;柱子规格为1×30cm。
上样榆黄菇多糖溶液,用NH
NH
将D1组分转移至透析袋(截留分子量为3KDa)中,然后在去离子水中透析,然后收集透析袋中的液相,用于后续的分子筛层析分离纯化。
分子筛层析的参数具体如下:分子筛层析柱为HiLoad 16/600Superdex 75pg。
上样透析袋中的液相,用去离子水作为流动相进行洗脱(流速具体可为1ml/min),收集保留体积为第37-45ml的洗脱峰对应的洗脱液,称为SP1组分。
SP1组分冷冻干燥后即为榆黄菇提取物。
以上任一所述榆黄菇提取物中的单糖组成为:甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖。
以上任一所述榆黄菇提取物中,甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖的质量配比依次为:11253:499:420:839439:14372:399:798。
以上任一所述榆黄菇提取物中,甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖的含量依次为:11253mg/kg、499mg/kg、420mg/kg、839439mg/kg、14372mg/kg、399mg/kg、798mg/kg。
以上任一所述榆黄菇提取物中,甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖的含量依次如表1所示。
以上任一所述榆黄菇提取物的Mp(最高峰分子量)为7772833g/mol。
以上任一所述榆黄菇提取物的Mn(数均分子量)为6173761g/mol。
以上任一所述榆黄菇提取物的Mw(重均分子量)为7498604g/mol。
以上任一所述榆黄菇提取物的Mz(平均分子量)为8522992g/mol。
以上任一所述榆黄菇提取物的单糖连接方式如表3所示。
本发明提供了一种制备榆黄菇提取物的方法以及该方法制备得到的榆黄菇提取物,该榆黄菇提取物富含多糖,具有改善肠道菌群结构、促进排便的功效,可用于治疗和/或预防便秘。
附图说明
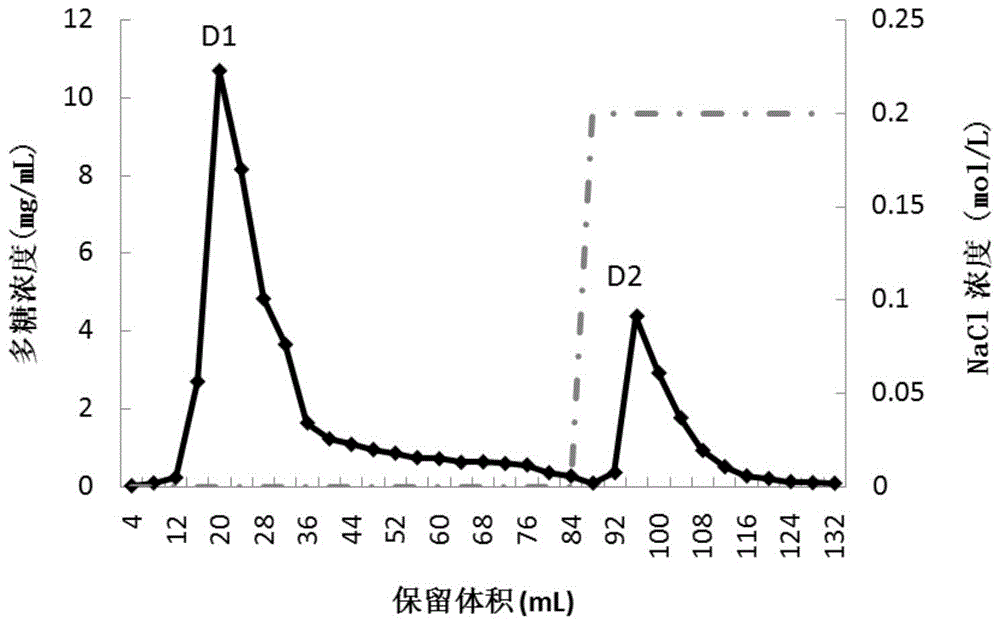
图1为阴离子交换层析分离纯化的洗脱曲线。
图2为分子筛层析分离纯化的洗脱曲线。
图3为榆黄菇提取物的单糖组成和含量结果。
图4为标准品的色谱图。
图5为动物试验的墨汁推进率结果。
图6为动物试验的粪便总重量结果。
图7为动物试验的首次排红便时间结果。
图8为动物试验的排红便数量结果。
图9为动物试验的粪便含水量结果。
图10为动物粪便发酵物的16S rRNA测序结果(肠道菌群在属水平上丰度百分比)。
图11为动物粪便发酵物的产气结果。
图12为动物粪便发酵物的菌群组成与产气的热图。
图13为动物粪便发酵物的短链脂肪酸测定结果。
图14为动物粪便发酵物的菌群组成与短链脂肪酸的热图。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。低聚果糖:上海源叶生物公司,货号S11133。如无特殊说明,以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
肠道运动实验数据和粪便实验数据采用DPS7.05进行统计分析,P<0.05或P<0.01具有统计学差异。产气量和短链脂肪酸(SCFAs)实验数据利用GraphPad Prism 8软件中非参数检验进行统计分析,P<0.05或P<0.01具有统计学差异。16S rRNA测序结果分析采用美吉生物一站式科研服务平台推荐的分析方法。
实施例中所用的榆黄菇为榆黄菇(Pleurotus citrinopileatus),又称榆黄菇(Pleurotus citrinopileatus Singer),已于2013年4月9日收藏于中国微生物菌种保藏管理委员会林业微生物中心(又称中国林业微生物菌种保藏管理中心,China ForestryCulture Collection Center,英文缩写CFCC,简称林业微生物中心),保藏号为CFCC89573,自该收藏日起公众可从CFCC获得该菌株。
试验动物:昆明系小鼠,雄性,22-24g(北京维通利华实验动物技术有限公司,品系代码202)。
实施例1、榆黄菇提取物的制备和鉴定
一、榆黄菇提取物的制备
1、水提醇沉法提取粗多糖
(1)将冷冻干燥后的榆黄菇子实体放入高速万能破碎机,反复破碎4次(每次20s),制成质地均一的干粉(约80目)。
(2)称取10g步骤(1)获得的干粉,加入400mL去离子水,4℃静置10小时。
(3)完成步骤(2)后,摇匀,封口,然后置于水浴摇床中,90℃、100r/min振荡孵育4h,然后7000r/min离心30min,收集上清液。
(4)完成步骤(3)剩余的沉淀,加入200mL去离子水,摇匀,封口,然后置于水浴摇床中,90℃、100r/min振荡孵育4h,然后7000r/min离心30min,收集上清液。
(5)将步骤(3)收集的上清液和步骤(4)收集的上清液合并,减压浓缩(70℃,0.1MPa)至密度为1.2g/mL,即为浓缩液。
(6)取步骤(5)得到的浓缩液,加入其4倍体积的无水乙醇,搅拌均匀,然后盖上锡箔纸,静置12小时。
(7)完成步骤(6)后,7000r/min离心15min,收集沉淀,将沉淀转移至60℃的烘箱中烘干至恒重,研磨成粉末状,即为榆黄菇粗多糖。
(8)将每1g榆黄菇粗多糖溶于50mL去离子水,得到粗多糖溶液。
2、去除榆黄菇粗多糖中的蛋白质(采用Seveag法去除蛋白质)
Seveag试剂:由4体积份三氯甲烷和1体积份正丁醇混匀获得。
(1)取步骤1制备的粗多糖溶液,加入其三分之一体积的Seveag试剂,涡旋震荡5min,然后4500r/min离心15min(游离蛋白将产生凝胶状沉淀),收集上清液。
(2)取前一步骤得到的上清液,加入其三分之一体积的Seveag试剂,涡旋震荡5min,然后4500r/min离心15min,收集上清液。
(3)按照步骤(2)进行重复多次操作,直至观察不到蛋白质层出现,收集此时的上清液。
(4)取步骤(3)得到的上清液,加入其4倍体积的无水乙醇,搅拌均匀,然后盖上锡箔纸,静置12小时,然后7000r/min离心15min,收集沉淀,将沉淀转移至60℃的烘箱中烘干至恒重,研磨成粉末状,即为去除蛋白的榆黄菇多糖。
(5)将每1g去除蛋白的榆黄菇多糖溶于50mL去离子水,得到榆黄菇多糖溶液。
3、阴离子交换层析分离纯化
阴离子交换层析柱:填料为纤维素DE-52(北京酷来搏科技有限公司,货号CC3311);柱子规格为1×30cm。NH
用NH
两步洗脱的过程如下:完成上样后,直接进行第一步洗脱,采用的流动相为NH
阴离子交换层析分离纯化的洗脱曲线见图1。
采用硫酸苯酚法检测每个收集管中的溶液的多糖浓度,结果见图1。
最终将第4管至21管的洗脱液合并(对应的洗脱峰的保留体积为第13-84ml),称为D1组分。
4、将步骤3获得的D1组分转移至透析袋(截留分子量为3KDa)中,然后在去离子水中透析4小时,收集透析袋中的液相。
5、分子筛层析分离纯化
分子筛层析柱:HiLoad 16/600Superdex 75pg(GE Healthcare,产品目录号28-9893-33)。
将步骤4获得的透析袋中的液相上样(上样体积为1ml),然后用去离子水进行洗脱,流速为1ml/min。持续用收集管收集过柱后的洗脱液(每管3mL),共收集41管。
分子筛层析分离纯化的洗脱曲线见图2。
采用硫酸苯酚法检测每个收集管中的溶液的多糖浓度,结果见图2。
最终将第13管至第15管的洗脱液合并(对应的洗脱峰的保留体积为第37-45ml),称为SP1组分。
6、取步骤5获得的SP1组分,-80℃预冻,然后进行冷冻干燥,得到干粉,即为榆黄菇提取物(用PCP表示)。
二、榆黄菇提取物的鉴定
1、榆黄菇提取物的单糖组成和含量
利用多糖糖醇醋酸盐衍生物的方法通过液相色谱技术对PCP的单糖以及糖醛酸组成和质量比进行测定。
试剂:三氟乙酸,乙腈(色谱纯),磷酸盐缓冲溶液(pH=6.8),单糖及糖醛酸标准品(甘露糖、鼠李糖、葡萄糖、阿拉伯糖、岩藻糖、木糖、半乳糖、半乳糖醛酸、葡萄糖醛酸等)。
(1)完全酸水解
称取PCP适量,加1mL水,加入4mol/L三氟乙酸溶液1mL,充氮,在110℃条件下水解120min,取出后冷却至室温,在60℃真空干燥箱中干燥2h。标准品处理:首先配制10mg/ml标准品溶液,放置于-20℃,用时取出融化,在可以密封的玻璃管中加入上述标准品各5μL,混匀,然后加入4mol/L三氟乙酸溶液1mL,与样品同时在110℃条件下水解120min,空气泵吹干。
(2)PMP衍生化
向水解干燥后得到的样品中加入溶于无水甲醇的0.5mol/L的1-苯基-3-甲基-5-吡唑啉酮(PMP)试剂和0.3mol/L的NaOH溶液各0.5ml,充分混匀后,水浴70℃反应60min。冷却至室温,加入0.3mol/L HCl 0.5ml,充分混匀。加入0.5ml氯仿,充分震荡萃取,离心(5000r/min,5min)去除氯仿层,共萃取三次。水层(不低于0.4ml)用0.22μm滤膜过滤后,待上机。
(3)仪器条件
色谱柱:SHISEIDO C18柱(4.6×250mm,5μm);
流动相:0.1mol/L pH6.8磷酸盐缓冲液(PB):乙腈=82:18(v/v);
流速:1.0mL/min;
柱温:25℃;
进样量:10μL
波长:245nm。
仪器:Agilent 1200高效液相色谱仪。
结果见表1和图3。标准品的色谱图见图4。
表1单糖组成和含量结果
2、榆黄菇提取物的分子量
采用凝胶色谱技术测定PCP的分子量。
凝胶色谱仪:Wyatt,ELEOS System;
色谱柱:ShodexOHpak系列SB-806串803;
流动相:0.02g/100ml NaN
检测器:Waters515泵激光检测器(LS)示差检测器(DRI)。
结果见表2。
表2PCP分子量检测结果
/>
3、榆黄菇提取物的单糖连接方式分析
将PCP送检至青岛科创质量检测有限公司,进行多糖甲基化分析,判定多糖的连接特性及含量。PCP内部单糖连接方式分析结果见表3。
表3PCP内部单糖连接方式分析结果
实施例2、榆黄菇提取物的应用
一、分组处理
将试验动物随机分为5组,每组10只。
5组分别为:阴性对照组、FO阳性对照组、模型组、PCP低剂量组、PCP高剂量组。
试验第1天至第7天,各组试验动物在温度22℃、湿度50%~60%环境下适应性喂养一周。试验第8天至试验第21天,PCP低剂量组每天灌胃一次PCP溶液(PCP的单次给予剂量为1.0g/kg体重)。试验第8天至试验第21天,PCP高剂量组每天灌胃一次PCP溶液(PCP的单次给予剂量为2.0g/kg体重)。试验第8天至试验第21天,FO阳性对照组每天灌胃一次低聚果糖溶液(低聚果糖的单次给予剂量为1.0g/kg体重)。试验第8天至试验第21天,阴性对照组每天灌胃一次蒸馏水。试验第8天至试验第21天,模型组每天灌胃一次蒸馏水。
PCP溶液是将实施例1的步骤一制备的PCP溶于蒸馏水得到的。
低聚果糖溶液是将低聚果糖溶于蒸馏水得到的。
单次单只试验动物的灌胃体积为0.5-1ml。
实验期间,试验动物正常饮食,每天观察试验动物形态和呼吸特征。
实验过程中,各组试验动物的毛发、皮肤及呼吸形态均正常,结果显示PCP未对试验动物的生长发育造成显著影响。
二、肠道运动实验
完成步骤一后,每组试验动物随机取5只,进行肠道运动实验。
肠道运动实验依次按照如下步骤进行:
1、试验第22天(与步骤一中连续计天数),所有试验动物禁食不禁水16h。
2、完成步骤1后,各组试验动物分别进行如下操作:
FO阳性对照组、模型组、PCP低剂量组和PCP高剂量组试验动物均灌胃给予一次硫糖铝悬液(硫糖铝的给予剂量为4g/kg体重)。阴性对照组试验动物灌胃给予蒸馏水。
硫糖铝悬液是将硫糖铝悬浮于蒸馏水得到的。单只试验动物的灌胃体积为1ml。
3、完成步骤2的灌胃30min后,各组试验动物分别进行如下操作(均为单次灌胃):
FO阳性对照组:灌胃给予低聚果糖胭脂红溶液(低聚果糖的给予剂量为1.0g/kg体重);
PCP低剂量组:灌胃给予PCP胭脂红溶液(PCP的给予剂量为1.0g/kg体重);
PCP高剂量组:灌胃给予PCP胭脂红溶液(PCP的给予剂量为2.0g/kg体重);
阴性对照组:灌胃给予胭脂红溶液;
模型组:灌胃给予胭脂红溶液。
PCP胭脂红溶液是将实施例1的步骤一制备的PCP溶于胭脂红溶液得到的。
低聚果糖胭脂红溶液是将低聚果糖溶于胭脂红溶液得到的。
胭脂红溶液:Sigma,货号为41325。
单只试验动物的灌胃体积为0.5-1ml。
4、完成步骤3的灌胃25min后,颈椎脱臼处死试验动物,剖开腹腔,剪取幽门至盲肠部位肠管,肠管不牵拉,平铺呈直线后测量“小肠总长度”和“墨汁推进长度”,计算墨汁推进率。“墨汁推进长度”指的是从幽门至胭脂红前沿的距离。
结果见表4和图5(与模型组比较,#代表P<0.05,##代表P<0.01)。采用硫糖铝构建小鼠便秘模型后,模型组小鼠的墨汁推进率显著低于阴性对照组,差异有统计学意义,说明小肠蠕动被硫糖铝抑制,小鼠便秘模型建立成功。FO阳性对照组、PCP低剂量组和PCP高剂量组小鼠的墨汁推进率均高于模型组,差异具有统计学意义。PCP高剂量组小鼠的墨汁推进率高于FO阳性对照组。结果表明,PCP能促进便秘小鼠肠道的蠕动,且高剂量PCP促进效果最为明显。
表4墨汁推进率(%)
三、粪便实验
完成步骤一后,每组小鼠随机取5只,进行粪便实验。
粪便实验依次按照如下步骤进行:
1、同步骤二的1。
2、同步骤二的2。
3、同步骤二的3。
正常饮食,连续观察。
记录每只动物给药后首次出现红色粪便的时间。
记录5h内(从完成步骤3的灌胃开始计时)每只动物红色粪便粒数。
称取每只动物5h内(从完成步骤3的灌胃开始计时)红色粪便的总重量(W1,单位为g),烘干后测定重量(W2,单位为g)),计算粪便含水量。
5h每只小鼠的粪便总重量的结果见表5和图6(与模型组比较,#代表P<0.05,##代表P<0.01)。采用硫糖铝构建小鼠便秘模型后,模型组小鼠的粪便总重量显著低于阴性对照组,差异有统计学意义,说明小鼠便秘模型建立成功。FO阳性对照组、PCP低剂量组和PCP高剂量组小鼠的粪便总重量均高于模型组,差异具有统计学意义。结果表明,PCP能增加便秘小鼠排便量,促进便秘小鼠排便。
表5小鼠粪便总重量(g)
首次出现红色粪便的时间见表6和图7(与模型组比较,#代表P<0.05,##代表P<0.01)。采用硫糖铝构建小鼠便秘模型后,模型组小鼠首次排便时间显著高于阴性对照组,差异有统计学意义,说明小鼠便秘模型建立成功。与模型组相比,FO阳性对照组、PCP低剂量组和PCP高剂量组小鼠首次排便时间均显著降低,差异具有统计学意义。结果表明,PCP能缩短便秘小鼠的排便时间。
表6小鼠首次排红便时间(min)
5h每只小鼠的红色粪便粒数见表7和图8(与模型组比较,#代表P<0.05,##代表P<0.01)。采用硫糖铝构建小鼠便秘模型后,模型组小鼠红色粪便粒数显著低于阴性对照组,差异有统计学意义,说明小鼠便秘模型建立成功。与模型组相比,FO阳性对照组、PCP低剂量组和PCP高剂量组小鼠红色粪便粒数均显著增高,差异具有统计学意义。结果表明,PCP能增加便秘小鼠排便量,促进排便。
表7小鼠排红便数量(粒)
粪便含水量见表8和图9(与模型组比较,#代表P<0.05,##代表P<0.01)。采用硫糖铝构建小鼠便秘模型后,模型组小鼠的粪便含水量显著低于阴性对照组,差异有统计学意义,说明小鼠便秘模型建立成功。FO阳性对照组、PCP低剂量组和PCP高剂量组小鼠的粪便含水量均高于模型组,差异具有统计学意义。结果表明,PCP能提高粪便含水量。
表8小鼠粪便含水量(%)
实施例3、榆黄菇提取物对肠道菌群的影响
一、分组处理
将试验动物随机分为4组,每组10只。
4组分别为:阴性对照组、FO阳性对照组、模型组、PCP组。
试验第1天至第7天,各组试验动物在温度22℃、湿度50%~60%环境下适应性喂养一周。试验第8天至试验第21天,PCP组每天灌胃一次PCP溶液(PCP的单次给予剂量为2.0g/kg体重)。试验第8天至试验第21天,FO阳性对照组每天灌胃一次低聚果糖溶液(低聚果糖的单次给予剂量为1.0g/kg体重)。试验第8天至试验第21天,阴性对照组每天灌胃一次蒸馏水。试验第8天至试验第21天,模型组每天灌胃一次蒸馏水。
PCP溶液是将实施例1的步骤一制备的PCP溶于蒸馏水得到的。
低聚果糖溶液是将低聚果糖溶于蒸馏水得到的。
单次单只试验动物的灌胃体积为0.5-1ml。
二、进一步处理
完成步骤一后,各组试验动物按照如下步骤进行:
1、试验第22天(与步骤一中连续计天数),所有试验动物禁食不禁水16h。
2、完成步骤1后,各组试验动物分别进行如下操作:
FO阳性对照组、模型组、PCP组试验动物均灌胃给予一次硫糖铝悬液(硫糖铝的给予剂量为4g/kg体重);阴性对照组试验动物灌胃给予蒸馏水。
硫糖铝悬液是将硫糖铝悬浮于蒸馏水得到的。单只试验动物的灌胃体积为1ml。
3、完成步骤2后,收集每只试验动物5h内(从完成步骤2的灌胃开始计时)的粪便。
三、检测
PCP代表PCP组。FOS代表FO阳性对照组。MOD代表模型组。CON代表阴性对照组。
1、体外发酵
收集各组小鼠粪便,利用PBS缓冲液悬浮,使其浓度为100g湿重/L,即为粪便悬液。使用孔径为0.125mm的无菌金属筛对粪便悬液进行过滤,收集滤液。将500μL滤液接种至装有5ml YCFA培养基(青岛海博生物,HB9212)的培养瓶中,然后封闭瓶口,37℃培养24h。
2、产气检测
完成步骤1后,利用气体测定仪测定培养瓶中的甲烷(CH
3、短链脂肪酸测定和16S rRNA测序
完成步骤1后,9000r/min离心3min,分别收集上清液和沉淀。上清液采用气相色谱仪进行短链脂肪酸(SCFAs)代谢分析。沉淀提取总DNA,然后进行16S rRNA测序分析。
4、结果
(1)16S rRNA测序结果
结果见图10。模型组的类拟杆菌属(Parabacteroides)相对丰度低于阴性对照组(P<0.05),模型组的毛螺菌属(Lachnospiraceae)相对丰度低于阴性对照组(P<0.05),说明造模会影响类拟杆菌属(Parabacteroides)和毛螺菌属(Lachnospiraceae)相对丰度。在模型建立成功的前提下,与模型组相比,PCP组中类拟杆菌属(Parabacteroides)相对丰度均增加(P<0.05),毛螺菌属(Lachnospiraceae)相对丰度均增加(P<0.05)。结果表明榆黄菇多糖能够改善肠道菌群结构,缓解菌群失调。
(2)产气结果
结果见表9和图11(与模型组比较,#代表P<0.05,##代表P<0.01)。阴性对照组与模型组各种气体产气量无明显差异(P>0.05),差异无统计学意义,说明是否造模对于产气量影响较小。与模型组相比,PCP组以及FO阳性对照组的H
表9产气量(ppm)
热图见图12。热图显示,CH
(3)短链脂肪酸(SCFAs)测定结果分析
结果见表10和图13(与模型组比较,#代表P<0.05,##代表P<0.01)。与阴性对照组相比,模型组的乙酸、丙酸和丁酸产量分别降低了82.33%(P<0.0001)、85.95%(P=0.0117)和80.59%(P=0.0359),差异具有统计学意义,模型组的戊酸、异戊酸和异丁酸产量无明显差异(P>0.05),说明建立便秘模型会使乙酸、丙酸和丁酸产量降低,对戊酸、异戊酸和异丁酸产量无明显影响。在模型建立成功的前提下,与模型组相比,PCP组以及FO阳性对照组的乙酸产量分别增加了80.03%(P<0.0001)和67.10%(P=0.0222),差异具有统计学意义,各组丙酸、丁酸、戊酸、异戊酸和异丁酸产量无明显差异(P>0.05)。
表10短链脂肪酸含量(mmol/L)
热图见图14。图14中:Ace,代表乙酸;Val,代表戊酸;Isob,代表异丁酸;But,代表丁酸;Pro,代表丙酸;Isov,代表异戊酸。热图显示,梭状芽胞杆菌属(Clostridia)和理研菌属(Rikenella)主要代谢产生乙酸、丙酸、丁酸和异丁酸,臭杆菌属(Odoribacter)主要代谢产生丙酸、丁酸和异丁酸,脱硫弧菌属(Desulfovibrio)主要代谢产生乙酸和和异丁酸,副杆菌属(Parabacteroides)代谢产生乙酸和丙酸,另枝菌属(Alistipes)乙酸和丁酸。而乙酸的生成还与瘤胃菌科(Ruminococcaceae)和颤螺旋菌科(Oscillospiraceae)有关,丙酸的生成还与戈登氏杆菌属(Gordonibacter)有关,结果表明榆黄菇多糖可能通过促进相关肠道菌群代谢,使得SCFAs产量提高。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
- 一种提取榆黄菇中麦角硫因与多糖的方法
- 一种具有降脂减肥功能的水解性多糖及制备方法与应用
- 一种基于紫荆泽兰的榆黄菇培养基菌榆黄菇液体菌种制备方法
- 一种具有调节肠道菌群功能的猴头菇多糖的制备方法
