鞣酸在制备抑制心肌纤维化药物中的应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物医药领域,具体地说,涉及鞣酸、线粒体或鞣酸化线粒体在制备抑制心肌纤维化药物中的应用。
背景技术
心力衰竭(HF)的特征是心脏无法充分泵送血液以满足身体的代谢需求。为了对抗心脏功能的下降,自体激活了各种代偿机制来维持灌注。如肾素-血管紧张素-醛固酮系统(RAAS)和交感神经系统(SNS)激活,以恢复心脏损伤后失去的心输出量。然而,这些系统的持续激活加剧了病情,导致血流动力学压力和心肌细胞死亡,促使心脏重塑。心脏重塑是HF发生和发展的主要驱动力,包括心脏肥大、心室扩张和纤维化。纤维化的发生降低了心肌的顺应性并促进了心律失常发生,这是由于病理刺激激活静止的成纤维细胞(CFs)转分化成肌成纤维细胞(myoFbs)时产生了过多的细胞外基质蛋白。心脏纤维化导致终末期细胞外基质(ECM)重塑和心力衰竭。在损伤期间,为了应对疾病刺激,功能性CFs分化为肌成纤维细胞,myoFbs表现出增殖和侵入性,并启动修复的愈合反应。MyoFbs还通过分泌ECM降解的金属蛋白酶(MMPs)和增加胶原蛋白周转率来重塑间质。然而,myoFbs表现出持续的增殖特征,这增强了促炎反应,并导致胶原蛋白网的形成。在急性组织损伤期间,血管紧张素II(AngII)和转化生长因子β(TGFβ或TGF-β)等促纤维化细胞因子由炎症和间充质细胞释放,并激活成纤维细胞。AngII信号通过血管紧张素I型受体(AT1R)激活钙(Ca
发明内容
本课题组的研究表明,线粒体功能障碍在纤维化过程中具有重要作用。线粒体功能障碍的主要特征是线粒体结构和基因损伤,以及细胞氧化蛋白活性的变化。线粒体(mitochondrion,MT)是活性氧(ROS)的主要来源。在心脏纤维化中,ROS可以通过调节基质蛋白的表达和代谢来直接调节间质ECM的产生。最近的一项研究中,发现过氧化物酶体增殖剂激活受体γ共激活剂1-α(PGC-1α)在心脏病中上调并影响线粒体生成,导致心肌纤维化。Ca
线粒体移植治疗是指用健康的线粒体替代或补偿受损细胞内的线粒体,从而达到影响细胞代谢和信号转导,促进细胞生存的治疗手段。我们的研究表明,线粒体移植在心脏缺血再灌注、肾缺血或再灌注损伤、急性肢体缺血、急性肺损伤等疾病中具有重要的治疗潜力。鉴于活性线粒体功能在心肌纤维化中的重要作用,我们设想线粒体的成纤维细胞移植能够影响心肌纤维化过程。
鞣酸(TA)是一组水溶性多酚化合物,TA已经显示出各种有益于健康的活性,许多研究已经探索了其功能和生物医学特性,如抗癌、抗菌、抗诱变、抗氧化剂、抗糖尿病、抗炎和抗高血压活性。研究发现,鞣酸可以通过形成氢键与粘蛋白、胶原蛋白形成紧密的结合,而心脏中成纤维细胞外基质含有丰富的粘蛋白和胶原蛋白,为心脏的特异靶向的效应提供基础。我们尝试利用鞣酸化线粒体进行线粒体移植,通过动物实验验证了其对心肌纤维化的影响,预示鞣酸化线粒体治疗成为一种新型抑制心肌纤维化新策略,可应用于治疗心肌纤维化相关疾病。因此,本发明包括以下技术方案。
本发明的第一个方面提供了鞣酸、线粒体或鞣酸化线粒体在制备抑制心肌纤维化药物中的应用。
上述药物可用于治疗心肌纤维化相关疾病例如心律失常或者心力衰竭等。
上述鞣酸用于制备鞣酸化线粒体。
优选地,上述线粒体来源于正常的心脏成纤维细胞,是健康的活性完整的线粒体。
优选上述线粒体来源于给药对象的自体心脏成纤维细胞。
可选地,上述线粒体既可以来源于待治疗主体自身,也可以来源于其他主体(即,异体心脏成纤维细胞/异种异体心脏成纤维细胞)。
上述鞣酸化线粒体是鞣酸和线粒体共孵育后形成的结合体。
本发明的第二个方面提供了一种治疗心肌纤维化相关疾病的药物组合物,其包含治疗有效量的上述的健康线粒体或鞣酸化线粒体作为药物活性成分。
在一种实施方式中,上述药物组合物还包含药学上可接受的载体。
上述药物组合物的剂型可以是任何适用于将线粒体和鞣酸化线粒体给药于主体、并保持线粒体和鞣酸化线粒体活性的剂型,例如为注射剂型比如静脉注射剂型。
本发明的第三个方面提供了一种制备上述鞣酸化线粒体的方法,其包括下述步骤:
(1)从心脏组织中提取成纤维细胞,并对心肌成纤维细胞进行培养,得到原代成纤维细胞;
(2)胶原酶消化步骤(1)培养的原代成纤维细胞,分离出线粒体;
(3)将步骤(2)分离得到的线粒体与鞣酸避光孵育,使线粒体与TA充分结合,得到鞣酸化线粒体。
优选地,上述步骤(3)中与线粒体结合的鞣酸浓度为10-50μmol/L。
上述步骤(3)中的孵育条件可以是:避光,于4℃左右摇床(220rpm以下)孵育大约20分钟,随后于4℃左右静置孵育大约20分钟。
应理解,本文中在表述数值特征时,术语“大约”或者“左右”是指所表示的本数可以有±10%、±9%、±8%、±6%或±5%的误差范围或浮动范围。
优选地,上述步骤(1)中所述成纤维细胞是来源于给药对象的自体心脏成纤维细胞。
本发明的第四个方面提供了一种治疗心肌纤维化相关疾病例如心律失常或者心力衰竭等的方法,该方法通过健康线粒体移植或者鞣酸化线粒体移植技术实施,即,将健康线粒体或者鞣酸化线粒体移植于待治疗主体的心脏组织纤维化来达到治疗目的。
本发明开创性地构思出将线粒体应用于心肌纤维化相关疾病治疗的策略,通过动物实验证实了健康线粒体移植和鞣酸化线粒体移植都能够有效抑制心肌纤维化,为临床治疗心律失常和心力衰竭等疾病提供了一种新思路,该技术具有良好的临床应用前景。
附图说明
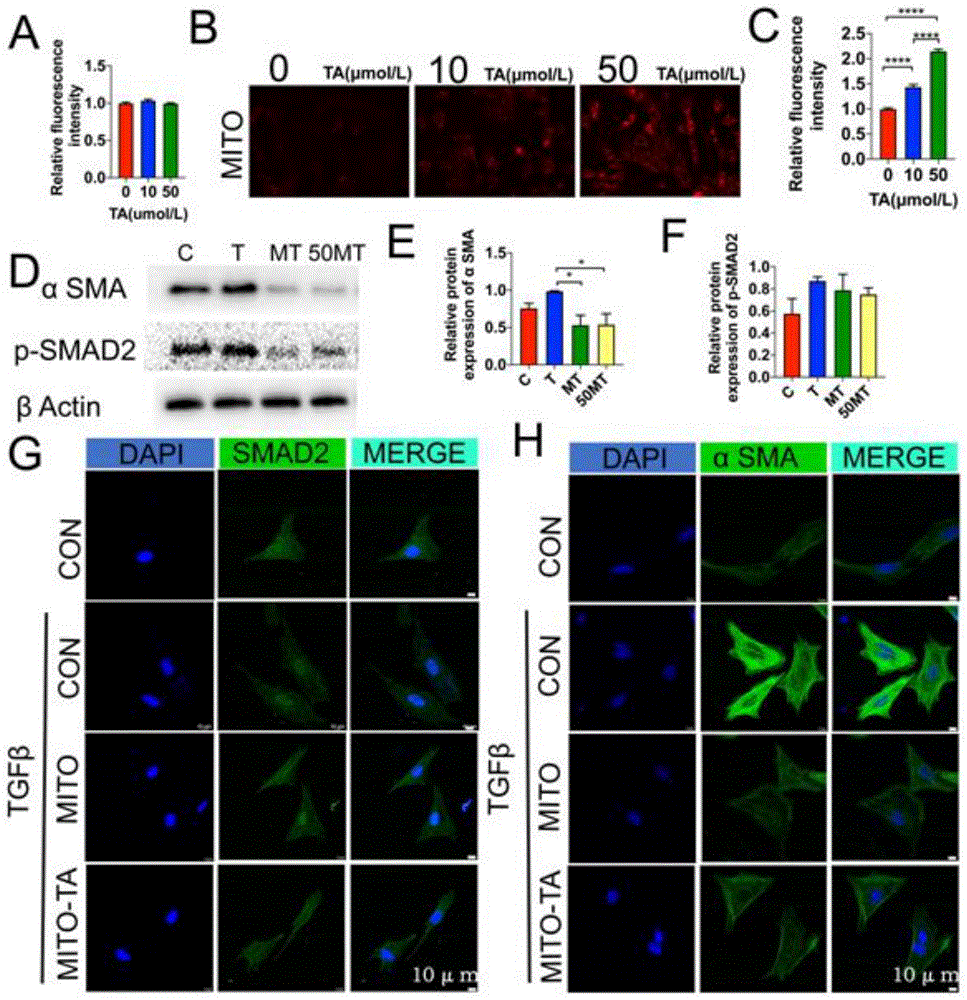
图1显示了线粒体移植和鞣酸化线粒体移植后成纤维细胞向肌成纤维细胞转分化水平的鉴定结果。其中,D中的MT代表线粒体移植抑制成纤维细胞向肌成纤维细胞转分化的结果,而50MT代表鞣酸化线粒体移植抑制成纤维细胞向肌成纤维细胞转分化的结果。
具体实施方式
心脏的病理重塑包括心脏肥大、心室扩张和纤维化,是慢性HF发生和发展的主要驱动力。心脏成纤维细胞是负责维持心脏结构完整性的关键细胞类型。压力应激可以将静止的成纤维细胞激活成合成和收缩的肌成纤维细胞。在本课题的研究显示,靶向心脏成纤维细胞可以作为治疗HF潜在替代方法。此外,还发现线粒体功能障碍在纤维化过程中具有重要作用,线粒体功能障碍通过促进ROS产生以及降低线粒体复合物活性促进纤维化的发生发展。
在研究中,我们还首次构思出将对于粘蛋白、胶原蛋白具有结合作用的鞣酸(TA)作为靶向媒介应用于线粒体移植技术。依托TA这一成纤维细胞的靶向分子,移植活性完整的线粒体到压力应激心脏能有效缓解或抑制纤维化的发生发展。
鞣酸英文名是Tannic acid(TA,Gallotannic acid),又名柔酸、单宁、单宁酸、丹宁酸、没食子鞣酸、鞣质、落叶松栲胶、二倍酸、炭尼酸,等。
在使用小鼠的动物实验过程中,首先获得乳鼠心肌成纤维细胞进行培养,应用细胞线粒体分离试剂盒分离成纤维细胞线粒体。分离后的线粒体与TA(10μmol/L和50μmol/L)结合。随后将TA化的线粒体与乳鼠心肌原代成纤维细胞共孵育,在TGF-β(20ng/ml)干预下鉴定鞣酸化线粒体移植后成纤维细胞向肌成纤维细胞转分化水平。
本研究涉及线粒体的分离与移植,方法真实可靠,并且初步的研究成果已经证实,TA化能够促进线粒体到小鼠成纤维细胞中转移,抑制成纤维细胞向肌成纤维细胞转化,抑制纤维化的发生发展,缓解心功能。该研究成果提示,对于罹患心肌纤维化相关疾病的主体而言,健康的活性完整的线粒体移植或鞣酸化线粒体移植是潜在的临床治疗手段。
本文中所用的术语“或”有时意指“和/或”,术语“或者”有时意指“并且/或者”。如在本文中的短语诸如“A和/或B”中使用的术语“和/或”旨在包括A和B两者;A或B;A(单独);和B(单独)。
在该治疗方案中,作为细胞器的线粒体可以被视为“药物”成分被施药于主体,比如施加于心脏组织,类似于“细胞疗法”。
上述线粒体来源于正常的心脏成纤维细胞,是健康的活性线粒体。
上述线粒体既可以来源于待治疗主体自身,也可以来源于其他主体(即,异体心脏成纤维细胞/异种异体心脏成纤维细胞)。
当线粒体来源于待治疗主体(例如心肌纤维化相关疾病患者)自身时,该线粒体是自体线粒体。临床研究表明,来源于体外培养的心脏成纤维细胞的线粒体与待施药主体自身具有更好的组织亲和性,可以免于体内免疫排斥和抗吞噬细胞破坏等。为了安全起见,优选线粒体来源于待治疗主体自身的心脏成纤维细胞。
当线粒体来源于其他主体比如健康主体时,该线粒体是异体线粒体、甚至异种异体线粒体。
术语“主体”表示人或动物。通常,动物是脊椎动物,例如灵长类动物、啮齿动物、家畜或狩猎动物。灵长类动物包括黑猩猩、食蟹猴、蜘蛛猴和猕猴,例如恒河猴。啮齿动物包括小鼠、大鼠、土拨鼠、雪貂、兔和仓鼠。家畜和狩猎动物包括牛、马、猪、鹿、野牛、水牛、猫科动物物种(例如家猫)、犬科动物物种(例如狗、狐狸、狼)。在一些实施方案中,主体是哺乳动物,例如灵长类动物比如人。术语“个体”、“患者”和“主体”在本文中可互换使用。优选地,主体是哺乳动物。哺乳动物可以是人、非人灵长类动物、小鼠、大鼠、狗、猫、马或牛,但不限于这些实例。主体可以是雄性或雌性。
本领域技术人员容易理解,上述药物可以制作成药物组合物剂型,该药物剂型除了包含主成分线粒体或鞣酸化线粒体外,还可以包含药学上可接受的载体。优选地,该载体在对于线粒体或鞣酸化线粒体具有保鲜作用即保持其生物活性的前提下,赋予药物以适合给药于主体有效量活性成分、适合于药品保存和运输等功能。
在一种可选的实施方式中,药物组合物还可以包含另一类型的抑制心肌纤维化治疗剂,前提是不损害线粒体或鞣酸化线粒体的生物活性。
本文采用的短语“药学上可接受的”指在合理的医学判断范围内,适合与人类和动物的组织接触使用而无过度毒性、刺激、过敏反应或其他问题或并发症,与合理的效益/风险比率相称的那些化合物、材料、组合物和/或剂型。药学上可接受的载体是本领域周知的,这些载体包括液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料。每种载体在与制剂的其他成分相容并且对患者无害的意义上必须是“可接受的”,包括例如水性溶液(如水或生理缓冲盐水)或其他溶剂或媒介物(如二醇类、甘油、油(如橄榄油)或可注射的有机酯)。可以选择赋形剂,例如,以实现药剂的延迟释放或以选择性地靶向一种或多种细胞、组织或器官。药物组合物可以呈剂量单位形式,如片剂、胶囊剂(包含分散型胶囊和明胶胶囊)、颗粒剂、粉剂、溶液、糖浆剂、栓剂、注射剂等。组合物也可以存在于透皮递送系统(例如,皮肤贴剂)中。组合物也可以存在于适合于局部施用的溶液(例如洗液、乳霜或软膏剂)中。
例如,药学上可接受的载体包括蛋白质稳定剂,所述蛋白质稳定剂可以选自蛋白质药物和/或活细胞药物中常用的用于保持蛋白质和/或细胞活性的稳定剂,例如包括但不限于下组中的至少一种、或者两种以上的组合:①缓冲液:如枸橼酸钠-枸橼酸缓冲剂;②表面活性剂:如非离子表面活性剂聚山梨酯类;③糖和多元醇:如蔗糖、葡萄糖、海藻糖、麦芽糖、甘油、甘露醇、山梨醇、PEG和肌醇等;④盐类:如氯化钠;⑤聚乙二醇类;⑥大分子化合物:如2-羟丙基-β-环糊精、白蛋白、血清蛋白(HAS)等;⑦组氨酸、甘氨酸、谷氨酸和赖氨酸的盐酸盐等。
如本文所用的术语“有效量”是指减轻心肌纤维化相关疾病例如心律失常或者心力衰竭等症状所需的治疗量,并且涉及提供所需效果的药物组合物的足够量。因此,术语“治疗有效量”是指当施用于典型主体时,足以引起特定效果的治疗量。在各种背景下,如本文所用的有效量还包括足以延迟心肌纤维化相关疾病况状的发展,改变心肌纤维化相关疾病况状的过程(例如但不限于,减缓心肌纤维化相关疾病况状的进展),或逆转疾病况状的量。应当理解,本领域已知有许多方式来确定用于给定应用的有效量。例如,用于剂量确定的药理学方法可用于治疗背景中。在治疗性或预防性应用的背景下,施用于主体的组合物的量将取决于疾病的类型和严重性以及个体的特征,例如总体健康状况、年龄、性别、体重和对药物的耐受性。它还取决于疾病的程度、严重性和类型。本领域技术人员将能够根据这些和其他因素来确定合适的剂量。
本领域中具有普通技术的医师或兽医可以容易地确定和开具所需要的药物组合物的治疗有效的量。例如,医师或兽医可以起始于处于低于为实现期望的治疗效果所需要的水平的线粒体或鞣酸化线粒体药物组合物的剂量,并且逐渐增加剂量直至实现期望的效果。“治疗有效的量”表示足以引起期望的治疗效果的化合物的浓度。通常理解,线粒体或鞣酸化线粒体的有效量将根据主体的重量、性别、年龄和病史变化。影响有效的量的其他因素可以包括但不限于,患者病况的严重程度、线粒体或鞣酸化线粒体的稳定性、以及(如果需要)与本发明的线粒体或鞣酸化线粒体一起施用的另一类型的治疗剂。可以通过药剂的多次施用递送较大的总剂量。确定功效和剂量的方法是本领域技术人员已知的。
示例性的施用/给药模式包括但不限于注射、输注、滴注、吸入或摄取。“注射”包括但不限于静脉内、肌肉、动脉内、鞘内、心室内、囊内、眶内、心内、皮内、肝内、腹膜内、经气管、皮下、表皮下、关节内、囊膜下、蛛网膜下腔、脊柱内、脑脊髓内和胸骨内注射和输注。施用可以是全身或局部的。
通常,本发明的组合物和方法中使用的线粒体或鞣酸化线粒体的适合的日剂量将是对心肌纤维化相关疾病例如心律失常或者心力衰竭等产生治疗效果有效的最低剂量的线粒体或鞣酸化线粒体的量。这样的有效剂量将通常取决于如上所述的因素。
如果需要,线粒体或鞣酸化线粒体的有效日/周/月剂量可以作为分开施用的一、二、三、四、五、六或更多的亚剂量,任选地以单位剂量形式,在全天以适当的时间间隔施用。在本发明的某些实施方案中,线粒体或鞣酸化线粒体可以每天/周/月施用两次或三次。在其他实施方案中,线粒体或鞣酸化线粒体将每天施用一次。
接受此治疗的患者是任何有需要的动物,包括灵长类动物(特别是人);和其他哺乳动物(如马、牛、猪、羊、猫和狗);家禽;以及通常的宠物。
我们之前的研究已经证实,心肌重构过程中成纤维细胞向肌成纤维细胞转化促进纤维化,而线粒体功能障碍影响心肌纤维化的发生发展。于是本发明着眼于线粒体在成纤维细胞激活及转分化过程中的重要作用,对成纤维实施线粒体移植,通过TA的成纤维靶向作用抑制纤维化过程的发生发展,缓解心脏的重构,延缓心衰。
为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。本领域技术人员应当理解,下述实施例仅用于阐明本发明,并非是对本发明进行限制。
实施例
本文中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。
本文的实施例中,如果对于操作温度没有做出具体说明,则该温度通常指室温(15-35℃)。
实施例中所用的动物为1-3天SD大鼠乳鼠。
统计分析:本研究中数值变量均以均数±标准误表示,两组间比较采用双尾Student t检验,三组间比较采用ANOVA检验。当P<0.05时,认为具有统计学差异。
实施例1:原代成纤维细胞的培养
1.1准备试剂:
1.1.1培养液:DMEM(添加终浓度为10%小牛血清(FBS)、100IU/ml青霉素、100μg/ml链霉素、500ml DMEM培养基+5ml双抗)。
消化液:胶原酶0.08%,粉末用无菌PBS溶液(平衡盐溶液PBS,磷酸盐平衡生理盐水)配制(0.024g/30ml),-20℃保存。
1.1.2终止消化液:胶原酶与10%FBS培养基比例是1:1,即3ml胶原酶:3ml培养基。
1.1.3器具:高压灭菌过的手术器械(眼科剪,眼科镊,过滤网,大镊子2把),培养皿(装D-Hanks),数个15ml离心管,滤器,2个小烧杯(装酒精用),75%酒精,换药碗,一次性吸管,六孔板,废液缸,记号笔,细胞计数器,载玻片,台盼蓝,1.5ml EP管。
1.2实验步骤:
1.2.1于超净台工作中,将小鼠用75%乙醇消毒后,沿大鼠乳鼠胸骨左缘第4-5肋间剪开胸腔,用弯眼科镊取材小鼠心脏。
1.2.2将心脏置于盛有PBS液的皿中,漂洗,修剪心脏,将心脏剪成1mm*1mm的碎片后,用PBS清洗3次(剪碎30min)。
1.2.3将心脏碎片移至15ml离心管中(吸取过程中注意静置,待心肌碎片降至吸管底部),加入3ml的0.08%胶原酶,37℃消化5分钟,自然沉淀3min,第一次上清液弃去(去除血细胞、细胞碎片)。
1.2.4先在离心管中加好培养基。第二次消化后,用一个吸管轻轻吹打,使消化下来的细胞彻底从组织团快上掉下来,自然沉淀后将上清吸出,滤网过滤,用培养基中和终止消化后,可将细胞先放在培养箱中减少细胞的损伤。
1.2.5重复上述步骤1.2.4,共5次左右,将每次的收集细胞混匀,离心1000rpm,5min,收集细胞,再用培养基重悬后,重悬时要充分吹打,动作轻柔,避免气泡,待用。
1.2.6约1.5h后,成纤维细胞贴壁,去除上清(即心肌细胞)进行培养。成纤维细胞胞体呈梭型或不规则三角形,中央有卵圆形核,胞质突起,生长时呈放射状。
实施例2:细胞线粒体分离与鞣酸化
2.1酶消化原代成纤维细胞,使用碧云天细胞线粒体分离试剂盒(货号C3601)进行线粒体分离。用线粒体分离液重悬消化后的细胞后,进行适当研磨,600g、4℃离心10分钟,取上清,转移到新的EP管中,继续离心(11000g,10min)获得的纯化线粒体,备用。
2.2分离后的线粒体与鞣酸(TA)(浓度分别为10μmol/L和50μmol/L)结合,避光4℃摇床孵育20分钟,随后4℃静置孵育20分钟,使线粒体与TA充分结合,得到鞣酸化线粒体。使用利用TMRE探针检测线粒体膜电位的试剂盒(碧云天生物科技有限公司)进行线粒体膜电位检测,以鉴定TA是否影响线粒体活性。
实施例3:线粒体移植和鞣酸化线粒体移植考察
鞣酸化线粒体移植:将实施例2所得鞣酸化线粒体与实施例1所得成纤维细胞共孵育。其中线粒体浓度参考标准为:供体成纤维细胞来源线粒体加入相同数目的受体成纤维细胞;鞣酸化线粒体浓度标准为:供体成纤维细胞线粒体与50μmol/LTA结合后,并于相同数目的受体成纤维细胞共孵育。孵育2小时后,更换含有TGF-β(转化生长因子-β)(20ng/ml)的新鲜无血清DMEM培养液进行培养,随后鉴定鞣酸化线粒体移植后成纤维细胞向肌成纤维细胞转分化水平,结果如图1所示。
参见图1,图中A所示的相对荧光强度柱形图显示了10μmol/L和50μmol/LTA分别与线粒体结合后进行TMRE检测,分析线粒体模式能变化,鉴定TA对线粒体功能的影响,研究发现10μmol/L和50μmol/L TA对线粒体功能没有显著影响,证明TA结合不影响线粒体的活性完整。
图中B的照片显示,10μmol/L和50μmol/LTA分别与Mitotracker Red标记的线粒体结合后与成纤维细胞进行共培养,2小时后检测成纤维细胞的红色荧光强度,鉴定鞣酸化的线粒体在成纤维细胞中的内化水平,研究发现10μmol/L和50μmol/LTA都能显著促进线粒体内化,即促进了线粒体向细胞内的转运(线粒体的细胞内化),而50μmol/LTA更显著。因此后续的研究使用50μmol/LTA进行鞣酸化线粒体。
图中C的相对荧光强度柱形图、图中D的SDS凝胶电泳图、图中E的α-SMA相对表达量柱形图和图中F的p-SMAD2相对表达量柱形图显示,将非TA化线粒体(MT)和TA化线粒体(50MT)分别与成纤维细胞共孵育2小时后,更换含有TGF-β(20ng/ml)的新鲜无血清DMEM培养液进行培养,随后WB鉴定成纤维细胞纤维化代表分子α-SMA(α-平滑肌肌动蛋白)和p-SMAD2(磷酸化细胞信号转导分子)的表达情况。研究发现,TGF-β激活纤维化过程,表现为α-SMA和p-SMAD2的表达增加,而线粒体移植(TA或非TA)抑制该过程。图中,C为对照组,T为TGF-β处理组,MT为TGF-β处理+线粒体移植组,50MT为TGF-β处理+50μmol/LTA化的线粒体移植组。
图中G和H的照片显示,将非TA化线粒体和TA化线粒体与成纤维细胞共孵育2小时后,更换含有TGF-β(20ng/ml)的新鲜无血清DMEM培养液进行培养,随后免疫荧光鉴定成纤维细胞纤维化代表分子α-SMA和SMAD2的表达情况。研究发现,TGF-β激活纤维化过程,表现为SMAD2的核定位增加以及α-SMA的表达增加,而线粒体移植(TA化或非TA化)抑制该过程。
*p<0.05,****p<0.0001。
该结果表明TA化线粒体移植能够有效抑制成纤维细胞的纤维化发生发展,同时单纯线粒体(即非TA化线粒体)移植也能够有效抑制成纤维细胞的纤维化发生发展。
上述对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的提示,不脱离本发明范畴所做出的改进和修改都应该视为仍在本发明的保护范围之内。
- 唾液酰基转移酶重组质粒及其与培美曲塞在制备抑制膀胱癌的增殖和侵袭药物中的应用
- 碳酸酐酶抑制剂在制备抗动脉粥样硬化药物中的应用
- 联苯乙酸或其盐在制备Xa抑制剂药物中的应用
- CD38抑制剂在制备抗类风湿关节炎药物中的应用
- KMT1A抑制剂在制备膀胱癌抗肿瘤药物中的应用
- CAND1在制备抑制心肌细胞肥大、心力衰竭以及心肌纤维化药物中的应用
- 促进SENP1基因表达的试剂在制备治疗或抑制心肌纤维化药物中的应用
