环状双苄基四氢异喹啉类化合物及其制备方法和应用
文献发布时间:2024-04-18 19:58:26
本发明涉及药物化学和化学合成领域。具体而言,本发明涉及环状双苄基四氢异喹啉类化合物及其制备方法和应用。
在急性传染病中,绝大部分都是病毒性传染病,病毒性传染病的发病率高,死亡率也很高。由于检测和诊断手段有限,导致新病毒引发的新疫情爆发往往具有突发性、随机性和不可预测性等特点,一旦爆发,如无有效的防治手段,极易造成大规模流行,严重威胁人民健康生命安全。
新型冠状病毒(SARS-CoV-2)是目前人类发现的第7种冠状病毒,新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)是由此病毒引起的急性传染病,目前该病毒席卷全球,感染人数及造成死亡人数已远超2003年的SARS,严重威胁人类的身体健康及社会经济发展。
虽然目前针对SARS-CoV-2冠状病毒导致的严重肺炎疾病已有疫苗和抗病毒药物获批上市,但其安全性或有效性仍不理想。截止2021年11月,新冠病毒已先后出现多个变异株,如南非株、德尔塔(Delta)株、奥密克戎(Omicron)株等,已成为全球主要流行的变异病毒,其具有高载量、强传染、隐匿性、免疫逃逸的特点,临床急需有效的预防、治疗措施和药物。因此针对SARS-CoV-2冠状病毒开发出低毒高效的抗病毒药物,以满足国内外SARS-CoV-2感染患者的临床需求,具有重大的社会意义。
以尖刺碱、小檗胺、汉防己甲素等为代表的具有良好的抗肺损伤、抗炎、抗纤维化、免疫调节作用的环状双苄基四氢异喹啉类化合物引起了本领域技术人员的关注。自新冠肺炎疫情爆发以来,发明人对大量天然产物进行了抗病毒活性筛选,发现小檗胺、尖刺碱和汉防己甲素等环状双苄基四氢异喹啉类生物碱具有抗新冠病毒作用;但其抗病毒活性不强、细胞毒性较大,导致选择性指数/治疗指数(SI)很低,有潜在的安全性隐患。
综上所述,本领域迫切需要开发安全性更高的新型环状双苄基四氢异喹啉类化合物来抑制SARS-CoV-2冠状病毒并用于治疗新型冠状病毒感染引起的肺炎。
除此之外,发明人还对环状双苄基四氢异喹啉类化合物的其它潜在用途进行了探索,发现其具有抑制CD4
Th17细胞参与维持免疫稳态,特别是在肠道粘膜表面,并导致类风湿性关节炎等自身免疫性疾病相关的慢性炎症。Th17细胞通过介导免疫功能失调在类风湿性关节炎的发病机制中发挥重要作用,尤其是在疾病进展早期。抑制Th17细胞的过度分化可以减缓或阻止类风湿性关节炎的发生与进展。
Th17细胞在宿主防御外来病原体过程中发挥了重要作用,除了在感染性疾病中的作用外,Th17细胞还与肝病的发病机制有关,如病毒性肝炎、自身免疫性肝病和代谢性肝病。致病性Th17细胞在响应毒性或代谢损伤而发展的肝病中也发挥着关键作用,如乙型肝炎病毒(HBV)/丙型肝炎病毒(HCV)感染、非酒精性脂肪肝疾病(NAFLD)、酒精性肝病(ALD)、肝细胞癌(HCC)和胆汁淤积性肝病。在各种形式的急性和慢性肝损伤患者的肝脏和血清中Th17细胞的数量增加。Th17细胞分泌两种对炎症发展过程重要的细胞因子IL-17和IL-22。IL-17受体在许多不同的细胞类型上表达,包括单核细胞、胆管细胞和肝星状细胞,受体激活诱导促炎细胞因子如IL-1β、IL-6、TNF和TGFβ的分泌。IL-17还通过激活信号转导子和转录激活子3(STAT3)信号通路直接诱导肝星状细胞产生I型纤维状胶原蛋白。另外,IL-22在乙型肝炎病毒感染中具有促炎作用。因此,具有抑制Th17过度分化作用的化合物可能具有缓解肝纤维化、乙型肝炎病毒(HBV)/丙型肝炎病毒(HCV)感染性肝病、非酒精性脂肪肝疾病(NAFLD)、酒精性肝病(ALD)、肝细胞癌(HCC)和胆汁淤积性肝病的作用。
Th17细胞分泌的糖蛋白IL-17A,也是一种参与慢性炎症和自身免疫性疾病的促炎细胞因子。IL-17A以TGF-β1依赖和非依赖的方式参与肺纤维化的发生和进展,IL-17A信号通路是治疗纤维增生性肺病的潜在治疗靶点。抑制IL-17A的分泌,也能改善二氧化硅诱导的小鼠肺功能障碍、肺部炎症和纤维化。由此可见,抑制能分泌IL17A的Th17细胞过度分化,能降低IL-17A水平,进而缓解包括硅肺病在内的多种肺纤维化疾病进展。
很少有文献报道能同时抑制Th1和Th17细胞分化的成药性良好的小分子,而这类分子在包括类风湿性关节炎、银屑病、多发性硬化症、系统性红斑狼疮、系统性硬化症、视神经脊髓炎、自身免疫性肠炎、自身免疫性肝炎等自身免疫性疾病和肝纤维化、肺纤维化、肾纤维化、硬皮病、硅肺病的治疗方面有着潜在的应用前景,也有望缓解肝脏病变,包括肝纤维化、乙型肝炎病毒(HBV)/丙型肝炎病毒(HCV)感染性肝病、非酒精性脂肪肝疾病(NAFLD)、酒精性肝病(ALD)、肝细胞癌(HCC)和胆汁淤积性肝病等。
发明内容
本发明的目的是提供一种安全性更高的抑制病毒,尤其是SARS-CoV-2冠状病毒活性的抑制剂,及其制备方法和在治疗、预防和缓解病毒感染引起的疾病,尤其是新型冠状病毒感染引起的肺炎等疾病中的用途。
本发明的另一目的是提供一种具有抗炎作用的化合物,及其制备方法和在治疗、预防和缓解肺炎、非酒精性脂肪肝炎、结肠炎、肾炎、胰腺炎、心肌炎、关节炎、炎性疼痛等炎症相关的疾病中的用途。
本发明的另一目的是提供一种具有抗纤维化作用的化合物,及其制备方法和在治疗、预防和缓解肺纤维化、硅肺病、肝纤维化、肾纤维化、心肌纤维化、皮肤纤维化、视网膜纤维化、骨髓纤维化、炎性疼痛等纤维化相关的疾病中的用途。
本发明的另一目的是提供一种抑制T细胞分化的抑制剂,尤其是抑制Th1和Th17细胞分化的抑制剂,及其制备方法和在治疗、预防和缓解银屑病、类风湿性关节炎、系统性红斑狼疮、多发性硬化、视神经性脊髓炎、重症肌无力、强直性脊柱炎、溃疡性结肠炎、克罗恩病、迟发型超敏反应、移植物抗宿主病等与T细胞分化异常相关的自身免疫性疾病中的用途。
在本发明的第一方面,提供了一种式I所示环状双苄基异喹啉类化合物或其药学上可接受的盐、或其对映异构体、非对映异构体、外消旋体、或其结晶水合物、溶剂化物,或其混合物,
式中,
R
其中n为0、1、2、3、或4;m为1、2、3、或4;
其中所述苯基氨基甲酰基、苯氧基羰基非必须地被一个或多个选自F、Cl、Br、I、 C1~C6烷基、卤代C1~C6烷基、C1~C6烷氧基或卤代C1~C6烷氧基的取代基所取代;
或者R
附加条件是:所述化合物不包含以下化合物:
在另一优选例中,所述化合物不包含以下化合物:
在另一优选例中,所述的式I化合物为非天然产物。
在另一优选例中,所述苯并[5~6元单环杂环]选自:
在另一优选例中,在所述的化合物中,R
或者,R
在另一优选例中,在所述的化合物中,R
或者,R
在另一优选例中,R
在另一优选例中,R
在另一优选例中,R
在另一优选例中,所述的式I化合物为手性或非手性的。
在另一优选例中,所述的化合物具有式I-a所示结构:
在另一优选例中,所述的化合物具有式I-b所示结构:
在另一优选例中,所述的式(I)化合物选自如下化合物:
在另一优选例中,所述的式(I)化合物选自如下化合物:
在本发明的第二方面,提供了一种制备第一方面所述的环状双苄基异喹啉类化合物的方法,所述方法选自下组:
a)以含酚羟基的环状双苄基异喹啉为原料,和烷基化试剂经烷基化反应得到所述的环状双苄基异喹啉类化合物;
b)以含酚羟基的环状双苄基异喹啉为原料,和酰基化试剂经酰基化反应得到所述的环状双苄基异喹啉类化合物;
c)以尖刺碱为原料,在碱存在下和磺酰化试剂反应得到化合物(I-1b);
(I-1b)和偶联试剂经偶联反应得到式I-1所示的环状双苄基异喹啉类化合物I-1,反应如反应式1所示:
式I-1中,R
式1-1b中的L选自:离去基团;
d)以尖刺碱为原料,经硝化、还原、关环反应制备得到式(I-2)化合物,如以下反应式2所示:
式I-2中,R
e)以尖刺碱为原料,经多步反应制备得到式(I-3)化合物,如反应式3所示:
式I-3中,R
f)由方法a)至e)所得到的化合物,进行官能团转化得到所述的环状双苄基异喹啉类化合物。
在上述方法中,所述原料“尖刺碱”以尖刺碱、其药学上可接受的盐、或其对映异构体、非对映异构体、外消旋体、或其结晶水合物、溶剂化物,或其混合物的形式存在。
在另一优选例中,所述方法为:以尖刺碱为原料,和羧酸发生缩合酰化反应得到所述的环状双苄基异喹啉类化合物。
在另一优选例中,所述缩合酰化反应在缩合剂存在下进行,所述缩合剂选自下组:N,N'-二环己基碳二亚胺(DCC)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDCI)、O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸酯(TBTU)、或其组合。
在另一优选例中,所述的离去基团L选自下组:C
在另一优选例中,所述磺酰化试剂选自:C
在另一优选例中,所述溶剂选自二氯甲烷、四氢呋喃、N,N-二甲基甲酰胺、甲醇、乙醇、乙腈、甲苯、丙酮、二氧六环和氯仿。
在另一优选例中,所述碱选自无机碱或有机碱。
在另一优选例中,所述无机碱选自:氢氧化钠、氢氧化钾、氢氧化铯、氢氧化钡、氢化钾、氢化钠、叔丁醇钠、叔丁醇钾、碳酸钾、碳酸钠或碳酸钙;所述有机碱选自:吡啶、三乙胺、二异丙基乙胺、N,N-二甲基苯胺和N,N-二甲基吡啶中。
在另一优选例中,所述偶联反应在钯催化剂和碱存在下进行。
在另一优选例中,所述钯催化剂选自:醋酸钯(Pd(OAc)
在另一优选例中,反应式1中还可以包含其他不干扰反应的反应溶剂。
在另一优选例中,反应式1中还可以加入合适的配体作为反应促进剂。
在另一优选例中,所述合适的配体选自:2,2'-二苯膦基-1,1'-联萘(BINAP)、三叔丁基(P(t-Bu)
在另一优选例中,所述偶联试剂选自下组:C
在另一优选例中,所述苯并[5~6元单环杂环]选自:
在另一优选例中,对于苯并[5~6元单环杂环]而言,所述取代基选自卤素、羟基、巯基、氨基、氧代(=O)、硫代(=S)、C
在另一优选例中,所述硝化反应中硝化试剂选自:硝酸,浓硫酸与硝酸的混合物,硝酸、硝酸钠与浓硫酸的混合物,硝酸钾与浓硫酸的混合物,亚硝酸钠与浓硫酸的混合物,醋酸与硝酸的混合物。
在另一优选例中,所述硝化反应中硝化试剂为醋酸和硝酸的混合物。
在另一优选例中,所述混合物的混合比例不做限制。
在另一优选例中,所述硝化反应温度为-20℃~室温。
在另一优选例中,所述还原反应以Pd/C为催化剂,
在另一优选例中,所述还原反应以氢气、甲酸铵或甲酸为还原剂,
在另一优选例中,所述还原反应在低级醇或低级醇-水混合溶剂中进行。
在另一优选例中,所述低级醇选自:甲醇、乙醇、异丙醇或其组合。
在另一优选例中,所述还原反应在0~100℃,优选地0~40℃范围内进行。
在另一优选例中,所述还原反应在常压下进行。
在另一优选例中,所述还原反应氢化1~10h。
在另一优选例中,所述关环反应在关环试剂存在下进行。
在另一优选例中,所述关环试剂包括:光气、三光气、1,1'-羰基二咪唑(CDI)、尿素、四溴化碳、甲酸、原甲酸三甲酯、原乙酸三甲酯、原乙酸三乙酯、乙酰氯、氯乙酰氯、溴乙酰溴、溴乙酰氯、或其组合。
在另一优选例中,所述关环反应在有或无碱存在下进行。
在另一优选例中,所述碱选自:无机碱或有机碱;其中所述无机碱选自氢氧化钠、氢氧化钾、氢化钾、氢化钠、叔丁醇钠、叔丁醇钾、碳酸钾、碳酸钠、碳酸铯和碳酸氢钠;其中所述有机碱选自吡啶、三乙胺、二异丙基乙胺、N,N-二甲基苯胺和N,N-二甲基吡啶;
在另一优选例中,反应式2中还可以包含其他不干扰反应的反应溶剂。
在另一优选例中,对于苯并[5~6元单环杂环]而言,所述取代基选自卤素、羟基、巯基、氨基、氧代(=O)、硫代(=S)、C
在另一优选例中,所述苯并[5~6元单环杂环]选自:
式I-3b中,L为离去基团。
在另一优选例中,所述的离去基团L选自下组:C
在另一优选例中,所述方法e)包括以下步骤:
e1)式(I-1a)化合物和硝化试剂发生邻位硝化反应生成式(I-3a)化合物;
e2)式(I-3a)化合物和磺酰化试剂在碱存在下在合适的溶剂中反应得到式(I-3b)化合物;
e3)式(I-3b)化合物和苄胺发生Buchwald-Hartig反应得到式(I-3c)化合物;
e4)式(I-3c)化合物发生还原反应得到式(I-3d)化合物;
e5)式(I-3d)化合物通过关环反应得到式(I-3)化合物。
在另一优选例中,步骤e1)中的硝化试剂为浓硫酸与硝酸的混合物,硝酸、硝酸钠与浓硫酸的混合物,硝酸钾与浓硫酸的混合物,亚硝酸钠与浓硫酸的混合物,醋酸与硝酸的混合物,优选地为醋酸和硝酸的混合物。
在另一优选例中,所述混合物的混合比例不做限制。
在另一优选例中,所述硝化反应温度为-20℃~室温。
在另一优选例中,所述硝化反应时间为10分钟~12小时。
在另一优选例中,所述步骤e2)中的磺酰化试剂选自:C
在另一优选例中,所述步骤e2)中的溶剂选自:二氯甲烷、四氢呋喃、N,N-二甲基甲酰胺、甲醇、乙醇、乙腈、甲苯、丙酮、二氧六环和氯仿。
在另一优选例中,所述步骤e2)中的碱选自无机碱或有机碱;其中所述无机碱选自氢氧化钠、氢氧化钾、氢氧化铯、氢氧化钡、氢化钾、氢化钠、叔丁醇钠、叔丁醇钾、碳酸钾、碳酸钠或碳酸钙;其中所述有机碱选自吡啶、三乙胺、二异丙基乙胺、N,N-二甲基苯胺和N,N-二甲基吡啶。
在另一优选例中,所述步骤e3)中的偶联反应在钯催化剂和碱存在下进行。
在另一优选例中,所述钯催化剂选自:醋酸钯(Pd(OAc)
在另一优选例中,所述碱选自:双(三甲硅基)氨基钠、叔丁醇钾、叔丁醇钠、碳酸铯、磷酸钾、磷酸钠、甲醇钠、乙醇钠、氢氧化钾、氢氧化钠、氟化钾、氟化钠、氟化四丁基铵(TBAF)、醋酸钠、醋酸钾、碳酸铯、碳酸钾和碳酸钠或其组合。
在另一优选例中,所述反应还可以包含不干扰反应的其他反应溶剂。
在另一优选例中,所述步骤e3)反应还可以加入合适的配体作为反应促进剂进行上述反应。
在另一优选例中,所述合适的配体选自下组:2,2'-二苯膦基-1,1'-联萘(BINAP)、三叔丁基(P(t-Bu)3)、1,1'-二-(二苯膦基)二茂铁(dppf)、2-二环己基磷-2,4,6-三异丙基联苯(x-phos)、4,5-双二苯基膦-9,9-二甲基氧杂蒽(Xantphos)、三叔丁基膦四氟硼酸盐或三(2-甲基苯基)膦(P(o-tolyl)
在另一优选例中,所述步骤e4)中还原反应以Pd/C、氢氧化钯或氢氧化钯炭为催化剂。
在另一优选例中,所述步骤e4)中还原反应以甲酸铵或氢气为还原剂。
在另一优选例中,所述还原反应在低级醇或低级醇-水混合溶剂中进行。
在另一优选例中,所述低级醇选自:甲醇、乙醇、异丙醇或其组合。
在另一优选例中,所述还原反应在20~100℃范围内进行。
在另一优选例中,所述还原反应在常压下进行。
在另一优选例中,所述步骤e5)关环反应在关环试剂存在下进行。
在另一优选例中,所述关环试剂选自下组:光气、三光气、1,1'-羰基二咪唑(CDI)、 尿素、甲酸、亚硝酸钠、二硫化碳、硫光气、原乙酸三乙酯、氯乙酸、溴乙酸、溴乙酸乙酯、溴乙酸甲酯、氯乙酰胺、或其组合。
在另一优选例中,所述关环反应在有或无碱存在下进行。
在另一优选例中,所述碱选自:无机碱或有机碱。
在另一优选例中,所述无机碱选自氢氧化钠、氢氧化钾、氢化钾、氢化钠、叔丁醇钠、叔丁醇钾、碳酸钾、碳酸钠、碳酸铯或碳酸氢钠;其中所述有机碱选自吡啶、三乙胺、二异丙基乙胺、N,N-二甲基苯胺和N,N-二甲基吡啶。
在另一优选例中,步骤e5)中还可以包含其他不干扰反应的反应溶剂。
在另一优选例中,所述的离去基团L选自下组:C
在另一优选例中,所述磺酰化试剂选自:C
在另一优选例中,所述碱选自无机碱或有机碱。
在另一优选例中,所述无机碱选自氢氧化钠、氢氧化钾、氢氧化铯、氢氧化钡、氢化钾、氢化钠、叔丁醇钠、叔丁醇钾、碳酸钾、碳酸钠和碳酸钙;所述有机碱选自吡啶、三乙胺、二异丙基乙胺、N,N-二甲基苯胺和N,N-二甲基吡啶。
在另一优选例中,所述偶联反应在钯催化剂和碱存在下进行。
在另一优选例中,所述钯催化剂选自下组:醋酸钯(Pd(OAc)
在另一优选例中,所述碱选自:双(三甲硅基)氨基钠、叔丁醇钾、叔丁醇钠、碳酸铯、磷酸钾、磷酸钠、甲醇钠、乙醇钠、氢氧化钾、氢氧化钠、氟化钾、氟化钠、氟化四丁基铵(TBAF)、醋酸钠、醋酸钾、碳酸铯、碳酸钾、碳酸钠或其组合。
在另一优选例中,所述反应式4中还可以包含不干扰反应的其他反应溶剂。
在另一优选例中,所述反应式4中还可以加入合适的配体作为反应促进剂进行上述反应。
在另一优选例中,所述合适的配体选自:2,2'-二苯膦基-1,1'-联萘(BINAP)、三叔丁基(P(t-Bu)
在另一优选例中,所述官能团转化反应包括:氧化水解反应、硼氢化-氧化反应、缩合酰化反应、还原反应、酰化反应、酯化反应、格氏反应、氯代反应或溴代反应。
在另一优选例中,所述氧化水解反应在氧化剂和碱存在下进行。
在另一优选例中,所述氧化水解体系包括:过氧化氢/氢氧化钠、过氧化氢/氢氧 化钾、过氧化氢/碳酸钾、过氧化氢/碳酸钠。
在另一优选例中,所述硼氢化-氧化反应为烯烃基团先与硼试剂加成,再被氧化水解成醇。
在另一优选例中,所述硼试剂包括:硼烷、9-BBN;
在另一优选例中,所述缩合酰化反应在缩合剂存在下进行。
在另一优选例中,所述缩合剂包括:N,N'-二环己基碳二亚胺(DCC)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDCI)、O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸酯(TBTU)。
在另一优选例中,所述还原反应在还原剂存在下进行。
在另一优选例中,所述还原剂包括:氢气、甲酸铵、硼氢化钠、硼氢化钾、二异丁基氢化铝(DIBAL)、硼烷。
在另一优选例中,所述酰化反应在酰化试剂存在下进行。
在另一优选例中,所述酰化试剂包括:乙酰氯、乙酸酐、丙酰氯、丙酸酐、甲磺酰氯等。
在另一优选例中,所述酯化反应体系包括但不限于:氯化亚砜/甲醇、氯化亚砜/乙醇等。
在另一优选例中,所述氯代反应在氯代试剂存在下进行。
在另一优选例中,所述氯代试剂包括但不限于:氯化亚砜、五氯化磷和N-氯代丁二酰亚胺(NCS)等。
在另一优选例中,所述格氏反应在格氏试剂存在下进行。
在另一优选例中,所述格氏试剂包括但不限于:甲基溴化镁、甲基氯化镁、甲基碘化镁等。
在另一优选例中,所述溴代反应在溴代试剂存在下进行。
在另一优选例中,所述溴代试剂包括但不限于:单质溴、N-溴代丁二酰亚胺(NBS)等。
在本发明的第三方面,提供了一种药物组合物,所述的药物组合物包含:
(A1)第一活性成分,所述第一活性成分包含治疗有效量的第一方面中任一项所述的式I所示的环状双苄基异喹啉类化合物、其对映异构体、非对映异构体、外消旋体、以及其药学上可接受的盐、结晶水合物及溶剂化物中的一种或几种混合物,和
(B)药学上可接受的载体。
在另一优选例中,所述的药物组合物还含有(A2)第二活性成分。
在另一优选例中,所述第二活性成分选自:(Y1)RNA复制酶抑制剂(如Remdesivir(瑞德西韦或GS-5734)、法匹拉韦、Molnupiravir);(Y2)3CL酶抑制剂(如nirmatrelvir);(Y3)抗体;(Y4)上述Y1~Y3的任意组合。
在另一优选例中,所述的抗体包括抗冠状病毒的抗体。
在本发明的第四方面,提供了一种第一方面所述的环状双苄基四氢异喹啉类化合物或第三方面所述药物组合物的用途,即用于制备抑制病毒复制、炎症、纤维化、T细胞异常分化的抑制剂;和/或用于制备预防和/或治疗病毒感染引起的相关疾病、炎症相关的疾病(肺炎、非酒精性脂肪肝炎、结肠炎、肾炎、胰腺炎、心肌炎、关节炎、炎性疼痛)、纤维化相关的疾病(肺纤维化、硅肺病、肝纤维化、肾纤维化、心肌纤维化、皮肤纤维化、视网膜纤维化、骨髓纤维化))、Th1和/或Th17异常分化相关的自身免疫性疾病(银屑病、类风湿性关节炎、系统性红斑狼疮、多发性硬化、视神 经性脊髓炎、重症肌无力、强直性脊柱炎、溃疡性结肠炎、克罗恩病、迟发型超敏反应、移植物抗宿主病等)、骨质疏松、神经退行性疾病的药物。
在另一优选例中,所述病毒选自:丝状科病毒、黄病毒科病毒、副粘病毒科病毒、沙粒病毒科病毒、冠状病毒科病毒、或其组合。
在另一优选例中,所述丝状科病毒选自:马尔堡病毒、埃博拉病毒。
在另一优选例中,所述冠状病毒选自下组:感染人类的冠状病毒,重症急性呼吸综合征冠状病毒SARS-CoV(Severe acute respiratory syndrome coronavirus,SARS-CoV)、2019新型冠状病毒及其变异株(SARS-CoV-2)、中东呼吸综合征冠状病毒MERS-CoV(Middle East respiratory syndrome coronavirus,MERS-CoV)、致普通感冒的冠状病毒或其组合。
在另一优选例中,所述的致普通感冒的冠状病毒选自:人冠状病毒OC
在另一优选例中,所述冠状病毒感染引起的相关疾病选自下组:人冠状病毒引起的普通感冒、高危症状感染、呼吸道感染、肺炎及其并发症、SARS-CoV-2引起的新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)、SARS-CoV-2引起的新型冠状病毒传染病或其组合。
在另一优选例中,所述由2019新型冠状病毒感染引起的相关疾病选自下组:呼吸道感染、肺炎及其并发症、或其组合。
在另一优选例中,所述用途为用于制备(a)抑制2019新型冠状病毒及其变异株(SARS-CoV-2)复制的抑制剂;和/或(b)治疗和/或预防、缓解由2019新型冠状病毒(SARS-CoV-2)感染引起的相关疾病的药物。
在另一优选例中,所述疾病为肺炎、非酒精性脂肪肝炎、结肠炎、肾炎、胰腺炎、心肌炎、关节炎、炎性疼痛、肺纤维化、硅肺病、肝纤维化、肾纤维化、心肌纤维化、皮肤纤维化、视网膜纤维化、骨髓纤维化、银屑病、类风湿性关节炎、系统性红斑狼疮、多发性硬化、视神经性脊髓炎、重症肌无力、强直性脊柱炎、溃疡性结肠炎、克罗恩病、迟发型超敏反应、移植物抗宿主病、骨质疏松、神经退行性疾病或其组合。
在另一优选例中,所述用途为用于制备治疗和/或预防、缓解与炎症、纤维化、T细胞异常分化引起的相关疾病的药物。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
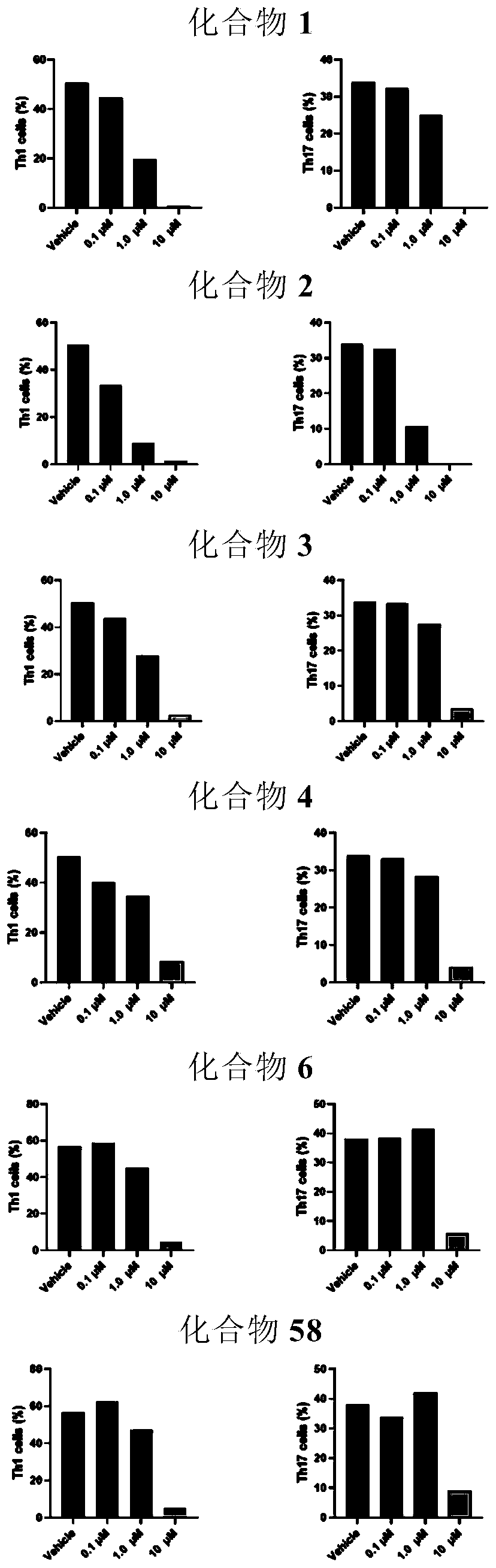
图1显示了化合物1、2、3、4、6、58对Th1/Th17分化的抑制作用。
图2显示了化合物1、2、3、4、6、58不影响LPS诱导的炎症模型中的细胞活力。
图3显示了化合物1、2、4、58能显著抑制LPS诱导的炎症模型中的炎症因子。
图4显示了化合物1、2、3、4、6、58不影响TNF-α诱导的炎症模型中的细胞活力。
图5显示了化合物1、2、3、4、6、58能显著抑制TNF-α诱导的炎症模型中的炎症因子。
图6显示了化合物4能显著抑制LPS诱导的小鼠急性炎症。
图7显示了化合物1能显著提高TNF-α诱导的A549肺细胞损伤模型中的细胞存活率。
图8显示了化合物3、58能显著抑制TNF-α诱导的A549肺细胞损伤模型中的损伤因子。
图9显示了化合物1、2、3、4、6、58能显著减轻H2O2诱导的ALM12肝细胞损伤。
图10和图11显示了化合物1、2、4能缓解TGF-β1诱导的A549肺上皮细胞纤维化。
图12显示了化合物2、4能缓解CCl4诱导的小鼠急性肝纤维化。
本发明人经过广泛而深入的研究,通过大量筛选,首次意外地开发了一类可有效抑制2019新型冠状病毒(SARS-CoV-2)等冠状病毒复制的活性成分。实验表明,本发明的活性成分(式I所示的环状双苄基异喹啉类化合物或其药学上可接受的盐、或其对映异构体、非对映异构体、外消旋体、或其结晶水合物、溶剂化物,或其混合物)可高效地抑制2019新型冠状病毒(SARS-CoV-2)等冠状病毒的复制和活力。在此基础上完成了本发明。
出乎意料的是,与尖刺碱、小檗胺、汉防己甲素等天然化合物相比,式I所述的环状双苄基异喹啉类化合物具有显著提高的抗冠状病毒活性(抗病毒活性提高幅度可达约10倍或更多)和/或具有较低的细胞毒性,因此,具有更佳的治疗指数SI,可用于SARS-CoV-2病毒等冠状病毒的预防和治疗,具有良好的临床应用前景。
除此之外,发明人还对环状双苄基异喹啉类化合物的其它潜在作用进行了探索,发现其具有抑制CD4
术语
如本文所用,“本发明的化合物”、“环状双苄基异喹啉类化合物”、“本发明的抑制冠状病毒活性的化合物”、“本发明的抑制冠状病毒复制的化合物”可互换使用,指具有优异的抑制冠状病毒复制的环状双苄基异喹啉类化合物,包括式I所示的化合物,或其药学上可接受的盐、或其对映异构体、非对映异构体、外消旋体、或其结晶水合物、溶剂化物,或其混合物。本发明的化合物不包括天然化合物(如汉防己甲素、汉防己乙素、尖刺碱)。
如本文所用,“本发明的制剂”指含有本发明化合物的制剂。
如本文所用,术语“包括”或其变换形式如“包含”或“包括有”等等,被理解为包括所 述的元件或组成部分,而并未排除其它元件或其它组成部分。
如本文所用,术语“新型冠状病毒”、“2019-nCov”或“SARS-CoV-2”可互换使用,该2019新型冠状病毒是已知感染人的第7种冠状病毒,并且造成新冠肺炎(COVID-19),是威胁全球人类健康的严重传染性疾病之一。
如本文所用卤素通常是指氟、氯、溴及碘;优选为氟、氯或溴;更优选为氟或氯。
C
卤代C
C
卤代C
C
C
C
C
C
C
卤代C
被C
被羟基C1~C6烷氧基C1~C6烷基取代的氨基甲酰基是指氨基甲酰基上的氢原子被1个或2个相同或不同的羟基C1~C6烷氧基C1~C6烷基取代,例如-CONHCH
被羟基C1~C6烷氧基取代的C1~C6烷氧羰基是指C1~C6烷氧羰基的一个烷基碳原子与羟基C1~C6烷氧基的氧原子连接,例如-COOCH
羟基C
氨基C
C
氨基甲酰基C
C
氰基C
羧基C
C
卤代C
C
C
C
C
环状双苄基异喹啉类化合物
环状双苄基异喹啉类生物碱是非常重要的一类天然产物,具有广泛的生物学活性,代表性物质有尖刺碱(oxyacanthine)、汉防己甲素(tetrandrine)、千金藤素(cepharanthine)、汉防己乙素(fangchinoline)等。
尖刺碱(Oxyacanthine)为白色晶体,苦粉末。熔点216~217℃,旋光度+131.5°(氯仿)。几乎不溶于水,溶于乙醇、氯仿、乙醚、稀酸。存在于小檗科植物刺檗(欧小檗)的根,毛茛科植物狭叶唐松草的根。尖刺碱有抗菌、降压、利胆、抗白血病作用。
本发明的化合物
本发明的化合物为式I所示的环状双苄基异喹啉类化合物或其药学上可接受的盐、或其对映异构体、非对映异构体、外消旋体、或其结晶水合物、溶剂化物,或其混合物,所述环状双苄基异喹啉类化合物为式(I)所示的化合物:
式中,R
优选地,本发明的式I化合物是非天然化合物。
在本发明中,发明人意外地发现,当化合物不含有酚羟基时,其对冠状病毒SARS-CoV-2的抑制活性居然显著提高,其EC
优选地,本发明的化合物选自表A:
表A
所述“药学上可接受的盐”为本发明的活性化合物与无机酸或有机酸反应形成常规的无毒盐。例如,常规的无毒盐可通过本发明的活性化合物与无机酸或有机酸反应制得,所述无机酸包括盐酸、氢溴酸、硫酸、硝酸、胺基磺酸和磷酸等,所述有机酸包括柠檬酸、酒石酸、乳酸、丙酮酸、乙酸、苯磺酸、对甲苯磺酸、甲磺酸、萘磺酸、乙磺酸、萘二磺酸、马来酸、苹果酸、丙二酸、富马酸、琥珀酸、丙酸、草酸、三氟乙酸、硬酯酸、扑酸、羟基马来酸、苯乙酸、苯甲酸、水杨酸、谷氨酸、抗坏血酸、对胺基苯磺酸、2-乙酰氧基苯甲酸和羟乙磺酸等;或者本发明的活性化合物与丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、天冬氨酸或谷氨酸形成酯后再与无机碱形成的钠盐、锌盐、钾盐、钙盐、铝盐或铵盐;或者本发明的活性化合物与赖氨酸、精氨酸、鸟氨酸形成酯后再与盐酸、氢溴酸、氢氟酸、硫酸、硝酸或磷酸形成的对应的无机酸盐或与甲酸、乙酸、苦味酸、甲磺酸或乙磺酸形成的对应的有机酸盐;或者本发明的活性化合物分子中的羧基/酚羟基与无机碱形成的钠盐、锌盐、钾盐、钙盐、铝盐或铵盐。
此外,本发明的活性成分还特别适合与其他抗冠状病毒的药物联用。代表性的其他的抗冠状病毒药物包括(但并不限于):干扰素、RNA依赖的RNA聚合酶抑制剂(如Remdesivir(瑞德西韦或GS-5734)、法匹拉韦(favipiravir)、Galidesivir、GS-441524、Molnupiavir(莫努匹拉韦或EIDD-2801)、NHC(EIDD-1931);3CL蛋白酶抑制剂(nirmatrelvir、ensitrelvir、GC-376)、洛匹那韦(Lopinavir)、利托那韦(Ritonavir)、奈非那韦(Nelfinavir);氯喹(Chloroquine)、羟氯喹、环孢菌素(cyclosporine)、可利霉素(Carrimycin)、黄芩苷(baicalin)、黄芩素(baicalein)、萘酚喹(Naphthoquine)、环索奈德(Ciclesonide)、利巴韦林(Ribavirin)、喷昔洛韦(Penciclovir)、来氟米特(Leflunomide)、特立氟胺(Teriflunomide)、萘莫司他(nafamostat)、硝唑尼特(nitazoxanide)、达芦那韦(Darunavir)、阿比多尔(Arbidol)、卡莫司他(Camostat)、氯硝柳胺(Niclosamide)、伊维菌素(Ivermectin)、巴瑞替尼(baricitinib)、芦可替尼(Ruxolitinib)、达沙替尼(Dasatinib)、沙奎那韦(Saquinavir)、Beclabuvir、司美匹韦(Simeprevir)、或其药学上可接受的盐、或其组合。所述干扰素包括干扰素α-2a、干扰素α-2b、干扰素α-n1、干扰素α-n3、干扰素β-1a、干扰素β-1b中的一种或多种。
此外,由于SARS-CoV-2感染可引起急性肺损伤、炎症反应甚至细胞因子风暴,本发明的活性成分还特别适合与具有改善急性肺损伤、抗炎作用或调节免疫作用的药物联用。代表性的药物包括但不限于锌(Zinc)、芬戈莫德(Fingolimod)、维生素C(Vitamin C)、奥美沙坦酯(Olmesartan Medoxomil)、缬沙坦(valsartan)、氯沙坦(Losartan)、沙利度胺(Thalidomide)、甘草酸(glycyrrhizic acid)、青蒿素(Artemisinin)、双氢青蒿素(dihydroartemisinin)、青蒿琥酯(Artesunate)、青蒿酮(Artemisone)、阿奇霉素(Azithromycin)、七叶皂苷(Escin)、萘普生(Naproxen)。
优选地,本发明的活性成分与青蒿素类药物(青蒿素、双氢青蒿素、青蒿琥酯、 青蒿酮中的一种或多种)联用。大量研究显示青蒿素类药物具有多重的抗炎、免疫调节机制,通过抑制T细胞增殖与活化,抑制B细胞活化和抗体产生,增加调节性T细胞以及减少致炎细胞因子的释放来实现抗炎、免疫调节功能,预期能够缓解新型冠状病毒(SARS-CoV-2)感染引起的免疫损伤症状。
优选地,本发明的活性成分与青蒿素类药物(青蒿素、双氢青蒿素、青蒿琥酯、青蒿酮中的一种或多种)、阿奇霉素联用。
本发明的活性成分可抑制SARS-CoV-2等新型冠状病毒的感染活性。因此,当在治疗上施用或给予本发明的的活性成分时,可抑制2019新型冠状病毒(SARS-CoV-2)的感染,进而达到抗病毒作用。
制备方法
制备本发明的环状双苄基异喹啉类化合物的方法,选自以下一种或多种方法:
a)以含酚羟基的环状双苄基异喹啉为原料,和烷基化试剂经烷基化反应得到所述的环状双苄基异喹啉类化合物;
b)以含酚羟基的环状双苄基异喹啉为原料,和酰基化试剂经酰基化反应得到所述的环状双苄基异喹啉类化合物;
在另一优选例中,所述方法为:以尖刺碱为原料,和羧酸发生缩合酰化反应得到所述的环状双苄基异喹啉类化合物。
在另一优选例中,所述缩合酰化反应在缩合剂存在下进行,所述缩合剂包括但不限于:N,N'-二环己基碳二亚胺(DCC)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDCI)、O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸酯(TBTU)等。
c)以尖刺碱为原料,在碱存在下和磺酰化试剂反应得到化合物(I-1b);
(I-1b)和偶联试剂经偶联反应得到式I-1所示的环状双苄基异喹啉类化合物,反应如反应式1所示:
式I-1中,R
式1-1b中的L选自:离去基团,如C
d)以尖刺碱为原料,经硝化、还原、关环反应制备得到式(I-2)化合物,如以下反应式2所示:
式I-2中,R
在另一优选例中,所述苯并[5~6元单环杂环]选自:
在另一优选例中,所述取代的取代基选自卤素、羟基、巯基、氨基、氧代(=O)、硫代(=S)、C
e)以尖刺碱为原料,经多步反应制备得到式(I-3)化合物,如反应式3所示:
式I-3中,R
所述取代的取代基选自卤素、羟基、巯基、氨基、氧代(=O)、硫代(=S)、C
所述杂环含有1至3个选自N、O、S的杂原子。
在另一优选例中,所述苯并[5~6元单环杂环]选自:
式I-3b中,L为:离去基团,如C
在另一优选例中,所述方法e)包括以下步骤:
e1)式(I-1a)化合物和硝化试剂发生邻位硝化反应生成式(I-3a)化合物;
e2)式(I-3a)化合物和磺酰化试剂在碱存在下在合适的溶剂中反应得到式(I-3b)化合物;
e3)式(I-3b)化合物和苄胺发生Buchwald-Hartig反应得到式(I-3c)化合物;
e4)式(I-3c)化合物发生还原反应得到式(I-3d)化合物;
e5)式(I-3d)化合物通过关环反应得到式(I-3)化合物。
f)由方法a)至e)任一方法所得到的化合物,进行官能团转化得到所述的环状双苄基异喹啉类化合物。
药物组合物和应用
本发明还提供了以本发明的抑制冠状病毒复制的式I的活性化合物、或其药学上可接受的盐、或其前药的一种或多种的混合物为有效成分,在制备治疗和/或预防、缓解由2019新型冠状病毒等冠状病毒感染引起的呼吸道感染、肺炎等相关疾病的药物中的用途。
本发明所提供的药物组合物优选含有重量比为0.001-99wt%的活性成份,优选的比例是本发明的活性化合物作为活性成分占总重量的0.1wt%~90wt%或1wt%~50wt%,其余部分为药学可接受的载体、稀释液或溶液或盐溶液。
需要的时候,在本发明药物中还可以加入一种或多种药学上可接受的载体。所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。
本发明所提供的化合物和药物组合物可以是多种形式,如片剂、胶囊、粉剂、糖浆、溶液状、悬浮液和气雾剂等,并可以存在于适宜的固体或液体的载体或稀释液中和适宜的用于注射或滴注的消毒器具中。
本发明的药物组合物的各种剂型可按照药学领域的常规制备方法制备。其制剂配方的单位计量中通常包含0.05-400mg本发明的活性化合物,优选地,制剂配方的单位计量中包含1mg-500mg本发明的活性化合物。
本发明的化合物和药物组合物可对哺乳动物临床使用,包括人和动物,可以通过口、鼻、皮肤、肺或者胃肠道等的给药途径。最优选为口服。最优选日剂量为0.01-400mg/kg体重,一次性服用,或0.01-200mg/kg体重分次服用。不管用何种服用方法,个人的最佳剂量应依据具体的治疗而定。通常情况下是从小剂量开始,逐渐增加剂量一直到找到最适合的剂量。
本发明的药物或抑制剂可通过各种不同方式施用,例如可通过注射、喷射、滴鼻、 滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织;或是被其他物质混合或包裹导入机体。
典型地,本发明活性成分或含有它的药物组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、静脉注射、肌肉注射、皮下注射、鼻腔、口腔粘膜、眼、肺和呼吸道、皮肤、阴道、直肠等。
给药剂型可以是液体剂型、固体剂型或半固体剂型。液体剂型可以是溶液剂(包括真溶液和胶体溶液)、乳剂(包括o/w型、w/o型和复乳)、混悬剂、注射剂(包括水针剂、粉针剂和输液)、滴眼剂、滴鼻剂、洗剂和搽剂等;固体剂型可以是片剂(包括普通片、肠溶片、含片、分散片、咀嚼片、泡腾片、口腔崩解片)、胶囊剂(包括硬胶囊、软胶囊、肠溶胶囊)、颗粒剂、散剂、微丸、滴丸、栓剂、膜剂、贴片、气(粉)雾剂、喷雾剂等;半固体剂型可以是软膏剂、凝胶剂、糊剂等。
本发明活性成分可以被制成普通制剂、也可以制成缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
为了将本发明活性成分被制成片剂,可以广泛使用本领域公知的各种赋形剂,包括稀释剂、黏合剂、润湿剂、崩解剂、润滑剂、助流剂。稀释剂可以是淀粉、糊精、蔗糖、葡萄糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素、硫酸钙、磷酸氢钙、碳酸钙等;润湿剂可以是水、乙醇、异丙醇等;黏合剂可以是淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、微晶纤维素、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、丙烯酸树脂、卡波姆、聚乙烯吡咯烷酮、聚乙二醇等;崩解剂可以是干淀粉、微晶纤维素、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠、羧甲基淀粉钠、碳酸氢钠与枸橼酸、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠等;润滑剂和助流剂可以是滑石粉、二氧化硅、硬脂酸盐、酒石酸、液体石蜡、聚乙二醇等。
还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。
为了将给药单元制成胶囊剂,可以将有效成分本发明活性成分与稀释剂、助流剂混合,将混合物直接置于硬胶囊或软胶囊中。也可将有效成分先与稀释剂、黏合剂、崩解剂制成颗粒或微丸,再置于硬胶囊或软胶囊中。用于制备本发明片剂的各稀释剂、黏合剂、润湿剂、崩解剂、助流剂品种也可用于制备本发明的胶囊剂。
为将本发明活性成分制成注射剂,可以用水、乙醇、异丙醇、丙二醇或它们的混合物作溶剂并加入适量本领域常用的增溶剂、助溶剂、PH调剂剂、渗透压调节剂。增溶剂或助溶剂可以是泊洛沙姆、卵磷脂、羟丙基-β-环糊精等;PH调剂剂可以是磷酸盐、醋酸盐、盐酸、氢氧化钠等;渗透压调节剂可以是氯化钠、甘露醇、葡萄糖、磷酸盐、醋酸盐等。如制备冻干粉针剂,还可加入甘露醇、葡萄糖等作为支撑剂。
此外,如需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂或其他添加剂。
本发明的活性成分或组合物可单独服用,或与其他治疗药物或对症药物合并使用。
当本发明的活性成分与其他治疗药物存在协同作用时,应根据实际情况调整它的剂量。
本发明的主要优点包括:
1)本发明化合物对冠状病毒复制具有良好的抑制活性;部分化合物抑制新冠病毒 RNA复制作用的EC
2)本发明化合物不含酚羟基,不仅抗冠状病毒SARS-CoV-2活性显著提高,而且理化性质好、代谢性质好,口服生物利用度高。
3)本发明化合物对hERG离子通道和Nav1.5离子通道的选择性好,预期对心脏的毒副作用低。
4)本发明化合物活性强,治疗指数SI大,口服有效,具有药效剂量低、毒副作用小等特点,可用于预防和/或治疗冠状病毒感染引起的相关疾病,具有良好的临床应用前景。
5)本发明化合物同时对病毒感染引起的相关疾病、炎症相关的疾病(肺炎、非酒精性脂肪肝炎、结肠炎、肾炎、胰腺炎、心肌炎、关节炎、炎性疼痛)、纤维化相关的疾病(肺纤维化、硅肺病、肝纤维化、肾纤维化、心肌纤维化、皮肤纤维化、视网膜纤维化、骨髓纤维化))、Th1和/或Th17异常分化相关的自身免疫性疾病(银屑病、类风湿性关节炎、系统性红斑狼疮、多发性硬化、视神经性脊髓炎、重症肌无力、强直性脊柱炎、溃疡性结肠炎、克罗恩病、迟发型超敏反应、移植物抗宿主病等)、骨质疏松、神经退行性疾病有治疗作用。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
实施例1制备化合物1
步骤如下所示:
步骤1:
50mL圆底单口烧瓶内加入盐酸尖刺碱(1.2g,1.76mmol),加入二氯甲烷(12mL)和三乙胺(0.89g,8.80mmol,5eq),冰浴下搅拌10min,缓慢滴加入三氟甲磺酸酐(0.58mL,3.45mmol,1.96eq),加毕,室温下搅拌2h,TLC原料转化完毕。加入1N盐酸(5.3mL),搅拌,分出有机层,有机层再用饱和碳酸氢钠水溶液洗一次,无水硫酸钠干燥,浓缩,硅胶柱层析得淡黄色固体1-a(1.08g,1.46mmol),收率83%。
步骤2:
取1-a(850mg,1.15mmol)与N,N-二甲基乙酰胺(10mL)混合,依次加入氰化锌(200mg,1.70mmol,1.48eq)、三(二亚苄基丙酮)二钯(55mg,0.06mmol,0.05eq)、1,1'-双(二苯基膦)二茂铁(65mg,0.12mmol,0.1eq)和锌粉(12mg,0.18mmol,0.16eq),氮气置换四次,升温至140~150℃反应2h,TLC原料转化完毕,等反应液冷却至30~40℃后,加入乙酸乙酯稀释,滤除不溶物,滤液用5%碳酸氢钠水溶液洗三次,分出乙酸乙酯层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物1(583mg,0.94mmol),淡黄色固体,收率82%。
实施例2制备化合物2
将500mg盐酸尖刺碱悬浮于乙腈(12mL)中,室温下加入三乙胺(260mg),再将114mg异氰酸正丁酯缓慢滴加到反应液中,25~28℃环境下搅拌2~3h后,加入乙酸乙酯稀释,水洗三次,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得到385mg标题化合物2,淡黄色固体,收率74%。
实施例3制备化合物3
步骤如下所示:
步骤1:
将化合物1(1.1g,1.78mmol)与乙二醇(11mL)混合,加入氢氧化钾(600mg,10.70mmol,6eq)和水(0.5mL),氮气置换多次,升温至150℃反应7h,反应液冷却至室温后,加水(25mL)稀释,用稀盐酸调pH至7~8,加入二氯甲烷萃取,分出有机相,水洗一次,食盐水洗一次,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得化合物3-a(300mg),淡黄色固体,收率26%。
步骤2:
将化合物3-a(600mg,0.94mmol)与甲醇(6mL)混合,室温下加入浓硫酸(352mg,3.59mmol,3.8eq),加毕,升温至回流并继续反应7h,TLC原料转化完毕,加入碳酸氢钠(938mg,11.8eq)搅拌10min,加入二氯甲烷稀释,加入水搅拌分层,分出有机相,食盐水洗,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物3(486mg),类白色固体,收率80%。
实施例4制备化合物4
将化合物1(1.1g,1.78mmol)悬浮于叔丁醇(8mL)中,加入叔丁醇钾(1.4g,12.48mmol,7eq),升温至80℃反应直至原料转化完毕,反应液冷却至室温后,浓缩掉大部分叔丁醇,向残液加水和乙酸乙酯,搅拌分层,分出乙酸乙酯层,食盐水洗一次,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物4(820mg),淡黄色固体,收率73%。
实施例5制备化合物5
化合物3-a(300mg,0.47mmol)与四氢呋喃(2mL)混合,室温下加入CDI(230mg,1.42mmol),室温下搅拌30min,将28%甲胺水溶液(468mg,4.23mmol)加入到反应液中,加毕继续搅拌30min,将反应液倒入水中,加乙酸乙酯萃取,分出有机层,浓缩,硅胶柱层析得标题化合物5(230mg),淡黄色固体,收率75%。
实施例6制备化合物6
将化合物3-a(600mg,0.94mmol)溶于二氯甲烷(5mL)中,加入N,N-二甲基甲酰胺(8μL),环境温度下再将草酰氯(0.4mL,4.72mmol)滴入,加毕氮气保护,继续搅拌40min后将反应液浓缩干,再次溶于二氯甲烷(5mL)中,环境温度下将该溶液滴加到环丙胺(330μL,4.76mmol)的二氯甲烷(4mL)溶液中,加毕,继续搅拌30min,加入饱和氯化铵水溶液(10mL)搅拌分层,分出有机相,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物6(504mg,0.75mmol),淡黄色固体,收率79%。
实施例7制备化合物7
已在实施例3中描述了化合物7(即化合物3-a)的制备方法。
实施例8制备化合物8
50mL圆底单口烧瓶内依次加入化合物1(500mg,0.81mmol)、甲酸(15mL)、雷尼镍(1.03g),氮气置换,升温至80~90℃反应1~2h,TLC原料转化完毕后,冷却反应液至环境温度,滤除不溶物,滤液浓缩干,加二氯甲烷稀释,碳酸氢钠水溶液洗,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物8(248mg,0.4mmol),黄色固体,收率49%。ESI-MS(m/z):621.37[M+H]
实施例9制备化合物9
将化合物8(80mg,0.13mmol)溶于1mL甲醇中,冰浴降温至5~10℃,加入硼氢化钠(9.3mg,0.245mmol,1.9eq),加毕,缓慢升温至环境温度,1h后TLC原料转化完毕,小心滴加饱和氯化铵水溶液淬灭反应,加二氯甲烷和水,搅拌分层,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物9(52mg,0.084mmol),浅黄色固体,收率64%。ESI-MS(m/z):623.38[M+H]
实施例10制备化合物10和33
取1-a(250mg,0.34mmol)、醋酸钯(12mg,0.05mmol,0.15eq)、2-二环己基膦-2',4',6'-三异丙基联苯(49mg,0.10mmol,0.3eq)、碳酸铯(328mg,1.00mmol,3eq)、苄胺(75μL,0.69mmol,2eq)混合于二氧六环(4mL)中,氮气置换三次,升温至100~105℃,并继续反应14小时。TLC显示原料反应完全,反应液冷却至室温后,硅藻土助滤,乙酸乙酯洗涤滤渣,向滤液中加入水和乙酸乙酯,搅拌分层,分出乙酸乙酯层,食盐水洗一次,无水硫酸钠干燥,浓缩,硅胶柱层析得到标题化合物10(192mg),淡黄色固体,收率82%。ESI-MS(m/z):698.47[M+H]
同样地,在硅胶柱层析过程中,还分离得主要的副产物化合物33(10mg),淡黄色固体,收率5%。ESI-MS(m/z):593.48[M+H]
实施例11制备化合物11
25mL圆底单口烧瓶内依次加入化合物10(190mg,0.27mmol)、钯碳(17mg)、甲酸铵(170mg)、甲醇(3mL),氮气置换两次,升温至回流反应4~5小时,TLC原料转化完毕,硅藻土助滤,乙酸乙酯洗涤滤渣,向滤液中加入水和乙酸乙酯,搅拌分层,分出乙酸乙酯层,食盐水洗一次,无水硫酸钠干燥,浓缩,硅胶柱层析得到标题化合物11(114mg),类白色固体,收率69%。ESI-MS(m/z):608.38[M+H]
实施例12制备化合物12和14
步骤如下所示:
步骤1:
将化合物11二盐酸盐(300mg,0.44mmol)与甲酸乙酯(10mL)混合,室温下加入三乙胺(400mg,3.95mmol,9eq),升温至回流反应过夜。TLC原料转化完毕,待反应液冷却至室温后,加入0.5N稀盐酸(7mL)搅拌分层,分出有机层,再用食盐水洗,浓缩,硅胶柱层析得化合物14(216mg),类白色固体,收率77%。ESI-MS(m/z):636.37[M+H]
步骤2:
将化合物14(100mg,0.157mmol)悬浮于干燥四氢呋喃(1.2mL)中,冰浴下滴加入硼烷四氢呋喃(1M in THF,0.79mL,5eq)加毕,氮气保护,升温至回流,TLC原料转化完毕后,冷却至室温,再于冰浴下放置10min,搅拌下小心滴加入甲醇,待无气体生成后加入过量甲醇和浓盐酸(95μL),回流3h,浓缩反应液,残液加二氯甲烷稀释,饱和碳酸氢钠水溶液洗,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物12(55mg),类白色固体,收率56%。ESI-MS(m/z):622.48[M+H]
实施例13制备化合物13
将化合物11二盐酸盐(150mg,0.220mmol)溶于吡啶(2.0mL)中,环境温度下滴加入乙酰氯(41μL,0.57mmol,2.6eq),加毕,升温至60℃反应2~3h。浓缩反应液,硅胶柱层析得标题化合物13(135mg),类白色固体,收率95%。ESI-MS(m/z):650.48[M+H]
实施例14制备化合物15
将盐酸尖刺碱(1.0g,1.47mmol)溶于乙酸(8mL)中,环境温度下滴加入浓硝酸(65~68%硝酸水溶液,128μL,1.2eq),加毕,室温下搅拌5min,将反应液缓慢倒入饱和碳酸氢钠水溶液中,搅拌,至无气体产生,加二氯甲烷萃取,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物15(486mg),黄色固体,收率51%。ESI-MS(m/z):654.36[M+H]
实施例15制备化合物16
25mL圆底单口烧瓶内依次加入化合物15(525mg,0.80mmol)、10%钯碳(55mg)、甲酸铵(610mg,9.68mmol,12eq)、甲醇(12mL),氮气置换,升温至回流反应1h,TLC原料转化完毕。滤除不溶物,滤渣用甲醇洗,滤液浓缩至小体积,残液加入二氯甲烷稀释,饱和碳酸氢钠水溶液洗,食盐水洗,无水硫酸钠干燥,过滤、浓缩,硅胶柱层析得标题化合物16(360mg),淡黄色固体,收率72%。ESI-MS(m/z):624.38[M+H]
实施例16制备化合物17
将化合物16的二盐酸盐(225mg,0.32mmol)溶于N,N-二甲基甲酰胺(3mL)中,室温下加入N,N'-羰基二咪唑(260mg,1.60mmol,5eq),环境温度下搅拌2h,TLC原料转化完毕,将反应液倒入12mL冰水中,并搅拌10min,过滤,滤饼水洗两次,50℃鼓风干燥6h,得标题化合物17(127mg),类白色固体,收率61%。
实施例17制备化合物18
将化合物16的二盐酸盐(215mg,0.31mmol)溶于乙醇(3mL)中,环境温度下加入原甲酸三甲酯(0.9mL,8.2mmol,27eq)和对甲苯磺酸一水合物(60mg,0.32mmol,1eq),氮气置换三次,65~70℃反应14h,TLC原料转化完毕,加入二氯甲烷稀释,饱和碳酸氢钠水溶液洗,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物18(168mg),类白色固体,收率86%。ESI-MS(m/z):634.48[M+H]
实施例18制备化合物19
在氮气保护下将化合物1(605mg,0.98mmol)溶于干燥四氢呋喃(5mL)中,冰浴5min,缓慢滴加入甲基锂(1.53mL,1.6M乙醚溶液,2.5eq),加毕,继续在冰浴条件下反应80min,将反应液小心倒入冰水中,加入2N硫酸水溶液调pH至2~3,环境温度下搅拌1h,加入碳酸氢钠调pH至弱碱性,加二氯甲烷萃取,分出有机相,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物19(143mg),淡黄色固体,收率23%。ESI-MS(m/z):635.38[M+H]
实施例19制备化合物21
将500mg盐酸尖刺碱悬浮于二氯甲烷(5mL)中,依次加入硫辛酸(160mg)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(220mg)、4-二甲氨基吡啶(15mg),23~25℃下搅拌4~6h。TLC原料转化完毕后,加入4mL水搅拌分层,分出有机层,再用2mL饱和食盐水洗一次,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得到380mg标题化合物21,淡黄色固体,收率65%。ESI-MS(m/z):797.48[M+H]
实施例20制备化合物22
参照实施例6的方法,由化合物7和环戊胺反应制得标题化合物22,浅黄色固体,收率57%。ESI-MS(m/z):704.48[M+H]
实施例21制备化合物27
步骤如下所示:
步骤1:
将化合物15(950mg,1.45mmol)溶于二氯甲烷(7mL)中,加入吡啶(565mg,7.14mmol,4.9eq)和4-二甲氨基吡啶(14mg,0.115mmol,0.08eq),冰浴下搅拌 5~10min,滴加入三氟甲磺酸酐(0.49mL,2eq),加毕,保温15min,TLC原料转化完毕,0.5N稀盐酸洗,分出有机相,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得产物27-a(800mg),黄色固体,收率70%,ESI-MS(m/z):786.28[M+H]
步骤2:
10mL圆底单口烧瓶内依次加入27-a(205mg,0.26mmol)、醋酸钯(7mg,0.12eq)、2-二环己基磷-2,4,6-三异丙基联苯(27mg,0.21eq)、甲酸(33μL,3.3eq)和N,N-二异丙基乙胺(152μL,3.3eq)、二氧六环(2.0mL)中,氮气置换多次,85~90℃下搅拌50min,TLC原料转化完毕,冷却反应液至室温,加入乙酸乙酯稀释,滤除不溶物,滤液水洗,分出乙酸乙酯层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物27(97mg),淡黄色固体,收率59%。ESI-MS(m/z):638.24[M+H]
实施例22制备化合物34
5mL圆底单口烧瓶内依次加入化合物1-a(120mg,0.162mmol)、醋酸钯(4mg,0.11eq)、2-二环己基磷-2,4,6-三异丙基联苯(15mg,0.19eq)、异丙烯基硼酸嚬哪醇酯(60μL,2eq)、二氧六环(1.5mL)和水(0.4mL),最后加入碳酸钠(53mg,3eq),氮气置换三次,升温至70~75℃,并反应过夜。反应液冷却至室温后,加入二氯甲烷稀释,水洗,分出有机相,无水硫酸钠干燥,过滤、浓缩,硅胶柱层析得到标题化合物34(55mg),浅黄色固体,收率54%。ESI-MS(m/z):633.57[M+H]
实施例23制备化合物35
参照实施例22的方法,由化合物1-a和甲基硼酸反应制得标题化合物35,淡黄色固体,收率54%。ESI-MS(m/z):607.38[M+H]
实施例24制备化合物36
将化合物11(100mg,0.164mmol)溶于二氯甲烷(2.0mL)中,环境温度下依次加入吡啶(66μL,5eq)和丙烯酰氯(27μL,2eq)。加毕,于环境温度下反应30min。TLC原料转化完毕,将反应液浓缩干,硅胶柱层析得到标题化合物36(70mg),类白色固体,收率65%。ESI-MS(m/z):662.48[M+H]
实施例25制备化合物37
参照实施例6的方法,由化合物7和正戊胺反应制得标题化合物37,浅黄色固体,收率67%。ESI-MS(m/z):706.48[M+H]
实施例26制备化合物38
参照实施例22的方法,由化合物1-a和环丙基硼酸反应制得标题化合物38,淡黄色固体,收率59%。ESI-MS(m/z):633.38[M+H]
实施例27制备化合物39
盐酸尖刺碱(600mg,0.88mmol)悬浮于二氯甲烷(8mL)中,加入三乙胺(0.62mL,5eq),冰浴下搅拌5~10min,滴加入丙烯酰氯(110μL,1.5eq),加毕, 室温下搅拌50min,TLC原料转化完毕,加入饱和氯化铵水溶液搅拌分层,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物39(240mg),类白色固体,收率41%。ESI-MS(m/z):663.2[M+H]
实施例28制备化合物40
在氮气保护下,将化合物8(300mg,0.483mmol)与冰浴下的甲基溴化镁(7.4mL,3.0M的四氢呋喃溶液)混合,缓慢升温至室温,并搅拌2~3h,将反应液倒入冰水中,加入二氯甲烷和适量氯化铵,搅拌分层,分出有机层,食盐水洗,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物40(165mg),淡黄色固体,收率54%。ESI-MS(m/z):637.2[M+H]
实施例29制备化合物41
参照实施例6的方法,由化合物7和哌啶反应制得标题化合物41,淡黄色固体,收率76%。ESI-MS(m/z):704.68[M+H]
实施例30制备化合物43
将尖刺碱(480mg,0.79mmol)和D-生物素(240mg,0.98mmol,1.2eq)悬浮于二氯甲烷(5mL)中,室温下依次加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(230mg,1.20mmol,1.5eq),4-二甲氨基吡啶(20mg,0.16mmol,0.2eq),加毕,环境温度下反应过夜。TLC原料转化完毕后,加入饱和氯化铵水溶液搅拌分层,分出有机层,食盐水洗,无水硫酸钠干燥,浓缩,硅胶柱层析得标题化合物43,类白色固体435mg,收率66%。ESI-MS(m/z):835.48[M+H]
实施例31制备化合物44
参照实施例6的方法,由化合物7和二甲羟胺盐酸盐反应制得标题化合物44,浅黄色固体,收率78%。ESI-MS(m/z):680.3[M+H]
实施例32制备化合物45
将化合物7(452mg,0.709mmol)溶于二氯甲烷(2mL)中,加入N,N-二甲基甲酰胺(5.5μL),环境温度下再将草酰氯(0.305mL,3.61mmol)滴入,加毕,氮气保护,继续反应20min后将反应液浓缩干,再次溶于二氯甲烷(5mL)中,室温下将该溶液滴加到苯胺(0.34mL,3.73mmol)、吡啶(0.28mL,3.46mmol)的二氯甲烷(5mL)溶液中,加毕,于环境温度下继续搅拌10min,TLC原料转化完毕,加入饱和氯化铵水溶液搅拌分层,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物45(259mg),淡黄色固体,收率51%。ESI-MS(m/z):712.2[M+H]
实施例33制备化合物46
氮气保护下,将化合物44(393mg,0.573mmol)溶于干燥过的四氢呋喃(5mL)中,冰浴降温至0~5℃,将乙烯基溴化镁(1.75mL,1.75mmol,3eq,1M四氢呋喃溶液)缓慢滴加进去,加毕,于环境温度下反应1~2h,TLC原料转化完毕,将反应液小心加入到1N盐酸(5mL)中,并搅拌20min,加入氢氧化钠水溶液调pH至8左右,再加入二氯甲烷萃取,有机相用无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物46(290mg,0.449mmol),淡黄色固体,收率78%。ESI-MS (m/z):647.48[M+H]
实施例34制备化合物47
参照实施例32的方法,由化合物7和4-三氟甲基苯胺反应制得标题化合物47,淡黄色固体,收率58%。ESI-MS(m/z):780.48[M+H]
实施例35制备化合物48
参照实施例6的方法,由化合物7和异丙胺反应制得标题化合物48,淡黄色固体,收率59%。ESI-MS(m/z):678.48[M+H]
实施例36制备化合物49
参照实施例6的方法,由化合物7和1-金刚烷胺反应制得标题化合物49,淡黄色固体,收率64%。ESI-MS(m/z):770.58[M+H]
实施例37制备化合物50
参照实施例6的方法,由化合物7和环丁胺反应制得标题化合物50,淡黄色固体,收率58%。ESI-MS(m/z):690.48[M+H]
实施例38制备化合物51
参照实施例32的方法,由化合物7和3-氨基吡啶反应制得标题化合物51,淡黄色固体,收率71%。ESI-MS(m/z):713.38[M+H]
实施例39制备化合物52
参照实施例32的方法,由化合物7和对甲氧基苯胺反应制得标题化合物52,淡黄色固体,收率72%。ESI-MS(m/z):742.52[M+H]
实施例40制备化合物53
参照实施例28的方法,由化合物8和环丙基溴化镁反应制得标题化合物53,淡黄色固体,收率64%,ESI-MS(m/z):663.35[M+H]
实施例41制备化合物54
将化合物53(183mg,0.28mmol)溶于二氯甲烷(2mL)中,环境温度下加入Dess-Martin Periodinane(174mg,0.41mmol,1.5eq),加毕,氮气保护,继续反应1h,TLC原料转化完毕,加入二氯甲烷稀释,饱和碳酸氢钠溶液洗一次,分出有机层,无水硫酸钠干燥,过滤,浓缩,硅胶柱层析得标题化合物54(38mg,0.057mmol),淡黄色固体,收率20%。ESI-MS(m/z):661.28[M+H]
实施例42制备化合物55
参照实施例6的方法,由化合物7和二甘醇胺反应制得标题化合物55,浅黄色固体,收率61%。ESI-MS(m/z):724.28[M+H]
实施例43制备化合物56
参照实施例3中步骤2的方法,由化合物7和正戊醇反应制得标题化合物56,类白色固体,收率82%。ESI-MS(m/z):707.46[M+H]
实施例44制备化合物57
参照实施例32的方法,由化合物7和对氟苯酚反应制得标题化合物57,浅黄色固体,收率55%。ESI-MS(m/z):731.26[M+H]
实施例45制备化合物58
参照实施例3中步骤2的方法,由化合物7和二乙二醇反应制得标题化合物58,类白色固体,收率72%。
实施例46制备化合物59
参照实施例2的方法,由盐酸尖刺碱和异氰酸甲酯反应制得标题化合物59,淡黄色固体,收率73%。ESI-MS(m/z):666.26[M+H]
实施例47制备化合物60
参照实施例2的方法,由盐酸尖刺碱和异氰酸乙酯反应制得标题化合物60,淡黄色固体,收率69%。ESI-MS(m/z):680.28[M+H]
实施例48制备化合物61
参照实施例2的方法,由盐酸尖刺碱和异氰酸正丙酯反应制得标题化合物61,淡黄色固体,收率76%。ESI-MS(m/z):694.24[M+H]
实施例49制备化合物62
参照实施例2的方法,由盐酸尖刺碱和异氰酸异丙酯反应制得标题化合物62,淡黄色固体,收率70%。ESI-MS(m/z):694.28[M+H]
实施例50制备化合物63
参照实施例5的方法,由化合物7和乙胺水溶液反应制得标题化合物63,淡黄色固体,收率80%。ESI-MS(m/z):664.24[M+H]
实施例51制备化合物64
参照实施例6的方法,由化合物7和正丙胺反应制得标题化合物64,淡黄色固体,收率73%。ESI-MS(m/z):678.26[M+H]
实施例52制备化合物65
参照实施例2的方法,由盐酸尖刺碱和异氰酸环戊酯反应制得标题化合物65,类白色固体,收率76%。ESI-MS(m/z):720.45[M+H]
实施例53制备化合物66
参照实施例2的方法,由盐酸尖刺碱和异氰酸环己酯反应制得标题化合物66,类白色固体,收率71%。ESI-MS(m/z):734.48[M+H]
药理实验
1)抗新冠病毒活性测试
测定化合物对2019新型冠状病毒(SARS-CoV-2)复制抑制活性:Vero E6细胞购买自ATCC,SARS-CoV-2病毒来源于国家病毒资源库微生物菌毒种保藏中心。将Vero E6细胞在密度为5×10
结果表明(表1),多个化合物显著抑制SARS-CoV-2病毒复制,抑制SARS-CoV-2病毒复制EC
2)新冠病毒包膜蛋白(2-E)离子通道体外活性测试
测定化合物对新型冠状病毒包膜蛋白(2-E)离子通道抑制活性:纯化的2-E蛋白的通道活性,在室温下用平面脂质双分子工作站(BLM)进行检测。将保存于氯仿中的磷脂酰胆碱(PC)和磷脂酰丝氨酸(PS)按3:2的比例混合,氮气吹干,再用葵烷溶解至终浓度为50mg/ml。将BLM系统中的杯槽(cup)与槽子安装好,并将杯槽侧定义为cis侧,对侧定义为trans侧,分别加入1ml的内外液。将安装好的装置置于平面脂双层工作站的操作台,使用体式显微镜观察杯槽中间的小孔,将制备好的磷脂涂于杯槽孔上,然后在cis侧加入纯化的2-E蛋白。在电化学梯度以及电压的驱动下,蛋白插入到人工脂双层膜上。通过膜片钳放大器的电压钳模式记录电流,并用Clampex10.3软件采集信号,单通道的电导及开放频率通过高斯函数进行拟合,其中,电流开放时间小于0.5-1.5ms的将被视为噪音。通过改变不同的电压,记录不同条件下的电流幅度,并观察反转电位。
在使用BLM系统评价化合物的通道抑制活性时,观察到电流出现后,记录三分钟然后在trans侧加入待测化合物,搅拌3秒钟,随后记录十分钟的电流信号,观察电流变化情况。
在记录药物多浓度抑制情况及计算半抑制浓度(IC
3)心脏毒性相关靶点(hERG和Nav1.5)体外活性测试
hERG:稳定表达hERG钾通道的CHO(Chinese Hamster Ovary)细胞,在室温下用全细胞膜片钳技术记录hERG钾通道电流。玻璃微电极由玻璃电极毛胚(BF150-86-10,Sutter)经拉制仪拉制而成,灌注电极内液后的尖端电阻为2-5MΩ左右,将玻璃微电极插入放大器探头即可连接至膜片钳放大器。钳制电压和数据记录由pClamp 10软件通过电脑控制和记录,采样频率为10kHz,滤波频率为2kHz。在得到全细胞记录后,细胞钳制在-80mV,诱发hERG钾电流(I hERG)的步阶电压从-80mV给予一个2s的去极化电压到+20mV,再复极化到-50mV,持续1s后回到-80mV。每10s给予此电压刺激,确定hERG钾电流稳定后(至少1分钟)开始给药过程。化合物每个测试浓度至少给予1分钟,每个浓度至少测试2个细胞(n≥2)。
细胞外液配方(mM):140NaCl,5KCl,1CaCl
细胞内液配方(mM):140KCl,1MgCl
Nav1.5:稳定表达hNav1.5钠通道的CHL细胞,在室温下用全细胞膜片钳技术记录hNav1.5钠通道电流。玻璃微电极由玻璃电极毛胚(BF150-86-10,Sutter)经拉制仪拉制而成,灌注电极内液后的尖端电阻为2-5MΩ左右,将玻璃微电极插入放大器探头即可连接至Axopatch 200B(Molecular Devices)膜片钳放大器。钳制电压和数据记录由pClamp 10软件通过电脑控制和记录,采样频率为10kHz,滤波频率为2kHz。在得到全细胞记录后,细胞钳制在-80mV,先给予一个200ms的超极化电压到-120mV,再去极化到-20mV持续20ms诱发Nav1.5电流。每10s给予此电压刺激,确 定hNav1.5钠电流稳定后(1分钟)开始给药过程。供试品浓度从低测试浓度开始连续给药,每个测试浓度给予1分钟达作用稳态或最长3分钟。供试品每个浓度至少测试3个细胞(n≥3),阳性对照品每个浓度至少测试2个细胞(n≥2)。
细胞外液配方(mM):140NaCl,5KCl,1CaCl
细胞内液配方(mM):130CsF,10NaCl,10EGTA and 10HEPES,用CsOH调节pH至7.2。
4)细胞毒性测试
在本实施例中,通过CCK8试剂盒分析确定各实施例对Vero E6细胞的半数毒性浓度(CC
结果显示,化合物2、3、4、5、6和58在Vero E6细胞上的细胞毒性弱于盐酸尖刺碱,治疗指数SI均远远优于盐酸尖刺碱(表1)。尤其是化合物3、4、6和58,其SI值大于50,远高于其它化合物。
表⒈对2019新型冠状病毒(SARS-CoV-2)原始株、南非变异株以及delta变异株、HCoV OC43复制抑制活性及新冠病毒包膜蛋白(2-E)离子通道、心脏毒性相关靶点及细胞毒性结果
a
如表1所示,本发明化合物抑制SARS-CoV-2原始株病毒复制的IC
5)CD4
通过CD4
实验方法:
CD4
CD4
结果显示,化合物1、2、3、4、6和58在10μM浓度下,同时对Th1/Th17分化有很强的抑制作用。化合物2在更低的1μM浓度下,仍对Th1/Th17分化有很强的抑制作用(图1)。
6)体内外抗炎测试
6.1)抗LPS诱导的Raw 264.7细胞炎症实验
在本实施例中,通过细胞活力结合炎症因子分析本发明中的化合物对LPS诱导的Raw 264.7细胞炎症模型的炎症水平影响;通过CCK-8检测分析细胞活力;通过实时定量PCR(Q-PCR)方法检测炎症相关指标的mRNA表达水平。Raw 264.7细胞购买自ATCC;CCK-8试剂盒购买自Meilunbio,货号MA0218-3;LPS购买自Sigma,货号L2630。
6.1.1)化合物对LPS诱导的Raw 264.7细胞炎症模型的细胞活性影响
实验方法:首先,将8000个细胞/孔Raw 264.7细胞置于96孔板中培养过夜。第二天,对照组细胞加入0.1%DMSO,模型组加入1μg/ml LPS以及0.1%DMSO,给药组加上1μg/ml LPS以及1μM的化合物(盐酸尖刺碱oxy、1、2、汉防己甲素tet、3、4、6、58),96孔板消毒后置于恒温培养箱中孵育16小时。最后利用CCK-8试剂盒检测细胞的存活率。
实验结果如图2所示,在LPS诱导的炎症模型下,所有细胞未见损伤,给药组与模型组之间无细胞存活率差异,表明测试的化合物不影响LPS诱导的炎症模型下的细胞活力。
6.1.2)化合物对LPS诱导的Raw264.7细胞炎症模型种相关炎症指标mRNA水平的检测
实验方法:首先,将5*104个细胞/孔Raw 264.7细胞置于12孔板中培养过夜。第二天,对照组细胞加入0.1%DMSO,模型组加入1μg/ml LPS以及0.1%DMSO,给药组加上1μg/ml LPS以及1μM的化合物(盐酸尖刺碱oxy、1、2、汉防己甲素tet、3、4、6、58),12孔板消毒后置于恒温培养箱中孵育16小时。使用Trizol(翊圣,10606ES60)裂解法提取细胞mRNA,反转录后进行实时定量PCR法检测。
表2.目的基因引物序列
实验结果如图3所示,1μg/ml LPS诱导下,细胞因子IL-6和IL-1β显著上升,趋化因子CXCL9显著上升,说明炎症模型有效;给予不同化合物(1μM),炎症因子和趋化因子相比于模型组下降,其中化合物oxy、1、2、tet、4、58对不同的炎症因子均有显著抑制,说明上述化合物抗炎活性较强,且不是通过影响细胞活力导致的。
6.2)抗TNF-α诱导的Raw 264.7细胞炎症实验
在本实施例中,通过细胞活力结合炎症因子表达水平分析化合物对TNF-α诱导的Raw 264.7细胞炎症水平的影响;通过CCK-8检测分析细胞活力;通过实时定量PCR(Q-PCR)方法检测炎症相关指标的mRNA表达水平。Raw 264.7细胞购买自ATCC,CCK-8试剂盒购买自Meilunbio,货号MA0218-3,TNF-α购买自Merck,货号GF314。
6.2.1)化合物对TNF-α诱导的Raw 264.7细胞炎症模型的细胞活性影响
实验方法:首先,将8000个细胞/孔Raw 264.7细胞置于96孔板中培养过夜。第二天,对照组细胞加入0.1%DMSO,模型组加入10ng/ml TNF-α以及0.1%DMSO,给药组加上10ng/ml TNF-α以及1μM的化合物(盐酸尖刺碱oxy、1、2、汉防己甲素tet、3、4、6、58),96孔板消毒后置于恒温培养箱中孵育16小时。最后利用CCK-8试剂盒检测细胞的存活率。
实验结果如图4所示,在TNF-α诱导的炎症模型下,所有细胞未见损伤,给药组与模型组之间无细胞存活率差异,表明测试的化合物不影响TNF-α诱导的炎症模型下的细胞活力。
6.2.2)化合物对TNF-α诱导的Raw264.7细胞炎症模型种相关炎症指标mRNA水平的检测
实验方法:首先,将5*104个细胞/孔Raw 264.7细胞置于12孔板中培养过夜。第二天,对照组细胞加入0.1%DMSO,模型组加入10ng/ml TNF-α以及0.1%DMSO,给药组加上10ng/ml TNF-α以及1μM的化合物(盐酸尖刺碱oxy、1、2、汉防己甲素tet、3、4、6、58),12孔板消毒后置于恒温培养箱中孵育16小时。使用Trizol(翊圣,10606ES60)裂解法提取细胞mRNA,反转录后进行实时定量PCR法检测,引物同表2。
实验结果如图5所示,10ng/ml TNF-α诱导下,细胞因子IL-6和IL-1β显著上升,趋化因子CXCL9显著上升,说明炎症模型有效;给予不同化合物(1μM),炎症因子和趋化因子相比于模型组下降,其中化合物oxy、1、2、tet、3、4、6、58对不同的炎症因子均有显著抑制。说明上述化合物抗炎活性较强,且不是通过影响细胞活力导致的。
6.3)抗LPS诱导的急性炎症的体内实验
在本实施例中,通过炎症因子表达水平分析化合物对LPS诱导的体内急性炎症模型的影响;通过实时定量PCR(Q-PCR)方法检测组织炎症相关指标的mRNA表达水平,通过Elisa的方法检测血清中炎症因子水平。C57BL/6小鼠购买自上海斯莱克(SLAC)公司,Elisa试剂盒购买自Novusbio,货号分别为IL-6,890860;TNF-α,266117。
实验方法:
溶液配制:LPS溶液用PBS配制为1mg/ml母液,用0.22μm水相滤头过滤;化合物用85%生理盐水+5%DMSO+5%HS-15+5%PEG400作为溶媒稀释为3mg/ml。
炎症模型小鼠构建:C57BL/6小鼠随机分为3组,分别为:1个对照组,5只实验动物;1个LPS造模组,5只实验动物;2个给药组,5只实验动物。对照组腹腔注射0.1ml/10g PBS,模型组与给药组均腹腔注射3mg/kg LPS,两小时之后给药;对照组和模型组均口服给予0.1ml/10g溶媒,给药组口服给予30mg/kg的化合物4。各组小鼠于给药后4h眼眶取血,安乐死后取脾脏和肺脏组织。分别提取肺组织和脾脏组织mRNA,反转录后进行实时定量PCR法检测,评估炎症相关指标的mRNA表达水平;提取血清后进行Elisa检测,评估炎症因子分泌水平。
实验结果如图6所示,3mg/kg LPS刺激下,细胞因子和趋化因子显著上升,说明体内炎症模型有效;口服给予30mg/kg的化合物4,炎症因子和趋化因子相比于模型组,mRNA水平和细胞因子分泌水平均显著下降。表明化合物4具有体内抗炎活性。
7)肺损伤保护活性测试
在本实施例中,细胞活力结合细胞死亡相关分子分析化合物对TNF-α诱导的A549肺上皮细胞损伤水平影响。通过显微镜镜下观察细胞损伤情况;通过CCK-8检测分析细胞活力;通过实时定量PCR(Q-PCR)方法检测损伤相关指标的mRNA表达水平。A549细胞购买自ATCC,CCK-8试剂盒购买自Meilunbio,货号MA0218-3,LPS购买自Sigma,货号L2630。
7.1)化合物对TNF-α诱导的A549细胞活性影响
实验方法:首先,将8000个细胞/孔A549细胞置于96孔板中培养过夜。第二天,对照组细胞加入0.1%DMSO,模型组加入10ng/ml TNF-α以及0.1%DMSO,给药组加上10ng/ml TNF-α以及1μM的化合物(oxy、1、2、tet、3、4、6、58),96孔板消毒后置于恒温培养箱中孵育24小时。最后,利用CCK-8试剂盒检测细胞的存活率。
实验结果如图7所示,在TNF-α诱导的肺损伤模型下,模型组细胞存活率受到影响,肺上皮细胞趋于死亡状态,给药组与模型组之间相比,部分化合物可以缓解由TNF-α介导的肺上皮细胞损伤,其中化合物1表现出显著性差异。
7.2)化合物对TNF-α诱导的A549细胞损伤相关指标mRNA水平的检测
实验方法:首先,将5*104个细胞/孔A549细胞置于12孔板中培养过夜。第二 天,对照组细胞加入0.1%DMSO,模型组加入10ng/ml TNF-α以及0.1%DMSO,给药组加上10ng/ml TNF-α以及1μM的化合物(oxy、1、2、tet、3、4、6、58),12孔板消毒后置于恒温培养箱中孵育24小时。使用Trizol(翊圣,10606ES60)裂解法提取细胞mRNA,反转录后进行实时定量PCR法检测。
表3.目的基因引物序列
实验结果如图8所示,10ng/ml TNF-α诱导下,可见肺上皮细胞损伤、TNF-α和IL-1β显著上升,说明炎症模型有效;给予不同化合物(1μM)后,损伤因子相比于模型组下降,其中化合物oxy、tet、3和58对不同的损伤因子均有显著抑制。表明本发明中的化合物具有肺上皮细胞损伤后保护活性,其中oxy、tet、3和58保护活性较强。
8)抗H
在本实施例中,通过镜下形态学观察、细胞活力结合细胞死亡相关分子分析本发明中的化合物对H
实验方法:首先,将8000个细胞/孔ALM12细胞置于96孔板中培养过夜。第二天,对照组细胞加入0.1%DMSO,模型组加入2mM H
实验结果如图9所示,在H
9)抗TGF-β1诱导的A549肺上皮细胞纤维化实验
在本实施例中,通过镜下观察、CCK-8试剂盒结合Weatern Blot检测分析本发明中的化合物对A549细胞的纤维化缓解作用。通过显微镜镜下观察细胞损伤情况;通过CCK-8检测分析细胞活力;通过Weatern Blot方法检测纤维化相关指标的蛋白表达水平。A549细胞购买自ATCC;CCK-8试剂盒购买自Meilunbio,货号MA0218-3;TGF-β1购买自MCE,货号HY-P70543;一抗:Collagen购买自ARG21965,货号arigobio;α-smooth muscle actin购买自CST,货号mAb#19245;VIMENTN购买自CST,货号mAb#5741;GAPDH购买自Yeasen,货号30201ES20。
实验方法:首先,将8000个细胞/孔A549细胞置于96孔板中培养过夜。第二天,对照组细胞加入0.1%DMSO,模型组加入10ng/ml TGF-β1以及0.1%DMSO,给药组 加上10ng/ml TGF-β1以及1μM的化合物(oxy、1、2、tet、3、4、6、58),96孔板消毒后置于恒温培养箱中孵育72小时。最后,利用显微镜观察镜下细胞损伤和生长情况;CCK-8试剂盒检测细胞的存活率。
实验结果如图10和图11所示,加入10ng/ml TGF-β1刺激A549细胞后,24h和72h进行镜下观察,在24小时即可见到A549细胞发生形变,有椭圆变为细长型,说明肺上皮细胞发生纤维化样改变,给药组镜下观察改变不明显;通过WB检测纤维化指标,可见模型组Collagen1、α-SMA有上调,说明模型有效,比较给药组与模型组,可见化合物oxy、1、2、tet和4可以部分缓解纤维化,表明化合物oxy、1、2、tet和4可以部分缓解纤维化指标,有一定的保护作用。
10)抗四氯化碳诱导的急性肝纤维化动物实验
在本实施例中,通过组织观测、纤维化指标、HE以及天狼星红染色分析本发明中的化合物对四氯化碳诱导的急性肝纤维化模型的影响;通过体重检测、组织明场拍摄判断小鼠损伤情况;通过Weatern Blot方法检测纤维化相关指标的蛋白表达水平;HE以及天狼星红染色分析纤维化进展情况。C57BL/6小鼠购买自上海斯莱克(SLAC)公司;CCl
实验方法:
溶液配制:CCl
纤维化模型小鼠构建:32只C57小鼠适应性饲养1周后随机分为3组:空白组、模型组、给药组2组;空白组6只实验动物,其余3组每组8只实验动物。除空白组外,其余三组分别于D1,D3,D5腹腔注射CCl
检测方法:1.解剖后,拍摄肝原位照片;2.留取肝组织利用RIPA裂解后提取蛋白做WB检测;3.固定后肝组织切片后进行HE染色以及天狼星红检测。
实验结果:
a.直至实验结束均无动物死亡,在模型建立后第6天动物体重下降(图12B);
b.实验动物安乐死之后,明场观察小鼠肝器官的损伤状态,可清楚看到模型组小鼠肝脏表面的纤维化病变,给药组的小鼠肝器官表面粗的糙程度有所缓解(图12A);
c.HE染色显示,造模组小鼠肝脏假小叶明显形成,肝实质细胞发生致密,说明造模成功,给予药物组有所缓解;天狼星红染色发现模型组纤维组织增加,给药组有所降低(图12C);
d.通过WB检测肝纤维化指标,模型组纤维化指标Collagen1、α-SMA显著上调,说明模型构建成功;给予30mg/kg化合物2或者化合物4后,发现肝纤维化指标下调(图12D);
上述实验结果表明,口服给予化合物2或者化合物4对急性肝纤维化损伤有一定的缓解作用。
综上,在本发明中,本发明人首次公开了一类新型的环状双苄基异喹啉类生物碱或其药学上可接受的盐、其制备方法,并发现其对SARS-CoV-2的复制具有显著的抑制作用,抑制EC
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 一种双苄基四氢异喹啉类化合物及其制备方法和应用
- 一种双苄基四氢异喹啉类化合物及其制备方法和应用
