用TACI-Fc融合蛋白治疗干燥综合征的方法
文献发布时间:2024-04-18 19:58:30
本发明涉及治疗干燥综合征的药物、剂量方案、给药间隔及施用方式。
干燥综合征(即Sjogren's Syndrome、Sjtoegren综合征、SS)是一种以侵犯泪腺、唾液腺等外分泌腺为主的慢性自身免疫性疾病,又称为自身免疫性外分泌腺体病。主要表现为干燥性角膜、结膜炎、口腔干燥症,它可累及其他系统如呼吸系、消化系、泌尿系、血液系、神经系以及肌肉、关节等造成多系统、多器官受损。
干燥综合征是一个全球性疾病,发病率高,发病年龄大多为40~60岁的中老年,且90%以上为女性,小儿较少。由于至今缺少统一的诊断标准,所以该病的患病率很不准确。一般估计为0.1%~0.7%。在美国,干燥综合征的发病率仅次于类风湿关节炎。中国经对万余人群的调查发现,该病患病率为0.29%~0.77%,说明在中国该病的患病率不低于类风湿关节炎0.3%~0.4%的发病率。
目前干燥综合征的治疗主要是通过激素抑制患者体内异常的免疫反应,进而保护外分泌腺及其他重要脏器的功能。然而全球尚无获批用于干燥综合征的特效疗法或生物药。截止到2021年07月20日,全球仅有5款BAFF/BLyS/APRIL靶点的生物新药处于干燥综合征的临床研究阶段(见表1)。
表1全球处于干燥综合征的临床研究阶段的BAFF/BLyS/APRIL靶点生物新药
因此,无论是中国还是全球,干燥综合征治疗领域都存在巨大的未满足的临床需求。
发明内容
通过对大量临床数据深入分析,本发明惊奇的发现了本发明提供的TACI-Fc融合蛋白在治疗干燥综合征的癌患者时,产生了意料不到的技术效果。具体的,本发明提供了一种治疗干燥综合征的方法,所述方法包括对具有所述干燥综合征的患者施用一种治疗有效量的TACI-Fc融合蛋白,所述的TACI-Fc融合蛋白包含:
(i)TACI胞外区或其结合Blys和/或APRIL的片段;和
(ii)人免疫球蛋白恒定区片段。
其中,在一些优选的实施例中,所述TACI-Fc融合蛋白的单次给药剂量优选为约0.1至10mg/kg。
本发明还涉及TACI-Fc融合蛋白在制备用于治疗干燥综合征的药物中的用途。
在一实施例中,所述的TACI胞外区或其片段包含SEQ ID NO:1的氨基酸序列。
SEQ ID NO:1
在一实施例中,所述的人免疫球蛋白为IgG1或所述的人免疫球蛋白恒定区片段包含SEQ ID NO:2的氨基酸序列或者包含与SEQ ID NO:2至少90%、至少91%、至少92%、至少93%、至少95%、至少96%一致性的氨基酸序列。
SEQ ID NO:2
在一优选的实施例中,所述的人免疫球蛋白恒定区片段包含对应于SEQ ID NO:2的位点3、8、14、15、17、110、111或173的一个或多个 位点上的氨基酸的修饰,其中,所述的修饰优选为氨基酸的取代、删除或插入。
在某些具体的实施例中,所述的取代选自以下组:P3T、L8P、L14A、L15E、G17A、A110S、P111S和A173T。
在一特定实施例中,所述的人免疫球蛋白恒定区片段包含SEQ ID NO:3的氨基酸序列。
SEQ ID NO:3
在一实施例中,所述的TACI-Fc融合蛋白为Telitacicept(泰它西普),其氨基酸序列如SEQ ID NO:4所示。
SEQ ID NO:4
在一些优选的实施例中,所述的TACI-Fc融合蛋白的施用方式为皮下、肌肉或静脉施用或者施用部位为大腿、腹部或者上臂。
在一些优选的实施例中,所述的TACI-Fc融合蛋白在一个月的间隔期间使用2-4次。
在一些优选的实施例中,所述的TACI-Fc融合蛋白的给药频次为一周一次。
在一些优选的实施例中,所述的治疗持续约2-50周。
在一些优选的实施例中,所述的干燥综合征为原发性干燥综合征。
在一些优选的实施例中,所述的干燥综合征为继发性干燥综合征。
在一些优选的实施例中,所述的TACI-Fc融合蛋白的单次给药剂量为160-240mg,进一步优选为160mg或240mg。
本发明还包括以上TACI-Fc融合蛋白用于制备治疗干燥综合症的药物中的应用。
本发明开展的一项临床研究中,结果显示,泰它西普治疗显著改善pSS患者第24周时的ESSDAI评分和MF-20评分;泰它西普在pSS患者中表现出较好的安全性。
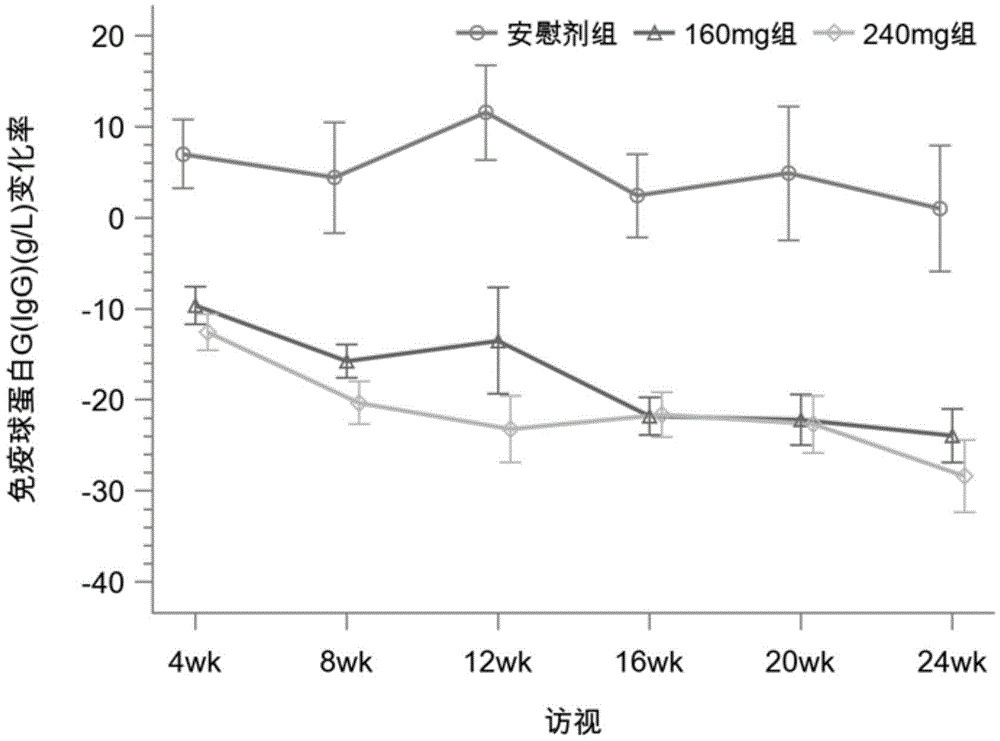
图1为安慰剂组、160mg组、240mg组IgG水平相比基线变化率;
图2为安慰剂组、160mg组、240mg组IgA水平相比基线变化率;
图3为安慰剂组、160mg组、240mg组IgM水平相比基线变化率;
图4为安慰剂组、160mg组、240mg组CD19+B细胞数相比基线变化率;
图5为安慰剂组、160mg组、240mg组CD4+T细胞数相比基线变化率;
图6为安慰剂组、160mg组、240mg组CD8+T细胞数相比基线变化率。
除非另有定义,本文使用的所有科技术语具有本领域普通技术人员所理解的相同含义。关于本领域的定义及术语,专业人员具体可参考Current Protocols in Molecular Biology(Ausubel)。
本发明所用氨基酸三字母代码和单字母代码如J.biol.chem,243,p3558(1968)中所述。
本发明提供了跨膜激活剂、钙调节剂和亲环蛋白配体相互作用剂(TACI)-免疫球蛋白融合蛋白(即TACI-Fc融合蛋白)在治疗干燥综合征中的应用。本发明涉及的患者优选为哺乳动物,如人。
本发明中的术语“TACI”即transmembrane activator and CAML interactor,是一种肿瘤坏死因子受体超家族中的成员之一。本发明中的术语“BLys”是指B淋巴细胞刺激物(B lymphocyte stimulator),它是一种以膜结合型和可溶型2种形式存在的TNF配体超家族成员之一,它特异 性表达于骨髓细胞表面,并选择性刺激B淋巴细胞增殖和免疫球蛋白的产生;本发明中的术语“APRIL”(a proliferation-inducing ligand)是一种肿瘤坏死因子(TNF)类似物,它能激发体内的原始B细胞和T细胞增殖,促进B细胞累积并增加脾含量。APRIL能和TACI、BCMA特异性结合,结合后能阻止APRIL与B细胞结合,并抑制APRIL激发的原始B细胞增殖反应。而且APRIL能和BLys竞争性结合受体(BCMA、TACI)。
本发明涉及的术语“TACI-Fc融合蛋白”是指跨膜激活剂、钙调节剂和亲环蛋白配体相互作用剂(TACI)-免疫球蛋白融合蛋白(即TACI-Fc融合蛋白),本发明提供的TACI-免疫球蛋白融合蛋白包括:(i)TACI胞外区或其结合Blys和/或APRIL的片段;和(ii)人免疫球蛋白恒定区片段。
术语“TACI胞外区或其结合Blys和/或APRIL的片段”具体可参见美国专利NO.5,969,102、6,316,222和6,500,428和美国专利申请09/569,245和09/627,206(其内容纳入本文作参考)公开的TACI的胞外结构域以及能与TACI配体相互作用的TACI胞外结构域特定片段,或者公开号为CN101323643A的中国专利公开的TACI胞外结构域第13-118位氨基酸片段。
本发明提供的TACI-免疫球蛋白融合蛋白的免疫球蛋白部分优选为IgG1,其可以包含重链恒定区,如人的重链恒定区。本发明优选的IgG1重链恒定区是含有CH2和CH3区的IgG1 Fc片段,其可以是野生型IgG1 Fc片段或经突变的IgG1 Fc片段。
术语“人免疫球蛋白恒定区片段”中,免疫球蛋白部分优选为IgG1,其可以包含重链恒定区,如人的重链恒定区。本发明优选的“人免疫球蛋白恒定区片段”是含有部分铰链区结构域、CH2结构域和CH3结构域的氨基酸片段。在一些更优选的实施例中,本发明所述的“人免疫球蛋白恒定区片段”的氨基酸序列如SEQ ID NO:2所示,或者包含与SEQ ID NO:2至少90%、至少91%、至少92%、至少93%、至少95%、至少96%、至少97%、至少98%、或至少99%一致性的氨基酸序列。在一些更优选的实施例中,所述的“人免疫球蛋白恒定区片段”的氨基酸序列如SEQ ID NO:3所示。
本发明涉及的术语“氨基酸”以最广义定义理解,是一类含有氨基和羧基的有机化合物的通称,优选的,本发明中涉及的氨基酸是组成生命体中的蛋白质的主要单元,其包括但不限于:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸(蛋氨酸)、脯氨酸、色氨酸、丝氨酸、酪氨 酸、半胱氨酸、苯丙氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸。
本发明所用氨基酸三字母代码和单字母代码如J.biol.chem,243,p3558(1968)中所述。氨基酸位点的编号方式有多种,如Kabat编号系统、EU编号系统、顺序编号等,在本发明中,氨基酸位点的编号方式采用“顺序编号”的方式进行,如本发明所述的“SEQ ID NO:2的位点3、8、14、15、17、110、111或173”是指SEQ ID NO:2的第3位氨基酸、第8位氨基酸,并依此类推;如本发明所述的“P3T”是指将SEQ ID NO:2的第3位氨基酸序列由之前的“P”突变为“T”,再如“L8P”是指将SEQ ID NO:2的第8位氨基酸序列由之前的“L”突变为“P”,并以此例类推。
作为一种可选择的实施方案,本发明提供的免疫球蛋白的恒定区可以引入一个或多个氨基酸的改变,如取代(即突变)、增加(即插入)或缺失(即删除)。
本发明中的术语“泰它西普”(或称“泰爱”,其在本发明中可以互换使用)是一种TACI-Fc融合蛋白,其INN名为Telitacicept,其氨基酸序列如SEQ ID NO:4所示,或参见https://extranet.who.int/soinn/mod/page/view.php?id=137&inn_n=10932所示。
本发明的TACI-Fc融合蛋白可以通过任意多种途径给药,其包括但不局限于:口服、静脉注射、肌肉内注射、动脉内注射、髓内注射、腹腔内注射、鞘内注射、心脑内、透皮、经皮肤、外用、皮下、鼻内、肠内、舌下、阴道内或直肠途经等多种途径。
本发明涉及的术语“治疗”与某给定的疾病或病症相关,包括但不限于:抑制该疾病或病症,例如阻止疾病或病症的发展;减轻该疾病或病症,例如导致该疾病或病症消退;或减轻该疾病或病症引起的症状,例如减轻、预防或治疗该疾病或病症的症状。
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下面实施例仅用于说明本发明,而不应视为限定本发明的范围。
实施例1泰它西普治疗干燥综合征的临床试验
1.研究方法
本研究是一项多中心、随机、双盲、安慰剂对照的Ⅱ期临床研究。受试者为确诊的、抗SSA抗体阳性的、原发性干燥综合征(pSS)患者,要求筛选期ESSDAI≥5分。试验阶段分为2个部分,筛选期和双盲治疗期。筛选期从-28天至-1天,符合入选标准而不符合排除标准的受试者按照1:1:1的比例随机分配至安慰剂组、泰它西普160mg组和泰它西普240mg组。双盲治疗期从第0天到168天(第24周),每周用药1次,共给药24次。
2.入选患者
符合2016年ACR/EULAR原发性干燥综合征分类标准,至少有眼干或口干症状其一的患者,即下列至少1项阳性:
·每日感到不能忍受的眼干,持续3个月以上;
·眼中反复砂砾感;
·每日需用人工泪液3次或3次以上;
·每日感到口干,持续3个月以上;
·吞咽干性食物时需要频繁饮水帮助;以及抗SSA抗体阳性;和ESSDAI≥5分。
3.评价标准
3.1疗效指标
3.1.1主要疗效指标
·第24周ESSDAI评分较基线的变化量。
3.1.2次要疗效指标
·第12周ESSDAI评分较基线的变化量;
·第12、24周ESSPRI评分较基线的变化量;
·第12、24周医生整体评估疾病活动相比基线的变化量;
·第12、24周患者整体评估疾病活动相比基线的变化量;
·第12、24周SF-36相比基线的变化量;
·第12、24周MFI-20相比基线的变化量;
·非刺激性全唾液(UWS)流速;
·5min时滤纸条被浸湿部分的前缘所对应的刻度;
·免疫学指标:IgG、IgA、IgM、补体(C3、C4)、B淋巴细胞总数(CD19+)、CD4+T细胞数、CD8+T细胞数。
3.2安全性评价
·不良事件;
·实验室检查;
·生命体征;
·胸部X线;
·心电图;
·免疫原性。
4.统计学方法
本研究采用SAS 9.4软件分析。所有统计检验均采用双侧检验,P值≤0.05被认为所检验的差异有统计意义。连续变量采用均值、标准差、中位数、最小值和最大值进行描述,计数和等级资料采用频数和百分比进行描述。
本研究有3个分析集:
·全分析集(FAS):全分析集指所有经随机化分组,至少使用一次试验药物的病例集合。
·符合方案集(PPS):符合方案集是由充分依从于试验方案的受试者所产生的数据集,依从性包括所接受的治疗、主要终点指标测量的可获得性以及对试验方案没有大的违背等。
·安全数据集(SS):至少接受一次治疗,且有安全性指标记录的实际数据。不良反应的发生率以安全集的病例数作为分母。
5.人口统计学和基线特征
本试验筛选57例患者,随机入组42例,30例完成24周试验观察,12例提前退出试验,最终42例纳入全分析集(FAS);30例纳入符合方案集(PPS);42例纳入安全数据集(SS)。其中安慰剂组FAS 14例,PPS 10例,SS 14例;160mg组FAS 14例,PPS 12例,SS 14例;240mg组FAS 14例,PPS 8例,SS 14例。
基线时240mg组(N=14)、160mg组(N=14)和安慰剂组(N=14)受试者的年龄、身高、体重、BMI、性别、民族、职业、婚姻状况、生育状况、吸烟史、药物过敏史、原发性干燥综合征病程、原发性干燥综合征诊断评分、原发性干燥综合征表现、原发性干燥综合征治疗史、生命体征、病毒学检查、甲状腺功能检查、免疫学指标、ESSDAI总分、研究者对疾病的整体评估、ESSPRI总分及各维度评分、受试者对疾病的整体评估、SF-36总分及各维度评分、MFI-20总分及各维度评分、自身抗体检查、BLyS浓度、APRIL浓度均具可比性(P>0.05)。
6.疗效结果
6.1主要疗效终点
本研究的主要疗效终点是第24周ESSDAI评分较基线的变化量,分析时采用重复测量混合效应模型(MMRM)比较组间差异,缺失数据不做填补。对FAS的分析结果显示,治疗后第24周ESSDAI评分较基线的变化值及其95%CI分别为:安慰剂组(N=14),-0.3[95%CI:-2.1~1.6];160mg组(N=14),-4.0[95%CI:-5.7~-2.3];240mg组(N=14),-3.1[95%CI:-5.2~-1.0],MMRM比较160mg组和安慰剂组组间差异有统计学意义(P=0.004),240mg组和慰剂组组间差异有统计学意义(P=0.044)。对PPS的分析结果显示,治疗后第24周ESSDAI评分较基线的变化值及其95%CI分别为:安慰剂组(N=10),-0.2[95%CI:-1.8~1.4];160mg组(N=12),-3.9[95%CI:-5.4~-2.5];240mg组(N=8),-3.1[95%CI:-4.8~-1.3],MMRM比较160mg组和安慰剂组组间差异有统计学意义(P<0.001),240mg组和安慰剂组组间差异有统计学意义(P=0.019)。
6.2次要疗效终点
6.2.1.第12周ESSDAI评分较基线的变化量
第12周ESSDAI评分较基线的变化量是本研究的次要疗效指标之一,分析时采用重复测量混合效应模型(MMRM)比较组间差异,缺失数据不做填补。对FAS的分析结果显示,治疗后第12周ESSDAI评分较基 线的变化值及其95%CI分别为:安慰剂组(N=14),0.7[95%CI:-1.0~2.4];160mg组(N=14),-3.8[95%CI:-5.5~-2.1];240mg组(N=14),-2.5[95%CI:-4.3~-0.6],MMRM比较160mg组和安慰剂组组间差异有统计学意义(P<0.001),240mg组和安慰剂组组间差异有统计学意义(P=0.013)。对PPS的分析结果显示,治疗后第12周ESSDAI评分较基线的变化值及其95%CI分别为:安慰剂组(N=10),-0.5[95%CI:-2.1~1.1];160mg组(N=12),-3.8[95%CI:-5.2~-2.3];240mg组(N=8),-2.9[95%CI:-4.7~-1.2],MMRM比较160mg组和安慰剂组组间差异有统计学意义(P=0.003),240mg组和安慰剂组组间差异有统计学意义(P=0.045)。
6.2.9.免疫学指标
免疫学指标包括:IgG、IgA、IgM、补体(C3、C4)、B淋巴细胞总数(CD19+)、CD4+T细胞数、CD8+T细胞数。治疗后免疫学指标相比基线的变化采用方差分析比较组间差异。当方差分析的P≤0.05时,采用LSD-t检验进行组间两两比较。采用FAS中实际数据进行分析。
与安慰剂组相比,从第4周开始,泰它西普治疗组IgG、IgA、IgM水平显著下降,持续至第24周。第24周时,安慰剂组、160mg组、240mg组IgG水平相较于基线的变化率分别为:1.02±21.855、-23.91±10.199、-28.40±11.219,160mg组和安慰剂组组间差异有统计学意义(P<0.001),240mg组和安慰剂组组间差异有统计学意义(P<0.001)。第24周时,安慰剂组、160mg组、240mg组IgA水平相较于基线的变化率分别为:-1.29±14.749、-47.55±8.790、-49.18±11.294,160mg组和安慰剂组组间差异有统计学意义(P<0.001),240mg组和安慰剂组组间差异有统计学意义(P<0.001)。第24周时,安慰剂组、160mg组、240mg组IgM水平相较于基线的变化率分别为:-7.87±19.062、-55.74±11.010、-61.61±8.692,160mg组和安慰剂组组间差异有统计学意义(P<0.001),240mg组和安慰剂组组间差异有统计学意义(P<0.001)。各组IgG、IgA、IgM水平相比基线变化率的历时性分析见图1-图3所示。
与安慰剂组相比,泰它西普治疗组CD19+B细胞数呈明显的下降趋势。第24周时,安慰剂组、160mg组、240mg组CD19+B细胞数相较于基线的变化率分别为:6.31±32.826、-29.26±44.698、-39.36±37.836,160mg组和安慰剂组组间差异有统计学意义(P=0.044),240mg组和安慰剂组组间差异有统计学意义(P=0.021)。各组CD19+B细胞数相比基线变 化率的历时性分析见图4-6。
6.3安全性结果
仅安慰剂组1例受试者发生严重不良事件,表现为低蛋白血症、带状疱疹、肺结核、感染性肺炎、干燥综合征病情加重,经治疗后缓解。
仅240mg组2例受试者出现重度及以上(CTCAE 3-5级)不良事件,分别为急性肾盂肾炎和白细胞减少症。
6.4结论
与安慰剂组相比,泰它西普治疗显著改善pSS患者第24周时的ESSDAI评分和MF-20评分;泰它西普在pSS患者中表现出较好的安全性。
以上描述地仅是优选实施方案,其只作为示例而不限制实施本发明所必需特征的组合。所提供的标题并不意指限制本发明的多种实施方案。术语例如“包含”、“含”和“包括”不意在限制。此外,除非另有说明,没有数词修饰时包括复数形式,以及“或”、“或者”意指“和/或”。除非本文另有定义,本文使用的所有技术和科学术语的意思与本领域技术人员通常理解的相同。
本申请中提及的所有公开物和专利通过引用方式并入本文,不脱离本发明的范围和精神,本发明所描述的方法和组合物的多种修饰和变体对于本领域技术人员是显而易见的。虽然通过具体的优选实施方式描述了本发明,但是应该理解所要求保护的本发明不应该被不适当地局限于这些具体实施方式。事实上,那些对于相关领域技术人员而言显而易见的用于实施本发明的所描述的模式的多种变体意在包括在随附的权利要求的范围内。
- 用TACI-Fc融合蛋白治疗IgA肾病的方法
- TACI-Fc融合蛋白用于制备治疗视神经脊髓炎谱系疾病和多发性硬化之药物中的应用
