一种白果蛋白与乳清蛋白的复合凝胶及其制备方法与应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明属于功能食品领域,涉及一种白果蛋白与乳清蛋白的复合凝胶及其制备方法与应用。
技术背景
银杏是现存种子植物中最为古老的孑遗植物,起源于中国,其种子和叶子含有银杏内酯、三萜类生物活性物质,因此具有很高的药用和食用价值。银杏种实的核俗称白果,其核仁为可食用部分,与银杏叶相比,银杏种子作为食物和药物使用的历史更为悠久。研究表明,银杏种子中含有9%-13%的粗蛋白质、3.69%-5.70%的脂肪、35%-72.6%的碳水化合物和一些具有良好生物活性的植物成分。虽然银杏种子中的蛋白质含量不高,但氨基酸组成多样,属于优质蛋白质。白果蛋白中90%为白蛋白和球蛋白,能够清除自由基的活性,具有很好的抗氧化性。然而,白果蛋白功能性差,特别是其凝胶功能性,限制了其在食品工业中的应用。
乳清蛋白是奶酪生产中的天然副产品,曾因为使用有限被认为是环境污染物。乳清分离蛋白主要由60-70%的β-乳球蛋白、α-乳清蛋白和牛血清白蛋白组成。乳清分离蛋白具有很高的营养价值和生物活性,由于其优异的功能特性,广泛用于改善食品的加工特性。然而,乳清分离蛋白的生产需要更多的温室气体排放和更大的土地面积需求,摄入过多动物蛋白更易导致心血管等疾病,因此在许多生产中会使用植物蛋白部分替代食品配方中的动物蛋白。过去的研究发现,单独的植物蛋白功能性质较为单一且具有一定的局限性,因此可以通过多种蛋白复合的处理,来提升植物蛋白凝胶的功能和使用范围。大量实验证明,动物蛋白和植物蛋白的营养价值高于单一蛋白质产品。
在食品生产领域,固体或半固体的形式便于包装、运输和储存。蛋白质凝胶在食品工业中有着广泛的应用,此方法将动物与植物蛋白混合,调节pH可以影响复合蛋白间的相互作用,导致其结构的改变,从而影响复合蛋白的凝胶性。与传统的蛋白-多糖复合凝聚体系不同,动物与植物两种蛋白质间的复合凝聚体系展现出了独特的凝胶、乳化、配体结合等功能特性,这也使得其在食品领域具有独特的优势。在热致凝胶过程中,弹性模量会随着蛋白分子热变性程度的増加而逐渐上升,在随后持续加热过程中与更多的蛋白分子相结合形成凝胶网络结构,最后在冷却过程中凝胶的强度会逐渐增强,最终形成热不可逆的凝胶结构。在这个过程中蛋白与蛋白之间的相互作用包括二硫键、静电相互作用、疏水相互作用和氢键等,通过这种方法复配白果蛋白和乳清蛋白,在凝胶性上产生协同作用从而改善产品的质地和感官特性,就能更好地拓宽两种蛋白的利用途径。
发明内容
发明目的:为了解决现有技术存在的技术问题,本发明旨在提供一种在不同pH下具有多样的凝胶特性,兼具质地硬度与弹性黏度,且富有营养,可以满足不同人群的食用需求的白果蛋白与乳清蛋白的复合凝胶,并且本发明还提供了该复合凝胶的制备方法与应用。
技术方案:本发明所述的白果蛋白与乳清蛋白的复合凝胶由白果分离蛋白和乳清分离蛋白经热诱导处理形成。
进一步地,所述白果分离蛋白和乳清分离蛋白的质量比为1:0.5-1,优选为1:1。
进一步地,所述热诱导处理的条件为:水浴80-90℃,20-40分钟。
本发明所述的白果蛋白与乳清蛋白的复合凝胶的制备方法包括以下步骤:
(1)配制白果分离蛋白储备液;
(2)配制乳清分离蛋白储备液;
(3)将白果分离蛋白储备液和乳清分离蛋白储备液混合,调节pH后,热诱导处理,结束后于低温下储存后形成白果蛋白与乳清蛋白的复合凝胶。
进一步地,步骤(1)中,所述白果分离蛋白的制备方法为:将未处理的白果剥壳,去掉种皮后烘干,磨碎成粉后过筛;将过筛后的白果粉与正己烷混合,低温搅拌后脱脂处理;将得到的脱脂白果粉通风晾干后采用碱溶酸沉的方法,提取出白果分离蛋白,低温保存。
进一步地,上述白果分离蛋白的制备方法具体为:
(a)前处理:将未处理的白果剥壳,去掉种皮后在40-45℃烘箱中4天以上直至烘干,磨碎成粉后,过80目筛;
(b)脱脂处理:将过筛后的白果粉与正己烷按质量体积比1:9(kg/L)的比例,在转速300-600rpm下低温搅拌,脱脂2-3次;将得到的脱脂粉置于通风橱中晾干后收集备用;
(c)碱溶处理:将脱脂粉与蒸馏水按质量体积比1:10(kg/L)的比例混合,用1MNaOH将溶液pH调整至9.0,室温搅拌30-40分钟后,使用离心机在2-4℃、10000g转速下离心15-30分钟,回收上清液;
(d)酸沉处理:将回收的上清液用1M HCl调整pH至4.4,在4℃、10000g转速下离心15-30分钟,取沉淀分散于去离子水中,用1MNaOH调整pH至7.0,将溶液冷冻干燥后得到白果分离蛋白粉末,置于2-4℃下保存。
进一步地,步骤(1)中,所述白果分离蛋白储备液的配制方法为:将白果分离蛋白粉末溶于水中,搅拌3-6小时后于冰箱中静置水化12-24小时。
进一步地,步骤(2)中,所述乳清分离蛋白储备液的配制方法为:将乳清分离蛋白粉溶于水中,搅拌3-6小时后于冰箱中静置水化12-24小时。
进一步地,步骤(1)中,所述白果分离蛋白储备液的浓度为110-130g/L,优选为120g/L;步骤(2)中,所述乳清分离蛋白储备液的浓度为110-130g/L,优选为120g/L。
进一步地,步骤(3)中,所述调节pH的范围为:3.0-8.0,优选为3.0、4.0、4.4、5.0、5.2、6.0、7.0或8.0;热诱导后低温储存的条件为:2-4℃,12-24小时。
本发明所述的白果蛋白与乳清蛋白的复合凝胶在食品加工中的应用。
发明原理:蛋白质之间的相互作用对加工食品的质构特性有很大的影响,不同种类的蛋白质组成、氨基酸序列、空间结构、表面疏水性、静电荷及其分布均不相同,因此在凝胶的形成中,不同的相互作用会导致复合蛋白凝胶结构及稳定性的差异。不同的pH影响蛋白间的非共价相互作用,在凝胶化过程中,不同种类的蛋白质是否共聚合取决于他们能否形成二硫键、疏水相互作用、氢键或静电相互作用的强交联。因此,不同pH下的白果分离蛋白和乳清分离蛋白的复合凝胶会形成不同的网络结构,表现出多样的质地和感官特性。
在本发明中,将白果分离蛋白与乳清分离蛋白进行复合,通过不同的pH来调节不同种类蛋白之间的相互作用,从而改变复合凝胶的质地和感官特性,包括蛋白溶解度、力学性能、水化性能和微观结构等,赋予复合凝胶营养的同时,也表现出多样化的质地特性,满足不同的食品加工需求,进而提高白果蛋白的利用价值。
有益效果:与现有技术相比,本发明具有以下显著优点:本发明提供了一种不同pH的白果蛋白与乳清蛋白的复合凝胶的制备方法,以本方法制备的复合凝胶在pH7.0和pH8.0时有较高的硬度和弹性,持水性强,蛋白溶解度高;在较低pH下凝胶硬度较弱,咀嚼性也较低,适合牙口不好的老年人及吞咽困难的特殊人群,本发明复合凝胶特性多样化,适合不同需求的人群食用,更利于投入食品生产中,提高了白果蛋白和乳清蛋白的利用价值。
附图说明
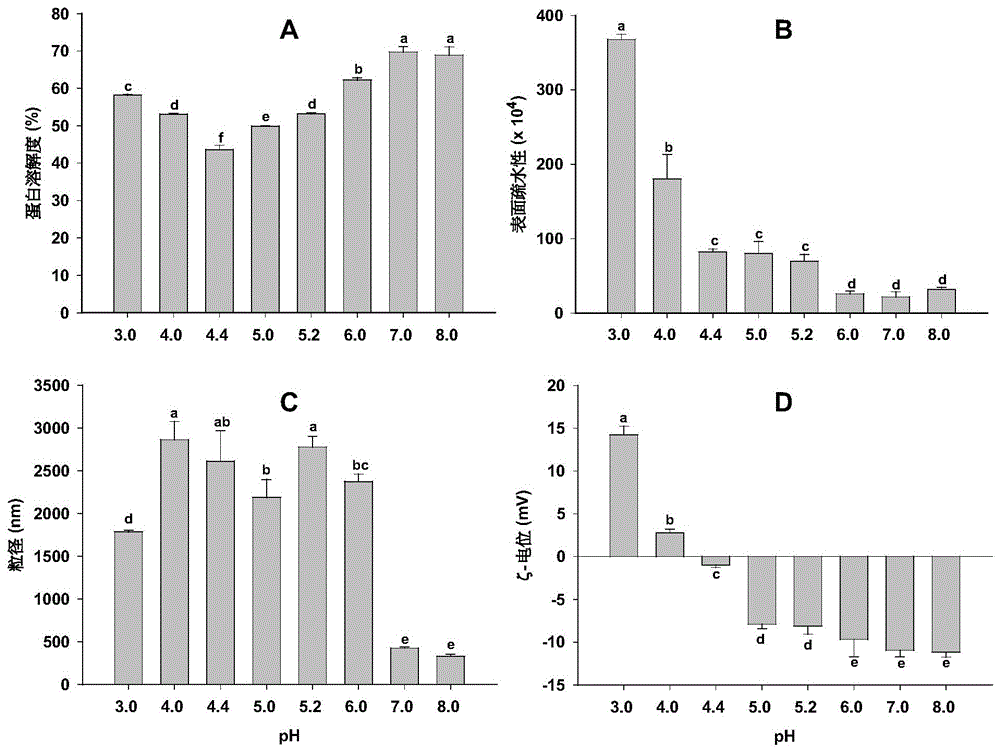
图1为本发明实施例1-实施例8制得的复合凝胶的性能图:(A)蛋白溶解度图;(B)表面疏水性图;(C)粒径图;(D)ζ-电位图;
图2为本发明实施例1-实施例8制得的复合凝胶的实物图;
图3为本发明实施例1-实施例8制得的复合凝胶的质地特性;
图4为本发明实施例1-实施例8制得的复合凝胶的持水性;
图5为本发明实施例1-实施例8制得的复合凝胶的扫描电镜示意图。
具体实施方式
下面,结合具体实施例和附图进一步对本发明进行说明。
实施例1:本发明所述的白果蛋白与乳清蛋白的复合凝胶由白果分离蛋白和乳清分离蛋白经热诱导形成,制备方法包括以下步骤:
(1)配制白果分离蛋白储备液:将新鲜未处理的白果剥壳,去掉种皮后在40℃烘箱中4天以上直至烘干,磨碎成粉后,过80目筛;将过筛后的白果粉与正己烷按质量体积比1:9(kg/L)的比例,在转速300rpm下低温搅拌,脱脂2-3次,将得到的脱脂粉置于通风橱中晾干后收集备用;将干燥后的脱脂粉与蒸馏水按质量体积比1:10(kg/L)的比例混合,用1M NaOH将溶液pH调整至9.0,室温搅拌30分钟后,使用离心机在4℃、10000g转速下离心15分钟,回收上清液;将回收的上清液用1M HCl调整pH至4.4,在4℃、10000g转速下离心15分钟,取沉淀分散于水中,用1M NaOH调整pH至7.0。将溶液冷冻干燥后得到白果粉末,置于4℃下保存;将上述白果分离蛋白粉溶于水中,搅拌4小时后于冰箱中静置水化12小时,得到浓度为120g/L的白果分离蛋白储备液;
(2)配制乳清分离蛋白储备液:将乳清分离蛋白粉溶于水中,搅拌4小时后于冰箱中静置水化12小时,得到浓度为120g/L的乳清分离蛋白储备液;
(3)将静置过夜的白果蛋白溶液与乳清蛋白溶液以体积1:1的比例混合,搅拌1小时直至均匀;将混合均匀后的复合溶液pH调节到3.0,继续搅拌2小时,结束后置于90℃水浴锅中加热30分钟,进行热诱导成胶处理,而后取出冷却到室温,放置于4℃冰箱,低温储存12小时。
实施例2:与实施例1的不同之处在于,步骤(3)中,所述混合溶液的pH调节到4.0。
实施例3:与实施例1的不同之处在于,步骤(3)中,所述混合溶液的pH调节到4.4。
实施例4:与实施例1的不同之处在于,步骤(3)中,所述混合溶液的pH调节到5.0。
实施例5:与实施例1的不同之处在于,步骤(3)中,所述混合溶液的pH调节到5.2。
实施例6:与实施例1的不同之处在于,步骤(3)中,所述混合溶液的pH调节到6.0。
实施例7:与实施例1的不同之处在于,步骤(3)中,所述混合溶液的pH调节到7.0。
实施例8:与实施例1的不同之处在于,步骤(3)中,所述混合溶液的pH调节到8.0。
对比例1:与实施例1的区别在于,步骤(2)和(3)中,将白果分离蛋白粉溶于水中,搅拌4小时后于冰箱中静置水化12小时,得到浓度为120g/L的白果分离蛋白储备液,将溶液pH调节到3.0。继续搅拌2小时,结束后置于90℃水浴锅中加热30分钟,进行热诱导成胶处理,而后取出冷却到室温,放置于4℃冰箱,低温储存12小时。
对比例2:与对比例1的不同之处在于,所述pH调节到5.0。
对比例3:与对比例1的不同之处在于,所述pH调节到6.0。
对比例4:与对比例1的不同之处在于,所述pH调节到7.0。
对比例5:与对比例1的不同之处在于,所述pH调节到8.0。
实施例9:对实施例1-实施例8制得的材料进行性能测定,包括:
(1)溶解度的测定
不同pH的白果分离蛋白和乳清分离蛋白复合凝胶用相应pH的柠檬酸磷酸盐缓冲液稀释至10mg/mL。在5000g,22℃的条件下离心10分钟后,采用双缩脲试剂测定上清液中的蛋白质浓度。蛋白质溶解度表示为上清液中的蛋白质浓度(mg/mL)占初始总蛋白浓度(10mg/mL)的百分比例。
(2)蛋白表面疏水性测定
用1-苯氨基萘-8-磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)作为荧光探针,对不同pH下的白果分离蛋白、乳清分离蛋白复合溶胶的表面疏水性进行测定。将各复合溶胶样品稀释至0.01、0.02、0.03、0.04和0.05mg/mL。随后将20μL ANS溶液与2mL稀释的样品溶液充分混合,在黑暗中反应15分钟。使用荧光分光光度计,在365nm的激发波长和484nm的发射波长下测定荧光强度。表面疏水性用荧光强度和蛋白质浓度之间线性回归的初始斜率来表示。
(3)蛋白溶胶粒径和ζ-电位测定
分析前将待测的样品溶液稀释到2mg/mL,避免高浓度引起多重散射。粒径分布主要基于动态光散射,使用粒径电位仪测量粒度,上样量为1mL,折射率和吸收参数分别设置为1.33和0.1。
(4)凝胶外观:将凝胶样品从烧杯中取出,置于黑色幕布前,从上方和侧面两个角度进行拍照。
(5)通过质构仪两次下压的模式测定复合凝胶的质地特性,选用P/0.5圆柱型探头。分别设置探头测试前、测试中及测试后的速率为1.0、2.0和5.0mm/s;下压距离为7.0mm,触发力为5.0g。凝胶质地以Bourne定义计算,主要包括复合凝胶的硬度、弹性、黏聚性、胶黏性、咀嚼性和回复性。
(6)取适量复合凝胶(5.0g)于含滤纸的离心管中,在3000g下离心20分钟,接着记下离心后的凝胶质量。持水性(WHC)按下式计算:
WHC(%)=(m
式中:m
(7)通过Quanta-200扫描电子显微镜,在20kV的电子加速电压下观察不同pH下的白果分离蛋白和乳清蛋白的复合凝胶的微观结构,在5μm的尺度范围内进行观察。在分析之前固定凝胶的横截面,进行喷金处理。
上述测定结果如图1-图5所示。
如图1(A)所示,蛋白质溶解度受pH值的影响,在pH4.4时溶解度最低,为43.6%,随着pH从4.4增加到7.0,白果分离蛋白/乳清分离蛋白的溶解度从43.6%增加到69.7%。
如图1(B)所示,随着pH值从3.0升高至8.0,复合溶胶的表面疏水性从367×10
如图1(C)所示,在pH7.0和8.0时,粒径大小分别为424nm和329nm,粒径明显小于其他pH值时。而在较低pH值下时,弱的静电斥力诱导蛋白质分子形成颗粒尺寸明显较大的聚集体,粒径尺寸在1750-2860nm之间。
如图1(D)所示,在pH4.4时,ζ-电位为-0.98mV,绝对值最小。在pH低于等电点时,蛋白质携带净正电荷;pH高于等电点时,蛋白质携带净负电荷,带电量不断增加至11.15mV。
如图2所示,在pH值为4.4到6.0范围内得到白色不透明凝胶,形状完整,表面有较多气孔。在其他pH值下的样品形成半透明的黄色凝胶,pH越大,凝胶表面气孔越少。pH值为3.0、4.0的凝胶不能保持其形状,而pH值为8.0的凝胶更具胶黏性。
如图3所示,复合凝胶在pH值为3.0到5.2范围内保持较低的硬度,在pH值为4.0时硬度最低,为17g。随着pH的进一步增加,凝胶硬度急剧增加,在pH值为7.0时达到峰值205g,提升了11倍。当pH达到8.0时硬度又下降至118g。胶黏性和咀嚼性的变化与硬度对pH值变化高度相关,呈现出相同的趋势。复合凝胶的弹性随pH的增加,整体呈现上升趋势,从0.521(pH值为3.0)增加到0.989(pH值为8.0)。复合凝胶在pH 3.0到5.2范围内回复性较差,最低为0.038(pH值为4.0),在更高pH值下凝胶回复性更好,最高可达0.478(pH值为8.0)。黏聚性是描述凝胶在连续两次变形期间保持其整体网络结构的能力的一种参数,在pH值为5.2和8.0之间有更渐进的增长,从0.34增长至0.77。总体而言,pH对白果分离蛋白/乳清分离蛋白质地特性影响较大,在pH值为7.0时,凝胶硬度最大。
如图4所示,pH值为3.0和pH值为8.0时凝胶的持水性最高,分别为97.5%和95.6%。当pH值接近蛋白质的等电点时,蛋白质形成的颗粒状凝胶,持水性下降,颗粒凝胶具有更大的孔径,这导致毛细管力更弱地捕获水。随着pH值远离等电点,蛋白质净电荷的增加也为水分子提供了更多的结合位点。
如图5所示,在pH值为3.0、7.0和8.0时,蛋白质分子结构展开,形成表面光滑的精细三维凝胶网络。所形成的细链凝胶的小孔径增大了蛋白质与水分子的相对接触面积。pH值在等电点附近时,白果分离蛋白/乳清分离蛋白在pH值为4.0到pH值为6.0之间,观察到颗粒状凝胶,由粗聚集的球形颗粒组成,孔隙大。
实施例10:同实施例9的测定方法,对对比例1-对比例5制得的材料进行质构性能测定,其结果如下表1所示。由表1可知,白果分离蛋白/乳清分离蛋白复合凝胶的质构严重依赖于pH值。在白果分离蛋白等电点处,其凝胶度极大;而远离蛋白等电点时,则凝胶性能显著下降,甚至无法成胶(比如:在pH 8.0时),这归结于蛋白分子间静电相作用过于强烈。与实施例1-9相比,白果分离蛋白单独缩成凝胶性能显著低于其与乳清分离蛋白复合凝胶性能。
表1对比例1-对比例5制得材料的质构性能汇总表
- 一种基于局域网通信的3D打印系统、控制方法和3D打印机
- 一种基于AI系统的保险标的远程估价方法
- 一种基于AI系统的银行取证方法
- 一种基于智慧农村AI系统的灾害识别方法
- 一种基于智慧农村AI系统的农产品溯源方法
- 一种基于AI的骨科3D打印方法及系统
- 一种基于AI的骨科3D打印方法和装置
