心脏瓣膜假体
文献发布时间:2023-06-19 10:44:55
本发明专利申请是国际申请号为PCT/US2016/055585,国际申请日为2016年10月5日,进入中国国家阶段的申请号为201680058947.5,名称为“心脏瓣膜假体”的发明专利申请的分案申请。
技术领域
本发明的技术大体上涉及心脏瓣膜假体及相关方法。具体而言,几个实施例涉及用于例如二尖瓣的天然心脏瓣膜的经皮置换的经导管心脏瓣膜装置。
背景技术
人的心脏是一个四腔肌肉器官,在心动周期内提供全身血液循环。四个主要腔室包括右心房和提供肺循环的右心室,以及左心房和将从肺接收的含氧血提供给身体其余部分的左心室。为确保血液沿心脏一个方向流动,房室瓣(三尖瓣和二尖瓣)存在于心房和心室的连接处,半月瓣(肺动脉瓣和主动脉瓣)控制心室通向肺部和身体的其余部分的出口。这些瓣膜含有瓣叶,这些瓣叶响应于由心室的收缩和舒张引起的血压变化继而打开和关闭。瓣叶彼此分开以打开并允许血液在瓣膜下游流动,并且彼此接合以闭合并防止逆流而上方式的回流或反流。
与心脏瓣膜相关的疾病,例如由损伤或缺陷引起的疾病,可包括狭窄和瓣膜功能不全或反流。例如,瓣膜狭窄导致防止血液流向下游心室的瓣膜变窄并变硬,以出现适当的流速并导致心脏更加努力工作以泵送血液通过患病瓣膜。当瓣膜不完全闭合时会出现瓣膜功能不全或反流,使血液倒流,从而导致心脏效率降低。先天性的、与年龄相关的、药物诱导的或在某些情况下由感染引起的患病瓣膜或受损瓣膜可能导致失去弹性和效率的心脏扩大、增厚。心脏瓣膜疾病的一些症状包括虚弱、呼吸急促、头晕、昏厥、心悸、贫血和水肿,以及增加中风或肺栓塞可能性的血凝块。症状往往严重到足以使人衰弱和/或危及生命。
人工心脏瓣膜已被开发用于修复和置换患病和/或受损的心脏瓣膜。这种瓣膜可以通过基于导管的系统经皮递送并在患病心脏瓣膜的部位展开。这种人工心脏瓣膜可以在低轮廓或压缩/收缩的布置中递送,使得人工瓣膜可以容纳在输送导管的护套组件内并推进穿过患者的脉管系统。一旦定位在治疗部位,人工瓣膜可被扩张以接合患病心脏瓣膜区域处的组织,从而例如将人工瓣膜保持在适当位置。尽管这些人工瓣膜提供了用于心脏瓣膜修复和/或置换的微创方法,但提供防止植入的人工瓣膜和周围组织之间的泄漏(瓣周漏)以及防止心动周期可能发生的人工瓣膜的移动和/或迁移的这样一种人工瓣膜,仍然存在挑战。例如,二尖瓣存在许多挑战,例如由于存在腱索(chordae tendinae)和残余瓣叶而导致的人工瓣膜变位或不当布置,导致瓣膜的冲击。另外的挑战可以包括提供人工瓣膜以抵抗在受到天然解剖结构赋予的扭曲力和在心动周期可能发生的各种部件的过早失效。与二尖瓣治疗相关的进一步解剖学挑战包括提供适应椭圆形或肾形的人工瓣膜。此外,肾形二尖瓣环仅沿着瓣膜的外壁具有肌肉,该瓣膜仅具有分隔二尖瓣和主动脉瓣的薄的血管壁。这种解剖肌肉分布,以及左心室收缩时所经受的高压,对于二尖瓣假体可能是有问题的。
发明内容
本发明的实施例涉及心脏瓣膜假体及其经皮植入的方法。心脏瓣膜假体具有压缩构型(compressed configuration),用于经由脉管系统或其他体腔递送至患者的天然心脏瓣膜;以及扩张构型(expanded configuration),用于在天然心脏瓣膜内展开。在一个实施例中,心脏瓣膜假体可以包括:框架,该框架具有瓣膜支持结构,该支持结构被配置为将人工瓣膜组件保持在其中;以及多个支撑臂,该支撑臂从瓣膜支持结构延伸使得当心脏瓣膜假体处于扩张构型时多个支撑臂被配置为朝向瓣膜支持结构的第一端延伸以接合天然心脏瓣膜的子环表面(subannular surface)。该多个支撑臂中的一个或多个支撑臂包括曲线形支撑臂,该曲线形支撑臂形成为具有相对的第一弧形区域和第二弧形区域,通过在其间延伸的直线区域纵向分隔该第一弧形区域和第二弧形区域,其中该第一弧形区域形成为朝向瓣膜支持结构靠近其下游部分,该直线区域形成为在连接该第一弧形区域和该第二弧形区域时朝向该瓣膜支持结构倾斜,该第二弧形区域形成为弯曲远离该瓣膜支持结构靠近其上游部分。
在另一个实施例中,用于植入在心脏的天然瓣膜区域的心脏瓣膜假体包括瓣膜支持结构,具有上游部分和下游部分,瓣膜支持结构被配置为将人工瓣膜组件保持在其中并具有从瓣膜支持结构的下游部分延伸的多个支撑臂。当心脏瓣膜假体处于扩张构型时,每个支撑臂被配置为从下游部分朝向上游部分延伸并且具有曲线形状,其包括具有第一曲率半径的第一弯曲区域、具有第二曲率半径的第二弯曲区域以及在第一弯曲区域和第二弯曲区域之间延伸的伸长区域。在这种支撑臂中,曲线形状被配置为吸收由天然瓣膜区域施加在其上的扭曲力。
在另一个实施例中,公开了一种用于治疗患者的天然二尖瓣的心脏瓣膜假体。该心脏瓣膜假体包括具有上游部分、下游部分和第一截面尺寸的圆柱形支持结构,其中该圆柱形支持结构被配置为保持抑制逆行血流的人工瓣膜组件。多个S形支撑臂从圆柱形支持结构的下游部分延伸,使得当心脏瓣膜假体处于扩张构型时,S形支撑臂被配置为在上游方向延伸以将心脏组织接合到天然二尖瓣的瓣环(annulus)之上或其下方。径向延伸段从圆柱形支持结构的上游部分延伸并且具有大于第一截面尺寸的第二截面尺寸。径向延伸段(radially-extending segment)被配置为将心脏组织接合到天然二尖瓣之上或其上方,使得当心脏瓣膜假体处于扩张构型并在天然二尖瓣展开时,该瓣环定位在S形支撑臂的上游弯曲段和径向延伸段之间。
附图说明
本发明的上述和其他的特征和方面可以从实施例的以下描述以及附图中所示更好地理解。附图在此并入本文并构成说明书的一部分,进一步用于说明本技术的原理。附图中的部件不一定按比例绘制。
图1是具有天然瓣膜结构的哺乳动物心脏的示意性截面图。
图2A是显示解剖结构和天然二尖瓣的哺乳动物心脏的左心室的示意性截面图。
图2B是具有脱垂的二尖瓣的心脏的左心室的示意性截面图,其中瓣叶不充分地接合并且适于用根据本技术的人工心脏瓣膜的各种实施例进行置换。
图3是与周围心脏结构隔离并显示瓣环和天然瓣叶的二尖瓣的顶面观的示意图。
图4A是根据本技术的实施例的处于展开或扩张构型(例如,展开状态)的心脏瓣膜假体的侧视图。
图4B是根据本技术的实施例的图4A的心脏瓣膜假体的俯视图。
图4C是沿图4A线4C-4C截取的并根据本技术的实施例的心脏瓣膜假体的俯视图。
图5A示出了心脏的剖视图,其显示根据本技术的实施例的植入在自然二尖瓣处的心脏瓣膜假体的局部侧视图。
图5B是根据本技术的实施例的展开构型(例如,展开状态)所示的图5A的心脏瓣膜假体的放大截面图。
图5C是根据本技术的另一实施例的展开构型(例如,展开状态)所示的心脏瓣膜假体的一部分的放大截面图。
图6A-6C是根据本技术的额外实施例的各种支撑臂构型的侧视图。
图7是心脏瓣膜假体的局部侧视图,其示出根据本技术的实施例的在支撑臂上的多个柔性区域。
图8A-8H是根据本技术的其他实施例的响应于扭曲力而弯曲的各种支撑臂的侧视图。
图9是根据本技术的实施例的处于递送构型(例如低轮廓(low profile)或径向压缩状态)所示的图5A-5B中的心脏瓣膜假体的放大截面图。
图10是心脏的截面图,其说明根据本技术的另一实施例的使用经中隔方法植入心脏瓣膜假体的方法的步骤。
具体实施方式
下文参考附图描述本技术的具体实施方式,其中相似的附图标记表明相同或功能上相似的部件。术语“远端”和“近端”在以下关于相对于治疗临床医生或关于人工心脏瓣膜装置的位置或方向描述中使用。例如,“远端的”或“远端地”是当提及递送程序或沿着脉管系统时远离临床医生或在远离临床医生方向的位置。同样地,“近端的”或“近端地”是靠近临床医生或在朝向临床医生方向的位置。相对于人工心脏瓣膜装置,术语“近端”和“远端”可以指相对于血液流动方向该装置的多个部分位置。例如,近端可以指上游位置或血液流入位置,并且远端可以指下游位置或血液流出位置。
以下详细描述本质上仅仅是示例性的,并非旨在限制本技术或本申请及本技术的应用。虽然本发明的实施例的描述是在对心脏瓣膜尤其是二尖瓣的治疗的背景下进行的,但是本技术还可以用在被认为有用的任何其他身体通道中。此外,在前述技术领域、背景技术、发明内容或以下详细描述中呈现的任何明示或暗示的理论中没有受约束的意图。
如本文所述的本技术的实施例可以以许多方式组合以治疗身体的许多瓣膜中的一个或多个瓣膜,包括心脏瓣膜,例如二尖瓣。本技术的实施例可以与许多已知的手术和步骤在治疗上结合,例如,这样的实施例可以与已知的进入心脏瓣膜(例如具有顺行或逆行入路的二尖瓣)的方法及其组合相结合。
图1是描述四个心脏腔室(右心房RA、右心室RV、左心房LA、左心室LV)和天然瓣膜结构(三尖瓣TV、二尖瓣MV、肺动脉瓣PV、主动脉瓣AV)的哺乳动物心脏10的示意性截面图。图2A是哺乳动物心脏10的左心室LV的示意性截面图,显示解剖结构和天然二尖瓣MV。同时参照图1和图2A,心脏10包括左心房LA,通过肺静脉接收来自肺部的含氧血液。在心室舒张期间,左心房LA泵送含氧血液通过二尖瓣MV并进入左心室LV。心脏收缩期间左心室LV收缩并且血液向外流过主动脉瓣AV,进入主动脉和身体的其余部分。
在健康的心脏中,二尖瓣MV的瓣叶LF在自由边缘处均匀会合或“接合”以在左心室LV收缩期间关闭并防止血液回流(图2A)。参考图2A,瓣叶LF经由称为瓣环(annulus)AN的结缔组织的纤维环附着周围心脏结构。二尖瓣瓣叶LF的柔性瓣叶组织与乳头肌PM连接,该乳头肌PM通过称为腱索CT的分支肌腱从左心室LV的下壁和室间隔IVS向上延伸。在具有瓣叶LF未充分接合或会合的脱垂二尖瓣MV的心脏10中,如图2B所示,将发生从左心室LV进入左心房LA的泄漏。几种结构缺陷可导致二尖瓣瓣叶LF脱垂和返流而发生包括腱索CT断裂、乳头肌PM损伤(例如,由于缺血性心脏病),以及心脏和/或二尖瓣环AN扩大(例如,心律失常)。
图3是与周围心脏结构隔离的二尖瓣MV的俯视图,并进一步示出了瓣叶LF和瓣环AN的形状和相对尺寸。正如所示,二尖瓣MV通常具有“D”形或肾形。二尖瓣MV包括前叶AL,其在闭合时在接合线处与后叶PL会合。当前叶AL和后叶PL不能会合时,在瓣叶AL、PL之间或在瓣叶之间的拐角的接合处(commissure)C可能发生返流。
根据本技术的人工心脏瓣膜装置和相关方法的实施例在本部分中参考图4A-10进行描述。应该理解的是,这里描述的实施例的特定部件、子结构、用途、优点和/或其它方面以及参考图4A-10,根据本技术的额外实施例可以适当地互换、替换或另外配置。
本发明提供了适用于在患者心脏中经皮递送并植入的人工心脏瓣膜的系统、装置和方法。在一些实施例中,呈现了用于通过人造或人工心脏瓣膜的微创植入来治疗瓣膜疾病的方法和装置。例如,根据本发明描述的实施例的人工心脏瓣膜装置可被植入以置换患者(例如如图2A所示的患有脱垂二尖瓣的患者)中患病或受损的天然二尖瓣或先前植入的人工二尖瓣。在进一步的实施例中,该装置适合于植入和置换其他患病或受损的心脏瓣膜或先前植入的人工心脏瓣膜,例如三尖瓣、肺和主动脉心脏瓣膜。
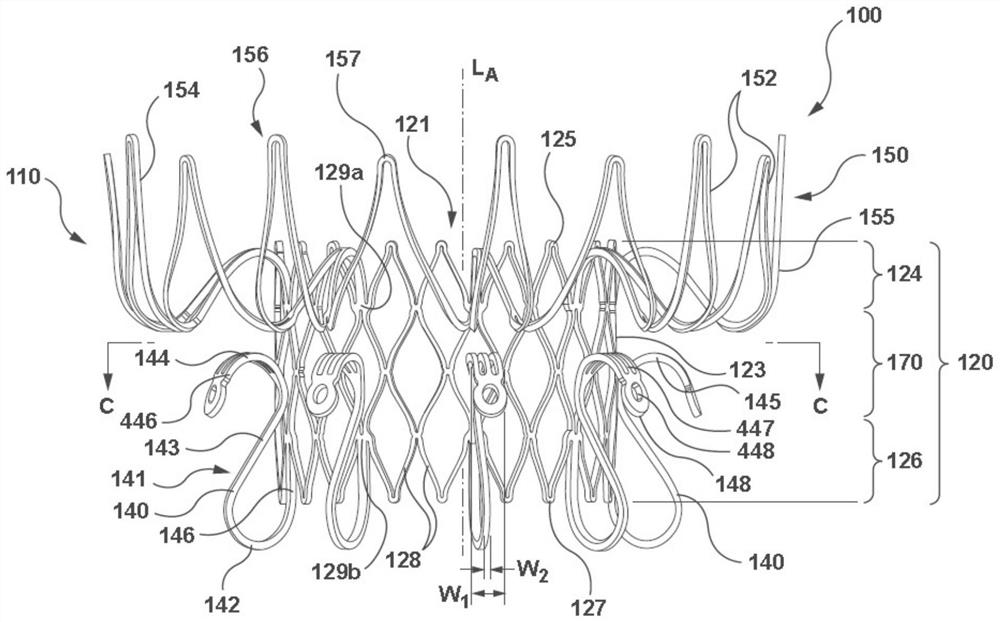
图4A是根据本技术的实施例的处于径向扩张或展开构型(例如展开状态)的心脏瓣膜假体或人工心脏瓣膜装置100的侧视图。图4B是如图4A和图4C中配置的心脏瓣膜假体100的俯视图。图4C是沿着图4A的线C-C截取的假体100的俯视图。参照图4A-4C所示,心脏瓣膜假体100包括框架或支架状支持结构110,其包括管状部分或结构性瓣膜支持结构120,其限定用于在其中保留、保持和/或固定人工瓣膜组件130的管腔121。瓣膜支持结构120通常可以是圆柱形的,其具有沿着瓣膜支持结构120的纵向轴线L
在一些实施例中,如图4A的径向扩张构型所示,框架110进一步包括径向延伸段或径向延伸部分150,其至少部分地围绕瓣膜支持结构120并从瓣膜支持结构120的上游部分124延伸。径向延伸段150可以包括多个自扩张支柱152,该多个自扩张支柱152被配置成当假体100展开至扩张构型时径向扩张。在一些布置中,径向延伸段150可以在植入天然二尖瓣膜空间内时接合到瓣环上或接合到瓣环上方的组织。在该实施例中,径向延伸段150可将瓣膜支持结构120保持在天然瓣膜区域内的期望位置(例如,天然瓣叶和二尖瓣的瓣环之间)。参考图4B所示,径向延伸段150和/或瓣膜支持结构120可以包括密封材料160,其可以围绕径向延伸段150的上表面或上游表面154或下表面或下游表面155(图4A)延伸和/或围绕瓣膜支持结构120的内壁122或外壁123延伸,以防止植入的假体100与天然心脏组织之间的血液泄漏(例如瓣周漏)。
参考图4B,示出了径向延伸段150和瓣膜支持结构120具有大致圆形的截面形状,其中径向延伸段150的截面尺寸D
图4A和4B示出了径向延伸段150,其具有多个支柱152,支柱152在瓣膜支持结构120的第一端125处从外壁123向外延伸。在一个实施例中,支柱152围绕瓣膜支持结构120的圆周相对均匀地布置,并且各个支柱152在冠部156处连接相邻的支柱152。在一个实施例中,冠部156具有防止损伤的顶端157,顶端157防止在展开和通过心动周期期间对心脏组织造成损伤。在美国专利公开号2015/0119982中描述了合适的径向延伸段150的示例,其全部内容通过引用合并于此。
再参照图4A和4C,多个支撑臂140从瓣膜支持结构120的下游部分126延伸,并且围绕瓣膜支持结构120的外壁123的圆周大致均匀地间隔开(图4C)。在未示出的可替代的布置中,支撑臂140可围绕圆周不均匀地间隔开、分组、不规则地间隔开等。在特定的实例中,支撑臂140可以更接近地分组在一起,并且在展开时大致与二尖瓣的前叶和后叶对齐的位置处从瓣膜支持结构120延伸。如图4C所示的实施例具有围绕瓣膜支持结构120的圆周均匀间隔开的十二个支撑臂140。在可替代的布置中,假体100可以包括少于12个支撑臂140,例如两个支撑臂,两个至六个支撑臂,多于六个支撑臂,九个支撑臂等,或多于十二个支撑臂140。
参考图4A,支撑臂140可以在第二端127处或第二端127附近从瓣膜支持结构120延伸,并且可以被描述为大致朝向上游部分124沿着瓣膜支持结构120的外壁123延伸或者平行于瓣膜支持结构120的外壁123延伸。如图所示,支撑臂140可以具有大致曲线形状141或类似的几何形状。曲线形状141包括相对的弧形或弯曲区域142,144,弧形或弯曲区域142,144通过在其间延伸的倾斜的伸长或直线区域143纵向分离。当被定位以用于天然二尖瓣时,曲线支撑臂140的弧形区域142可以被称为下游弯曲段142,并且曲线支撑臂140的弧形区域144可以被称为上游弯曲段144。
在一些实施例中,曲线形状141包括第一弧形(例如,弯曲)区域142,其被形成为朝向外壁123的方向弯曲以接合天然心脏瓣膜的至少一个瓣叶的一部分或心脏瓣膜区域中的其他结构,如腱索(chordae tendinae)。在一个实施例中,第一弧形区域142可围绕天然瓣膜瓣叶的下游边缘延伸。在支撑臂140的中间部分中,支撑臂包括直线区域143,该直线区域143被配置为接着第一弧形区域142并且在瓣膜支持结构120的中间或中央部分170处朝向外壁123的方向倾斜。在支撑臂140的靠近瓣膜支持结构120的第一端125的自由端部分、支撑臂140还包括沿曲线形状141接在直线或伸长区域143后的第二弧形(例如,弯曲)区域144,形成为在远离瓣膜支持结构120的外壁123的方向上弯曲并在植入时接合天然心脏瓣膜处或天然心脏瓣膜附近的组织。在一个特定的实例中,第二弧形区域144可以在无创伤的情况下接合子环组织和/或心脏腔室壁(例如,心室壁)的部分。参照图4A,在特定实施例中,第一弧形区域142通过直线或伸长区域143与第二弧形区域144纵向分离以形成或限定大致S形轮廓。
在如图4A和图4C所示的实施例中,每个支撑臂140上的第二弧形区域144提供或限定接触面或着陆区145,该接触面或着陆区145被配置为与组织以防止损伤方式接合在子环组织处或子环组织附近,从而抑制组织侵蚀和/或抵抗在心室收缩期间假体100在上游方向上的运动,下文要进一步描述。如图所示,第二弧形区域144包括形成着陆区145的加宽和/或平坦部分446。如图4A所示,加宽部分446具有大于支撑臂140的第一弧形区域142的宽度W
在本文描述的一些实施例中,为了在初始压缩构型(例如,在递送状态中,未示出)和展开构型(图4A)之间转换或自扩张,框架110由弹性或形状记忆材料如镍钛合金(例如,镍钛诺)形成,其具有机械记忆以恢复到展开或扩张构型。在一个实施例中,框架110可以是限定假体100、瓣膜支持结构120和多个支撑臂140的流入部分处的径向延伸段150的整体结构,并且如此描述的框架110可以由不锈钢、如镍钛合金或镍钛诺的伪弹性金属(pseudo-elastic metal),或所谓的超合金制成。在一些布置中,框架110可以被形成为整体结构,例如,来自激光切割、开窗的镍钛诺或其它金属管。机械记忆可以通过热处理赋予形成框架110的结构,以在不锈钢中实现弹簧回火,例如,或在敏感金属合金(例如镍钛诺)中设定形状记忆。框架110还可以包括聚合物或金属、聚合物或其他材料的组合。
在一个实施例中,框架110可以是具有按几何学布置的多个肋和/或支柱(例如,支柱128,152)的柔性金属框架或支撑结构,以提供能够用于递送至目标天然瓣膜部位的径向压缩(例如,在递送状态,未示出)且能够用于在目标天然瓣膜部位展开和植入的径向扩张(例如,达到图4A所示的径向扩张构型)的网格结构。参考如图4A所示的瓣膜支持结构120,肋和支柱128可布置成多个几何图案,其可扩张或弯曲和收缩,同时提供足够的弹性和强度用以保持在其内封装的人工瓣膜组件130的完整性。例如,支柱128可围绕纵向轴线L
在其他实施例中,框架110可以包括单独制造的部件,这些部件彼此对接、连接、焊接或以其他方式机械连接以形成框架110。例如,径向延伸段150可以对接到瓣膜支持结构的上游部分124(例如,在由瓣膜支持结构120的菱形几何形状限定的支柱128上的附接点129a处)。同样地,支撑臂140可以耦接到瓣膜支持结构120的下游部分126(例如,在由瓣膜支持结构120的菱形几何形状限定的支柱128上的附接点129b处)。可以想到其他布置和附接点用于将一个或多个支撑臂140和径向延伸段150对接到瓣膜支持结构120。在特定的实施例中,如图4A所示,支撑臂140可以经由臂柱146对接到瓣膜支持结构120。在一个实施例中,臂柱146可以与框架110成为一体,使得臂柱146是一个或多个支柱128的延伸。在另一个实施例中,臂柱146和瓣膜支持结构120可以通过例如焊接(soldering)、熔接(welding)、粘接(bonding)、铆钉或其他紧固件、机械联锁或其任何组合等各种本领域已知的方法对接。在一个实施例中,瓣膜支持结构120可以是球囊扩张管金属支架,并且框架110的径向延伸段150和支撑臂140可以由材料和方法形成,以便如上所述的自扩张。在与此相关的另一个实施例中,在不脱离本发明的范围的情况下,支撑臂140可以从瓣膜支持结构120的中间或中央部分170延伸或对接到瓣膜支持结构120的中间或中央部分170。
参考图4B-4C,人工瓣膜组件130可以对接到瓣膜支持结构120的内壁122上,用于控制通过心脏瓣膜假体100的血液流动。例如,假体瓣膜部件130可以包括多个瓣叶132(以132a-b单独示出),其接合并被配置为允许血液在下游方向(例如,从第一端125到第二端127)上流过假体100并且抑制血液在上游方向(例如,从第二端127到第一端125)上流过。尽管人工瓣膜组件130显示为具有二尖瓣布置,但应理解的是,人工瓣膜组件130可以具有三个瓣叶132(三尖瓣布置,未示出)或多于三个瓣叶132以便接合来闭合人工瓣膜组件130。在一个实施方案中,瓣叶132可以由牛心包膜(bovine pericardium)或其他天然材料(例如,从人或动物的心脏瓣膜、主动脉根部、主动脉壁、主动脉瓣叶、心包膜组织,例如心包贴片、旁路移植、血管、肠粘膜下层组织、脐带组织等获取)安装在瓣膜支持结构120的内壁122上。在另一个实施例中,适合用作瓣叶132的合成材料包括:
图5A是示出根据本技术的实施例的假体100植入心脏10的天然二尖瓣区域的局部侧视图的示意图。在图5A中示出的假体100,仅用于说明目的而仅具有两个支撑臂140。可以理解,假体100在一些布置中可以具有多于两个的支撑臂140,例如多于六个的支撑臂等等。通常,当植入时,瓣膜支持结构120的上游部分124被定向为接收来自第一心脏腔室(例如用于二尖瓣MV置换的左心房LA、用于主动脉瓣膜置换的左心室等)的血液流入,并且下游部分126被定向为释放血液流出至第二心脏腔室或结构(例如用于二尖瓣MV置换的左心室LV、用于主动脉瓣置换的主动脉)。
在操作中,心脏瓣膜假体100可以在径向压缩构型中(未示出)以及输送导管(未示出)内血管内地递送期望的至心脏10的天然瓣膜区域,例如二尖瓣MV附近。参考图5A,假体100可被推进到天然二尖瓣环AN内或其下游的位置处,其中瓣膜支持结构120的支撑臂140和下游部分126从输送导管释放。然后在天然二尖瓣MV内或其上游的位置处,输送导管可以释放瓣膜支持结构120的上游部分124和径向延伸段150,以便朝向径向扩张构型扩大并且在天然心脏瓣膜区域接合天然组织。一旦从输送导管释放,假体100就可定位成使得径向延伸段150驻留在左心房内并接合在上环区域处或其附近的组织。假体100进一步定位成使得支撑臂140接合天然瓣叶LF的面向外的表面以捕获支撑臂140与瓣膜支持结构120的外壁123之间的瓣叶。如在此进一步描述的,每个支撑臂140的接触面或着陆区145被配置为接合在子环组织处或其附近的组织,以便抵抗在心室收缩期间假体100在上游方向上的运动。
图5B是在径向扩张构型(例如,展开状态)中示出并且根据本技术的实施例的图5A的心脏瓣膜假体100的放大截面图。在图5B中,假体100被示意性地示出为位于图示右侧的二尖瓣MV处。当展开和植入时,心脏瓣膜假体100被配置为将保留或保持在瓣膜支持结构120内的人工瓣膜组件130定位于天然二尖瓣MV内的期望位置和取向。同时参照图5A和5B,假体100的几个特征提供了对假体100的运动的阻力、促进组织向内生长、最小化或防止瓣周漏和/或当植入径向扩张构型时使天然组织侵蚀最小化。例如,径向延伸段150可被定位成在二尖瓣上方的心房空间内扩张并且接合心房空间内的心脏组织。特别是,弓形或S形支柱152的至少下表面或顶端153可以提供用于接触上环组织的组织接合区域,例如以提供对瓣周漏的密封并且抑制假体100相对于天然瓣环的下游迁移。
在一些实施例中,上升到形成冠部156的支柱152的向上定向的唇部部分158可以提供进一步的组织接触区域,该组织接触区域可以进一步抑制假体100相对于天然瓣环的下游移动,并且抑制心动周期期间的摇摆或假体100在天然瓣膜内的左右旋转(side-to-side rotation),从而抑制瓣周漏并确保人工瓣膜组件130在天然瓣环内对准(alignment)。在其他实施例中,径向延伸段150可以是法兰、边缘、环形物、指状突起,或其它突出进心房空间中以便至少部分地接合在其上环区域处或其上方的组织。
同时参照图5A和5B,示出支撑臂140具有曲线形状141并且从瓣膜支持结构120的下游部分126延伸。支撑臂140被配置为接合天然瓣叶(如果存在)和/或心室空间内的二尖瓣MV的子环区域。在一个实施例中,支撑臂140被配置为接合瓣叶的外表面(例如,面向心室侧),使得天然瓣叶被捕获在支撑臂140与瓣膜支持结构120的外壁123之间。在一个这样的实施例中,支撑臂140的预成型的曲线形状141(例如在第二弧形区域144的过渡顶端144a处)可以偏向瓣膜支持结构120的外壁123,使得压缩力F
为了进一步抑制假体100相对于天然瓣膜环AN的上游迁移,第二弧形区域144被配置为经由接触面或着陆区145接合子环区域(例如,在瓣叶LF后面)。在另外的实施例中,第二弧形区域144可以接触瓣环AN下方的组织,例如心室壁(如图5C所示)。通过经由例如延伸到臂尖端148的加宽部分446(图4A和4C)通过接触子环区域(图5A和5B)和/或瓣环AN下方的组织(图5C),着陆区145将表面接触分布在较大的区域上以抑制组织侵蚀并以无创伤的方式将负载应力分布在支撑臂140上。
在各种布置中,支撑臂140的曲线形状141可以形成大致S形的轮廓。在某些布置中,支撑臂140可以更加柔性(例如,比框架110的其他部分)和/或由弹性材料(例如,形状记忆材料、超弹性材料等)制成,其可以当植入心脏10中并且在心动周期期间吸收施加在支撑臂140上的力。例如,这些力可以导致基本上S形的轮廓暂时变形、偏转或以其他方式改变形状。类似地,支撑臂的曲线形状141可以在上游方向(例如,在接触区145处)和抵靠瓣环组织提供压缩力F
在一些实施例中,诸如径向延伸段150、瓣膜支持结构120和/或支撑臂140的部分假体100可设置有密封材料160(图4B)以覆盖至少部分的假体100。密封材料160可以防止瓣周漏以及在植入后为组织向内生长提供介质,其可以进一步提供假体100在天然心脏瓣膜区域内的期望的展开位置中的生物力学保留(biomechanical retention)。在一些实施例中,密封材料160或其部分可以是低孔隙度的机织织物,例如聚酯、
图6A-6C是根据本技术的额外的实施例的各种支撑臂构型的侧视图。同时参照图6A-6C,在一个实施例中,支撑臂140通常可以具有带第一弧形区域和第二弧形区域142,144的曲线形状141,第一弧形区域和第二弧形区域142,144被伸长或大体上为直线的区域143分开,它们一起大体上平行于纵向轴线601延伸(例如,大致与瓣膜支持结构120的纵向轴线L
同时参考图5B和图6A-6C,第二弧形区域144可以具有组织接合部分或接触区145,用于在展开期间和/或展开之后接合子环或其他心脏组织。在如图6A-6C所示的实施例中,支撑臂140包括位于第一端部140a处的臂柱146,并且第一弧形区域142通常从纵向轴线L
参照图6A,在一些实施例中,臂柱146可以是大致线性的并且具有合适的长度L
如图6A所示,第一过渡点616起始于支撑臂140的伸长区域143,其中伴随伸长区域143相对于瓣膜支持结构120的纵向轴线L
参照图6A,支撑臂140的第一弧形区域142和第二弧形区域144可以被配置为在例如心脏收缩和心脏舒张期间吸收、转化和/或减轻存在于心脏内的扭曲力。在特定布置中,支撑臂140对扭曲力(例如,能够施加在支撑臂140上并且改变支撑臂140的轮廓的物理力)具有弹簧类型的回应。如在此更详细描述的那样,支撑臂140可具有多个铰接点以用于弯曲或吸收这种扭曲力。例如,作为单个支撑臂140的弹簧式响应的结果,可以以弹性地或可逆地且暂时地扭曲支撑臂140的无偏置构型(unbiased configuration)的方式吸收第一扭曲力。随着第一扭曲力消散(例如,在心动周期期间),弹簧式运动继续支撑臂轮廓从扭曲位置转变回到无偏置构型的转换。因此,支撑臂140的弹簧式响应以与第一扭曲力相反的方式发生。在这些布置中,支撑臂140被压缩和/或延伸的程度与施加在支撑臂上的扭曲力成比例。支撑臂140可以具有选定的刚度,该刚度为扭曲的距离或增量(例如,压缩、扩张)提供常数。在某些布置中,沿支撑臂的整个长度并覆盖所有多个铰接点,支撑臂140可具有恒定的刚度。在其他布置中,沿支撑臂的长度并包含不同的铰接点,支撑臂140可具有可变的刚度。单个的支撑臂140的这种刚度选择性可以提供假体设计以适应独特且可变的天然结构,例如用于适应由天然二尖瓣区域施加的可变的扭曲力。可变刚度可通过多种方式实现:i)支撑臂横截面积的差异,ii)在传统弹塑性金属(例如不锈钢、钛合金、钴-铬合金)的情况下所选择的支撑臂的可变冷加工,和/或iii)对一个或多个支撑臂而不对其他支撑臂,选择性加热或提供的热处理。
在特定实施例中,可以选择第一弧形区域142和第二弧形区域144的形状和/或尺寸以适应力,例如由天然瓣环和/或瓣叶施加的径向压缩力Fa、纵向舒张力Fd和收缩力Fs、环向应力等。扭曲力的吸收可用来防止那些力转化给瓣膜支持结构120并由此保持人工瓣膜组件130的接合。另外,如图7进一步所示,沿整个支撑臂140和/或在几个铰接点或位置701(例如,过渡部140a,142a,616,618和144a)处的扭曲力的吸收分配由力引起的应力,从而基本上防止支撑臂140的疲劳和/或使天然解剖体的接触部分处的组织侵蚀最小化。根据本技术,支撑臂140可以在瓣膜支持结构120大体上保持其刚性和/或原始形状(例如,大致圆形)的同时在扭曲力的作用下折曲、弯曲、旋转或扭曲。
图8A-8H是根据本技术的其他实施例的响应于扭曲力而弯曲的各种支撑臂140的侧视图。单个的支撑臂140的柔性程度可以在假体100的所有支撑臂140之间一致,或者可替代地,一些支撑臂140可以比同一假体100上的其他支撑臂140更具柔性。类似地,单个支撑臂140的柔性程度在遍及支撑臂140的整个长度上是一致的或在第一弧形区域142和第二弧形区域144的曲率上是一致的。然而,在其他实施例中,柔性程度可以沿着每个支撑臂140的长度和/或形状变化。
如图8A-8H所示,支撑臂140的第一弧形区域142和第二弧形区域144可以相对于臂柱146、瓣膜支持结构120(以虚线示出)弯曲和/或被配置为响应于在植入假体100期间或之后可由周围组织施加的变化的扭曲力F改变它们的弧形形状。从静态位置(图8A),第一弧形区域142响应于由例如索负荷(chordal load)(例如,从接合第一弧形区域142的腱索)引起的向下的力F
在其他布置中,如图8F-8H所示,在图8F中以静态位置示出的第一弧形区域142和第二弧形区域144也可以通过在一个或多个过渡部140a,142a,616,618和144a(图6A)处弯曲而响应于横向定向力F
图9是根据本技术的实施例配置的处于经压缩的递送构型(例如,低轮廓或径向压缩状态)所示的图5A-5B的心脏瓣膜假体100的放大截面图。假体100可配置为用于在如图9所示的径向压缩构型中的输送导管护套(未示出)内的递送。更具体地,在径向压缩构型中,径向延伸段150可以被拉长、折叠或以其他方式布置成从瓣膜支持结构120以大体上伸直的状态纵向地延伸。另外,多个支撑臂140纵向地延伸并以大体上伸直的状态布置以用于经皮递送至目标天然心脏瓣膜。如图9所示,支撑臂140可以延伸超出瓣膜支持结构120的第二端127,使得第一弧形区域142是大致直线的并且与纵向轴线L
进入二尖瓣或其他房室瓣可以通过患者的脉管系统以经皮方式完成。取决于血管通路的点,二尖瓣的入路可能是顺行的,并且可能依赖穿过房间隔进入左心房。或者,通过主动脉瓣或经心尖穿刺进入左心室的二尖瓣入路可以是逆行的。一旦实现经皮进入,介入工具和支撑导管可以以血管内方式前进到心脏并且以各种方式定位在目标心脏瓣膜附近。例如,可以将心脏瓣膜假体100递送到天然二尖瓣区域,以通过经中隔入路(如图10所示)、通过主动脉瓣膜或经由经心尖穿刺的逆行入路修复或替换天然瓣膜。适用于本文描述的心脏瓣膜假体100的合适的经心尖和/或经动脉的植入程序在授予给Igor Kovalsky的2012年8月13日提交的美国申请号13/572,842、授予Tuval等人的美国申请公开号2011/0208297、以及授予Tuval等人的美国申请公开号2012/0035722的专利申请中公开,其在此通过引用的方式整体并入本文。
图10是根据本技术的另一个实施例的心脏10的截面图,示出了使用经中隔入路植入心脏瓣膜假体100的方法的步骤。同时参照图5A、图9和图10,假体100可以被推进到输送导管20内的二尖瓣MV附近。可选地,可以使用导丝(未示出),输送导管20可以在导丝上滑动推进。如图10所示,输送导管20的护套22(其包含处于径向压缩构型(图9所示)的假体100)被推进通过天然瓣叶LF之间的二尖瓣环AN。参考图10,护套22随后向近端缩回,允许假体100扩张,使得支撑臂140处于向外位置与纵向轴线L
在护套22已被移除并且假体100被允许返回到其展开状态之后,输送导管20仍然可以连接到假体100(例如未示出的系统孔眼连接到假体孔眼),使得当假体100朝向径向扩张构型扩张时操作者可以进一步控制假体100的布置。例如,在从输送导管20释放假体100之前,假体100可以在目标位置的上游或下游扩张,然后分别推向下游或上游到期望的目标位置。一旦假体100定位在目标部位,输送导管20可在近端方向缩回,并且当假体100在目标天然瓣膜(例如二尖瓣MV)处处于径向扩张构型时脱离假体100。
虽然以上已经描述了各种实施例,但应该理解的是,它们仅作为本技术的说明和示例而被呈现,而不是作为限制而被呈现。对于相关领域的技术人员显而易见的是,在不脱离本技术的精神和范围的情况下,可以在其中进行形式和细节上的各种改变。因此,本技术的广度和范围不应由任何上述实施例限制,而应仅根据所附权利要求及其等同物来限定。还应该理解的是,在此讨论的每个实施例的每个特征以及在此引用的每个参考文献的每个特征可以与任何其他实施例的特征组合使用。在此讨论的所有专利和出版物通过引用整体并入本文。
- 假体心脏瓣膜以及用于输送假体心脏瓣膜的系统和方法
- 用于通过引导鞘和装载系统来递送心脏瓣膜假体的心脏瓣膜假体递送系统和方法
