用于包封和测定细胞的方法
文献发布时间:2024-04-18 19:52:40
本申请是中国申请号为202080048197.X(对应于PCT国际申请号PCT/US2020/030846)、申请日为2020年4月30日、发明名称为“用于包封和测定细胞的方法”的发明专利申请的分案申请。
相关申请的交叉引用
本申请要求2019年4月30日提交的题为“METHODS FOR ENCAPSULATING ANDASSAYING CELLS(用于包封和测定细胞的方法)”的第62/841,229号美国临时申请和2019年5月21日提交的题为“METHODS FOR ENCAPSULATING AND ASSAYING CELLS(用于包封和测定细胞的方法)”的第62/850,557号美国临时申请的权益,其每个公开内容通过引用整体合并在本文中。
背景技术
在生物科学和相关领域中,在隔离的情况下研究细胞是有用的,以便可以在异质细胞混合物中标识具有独特和期望的特性的细胞。本公开的一些方面和实施例包括用于将细胞包封(encapsulate)在微流体装置内并测定(assay)包封的细胞的过程和方法。除其他好处外,包封还可以促进对产生关注的分泌物的细胞的分析,否则这些分泌物会迅速地扩散开来或与其他细胞的分泌物混合。
发明内容
在第一方面中,提供了一种用于将细胞包封在微流体装置中的过程,该微流体装置具有围栏,该围栏包括通道和多个腔室,多个腔室中的每个腔室具有将腔室流体连接到通道的开口(例如,单个开口),其中,形成靠近通向多个腔室中的每个腔室的开口的通道的表面的至少一部分可以包括疏水涂层,所述过程包括:用第一水性介质填充微流体装置的围栏中的通道和多个腔室;将第一细胞置于多个腔室中的第一腔室中;将第二细胞置于多个腔室中的第二腔室中;以及使与水不混溶的流体介质流入通道中,基本上置换通道中的所有第一水性介质,而基本上不置换多个腔室中的腔室中的第一水性介质,从而可逆地将第一细胞和第二细胞包封在它们相应的腔室中。
在一些实施例中,靠近并围绕通向多个腔室中的每个腔室的开口的所有通道表面可以包括疏水涂层。在一些其他实施例中,在通向多个腔室中的每个腔室的开口的10微米内的所有通道表面可以包括疏水涂层。
在一些变型中,疏水涂层可具有约45度至约100度的接触角度。在一些实施例中,疏水涂层可以共价结合到形成靠近通向多个腔室中的每个腔室的开口的通道的表面的至少一部分。
在一些变型中,与水不混溶的流体介质可包括烷烃、氟代烷烃、油、疏水聚合物或其任意组合。
在一些变型中,该过程还可以包括:将与水不混溶的流体介质吸出通道。在一些实施例中,将与水不混溶的流体介质吸出通道的速率可以处于0.01μl/sec和1.0μl/sec或在0.01μl/sec至1.0μl/sec之间。在一些实施例中,吸出与水不混溶的流体介质还可以包括:随后将第二水性介质吸入到通道中。在一些变型中,第二水性介质可包括表面活性剂。
在一些变型中,形成多个腔室中的每个腔室的表面的至少一部分可以包括疏水涂层,并且腔室表面的具有疏水涂层的所述至少一部分可以位于通向通道的开口附近,其中,该过程还可以包括:在多个腔室中的每个腔室中生成与水不混溶的流体介质的包封层,其中,多个腔室中的每个腔室的包封层紧邻通道定位并且与腔室中的第一水性介质共享界面,以将腔室中的第一水性介质与通道中存在的介质(例如,第二水性介质、空气、CO
在一些变型中,多个腔室中的每个腔室的包封层可具有约5微米至约50微米的平均厚度。
在一些实施例中,该过程还可以包括:选择其中布置有细胞的第一腔室和第二腔室中的一个(或多个);以及移除由与水不混溶的流体介质在通向选择的腔室的通道的开口处形成的包封层,从而产生解包封的腔室。在一些实施例中,选择性地移除包封层可以包括:在腔室内产生气泡(例如,靠近包封层产生气泡)。在一些变型中,产生气泡可以包括:将激光引导到腔室的基部的内表面上靠近第一水性介质与与水不混溶的流体介质之间的界面的位置。
在一些变型中,该过程还可包括:使第三水性介质流入通道中。第三水性介质可以包括试剂(例如,测定试剂或裂解试剂(例如,第三水性介质可以是裂解缓冲液))或输出缓冲液。
在一些变型中,该过程还可包括:将捕获珠粒(例如,结合生物材料的珠粒,诸如非特异性捕获珠粒、抗原特异性捕获珠粒、酶捕获珠粒或核酸捕获珠粒)置于第一腔室和第二腔室之一或两者中。在一些变型中,该过程还可以包括:从解包封的腔室中释放(unpen)捕获珠粒(例如,以及进一步分析结合到捕获珠粒的材料);以及可选地,从微流体装置输出捕获珠粒(例如,以及进一步分析结合到捕获珠粒的材料)。
在一些变型中,将第一细胞和第二细胞置于第一腔室和第二腔室中可以包括:使含有细胞的水性介质流入微流体装置的通道中,该含有细胞的水性介质包括多个细胞;以及从微流体装置的通道中的含有细胞的水性介质中的多个细胞中选择第一细胞和第二细胞,以将其分别置于第一腔室和第二腔室中的每一个中。在一些实施例中,可以使用DEP力(例如,光致动DEP力)分别将选定的第一细胞和第二细胞从通道单独地移动到第一腔室和第二腔室。
在一些实施例中,多个腔室中的每个腔室可以是隔绝坞,其具有通向通道的单个开口并且可以包括隔离区域(例如,具有单个开口)和将隔离区域流体连接到通道的连接区域。在一些变型中,每个隔绝坞的连接区域可以包括通向通道的近端开口和通向隔离区域的远端开口,连接区域的近端开口具有范围从约20微米至约100微米的宽度W
在一些变型中,通道(例如,具有基本均匀的宽度的通道)的宽度W
在一些变型中,通道在多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的高度可以在约20微米至约100微米之间(例如,约30微米至约50微米、约50微米至约70微米、约70微米至约90微米、约35微米至约45微米、约45微米至约55微米、约55微米至约65微米、约65微米至约75微米、或约75微米至约85微米)。
在一些变型中,多个腔室中的每个腔室(或每个隔绝坞)的体积可以在从约2x10
在一些变型中,形成通道的表面的总表面积的小于或等于50%可包括疏水涂层。在一些其他变型中,形成通道的表面的总表面积的大于或等于50%可包括疏水涂层。
在一些变型中,多个腔室中的每个腔室可包括形成腔室的多个表面,其中,多个腔室表面中的至少一个腔室表面可包括亲水涂层。在一些变型中,多个腔室可以包括多个隔绝坞,每个隔绝坞具有通向通道的单个开口并且可以包括隔离区域(例如,具有单个开口)和将隔离区域流体连接到通道的连接区域,并且其中,形成每个隔绝坞的隔离区域的至少一个表面(例如,所有表面)可以包括亲水涂层。在一些变型中,形成每个隔绝坞的连接区域的至少一个表面(例如,所有表面)可以包括亲水涂层。在一些变型中,形成连接区域的至少一个表面(例如,所有表面)中的每一个可以包括靠近隔离区域的具有亲水涂层的部分和靠近通道的具有疏水涂层的部分,并且可选地,当形成连接区域的所有表面可以包括靠近通道的具有疏水涂层的部分时,提供包围连接区域的紧邻通道的部分的疏水涂层。
在一些变型中,疏水涂层可以包括第一共价结合的表面修饰(modification),其可以包括:第一链接基团和第一部分,其中,第一部分是非极性的(例如,油酸部分、炔基部分、炔基封端的(alkynyl-terminated)PEG部分或氟化部分)。在一些变型中,亲水涂层可以包括多个第二共价结合的表面修饰,其每一个包括第二链接基团和第二部分,其中,第二部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
在一些变型中,疏水涂层可以通过以下方式形成:使形成通道的表面的至少一部分与第一改性(modifying)剂接触;以及使第一改性剂与形成通道的表面的至少一部分上的多个第一反应性部分反应。在一些变型中,亲水涂层可以通过以下方式形成:使腔室(例如,隔绝坞)的至少一个表面与亲水改性剂接触;以及使第二改性剂与腔室的至少一个表面上的多个第二反应性部分反应。
在另一方面中,提供了一种用于测定微流体装置中包封的细胞的过程,该微流体装置具有围栏,该围栏包括通道和多个腔室,多个腔室中的每个腔室具有将腔室流体连接到通道的开口(例如,单个开口),其中,形成靠近多个腔室中的每个腔室的通道的表面的至少一部分包括疏水涂层,其中,该过程包括:用第一水性介质填充微流体装置的围栏中的通道和多个腔室;将第一细胞置于多个腔室中的第一腔室中;将第二细胞置于多个腔室中的第二腔室中;使与水不混溶的流体介质流入通道中,置换通道中的基本上所有第一水性介质,而基本上不置换多个腔室中的任意腔室中的第一水性介质,从而可逆地将第一细胞和第二细胞包封在它们相应的腔室中;以及监测包封在第一腔室和第二腔室中的细胞的活性。在一些变型中,靠近并围绕通向多个腔室中的每个腔室的开口的所有通道表面可以包括疏水涂层。在一些变型中,在通向多个腔室中的每个腔室的开口的10微米内的所有通道表面可以包括疏水涂层。在一些变型中,疏水涂层可具有约45度至约100度的接触角度。在一些变型中,疏水涂层可以共价结合到形成靠近多个腔室中的每个腔室的通道的表面的部分。
在一些变型中,与水不混溶的流体介质可包括烷烃、氟代烷烃、油、疏水聚合物或其任意组合。
在一些变型中,该过程还可以包括:将与水不混溶的流体介质吸出通道。在一些实施例中,将与水不混溶的流体介质吸出通道的速率可以处于0.01μl/sec和1.0μl/sec或在0.01μl/sec至1.0μl/sec之间。在一些实施例中,吸出与水不混溶的流体介质还可以包括:随后将第二水性介质吸入到通道中。在一些实施例中,第二水性介质可包括表面活性剂。
在一些变型中,形成多个腔室中的每个腔室的表面的至少一部分可以包括疏水涂层,并且腔室表面的具有疏水涂层的至少一部分位于通向通道的开口附近,该过程还可以包括:在多个腔室中的每个腔室中生成与水不混溶的流体介质的包封层,其中,多个腔室中的每个腔室的包封层可以紧邻通道定位并且可以与腔室中的第一水性介质共享界面,以将腔室中的第一水性介质与通道中存在的介质(例如,第二水性介质、空气、CO
在一些变型中,多个腔室中的每个腔室的包封层可具有约5微米至约50微米的平均厚度。
在一些变型中,该过程还可以包括:选择其中布置有细胞的至少两个腔室中的一个(或多个);以及移除由不混溶的流体介质在通向所选择的腔室的通道的开口处形成的包封层,从而产生解包封的腔室。在一些变型中,选择性地移除包封层可以包括:在腔室内产生气泡(例如,靠近包封层产生气泡)。在一些变型中,产生气泡可以包括:将激光引导到腔室的基部的内表面上靠近第一水性介质和与水不混溶的流体介质之间的界面的位置。
在一些变型中,该过程还可包括:使第三水性介质流入通道中。第三水性介质可以包括试剂(例如,测定试剂或裂解试剂(例如,第三水性介质可以是裂解缓冲液))或输出缓冲液。
在一些变型中,该过程还可包括:将捕获珠粒(例如,选择性地结合生物材料的珠粒,诸如抗原捕获珠粒、酶捕获珠粒或核酸捕获珠粒等)置于第一腔室和第二腔室之一或两者中。
在一些变型中,该过程还可以包括:从解包封的腔室中释放捕获珠粒(例如,进一步分析结合到捕获珠粒的材料);以及可选地,从微流体装置输出捕获珠粒(例如,以及进一步分析结合到捕获珠粒的材料)。
在一些变型中,将第一细胞和第二细胞置于第一腔室和第二腔室中可以包括:使水性介质流入微流体装置的通道中,该水性介质包括多个细胞;以及从微流体装置的通道中的含有细胞的水性介质中选择第一细胞和第二细胞,以将其分别置于第一腔室和第二腔室中。在一些实施例中,可以使用DEP力(例如,光致动DEP力)分别将选定的第一细胞和第二细胞从通道单独地移动到第一腔室和第二腔室。
在一些变型中,多个腔室中的每个腔室可以是隔绝坞,其具有通向通道的单个开口,并且可以包括隔离区域(例如,具有单个开口)和将隔离区域流体连接到通道的连接区域。在一些实施例中,每个隔绝坞的连接区域可以包括通向通道的近端开口和通向隔离区域的远端开口,连接区域的近端开口具有范围从约20微米至约100微米的宽度W
在一些实施例中,连接区域的长度L
在一些变型中,通道(例如,具有基本均匀的宽度的通道)的宽度W
在一些变型中,通道在多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的高度可以在约20微米至约100微米之间(例如,约30微米至约50微米、约50微米至约70微米、约70微米至约90微米、约35微米至约45微米、约45微米至约55微米、约55微米至约65微米、约65微米至约75微米、或约75微米至约85微米)。在一些变型中,多个腔室中的每个腔室(或每个隔绝坞)的体积可以在从约2x10
在一些变型中,形成通道的表面的总表面积的小于或等于50%可包括疏水涂层。在一些其他变型中,形成通道的表面的总表面积的大于或等于50%可包括疏水涂层。
在一些变型中,多个腔室中的每个腔室可包括形成腔室的多个表面,其中,多个腔室表面中的至少一个腔室表面可包括亲水涂层。在一些变型中,多个腔室可以包括多个隔绝坞,每个隔绝坞具有通向通道的单个开口并且可以包括隔离区域(例如,具有单个开口)和将隔离区域流体连接到通道的连接区域,并且其中,形成多个隔绝坞中的每个隔绝坞的隔离区域的至少一个表面(例如,所有表面)可以包括亲水涂层。在一些变型中,形成多个隔绝坞中的每个隔绝坞的连接区域的至少一个表面(例如,所有表面)可以包括亲水涂层。
在一些变型中,形成连接区域的至少一个表面(例如,所有表面)中的每一个可以包括靠近隔离区域的具有亲水涂层的部分和靠近通道的具有疏水涂层的部分,并且可选地,当形成连接区域的所有表面可以包括靠近通道的具有疏水涂层的部分时,它们提供包围连接区域的紧邻通道的部分的疏水涂层。
在一些变型中,疏水涂层可以包括第一共价结合的表面修饰,其包括:第一链接基团和第一部分,其中,第一部分是非极性的(例如,油酸部分、炔基部分、炔基封端的(alkynyl-terminated)PEG部分或氟化部分)。在一些变型中,亲水涂层可以包括多个第二共价结合的表面修饰,其每一个包括第二链接基团和第二部分,其中,第二部分可以是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
在一些变型中,该过程还可以包括:在监测第一细胞和第二细胞的活性之前将包封在第一腔室和第二腔室中的第一细胞和第二细胞孵育第一时间段。在一些变型中,该过程还可以包括将包封在第一腔室和第二腔室中的每一个中的第一细胞和第二细胞孵育第一时间段并且在第一时间段期间的多个时间点监测第一细胞和第二细胞的活性。在一些变型中,该过程还可包括:在第一时间段期间基本上连续地监测孵育中的第一细胞和第二细胞的活性。在一些变型中,第一时间段可以是至少30分钟。在一些实施例中,第一时间段可以在4小时至24小时之间(例如,8小时至12小时之间、12小时至16小时之间、16小时至20小时之间)。
在一些变型中,该过程还可包括:在18℃至50℃之间(例如,25℃至37℃之间)的温度下孵育细胞。
在一些变型中,第一细胞和第二细胞可以表达不同量的关注的分子或报告分子。在一些变型中,关注的分子可以是小分子。在一些其他变型中,关注的分子可以是蛋白质。在一些另外的变型中,关注的分子可以是核酸。在一些变型中,关注的分子可以是分泌的。
在一些变型中,分别监测包封在第一腔室和第二腔室中的第一细胞和第二细胞的活性可以包括:检测存在于第一腔室和第二腔室中的每一个中的关注的分子或报告分子。在一些变型中,检测关注的分子或报告分子可以包括:检测与关注的分子或报告分子相关联的或由关注的分子或报告分子产生的荧光信号。在一些变型中,检测关注的分子或报告分子可以包括:检测关注的分子或报告分子与固体基质的结合,其中,固体基质(例如,珠粒)可以包括关注的分子的受体。
在一些变型中,监测第一细胞和第二细胞的活性可以包括:分别对第一腔室和第二腔室成像。在一些变型中,第一细胞和第二细胞可被成像以监测细胞的一个或多个表型参数。在一些变型中,监测第一细胞和第二细胞的活性可以包括监测细胞生长。
在一些变型中,已流过/正流过通道的与水不混溶的流体介质可以包括可溶性氧。第一水性介质可包括碳源/能源以及可选地,其他矿物质和营养物。
在一些变型中,该过程还可以包括:基于检测到的细胞活性,例如,基于预定标准或相对于微流体装置的其他腔室中检测到的细胞活性,从第一细胞和第二细胞中选择关注的细胞以进行附加的测定。在一些变型中,选择可以基于关注的分子的表达量、细胞生长量或其组合。
在一些变型中,该过程还可以包括:将微物体置于多个腔室中的第一腔室和第二腔室中的每一个中,其中,该微物体可以包括分子,其被配置为影响或测试置于腔室中的第一细胞和第二细胞的生物活性。在一些变型中,分子可以非共价地与微物体相关联。在一些变型中,将微物体置于第一腔室和第二腔室中的每一个中可以在将第一细胞和第二细胞包封在它们相应的腔室内之前执行。
在一些变型中,该过程还可以包括:在将微物体引入第一腔室和第二腔室中之后,将释放试剂引入第一腔室和第二腔室中的每一个中,其中,该释放试剂被配置为触发分子从微物体的释放。在一些变型中,将释放试剂引入第一腔室和第二腔室中的每一个中可以在将第一细胞和第二细胞包封在它们相应的腔室内之前执行。
在一些变型中,该过程还可以包括:触发分子从微物体的释放。在一些变型中,触发从微物体释放分子可包括:提高微流体装置的第一腔室和第二腔室中的每一个的温度。在一些变型中,触发释放可以包括:将激光照明引导到第一腔室和第二腔室中的每一个中的微物体处。
在一些变型中,该过程还可包括:评估微物体可以包括的分子是否改变第一细胞或第二细胞对关注的分子(或报告分子)的表达。在一些变型中,该过程还可以包括:量化第一细胞和第二细胞的关注的分子(或报告分子)的表达的变化(例如,量化第一细胞相对于第二细胞的变化,反之亦然,或相对于置于多个腔室中除第一腔室和第二腔室之外的腔室中的一个或多个细胞进行量化)。在一些变型中,微物体还可包括标识符,其被配置为允许跟踪分子的身份。
在一些变型中,多个腔室中的每个腔室从通道横向开口。
在一些变型中,微流体装置的围栏还可以包括:基部;微流体回路结构,设置在基部座的内表面上;以及盖,设置在微流体回路结构上方,其中,基部、微流体回路结构和盖共同限定通道和多个腔室。基部的内表面和/或盖的内表面可以包括金属、金属氧化物、玻璃、聚合物或其任意组合。在一些变型中,微流体装置的盖或基部可包括DEP配置。在一些变型中,DEP配置可以被光学致动。
在一些变型中,第一细胞和第二细胞可以是酵母细胞。
在一些变型中,第一细胞和第二细胞可以是源自丝状真菌的孢子。
在一些变型中,第一细胞和第二细胞可以是哺乳动物细胞。在一些其他变型中,第一细胞和第二细胞可以是免疫细胞。在一些另外的变型中,第一细胞和第二细胞可以是T细胞。在一些变型中,第一细胞和第二细胞可以是B细胞。在一些其他变型中,第一细胞和第二细胞是细菌细胞。在一些变型中,第一细胞和第二细胞可以是植物细胞。在一些变型中,第一细胞和第二细胞可以是胎儿细胞。在一些变型中,第一细胞和第二细胞可以是干细胞或祖细胞。
在另一方面中,提供了一种微流体装置,其具有围栏,该围栏包括通道和多个腔室,多个腔室中的每个腔室具有将腔室流体连接到通道的开口(例如,单个开口),其中,多个腔室中的每个腔室由具有总表面积的多个表面形成,其中,每个腔室的总表面积的第一部分包括疏水涂层,每个腔室的总表面积的第二部分包括亲水涂层,并且其中,每个腔室的总表面积的第一部分可以位于腔室开口与通道之间的边界附近。
在一些变型中,多个腔室中的每个腔室的总表面积的第一部分靠近并围绕腔室的通向通道的开口(例如,形成腔室的开口的每个表面可以在靠近腔室开口与通道之间的边界的位置处包括疏水涂层)。在一些变型中,多个腔室中的每个腔室的位于腔室开口与通道之间的边界的约10微米内(例如,约20微米内、约25微米内、约30微米内、约35微米内、约40微米内、约45微米内、约50微米内、约55微米内、约60微米内或更多)的所有总表面积可以包括疏水涂层。在一些变型中,通道可由具有总表面积的多个表面形成,其中通道的总表面积的一个或多个部分包括疏水涂层(例如,与多个腔室相同的疏水涂层)。
在一些变型中,通道的总表面积的包括疏水涂层的一个或多个部分中的每一个可以位于通道与多个腔室中的对应的腔室之间的边界附近。在一些变型中,通道的位于通道与多个腔室的开口之间的边界的约10微米内(例如,约20微米内、约25微米内、约30微米内、约35微米内、约40微米内、约45微米内、约50微米内、约55微米内、约60微米内或更多)的所有总表面积可以包括疏水涂层。
在一些变型中,通道的基本上所有(例如,至少80%、85%、90%、95%、98%、99%或更多)的总表面积可包括疏水涂层。在一些变型中,多个腔室的疏水涂层可具有约45度至约100度的接触角度。
在一些变型中,多个腔室中的每个腔室可以是隔绝坞,其包括隔离区域和将隔离区域流体连接到通道的连接区域。在一些变型中,每个隔绝坞的疏水涂层可以存在于连接区域中,并且基本上不存在于隔离区域中(例如,形成隔离区域的腔室表面的总表面积可以包括小于5%、4%、3%、2%、1.5%、1%、0.5%的疏水涂层)。
在一些变型中,形成每个隔绝坞的连接区域的腔室表面的总表面积的小于或等于50%可包括疏水涂层。在一些其他变型中,形成每个隔绝坞的隔离区域的腔室表面的总表面积的大于或等于50%可包括疏水涂层。
在一些变型中,形成每个隔绝坞的连接区域并且包括疏水涂层的腔室表面可以形成围绕连接区域的近端的环(例如,从通道与连接区域的近端开口之间的边界开始并且延伸到连接区域中)。在一些变型中,形成每个隔绝坞的隔离区域的腔室表面的总表面积的大于或等于50%可包括亲水涂层。
在一些变型中,形成每个隔绝坞的隔离区域的腔室表面的基本上所有总表面积可以包括亲水涂层(例如,至少80%、85%、90%、95%、98%、99%或更多)。
在一些变型中,每个隔绝坞的连接区域可以包括通向通道的近端开口和通向隔离区域的远端开口,连接区域的近端开口具有范围从约20微米至约100微米(例如,约20微米至约60微米,或约30微米至约90微米)的宽度W
在一些变型中,通道(例如,具有基本均匀的宽度的通道)的宽度W
在一些变型中,通道(例如,具有基本均匀的宽度的通道)在多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的宽度W
在一些变型中,多个腔室中的每个腔室(或每个隔绝坞)的体积可以在从约2x10
在一些变型中,微流体装置的围栏还可以包括:基部;微流体回路结构,设置在基部的内表面上;以及盖,设置在微流体回路结构上方,其中,基部、微流体回路结构和盖共同限定通道和多个腔室。
在一些变型中,疏水涂层可以包括第一共价结合的表面修饰,其可以包括:第一链接基团和第一部分,其中,第一部分是非极性的(例如,油酸部分、炔基部分、PEG链接的炔基或氟化部分)。在一些变型中,亲水涂层可以包括多个第二共价结合的表面修饰,其每一个包括第二链接基团和第二部分,其中,第二部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
在另一方面中,提供了用于包封细胞的试剂盒,包括:具有围栏的微流体装置,该围栏包括通道和多个腔室,多个腔室中的每个腔室具有将腔室流体连接到通道的开口(例如,单个开口),其中,形成通道和每个腔室的内表面的至少一部分可以包括多个反应性部分;第一表面改性剂,其可以包括被配置为与反应性部分共价结合的第一链接基团、和第一表面接触部分,其中,第一表面接触部分可以是非极性的(例如,油酸部分、炔基部分、PEG链接的炔基或氟化部分);以及第二表面改性剂,包括被配置为与反应性部分共价结合的第二链接基团、和第二表面接触部分,其中,第二表面接触部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分),其中,该试剂盒可用于产生如本文所述并具有任何特征组合的微流体装置。
在一些变型中,多个反应性部分可以包括叠氮基部分或炔基部分。
在一些变型中,试剂盒还可包括多个捕获珠粒(例如,结合生物材料的珠粒,诸如非特异性捕获珠粒、抗原特异性捕获珠粒、酶捕获珠粒或核酸捕获珠粒等)。
在一些变型中,试剂盒还可包括水性介质、与水不混溶的流体介质(例如,烷烃、氟代烷烃、油、疏水聚合物或其任意组合)、测定试剂(例如,裂解试剂,诸如裂解缓冲液等)、或输出缓冲液中的一种或多种。
本文公开的方法和过程的附加的方面和实施例将从随后的详细描述、示例、实施例和权利要求中变得明显。
附图说明
图1A示出了根据本公开的一些实施例的微流体装置和具有相关联的控制设备的系统。
图1B示出了根据本公开的实施例的具有隔绝坞的微流体装置。
图2A至图2B示出了根据本公开的一些实施例的具有隔绝坞的微流体装置。
图2C示出了根据本公开的一些实施例的微流体装置的隔绝坞。
图3示出了根据本公开的一些实施例的微流体装置的隔绝坞。
图4A至图4B示出了根据本公开的一些实施例的微流体装置的动电特征。
图5A示出了根据本公开的一些实施例的用于与微流体装置和相关联的控制设备一起使用的系统。
图5B示出了根据本公开的一些实施例的成像装置。
图6A至图6L示出了根据本公开的一些实施例的微流体装置内的区域选择性地引入的改性表面。
图7A至图7B示出了根据本公开的一些实施例的在各个腔室中的区域选择性改性的表面的制备,该表面可以支撑形成在腔室的连接区域处的限定厚度的包封层。
图7C至图7D示出了根据本公开的一些实施例的微流体装置内的区域选择性地引入的改性表面。
图8A至图8B示出了在对应的各个腔室中的各个细胞的包封,其中在腔室的连接区域处形成了限定厚度的包封层。
图9A至图9C示出了用于产生和移除薄膜包封层(或密封)的示例性方法。
图10A至图10E示出了用于大量移除包封层的示例性方法。
图11A至图11D示出了用于选择性地消融(ablate)包封层的示例性方法。
图12A至图12C示出了用于培养和选择性地裂解细胞的示例性方法。
图13A至图13D示出了示例性实施例,其中酵母细胞已经被包封在隔绝坞中并且测定正在进行中。图13A和图13B分别示出了测定开始后30分钟时的对应的明场和荧光图像。图13C和图13D分别示出了在测定开始后16小时时的同一隔绝坞的对应的明场和荧光图像。
图14A至图14B示出了图13A至图13D的酵母菌株的平均密度、平均密度的导数、发射(例如,荧光)的平均强度和强度的导数的示例性时间进程图。
图15示出了在四个不同的时间点在三个不同的OptoSelect芯片中每一个上的从图13A至图13D的酵母菌株采集的累积数据,包括针对四个菌株中的每一个的平均表达水平(其中,第一标准偏差、第二标准偏差和第三标准偏差由深灰色到浅灰色阴影表示)。
具体实施方式
本说明书描述了本公开的示例性实施例和应用。然而,本公开不限于这些示例性实施例和应用,也不限于示例性实施例和应用在本文中操作或描述的方式。此外,附图可以示出简化或局部视图,并且附图中的元件尺寸可以被夸大或者可以不成比例。此外,当在本文中使用术语“在…上”、“附着到”、“连接到”或“耦接到”或类似词语时,一个元件(例如,材料、层、衬底等)可以“在另一元件上”、“附着到另一元件”、“连接到另一元件”、或“耦接到另一元件”,而不论该一个元件是直接位于该另一元件上、附着、连接或耦接到该另一元件,还是在该一个元件与该另一元件之间存在一个或多个中间元件。而且,除非上下文另有所指,否则如果提供方向(例如,上方、下方、顶部、底部、侧面、上、下、在…下、在…上、上部、下部、水平、竖直、“x”、“y”、“z”等),它们是相对地且仅作为示例提供的,并且为了便于说明和讨论而不是作为限制。此外,在提及元件列表(例如,元件a、b、c)的情况下,这种提及旨在包括所列出的元件的任何一个本身、少于所有列出的元件的任意组合和/或所有所列出的元件的组合。本说明书中的段落划分仅为了便于查看,并且不限制所讨论元件的任意组合。
在微流体特征的尺寸被描述为具有宽度或面积的情况下,通常相对于x轴和/或y轴尺寸来描述该尺寸,这两个尺寸均位于与微流体装置的衬底和/或盖平行的平面内。可以相对于z轴方向描述微流体特征的高度,该z轴方向垂直于与微流体装置的衬底和/或盖平行的平面。在一些情况下,诸如通道或通路的微流体特征的横截面积可以参照x轴/z轴、y轴/z轴或x轴/y轴面积。
如本文所使用的,“基本上”意指足以用于预期目的。因此,术语“基本上”允许从绝对或完美状态、尺寸、测量、结果等的微小的、无关紧要的变化,诸如本领域普通技术人员可以预期的,但这些变化对整体性能没有明显影响。当与数值或者可以表示为数值的参数或特征一起使用时,“基本上”意指在百分之十之内。
术语“ones”意味着多于一个。如本文所使用的,术语“多个”可以是2、3、4、5、6、7、8、9、10个或更多个。
如本文所使用的:μm意味着微米,μm
如本文所使用的,“烷基”是指仅由碳和氢原子组成的直链或支链烃链基团,不含不饱和度,具有1至6个碳原子(例如,C
除非在说明书中另有具体说明,否则可选地,烷基可被一个或多个取代基取代,该取代基独立地为:芳基、芳基烷基、杂芳基、杂芳基烷基、羟基、卤素、氰基、三氟甲基、三氟甲氧基、硝基、三甲基硅烷基,—OR’、—SR’、—OC(O)—R’、—N(R’)
如本文所指,氟化烷基部分是烷基部分的一个或多个氢被氟取代基取代的烷基部分。全氟化烷基部分使附着到烷基部分的所有氢被氟取代基取代。
如本文所指,“卤素”部分是溴、氯或氟部分。
如本文所指,“烯烃”化合物是包含“烯烃”部分的有机分子。烯烃部分是指由至少两个碳原子和至少一个碳-碳双键组成的基团。分子的非烯烃部分可以是任何有机分子类,并且在一些实施例中,可以包括烷基或氟化(包括但不限于全氟化)烷基部分,其中任何一个可以被进一步取代。
如本文所使用的,“空气”是指在地球大气中占主导地位的气体组分。四种最丰富的气体是氮气(通常以约78%体积的浓度存在,例如在约70-80%的范围内)、氧气(通常以约20.95%的体积存在于海平面,例如在约10%至约25%的范围内)、氩气(通常以约1.0%体积存在,例如在约0.1%至约3%的范围内)和二氧化碳(通常以约0.04%存在,例如在约0.01%至约0.07%的范围内)。空气可具有其他微量气体,如甲烷、一氧化二氮或臭氧,微量污染物和有机物质,如花粉、柴油颗粒等。空气可包括水蒸气
(通常以约0.25%存在,或在约10ppm至约5%体积的范围内存在)。空气可以作为过滤的、受控的组分提供用于培养实验,并且可以如本文所述进行调节。
如本文所使用的,术语“设置”在其含义内包括“位于”。
如本文所使用的,“微流体装置”或“微流体设备”是一种包括一个或多个离散的微流体回路和至少一个端口的装置,微流体回路被配置为保持流体,每个微流体回路由流体互连的回路元件构成,包括但不限于(多个)区域、(多个)流动路径、(多个)通道、(多个)腔室和/或(多个)坞,并且至少一个端口被配置为允许流体(以及可选地悬浮在流体中的微物体)流入和/或流出微流体装置。通常,微流体装置的微流体回路将包括流动区域和至少一个腔室,该流动区域可包括微流体通道,并且微流体回路将保持小于约1mL(例如,小于约750、500、250、200、150、100、75、50、25、20、15、10、9、8、7、6、5、4、3或2μL)的流体体积。在某些实施例中,微流体回路保持约1-2、1-3、1-4、1-5、2-8、2-10、2-12、2-15、2-20、5-20、5-30、5-40、5-50、10-50、10-75、10-100、20-100、20-150、20-200、50-200、50-250或50-300μL。微流体回路可以被配置为具有与微流体装置中的第一端口(例如,入口)流体连接的第一端和与微流体装置中的第二端口(例如,出口)流体连接的第二端。
如本文所使用的,“纳米流体装置”或“纳米流体设备”是具有包含至少一个回路元件的微流体回路的一种类型的微流体装置,该至少一个回路元件被配置为保持小于约1μL的流体体积,例如,小于约750、500、250、200、150、100、75、50、25、20、15、10、9、8、7、6、5、4、3、2、1nL或更少。纳米流体装置可包括多个回路元件(例如,至少2、3、4、5、6、7、8、9、10、15、20、25、50、75、100、150、200、250、300、400、500、600、700、800、900、1000、1500、2000、2500、3000、3500、4000、4500、5000、6000、7000、8000、9000、10000个或更多个)。在某些实施例中,至少一个回路元件中的一个或多个(例如,所有)回路元件被配置为保持以下流体体积:约100pL至1nL、100pL至2nL、100pL至5nL、250pL至2nL、250pL至5nL、250pL至10nL、500pL至5nL、500pL至10nL、500pL至15nL、750pL至10nL、750pL至15nL、750pL至20nL、1至10nL、1至15nL、1至20nL、1至25nL或者1至50nL。在其它实施例中,至少一个回路元件中的一个或多个(例如,所有)回路元件被配置为保持以下流体体积:约20nL至200nL、100至200nL、100至300nL、100至400nL、100至500nL、200至300nL、200至400nL、200至500nL、200至600nL、200至700nL、250至400nL、250至500nL、250至600nL或者250至750nL。
微流体装置或纳米流体装置在本文中可称为“微流体芯片”或“芯片”;或者“纳米流体芯片”或“芯片”。
如本文所使用的“微流体通道”或“流动通道”指具有明显长于水平和竖直尺寸的长度的微流体装置的流动区域。例如,流动通道可以是水平或竖直尺寸的长度的至少5倍,例如,是长度的至少10倍、长度的至少25倍、长度的至少100倍、长度的至少200倍、长度的至少500倍、长度的至少1000倍、长度的至少5000倍或者更长。在一些实施例中,流动通道的长度是约100000微米至约500000微米,包括在其之间的任何值。在一些实施例中,水平尺寸是约100微米至约1000微米(例如,约150到约500微米),竖直尺寸是约25微米至约200微米(例如,从约40至约150微米)。应该注意,流动通道在微流体装置中可以具有各种不同的空间构造,并且因此不限于完美的线性元件。例如,流动通道可以是或者可包括具有以下构造的一个或多个部分:曲线、弯曲、螺旋、倾斜、下倾、分叉(例如,多个不同的流动路径)及其任意组合。此外,流动通道可以具有沿其路径的不同的横截面积(扩宽和收缩),以在其中提供期望的流体流动。流动通道可包括阀,并且阀可以是微流体领域中已知的任何类型。包括阀的微流体通道的示例在美国专利6,408,878和9,227,200中公开,其所有内容通过引用整体合并在本文中。
如本文所使用的,术语“障碍物”通常是指足够大以至于部分地(但不完全地)阻止目标微物体在微流体装置中的两个不同的区域或回路元件之间移动的凸块或相似类型的结构。两个不同的区域/回路元件可以是例如微流体隔绝坞和微流体通道,或者微流体隔绝坞的连接区域和隔离区域。
如本文所使用的,术语“收缩”通常是指微流体装置中的回路元件(或两个回路元件之间的界面)的宽度变窄。收缩部可以位于例如微流体隔绝坞与微流体通道之间的界面处,或微流体隔绝坞的隔离区域与连接区域之间的界面处。
如本文所使用的,术语“透明的”是指允许可见光穿过而在光穿过时基本上不改变光的材料。
如本文所使用的,“明场”照明和/或图像是指来自广谱光源的微流体视场的白光照明,其中对比度由视场中的物体对光的吸收形成。
如本文所使用的,“结构光”是被调制以提供一种或多种照明效果的投射光。第一照明效果可以是照射装置表面的一部分而不照射(或至少最小化其照射)表面的相邻部分的投射光,例如,如下面更全面描述的用于活化DEP衬底内的DEP力的投射光图案。当使用结构光图案活化DEP力时,强度(例如诸如DMD的结构光调制器的占空比的变化)可以用于改变施加到光活化的DEP致动器的光功率,并且因此改变DEP力而不改变标称电压或频率。可以由结构光产生的另一照明效果包括可以针对表面不规则性和与光投射本身相关联的不规则性(例如,在照明区域的边缘处的下落)校正的投射光。结构光通常由结构光调制器生成,诸如数字镜装置(DMD)、微光闸阵列系统(MSA)、液晶显示器(LCD)等。用结构光照明表面的小区域,例如,所选择的关注区域,提高了信噪比(SNR),由于仅照明所选择的关注区域减少了杂散光/散射光,从而降低了图像的暗度。结构光的一个重要方面是它可以随着时间快速改变。来自结构光调制器(例如,DMD)的光图案可以用于在诸如干净的镜子或远离焦点的表面的困难目标上自动聚焦。使用干净的镜子,可以复制多个自测试特征,诸如调制传递函数和场曲率/场倾斜的测量,而不需要更加昂贵的Shack-Hartmann传感器。在结构光图案的另一使用中,代替相机,可以利用简单的功率表在样本表面处测量空间功率分布。结构光图案也可以用作光学模块/系统部件对准的参照特征,以及用作手动聚焦的手动读数。通过使用结构光图案可能实现的另一种照明效果是对微流体装置内的水凝胶的选择性固化(curing),例如凝固(solidification)。
如本文所使用的,术语“微物体”大体上指可以根据本公开被隔离和/或操纵的任何微观物体。微物体的非限制性示例包括:无生命的微物体,例如微粒;微珠粒(例如,聚苯乙烯珠粒、玻璃珠粒、无定形固体基质、Luminex
如本文所使用的,术语“细胞”与术语“生物细胞”可互换使用。生物细胞的非限制性示例包括:真核细胞、植物细胞、动物细胞(诸如哺乳动物细胞、爬行动物细胞、鸟类细胞、鱼类细胞等);原核细胞、细菌细胞、真菌细胞、原生动物细胞等;从组织解离的细胞,诸如肌肉、软骨、脂肪、皮肤、肝脏、肺、神经组织等;免疫细胞,诸如T细胞、B细胞、自然杀伤细胞、巨噬细胞等;胚胎(例如,合子)、卵母细胞、卵细胞、精细胞、杂交瘤、培养细胞、来自细胞株的细胞、癌细胞、受感染的细胞、转染的和/或转化的细胞、报告细胞等。哺乳动物细胞可以来自例如人、小鼠、大鼠、马、山羊、绵羊、牛、灵长类动物等。
如果集落中能够繁殖的所有活细胞都是源自单个亲本细胞的子细胞,则生物细胞集落是“克隆的”。在某些实施例中,克隆集落中的所有子细胞源自通过不超过10次分裂的单个亲本细胞。在其它实施例中,克隆集落中的所有子细胞源自通过不超过14次分裂的单个亲本细胞。在其它实施例中,克隆集落中的所有子细胞源自通过不超过17次分裂的单个亲本细胞。在其它实施例中,克隆集落中的所有子细胞源自通过不超过20次分裂的单个亲本细胞。术语“克隆细胞”指相同克隆集落的细胞。
如本文所使用的,生物细胞的“集落”是指2个或更多个细胞(例如,约2至约20、约4至约40、约6至约60、约8至约80、约10至约100、约20至约200、约40至约400、约60至约600、约80至约800、约100至约1000、或大于1000个细胞)。
如本文所使用的,术语“维持(多个)细胞”是指提供包括流体和气体组分两者的环境以及可选地提供保持细胞存活和/或扩增(expanding)所需的条件的表面。
如本文所使用的,术语“扩增”在指代细胞时,是指细胞数量的增加。
如本文所指,“气体可渗透的”含义是材料或结构可渗透氧气、二氧化碳或氮气中的至少一种。在一些实施例中,气体可渗透材料或结构对氧气、二氧化碳和氮气中的多于一种是可渗透的,并且还可以对所有这三种气体是可渗透的。
流体介质的“组分”是存在于介质中的任何化学或生物化学分子,包括溶剂分子、离子、小分子、抗生素、核苷酸和核苷、核酸、氨基酸、肽、蛋白、糖类、碳水化合物、脂类、脂肪酸、胆固醇、代谢物等。
如本文关于流体介质所使用的那样,“使…扩散(diffuse)”和“扩散(diffusion)”是指流体介质的组分沿着向下的浓度梯度的热力学运动。
短语“介质的流动”含义是流体介质的主要由于除扩散以外的任何机制所导致的整体运动,并且可以涵盖灌注(perfusion)。例如,介质的流动可涉及由于点之间的压力差引起的流体介质从一个点到另一个点的运动。这种流动可包括液体的连续流动、脉冲流动、周期性流动、随机流动、间歇性流动或往复流动,或者其任意组合。当一种流体介质流入另一种流体介质中时,会产生湍流和介质的混合。流动可以包括将溶液拉动通过并拉出微流体通道(例如,吸取)或将流体推入并通过微流体通道(例如,灌注)。
短语“基本上没有流动”是指流体介质的流动速率,其随时间的平均值小于材料组分(例如,关注的分析物)扩散到流体介质中的扩散速率或者在流体介质内的扩散速率。这种材料的组分的扩散速率可以取决于例如温度、组分的粒径(size)以及组分与流体介质之间的相互作用强度。
如本文中关于微流体装置内的不同区域所使用的那样,短语“流体连接”是指当不同区域基本上填充有液体(诸如流体介质)时,每个区域中的流体被连接以形成流体的单一体(single body)。这并不意味着不同区域中的流体(或流体介质)在组成上一定是相同的。相反,微流体装置的不同的流体连接区域中的流体可以具有不同的组成(例如,不同浓度的溶质,诸如蛋白、碳水化合物、离子或其它分子),由于溶质沿着它们各自的向下的浓度梯度运动和/或由于流体流经微流体装置,这些成分不断变化。
如本文所使用的,“流动路径”是指限定介质流的轨迹并经历介质流的轨迹的一个或多个流体连接的回路元件(例如,(多条)通道、(多个)区域、(多个)腔室等)。因此,流动路径是微流体装置的波及区域的示例。其它回路元件(例如,未波及区域)可以与包括流动路径而不经历流动路径中的介质流的回路元件流体连接。
如本文所使用的,“隔离微物体”将微物体限制到微流体装置内的限定区域。
微流体(或纳米流体)装置可包括“波及”区域和“未波及”区域。如本文所使用的,“波及”区域由微流体回路的一个或多个流体互连回路元件组成,当流体正在流经微流体回路时,每个流体互连回路元件都经受着介质的流。波及区域的回路元件可以包括例如区域、通道以及所有或部分腔室。如本文所使用的,“未波及”区域由微流体回路的一个或多个流体互连回路元件组成,当流体流经微流体回路时,每个流体互连回路元件基本上不经受流体通量。只要流体连接被构造为使得能够扩散,但在波及区域与未波及区域之间基本上没有介质流,则未波及区域能够流体连接到波及区域。微流体装置因此可以被构造为基本上将未波及区域与波及区域中的介质流隔离,同时使得基本上仅实现在波及区域与未波及区域之间的扩散流体连通。例如,微流体装置的流动通道是波及区域的示例,而微流体装置的隔离区域(在下面进一步详细描述)是未波及区域的示例。
如本文所使用的,流体介质流动的“未波及”速率是指足以允许隔绝坞的隔离区域中的第二流体介质的组分扩散到流动区域中的第一流体介质中和/或第一流体介质的组分扩散到隔离区域中的第二流体介质中的流动速率;并且进一步其中,第一介质基本上不流入隔离区域中。
包封细胞和测定包封的细胞的方法
对于本领域技术人员来说将是显而易见的,可以根据需要组合包封细胞和测定包封的细胞的方法的各个方面的以下描述以实现复杂的工作流程。因此,例如,单独的小标题(以及在每个这种小标题下提供的教导)旨在强调可以适当地与在任何其他小标题(和本文别处)下公开的各方面组合的方法的各方面。
微流体培养和测定设备提供高度复合环境用于维持、扩增和研究包括细胞在内的生物微物体。然而,在一些实验中,可能期望防止从特定微物体产生或发出的分泌物从包含关注的微物体的微流体设备的特定腔室扩散出或以其他方式从该特定腔室移开。为此,已经发现微流体装置中的腔室(在一些变型中可以是隔绝坞)可以通过使与水不混溶的流体介质流过腔室/隔绝坞从其开口的通道而彼此密封,从而包封每个腔室/隔绝坞。与水不混溶的流体介质可以完全填满通道。或者,可以随后引入水性介质以置换除了包封或密封腔室/隔绝坞的与水不混溶的流体介质的薄层之外的所有介质。如本文所描述的微流体装置的特征(例如,隔绝坞/腔室和通道在共享水平面上的定位、通道的结构特征以及包括连接区域和隔离区域特征和尺寸的隔绝坞的特征)可以被配置为辅助防止通道中的与水不混溶的介质进入隔绝坞,同时还允许水性流体介质保留在坞内,并且进一步地,可以在选定的子区域中引入改性表面,这也有助于包封和解包封。
无论密封是通过用与水不混溶的流体介质完全填充通道还是通过形成薄的包封层来实现的,包封都可以提供腔室到腔室的隔离(例如,将隔绝坞与任何其他隔绝坞隔离),从而允许对来自任何单独的腔室的微物体的高度选择性的进一步的操纵、测定和输出。包封可以单独地或批量地移除,以允许引入或输出试剂、测定捕获对象、分泌产物或生物细胞,为各种微流体工作流程提供灵活且可控的工具。本文描述了多种工作流程中的一些,但本公开不限于此,如技术人员在阅读本公开时可以确定的,任何合适的实验都可以使用包封方法。
当通道的表面(例如,围绕通向腔室/隔绝坞的开口的表面)和/或腔室/隔绝坞的表面包括共价结合的修饰时,可以促进密封,例如,包封,该修饰包括基本上为非极性或疏水的部分(例如,第一表面接触部分或第一反应性部分)。在一些变型中,通道的表面的所有表面积都可以被改性,例如,限定通道的侧壁、基部的内表面和盖的内表面中的每一个都可以被改性,而在其他变型中,少于通道的所有表面的表面可以被改性,并且改性的程度可以描述为通道的总表面积的百分比,该总表面积是从形成限定通道的侧壁和微流体装置的底座和盖的内表面的表面积的总和计算的。在一些变型中,可以改性少于形成每个腔室/隔绝坞的表面的所有表面积。例如,在一些变型中,可以仅改性靠近通向通道的腔室/隔绝坞的开口的表面积。本文描述的微流体装置的特征的配置(例如,腔室/隔绝坞和通道在共享水平面上的定位、通道的结构特征以及包括连接区域和隔离区域特征和尺寸的隔绝坞的特征)可以辅助选择性改性通道和/或腔室/隔绝坞内的表面。
当少于形成通道的表面的所有总表面积利用疏水表面改性时,可以选择性地且可控地引入改性程度以对形成靠近通向通道的腔室/隔绝坞的开口的通道的表面的区域进行改性,该腔室/隔绝坞通向该通道。例如,通道的一部分(例如,小于整个通道、小于约95%、约90%、约85%、约80%、约75%、约70%、约60%、约50%、约40%、约35%、约30%、约25%、约20%、约10%或更少)可以具有例如小于通道的总表面积(例如,盖的内表面、基部的内表面和形成通道的侧壁的微流体回路材料表面)的50%的疏水表面。在某些实施例中,具有通向腔室/隔绝坞的开口的通道的侧壁的表面积的100%可以具有疏水表面,而远离腔室/隔绝坞的开口的通道的侧壁可以不具有疏水表面。在一些变型中,形成靠近通向每个腔室(例如,隔绝坞)的开口的通道的表面的至少一部分可以包括疏水涂层。例如,位于通向每个腔室/隔绝坞的开口的约10微米内的通道表面可以包括疏水涂层。在一些其他变型中,形成靠近通向每个腔室/隔绝坞的开口的通道并具有疏水涂层的表面部分可以包括位于通向每个腔室/隔绝坞的开口的约20微米、约30微米、约40微米、约50微米、约60微米、约70微米、约80微米、约90微米、约100微米或更多内的表面的所有区域。在一些实施例中,形成(例如,限定)通道的盖的内表面和/或基部的内表面可以在盖和/或基部的内表面的面积的50%或更少上具有疏水涂层,并且特别地可以在相应的盖和/或基部的靠近包含通向腔室/隔绝坞的开口的侧壁的所有表面积上具有疏水涂层,而相应的盖和/或基部的远离包含通向腔室/隔绝坞的开口的通道的侧壁的内表面的表面积可以都不具有疏水涂层(例如,靠近腔室/隔绝坞的通道表面的一半可具有疏水涂层,而通道表面的另一半没有疏水涂层)。通常,当在通道中引入疏水表面改性时,包含通向腔室/隔绝坞的开口的通道的侧壁的大部分或所有表面积可具有疏水涂层。随着疏水改性量的增加,盖和/或基部的内表面的表面积的百分比也增加,从盖和/或基部的内表面与靠近腔室/隔绝坞的开口的侧壁的相交处朝向远端侧壁延伸。因此,疏水表面可以可控地引入到形成通道的表面的表面积的100%;表面积的约50%,小于表面积的50%,例如,从约1%至约49%,或大于表面积的50%,例如,从约50.1%至约100%,并且可以根据需要以在其之间的任何选定的百分比引入,如下文更详细地描述的。
替代地,或除了具有疏水涂层的通道表面之外,腔室/隔绝坞的一部分的表面(例如,连接区域最靠近通道的表面)包含共价结合的修饰,其包括基本为非极性或疏水的部分(例如,表面接触部分或反应性部分)。在一些变型中,连接区域在通向通道的开口处的表面的一部分可具有引入的疏水表面,其中,如此改性的每个表面可具有长度L
在一些变型中,连接区域在通向通道的开口处的表面的部分具有引入的疏水表面,该表面具有长度L
非极性/疏水部分可以例如包括以下项、由以下项组成或基本上由以下项组成:烷烃(包括氟代烷烃和全氟代烷烃)、烯烃、炔烃、芳环(其可以用非极性基团(例如,烷烃等)官能化)、聚合物(例如,聚丙烯)等,如可由技术人员选择的。示例性但非限制性的非极性/疏水部分在本文中进一步描述。
微流体装置内的区域选择性改性的表面的制备。
对于根据本公开的方法包封隔绝坞有用的区域选择性改性的表面可以以多种方式引入。在一些变型中,区域选择性改性的表面可以通过其中并入有光可裂解部分的疏水表面配体的区域选择性光引发的光裂解来引入,移除形成疏水表面的疏水部分。这种选择性移除可以在微流体通道和/或腔室(例如,隔绝坞)的可能不期望疏水性的区域中进行。在通道和腔室(例如,隔绝坞)的表面上呈现反应性部分的微流体装置(例如,微流体装置600(图6A))可以与具有疏水表面接触部分的疏水表面改性剂反应,该疏水表面接触部分可以是已知的任何合适的疏水表面接触部分(本文描述了此类疏水表面接触部分的非限制性列举)。疏水表面接触部分可以经由光可裂解接头(linker)链接到反应性对部分,该反应性对部分被配置为参与点击化学反应,例如炔烃,包括但不限于空间位阻炔烃,例如二苯并环辛炔基(DBCO)反应性对部分。包括在接头内的光可裂解部分可包括硝基取代的苯基、硝基取代的香豆素基或如本领域已知的任何其他合适的光可裂解部分。在一些变型中,可以使疏水表面改性剂流入微流体通道中,置换通道和隔绝坞内的二氧化碳气体环境,引入疏水改性表面610,如图6B所示,分布在通道和隔绝坞的整个内表面。光引发的光裂解可以手动或以自动方式进行,例如,使用可编程掩模工艺(masking process)。激光照明可以被引导在微流体通道和/或隔绝坞的选定部分处,以从共价结合的表面改性配体选择性地切割疏水部分,在照明区域处留下疏水性较低(例如,更亲水)的PEG“疤痕”配体615(如图6D中所示),从而提供较不疏水(或更亲水)的表面620。因此,疏水区域可以被选择性地引入(并保留)在微流体通道内,其可以小于邻近或靠近隔绝坞通向微流体通道的开口(而不是其他任何地方)设置的通道的表面积的约50%(或大于通道的表面积的约50%),如图6C所示。
类似地,疏水表面可以被引入,然后通过光引发的光裂解从每个腔室/隔绝坞位于腔室/隔绝坞通向通道的开口远端的的表面部分移除。例如,疏水涂层可以被引入到腔室/隔绝坞的所有表面上,选择性地从隔绝坞的隔离区域的表面和隔绝坞的连接区域的表面的一部分移除,或者甚至完全从隔绝坞的表面移除。在一些变型中,连接区域在通向通道的开口处的表面的部分可以保留为疏水表面,如此改性的每个表面可以具有长度L
微流体装置的每个区域中的配体的示例性示意表示在图6D中示出,其中疏水性配体605形成改性表面610,该改性表面610保留在隔绝坞的开口附近和连接区域在通向通道的开口附近的部分中。切割的配体615作为来自疏水性较低(或更亲水)的表面620的“疤痕”保留在远离隔绝坞开口的通道内、远离开口的连接区域内以及隔绝坞的隔离区域内。在一些变型中,光裂解可以仅在隔绝坞的部分内进行,并且通道的所有表面可以保留具有疏水配体605的疏水表面。
在一些其他变型中,表面改性剂可以是两种或更多种表面改性剂(其中仅一种包括疏水部分和光可裂解部分)的混合物,形成配体605。第二试剂包含第二不同的表面涂覆部分和在其接头内没有光可裂解部分的第二接头,并形成第二配体625。第二试剂的第二接头可以与第一表面改性剂的第一接头相同或不同。在一些变型中,该第二表面涂覆部分可以是亲水表面涂覆部分。图6C的在整个通道和隔绝坞上形成的表面630具有配体605和625的混合群,如图6E中示意性所示。当进行区域选择性的光引发切割时,可以形成具有切割的配体615(包括疏水配体605的剩余“疤痕”)和第二配体625的组合的表面640,从而提供比未被照明的区域中的表面更亲水的表面。在一些实施例中,疏水区域可以从靠近腔室/隔绝坞的开口的区域延伸以包含通道的所有表面。在其他实施例中,通道的一部分可以保留如上所述的疏水表面。以这种方式,可以通过改变配体的组成和每个配体的相对比例来微调表面640相比于表面630的疏水性程度。在一些实施例中,疏水性光可裂解第一配体与非光可裂解的第二配体(其可以是不同的疏水性第二配体、疏水性较低的第二配体或亲水性第二配体)的比率可为约99:1;约90:10;约85:15;约80:20:约75:25;约60:40;约50:50;约45:55;约40:60;约35:65;约30:70;约25:75;约20:80或在其之间的任何比例。在一些变型中,疏水性光可裂解配体与非光可裂解第二配体的比率范围可为约99:1至约10:90;约90:10至约50:50;约90:10至约60:40;或约90:10到约75:25。
在一些其他变型中,可以使用微流体装置的区域内的气体环境的温度控制来区域选择性地引入疏水表面。在通道和腔室(例如,隔绝坞)的表面上呈现反应性部分(例如,叠氮化物或炔基部分)的微流体装置(例如,微流体装置600(图6A))可以用环境空气(例如,未灌注有100%二氧化碳气体)冲洗,并冷却至相对于环境温度降低的温度。降低的温度可以是约-40摄氏度左右;约-35摄氏度;约-25摄氏度;约-20摄氏度;约-10摄氏度;约-5摄氏度;约0摄氏度;约5摄氏度;约10摄氏度;约15摄氏度;约20摄氏度或约25摄氏度。
第一(疏水)表面改性剂(其可以是如本文所述的任何合适的疏水表面改性剂)可以冷却至与微流体装置相同的降低的温度(5摄氏度)。试剂溶液可以在使用前用选定百分比的二氧化碳气体饱和,该选定百分比的二氧化碳气体可以是约5%、约10%、约15%、约20%、约30%、约50%、约60%、约70%、约80%、约90%、约100%或在其之间的任何百分比的二氧化碳气体。还制备了用相同百分比的二氧化碳饱和的去离子水溶液并冷却至18摄氏度,或约15摄氏度至约20摄氏度之间。二氧化碳饱和的去离子水溶液可以在略低于大气压的压力下被引入到微流体通道的装置中。通道填充去离子水溶液,但是,由于流体引入的低压(即,经由吸取)和微流体装置内的表面的未灌注性质,去离子水溶液可能不会进入从微流体通道开口的隔绝坞。进入隔绝坞的程度还取决于去离子水溶液中存在的二氧化碳的百分比(例如,二氧化碳的分压)。在引入去离子水溶液之后,微流体装置被加热到期望的温度,该温度可以是约30摄氏度;约35摄氏度、约40摄氏度、约45摄氏度、约50摄氏度、约55摄氏度、约60摄氏度、约70摄氏度、约80摄氏度、约90摄氏度或者在其之间的任何温度。在加热时,每个隔绝坞中被困的空气可以从隔绝坞向外膨胀,形成延伸到微流体通道中的气泡。冷却的疏水表面改性剂可以缓慢地(例如,约0.01ul/s达约10分钟的时间段至约0.05ul/s达约20秒的时间段,该吸取率/时间段的范围避免了隔绝坞内的气泡不期望的过度膨胀)引入到通道中,在从隔绝坞延伸的气泡周围流动,并且仅与通道中气泡不延伸的表面反应。可以允许疏水表面改性剂接触未被气泡排除的通道表面达一定时间段,该时间段可以为约15分钟、约30分钟、约45分钟、约60分钟或其间的任何分钟数。因此,可以选择性地形成如图6H-I所示的呈现疏水配体635的疏水表面650。气泡从隔绝坞向外延伸的程度可以通过在冷却的第一表面改性剂通过通道被缓慢吸取的同时微流体装置保持在的温度来控制。在一些变型中,气泡可延伸超出隔绝坞的开口以占据通道面积的约60%、约50%、约40%、约30%、约20%、约10%或约5%。因此,隔绝坞内和气泡延伸进入通道中的区域内的表面是未改性表面602(例如,叠氮化物部分仍然存在)。
在反应期完成后,可以从通道和装置中冲洗任何剩余的疏水表面改性剂。继续以1微升/秒用水进行附加冲洗达约5分钟。然后可以通过用二氧化碳气体进行冲洗同时将微流体装置加热至以下温度来干燥具有疏水表面改性的微流体通道的微流体装置:约30摄氏度;约40℃;约40摄氏度;约45摄氏度;约50摄氏度或更高,从而灌注微流体装置的内部用于在微流体通道的剩余部分和隔绝坞内(例如,其中存在图6H中的表面602)用第二表面改性剂进行区域选择性表面改性。然后可以通过使第二表面改性剂流过微流体装置来区域选择性地进行第二表面改性。该第二表面改性剂(其与第一表面改性剂相比更不疏水,或可以是亲水表面改性剂)可以进入隔绝坞并与仍然存在于通道(其中气泡阻止了之前的改性)中和隔绝坞中的剩余的反应性部分反应,形成表面670,其由改性表面上的亲水配体625组成,如图6J所示。因此,疏水表面650可以被引入为小于通道的表面积的约50%;约45%;约40%;约35%;约30%;约25%;约20%;约15%;或更少,并且亲水表面670被引入隔绝坞内和隔绝坞的开口附近,延伸到通道中。
本文公开的技术还可用于将任何种类的表面改性的组合区域选择性地引入通道、隔绝坞和围绕每个隔绝坞通向通道的开口的区域,这取决于:为每个表面改性剂的引入而选择的温度、在微流体装置环境中平衡的二氧化碳气体的百分比和/或表面改性剂。在另一个变型中,图6H-6J中引入的疏水表面660可以包括表面改性配体的组合,其中可以如所述地引入两个配体635和645的组合,其中表面接触部分635提供疏水表面接触部分,并且表面接触部分645可以是:不同的疏水表面接触部分、亲水表面接触部分或提供不同表面化学的表面接触部分,它们可以以任何比率使用,从而根据特定应用的需要而微调疏水表面660。在一些实施例中,疏水配体635与配体645的比率可为约99:1;约90:10;约85:15;约80:20;约75:25;约60:40;约50:50;约45:55;约40:60;约35:65;约30:70;约25:75;约20:80或在其之间的任何比率。在一些变型中,疏水配体635与配体645的比率范围可以为从约99:1至约10:90;约90:10至约50:50;约90:10至约60:40;或约90:10到约75:25。
在一些其他变型中,通道可具有超过约50%;约55%;约60%;约65%;约70%;约75%;约80%;约85%;约90%;或约100%的第一疏水涂层650或660,其可以是如本文所述或本领域已知的任何合适的疏水涂层,而通道的剩余部分(例如,在隔绝坞的连接区域的开口附近)和隔绝坞内的表面具有第二亲水涂层670,其可以是如本文所述或本领域已知的任何合适的亲水涂层。
如图6K所示,微流体装置600可具有如本文所述的在整个通道上的疏水表面650或660,并且还可以延伸到腔室的一部分(或隔绝坞的连接区域)中,使用温度控制和二氧化碳含量以可控地区域选择性地引入疏水表面。连接区域的具有引入到其的疏水表面的部分可以如子区域731,如图7D所示,并且具有如本文所述的长度L
在其他变型中,通道可以具有小于50%的第一疏水涂层,其可以是如本文所述或本领域已知的任何合适的疏水涂层,而通道的剩余部分(例如,靠近隔绝坞的连接区域的开口)和隔绝坞内的表面具有第二疏水涂层,其中第二疏水涂层不同于第一疏水涂层,并且可选地,为如本文所述或本领域已知的任何合适的疏水涂层。
在一些其他变型中,第一表面改性剂可以包括表面改性配体的混合物,包括第一疏水性配体635和第二配体645,它们可以具有不同的疏水性、可以是中性的或亲水的,并且可以以任何比率存在于第一表面改性剂中,从而提供如图6F-6L中所示的疏水表面660(用于提供图6F的微流体装置表面的方法也可以具有配体635和645的这种组合表面660,尽管未在图6F中示出)。在一些实施例中,第一表面改性剂的第一疏水性配体与第二配体的比率,其中第二配体可以是不同的疏水性第二配体、疏水性较低的第二配体或亲水性第二配体,并且比率可以为约99:1;约90:10;约85:15;约80:20:约75:25;约60:40;约50:50;约45:55;约40:60;约35:65;约30:70;约25:75;约20:80或在其之间的任何比率。在一些变型中,第一表面改性剂的第一疏水性配体与第二配体的比率范围可以为约99:1至约10:90;约90:10至约50:50;约90:10至约60:40;或约90:10至约75:25。
在一些其他变型中,引入达通道表面积的超过50%;小于50%或被认为适合特定实验的任何比例的第一表面修饰可以是亲水表面修饰(例如,将配体625引入通道的远离隔绝坞通向通道的开口的部分中,形成表面),并且引入到隔绝坞的开口附近的通道表面和隔绝坞本身的表面的第二表面修饰可以是疏水表面修饰650(如果仅引入一种类型的疏水配体635)或660(当第二表面改性剂同时引入第一疏水性配体635和第二配体645时),如图6L所示。
在一些其他实施例中,第一表面修饰和第二表面修饰中的一个或两者可以是表面改性配体的混合物,例如,在第一表面改性剂和/或第二表面改性剂中可以存在不同的化学种类的混合物。可以以任何合适的比率修改混合物的比例,以通过引入到微流体装置的两个不同地改性的区域中的每一个中的表面改性提供特定的物理化学行为。
在另一个变型中,可以引入多于两个不同的表面。例如,微流体装置可以具有引入到微流体通道的有限区域(例如,腔室(例如,隔绝坞)的通向通道的开口附近)以及腔室在腔室通向通道的开口附近的表面的部分(例如,隔绝坞的连接区域的表面的靠近通向通道的开口的部分)的疏水表面,如图7A-7C所示。通道的剩余部分(例如,腔室(隔绝坞)通向通道的开口的远端)可以具有亲水(或不同地疏水)的表面。然而,腔室的内部(例如,隔离区域和连接区域靠近隔离区域的部分)可以不进行处理以用于以后的表面改性,或者可以引入第三不同的表面改性,如图7C所示。
这可以使用本文描述的温度和气体含量控制的引入的变型来实现。第一表面改性剂溶液(其是亲水性或疏水性较低的表面改性剂)可以通过在略低于大气压下在所需的温度下(其可以为约30摄氏度)吸取溶液经过装置的通道来被引入到微流体装置的通道中。由于流体引入的低压和微流体装置内的表面的未填充性质,第一表面改性剂溶液可能不会进入从微流体通道718开口的隔绝坞。将微流体将装置加热到较高的温度(例如,诸如约36摄氏度等)可以允许气泡从坞仅稍微向外膨胀进入通道中,从而防止第一表面改性剂进入隔绝坞,如图7A所示,并且气泡触及(broach)的区域以外的通道用表面770的亲水性第一表面改性剂进行改性,其可以类似于图6F至图6L的表面670。隔绝坞内的表面702保持未反应。第二表面改性剂(即,疏水试剂)然后可以在较冷的温度(例如,18摄氏度)下流入。来自每个隔绝坞的气泡然后可以收缩回隔绝坞,允许疏水试剂进入隔绝坞的连接区域的一部分(例如,连接区域最接近或靠近隔绝坞通向通道的开口的部分)。疏水表面750可以形成为紧邻坞开口(图7A中气泡在此处延伸)并且进入连接区域的由于气泡收缩而暴露的部分,如图7B所示。疏水表面750可以类似于图6F至图6L的疏水表面650。在其他变型中,疏水表面750可以具有多于一种类型的配体,如图6F-6L的混合疏水表面660。
腔室的内部(例如,隔离区域和隔绝坞的连接区域的远离隔绝坞通向通道的开口的部分)仍可保留未改性的含有反应性部分的表面,例如,具有叠氮基或炔基部分。之后可以进行第三表面改性以在用二氧化碳灌注之后将任何期望的表面改性引入到隔绝坞中。表面改性可以是如以下文献中所描述的任何共价结合的表面:2016年4月22日提交的题为“Microfluidic Cell Culture(微流体细胞培养)”的第PCT/US2016/028808号国际申请;2017年5月26日提交的题为“Covalently Modified Surfaces,Kits,and Methods ofPreparation and Use(共价改性的表面、试剂盒以及制备和使用方法)”的第PCT/US2017/034832号国际申请;以及2020年2月14日提交的题为“Laser Assisted Repositioning ofa Micro-Object and Culturing of an Attachment-Dependent Cell in aMicrofluidic Environment(在微流体环境中微物体的激光辅助重新定位和附着依赖细胞的培养)”的第PCT/US2020/018388号国际申请,每个公开内容均通过引用整体并入本文。在一些变型中,通道和隔绝坞的连接区域的部分的表面改性(第一表面改性和第二表面改性)可以在第一时间点被引入,并且腔室的内部(例如,隔离区域和连接区域的远离隔绝坞通向通道的开口的部分)的表面改性可以在稍后的日子或时间进行。因此,三个表面的任何期望的组合可以区域选择性地被引入微流体装置中。通过改变在反应期间的微流体装置的温度以及存在的二氧化碳的百分比,可以修改在隔绝坞的开口处并渗透到连接区域的部分中的疏水表面改性的“带”的程度(例如,“厚度”),例如,从隔绝坞的开口到隔绝坞本身中的距离。例如,增加引入到疏水表面改性剂中的二氧化碳的百分比将允许更多地渗透到隔绝坞中并产生更广泛的(例如“更厚”)的支撑包封层的疏水表面带。
图7D示出了隔绝坞627的不同区域与可以在微流体装置内引入的不同改性表面之间的关系。隔绝坞627与图7C的隔绝坞627相同,具有引入到大于微流体通道718的表面的50%的亲水表面770,特别地,用亲水表面对通道的远离隔绝坞627的开口的侧壁进行改性。疏水表面750已被引入到通道718的靠近隔绝坞的开口的部分。在该变型中,疏水表面750延伸到连接区域的一部分中,如本文所述。该部分是连接区域的子区域731,其靠近连接区域通向通道718的开口。限定子区域731的壁具有如本文所述的长度L
在一些方面中,提供了一种微流体装置,其中,该微流体装置具有围栏,该围栏包括通道和多个腔室,多个腔室中的每个腔室具有将腔室流体连接到通道的开口(例如,单个开口),其中,多个腔室中的每个腔室由具有总表面积的多个表面形成,其中,每个腔室的总表面积的第一部分包括疏水涂层,每个腔室的总表面积的第二部分包括亲水涂层,并且其中,每个腔室的总表面积的第一部分位于腔室开口与通道之间的边界附近。
多个腔室中的每个腔室的总表面积的第一部分可以靠近并围绕腔室通向通道的开口(例如,形成腔室的开口的每个表面在靠近腔室开口与通道之间的边界的位置处包括疏水涂层)。在一些变型中,多个腔室中的每个腔室的位于腔室开口与通道之间的边界的约10微米内(例如,约20微米内、约25微米内、约30微米内、约35微米内、约40微米内、约45微米内、约50微米、约55微米、约60微米或更多)的所有总表面积可以包括疏水涂层。通道可由具有总表面积的多个表面形成(例如,限定),其中通道的总表面积的一个或多个部分具有疏水涂层(例如,与多个腔室相同的疏水涂层)。在一些实施例中,具有疏水涂层的通道的总表面积的一个或多个部分中的每一个可以位于通道与多个腔室中的对应的腔室之间的边界附近。在一些实施例中,位于通道与多个腔室的开口之间的边界的约10微米内(例如,约20微米内、约25微米内、约30微米内、约35微米内、约40微米内、约45微米内、约50微米、约55微米、约60微米或更多)的通道的所有总表面积可以具有疏水涂层。在一些实施例中,通道的基本上所有(例如,至少80%、85%、90%、95%、98%、99%或更多)的总表面积可具有疏水涂层。在一些变型中,多个腔室的疏水涂层可具有约45度至约100度的接触角度。
在一些变型中,多个腔室中的每个腔室可以是隔绝坞,其包括隔离区域和将隔离区域流体连接到通道的连接区域。在一些实施例中,每个隔绝坞的疏水涂层可以存在于连接区域中,并且基本上不存在于隔离区域中(例如,形成隔离区域的腔室表面的总表面积包括小于5%、4%、3%、2%、1.5%、1%、0.5%的疏水涂层)。在一些变型中,形成每个隔绝坞的连接区域的腔室表面的总表面积的小于或等于50%可具有疏水涂层。在一些其他变型中,形成每个隔绝坞的连接区域的腔室表面的总表面积的大于或等于50%可具有疏水涂层。在一些变型中,形成每个隔绝坞的连接区域并且包括疏水涂层的腔室表面可以形成围绕连接区域的近端的环(例如,从通道与连接区域的近端开口之间的边界开始并且延伸到连接区域中)。
在一些变型中,形成每个隔绝坞的隔离区域的腔室表面的总表面积的大于或等于50%可包括亲水涂层。在一些实施例中,形成每个隔绝坞的隔离区域的腔室表面的基本上所有总表面积(例如,至少80%、85%、90%、95%、98%、99%或更多)可以包括亲水涂层。
在一些变型中,疏水涂层可以包括第一共价结合的表面修饰,其包括:第一链接基团和第一部分,其中,第一部分是非极性的(例如,油酸部分、炔基部分、PEG链接的炔基或氟化部分)。在一些变型中,亲水涂层可以包括多个第二共价结合的表面修饰,其每一个包括第二链接基团和第二部分,其中,第二部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
在一些变型中,每个隔绝坞的连接区域可以包括通向通道的近端开口和通向隔离区域的远端开口,其中,连接区域的近端开口可以具有范围从约20微米至约100微米(例如,约20微米至约60微米,或约30微米至约90微米)的宽度W
在一些变型中,通道(例如,具有基本均匀的宽度的通道)的宽度W
通道在多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的高度可以在约20微米至约100微米之间(例如,约30微米至约50微米之间、约50微米至约70微米之间、约70微米至约90微米之间、约35微米至约45微米之间、约45微米至约55微米之间、约55微米至约65微米之间、约65微米至约75微米之间、或约75微米至约85微米之间)。
在一些变型中,多个腔室中的每个腔室(或每个隔绝坞)的体积可以在从约2x 10
在一些变型中,微流体装置的围栏还可以包括:基部;微流体回路结构,设置在基部的内表面上;以及盖,设置在微流体回路结构上方,其中,基部、微流体回路结构与盖共同限定通道与多个腔室。
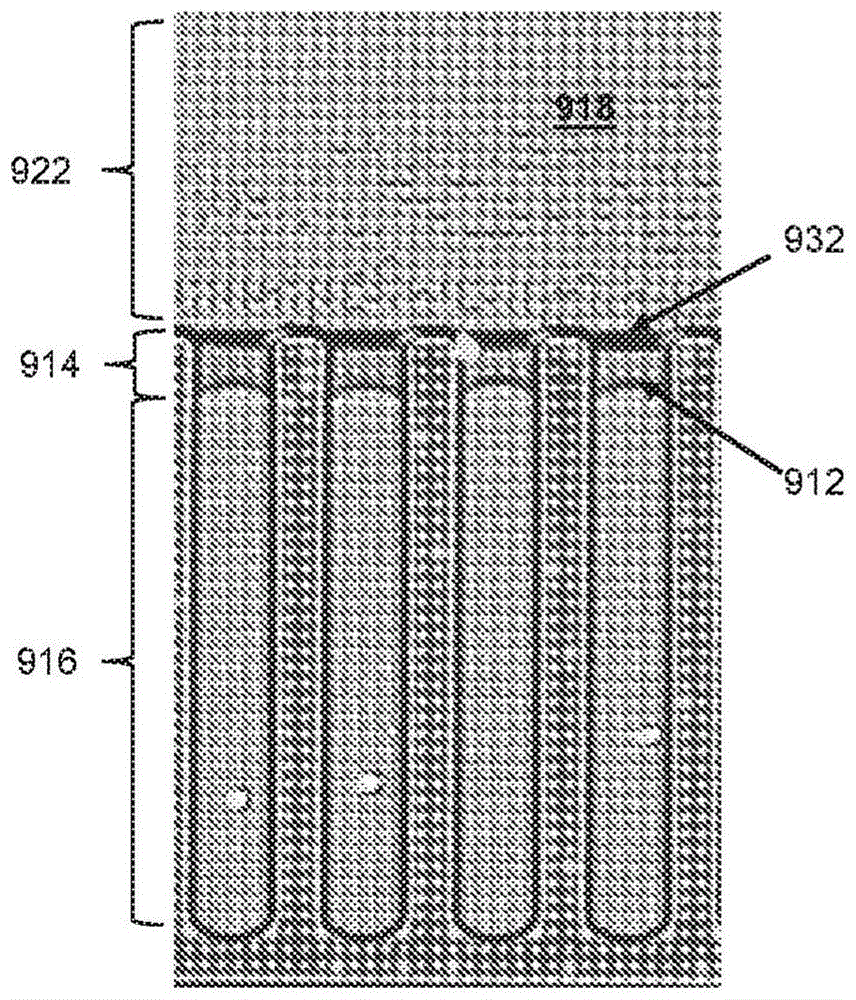
生成和选择性地移除用于生物细胞分析的包封层。使用如本文所述的具有引入到微流体通道和腔室(例如,隔绝坞)的改性表面的微流体装置,可以(在一些变型中,选择性地)生成并随后移除包封层,如图8A至图8B和图9A至图9C所示。疏水表面至少存在于在腔室通向通道的开口附近,或者可以以更大的比例存在于微流体装置的整个通道和/或腔室中。疏水表面可以辅助支撑每个腔室的包封层。在一些非限制性实施例中,通道的一个或多个表面可包括疏水涂层。在一些变型中,通道的一个或多个表面可以包括亲水涂层和/或每个腔室或隔绝坞的一个或多个表面可以包括亲水涂层。在一些实施例中,通道的一个或多个表面可以包括疏水涂层,并且每个腔室或隔绝坞的一个或多个表面可以包括疏水涂层(例如,每个腔室的通道近端部分可以包括疏水涂层)。在一些变型中,疏水涂层可具有约45度至约100度的接触角度。在另外的实施例中,通道和/或隔绝坞的部分的表面的表面积的选择性部分(例如,大于或等于1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%等)可以涂覆有涂层,如本文所述。更具体地,在一些实施例中,通道的一个或多个表面或选择性部分(例如,大于或等于表面积或表面的1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%等)可以包括疏水涂层,和/或每个腔室或隔绝坞的一个或多个表面或选择性部分(例如,大于或等于1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%等)可以包括亲水涂层。在一些变型中,形成靠近通向多个腔室中的每个腔室(例如,隔绝坞)的开口的通道的表面的至少一部分可以包括疏水涂层,例如,位于通向每个腔室/隔绝坞的开口的约10微米内的通道表面可以包括疏水涂层。在一些其他变型中,形成靠近通向多个腔室中的每个腔室的开口的通道的表面的部分可以是位于通向每个腔室的开口的约20微米、约30微米、约40微米、约50微米、约60微米、约70微米、约80微米、约90微米、约100微米或更多内的表面。在替代实施例中,通道的一个或多个表面或选择性部分
(例如,大于或等于1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%等)包括亲水涂层,和/或腔室或隔绝坞的一个或多个表面或选择性部分(例如,大于或等于1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%等)可以包括亲水涂层。在一些其他变型中,通道的一个或多个表面或选择性部分(例如,小于或等于5%、10%、15%、20%、25%、30%、40%、50%)可包括疏水涂层。可选地,腔室或隔绝坞的一个或多个表面或选择性部分(例如,大于或等于1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%等)可以包括亲水涂层。具有所描述的表面涂层的表面的百分比可以表示表面积,其可以从形成(例如,限定)通道或腔室的表面的总和来计算,相对应地(例如,由微流体回路材料形成的盖、基部和侧壁)。在一些实施例中,微流体装置的多个腔室中的每个腔室可包括包含亲水涂层的表面。在一些实施例中,其中当微流体装置的多个腔室是多个隔绝坞时,至少每个隔绝坞的隔离区域可以包括亲水涂层。在一些其他实施例中,当多个腔室包括多个隔绝坞(隔绝坞包括隔离区域和将隔离区域流体连接到通道的连接区域)时,连接区域靠近通道的一部分(例如,在连接区域的近端处形成环的表面,其可以如图7D的具有L
在一些变型中,疏水涂层可以包括第一共价结合的表面修饰和第一部分,该第一共价结合的表面修饰包括第一链接基团,其中,第一部分是非极性的(例如,油酸部分、炔基部分、PEG链接的炔基或氟化部分)。在一些变型中,亲水涂层可以包括多个第二共价结合的表面修饰和第二部分,每一个第二共价结合的表面修饰包括第二链接基团,其中,第二部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
在一些实施例中,每个隔绝坞的连接区域可以包括通向通道的近端开口和通向隔离区域的远端开口,连接区域的近端开口具有范围从约2微米至约100微米、约20微米至约100微米、约2微米至约300微米、或约20微米至约300微米的宽度W
“基本”均匀的宽度意味着在通道的平均宽度的+/-10%(例如,9%、8%、7%、6%、5%、4%、3%、2%或1%)内。通道(例如,具有基本均匀的宽度的通道)在多个腔室中的每个腔室的开口(例如,通向隔绝坞的连接区域的近端开口)处的宽度W
许多参数可有助于密封腔室(例如,隔绝坞)的能力。不受理论的束缚,接触角度可能是有助于包封层进行包封的有效性的重要因素。与微流体装置的表面的接触角度和两个不混溶性介质之间的表面张力可能对包封层所承受的爆裂压力有很大贡献。其他值得注意的参数包括收缩/膨胀时的角度、包封的开口的宽度、通道/腔室中介质的高度和压力。
包封包含一个或多个微物体(例如,生物细胞)的腔室并且随后选择性地且可控地移除特定包封层(例如,解包封选定的腔室)的能力可为各种类型的分析提供优势。包封可以:抑制(或防止)分泌的蛋白质、小分子和其他生物产物离开产生分子的腔室(这可以防止串扰并附加地,提高分泌率分析的精度);将移动的生物细胞保留在腔室内;在生物细胞的裂解后保留核酸;保留捕获珠粒,该捕获珠粒可以捕获小分子、蛋白质或核酸;和/或抑制(或防止)引入到腔室中的任何缓冲液或试剂(例如,测定试剂)离开该腔室并进入另一个腔室。这些特性中的任何一个都可以有用地包括在使用包封的腔室进行的测定中。
可以使用DEP力、重力或本文所述的任何其他动力将一个或多个微物体(例如,一个或多个细胞和/或一个或多个捕获珠粒)引入到腔室(例如,隔绝坞)中。细胞或多个细胞可以是但不限于:哺乳动物细胞;细菌细胞;植物细胞;酵母细胞或源自丝状真菌的孢子。细胞或多个细胞可以是免疫细胞、胎儿细胞、干细胞或祖细胞。细胞或多个细胞可以是T细胞或B细胞。捕获珠粒或多个捕获珠粒可以是但不限于结合生物材料的任何珠粒,例如,非特异性捕获珠粒、抗原捕获珠粒、酶捕获珠粒、核酸捕获珠粒或其任意组合。
在一些实施例中,微物体可在水性介质内流入微流体通道中,并且一些或所有微物体可选自微流体装置的通道中的含微物体的水性介质,以置于一个或多个腔室内。在一些实施例中,可以在单个腔室内仅布置一个细胞。任何其他期望的试剂/捕获物体/饲养细胞或其他附属生物微物体也可以被引入到腔室中。例如,非特异性地结合生物材料(例如肽、蛋白质或小分子)的一个或多个捕获珠粒可以与细胞一起置于腔室中;一个或多个抗原特异性捕获珠粒或酶捕获珠粒可以与细胞一起置于腔室中;和/或一个或多个核酸结合捕获珠粒可以与细胞一起置于腔室中。虽然通道和腔室中的水性介质(例如,第一水性介质)最初可能具有基本相同的组成,但腔室中的水性介质可能随着时间而变得不同,例如,由于细胞分泌物进入到腔室中包含生物细胞的第一水性介质中;这种分泌物可能结合到存在于腔室中的捕获珠粒。水性介质可以包括任何种类的碳/能源,并且在一些变型中,还包括用于支持细胞活力和生长的矿物质和营养物。腔室可以用与水不混溶的流体介质层包封,其可以将每个腔室内的第一水性介质与通道中的介质分离(例如,隔离)。在此上下文中使用的“隔离”可能意味着完全分离。或者,分离/隔离可以允许某些类型的分子在通道与腔室之间扩散,例如,类固醇可以如何扩散通过质膜,或气体分子(例如,氧气)可以从与水不混溶的流体扩散到水性流体中。可选地,包封可以是可逆的(例如,对于单个腔室/坞选择性地可逆或在微流体装置上的腔室/坞的阵列上全局可逆)。与水不混溶的流体介质可以置换通道中基本上所有的第一水性介质,其中“基本上所有”在此上下文中是指通道中的水性介质的至少约95%(例如,至少约96%、约97%、约98%、约99%、约99.5%、约99.8%、约99.9%或更多)。与水不混溶的流体介质层可以通过使与水不混溶的流体介质流入到微流体通道中或用与水不混溶的流体介质填充通道来引入。与水不混溶的流体介质可以是如本文所述或本领域已知的任何合适的与水不混溶的流体介质。当引入与水不混溶的流体介质层时,它被引入而基本不会置换腔室内的水性介质,即腔室内的水性介质和其中包含的细胞和试剂不会大量地被置换或逐出。如本文所使用的,“基本不会置换”是指每个腔室中的介质的约20%或更少(例如,18%、15%、12%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少)。在某些实施例中,腔室包括连接区域和隔离区域(如本文别处所述),并且使与水不混溶的流体介质流入到通道中基本上置换了通道中的所有第一水性介质,而不置换腔室的隔离区域中的任何第一水性介质。在某些相关实施例中,使与水不混溶的流体介质流入到通道中基本上置换了通道中的所有第一水性介质,同时置换连接区域中的第一水性介质的50%或更少(例如,45%、40%、35%、30%、25%、20%或更少)。与水不混溶的流体层可能不会大量地置换腔室内的水性介质,部分原因在于微流体装置的构造和结构。例如,本文所描述的微流体装置的特征(例如,隔绝坞/腔室和通道在共享水平面上的定位、通道的结构特征以及包括连接区域和隔离区域特征和尺寸的隔绝坞的特征)可以被配置为防止通道中的与水不混溶的介质进入隔绝坞,同时还允许水性流体介质保留在坞内。
在一些实施例中,不混溶的流体介质是油。在一些实施例中,为了提供跨通道和腔室的分压梯度的目的,可以用气体或气体混合物使与水不混溶的流体介质氧化或饱和。与水不混溶的流体介质可以与疏水或亲水涂层的组成配对,使得该配对被配置为促进在腔室或隔绝坞的连接区域中(例如,在连接区域靠近微流体通道的部分(例如,子区域)处,如本文所述)的包封层的热力学上有利的形成;包封层的热力学上有利的形成可以例如包括在与水不混溶的流体介质与疏水涂层之间形成疏水相互作用。
在一些实施例中,如图8B所示,第二水性介质可以被引入(例如,吸取或流动)到微流体通道中,将与水不混溶的流体介质的超过约40%、约50%、约60%、约70%、约80%、约90%或约95%拉出通道,留下剩余部分作为包封层914。引入与水不混溶的流体介质后,随后可以引入第二水性介质介质,其中,在此上下文中使用的“随后”可以就在与水不混溶的流体介质之后(例如,紧接在其之后),或在中间介质(例如,空气、空气中的5% CO
在移除选定的腔室或所有腔室的包封层之前,可以使用明场和/或发射(例如,荧光)显微术一段时间,随时间对如此包封在腔室(例如,隔绝坞)内的细胞进行培养(例如,孵育)和/或测定和/或监测。例如,细胞可以培养一段时间,包括但不限于:约30分钟;约45分钟;约1小时;约2小时;约4小时;约6小时;约8小时;约10小时;约12小时;约18小时;约24小时;约48小时;约72小时;或者更长。在一些实施例中,细胞可培养约2小时至约24小时、约4小时至约24小时(例如,约8小时至约12小时之间、约12小时至约16小时之间、约16小时至约20小时之间)或在其之间的任何时间长度。细胞可以培养一个时间段或可以培养重复的时间段。细胞可以在约18摄氏度(C)至约50摄氏度之间(例如,约25摄氏度至约37摄氏度之间)的温度下培养。
监测可以包括监测细胞的活性,这可以形成测定细胞的部分。监测可以在第一培养期期间进行,并且可以在第一培养期期间的多个时间点处进行。监测可以约每5分钟进行一次;约每10分钟一次;约每15分钟一次;约每30分钟一次;约每小时一次;或者更长时间一次。或者,监测可以在第一培养期和/或附加的培养期期间连续或基本连续地进行。在其他变型中,监测可在第一培养期后进行或可在每个培养期后进行。
监测可以包括对包封在腔室内的细胞(和/或捕获珠粒)成像,并且可以附加地包括对其中布置了细胞的腔室(例如,隔绝坞)成像。可以对这些图像进行量化,以确定细胞体积、细胞密度、发射(例如,荧光)量、与捕获珠粒结合的分泌物量(例如,如通过结合到报告分子的荧光信号确定的,该报告分子与结合珠粒的分泌的分子结合)、分泌的小分子的浓度、生物分子的表达水平和可能与细胞分泌、细胞健康和/或使细胞亚群彼此区分相关的其他指标。量化可以在单个固定的时间点或在固定的时间段内的离散时间点进行,并且可以对量化后的信息进行比率、关系和/或其他数学操作,以在包封在整个微流体芯片的离散腔室中的相似细胞群或包封在整个微流体芯片的离散腔室中的功能不同的细胞群上做出关于每个腔室中的细胞的推论。
包封在腔室内的细胞可以表达不同量的关注的分子或报告分子(例如,其中,报告分子指示细胞的活性)。如本文所使用的,“不同量”可涵盖从无表达/分泌物到极高水平的表达/分泌物的任何。关注的分子可以是小分子、碳水化合物、肽、蛋白质、核酸或能够由生物细胞产生的任何其他分子。在一些变型中,关注的分子或报告分子(例如但不限于绿色荧光蛋白)可以是分泌的。在其他变型中,关注的分子或报告分子可以经由裂解从细胞中释放出来。在其他变型中,关注的分子或报告分子在存在于细胞内的同时可以被监测、检测和/或量化。由于包封层防止腔室内分泌或释放的小分子/碳水化合物/肽/蛋白质/核酸扩散出腔室,因此每个腔室中观察到的荧光/发光/光密度(例如,可检测的信号)可能是仅由于由细胞产生的分子或从驻留在每个腔室中的细胞(例如,细胞的内容物)释放的分子。装置内其他地方产生的分子可能不会对选定腔室中的可检测信号做出贡献,对应地,在选定腔室中观察到的可检测光信号的量可能不会被从该腔室扩散出的分泌的小分子、碳水化合物、肽、蛋白质或核酸减弱。当监测包封的细胞时,可以更准确地检测关注的分子或报告分子的表达水平,因为在包封的隔绝坞内观察到的信号仅仅是由于相应的细胞的关注的分子或报告分子引起。用于选择关注的细胞以进行附加的测定或进一步培养的阈值可以由用户预先确定,例如相对于对照组,或者可以通过在微流体装置内的多个隔绝坞上建立的检测信号的相对水平来确定。
替代地或附加地,可以监测细胞以确定细胞的一个或多个表型参数,其包括但不限于细胞表面标记(例如,分化分子簇(CD));细胞分裂率、寿命、形态差异和可观察或可测试的其他固有特质或特征。
替代地或附加地,可以监测细胞以确定细胞生长,这可包括细胞大小的变化或可包括确定细胞群(例如,细胞的克隆群)的扩增或扩增速率。
在附加的或替代的实施例中,包封可以适于执行用户特定的目标,这些目标依赖于选择性地或均匀地将细胞或细胞群隔离到腔室或坞中以为了对一个或多个基因型或表型不同的细胞进行一系列单独的实验、测定,或工作流程的目的,以为了在变化的或相似的条件下标识或表征基因型或表型不同的细胞的目的。例如,在本文所示的任一示例中,包封层可被配置为对于置于腔室的水性溶液内的水性溶液中的溶质的扩散而言相对不可渗透,对于腔室的水性溶液中的可溶性组分类选择性地不可渗透,和/或对于包封在坞中的水性溶液不可渗透。在一些实施例中,包封可以被配置为执行以下非限制性用途中的任一个:防止坞或腔室之间的串扰,限制小分子在坞或腔室之间的扩散;对单个细胞进行遗传表征;和/或防止活动细胞在坞或腔室之间迁移。
在培养、测定、操纵细胞(例如,裂解和捕获核酸用于核酸测序和遗传表征)的过程期间或之后,可以选择性地或批量地移除包封层,从而产生一个或多个解包封的腔室(例如,隔绝坞)。可以选择性地或随机地移除单个包封层或成组的包封层。
可以在细胞培养期间的限定时间点移除一个或多个包封层。在一些实施例中,包封可用于选择性地将不同条件引入细胞以测定条件对一个或多个细胞或细胞类型的影响。例如,在一些实施例中,可以以特定顺序移除包封层以支持将不同类型的介质选择性灌注到单个选定的腔室或隔绝坞或选定的腔室或隔绝坞组中。在其他非限制性实施例中,可以进行包封以将某些细胞与有害条件(例如,用于细胞裂解的裂解剂)隔离,而解包封可以用于将某些细胞暴露于这种有害条件(例如,裂解条件)。附加地或替代地,可以进行包封以选择性地将裂解细胞的组分包含在腔室或坞中以为了保留或限制RNA/DNA在腔室或坞之外的扩散的目的。在另外的变型中,解包封,无论是批量解包封还是选择性解包封,可以允许微物体(例如,细胞或珠粒)选择性地或批量地的释放(unpen)。如本文所使用的,释放可以指将微物体移出腔室/隔绝坞,并区别于在释放微物体后将微物体输出到芯片外。如图11A至图11C中所示,包封和解包封可以有效地将处理腔室与非处理腔室分开,因为只有选择性移除了包封层的单个腔室(例如,隔绝坞)在腔室内显示出任何荧光。根据特定工作流程的需要和设计,可以在任何工作流程期间执行一次、两次、三次、四次或任何期望次数的包封和/或解包封。
用于大量移除包封层的方法可以包括使包括一个或多个表面活性剂的介质流过通道。表面活性剂的类型和灌注速率可以被配置为以特定速率移除包封层。表面活性剂可以配制成表面活性剂的水性溶液,其中,表面活性剂以约0.1%;约0.5%;约1.0%;约2%;约3%;约4%;约5%或在其之间的任何百分比存在。在一些变型中,表面活性剂可以以约0.1%或约1.0%的浓度存在。含表面活性剂的水性介质可以以约0.2ul/s至约1.0ul/sec的速率流过微流体通道。在一些其他实施例中,表面活性剂溶液可以约2.0ul/s;约3.0ul/s;约4.0ul/s或约5ul/s流过微流体通道。如图10A至图10E所示,表面活性剂可以在通道内流动以置换填充通道的与水不混溶的流体介质,或者表面活性剂的流动可以置换覆盖腔室(例如,隔绝坞)的与水不混溶的流体介质的薄包封层。表面活性剂可以是如本文所述或本领域已知的任何合适的表面活性剂。
在一些变型中,当包封层是薄包封层时,例如,整个通道没有填充与水不混溶的流体介质,至少如图9B至图9C、图11A至图11D、图12A至图12C所示,可以通过将目标激光脉冲施加到腔室内靠近包封层的水性介质来移除包封层。在此上下文中,靠近是指在包封层的约100um内(例如,在约90um、约80um、约70um、约60um或约50um内)。选择激光照明以产生指向薄包封层的气泡,将包封层的与水不混溶的流体推出到微流体通道中并远离通向腔室的开口。可以选择激光的功率(离开光学系统的有效功率可以约为10-100mW)和波长(其可以为约450nm至约1000nm,可以为约800nm)来在介质中使气泡成核,气泡产生足以破坏包封层的机械扰动和剪切力。虽然激光照明可能需要在约50ms的时段内选择程序化的斜坡(ramp)/输送以输送阈值量的能量来使气泡成核,但所需的能量输送的实际时段要短得多,例如在几微秒的数量级上,例如,约3ms、约5ms、约6ms等。一旦气泡成核,则气泡本身就会减慢气泡尺寸的进一步增加速率,并且一旦已超过引发/成核能量输入,就不需要更长的照明时段。在一些实施例中,如图11A至图11D所示的选择性移除(例如,解包封)可以在包括已包封在坞中的细胞的腔室或坞的包封层上进行,从而允许特定的靶细胞暴露于流过通道的新介质。用于引入附加的不同组成的水性介质(例如,第二、第三、第四、第五等)的方法可以包括一个或多个先前公开的用于生成包封层的方法,然后选择性移除一个或多个坞,以及使不同组成的介质(例如,第二、第三、第四、第五等类型的介质)以促进通道与解包封的腔室或隔绝坞之间的介质交换的速率和持续时间流入到通道中。一旦交换完成,与水不混溶的流体介质就可以流入到通道中以重新形成包封层。
在另外的实施例中,一个或多个腔室或坞上的包封层的选择性移除可以被配置为用于基于细胞的定量或定性特征来执行工作流程或测定的方法的一部分,该细胞的定量或定性特征是通过以下方式确定的:使用显微镜(例如,明场或发射(例如,荧光)显微镜)对细胞或多个细胞成像,对已经捕获由腔室或坞内的细胞或多个细胞分泌的分子的捕获珠粒进行成像,或将捕获珠粒(例如,在捕获由细胞或多个细胞分泌或释放的分子后)输出到微流体装置之外,其中,可以通过其他方法对分子和/或珠粒进行进一步分析。
在一些变型中,在移除一个或多个腔室或坞上的包封层后,可以使用以下方法将一个或多个细胞、一个或多个捕获珠粒(例如,核酸捕获珠粒、蛋白质捕获珠粒、小分子捕获珠粒等)或其任意组合从其所在的腔室或坞中选择性地或非选择性地移出,这些方法包括但不限于直接或间接产生的力(例如,DEP产生的力、局部流动(例如,由可变形表面的变形产生的)、重力等)。在这样移动到通道之后,细胞、捕获珠粒或其组合可以例如通过使输出缓冲液流过通道并流出微流体装置而从微流体装置输出。替代地或附加地,在移除一个或多个腔室或坞的包封层后,可以使用以下方法将一个或多个细胞、一个或多个捕获珠粒(例如,核酸捕获珠粒、蛋白质捕获珠粒、小分子捕获珠粒等)或其任意组合置于腔室或坞内,这些方法包括但不限于使包括细胞、捕获珠粒或其任意组合的一个或多个水性溶液流动并且使用直接或间接产生的力(例如,DEP产生的力、局部流动(例如,由可变形表面的变形产生的)、重力等)将细胞、捕获珠粒或其组合布置到腔室或坞中。这些变型允许例如添加、减少或更换捕获珠粒,以用于监测在不同时间段期间(例如,在第一、第二、第三等孵育/培养期期间)产生的分泌物并检测分泌物随时间的变化(例如,通过比较从不同的孵育/培养期获得的结果)。此外,这些变型允许添加、减少或更换细胞,以用于监测不同时间段期间(例如,在第一、第二、第三等孵化/培养期期间)的细胞-细胞相互作用。
在移除一个或多个腔室或坞上的包封层后,与水不混溶的流体介质可流入到通道中,从而重新包封包括细胞、捕获珠粒或其组合的一个或多个腔室或隔绝坞;与水不混溶的流体介质可以基本上填满通道。
在一些变型中,除了不混溶性流体介质之外的流体然后可以流入到通道中,将通道的大部分中的不混溶性流体介质排出,从而再生成包封层(例如,具有限定的厚度的包封层,如本文所公开的),该包封层被配置为将通道中的另一流体与一个或多个腔室或隔绝坞中的介质分离。另一流体可以是空气或另一种气体(例如,空气中的5% CO
在一些非限制性实施例中,包封层的选择性移除可以基于特定腔室或坞的自动或手动选择来执行,其中,该选择基于从腔室或隔绝坞拍摄的单个或堆叠的明场或发射(例如,荧光)图像的一个或多个像素集的一个或多个定量或定性特征,其中,腔室或隔绝坞中像素集的特征提供以下项的任意组合:关于每个单独腔室或隔绝坞中细胞生理状态的指示、指示每个单独腔室或隔绝坞中细胞的基因型或表型特性的一个或多个特征、腔室或隔绝坞中存在或不存在捕获珠粒、或在一段时间内观察到的腔室或隔绝坞中生物学意义重大的事件。在一些变型中,可以基于这些选择标准中的一个或多个选择关注的细胞以进行附加的测定,该选择标准可以是预定标准(例如,检测到分泌分子的表达的水平)。或者,可以基于相对活性来选择细胞,例如,与微流体装置的其他腔室中检测到的细胞活性相比,该细胞的细胞活性的程度。例如,可以选择总共四个腔室中表达对于分泌的分子产生的最高水平的荧光标记的细胞以进行进一步的测定,而不需要对于选定细胞的特定阈值水平的荧光标记,该荧光标记用于分泌分子的产生。进一步的测定可以包括对于不同的细胞表面标志进行标记,检测不同分子从细胞的分泌;检测分泌的分子对第二不同的细胞的影响,或可以包括对腔室内一个或多个细胞的遗传分析。
用于对从单个或堆叠的明场或发射(例如,荧光)图像取得的图像进行定性或定量分析的方法可以在例如第WO2018/102748号PCT公开中找到,其所有内容在本文以引用的方式并入。在方案是自动化的情况下,用户可以预加载试剂并选择一个或多个定性或定量特征或标准,然后可以自动化进行包封层的移除,使得包封层的选择性移除基于用户先前标识的一个或多个定性或定量特征自动执行。
移除包封层(无论是选择性的还是批量的)将置于未包封的腔室或坞中的细胞和/或捕获珠粒/固体基质暴露于试剂。然后可以对腔室或隔绝坞进行成像以监测特定响应(例如,发射、荧光等的变化),可以选择性地重新密封腔室或隔绝坞,可以将其他腔室或隔绝坞移除并暴露于相同或不同的试剂,和/或细胞和/或微物体(例如,捕获珠粒)可以被输出以进行微流体芯片外的附加分析,包括但不限于诸如质谱法等标识方法,或定量测定,例如能够产生可量化的测定结果的蛋白酶或其他酶促测定。
包封和解包封有用的生物细胞分析的一些示例性方法。如上所述,在微流体装置的腔室内包封和解包封细胞可以允许选择性和可控的培养、测定(包括但不限于在腔室内裂解细胞)、标识优化的细胞,以及其选择性的释放或输出。一种示例性但非限制性的方法在图12A至图12C中示出,并示出了培养和选择性裂解细胞。使用本文公开的方法的任何组合,利用包封层将细胞包封在腔室或隔绝坞中。一旦细胞被围起,就使与水不混溶的流体(例如,油)流入通道中。然后将水性溶液灌注到通道中,将与水不混溶的流体排出通道,如图12A所示,从而将细胞和培养介质置于隔绝坞内,并且每个隔绝坞由与水不混溶的流体介质的薄膜涂层包封。通道中薄膜或包封层的外部是水性溶液,该水性溶液可以是缓冲液,例如细胞裂解缓冲液;或者,水性溶液可以是培养介质或其他类型的缓冲液,其在合适的时间量后替换(例如,通过流过通道)细胞裂解缓冲液。图12B是来自与图12A和图12C同一视场的明场图像,其在单个坞的包封层已被选择性地移除(例如,通过激光诱导形成气泡)之后拍摄。在图12B中,裂解缓冲液选择性地从通道扩散到隔绝坞中。裂解在图12C中得到确认,这是在碘化丙啶染色剂已灌注到通道中并扩散到开放坞中后与图12B同一视场的荧光图像,其中在该开放坞中产生了发射(例如,荧光),确认细胞被成功裂解。在一些非限制性实施例中,捕获珠粒(例如,核酸捕获珠粒)可以加载到通道中。在从仅包括捕获珠粒(例如,核酸捕获珠粒)的介质加载细胞之前,或在将细胞与例如裂解缓冲液一起加载之后(例如,使用光学致动的DEP力),可以从包括细胞和捕获珠粒(例如,核酸捕获珠粒)的介质中将捕获珠粒(例如,核酸捕获珠粒)与细胞一起加载。裂解缓冲液、核酸捕获珠粒和细胞可被包封在腔室中,从而允许选择性裂解细胞并将RNA/DNA从裂解的细胞捕获到珠粒。在一些变型中,珠粒可包括用于捕获核酸的引物,以及可选地,用于测序的标签。在另外的实施例中,该方法可以附加地包括以下中的一项或多项:将独特的指定符应用于腔室或坞,标识通道或坞中的一个或多个捕获珠粒(例如,核酸捕获珠粒),观察坞中的捕获珠粒(例如,核酸捕获珠粒)的一个或多个特征,将坞中观察到的微物体的特征与珠粒上的独特标签相关联,对捕获珠粒(例如,核酸捕获珠粒)进行测序,以及将针对坞中的捕获珠粒(例如,核酸捕获珠粒)观察到的特征与从标记的捕获珠粒获得的序列信息进行关联。用于在微流体装置上捕获核酸的方法和装置公开在例如第WO2015095623号PCT申请中,除了任何定义、免责声明、否认和不一致之处以外的所有公开内容通过引用并入本文。用于捕获核酸的其他方法和装置以及用于生成和利用DNA条形码的方法和组合物公开在例如第WO2018064640号PCT申请中,除了任何定义、免责声明、否认和不一致之处以外的所有公开内容通过引用并入本文。
使用包封层进行生物细胞分析的另一种示例性方法可以包括测定分子(其可以是小分子(例如具有等于或小于2000Da的分子量的有机小分子)或肽)对置于微流体装置的腔室(例如,隔绝坞)内的生物细胞的影响,该腔室已根据本文所述的方法被包封。分子,尤其是小分子,从微流体装置的腔室/隔绝坞快速扩散的能力使腔室/隔绝坞的包封成为用于可控地使细胞与易于扩散的物质(species)接触的有吸引力的方法。
微流体装置可以在微流体装置内的一个或多个表面上具有疏水涂层,其可以是如本文所述的任何疏水涂层,如本文所公开的疏水涂层可辅助腔室/隔绝坞的包封。生物细胞可流入微流体装置并置于腔室/隔绝坞内。
分子(例如,小分子)可以被引入腔室/隔绝坞中,结合到微物体上/结合到微物体内或与微物体(例如,珠粒或其他能够置于微流体装置的腔室/隔绝坞中的固体基质)相关联。可以在引入生物细胞之前或之后将分子承载珠粒引入到腔室/隔绝坞中。分子的并入可以是物理浸渍到珠粒的可溶解基质或涂层中(例如,非共价地)。或者,分子可以通过流体静力学/疏水性/亲水性/离子缔合(例如,非共价地)与珠粒相关联,或者可以通过直接或间接地与珠粒的可释放附着(例如,共价或非共价地)而与珠粒相关联。在任何情况下,加载到珠粒上/与珠粒相关联的分子量可以是已知的,并且释放到腔室/隔绝坞中的分子的浓度可以被设计为输送已知浓度的小分子。在该方法的一些变型中,分子承载珠粒还可包括标识符,其允许在整个测定中跟踪小分子的身份。标识符可以是任何合适的标识符,包括RFID条形码、化学条形码(例如,核酸条形码)、物理可检测的条形码(例如,颜色编码的纳米粒子(诸如量子点))或本领域已知的任何标识符。用于生成和利用DNA条形码的一些非限制性组合物公开在第WO2018064640号PCT申请中,其通过引用整体并入。
分子在珠粒内/之上/与珠粒的结合或可释放附着可以防止分子从珠粒解离和/或可以以可控的方式可释放地脱离,使得在将珠粒引入到腔室/隔绝坞中期间不发生解离或脱离。这防止不同腔室/隔绝坞中的细胞交叉暴露于分子,并将已知数量的分子输送到选定的腔室/隔绝坞。
在一些变型中,在分子承载珠粒已经被置于腔室内之后,释放试剂可以被引入腔室/隔绝坞。释放试剂可触发分子从其与珠粒的结合或关联中释放。释放试剂可包括但不限于温度、酶、化学品和光。例如,使用温差的释放试剂可以例如包括在第一较低温度(例如,15摄氏度至约25摄氏度)下引入分子承载珠粒,然后将微流体装置内的温度提高到约27摄氏度至约37摄氏度。这可起到溶解已固定了分子的珠粒上的凝胶基质的作用。或者,例如,如果分子通过杂交的寡核苷酸对可释放地附着到了珠粒,则温度升高可以使分子脱离。升高的温度可能达到杂交寡核苷酸对的解链温度(Tm),对其“解链”并释放分子。在另一个替代方案中,可以引入蛋白酶来切割肽键,其可以特异性地(在含有分子的可溶解珠粒的情况下)或特异性地(在可释放地附着的分子的情况下)释放分子。在另一个替代方案中,改变腔室/隔绝坞中的pH的试剂的引入可以触发分子的释放。在一些其他变型中,表面活性剂(例如但不限于非离子表面活性剂)可触发分子从珠粒中释放。在其他变型中,基质或涂层可被光引发的切割破坏,或者分子可通过光引发的切割可释放地脱离,从而触发分子的释放。在一些变型中,可以不引入释放试剂并且分子可以在一段时间内从珠粒解离或脱离,这可以是预先选择的。例如,分子可以被并入到基质或涂层中,该基质或涂层被设计为在与水接触时在指定的时间段后溶解在腔室/隔绝坞的水性介质中,例如,缓释或控释制剂。可以使用其他化学释放试剂,如技术人员可以设计的那样。
一旦包括分子的珠粒被引入到包含一个或多个生物细胞的腔室/隔绝坞中,并且可选地,已经引入了释放试剂,就可以引入包封层以将腔室/隔绝坞的内容物与通道和/或其他腔室/隔绝坞密封开。包封层,与水不混溶的流体介质可以填充通道或者它可以形成薄的包封层。在一些变型中,包封层可以延伸到隔绝坞的连接区域的一部分中,如本文所述,其中连接区域的一部分可以是连接区域靠近通道的子区域。与水不混溶的流体介质可以是本文所述的或技术人员已知的适用于该目的的任何与水不混溶的流体介质。
然后可以触发释放试剂以释放分子,并且可以释放已知量(浓度)的分子以接触腔室/隔绝坞中的生物细胞一段时间,该时间段可以是约1小时、约2小时、约4小时、约8小时、约12小时、约18小时、约24小时或更长时间,同时维持生物细胞。包封层保持分子的浓度,并防止相邻坞中的细胞暴露于来自其他坞的污染分子。在一些实施例中,当暴露时间结束时,隔绝坞可以被解包封并且培养介质可以流动以从微流体装置中冲刷掉所有测试分子。解包封可以如本文所述的那样进行,并且包封层,无论是填充整个通道还是作为薄包封层存在,都可以通过在通道内流动表面活性剂以置换与水不混溶的流体介质而被大量置换。当包封层是腔室/隔绝坞通向通道的整个开口上的薄包封层时,可以通过将激光朝向腔室/隔绝坞内的水性介质与与水不混溶的流体介质的边界引导来实现选择性解包封,产生破坏包封层并允许水性介质扩散进腔室/隔绝坞/从腔室/隔绝坞扩散出的气泡。
在一些实施例中,可以对细胞进行测定以评估分子对生物细胞的影响,这可以包括将测定介质和/或测定试剂添加到腔室/隔绝坞中,并且可以检测以及可选地量化从测定产生的可检测的信号。在一些变型中,量化可以是相对于在一些或所有腔室/隔绝坞中检测到的响应,例如,相对于对照组,针对选定的腔室/隔绝坞组进行标准化,或相对于跨腔室/隔绝坞检测到的平均响应。因此,可以相对于微流体装置内的约1个、约5个、约10个、约50个、约100个、约1000个、约5000个、约10,000个或所有腔室/隔绝坞进行量化。测定和/或检测可以在不重新包封腔室/隔绝坞的情况下进行,或者可以包括通过在通道内流动与水不混溶的流体介质以置换含有测定试剂的水性介质来重新包封腔室/隔绝坞的步骤。此外,在一些实施例中,可以通过将另外的水性介质引入到通道中并留下薄的包封层来引入薄的包封层。
一个这样的该测定的版本可以是在被认为通过暴露于小分子来调节的转录启动子的控制下使用包含报告基因构建体的细胞,该报告基因构建体具有绿色荧光蛋白(GFP)。该测定可允许在多个细胞,特别是多个克隆细胞暴露于数千个分子的库时确定GFP表达时间、最大信号和信号衰减。这可用于标识用于通路激活(pathway activation)的最佳配体,并且可在实验中使用配体的数千种变种。
可以使用这种类型的实验,通过使用具有不同浓度的相同配体的珠粒来研究配体(例如,分子)的浓度效应。对多个细胞,特别是多个克隆细胞的平行测试可产生关于亲和力和调节动力学的信息。
在另一个变型中,分子对多个细胞的影响可用于筛选有效的治疗分子,其中,测定试剂(包括提供可检测信号的试剂)可包括在具有分子承载珠粒和生物细胞的包封的腔室/隔绝坞内。对具有多个不同的分子(可以可选地以不同的浓度存在)的多个细胞,特别是多个克隆细胞并行进行可以允许阐明这些分子(例如,IC50、EC50、LD50或TD50)的效力。
在一些其他变型中,除了如上所述的对珠粒承载的分子(bead-bornemolecule)的细胞的直接影响的分析之外或者替代该分析,还可以研究响应于如上所述的暴露于珠粒承载的分子而产生的一个或多个产物(例如,由细胞分泌的分子)的定性或定量分析。可以将捕获珠粒引入到包含细胞、珠粒承载的分子和任何其他合适试剂的腔室/隔绝坞中。捕获珠粒的引入可以在引入细胞和/或珠粒承载的分子和/或其他试剂之前/之后/同时进行,并且可能需要包封/解包封一个或多个腔室/隔绝坞的一个或多个实例。珠粒承载的分子的释放后,可以进行一段时间的培养,其可以是约30分钟;约45分钟;约1小时;约2小时;约4小时;约6小时;约8小时;约10小时;约12小时;约18小时;约24小时;约48小时;约72小时;或者更长时间。在一些实施例中,细胞可培养约2小时至约24小时、约4小时至约24小时(例如,在约8小时至约12小时之间、在约12小时至约16小时之间、在约16小时至约20小时之间)或其间的任何时间长度。可以在培养期期间或之后对细胞和/或腔室/隔绝坞进行成像,该成像结果可用于选择要从中取出捕获珠粒的一个或多个腔室/隔绝坞。可以进行批大量的解包封或者在一些实施例中的如本文所述的选择性解包封。选定的捕获珠粒可以从腔室/隔绝坞中释放,并且可以从微流体装置输出以进行进一步分析(例如,质谱,如上文和本文别处所述)。
在一些变型中,提供了一种用于测定微流体装置中包封的细胞的方法,该微流体装置具有围栏,该围栏包括通道和多个腔室,多个腔室中的每个腔室具有将腔室流体连接到通道的开口(例如,单个开口),其中,形成靠近多个腔室中的每个腔室的通道的表面的至少一部分和/或每个腔室的形成开口并靠近通道的表面的至少一部分包括疏水涂层,其中,该过程包括:用第一水性介质填充微流体装置的围栏中的通道和多个腔室;将第一细胞置于多个腔室中的第一腔室中;将第二细胞置于多个腔室中的第二腔室中;将微物体置于多个腔室中的第一腔室和第二腔室中的每一个中,其中,该微物体包括分子(例如,测试分子);使与水不混溶的流体介质流入通道中,置换通道中的第一水性介质,而基本上不置换多个腔室中的任意腔室中的第一水性介质,从而可逆地将细胞包封在它们相应的腔室中;以及监测包封在第一腔室和第二腔室中的每一个中的细胞的活性。细胞可以是如本文所述的任何种类的细胞。
在一些变型中,分子被配置为影响或表达(text)置于其中的细胞的生物活性。分子可以是小分子(例如,小的有机分子或肽)。分子可以非共价地或共价地与微物体相关联。在一些变型中,微物体还可包括标识符,其被配置为允许跟踪分子的身份。
在一些变型中,将微物体置于第一腔室和第二腔室中的每一个中可以在将细胞包封在它们相应的腔室内之前执行。在一些变型中,该过程还可以包括:在将微物体引入第一腔室和第二腔室中之后,将释放试剂引入第一腔室和第二腔室中的每一个中,其中,该释放试剂被配置为触发分子从微物体的释放。将释放试剂引入第一腔室和第二腔室中的每一个中可以在将细胞包封在它们相应的腔室内之前执行
在一些变型中,该过程还可以包括:触发分子从微物体的释放。在一些实施例中,触发释放可包括:提高微流体装置的第一腔室和第二腔室中的每一个的温度。在其他实施例中,触发释放可以包括:将激光照明引导到微流体装置的第一腔室和第二腔室中的每一个中的微物体处。在其他实施例中,触发释放可以包括:改变第一腔室和第二腔室中的每一个内的第一水性介质的pH。在其他实施例中,触发释放可以包括通过酶促释放试剂的酶促释放。
在一些变型中,该过程还可以包括:在监测细胞的活性之前将包封在第一腔室和第二腔室的每个中的细胞孵育第一时间段;在第一时间段期间的多个时间点监测细胞的活性;或在第一时间段期间基本上连续地监测孵育中的细胞的活性。细胞可以被孵育的第一时间段可以是至少30分钟。在其他实施例中,第一时间段可以在4小时至24小时之间(例如,8小时至12小时之间、12小时至16小时之间、16小时至20小时之间)。在一些实施例中,已流过通道的与水不混溶的流体介质/正流过通道的与水不混溶的流体介质可以包括可溶性氧。在一些实施例中,第一水性介质可包括碳源/能源以及可选地,其他矿物质和营养物。
在一些变型中,孵育细胞可以在18℃至50℃之间(例如,25℃至37℃之间)的温度下进行。
在一些变型中,检测关注的分子或报告分子还可包括:量化检测到的信号。量化来自关注的分子或报告分子的检测到的信号还可以包括:量化第一腔室和第二腔室中的每一个中的检测到的信号相对于彼此或相对于微流体装置的其他腔室中的一个或多个检测到的信号。
在一些变型中,靠近并围绕通向多个腔室中的每个腔室的开口的所有通道表面可以包括疏水涂层。在一些变型中,在通向多个腔室中的每个腔室的开口的10微米内的所有通道表面可以包括疏水涂层。在一些变型中,疏水涂层可具有约45度至约100度的接触角度。疏水涂层可以共价结合到形成靠近每个腔室的通道的表面的部分。在一些变型中,疏水涂层可以共价结合到形成靠近多个腔室中的每个腔室的通道的表面的部分。
在一些变型中,与水不混溶的流体介质可包括烷烃、氟代烷烃、油、疏水聚合物或其任意组合。
在一些变型中,该过程还可以包括:将与水不混溶的流体介质从通道吸出。在一些实施例中,与水不混溶的流体介质可以以处于或在0.01μl/sec至1.0μl/sec之间的速率吸取。在一些变型中,吸取与水不混溶的流体介质还可以包括:随后将第二水性介质吸入到通道中。在一些实施例中,第二水性介质可包括表面活性剂。
在一些变型中,形成多个腔室中的每个腔室的表面的至少一部分可以包括疏水涂层,并且腔室表面的具有疏水涂层的至少一部分可以位于通向通道的开口附近,该过程还可以包括:在多个腔室中的每个腔室中生成与水不混溶的流体介质的包封层,其中,多个腔室中的每个腔室的包封层紧邻通道定位并且与腔室中的第一水性介质共享界面,以将腔室中的第一水性介质与通道中存在的介质(例如,第二水性介质、空气、CO
在一些变型中,该过程还可包括:生成从与腔室中的水性介质的接触表面延伸约5微米至约50微米到通道中的与水不混溶的流体介质的包封层。
在一些变型中,该过程还可以包括:选择性地移除由不混溶性流体介质在通向通道的开口处形成的包封层,从而产生解包封的腔室。在一些变型中,选择性地移除包封层可以包括:在腔室内(例如,靠近包封层)产生气泡。产生气泡可以包括:将激光引导到腔室的基部的内表面上靠近第一水性介质与与水不混溶的流体介质之间的界面的位置。在一些变型中,该过程还可包括:使第三水性介质流入通道中。在一些实施例中,第三水性介质可以包括裂解试剂(例如,第三水性介质可以是裂解缓冲液)。
在一些变型中,该过程还可包括:将捕获珠粒(例如,选择性地结合生物材料的珠粒,诸如核酸捕获珠粒等)置于第一腔室和第二腔室中的一个或两个中。在一些实施例中,该过程可以包括:从解包封的腔室中释放捕获珠粒。在一些实施例中,该过程可包括:从微流体装置输出捕获珠粒并使捕获珠粒经受进一步分析(例如,质谱法、ELISA、酶促测定、核酸测序等)。
在一些变型中,将细胞置于第一腔室和第二腔室中的每一个中可以包括:使包括多个细胞的水性介质流入微流体装置的通道中;以及从微流体装置的通道中的含有细胞的水性介质中选择细胞,以将其置于第一腔室和第二腔室中的每一个中。可以使用DEP力(例如,光致动DEP力)分别将第一细胞和第二细胞从通道单独地移动到第一腔室和第二腔室中。
在一些变型中,多个腔室中的每个腔室可以是隔绝坞,其包括隔离区域和将隔离区域流体连接到通道的连接区域。隔绝坞可以具有通向通道的单个开口。在一些实施例中,每个隔绝坞的连接区域可以包括通向通道的近端开口和通向隔离区域的远端开口,连接区域的近端开口具有范围从约20微米至约100微米的宽度W
在一些变型中,疏水涂层可包括小于或等于从形成通道的表面的各部分的总和计算的表面积的50%。在其他变型中,疏水涂层可包括大于或等于从形成通道的表面的总和计算的表面积的50%。在一些变型中,多个腔室中的每个腔室可包括包含亲水涂层的表面。在一些实施例中,多个腔室(例如,隔绝坞)中的每个腔室可以包括包含亲水涂层的表面,并且至少每个隔绝坞的隔离区域包括亲水涂层。在一些实施例中,每个隔绝坞的连接区域的靠近隔离区域的至少一部分(例如,远离隔绝坞开口的子区域)可以包括亲水涂层。在一些实施例中,隔绝坞的连接区域的靠近通道的一部分(例如,具有长度L
在一些实施例中,形成连接区域的至少一个表面(例如,所有表面)中的每一个表面可以包括靠近隔离区域的具有亲水涂层的部分和靠近通道的具有疏水涂层的部分,并且可选地,当形成连接区域的所有表面包括靠近通道的具有疏水涂层的部分时,它们可以提供包围连接区域紧邻通道的部分的疏水涂层。
在一些变型中,疏水涂层可以包括第一共价结合的表面修饰,其包括:第一链接基团和第一部分,其中,第一部分是非极性的(例如,油酸部分、炔基部分、PEG链接的炔基或氟化部分)。在一些变型中,亲水涂层可以包括多个第二共价结合的表面修饰,其每一个包括第二链接基团和第二部分,其中,第二部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
在一些变型中,疏水涂层可以包括具有第一链接基团的第一共价结合的表面修饰和第一部分,其中,第一部分是非极性的。在一些变型中,亲水涂层可以包括多个第二共价结合的表面修饰和第二部分,每一个第二共价结合的表面修饰包括第二链接基团,其中,第二部分是极性的。
在一些变化形式中,细胞可以表达不同量的关注的分子或报告分子,其可以是本文所述的任何关注的分子或报告分子。在一些变型中,该方法还可包括:在监测第一细胞和第二细胞的活性之前,将包封在第一腔室和第二腔室中的第一细胞和第二细胞孵育第一时间段。
在一些变型中,监测包封在第一腔室和第二腔室中的每一个中的细胞的活性可以包括:检测关注的分子或报告分子。检测关注的分子或报告分子可以包括:检测与关注的分子相关联的或由关注的分子产生的荧光信号。在一些变型中,检测关注的分子可以包括:检测关注的分子或报告分子与固体基质的结合,其中,固体基质可以包括关注的分子或报告分子的受体。监测细胞的活性可以包括:对其中布置有细胞的腔室成像。在一些其他实施例中,细胞可被成像以监测细胞的一个或多个表型参数。监测细胞的活性可以包括监测细胞生长。
在一些变型中,该过程还可以包括:基于检测到的细胞活性,例如,基于预定标准或相对于微流体装置的其他腔室中检测到的细胞活性,选择关注的细胞以进行附加的测定。在一些实施例中,选择可以基于关注的分子的表达量、细胞生长量或其组合。
在一些变型中,第一腔室和/或第二腔室可以被解包封,并且相应的捕获珠粒可以被释放(unpenned)。在一些变型中,可以从微流体装置输出释放的捕获珠粒以进行进一步分析。在一些变型中,第一腔室和/或第二腔室可以被解包封,并且关注的细胞可以被释放。在一些实施例中,可以从微流体装置输出释放的关注的细胞。
裂解试剂。适用于在本文所述方法内使用的裂解试剂可以不包含去污剂,因为去污剂会影响包封层。用于裂解包括外细胞膜/壁和/或核膜的细胞膜的合适试剂可以包括酶促裂解剂(例如,蛋白酶)或可以是溶菌酶(例如,用于细菌)。裂解试剂可以是裂解缓冲液,其可以是低渗的或等渗的。低渗裂解缓冲液可包括10nM HEPES,pH7.9;具有氯化镁和氯化钾。等渗裂解缓冲液可包括pH 7.5的10mM Tris HCl、氯化镁、氯化钙和0.3M蔗糖。
表面活性剂。一种有用的表面活性剂是非离子表面活性剂,CapstoneFS30。然而,在这些用于移除包封层的方法中使用的表面活性剂不限于Capstone FS30。可以使用本领域技术人员已知的其他非离子表面活性剂。非离子表面活性剂的浓度可为约0.1%至约10%;约0.1%至约5%;约0.1%至约3%;约0.1%至约2%,或约0.1%至约1.0%v/v。
与水不混溶的流体介质。用于密封腔室/隔绝坞的与水不混溶的流体介质可以是例如烷烃、氟代或全氟代烷烃或油(例如,硅油或氟化油)。与水不混溶的流体介质的具体示例包括异辛烷(或七甲基壬烷(HMN))、十六烷、2-(三氟甲基)-3-乙氧基十二氟己烷(HFE-7500,3MTM,NovecTM)、Fluorinert
可以选择上面列出的与水不混溶的流体介质中的一些来溶解氧气,氧气可以例如在腔室或隔绝坞内跨过与水性介质的边界而转移,并有助于支持在可以通过与水不混溶的流体介质包封腔室或隔绝坞的时间段期间维持和扩增生物细胞。一些与水不混溶的流体介质可能具有比水本身更大的氧溶解度,包括但不限于5cSt.硅油、HFE-7500或FC-40。
疏水部分。微流体装置中的腔室(包括隔绝坞)可以通过使与水不混溶的流体介质流过腔室/隔绝坞从其开口的通道而彼此密封。当通道的表面(例如,围绕通向腔室/隔绝坞的开口的表面)包括共价结合的修饰时,有利于密封,该共价结合的修饰包括基本上为非极性或疏水的部分(例如,第一表面接触部分或第一疏水反应性部分,例如炔基)。可选地,腔室/隔绝坞的表面(例如,最接近通道的连接区域的表面)也包括共价结合的修饰,该共价结合的修饰包括基本上为非极性或疏水的部分(例如,表面接触部分或反应性部分)。非极性/疏水部分可以例如包括以下项、由以下项组成或基本上由以下项组成:烷烃(包括氟代烷烃和全氟代烷烃)、烯烃、炔烃、芳环(其可以用非极性基团(例如,烷烃等)官能化)、聚合物(例如,聚丙烯)等。在一些变型中,可以引入具有一个或多个疏水表面部分的疏水表面,这些疏水表面部分具有至少约45度的接触角度。在一些其他变型中,疏水表面可具有小于约100度的接触角度。在一些实施例中,疏水表面可具有约45度至约100度的接触角度。在表1中,示出了提供疏水表面的一些合适的表面改性剂以及疏水表面的相应的接触角度,但本发明不限于此。其他表面改性剂也可能有用,包括DBCO-马来酰亚胺(BroadPharm Cat.No.BP-22293);磺基DBCO-马来酰亚胺(BroadPharm Cat.No.BP-22217);DBCO-PEG4-马来酰亚胺(BroadPharm Cat.No.BP-22294);磺基DBCO-PEG4-马来酰亚胺(BroadPharm Cat.No.BP-22218)和/或DBCO-PEG4-DBCO(BroadPharm Cat.No.BP-23772)。
表1。示例性疏水表面改性剂和由此形成的表面的接触角度。
/>
亲水部分。合适的亲水部分可包括如本文所述的用于表面改性剂的任何亲水接触部分。在一些实施例中,亲水表面接触部分可以是极性部分。具有亲水表面接触部分的表面改性剂可以产生具有小于约45度的接触角度的共价结合的涂层表面。例如,具有甲氧基封端的PEG Mw-5k接触部分的亲水表面可具有约32度的接触角度。亲水表面的另一个非限制性示例可具有磺酸封端的PEG4的表面接触部分,其可具有约7度的接触角度。
在一些实施例中,疏水涂层可包括油酸部分、炔基部分、炔基封端的PEG部分或氟化表面接触部分,而亲水表面可包括甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、磺酸、醇部分或醇封端的PEG极性接触部分。在一些实施例中,疏水涂层可包括油酸表面接触部分,而亲水涂层可包括甲氧基封端的PEG表面接触部分。在一些其他实施例中,疏水涂层可包括炔基表面接触部分,亲水涂层可包括甲氧基封端的PEG表面接触部分。在其他实施例中,疏水涂层可包括炔基封端的PEG部分,亲水涂层可包括甲氧基封端的PEG表面接触部分。在其他实施例中,疏水涂层可包括氟化表面接触部分,而亲水涂层可包括甲氧基封端的PEG表面接触部分。在一些其他实施例中,疏水涂层可包括油酸表面接触部分,亲水涂层可包括羧酸或羧酸封端的PEG部分。在其他实施例中,疏水涂层可包括炔基表面接触部分,亲水涂层可包括羧酸或羧酸封端的PEG部分。在另外的实施例中,疏水涂层可以包括炔基封端的PEG部分,而亲水涂层可以包括羧酸或羧酸封端的PEG部分。在其他实施例中,疏水涂层可包括氟化表面接触部分,而亲水涂层可包括羧酸或羧酸封端的PEG部分。
表面改性剂。表面改性剂(式I)包括表面接触部分和链接基团,其中,链接基团可以包括接头L和反应对部分RP,该反应对部分RP是与存在于微流体装置的表面上的反应性部分反应的部分。
Rp-L-表面接触部分式I
当改性表面已经形成时,如此形成的表面改性配体具有类似于表面改性剂的结构,但表面改性配体的链接基团包括通过反应对部分RP与官能化表面的反应性部分的反应形成的偶联基团CG,并且还包括将反应性部分连接到微流体装置表面的接头部分。
反应对部分。反应对部分RP是可以与官能化表面的反应性部分反应的部分。例如,反应性部分R
当官能化表面具有叠氮化物或炔基部分作为R
接头L可以是键或可以包括1至200个选自硅、碳、氮、氧、硫和磷原子的任意组合的非氢原子,受到本领域已知的化学键合限制。在一些实施例中,接头L可包括1至200个选自硅、碳、氮、氧、硫和磷原子的任意组合的非氢原子,受到本领域已知的化学键合限制。接头L或表面接触部分可包括0、1或3个偶联基团CG。
偶联基团CG。CG是偶联基团并且可以是任何部分,例如但不限于三唑基、甲酰胺、酰亚胺、醚、酯、酮、磺酰胺、磺酸盐、环辛基稠合的二嗪、烯烃或可能由将表面接触部分附着到表面改性剂的剩余部分产生的芳烃部分。
在一些其他实施例中,CG是由官能化表面的反应性部分与本文所述的表面改性剂的相应的反应对部分反应得到的部分。例如,具有叠氮化物反应性部分的官能化表面在点击反应中与炔基部分反应时可形成三唑基CG部分。或者,具有炔基反应性部分的官能化表面可与表面改性剂的叠氮化物反应对部分反应以形成三唑基部分。在又一个替代方案中,官能化表面可存在炔基部分,其可与硫基反应以形成硫-烯烃偶联基团CG。
偶联基团CG可以是三唑基部分,其可以被进一步取代,并且可以具有与三唑基部分稠合的一个或多个附加环系。附加的稠合的环系本身可以进一步被附加的稠合的环取代并且可以提供到接头L-表面接触部分的附着点。在一些实施例中,三唑基部分与环辛炔基环系稠合,该环系可以进一步被附加的稠合的环(包括但不限于二苯并环辛炔基或其他取代基,例如氟(二氟化环辛炔(DIFO))取代。
在一些实施例中,CG可以是非共价结合对。例如,生物素与链霉亲和素的非共价结合提供了非常稳定的结合对,并且可以是CG。此外,由于链霉亲和素具有四个结合位点,表面改性配体、表面改性剂或官能化表面的两部分可以通过生物素/链霉亲和素/生物素的序列而接合。例如,官能化表面具有生物素反应性部分,然后引入链霉亲和素以与生物素反应性部分结合,最后引入第二生物素部分(例如,生物素-纤连蛋白)并与链霉亲和素上的另一个结合位点结合。该产物是具有纤连蛋白的表面接触部分的共价结合的表面修饰,并且生物素/链霉亲和素/生物素的序列被认为是单个偶联基团CG。链霉亲和素的作用是将两个类似官能化的部分链接在一起。
表面接触部分。表面改性剂或配体的表面接触部分可以是本文和本公开的其他部分中描述的任何表面接触部分,并且可以包括非聚合或聚合部分。表面接触部分可以包括烷基或氟烷基(包括全氟烷基)部分;烯基部分、炔基部分、单糖或多糖(可包括但不限于葡聚糖);醇类(包括但不限于炔丙醇);多元醇,包括但不限于聚乙烯醇;亚烷基醚,包括但不限于聚乙二醇;聚电解质(包括但不限于聚丙烯酸或聚乙烯基膦酸);氨基(包括其衍生物,例如但不限于烷基化胺、羟烷基化氨基、胍盐和含有未芳构化氮环原子的杂环基团,例如但不限于吗啉基或哌嗪基);羧酸,包括但不限于丙炔酸(其可提供羧酸盐阴离子表面);膦酸,包括但不限于乙炔基膦酸(其可提供膦酸盐阴离子表面);磺酸根阴离子;羧基甜菜碱;磺基甜菜碱;氨基磺酸;氨基酸;或其任意组合。烷基或全氟烷基部分可具有大于10个碳的主链长度。在其他实施例中,表面接触部分可以包括糖部分,并且可以是葡聚糖。在其他实施例中,表面接触部分可包括亚烷基醚部分。亚烷基醚部分可以是聚乙二醇。
在其他实施例中,亲水表面接触部分可包括但不限于至少一个环氧烷部分。一类有用的含亚烷基醚的聚合物是聚乙二醇(PEG M
在各种实施例中,表面接触部分可以包括非聚合部分,例如烷基部分、取代的烷基部分(例如,氟烷基部分(包括但不限于全氟烷基部分))、氨基酸部分、醇部分、氨基部分、羧酸部分、膦酸部分、磺酸部分、氨基磺酸部分或糖部分。
在一些实施例中,表面接触部分可以包括形成线性链(例如,具有至少10个碳,或至少14、16、18、20、22或更多个碳的线性链)的碳原子并且可以是无支链的烷基部分。在一些实施例中,烷基可以包括取代的烷基(例如,烷基中的一些碳可以被氟化或全氟化)。在一些实施例中,烷基可包括接合到第二段的第一段(segment),该第一段可包括全氟烷基,该第二段可包括全未取代的烷基,其中,第一段和第二段可直接或间接(例如,借助于醚键)接合。烷基的第一段可以位于链接基团的远端,而烷基的第二段可以位于链接基团的近端。
其他表面接触部分可以包括用于细胞特异性相互作用的肽或蛋白质,包括抗原、细胞表面标记等。
粘附基序(Adherent motifs)。通常,带正电的表面接触部分(例如,聚-L-赖氨酸、胺等)可用作表面接触部分以为附着依赖性细胞提供锚定附着。可以使用的另一个基序包括三肽序列RGD,它可作为生物素化试剂获得,并且很容易适用于本文所述的方法。可以使用的其他较大的生物分子包括纤连蛋白、层粘连蛋白或胶原蛋白等。聚谷氨酸表面接触部分可以诱导粘附细胞有生命力地附着和生长。可以辅助提供粘附位点的另一个基序是弹性蛋白样肽(ELP),其包括VPGXG的重复序列,其中,X是可以调节基序的作用的可变氨基酸。当要在微流体装置的腔室内培养需要粘附支持的细胞时,可以将这种粘附基序引入微流体装置的腔室或隔绝坞内。
可切割部分。表面改性剂还可包括可切割部分,其可位于接头L内或可为表面接触部分的一部分。可切割部分可以被配置为允许破坏共价改性的表面。在一些实施例中,破坏对于促进一个或多个生物细胞在一时段的培养后的便携性可能是有用的。可切割部分可以是光可裂解部分,例如硝基取代的苄酯(例如,BroadPharm Catalog#BP-22675);UV可裂解部分,例如取代的1,2-二苯基乙基酮酯部分(例如,苯偶酰衍生物,诸如BroadPharmCatalog#BP 22689);或者可以是可以在特定的化学条件下被切割的部分。例如,二硫键可以在可以不干扰共价改性的表面上的生物细胞的生长或活力的条件(例如,诸如二硫苏糖醇等还原条件)下被切割。可并入表面改性配体或官能化表面内的其他有用的可切割部分可包括邻位二醇部分,其可被高碘酸钠切割。高碘酸钠切割是另一种非细胞毒性切割试剂。可被连二亚硫酸盐切割的重氮部分也可以是有用的可切割部分。此外,5,5,二甲基-外-环己烯-基-1,3,二酮部分可以是有用的可切割部分并且可以被肼溶液切割。
官能化表面:表面可以通过功能化试剂共价改性,以将官能化表面改性引入微流体装置的一个或多个表面,其向微流体装置的内部呈现反应性部分。可以使用所描述的表面改性剂来改性官能化表面,以支持腔室内的培养和从腔室进行输出的能力以及支持包封腔室的包封层。
反应性部分。反应性部分可以是以下任意者:炔部分、叠氮部分、胺部分、羧酸部分、生物素部分、链霉亲和素部分、烯烃部分、反式环辛烯部分、s-四嗪部分、硫醇部分、马来酰亚胺部分、卤化物部分、氰化物部分、异氰酸酯部分、环氧化物部分、羟胺部分、诸如乙酸酯等掩蔽的羟基、或磺酰氟部分。该反应性部分的列表不是限制性的,可以选择任何合适的反应性部分与合适的反应对部分一起使用。虽然大多数反应性部分与相应的反应对部分反应以形成共价偶联的CG,但生物素与链霉亲和素之间的高结合亲和力允许其用作反应性部分/反应对部分。
通过官能化试剂的反应形成的官能化表面可以具有式II的结构:
其中,LG是-W-Si(OZ)2O-或-OP(O)2O-;W是O、S或N,Z是与相邻硅原子的键或是与表面的键,L
铜催化剂。铜催化剂可用于一些点击化学反应。可以使用任何合适的铜(I)催化剂。在一些实施例中,碘化铜(I)、氯化铜(I)、溴化铜(I)或另一种铜(I)盐。在其他实施例中,铜(II)盐可以与还原剂(例如,抗坏血酸盐)组合使用以原位产生铜(I)物质。硫酸铜或乙酸铜是合适的铜(II)盐的非限制性示例。在其他实施例中,还原剂(例如,抗坏血酸盐)可以与铜(I)盐组合存在以确保在反应过程中足够的铜(I)物质。铜金属可用于在氧化还原反应中提供Cu(I)物质,该氧化还原反应还产生Cu(II)物质。可以使用铜的配位络合物,例如,[CuBr(PPh3)3]、铜的硅钨酸盐络合物、[Cu(CH3CN)4]PF6、或(Eto)3P CuI。在其他实施例中,二氧化硅支持的铜催化剂、铜纳米团簇或铜/氧化亚铜纳米粒子可用作催化剂。
其他反应增强剂。如上所述,可以使用还原剂(例如,抗坏血酸钠)以允许铜(I)物质在整个反应过程中保持不变,即使没有严格地将氧气从反应中排除。反应混合物中可包括其他辅助配体,以稳定铜(I)物质。可以使用含三唑基的配体,包括但不限于三(苄基-1H-1,2,3-三唑-4-基)甲胺(TBTA)或3[三(3-羟丙基三唑基甲基)胺(THPTA)。可用于促进反应的另一类辅助配体是磺化红菲咯啉,它也是水溶性的,可在排除氧气时使用。
本领域已知的其他化学偶联可用于将表面改性剂偶联至如针对反应对部分所描述的官能化表面。
溶剂和反应条件。当微流体装置的内表面是与表面改性剂反应的官能化表面时,可以通过使表面改性剂的溶液流入并流过微流体装置来进行反应。在各种实施例中,表面改性剂溶液可以是水性溶液。其他有用的溶剂包括含水二甲亚砜(DMSO)、DMF、乙腈,或者可以使用醇。该反应可以在室温或升高的温度下进行。在一些实施例中,反应在约15℃至约60℃;约15℃至约55℃;约15℃至约50℃;约20℃至约45℃的范围内的温度下进行。在一些实施例中,将微流体装置的官能化表面转化为共价改性的表面的反应在约15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃或约60℃的温度下进行。
合适的涂层处理和改性以及制备方法的更多细节可以在以下文献中找到:公开号为US2016/0312165的美国专利申请(Lowe,Jr.等人)、公开号为US2017/0173580的美国专利申请(Lowe,Jr.等人)、国际专利申请公开WO2017/205830(Lowe,Jr等人)和国际专利申请公开WO2019/01880
(Beemiller等人),其每个的公开内容在本文中全文以引用方式并入。
试剂盒。提供了用于包封细胞的试剂盒,包括:具有围栏的微流体装置,该围栏包括通道和多个腔室,多个腔室中的每个腔室具有将腔室流体连接到通道的开口(例如,单个开口),其中,形成通道和每个腔室的内表面的至少一部分包括多个反应性部分;第一表面改性剂,其包括被配置为与反应性部分共价结合的第一链接基团,并且包括第一表面接触部分,其中,第一表面接触部分是非极性的(例如,油酸部分、炔基部分、PEG链接的炔基或氟化部分);以及第二表面改性剂,其包括被配置为与反应性部分共价结合的第二链接基团,并且包括第二表面接触部分,其中,第二表面接触部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。第一表面改性剂可具有式I的化学结构,其中,RP、L和表面接触部分如本文所述。第一表面改性剂的第一表面接触部分可以是本文所述的或本领域技术人员已知的任何疏水表面部分。微流体装置可以是具有如本文所述的多个反应性部分的任何微流体装置,并且可以具有特征的任何组合。第二表面改性剂可具有式I的化学结构,其中,RP、L和表面接触部分如本文所述。第二表面改性剂的第二表面接触部分可以是本文所述的或本领域技术人员已知的任何亲水性或极性表面部分。微流体装置的多个反应性部分可包括叠氮部分或炔基部分。在一些变型中,试剂盒可包括多个捕获珠粒(例如,结合生物材料的珠粒,诸如非特异性捕获珠粒、抗原特异性捕获珠粒、酶捕获珠粒或核酸捕获珠粒等)。
该试剂盒还可包括在产生具有至少一个共价改性的表面的微流体装置中使用的其他试剂。试剂盒中可提供合适的反应介质、缓冲液或反应促进剂。在一些变型中,试剂盒还可包括水性介质、与水不混溶的流体介质
(例如,烷烃、氟代烷烃、油、疏水聚合物或其任意组合)、测定试剂
(例如,裂解试剂,诸如裂解缓冲液等)、或输出缓冲液中的一种或多种。辅助试剂和/或表面改性剂和/或第二官能化试剂可以在单独的容器中提供。
该试剂盒还可以包括适用于密封具有至少一个共价改性的表面的微流体装置中的腔室(或隔绝坞)的试剂。例如,密封试剂可以是与水不混溶的流体介质,例如,烷烃、氟-或全氟代烷烃,或油(例如,硅油或氟化油)。与水不混溶的流体介质的具体示例包括异辛烷(或七甲基壬烷(HMN))、2-(三氟甲基)-3-乙氧基十二氟己烷(HFE-7500,3MTM,NovecTM)、双(2-乙基己基)碳酸酯(
在其他变型中,提供了用于包封细胞的试剂盒,其包括具有围栏的微流体装置,该围栏具有通道和多个腔室,每个腔室流体连接到通道,其中,形成靠近每个腔室的通道的表面的至少一部分包括共价结合的疏水涂层和适用于密封腔室(例如,隔绝坞)的试剂。在一些变型中,疏水涂层可具有约45度至约100度的接触角度。在一些变型中,多个腔室中的每个腔室可以是隔绝坞,其具有隔离区域和将隔离区域流体连接到通道的连接区域。具有至少一部分的具有共价结合的疏水涂层的表面的微流体装置可以是如本文所述的任何微流体装置并且可以具有特征的任何组合。
密封试剂可以是与水不混溶的流体介质,例如烷烃、氟代或全氟代烷烃或油(例如,硅油或氟化油)。与水不混溶的流体介质的具体示例包括异辛烷(或七甲基壬烷(HMN))、2-(三氟甲基)-3-乙氧基十二氟己烷(HFE-7500,3MTM,NovecTM)、双(2-乙基己基)碳酸酯(
(Evonik))、(十三氟-1,1,2,2,-四氢辛基)四甲基二硅氧烷(Gelest,Cat#SIB1816.0)、硅油(5厘沲粘度,Gelest Cat.#DMS-T05)等。密封试剂可以在单独的容器中提供。
微流体装置/系统特征交叉适用性。应该理解,本文所述的微流体装置、系统和动力技术的各种特征可以是可组合的或可互换的。例如,本文中参照微流体装置100、175、200、300、320、400、450、520描述的特征以及如图1A-5B所描述的系统属性可以是可组合或可互换的。
微流体装置。图1A示出了微流体装置100的示例。微流体装置100的透视图被示出为切除其盖110的一部分以提供微流体装置100内的局部视图。微流体装置100大体上包括微流体回路120,该微流体回路包括流动路径106,流体介质180可以流经该流动路径,可选地将一个或多个微物体(未示出)携带到微流体回路120中和/或经过微流体回路120。
如图1A中大体上所示,微流体回路120由围栏102限定。尽管围栏102可以以不同配置物理地构造,但在图1A中所示的示例中,围栏102被描绘为包括支撑结构104(例如,基部)、微流体回路结构108和盖110。支撑结构104、微流体回路结构108和盖110可以彼此附着。例如,微流体回路结构108可以设置在支撑结构104的内表面109上,并且盖110可以设置在微流体回路结构108上方。微流体回路结构108可以与支撑结构104和盖110一起限定微流体回路120的元件,以形成三层结构。
如图1A所示,支撑结构104可以位于微流体回路120的底部,盖110可以位于其顶部。可替代地,支撑结构104和盖110可以以其它定向配置。例如,支撑结构104可以位于微流体回路120的顶部,盖110可以位于其底部。无论如何,可以存在一个或多个端口107,每个端口包括进入或离开围栏102的通道。通道的示例包括阀门、闸门、通孔等。如图所示,端口107是由微流体回路结构108中的间隙形成的通孔。然而,端口107可以位于围栏102的其它部件中,诸如盖110。图1A中仅示出了一个端口107,但微流体回路120可以具有两个或更多个端口107。例如,可以存在第一端口107,其用作流体进入微流体回路120的入口,并且可以存在第二端口107,其用作流体离开微流体回路120的出口。端口107是用作入口还是出口可以取决于流体流经流动路径106的方向。
支撑结构104可包括一个或多个电极(未示出)和衬底或多个互连的衬底。例如,支撑结构104可包括一个或多个半导体衬底,每个半导体衬底均电连接到电极(例如,所有半导体衬底或半导体衬底的子集可以电连接到单个电极)。支撑结构104还可包括印刷电路板组件(“PCBA”)。例如,半导体衬底可以安装在PCBA上。
微流体回路结构108可以限定微流体回路120的回路元件。这样的回路元件可包括当微流体回路120填充有流体时可以流体地互连的空间或区域,诸如流动区域(其可包括或者可以是一个或多个流动通道)、腔室(其类别的回路元件还可包括子类别,其包括隔绝坞)、阱(trap)等。回路元件还可包括屏障等。在图1A中所示的微流体回路120中,微流体回路结构108包括框架114和微流体回路材料116。框架114可以部分地或完全地包围微流体回路材料116。框架114可以是例如基本上围绕微流体回路材料116的相对刚性的结构。例如,框架114可包括金属材料。然而,微流体回路结构不必包括框架114。例如,微流体回路结构可以由(或基本上由)微流体回路材料116组成。
微流体回路材料116可以被图案化为具有腔室等,以限定微流体回路120的回路元件和互连,诸如腔室、坞和微流体通道。微流体回路材料116可包括柔性材料,诸如柔性聚合物(例如,橡胶、塑料、弹性体、硅树脂、聚二甲基硅氧烷(“PDMS”)等),其可以是透气的。可以形成微流体回路材料116的材料的其它示例包括模制玻璃、诸如硅树脂的可蚀刻材料(例如,可光图案化的硅树脂或“PPS”)、光致抗蚀剂(例如,SU8)等。在一些实施例中,这样的材料(并且因此微流体回路材料116)可以是刚性的和/或基本上不透气的。无论如何,微流体回路材料116可以设置在支撑结构104上和框架114内部。
微流体回路120可包括流动区域,在该流动区域中可以设置一个或多个腔室和/或一个或多个腔室可以与流动区域流体连通。腔室可以具有将其与一个或多个流动区域流体连接的一个或多个开口。在一些实施例中,流动区域包括或对应于微流体通道122。尽管在图1A中示出了单个微流体回路120,但是合适的微流体装置可包括多个(例如,2或3个)这种微流体回路。在一些实施例中,微流体装置100可以被配置为纳米流体装置。如图1A所示,微流体回路120可包括多个微流体隔绝坞124、126、128和130,其中每个隔绝坞可以具有一个或多个开口。在隔绝坞的一些实施例中,隔绝坞可以仅具有与流动路径106流体连通的单个开口。在一些其它实施例中,隔绝坞可以具有与流动路径106流体连通的多于一个开口,例如,n个开口,但是其中n-1个带阀的开口,使得除了一个开口之外的所有开口均是可关闭的。当所有带阀的开口关闭时,隔绝坞将材料从流动区域到隔绝坞中的交换限制为仅通过扩散进行。在一些实施例中,隔绝坞包括各种特征和结构(例如,隔离区域),这些特征和结构已经被优化,用于即使在介质180正流经流动路径106时也将微物体保留在隔绝坞内(并且因此保留在诸如微流体装置100的微流体装置内)。
盖110可以是框架114和/或微流体回路材料116的整合部件。可替代地,盖110可以是结构上不同的元件,如图1A所示。盖110可包括与框架114和/或微流体回路材料116相同或不同的材料。在一些实施例中,盖110可以是微流体回路材料116的整合部件。类似地,支撑结构104可以是与框架114或微流体回路材料116分开的结构,如图所示,或者是框架114或微流体回路材料116的整合部件。同样,框架114和微流体回路材料116可以是如图1A所示的单独结构,或相同结构的整合部件。不管各种可能的集成,微流体装置都可以保持三层结构,该三层结构包括基底层和覆盖层,基底层和覆盖层将微流体回路120所位于的中间层夹在中间。
在一些实施例中,盖110可以包括刚性材料。刚性材料可以是玻璃或具有类似性质的材料。在一些实施例中,盖110可包括可变形材料。可变形材料可以是聚合物,例如PDMS。在一些实施例中,盖110可包括刚性和可变形材料两者。例如,盖110的一个或多个部分(例如,定位在隔绝坞124、126、128、130上方的一个或多个部分)可包括与盖110的刚性材料接口连接的可变形材料。具有包括刚性材料和可变形材料两者的盖的微流体装置已经在例如美国专利第No.10,058,865号(Brinlinger等人)中进行描述,其内容通过引用整体合并在本文中。在一些实施例中,盖110还可包括一个或多个电极。一个或多个电极可包括导电氧化物,诸如氧化铟锡(ITO),其可以涂覆在玻璃或类似的绝缘材料上。可替代地,一个或多个电极可以是柔性电极,诸如单壁纳米管、多壁纳米管、纳米线、导电纳米颗粒簇或其组合,其嵌入在诸如聚合物(例如,PDMS)的可变形材料中。例如,在美国专利第No.9,227,200号(Chiou等人)中已经描述了可以用于微流体装置中的柔性电极,其内容通过引用整体合并在本文中。在一些实施例中,盖110和/或支撑结构104可以是透光的。盖110还可包括至少一种可透气的材料(例如,PDMS或PPS)。
在图1A所示的示例中,微流体回路120被示出为包括微流体通道122和隔绝坞124、126、128、130。每个坞包括通向通道122的开口,但是以其他方式被封闭,使得坞可以基本上将坞内部的微物体与通道122的流动路径106或其它坞中的流体介质180和/或微物体隔离。隔绝坞的壁从基部的内表面109延伸到盖110的内表面以提供围栏。隔绝坞通向微流体通道122的开口与流体介质180的流106成一定角度定向,使得流106不被引导到坞中。通道122中的大量流体流的矢量可以与隔绝坞的开口的平面相切或平行,并且不被引导到坞的开口中。在一些情况下,坞124、126、128、130被配置为物理地隔离微流体回路120内的一个或多个微物体。根据本公开的隔绝坞可包括各种形状、表面和特征,这些形状、表面和特征被优化以与DEP、OET、OEW、流体流、磁力、向心力和/或重力一起使用,如将在下面详细讨论和示出的。
微流体回路120可包括任何数量的微流体隔绝坞。尽管示出了五个隔绝坞,但微流体回路120可以具有更少或更多的隔绝坞。如图所示,微流体回路120的微流体隔绝坞124、126、128和130分别包括不同的特征和形状,其可以提供对于维持、隔离、测定或培养生物微物体有用的一个或多个益处。在一些实施例中,微流体回路120包括多个相同的微流体隔绝坞。
在图1A所示的实施例中,示出了包含单个通道122的单个流动路径106。然而,其它实施例可以在单个流动路径106内包含多个通道122,如图1B所示。微流体回路120还包括与流动路径106流体连通的入口阀或端口107,由此流体介质180可以进入流动路径106(和通道122)。在一些情况下,流动路径106包括基本上直的路径。在其它情况下,流动路径106以非线性或蜿蜒(winding)的方式布置,诸如之字形图案,由此流动路径106例如沿交替的方向行进穿过微流体装置100两次或更多次。流动路径106中的流动可从入口行进到出口,或者可以反向并从出口行进到入口。
在图1B中示出多通道装置的一个示例:微流体装置175,其在其它方面可以与微流体装置100类似。微流体装置175及其组成回路元件(例如,通道122和隔绝坞128)可以具有本文所述的任何尺寸。图1B所示的微流体回路具有两个入口/出口端口107以及包含四个不同通道122的流动路径106。可以选择微流体回路被细分成的通道数量以减小流体阻力。例如,微流体回路可包括1、2、3、4、5、6、7、8、9、10或更多个通道,以提供所选范围的流体阻力。微流体装置175还包括从每个通道122开口的多个隔绝坞,其中隔绝坞中的每个隔绝坞类似于图1A的隔绝坞128,并且可以具有如本文描述的任何隔绝坞的任何尺寸或功能。然而,微流体装置175的隔绝坞可以具有不同的形状,诸如图1A的隔绝坞124、126或130或如本文其它任何地方所述的任何形状。此外,微流体装置175可包括具有不同形状的混合的隔绝坞。在一些情况下,多个隔绝坞被配置为(例如,相对于通道122)使得隔绝坞可以并行地加载有目标微物体。
返回图1A,微流体回路120还可包括一个或多个可选的微物体阱132。可选的阱132可以形成在形成通道122的边界的壁中,并且可以与微流体隔绝坞124、126、128、130中的一或多者的开口相对定位。可选的阱132可以被配置为从流动路径106接收或捕获单个微物体,或可以被配置为从流动路径106接收或捕获多个微物体。在一些情况下,可选的阱132包括与单个目标微物体的体积近似相等的体积。
隔绝坞。本文所述的微流体装置可包括一个或多个隔绝坞,其中每个隔绝坞适合于保持一个或多个微物体(例如,生物细胞或关联在一起的细胞组)。隔绝坞可以被设置在流动区域内并向流动区域敞开,在一些实施例中,该流动区域是微流体通道。每个隔绝坞可以具有用于与一个或多个微流体通道流体连通的一个或多个开口。在一些实施例中,隔绝坞可以仅具有一个通向微流体通道的开口。
图2A-2C示出了微流体装置200的隔绝坞224、226和228,其可以类似于图1A的隔绝坞128。每个隔绝坞224、226和228可包括隔离区域240和将隔离区域240流体连接到流动区域的连接区域236,在一些实施例中,该流动区域可包括微流体通道,诸如通道122。连接区域236可包括通向流动区域(例如,微流体通道122)的近端开口234和通向隔离区域240的远端开口238。连接区域236可以被配置为使得在微流体通道122中流动的流体介质(未示出)通过隔绝坞224、226和228的流的最大渗透深度不延伸到隔离区域240中,如以下针对图2C所讨论的。在一些实施例中,来自微流体通道中的流的流线不进入隔离区域。因此,由于连接区域236,设置在隔绝坞224、226和228的隔离区域240中的微物体(未示出)或其它材料(未示出)可以与微流体通道122中的流体介质180的流隔离,并且基本上不受其影响。
图2A-2C的隔绝坞224、226和228分别具有直接向微流体通道122敞开的单个开口。隔绝坞的开口可以从微流体通道122横向敞开,如图2A所示,该图描绘了微流体装置200的竖直横截面。图2B示出了微流体装置200的水平横截面。电极活化衬底206可以位于微流体通道122以及隔绝坞224、226和228两者的下面。形成隔绝坞的底板(floor)的隔绝坞的围栏内的电极活化衬底206的上表面可以设置在微流体通道122(或流动区域,如果不存在通道的话)内的电极活化衬底206的上表面的相同水平面或基本上相同的水平面上,以形成微流体装置的流动通道(或流动区域,分别地)的底板。电极活化衬底206可以是无特征的或者可以具有不规则或图案化的表面,该表面从其最高高度到其最低凹陷变化小于约3微米(microns)、2.5微米、2微米、1.5微米、1微米、0.9微米、0.5微米、0.4微米、0.2微米、0.1微米或更小。衬底的上表面跨微流体通道122(或流动区域)和隔绝坞两者的高度变化可以等于或小于隔绝坞的壁高度的约10%、7%、5%、3%、2%、1%、0.9%、0.8%、0.5%、0.3%或0.1%。可替代地,衬底的上表面跨微流体通道122(或流动区域)和隔绝坞两者的高度变化可以等于或小于衬底高度的约2%、1%、0.9%、0.8%、0.5%、0.3%、0.2%或0.1%。虽然详细描述了微流体装置200,但这也可适用于本文所述的任何微流体装置。
微流体通道122和连接区域236可以是波及区域的示例,而隔绝坞224、226和228的隔离区域240可以是未波及区域的示例。类似224、226、228的隔绝坞具有隔离区域,其中,每个隔离区域仅具有一个开口,该开口通向隔绝坞的连接区域。进入和离开如此配置的隔离区域的流体介质交换可以被限制为基本上仅通过扩散发生。如所指出的,微流体通道122以及隔绝坞224、226和228可以被配置为包含一个或多个流体介质180。在图2A-2B所示的示例中,端口222连接到微流体通道122并且允许流体介质180被引入微流体装置200或从该微流体装置移除。在引入流体介质180之前,微流体装置可以用诸如二氧化碳气体的气体灌注。一旦微流体装置200容纳流体介质180,就可以选择性地生成和停止微流体通道122中的流体介质180的流242(参见图2C)。例如,如图所示,端口222可以设置在流动区域(微流体通道122)的不同位置(例如,相对端),并且可以建立从用作入口的一个端口222到用作出口的另一端口222的流体介质的流242。
图2C示出了根据一些实施例的隔绝坞224的示例的详细视图,该隔绝坞可以容纳一个或多个微物体246。微流体通道122中的流体介质180的流242经过隔绝坞224的连接区域236的近端开口234可以引起流体介质180进入和离开隔绝坞224的次级流244。为了将隔绝坞224的隔离区域240中的微物体246与次级流244隔离,隔绝坞224的连接区域236的长度L
(即,从近端开口234到远端开口238)应该大于次级流244进入连接区域236的穿透深度D
在一些实施例中,微流体通道122和隔绝坞224、226或228的壁可以相对于微流体通道122中的流体介质180的流242的矢量如下定向:微流体通道宽度W
在一些实施例中,对于给定的微流体装置,微流体通道122和开口234的配置可以固定,而流体介质180在微流体通道122中的流242的速率可以是可变的。因此,对于每个隔绝坞224,可以识别流体介质180在通道122中的流242的最大速度V
微流体通道122中第一流体介质180中的组分(未示出)可以基本上仅通过第一介质180的组分从微流体通道122经过连接区域236扩散并且进入隔离区域240中的第二流体介质248中而与隔离区域240中的第二流体介质248混合。类似地,隔离区域240中的第二介质248的组分(未示出)可以基本上仅通过第二介质248的组分从隔离区域240经过连接区域236扩散并且进入微流体通道122中的第一介质180中而与微流体通道122中的第一介质180混合。在一些实施例中,隔绝坞的隔离区域和流动区域之间通过扩散进行的流体介质交换的程度大于流体交换的约90%、91%、92%、93%、94%、95%、96%、97%、98%或大于约99%。
在一些实施例中,第一介质180可以是与第二介质248相同的介质或不同的介质。在一些实施例中,第一介质180和第二介质248可以开始是相同的,随后变得不同(例如,通过由隔离区域240中的一个或多个细胞对第二介质248的调节,或者通过改变流经微流体通道122的介质180)。
如图2C所示,连接区域236的宽度W
图3描绘了包含微流体回路结构308的微流体装置300的另一示例性实施例,该微流体装置包括通道322和隔绝坞324,该隔绝坞具有类似于本文所述的用于微流体装置100、175、200、400、520和本文所述的任何其它微流体装置的任何隔绝坞的特征和性质。
图3的示例性微流体装置包括微流体通道322,其具有如本文所述的宽度W
连接区域壁330可以限定钩区域352,该钩区域是隔绝坞324的隔离区域340的子区域。由于连接区域壁330延伸到隔绝坞的内腔体中,所以连接区域壁330可以用作物理屏障以将钩区域352与次级流344屏蔽开,其中L
在类似于图2A-2C和图3的那些配置的隔绝坞中,隔离区域可以具有任何类型的形状和大小,并且可以被选择以调节营养物、试剂和/或介质到隔绝坞中的扩散以到达隔绝坞的远壁,例如,与连接区域到流动区域(或微流体通道)的近端开口相对。可以进一步选择隔离区域的尺寸和形状,以调节废产物和/或生物微物体的分泌产物从隔离区域经由隔绝坞的连接区域的近端开口向流动区域的扩散。大体上,隔离区域的形状对于隔绝坞将微物体与流动区域中的直接流动隔离的能力不是关键的。
在隔绝坞的一些其它实施例中,隔离区域可以具有将隔离区域与微流体装置的流动区域流体连接的多于一个的开口。然而,对于具有将隔离区域流体连接到流动区域(或两个或更多个流动区域)的n个开口的隔离区域,n-1个开口可以带有阀。当n-1个带阀开口关闭时,隔离区域仅具有一个有效开口,并且进入/离开隔离区域的材料交换仅通过扩散发生。
具有其中可以放置、培养和/或监测生物微物体的坞的微流体装置的示例已经在例如以下文件中进行描述:美国专利第No.9,857,333号(Chapman等人)、美国专利第No.10,010,882号(White等人)和美国专利第No.9,889,445号(Chapman等人),其公开内容分别通过引用整体合并在本文中。
微流体回路元件尺寸。如本文所述,可以选择隔绝坞和隔绝坞通向的微流体通道的各种尺寸和/或特征,以限制污染物或不需要的微物体从流动区域/微流体通道引入隔绝坞的隔离区域中;将来自通道或来自隔离区域的流体介质中的组分的交换限制为基本上仅扩散交换;促进微物体进入和/或离开隔绝坞的转移;和/或促进生物细胞的生长或扩增。对于本文所述的任何实施例,微流体通道和隔绝坞可以具有任何合适的尺寸组合,可以由技术人员根据本公开的教导而选择,如下所述。
隔绝坞的连接区域的近端开口可以具有至少与隔绝坞所针对的微物体(例如,生物细胞,其可以是植物细胞,诸如植物原生质体)的最大尺寸一样大的宽度(例如,W
在一些实施例中,隔绝坞的连接区域可以具有从近端开口到通向隔绝坞的隔离区域的远端开口的长度(例如,L
隔绝坞所通向的微流体装置的微流体通道可以具有指定的尺寸(例如,宽度或高度)。在一些实施例中,微流体通道在通向隔绝坞的连接区域的近端开口处的高度(例如,H
在通向隔绝坞的连接区域的近端开口处的微流体通道的宽度(例如,W
微流体通道在通向隔绝坞的连接区域的近端开口处的横截面积可以为约500-50000平方微米、500-40000平方微米、500-30000平方微米、500-25000平方微米、500-20000平方微米、500-15000平方微米、500-10000平方微米、500-7500平方微米、500-5000平方微米、1000-25000平方微米、1000-20000平方微米、1000-15000平方微米、1000-10000平方微米、1000-7500平方微米、1000-5000平方微米、2000-20000平方微米、2000-15000平方微米、2000-10000平方微米、2000-7500平方微米、2000-6000平方微米、3000-20000平方微米、3000-15000平方微米、3000-10000平方微米、3000-7500平方微米或3000至6000平方微米。前述内容仅为示例,并且微流体通道在近端开口处的横截面积可以被选择为在以上列出的值中的任何值之间。在各种实施例,在微流体通道的除了在近端开口处以外的区域处,微流体通道的横截面积可以被选择为在以上列出的任何值之间。在一些实施例中,横截面积被选择为对于微流体通道的整个长度是基本上一致的值。
在一些实施例中,微流体芯片被配置为使得隔绝坞的连接区域的近端开口(例如,234或334)可以具有从约20微米至约200微米(例如,约50微米至约150微米)的宽度(例如,W
在一些实施例中,通道122、322、618、718的尺寸W
因此,在一些变型中,微流体通道在通向隔绝坞的连接区域的近端开口处的宽度(例如,W
在一些实施例中,隔绝坞的连接区域的近端开口(例如,234或334)的宽度(例如,Wcon或W
在一些实施例中,隔绝坞的连接区域的近端开口(例如,234或334)的宽度W
连接区域的长度(例如,L
隔绝坞的连接区域壁的长度(例如,L
隔绝坞可以具有约40-600微米、约40-500微米、约40-400微米、约40-300微米、约40-200微米、约40-100微米或约40-80微米的长度L
根据一些实施例,隔绝坞可以具有指定的高度(例如,H
连接区域在隔绝坞的近端开口处的高度H
隔离区域可以被配置为容纳仅一个、两个、三个、四个、五个或类似的相对少量的微物体。在其它实施例中,隔离区域可以容纳多于10个、多于50个或多于100个微物体。因此,隔离区域的体积可以是例如至少1×10
根据一些实施例,微流体装置的隔绝坞可以具有指定体积。可以选择隔绝坞(或隔绝坞的隔离区域)的指定体积,使得单个细胞或少量(例如,2-10或2-5个)细胞可以快速地调节介质,从而获得有利的(或最佳的)生长条件。在一些实施例中,隔绝坞具有约5x10
根据一些实施例,微流体通道(例如,122或322)内的流体介质的流可以具有指定的最大速度(例如,V
在各种实施例中,微流体装置具有如本文所述的实施例中的任一实施例中配置的隔绝坞,其中微流体装置具有约5至约10个隔绝坞、约10至约50个隔绝坞、约25至约200个隔绝坞、约100至约500个隔绝坞、约200至约1000个隔绝坞、约500至约1500个隔绝坞、约1000至约2500个隔绝坞、约2000至约5000个隔绝坞、约3500至约7000个隔绝坞、约5000至约10000个隔绝坞、约7500至约15000个隔绝坞、约12500至约20000个隔绝坞、约15000至约25000个隔绝坞、约20000至约30000个隔绝坞、约25000至约35000个隔绝坞、约30000至约40000个隔绝坞、约35000至约45000个隔绝坞或约40000至约50000个隔绝坞。隔绝坞不必所有是相同的尺寸并且可包括各种配置(例如,隔绝坞内的不同宽度、不同特征)。
涂覆溶液和涂覆剂。在一些实施例中,微流体装置的至少一个内表面包括涂覆材料,该涂覆材料提供适合于(多个)生物微物体的维持、扩增和/或移动的有机和/或亲水分子的层(即,生物微物体在微流体装置内展现出增加的活力、更大的扩增和/或更大的可移植性)。经调节的表面可以减少表面结垢、参与提供水合层和/或以其它方式保护生物微物体不与微流体装置内部的非有机材料接触。
在一些实施例中,微流体装置的基本上所有内表面都包括涂覆材料。
(多个)涂覆的内表面可包括流动区域(例如,通道)、腔室或隔绝坞或隔绝坞的表面,或者其组合。在一些实施例中,多个隔绝坞中的每一个具有涂覆有涂覆材料的至少一个内表面。在其它实施例中,多个流动区域或通道中的每一个具有至少一个涂覆有涂覆材料的内表面。在一些实施例中,多个隔绝坞中的每一个和多个通道中的每一个的至少一个内表面涂覆有涂覆材料。涂覆可以在引入(多个)生物微物体之前或之后施加,或者可以与(多个)生物微物体同时引入。在一些实施例中,(多个)生物微物体可以在包括一种或多种涂覆剂的流体介质中输入到微流体装置中。在其它实施例中,在将(多个)生物微物体引入微流体装置之前,微流体装置(例如,具有电极活化衬底的微流体装置,例如但不限于包括介电泳(DEP)电极的装置)的(多个)内表面可以用包括涂覆剂的涂覆溶液处理或“涂底漆”。可以使用任何方便的涂覆剂/涂覆溶液,包括但不限于:血清或血清因子、牛血清白蛋白(BSA)、聚合物、去污剂、酶及其任意组合。
基于合成聚合物的涂覆材料。该至少一个内表面可包括包含聚合物的涂覆材料。聚合物可以非共价结合(例如,其可以非特异性地粘附)到该至少一个表面。聚合物可以具有各种结构基序,例如在嵌段聚合物(和共聚物)、星形聚合物(星形共聚物)和接枝或梳形聚合物(接枝共聚物)中发现的,所有这些都可以适用于本文公开的方法。多种含亚烷基醚的聚合物可适用于本文所述的微流体装置中,包括但不限于诸如
共价链接的涂覆材料。在一些实施方式中,至少一个内表面包括共价链接的分子,其提供适合于在微流体装置内维持/扩增生物微物体的有机和/或亲水分子层,以为这样的细胞提供调节的表面。共价链接的分子包括链接基团,其中,链接基团共价链接到微流体装置的一个或多个表面,如下所述。链接基团也共价链接到表面改性部分,该表面改性部分被配置为提供适合于(多个)生物微物体的维持/扩增/移动的有机和/或亲水分子层。
在一些实施例中,被配置为提供适合于生物微物体的维持/扩增的有机和/或亲水分子层的共价链接部分可包括烷基或氟烷基(其包括全氟烷基)部分;单糖或多糖(其可包括但不限于葡聚糖);醇类(包括但不限于炔丙醇);多元醇,包括但不限于聚乙烯醇;亚烷基醚,包括但不限于聚乙二醇;聚电解质(包括但不限于聚丙烯酸或聚乙烯基膦酸);氨基(包括其衍生物,例如但不限于烷基化胺、羟烷基化氨基、胍基和含有未芳香化的氮环原子的杂环基,例如但不限于吗啉基或哌嗪基);羧酸,包括但不限于丙炔酸(其可以提供羧酸根阴离子表面);膦酸,包括但不限于乙炔基膦酸(其可以提供膦酸酯阴离子表面);磺酸根阴离子;羧基甜菜碱;磺基甜菜碱;氨基磺酸;或氨基酸。
在各种实施例中,被配置为提供适合于在微流体装置中维持/扩增生物微物体的有机和/或亲水分子层的共价链接部分可包括非聚合部分,例如烷基部分、氨基酸部分、醇部分、氨基部分、羧酸部分、膦酸部分、磺酸部分、氨基磺酸部分或糖部分。可替代地,共价链接部分可包括聚合部分,其可包括这些部分中的任一部分。
在一些实施例中,微流体装置可以在衬底的内表面上具有疏水层,该疏水层包括共价链接的烷基部分。共价链接的烷基部分可包括形成直链(例如,至少10个碳或至少14、16、18、20、22或更多个碳的直链)的碳原子,并且可以是未分支的烷基部分。在一些实施例中,烷基可包括取代的烷基(例如,烷基中的一些碳可以被氟化或全氟化)。在一些实施例中,烷基可包括接合到第二片段的第一片段,第一片段可包括全氟烷基,第二片段可包括未取代的烷基,其中第一和第二片段可直接或间接地接合(例如,通过醚键的方式)。烷基的第一片段可位于链接基团远端,烷基的第二片段可位于链接基团近端。
在其它实施例中,共价链接部分可包括至少一个氨基酸,其可包括多于一种类型的氨基酸。因此,共价链接部分可包括肽或蛋白。在一些实施例中,共价链接部分可包括可以提供两性离子表面以支持细胞生长、活力、可移植性或其任意组合的氨基酸。
在其它实施例中,共价链接部分还可包括链霉亲和素或生物素部分。在一些实施例中,改性的生物部分(例如,生物素化的蛋白或肽)可以被引入到携带共价链接的链霉亲和素的微流体装置的内表面,并经由共价链接的链霉亲和素偶联到表面,从而提供呈现蛋白或肽的改性的表面。
在其它实施例中,共价链接部分可包括至少一个环氧烷烃部分,并且可包括如上所述的任何环氧烷烃聚合物。一类有用的含亚烷基醚的聚合物是聚乙二醇(PEG M
共价链接部分可包括一种或多种糖。共价链接的糖可以是单糖、二糖或多糖。共价链接的糖可被改性以引入反应性配对部分,该反应性配对部分允许偶联或精制以附着到表面。一个示例性的共价链接部分可包括葡聚糖多糖,其可以通过非分支的接头间接偶联到表面。
提供经调节的表面的涂覆材料可以仅包括一种共价链接部分,或者可以包括多于一种不同种类的共价链接部分。例如,聚乙二醇调节的表面可以具有共价链接的环氧烷烃部分,该环氧烷烃部分具有指定数量的所有相同的环氧烷烃单元,例如具有相同的链接基团和与表面的共价附着、相同总长度和相同数量的环氧烷烃单元。可替代地,涂覆材料可以具有多于一种附着到表面的共价链接部分。例如,涂覆材料可包括具有共价链接的环氧烷烃部分的分子,该部分具有第一指定数量的环氧烷烃单元,并且涂覆材料还可包括另一组分子,其具有诸如连接到具有更多数量的环氧烷烃单元的共价附着的环氧烷烃链接部分的蛋白或肽的大体积部分。不同类型的分子可以以任何合适的比率变化以获得期望的表面特性。例如,具有第一分子(具有具有第一指定数量的环氧烷单元的化学结构)和第二分子(包含可通过生物素/链霉亲和素结合对联接至共价附着的亚烷基链接部分的肽或蛋白部分)的混合物的经调节的表面可以具有以下第一分子与第二分子的比率:约99:1;约90:10;约75:25;约50:50;约30:70;约20:80;约10:90;或者被选择为在这些值之间的任何比率。在这种情况下,具有不同的、空间要求较低的末端和较少主链原子的第一组分子可以有助于对整个衬底表面的功能化,从而防止与构成衬底本身的硅/氧化硅、氧化铪或氧化铝的不期望的粘附或接触。第一分子与第二分子的混合物的比率的选择也可以调节由携带肽或蛋白部分的第二分子引入的表面改性。
经调节的表面性质。各种因素可以改变经调节的表面的物理厚度,例如在衬底上形成经调节的表面的方式(例如,气相沉积、液相沉积、旋涂、浸渍和静电涂覆)。在一些实施例中,经调节的表面可以具有约1nm至约10nm的厚度。在一些实施例中,经调节的表面的共价链接部分在共价链接到微流体装置(其可包括具有介电泳(DEP)或电润湿(EW)电极的电极活化衬底)的表面时可以形成单层,并且可以具有小于10nm(例如,小于5nm,或约1.5至3.0nm)的厚度。这些值与通过旋涂制备的表面的值形成对比,例如,该表面通常可以具有约30nm的厚度。在一些实施例中,经调节的表面不需要完美形成的单层来适当地起作用以用于DEP配置的微流体装置内的操作。在其它实施例中,由共价链接部分形成的经调节的表面可以具有约10nm至约50nm的厚度。
单一部分或多部分经调节的表面。共价链接的涂覆材料可以通过分子的反应形成,该分子已经包含被配置为提供适合于在微流体装置中维持/扩增(多个)生物微物体的有机和/或亲水分子层的部分,并且共价链接的涂覆材料可以具有如下所示的式I的结构。可替代地,共价链接的涂覆材料可以形成为两部分的序列,其具有式II的结构,通过将被配置为提供适合于维持和/或扩增(多个)生物微物体的有机和/或亲水分子层的部分偶联到表面改性配体上,该表面改性配体本身已经共价链接到表面。在一些实施例中,表面可以形成为两部分或三部分序列,包括链霉亲和素/生物素结合对,以引入蛋白、肽或混合的改性表面。
涂覆材料可以共价链接到DEP配置的或EW配置的衬底的表面的氧化物。涂覆材料可以经由链接基团(“LG”)附着到氧化物,该链接基团可以是由硅氧烷或膦酸基团与氧化物反应形成的甲硅烷氧基或膦酸酯基团。被配置为提供适合于在微流体装置中维持/扩增(多个)生物微物体的有机和/或亲水分子层的部分可以是本文所述的任何部分。链接基团LG可以直接或间接地连接到被配置为提供适合于在微流体装置中维持/扩增(多个)生物微物体的有机和/或亲水分子层的部分。当链接基团LG直接连接到该部分时,不存在可选的接头(“L”)且n为0,当链接基团LG间接连接到该部分时,存在接头L且n为1。接头L可以具有线性部分,其中线性部分的主链可包括1至200个选自硅、碳、氮、氧、硫和/或磷原子的任意组合的非氢原子,其受到本领域已知的化学键合限制。它可以被一个或多个部分的任意组合中断,该一个或多个部分可以选自醚、氨基、羰基、酰氨基和/或膦酸酯基团、亚芳基、杂亚芳基或杂环基团。在一些实施例中,偶联基团CG表示从反应性部分R
合适的涂层处理和改性以及制备方法的其它细节可在美国专利申请公开第No.US2016/0312165号(Lowe,Jr.等人)、美国专利申请公开号No.US2017/0173580号(Lowe,Jr.等人)、国际专利申请公开WO2017/205830号(Lowe,Jr.等人)和国际专利申请公开WO2019/01880号(Beemiller等人)中找到,这些公开内容分别通过引用整体合并在本文中。
微流体装置动力技术。本文所述的微流体装置可与任何类型的动力技术一起使用。如本文所述,系统的控制和监测设备可包括用于在微流体装置的微流体回路中选择和移动诸如微物体或液滴的物体的动力模块。动力技术可包括例如介电泳(DEP)、电润湿(EW)和/或其它动力技术。取决于被移动的物体类型和其它考虑,微流体装置可以具有多种动力配置。返回图1A,例如,微流体装置100的支撑结构104和/或盖110可包括DEP电极活化衬底,用于选择性地在微流体回路120中的流体介质180中的微物体上引起动力,从而选择、捕获和/或移动各个微物体或微物体组。
在一些实施例中,经由一个或多个电极(未示出)跨流体介质180(例如,在流动路径中和/或在隔绝坞中)施加动力以操纵、运输、分离和分类位于其中的微物体。例如,在一些实施例中,将动力施加到微流体回路120的一个或多个部分,以便将单个微物体从流动路径106转移到期望的微流体隔绝坞中。在一些实施例中,动力用于防止隔绝坞内的微物体从该隔绝坞中移位。此外,在一些实施例中,动力用于从根据本公开的实施例先前收集的隔绝坞中选择性地移除微物体。
在一些实施例中,微流体装置被配置为光学致动的电动装置,诸如在光电子镊(OET)和/或光电湿润(OEW)配置的装置中。合适的OET配置的装置(例如,包含光学致动的介电泳电极活化衬底)的示例可包括在美国专利第No.RE 44,711号(Wu等人)(最初作为美国专利第7,612,355号公布)、美国专利第No.7,956,339号(Ohta等人)、美国专利第No.9,908,115号(Hobbs等人)和美国专利第No.9,403,172号(Short等人)中说明的那些,这些专利中的每一个均通过引用整体合并在本文中。合适的OEW配置的装置的示例可包括美国专利第No.6,958,132号(Chiou等人)和美国申请第No.9,533,306号(Chiou等人)中说明的那些,其每一个均通过引用整体合并在本文中。包括组合的OET/OEW配置的装置的合适的光学致动的电动装置的示例可包括美国专利申请公开第No.2015/0306598号(Khandros等)、美国专利申请公开第No.2015/0306599号(Khandros等)和美国专利申请公开第No.2017/0173580号(Lowe等)中说明的那些,这些专利中的每一个均通过引入整体合并在本文中。
应该理解,出于简化目的,图1-5B的各种示例可以示出微流体装置的一部分,而没有描绘其它部分。此外,图1-5B可以是一个或多个微流体系统的一部分,并被实施为一个或多个微流体系统。在一个非限制性示例中,图4A和图4B分别示出了具有区域/腔室402的微流体装置400的围栏102的一部分的侧截面图和俯视截面图,该部分可以是具有更详细结构的流体回路元件的一部分,诸如生长腔室、隔绝坞(其可以类似于本文所述的任何隔绝坞)、流动区域或流动通道。例如,微流体装置400可以类似于微流体装置100、175、200、300、520或如本文所述的任何其它微流体装置。此外,微流体装置400可包括其它流体回路元件,并且可以是包括上述控制和监测设备152的系统的部分,该系统具有介质模块160、动力模块162、成像模块164、可选的倾斜模块166和其它模块168中的一个或多个。微流体装置175、200、300、520和本文所述的任何其它微流体装置可以类似地具有针对图1A-1B和4A-4B详细描述的任何特征。
如图4A的示例所示,微流体装置400包括具有底部电极404和覆盖底部电极404的电极活化衬底406的支撑结构104,以及具有顶部电极410的盖110,其中顶部电极410与底部电极404间隔开。顶部电极410和电极活化衬底406限定区域/腔室402的相对表面。因此,容纳在区域/腔室402中的流体介质180提供了顶部电极410与电极活化衬底406之间的电阻连接。还示出了电源412,其被配置为连接到底部电极404和顶部电极410,并且在电极之间产生偏置电压,如在区域/腔室402中生成DEP力所需的。电源412可以是例如交流(AC)电源。
在某些实施例中,图4A和图4B所示的微流体装置200可以具有光学致动的DEP电极活化衬底。因此,可以由动力模块162控制的来自光源416的光418的图案的改变可以选择性地激活和停用电极活化衬底406的内表面408的区域414处的DEP电极的改变图案。(在下文中,具有DEP电极活化衬底的微流体装置的区域414被称为“DEP电极区域”。)如图4B所示,指向电极活化衬底406的内表面408上的光图案418可以以诸如正方形的图案照明所选择的DEP电极区域414a(以白色示出)。未被照明的DEP电极区域414(交叉阴影线)在下文中被称为“暗”DEP电极区域414。在每个暗DEP电极区域414处,通过DEP电极活化衬底406(即,从底部电极404向上直到电极活化衬底406的与流动区域106中的流体介质180交界的内表面408)的相对电阻抗大于通过区域/腔室402中的流体介质180(即,从电极活化衬底406的内表面408到盖110的顶部电极410)的相对电阻抗。然而,被照明的DEP电极区域414a展现出通过电极活化衬底406的降低的相对阻抗,该降低的相对阻抗小于通过每个被照明的DEP电极区域414a处的区域/腔室402中的流体介质180的相对阻抗。
在激活电源412的情况下,前述DEP配置在被照明的DEP电极区域414a与相邻的暗DEP电极区域414之间的流体介质180中产生电场梯度,这进而产生吸引或排斥流体介质180中的附近的微物体(未示出)的局部DEP力。因此,通过改变从光源416投射到微流体装置400中的光图案418,可以在区域/腔室402的内表面408处的许多不同的这种DEP电极区域414处选择性地激活和停用吸引或排斥流体介质180中的微物体的DEP电极。DEP力是吸引还是排斥附近的微物体可以取决于诸如电源412的频率和流体介质180和/或微物体(未示出)的介电性质之类的参数。取决于施加到DEP配置的功率的频率以及流体介质(例如,诸如PBS的高导电介质或适合于维持生物细胞的其它介质)的选择,可以产生负DEP力。负DEP力可以排斥微物体,使其远离所感应的非均匀电场的位置。在一些实施例中,结合DEP技术的微流体装置可以产生负DEP力。
图4B所示的被照明的DEP电极区域414a的正方形图案420仅为示例。DEP电极区域414的任何图案都可以被投射到微流体装置400中的光418的图案照明(并且由此激活),并且被照明/被激活的DEP电极区域414的图案可以通过改变或移动光图案418来重复地改变。
在一些实施例中,电极活化衬底406可包括光电导材料或由其组成。在这样的实施例中,电极活化衬底406的内表面408可以是无特征的。例如,电极活化衬底406可包括氢化非晶硅(a-Si:H)层或由其组成。例如,a-Si:H可包括约8%至40%的氢(按100*氢原子数/氢原子和硅原子的总数计算)。a-Si:H层的厚度可为约500nm至约2.0微米。在这样的实施例中,DEP电极区域414可以根据光图案418在电极活化衬底406的内表面408上的任何地方和以任何图案形成。DEP电极区域214的数量和图案因此不必固定,而是可以对应于光图案418。具有包括诸如上面讨论的光电导层的DEP配置的微流体装置的示例已经在例如美国专利第No.RE 44,711号(Wu等人)(最初作为美国专利第No.7,612,355号公布)中进行描述,其内容分别通过引用整体合并在本文中。
在其它实施例中,电极活化衬底406可包括衬底,该衬底包括多个掺杂层、电绝缘层(或区域)和形成半导体集成电路的导电层,诸如在半导体领域中已知的。例如,电极活化衬底406可包括多个光电晶体管,这些光电晶体管包括例如横向双极光电晶体管,其中每个光电晶体管对应于DEP电极区域414。可替代地,电极活化衬底406可包括由光电晶体管开关控制的电极(例如,导电金属电极),其中每个这种电极对应于DEP电极区域414。电极活化衬底406可包括这样的光电晶体管或光电晶体管控制的电极的图案。例如,图案可以是排列成行和列的基本上正方形的光电晶体管或光电晶体管控制的电极的阵列。可替代地,图案可以是形成六边形点阵的基本上六边形的光电晶体管或光电晶体管控制的电极的阵列。无论图案如何,电路元件可以在电极活化衬底406的内表面408处的DEP电极区域414与底部电极404之间形成电连接,并且这些电连接(即,光电晶体管或电极)可以由光图案418选择性地激活和停用,如上所述。
例如,在美国专利第No.7,956,339号(Ohta等人)和美国专利第No.9,908,115号(Hobbs等人)中已经描述了具有包括光电晶体管的电极活化衬底的微流体装置的示例,这些专利的所有内容分别通过引用整体合并在本文中。已经在例如美国专利第No.9,403,172号(Short等人)中描述了具有包括由光电晶体管开关控制的电极的电极活化衬底的微流体装置的示例,其内容通过引用整体合并在本文中。
在DEP配置的微流体装置的一些实施例中,顶部电极410是围栏402的第一壁(或盖110)的一部分,并且电极活化衬底406和底部电极404是围栏102的第二壁(或支撑结构104)的一部分。区域/腔室402可以位于第一壁与第二壁之间。在其它实施例中,电极410是第二壁(或支撑结构104)的一部分,并且电极活化衬底406和/或电极410中的一个或两个是第一壁(或盖110)的一部分。此外,光源416可以可替代地用于从下方照明围栏102。
利用图4A-4B的具有DEP电极活化衬底的微流体装置400,如本文针对图1A所述,控制和监测设备152的动力模块162可以通过将光图案418投射到微流体装置400中以围绕并捕获微物体的图案(例如,正方形图案420)激活电极活化衬底406的内表面408的DEP电极区域414a处的第一组一个或多个DEP电极,来选择区域/腔室402中的流体介质180中的微物体(未示出)。动力模块162随后可以通过相对于微流体装置400移动光图案418以激活在DEP电极区域414处的第二组一个或多个DEP电极,来移动原位生成的捕获的微物体。可替代地,微流体装置400可以相对于光图案418移动。
在其它实施例中,微流体装置400可以是DEP配置的装置,其不依赖于在电极活化衬底406的内表面408处的DEP电极的光激活。例如,电极活化衬底406可包括选择性可寻址和可激励的电极,该电极与包括至少一个电极的表面(例如,盖110)相对地定位。开关(例如,半导体衬底中的晶体管开关)可以选择性地打开和闭合以激活或去激活DEP电极区域414处的DEP电极,从而在激活的DEP电极附近的区域/腔室402中的微物体(未示出)上产生净DEP力。取决于诸如电源412的频率和区域/腔室402中的介质(未示出)和/或微物体的介电性质的特性,DEP力可以吸引或排斥附近的微物体。通过选择性地激活和停用一组DEP电极(例如,在形成正方形图案420的一组DEP电极区域414处),可以选择区域/腔室402中的一个或多个微物体,并且在区域/腔室402内移动所述一个或多个微物体。图1A中的动力模块162可以控制这样的开关,并且因此激活和停用DEP电极中的各个DEP电极以选择和移动区域/腔室402周围的特定微物体(未示出)。具有包括选择性可寻址和可激励的电极的DEP电极活化衬底的微流体装置是本领域已知的,并且已经在例如美国专利第No.6,294,063号(Becker等人)和美国专利第No.6,942,776号(Medoro)中描述,其内容分别通过引用整体合并在本文中。
不管微流体装置400是否具有介电泳电极活化衬底、电湿润电极活化衬底或者介电泳和电湿润活化衬底两者的组合,电源412可以被用于提供向微流体装置400的电路供电的电势(例如,AC电压电势)。电源412可以与图1A中参考的电源192相同或者是其部件。电源412可以被配置为将AC电压及/或电流提供到顶部电极410和底部电极404。对于AC电压,电源412可以提供频率范围和平均或峰值功率(例如,电压或电流)范围,其足以生成足够强的净DEP力(或电润湿力)以选择和移动区域/腔室402中的各个微物体(未示出),如上所述,和/或以改变区域/腔室202中的支撑结构104的内表面408的湿润性质,同样如上所述。这样的频率范围和平均或峰值功率范围在本领域中是已知的。参见例如美国专利第No.6,958,132号(Chiou等人)、美国专利第No.RE44,711号(Wu等人)(最初作为美国专利第No.7,612,355号公布)和美国专利申请公开第No.2014/0124370号(Short等人)、No.2015/0306598号(Khandros等人)、No.2015/0306599号(Khandros等人)和No.2017/0173580号(Lowe,Jr等人),其公开内容分别通过引用整体合并在本文中。
在微流体装置内可以单独地或组合地利用其它力来移动所选择的微物体。微流体通道内的大量流体流动可以移动流动区域内的微物体。也可使用可在微流体通道内、隔绝坞内或另一种类的腔室(例如,储存器)内操作的局部化的流体流来移动所选择的微物体。局部化流体流可以用于将所选择的微物体从流动区域移出到非流动区域中,诸如隔绝坞中,或反之亦然,从非流动区域移动到流动区域中。如美国专利第No.10,058,865号(Brinlinger等人)所述,通过使微流体装置的可变形壁变形可以致动局部化的流动,其内容通过引用整体合并在本文中。
重力可以被用于将微流体通道内的微物体移动到隔绝坞中和/或移出隔绝坞或其它腔室,如在美国专利第No.9,744,533号(Breilinger等人)中所述,其内容通过引用整体合并在本文中。重力的使用(例如,通过倾斜微流体装置和/或微流体装置所附着到的支撑件)对于细胞从流动区域进入隔绝坞或从隔绝坞到流动区域的整体移动可以是有用的。可以采用磁力来移动包括顺磁性材料的微物体,该微物体可包括附着到生物微物体或与生物微物体相关联的磁性微物体。可替代地或额外地,向心力可以用于在微流体通道内移动微物体,以及将其移入或移出微流体装置中的隔绝坞或其它腔室。
在移动微物体的另一可替代模式中,激光生成的移位力(dislodgingforce)可以用于从隔绝坞或微流体装置中的任何其它腔室中输出微物体或协助输出微物体,如国际专利公开第No.WO2017/117408号(Kurz等人)中所描述,其内容通过引用整体合并在本文中。
在一些实施例中,DEP力与其它力组合,诸如流体流(例如,通道中的整体流体流或通过使微流体装置的可变形表面变形而致动的局部化流体流、激光生成的移位力和/或重力),以便在微流体回路120内操纵、运输、分离和分类微物体和/或液滴。在一些实施例中,DEP力可以在其它力之前施加。在其它实施例中,DEP力可以在其它力之后施加。在其它情况下,DEP力可以与其它力同时施加,或者以与其它力交替的方式施加。
系统。返回图1A,示出了用于操作和控制微流体装置的系统150,诸如用于控制微流体装置100。电源192可以向微流体装置100提供电力,以根据需要提供偏置电压或电流。电源192可以例如包括一个或多个交流(AC)和/或直流(DC)电压源或电流源。
系统150还可包括介质源178。介质源178(例如,容器、储存器等)可包括多个部分或容器,每个部分或容器用于保持不同的流体介质180。因此,介质源178可以是微流体装置100外部并与其分离的装置,如图1A所示。可替代地,介质源178可以所有或部分位于微流体装置100的围栏102内部。例如,介质源178可包括作为微流体装置100的一部分的储存器。
图1A还示出了控制和监测设备152的示例的简化框图描绘,该控制和监测设备构成系统150的一部分并且可以与微流体装置100结合使用。如图所示,这种控制和监测设备152的示例可包括主控制器154,该主控制器包括用于控制介质源178的介质模块160、用于控制微物体(未示出)和/或介质(例如,介质的液滴)在微流体回路120中的移动和/或选择的动力模块162、用于控制成像装置(例如,相机、显微镜、光源或其任意组合)以捕获图像(例如,数字图像)的成像模块164以及用于控制微流体装置100的倾斜的可选的倾斜模块166。控制设备152还可包括用于控制、监测或执行关于微流体装置100的其它功能的其它模块168。如图所示,监测设备152还可包括显示装置170和输入/输出装置172。
主控制器154可包括控制模块156和数字存储器158。控制模块156可包括例如数字处理器,该数字处理器被配置为根据作为非暂时性数据或信号存储在存储器158中的机器可执行指令(例如,软件、固件、源代码等)进行操作。可替代地或者额外地,控制模块156可包括硬连线数字电路和/或模拟电路。介质模块160、动力模块162、成像模块164,可选的倾斜模块166和/或其它模块168可以类似地配置。因此,本文所述的关于微流体装置100或任何其它微流体装置执行的功能、过程行为、动作或过程步骤可以由如上所述配置的主控制器154、介质模块160、动力模块162、成像模块164、可选的倾斜模块166和/或其它模块168中的任何一个或多个执行。类似地,主控制器154、介质模块160、动力模块162、成像模块164、可选的倾斜模块166和/或其它模块168可以通信地耦接,以传输和接收在本文所述的任何功能、过程、行为、动作或步骤中使用的数据。
介质模块160控制介质源178。例如,介质模块160可以控制介质源178将所选择的流体介质180输入到围栏102中(例如,通过入口端口107)。介质模块160还可以控制介质从围栏102中的移除(例如,通过出口端口
(未示出))。因此,可以选择性地将一个或多个介质输入微流体回路120中和从其中移除。介质模块160还可以控制微流体回路120内部的流动路径106中的流体介质180的流。介质模块160还可以向介质源178提供调节气体条件,例如,提供包含5%(或更高)的CO
动力模块。动力模块162可以被配置为控制微物体(未示出)在微流体回路120中的选择和移动。微流体装置100的围栏102可包括一个或多个电动机构,所述一个或多个电动机构包括介电泳(DEP)电极活化衬底、光电镊子(OET)电极活化衬底、电润湿(EW)电极活化衬底和/或光电润湿(OEW)电极活化衬底,其中动力模块162可以控制电极和/或晶体管(例如,光电晶体管)的活化以选择和移动流动路径106中和/或隔绝坞124、126、128和130内的微物体和/或液滴。电动机构可以是任何合适的单个的或组合的机构,如本文在描述用于在微流体装置内使用的动力技术的段落中所述。DEP配置的装置可包括一个或多个电极,所述一个或多个电极在微流体回路120中施加非均匀电场,该非均匀电场足以在微流体回路120中的微物体上施加介电泳力。OET配置的装置可包括可光电激活的电极,以通过光诱导的介电泳提供对微流体回路120中的微物体的移动的选择性控制。
成像模块164可以控制成像装置。例如,成像模块164可以接收和处理来自成像装置的图像数据。来自成像装置的图像数据可包括由成像装置捕获的任何类型的信息(例如,微物体的存在或不存在、介质的液滴、诸如荧光标签等的标签的积聚,等等)。使用由成像装置捕获到的信息,成像模块164可以进一步计算物体(例如,微物体、介质的液滴)的位置和/或这样的物体在微流体装置100内的运动速率。
成像装置(如下所述的成像模块164的一部分)可包括用于捕获微流体回路120内部的图像的装置,例如数码相机。在一些情况下,成像装置还包括具有快速帧速率和/或高灵敏度(例如,用于低光应用)的检测器。成像装置还可包括用于将激发辐射和/或光束引导到微流体回路120中并收集从微流体回路120(或其中容纳的微物体)反射或发射的辐射和/或光束的机构。所发射的光束可以在可见光谱中,并且可以例如包括荧光发射。反射光束可包括源自LED或宽光谱灯(例如汞灯(例如,高压汞灯)或氙弧灯)的反射的发射。成像装置还可包括显微镜(或光学系统),其可包括或不包括目镜。
支撑结构。系统150还可包括支撑结构190,该支撑结构被配置为支撑和/或保持包括微流体回路120的围栏102。在一些实施例中,可选的倾斜模块166可以被配置为激活支撑结构190以使微流体装置100围绕一个或多个旋转轴旋转。可选的倾斜模块166可以被配置为将微流体装置100支撑和/或保持在水平定向(即,相对于x轴和y轴成0°)、垂直定向(即,相对于x轴和/或y轴成90°)或其之间的任何定向。微流体装置100(和微流体回路120)相对于轴的定向在本文中被称为微流体装置100(和微流体回路120)的“倾斜”。例如,支撑结构190可以可选地用于使微流体装置100相对于x轴倾斜(例如,如由可选的倾斜模块166控制的)0.1°、0.2°、0.3°、0.4°、0.5°、0.6°、0.7°、0.8°、0.9°、1°、2°、3°、4°、5°、10°、15°、20°、25°、30°、35°、40°、45°、50°、55°、60°、65°、70°、75°、80°、90°或在其之间的任何角度。当微流体装置以大于约15°的角度倾斜时,可以执行倾斜以产生微物体从流动区域(例如,微流体通道)进入隔绝坞/从隔绝坞进入流动区域的整体移动。在一些实施例中,支撑结构190可以相对于x轴(水平)以0.1°、0.2°、0.3°、0.4°、0.5°、0.6°、0.7°、0.8°、0.9°、1°、2°、3°、4°、5°或10°的固定角度保持微流体装置100,只要DEP是将微物体从隔绝坞移出到微流体通道中的有效力即可。由于电极活化衬底的表面基本上是平坦的,因此即使当隔绝坞的与其通向微流体通道的开口相对的远端沿竖直方向设置在比微流体通道更低的位置处时,也可以使用DEP力。
在微流体装置相对于水平以固定角度倾斜或保持的一些实施例中,微流体装置100可以以一定定向设置,使得流动路径106的基部的内表面以一定角度定位在横向于流动路径敞开的一个或多个隔绝坞的基部的内表面上方或下方。如本文所使用的,术语“上方”表示流动路径106在由重力限定的竖直轴上定位成高于一个或多个隔绝坞(即,流动路径106上方的隔绝坞中的物体将具有比流动路径中的物体更高的重力势能),并且反过来,用于将流动路径106定位在一个或多个隔绝坞下方。在一些实施例中,支撑结构190可以相对于x轴(水平)以小于约5°、约4°、约3°或小于约2°的固定角度保持,从而将隔绝坞放置在相对于流动路径更低的势能处。在一些其它实施例中,当在微流体装置内进行长期培养(例如,超过约2、3、4、5、6、7或更多天)时,该装置可被支撑在培养支撑件上,并且可以以约10°、15°、20°、25°、30°或在其之间的任何角度的更大角度倾斜,以在长期培养时间段期间将生物微物体保留在隔绝坞内。在培养时间段结束时,容纳培养的生物微物体的微流体装置可以被返回到系统150内的支撑件190,其中倾斜角度减小到如上所述的值,从而提供DEP的使用以将生物微物体移出隔绝坞。在美国专利第No.9,744,533号(Brinlinger等人)中描述了使用由倾斜引起的重力的其它示例,其内容通过引用整体合并在本文中。
巢。现在转到图5A,系统150可包括被配置为保持微流体装置520的结构(也称为“巢”)500,其可以类似于微流体装置100、200或本文所述的任何其它微流体装置。巢500可包括能够与微流体装置520(例如,光学致动的电动装置100、200等)接口连接并且能够提供从电源192到微流体装置520的电连接的插座502。巢500还可包括集成的电信号生成子系统504。电信号生成子系统504可以被配置为将偏置电压供应到插座502,使得当微流体装置520被插座502保持时,偏置电压被施加在微流体装置中的一对电极上。因此,电信号生成子系统504可以是电源192的一部分。向微流体装置520施加偏置电压的能力并不意味着当微流体装置520由插座502保持时,偏置电压将一直被施加。相反,在大多数情况下,将间歇地施加偏置电压,例如,仅在需要促进在微流体装置520中生成电动力时施加时,例如生成介电泳或电润湿时。
如图5A所示,巢500可包括印刷电路板组件(PCBA)522。电信号生成子系统504可以安装在PCBA 522上并且电集成到其中。示例性支撑件也包括安装在PCBA 522上的插座502。
在一些实施例中,巢500可包括电信号生成子系统504,该电信号生成子系统被配置为测量微流体装置520处的放大电压,随后根据需要调节其自身的输出电压,使得微流体装置520处的测量电压为期望值。在一些实施例中,波形放大回路可以具有由安装在PCBA322上的一对DC-DC转换器生成的+6.5V至-6.5V电源,从而在微流体装置520处得到高达13Vpp的信号。
在某些实施例中,巢500还包括控制器508,诸如用于感测和/或控制电信号产生子系统504的微处理器。合适的微处理器的示例包括Arduino
如图5A所示,支撑结构500(例如,巢)还可包括热控制子系统506。热控制子系统506可以被配置为调节由支撑结构500保持的微流体装置520的温度。例如,热控制子系统506可包括珀耳帖热电装置(未示出)和冷却单元(未示出)。在图5A所示的实施例中,支撑结构500包括入口516和出口518,以从冷却单元的外部储存器(未示出)接收冷却的流体,将冷却的流体引入流体路径514中并通过冷却块,随后将冷却的流体返回到外部储存器。在一些实施例中,珀尔帖热电装置、冷却单元和/或流体路径514可以安装在支撑结构500的壳体512上。在一些实施例中,热控制子系统506被配置为调节珀尔帖热电装置的温度,以便实现微流体装置520的目标温度。珀耳帖热电装置的温度调节可以例如通过热电电源来实现,例如Pololu
巢500可包括串行端口524,该串行端口允许控制器508的微处理器经由接口与外部主控制器154进行通信。此外,控制器508的微处理器可以与电信号生成子系统504和热控制子系统506进行通信(例如,经由Plink工具(未示出))。因此,经由控制器508、接口和串行端口524的组合,电信号生成子系统504和热控制子系统506可以与外部主控制器154进行通信。以这种方式,主控制器154可以通过执行用于输出电压调整的缩放计算来辅助电信号生成子系统504,等等。经由耦接到外部主控制器154的显示装置170提供的图形用户界面(GUI)(未示出)可以被配置为绘制分别从热控制子系统506和电信号生成子系统504获得的温度和波形数据。可替代地或额外地,GUI可以允许更新控制器508、热控制子系统506和电信号生成子系统504。
光学子系统。图5B是具有用于成像和操纵微流体装置520中的微物体的光学设备510的光学子系统550的示意图,该微流体装置可以是本文所述的任何微流体装置。光学设备510可以被配置为执行微流体装置520的围栏内的一个或多个微物体的成像、分析和操纵。
光学设备510可以具有第一光源552、第二光源554和第三光源556。第一光源552可以将光传输到结构光调制器560,该结构光调制器可包括数字镜装置(DMD)或微型快门阵列系统(MSA),其中的任一个可以被配置为接收来自第一光源552的光并且选择性地将所接收的光的子集传输到光学设备510中。可替代地,结构光调制器560可包括产生其自己的光(并因此不需要光源552)的装置,诸如有机发光二极管显示器(OLED)、硅基液晶(LCOS)装置、硅基铁电液晶装置(FLCOS)或透射式液晶显示器(LCD)。结构光调制器560可以是例如投影仪。因此,结构光调制器560能够发射结构光和非结构光两者。在某些实施例中,系统的成像模块和/或动力模块可以控制结构光调制器560。
在实施例中,当结构化光调制器560包括反射镜时,调制器可以具有多个反射镜。多个反射镜中的每个反射镜可具有约5微米x 5微米至约10微米x 10微米或其之间的任何值的尺寸。结构化光调制器560可以包括2000x 1000、2580x 1600、3000x 2000或其之间的任何值的反射镜(或像素)的阵列。在一些实施例中,仅使用结构化光调制器560的照明区域的一部分。结构化光调制器560可以将所选择的光的子集传输到第一二向色分束器558,该第一二向色分束器558可以将该光反射到第一镜筒透镜562。
第一镜筒透镜562可以具有大的通光孔径,例如,大于约40mm至约50mm或更大的直径,从而提供大的视场。因此,第一镜筒透镜5621可以具有足够大的孔径以捕获从结构光调制器560发出的所有(或基本上所有)光束。
可替代地或额外地,具有约400nm至约710nm波长的结构光515可以向微流体装置提供荧光激发照明。
第二光源554可以提供非结构化的明场照明。明场照明光525可以具有任何合适的波长,并且在一些实施例中,可以具有约400nm至约760nm的波长。第二光源554可将光传输到第二二向色分束器564(其也可接收来自第三光源556的光535),并且第二光、明场照明525可从其传输到第一二向色分束器558。第二光、明场照明525随后可以从第一分束器558传输到第一镜筒透镜562。
第三光源556可以通过匹配的对中继透镜(未示出)将光传输到反射镜566。第三光照明535可以从其反射到第二二向色分束器5338,并且从其传输到第一分束器5338,并且向前延伸到第一镜筒透镜5381。第三照明光535可以是激光并且可以具有任何合适的波长。在一些实施例中,激光照明535可以具有约350nm至约900nm的波长。激光照明535可以被配置为加热微流体装置内的一个或多个隔绝坞的部分。激光照明535可以被配置为加热流体介质、微物体、隔绝坞的壁或壁的一部分、设置在微流体通道或微流体通道的隔绝坞内的金属靶、或微流体装置内的光可逆的物理屏障,并且在美国申请公开号第No.2017/0165667号(Beaumont等人)和2018/0298318(Kurz等人)中更详细地描述,其公开内容分别通过引用整体合并在本文中。在其它实施例中,激光照明535可以被配置为启动微流体装置的改性表面的表面改性部分的光裂解或为微流体装置内的隔绝坞内的微物体提供粘附功能的部分的光裂解。使用激光的光裂解的其它细节可以在国际申请公开号第No.WO2017/205830号(Lowe,Jr等人)中找到,其公开内容通过引用整体合并在本文中。
来自第一、第二和第三光源(552、554、5560)的光穿过第一镜筒透镜562,并传输到第三二向色分束器568和滤光器变换器572。第三二向色分束器568可反射光的一部分并将光透射通过滤光器变换器572中的一个或多个滤光器并到达物镜570,该物镜可以是具有可根据需求切换的多个不同物镜的物镜变换器。一些光(515、525和/或535)可以穿过第三二向色分束器568,并且由光束块(未图示)终止或吸收。从第三二向色分束器568反射的光穿过物镜570以照明样本平面574,该样本平面可以是微流体装置520的一部分,诸如本文所述的隔绝坞。
如图5A所示,巢500可以与光学设备510集成在一起,并且是设备510的一部分。巢500可以提供到围栏的电连接,并且还被配置为提供到围栏的流体连接。用户可以将微流体装置520加载到巢500中。在一些其它实施例中,巢500可以是独立于光学设备510的单独部件。
光可以从样本平面574反射和/或发射,以返回穿过物镜570、穿过滤光器变换器572、并穿过第三二向色分束器568到达第二镜筒透镜576。光可以穿过第二镜筒透镜576(或成像镜筒透镜576)并且从反射镜578反射到成像传感器580。杂散光挡板(未示出)可以放置在第一镜筒透镜562与第三二向色分束器568之间、第三二向色分束器568与第二镜筒透镜576之间以及第二镜筒透镜576与成像传感器580之间。
物镜。光学设备可包括物镜570,该物镜被特别设计和配置为用于观察和操纵微流体装置520中的微物体。例如,常规显微镜物镜被设计为观察载玻片上的或通过5mm的含水流体的微物体,而微流体装置520中的微物体在观察平面574内的多个隔绝坞内部,其具有20、30、40、50、60、70、80微米或其之间的任何值的深度。在一些实施例中,透明盖520a(例如,具有约750微米的厚度的玻璃或ITO盖)可以被放置在多个隔绝坞的顶部上,这些隔绝坞设置在微流体衬底520c上方。因此,通过使用常规的显微镜物镜获得的微物体的图像可能具有大的像差(例如,球差和色差),这会降低图像的质量。光学设备510的物镜570可以被配置为校正光学设备1350中的球差和色差。物镜570可以具有一个或多个可用的放大倍率,例如4X、10X、20X。
照明模式。在一些实施例中,结构光调制器560可以被配置为调制从第一光源552接收到的光束并且将多个照明光束515(可以是结构光束)传输到微流体装置的围栏中,例如,包含隔绝坞的区域中。结构光束可包括所述多个照明光束。多个照明光束可以被选择性地激活以生成多个照明图案。一些实施例中,结构光调制器560可以被配置为生成照明图案,类似于针对图4A-4B所描述的,该照明图案可以被移动和调整。光学设备560还可包括控制单元(未示出),该控制单元被配置为调整照明图案以选择性地激活衬底520c的多个DEP电极中的一个或多个DEP电极并且生成DEP力以在微流体装置520内的多个隔绝坞内移动一个或多个微物体。例如,可以以受控方式随时间调整多个照明图案以操纵微流体装置520中的微物体。多个照明图案中的每一个可以被移位以移位所生成的DEP力的位置并且将结构光从一个位置移动到另一个位置,以便在微流体装置520的围栏内移动微物体。
在一些实施例中,光学设备510可以被配置为使得视场内的样本平面574中的多个隔绝坞中的每个隔绝坞在图像传感器580处和结构光调制器560处同时聚焦。在一些实施例中,结构光调制器560可以设置在图像传感器580的共轭平面处。在各种实施例中,光学设备510可以具有共焦配置或共焦性质。光学设备510可被进一步配置为,使得仅视场内的样本平面574中的流动区域的每个内部区域和/或多个隔绝坞中的每个隔绝坞被成像到图像传感器580上,以便减少整体噪声,从而提高图像的对比度和分辨率。
在一些实施例中,第一镜筒透镜562可以被配置为生成准直光束并且将准直光束传输到物镜570。物镜570可以接收来自第一镜筒透镜562的准直光束,并且将准直光束聚焦到流动区域的每个内部区域以及图像传感器580或光学设备510的视场内的样本平面574中的多个隔绝坞中的每个隔绝坞中。在一些实施例中,第一镜筒透镜562可以被配置为生成多个准直光束并且将多个准直光束传输到物镜570。物镜570可以从第一镜筒透镜562接收多个准直光束,并且将多个准直光束会聚到图像传感器580或光学设备510的视场内的样本平面574中的多个隔绝坞中的每个隔绝坞中。
在一些实施例中,光学设备510可以被配置为利用多个照明点照明隔绝坞的至少一部分。物镜570可以从第一镜筒透镜562接收多个准直光束,并且将可以形成照明图案的多个照明点投影到视场内的样本平面574中的多个隔绝坞中的每个隔绝坞中。例如,多个照明点中的每一个可以具有约5微米x 5微米;10微米x 10微米;10微米x 30微米、30微米x 60微米、40微米x 40微米、40微米x 60微米、60微米x 120微米、80微米x 100微米、100微米x140微米以及其之间的任何值的尺寸。照明点可以分别具有圆形、正方形或矩形的形状。可替代地,可以在多个照明点(例如,照明图案)内对照明点分组以形成较大的多边形形状,例如矩形、正方形或楔形形状。照明图案可以包围(例如,围绕)未照明空间,该未照明空间可以是正方形、矩形或多边形。例如,多个照明点中的每一个可以具有约150至约3000、约4000至约10000、或5000至约15000平方微米的面积。照明图案可以具有约1000至约8000、约4000至约10000、7000至约20000、8000至约22000、10000至约25000平方微米以及其之间的任何值的面积。
光学系统510可以用于确定如何重新定位微物体以及向微流体装置的隔绝坞中和从微流体装置的隔绝坞中重新定位微物体,以及对存在于装置的微流体回路内的微物体数量计数。重新定位和计数微物体的其它细节可在以下文献中找到:美国申请公开号第No.2016/0160259号(Du);美国专利第No.9,996,920号(Du等人);和国际申请公开号第WO2017/102748号(Kim等)。光学系统510也可以用于测定方法中以确定试剂/测定产物的浓度,并且其它细节可以在以下文献中找到:美国专利第No.8,921,055号(Chapman)、10,010,882号(White等人)和9,889,445号(Chapman等人);国际申请公开号第No.WO2017/181135号(Lionberger等人);以及国际申请序列号第No.PCT/US2018/055918号(Lionberger等人)。如本文所述,适用于在用于观察和操纵在微流体装置内的微物体的系统内使用的光学设备的特征的其它细节可在WO2018/102747(Lundquist等人)中找到,其公开内容通过引用整体合并在本文中。
用于维持微流体装置的隔绝坞内的细胞的活力的额外系统部件。为了促进细胞群的生长和/或扩增,可以通过系统的额外部件提供有助于维持功能细胞的环境条件。例如,这些额外部件可以提供营养物、细胞生长信号传递种类、pH调节、气体交换、温度控制和从细胞中移除废产物。
示例
系统和微流体装置:OptoSelect
引发溶液:包含0.1%
培养的准备:将具有改性表面的微流体装置加载到系统上,并用100%二氧化碳在15psi下吹扫5分钟。在二氧化碳吹扫之后,立即以5微升/秒将引发溶液灌注通过微流体装置8分钟。随后使培养介质以5微升/秒流经微流体装置5分钟。
引发方案:250微升的100%二氧化碳以12微升/秒的速率流入。随后是250微升含0.1%
灌注方案。灌注方法是以下两种方法中的任一种:
1.以0.01微升/秒灌注2小时;以2微升/秒灌注64秒;并且重复。
2.以0.02微升/秒灌注100秒;停止流动500秒;以2微升/秒灌注64秒;并且重复。
示例1.具有式III的改性内表面的微流体装置的准备。具有第一硅电极活化衬底和在相对的壁上的第二ITO衬底以及分隔两个衬底的光图案化的硅微流体回路材料的OptoSelect装置,在氧等离子体清洁器(NordsonAsymtek)中使用100W功率,在240mTorr压力和440sccm氧气流速下被处理1分钟。在真空反应器中,利用真空反应器底部的箔舟中的3-叠氮基十二烷基)三甲氧基硅烷(化合物5,300微升),在真空反应器底部的单独的箔舟中存在作为水反应物源的七水合硫酸镁(0.5g,Acros)的情况下,对等离子体处理后的微流体进行处理。然后使用真空泵将腔室泵至750mTorr,然后密封。将真空反应器放置在110℃下加热24-48小时的烘箱中。这将官能化表面引入微流体装置的所有面向内部的表面,其中,官能化表面具有式III的结构:
/>
其中,Z是与结合到表面的相邻硅原子的键,或者是与表面的键并且
示例2.将光可裂解生物素官能化PEG表面(式IV)的共价改性表面引入微流体装置。如上所述的来自示例1的具有式III的表面的产品微流体装置与生物素官能化的光可裂解炔PEG3(化合物10,Broadpharm,Cat.#BP-22677,其包含光可裂解的硝基取代的苯基作为接头L的一部分)反应,使至少250微升的含有1.33毫摩尔的化合物10、500微摩尔的硫酸铜、550微摩尔的THPTA配体和5毫摩尔的抗坏血酸钠的水性溶液流过具有11-叠氮十二烷基甲硅烷氧基表面改性配体的微流体装置。使反应在室温下继续进行至少1小时。然后通过使至少250微升的去离子水流过装置来冲洗具有式XX1的生物素化PEG改性表面的微流体装置:
引入改性表面的环化反应完成后,层的厚度从1.4nm(官能化表面厚度)增加到约5nm厚。此外,座滴水(sessile drop water)接触角度从约80度(式III的官能化表面)减小到42度(式IV的表面)。
示例3.在微流体装置的第一区域中引入PEG5k的区域选择性表面修饰以及在隔绝坞内的聚-L-赖氨酸。利用1.0至3.3毫摩尔的重均分子量5000Da的二苄基环辛炔基(DBCO)改性的PEG(化合物8,Broadpharm,Cat.#BP-22461)的水性溶液,通过在略低于大气压的情况下吸取溶液通过装置的微流体通道来处理具有式III的表面的先前制备的、干燥的和未灌注的(例如,未用二氧化碳气体冲洗的)微流体装置。结果是通道填充了试剂溶液。然而,由于流体引入的低压和微流体装置内表面的未灌注性质,DBCO改性的PEG5kDa溶液不会进入从微流体通道开口的隔绝坞。在室温下孵育30分钟后,在减小的压力下将80微升的水吸取通过通道,将任何剩余的试剂从微流体装置中洗掉。仍然控制溶液仅流过微流体通道。继续在低压下以1微升/秒利用水附加冲洗约5分钟。利用二氧化碳气体反复冲洗表面改性的微流体通道,同时将装置加热到90℃。
然后如上所述,利用二氧化碳灌注具有PEG5K的第一表面修饰的干燥的微流体装置。然后通过流过1.33微摩尔的溶液(包括炔-聚-L-赖氨酸HBr盐(100聚体单元,Alamanda聚合物)和炔改性的PEG(j=MW~5000Da,化合物6,JenKem科技公司)的1:1化学计量混合物以及硫酸铜(过量)、THPTA配体和抗坏血酸钠)来区域选择性地改性从微流体通道开口的隔绝坞。过量的硫酸铜防止在反应期间抗坏血酸盐对二硫化物的切割(cleavage),反应在40℃下进行约15分钟(也可以在室温下进行约1小时)。孵育期完成后,通过用水进行冲洗来去除过量的试剂和副产物。通过在将微流体装置加热到40℃的同时用二氧化碳气体进行冲洗来干燥微流体装置的内部,从而为微流体装置提供在微流体通道内的仅具有PEG-5K的第一表面修饰以及仅在隔绝坞中的包括聚-L-赖氨酸的第二区域选择性表面修饰的区域选择性引入,聚-L-赖氨酸提供正电荷以增强生物细胞的粘附。值得注意的是调节用于改性隔绝坞的表面的试剂的比率的能力。PEG-5K:聚-L-赖氨酸的比率从0:100到99.9999:0.0001%变化,并且在隔绝坞内观察到HeLa细胞的粘附,而通过通道内仅存在亲水表面,抑制了活动的HeLa细胞的迁移。
预计具有用PEG5kDa的第一表面修饰和聚-L-赖氨酸的第二表面修饰(具有约0.00001%或0.000001%的聚-L-赖氨酸表面修饰的百分比)而改性的内表面的微流体装置允许附着细胞(例如,HeLa细胞)粘附,同时仍允许使用介电泳力输出培养的细胞,而无需激光启动位移。
进一步概括。在隔绝坞内引入第二表面修饰时,可以使用任何类型的表面改性剂,并且不限于聚-L-赖氨酸。
在第二表面修饰仅在通道区域的情况下,进行微流体通道的二次钝化。在如上所述的微流体通道的初始表面改性后,通道中可能仍存在未反应的反应性部分(例如,叠氮化物)。不希望受理论束缚,如果改性剂体积大,则这可能发生。用空间要求较低的表面改性剂进行二次钝化可能能够达到剩余的反应性部分以将第二表面改性添加到通道的改性表面而不改性隔绝坞中的表面。
具有仅引入微流体通道的PEG5kDa表面修饰的微流体装置在表面引入后仅用水冲洗。与上述第一处理类似,用水性溶液中的浓度为1.3微摩尔的DBCO-PEG4-OH(Aldrich目录#761982)进行第二处理。由于微流体装置未被灌注,因此没有第二表面改性剂进入隔绝坞,相应地只有通道被进一步改性。在清洗、干燥和加热后,进行二氧化碳灌注,然后对隔绝坞进行区域选择性改性,如上所述。
实验4.光引发的表面引入。
4.A光引发的切割。如在实验1中一样制备具有式III的改性的内表面的微流体装置。清洁且干燥的叠氮基表面改性的微流体装置(图6A)用二氧化碳气体灌注并与具有疏水表面改性部分(例如,经由光可裂解的含硝基取代苯基的接头(例如,PEG接头)链接到DBCO点击反应性部分的氟化或全氟化烷基部分)的表面改性剂反应。试剂流入微流体通道中并置换通道和隔绝坞内的二氧化碳气体环境,并使其反应超过30分钟。去离子水冲洗通过微流体通道30到40分钟,以将任何剩余的未反应试剂冲洗出微流体装置。如图6B所示,引入疏水改性表面610,其分布在通道618和隔绝坞622、623、624、625、626、627(其可以与本文所述的任何隔绝坞类似)的整个内表面。可通过将激光照明引导在微流体通道和/或隔绝坞的选定部分处以从共价结合的表面改性配体选择性地切割氟化或全氟化烷基部分来手动进行光引发的光裂解,在照射的区域留下疏水性较低的(例如,更亲水的)PEG“疤痕”配体615(如图6D所示),这提供了疏水性较低的表面620。因此,在微流体通道内可以选择性地引入疏水区域,而其他地方没有,该疏水区域可小于与隔绝坞通向微流体通道的开口相邻或靠近隔绝坞通向微流体通道的开口布置的通道的表面积的约50%(或大于该通道的表面积的约50%),如图6C所示。可以通过光引发的光裂解从隔绝坞的隔离区域、从隔绝坞的连接区域的一部分或完全从隔绝坞移除疏水表面。留在原处的疏水性的区域可以辅助保持包封层,并且特别地,可以辅助限定包封层从与隔绝坞的剩余部分内的水性介质的接触处延伸出到隔绝坞在通道处的开口的距离。例如,包封层可以从与隔绝坞内的水性介质的接触点延伸约5微米至约50微米。每个区域中配体的示意性表示在图6D中示出,其中,疏水性配体605是在隔绝坞的开口附近的表面610中和连接区域的在通向通道的开口附近的部分中留在原处的改性表面。作为“疤痕”留下的切割后的配体625形成在远离隔绝坞开口的通道内的疏水性较低的(或更亲水的)表面620以及在远离开口的连接区域内和隔绝坞的隔离区域内的表面620。
B.光引发的连接(ligation)。使用八臂PEG炔(Broadpharm Cat.No.PSB-866)制备具有呈现炔基反应性部分的改性内表面的微流体装置,该八臂PEG炔类似于2017年5月26日提交的题为“Covalently Modified Surfaces,Kits,and Methods of Preparation andUse(共价改性的表面、试剂盒以及制备和使用方法)”的PCT/US2017/034832(其公开内容通过引用整体并入本文)中针对四臂PEG炔所描述的。微流体装置在内表面上具有共价结合的疏水表面,如图6B中示意性示出的,具有表面610。
硫辛酰胺-PEG4-COOH(Iris Biotech GMBH Cat.No.PEG3500)在DMSO中溶解至100mM。苯基-2,4,6-三甲基-苯甲酰基次膦酸锂(LAP)光引发剂在PBS pH 7.4中溶解至5mM。TCEP在PBS中溶解至40mM,并还原硫辛酰胺的二硫化物以提供用于光连接的硫自由基。Tween 20在水中溶解至10%w/v。用于导入微流体装置中的反应混合物提供:硫辛酰胺表面改性剂溶液(最终10mM);LAP溶液(最终1mM);TCEP溶液(最终20mM)和Tween溶液(最终2%)。
通过用PBS中2% Tween 20的溶液进行冲洗来准备微流体装置用于光连接反应。光连接反应溶液通过输出线进行吸取来输入。输入100μL等分试样并使其平衡约10分钟。
将微流体装置冷却至15℃。用来自DAPI立方体的光照明腔室(例如,隔绝坞)约1至10秒。为了去除残留的引发剂产物,在15℃下用2%Tween/PBS溶液冲洗微流体装置,然后在55℃下用2% Tween进行冲洗。最后用0.05% Tween/PBS溶液冲洗芯片。
这提供了如下微流体装置600,其在支撑包封层的通道618中具有呈现炔基部分605的疏水表面610,并且在提供用于培养和扩增生物细胞的相容表面的隔绝坞内具有亲水表面674。表面674的亲水表面配体具有亲水表面接触部分627,例如,PEG4-COOH,并且表面改性配体包括偶联基团CG,由硫自由基和炔烃的偶联产生的烯属硫代部分(疏水表面接触部分605)。
实验5.使用温度控制的区域选择性表面改性。如实验1中一样制备具有式III的改性内表面的微流体装置。用环境空气冲洗清洁且干燥的叠氮基表面改性的微流体装置,且不用100%二氧化碳气体灌注该微流体装置,并将微流体装置保持在18℃。
制备去离子水中1-5% DMSO中的第一(疏水)表面改性剂即二苄基环辛炔基(DBCO)-PEG4-炔烃(Conju-Probe目录号CP-2039)的1.0至3.3毫摩尔的溶液,并将其冷却到与微流体装置相同的低温(18摄氏度)。在常压下用碳饱和试剂溶液。还制备了用二氧化碳饱和的去离子水溶液并将其冷却至18摄氏度。通过在略低于大气压力的情况下吸取溶液通过装置的通道,将二氧化碳饱和的去离子水溶液引入到微流体装置的通道中。该通道填充了去离子水溶液,然而,由于流体引入的低压和微流体装置中表面的未灌注性质,去离子水溶液不会进入从微流体通道开口的隔绝坞。引入去离子水溶液后,微流体装置被加热到36摄氏度。加热后,每个隔绝坞中被困的空气膨胀,水相中的气体溶解度减小,将气体释放到坞中,导致坞中的气体体积从隔绝坞向外增长,形成延伸到微流体通道中的气泡。以0.01ul/min的速率将冷却后的DBCO-PEG4炔烃试剂缓慢吸取通过通道达30分钟的时段,在从隔绝坞延伸的气泡周围流动,并仅与其中气泡未延伸的通道中的表面发生反应,从而形成呈现疏水配体635的疏水表面650,如图6H所示。气泡从隔绝坞向外延伸的程度由微流体装置被保持的温度来控制,同时将冷却后的第一表面改性剂缓慢吸取通过通道。在一些变型中,气泡可延伸超出隔绝坞的开口以占据通道面积的约60%、约50%、约40%、约30%、约20%、约10%或约5%。因此,隔绝坞内和气泡延伸到通道中的区域内的表面是未改性的表面602(例如,叠氮化物部分仍然存在)。
在30分钟的反应期完成后,将80微升冷却后的二氧化碳饱和的去离子水缓慢(例如,以约0.01ul/s)吸取通过微流体通道以从通道和装置中冲洗掉任何剩余的DBCO-PEG4-炔烃试剂。继续以1微升/秒利用水附加清洗约5分钟。通过在将微流体装置加热到40℃的同时用二氧化碳气体进行冲洗来干燥表面改性的微流体通道,从而灌注微流体装置的内部以在微流体通道的剩余部分和隔绝坞(例如,其中存在图6H中的表面602)内利用第二表面改性剂进行区域选择性表面改性。然后将微流体装置保持在约36摄氏度,并且通过使第二表面改性剂,即在36摄氏度下在正常大气压空气下平衡的DBCO-PEG4-OH(Aldrich目录#761982)的1.33微摩尔的溶液流过微流体装置来区域选择性地进行第二表面改性。亲水性的第二改性剂现在能够进入隔绝坞并与仍然存在于通道中和隔绝坞中的剩余的亲核部分反应(气泡阻止了先前的反应),从而在改性表面上形成由亲水配体625组成的表面670,如图6H所示。因此,疏水表面650被引入到小于通道的表面积的50%,亲水表面670被引入在隔绝坞内和隔绝坞的开口附近,延伸到通道中。
在另一个变型中,可以如所述引入两种配体635和645的组合,其中表面接触部分635提供疏水表面接触部分并且表面接触部分645可以是不同的疏水表面接触部分、亲水表面接触部分或提供不同表面化学的表面接触部分,两种配体635和645可以以任何比率使用,从而针对特定应用的需要而微调疏水表面660。
实验6.使用温度控制的区域选择性表面改性。如实验1中一样制备具有式III的改性内表面的微流体装置。用环境空气冲洗清洁且干燥的叠氮基表面改性的微流体装置,且不用100%二氧化碳气体灌注该微流体装置,并将微流体装置保持在30℃。
制备去离子水中的第一表面改性剂(其是亲水的)即DBCO封端的甲氧基PEG Mw=5K的1.0至3.3毫摩尔的溶液,并将其平衡至与微流体装置相同的温度(30摄氏度)。试剂溶液在常压下用空气饱和。通过在30摄氏度下在略低于大气压的情况下吸取溶液通过装置的通道,将第一表面改性剂溶液引入到微流体装置的通道中。由于流体引入的低压和微流体装置中表面的未灌注性质,第一表面改性剂溶液没有进入微流体通道718的隔绝坞开口。一旦装置中的通道充满,则微流体装置被加热到36摄氏度,使气泡从坞仅稍微向外膨胀进入通道中,从而防止第一表面改性剂进入隔绝坞,如图7A所示,并且气泡触及的区域以外的通道用表面770的亲水甲氧基PEG表面改性剂进行改性,表面770可以类似于图6F至图6L的表面670。隔绝坞内的表面702保持未反应并且气泡伪影706在图7A中示出。空气被冲洗通过微流体通道以排出第一表面改性剂,然后以1微升/秒用1000微升的去离子水冲洗该装置。然后用5%的二氧化碳大量冲洗该装置。第二表面改性剂即疏水试剂DBCO-PEG4-炔流入(60微升,以1微升/秒)。然后将温度从36度调整到18摄氏度。来自每个隔绝坞的气泡收缩回到隔绝坞中,并且允许疏水试剂进入到隔绝坞的连接区域的一部分中。允许试剂反应另一个30分钟,从而形成与坞开口相邻的(图7A中气泡延伸的地方)并进入连接区域的由于气泡收缩而暴露的部分中的疏水表面750,如图7B所示。疏水表面750可以类似于图6F至图6L的疏水表面650或类似的混合疏水表面660。然后从微流体通道和微流体装置的隔绝坞的连接区域冲洗掉试剂。
在一些变型中,隔离区域和隔绝坞的连接区域的远离隔绝坞通向通道的开口的部分可以仍然保留未改性的叠氮化物表面,其可以在适合时被改性用于特定实验。该随后的表面改性可以在通道和连接区域的近端部分的改性完成之后立即进行,或者可以在以后进行。
示例7:生成和选择性移除用于单个细胞分析的包封层。图8A至图8B示出了在对应的各个腔室中的各个细胞的包封,其中包封层通过与水不混溶的流体介质(例如,油)填充微流体通道形成,在明场图像8B中在每个单独腔室(例如,隔绝坞)的开口处的明显的边界812处可见。在该图示中,单个分泌细胞已被置于每个腔室(例如,隔绝坞)中,并进行培养。培养的细胞已经随着时间分裂成分泌细胞集群。处于该测定中的细胞分泌荧光小分子,该荧光小分子可以被成像以确定有关细胞的信息。信息可以包括但不限于每个腔室中包封的单个细胞或细胞群的特征与在每个腔室中测得的荧光小分子的量或发射(例如,荧光)的量之间的相关性。
图8A示出了一组腔室(例如,隔绝坞)的荧光图像,图8B是同一组腔室的明场图像。明场图像描绘了腔室中细胞的密度以及腔室的形状和腔室的连接区域处的包封层。图8A示出了在这种情况下,根据明场图像,在明场成像下具有最高细胞表观密度的腔室也呈现出比具有较低细胞表观密度的腔室更高的荧光。可以对这些图像进行量化,以确定细胞体积、细胞密度、发射(例如,荧光)量、分泌的小分子的浓度以及可能与细胞分泌、细胞健康、和/或将一个细胞亚群与另一个细胞亚群区分开来相关的其他指标。量化可以在单个固定的时间点或在固定时间段内的离散时间点进行,并且可以对量化后的信息进行比率、关系和/或其他数学操作,以对包封在整个微流体芯片的离散腔室中的相似细胞的群或包封在整个微流体芯片的离散腔室中的功能不同的细胞的群做出关于每个腔室中的细胞的推论。油密封下信号积累的持续时间可以从24小时到仅几分钟不等。在这种情况下,油密封在超过约24小时的培养期期间允许扩增到更大的菌落大小。
包封层防止隔绝坞802内分泌的小分子扩散出隔绝坞。因此,所示的在每个坞中观察到的荧光仅是由于每个坞中驻留的细胞的分泌物。坞802内分泌的荧光分子对除802之外的坞中的荧光没有贡献,对应地,坞802中观察到的荧光量不会因分泌的小分子扩散出坞802而减少。
图9A至图9C示出了用于生成和可选地移除与水不混溶的流体包封层的方法。将不同细胞(例如,来自同一集群的不同细胞、基因型/表型可区分的细胞、分泌不同类型的分子的细胞等)加载到OptoSelect
在图9A至图9C的每一个中,每个隔绝坞都用与水不混溶的流体介质层包封,并在移除选定的腔室的包封层之前培养和/或监测一段时间。通过将激光脉冲施加到腔室内靠近包封层的水性介质,移除包封层。激光照明产生气泡,该气泡将包封层的与水不混溶的流体推出到微流体通道中并远离通向腔室的开口。选择激光照明以生成朝向薄包封层的气泡,将包封层的与水不混溶的流体推出到微流体通道中并远离通向腔室的开口。可以选择激光的功率(离开光学系统的有效功率可以约为10-100mW)和波长(其可以为约450nm至约1000nm,可以为约800nm)来在介质中使气泡成核,气泡产生足以破坏包封层的机械扰动和剪切力。虽然激光照明可能需要选择程序化的斜坡(ramp)/输送超过约50ms的时段以输送阈值量的能量来使气泡成核,但能量输送的实际时段要短得多,例如在几微秒的数量级上,例如,约3ms、约5ms、约6ms等。没有必要使用更长的照明时间,因为一旦已经超过引发/成核能量输入,成核的气泡打破包封层的能力不会显著地改变。一旦气泡成核,则气泡本身就会进一步减慢气泡尺寸的增加速率。
在图9A至图9C的每个微流体装置中,用PEG4-炔部分改性内表面以支撑包封层,从而具有通道和/或隔绝坞的区域选择性的疏水和亲水区域,如下文针对每个图所提到的。
在图9A中,微流体装置包括遍及整个通道的疏水表面和在腔室(例如,隔绝坞)内的使用实验5和/或6中描述的方法的变型引入的非疏水表面,其中整个通道表面被改性,使用温度控制以将气泡刚好保持在隔绝坞的开口处。在通道中引入疏水表面后,腔室(例如,隔绝坞)的内表面被改性为更亲水的表面,更亲水的表面允许仅使用DEP力布置和输出生物细胞。
一旦细胞被引入并置于腔室内,就使与水不混溶的流体914流入通道中,如图9A所示。在图9A中,包含细胞的水性介质被包封在腔室中,而与水不混溶的油916填充微流体通道,具有接触边界912。与水不混溶的油被氧化,或用气体或气体混合物饱和,以为培养关注的细胞提供适当的边界条件。例如,5% CO
在图9B中,如针对图9A的微流体装置所描述的,在通道918内具有疏水表面和在腔室(例如,隔绝坞)内具有亲水表面的微流体装置填充有第一水性介质,该第一水性介质分布到隔绝坞和整个通道中。然后将与水不混溶的油引入通道中,置换通道中的第一水性介质,但不干扰隔绝坞中的第一水性介质916。将第二水性溶液922引入(例如,吸取)到微流体通道中,将与水不混溶的流体介质拉出通道并留下薄包封层914,覆盖保留在隔绝坞内的水性介质,并将可具有与第一水性介质914相同或不同的组成的第二水性介质922置于通道的剩余部分中。第二水性溶液可以以有助于形成包封层的速率引入,例如,包括范围从0.01ul/sec到2.0ul/sec的速率。在所公开的方法中生成的包封层具有约1微米至约100微米的“厚度”,即,包封层从与隔绝坞中的水性介质916的接触边界912向外朝向通道延伸至与通道中的第二水性介质的接触边界922。在某些情况下,“厚度”可能小于约1微米,同时仍保持包封。“厚度”取决于许多变量,包括但不限于与水不混溶的流体介质从微流体通道流动(例如,吸取)的速率、与水不混溶的流体介质的组成、疏水和/或亲水涂层的组成和分布、以及连接区域的长度L
图10A至图10E是在连续时间点拍摄的同一组隔绝坞的照片,并示出了用于大量移除包封层的示例性方法。在图10A至图10E中所示的微流体装置中,疏水表面(例如,具有PEG4-炔配体的表面)被引入遍及整个通道1018,而亲水表面(例如,具有PEG4-OH配体的表面)被引入在隔绝坞内。大量移除包封层的方法可以包括使包括表面活性剂的介质流过通道。表面活性剂的类型和灌注速率可以被配置为以特定速率移除包封层。在图10A中,通道1018填充有与水不混溶的流体,例如,油、HFE-7500TMNovecTM工程流体(2-(三氟甲基)-3-乙氧基十二氟己烷,3M)。油与包封在每个隔绝坞中的水性介质之间的接触边界1012在图10A中可见,其中每个隔绝坞完全被包封。包括具有0.1% Capstone FS30氟表面活性剂(SynQuest Laboratories,Cat.No.2108-3-38)的去离子水的表面活性剂溶液用于大量移除包封层。表面活性剂溶液流过通道1018,在图10B中可见的时间点处开始,在10分钟的过程中以0.2至5ul/s之间的任何流速流过。图10B与图10C之间的接触角度的变化在图中很容易观察到,表明在接触边界1012处从疏水介质过渡到亲水介质,这允许继续移除,因为在图10D处,包封层材料进展到几乎被移除,并且在图10E处,完全被移除。
图11A至图11D示出了用于选择性消融包封层的示例性方法。可以使用本文公开的任何单个方法或其组合来形成包封层。包封层的移除可以包括应用靶向激光移除。在一种示例性方法中,可以靠近包封层(例如在腔室的隔绝坞的就在包封层内部的水性介质中)瞄准激光,其中,激光被配置为使得激光的功率和频率可以在介质中使气泡成核,气泡产生足以破坏包封层的机械扰动和剪切力。图11A示出了包括包封的坞的阵列的明场图像,这些包封的坞在每个坞的开口处具有包封层1112,其中通道1118包括荧光染料,其在与图11A相同的时间点拍摄的同一视场的对应的荧光图像图11B中是可见的。然后仅对单个选定的隔绝坞进行激光解包封。图11C是在选择性移除一个包封层之后同一视场的明场图像。图11D是与图11C的明场图像在同一时间点拍摄的荧光图像。图11D示出了微流体装置的微流体通道中的荧光染料仅扩散到包封层被去除的腔室1126(例如,隔绝坞)中。随后可以实现微物体的进一步输入或输出和/或试剂的输入。
示例8.使用包封方法培养和处理/测定细胞。图12A至图12C示出了用于培养和选择性裂解细胞的示例性方法。使用本文公开的方法的任何组合将细胞包封在具有包封层的腔室或隔绝坞中。在该方法中,悬浮在水性介质(例如,培养介质)中的细胞流入微流体芯片的通道中,其中,通道1218的表面具有疏水表面并且腔室或隔绝坞(例如,坞1228)的表面具有亲水表面,如本文所述的那样产生。水性介质(例如,细胞悬浮在其中)从通道扩散到腔室或隔绝坞中,并且例如使用光学致动的DEP力将通道中的细胞从通道加载到单独的腔室或隔绝坞中。
在使用包封层将隔绝坞彼此隔离的实验的一些变型中,还可在加载细胞之前、期间或之后将水性介质中的试剂引入到通道中,从而填充通道,并通过扩散与隔绝坞内的水性介质交换来并行输送至所有隔绝坞。一旦水不混溶相被引入主通道,承载试剂的水性介质就被与水不混溶的介质“掐断”,防止进一步交换进/出隔绝坞。这可以将试剂快速输送到微流体装置中的所有隔绝坞。
在图12A至图12C所示的具体示例中,一旦细胞被围封,就使与水不混溶的流体(例如,油)流入通道中。在用于裂解细胞的方法中,可将裂解缓冲液灌注到通道中,将与水不混溶的流体从通道中排出并留下图12A所示的状况,其中在隔绝坞/腔室通向通道1218的开口处形成薄的包封层。
在图12A中,包括细胞和培养介质的水性溶液被保留在隔绝坞内,并且每个隔绝坞都被与水不混溶的流体介质的薄膜涂层包封。在薄膜或包封层1212的外部,在通道1218中,是细胞裂解缓冲液。图12B是来自与图12A和图12C同一视场的明场图像,在选择性地移除1202单个坞的包封层(例如,通过激光诱导形成气泡)之后拍摄的。在图12B中,裂解缓冲液已经选择性地从通道灌注到隔绝坞1228中。图12B的明场图像的解包封的隔绝坞中的细胞1203的轮廓看起来比相邻的仍然包封的坞中的细胞1209
(没有经历任何裂解缓冲液)更弥散,表明细胞膜正在分解。在图12C中确认了裂解,图12C是在碘化丙啶染色剂已灌注到通道中并扩散到开放坞中之后与图12B同一视场的荧光图像。产生发射(例如,荧光),确认细胞已成功裂解。在一些非限制性实施例中,捕获珠粒(例如,核酸捕获珠粒、蛋白质纯化珠粒)也可以加载到通道中。在从仅包括捕获珠粒(例如,核酸捕获珠粒)的介质加载细胞之前,或在将细胞与例如裂解缓冲液一起加载之后(例如,使用光学致动的DEP力),可以将捕获珠粒(例如,核酸捕获珠粒)与来自包括细胞和捕获珠粒(例如,核酸捕获珠粒)的介质的细胞一起加载,从而允许释放的核酸被捕获到捕获珠粒。
前述示例可以改变,例如,通过将一个或多个测定捕获珠粒(除核酸捕获珠粒外)与细胞一起引入腔室(或隔绝坞)中并孵育腔室中的测定捕获珠粒和细胞达第一时间段。测定捕获珠粒可以特异性地或非特异性地结合到生物材料,例如,小分子、碳水化合物、肽、蛋白质等。在第一孵育期期间,可以可选地监测测定捕获珠粒与生物材料的结合(例如,使用标记的报告分子,如本文别处所述)。在第一孵育期之后,可以选择性地或非选择性地解包封细胞,并且可以释放或输出一个或多个测定捕获珠粒以进行芯片外分析(例如,质谱、ELISA、酶促测定等)。在输出测定捕获珠粒之后,可以将一个或多个新的测定捕获珠粒加载到腔室中并且可以重复该过程(即,添加新的测定捕获珠粒、包封、孵育、选择性或非选择性解包封、释放和输出捕获珠粒以进行后续分析)一次或多次(例如,1、2、3、4、5或更多次)。或者,如果将多个测定捕获珠粒与细胞一起引入到腔室中,则可以重复该过程而不必在每次重复时引入新的测定捕获珠粒。最后,一旦测定捕获珠粒已被输出并且没有规划另外一轮的测定捕获珠粒孵育和输出,则可选地,可以裂解细胞(如上所述)并且从细胞释放的核酸可以被捕获和处理以进行测序。通过将过程的各个步骤期间产生的数据与测定捕获珠粒和核酸捕获珠粒所源自的坞相关联,测定数据可以与单个细胞群(例如,克隆细胞群)的基因组数据链接。
示例9.检测酵母的不同水平的小分子分泌。将各自分泌不同水平的小分子的不同酵母菌株加载到OptoSelect芯片(伯克利之光公司,埃默里维尔,加利福尼亚州)中,进行包封并测定小分子的分泌。OptoSelect芯片包括通道和多个隔绝坞,并且使用光学致动的DEP力将各个酵母细胞加载到单独的坞中。通道的表面具有疏水涂层,而隔绝坞的表面具有亲水涂层。一旦细胞被围封,就使油流入通道中,从而将细胞包封在其相应的隔绝坞中。使用明场显微镜和从由酵母菌株分泌的小分子发射的发射光(例如,荧光)在24小时的时段内监测细胞。
图13A至图13B示出了测定开始后30分钟时的细胞。来自同一类型的酵母的不同菌株的细胞(在其小分子的分泌水平方面不同)被选择性地放置在单独的隔绝坞中,以便让包含细胞的坞与空的坞交替。这种交替加载不是必需的,但在这个特定的实验运行(run)中以这种方式进行,仅用于成像目的。在图像的底部示出了各个隔绝坞编号,具有细胞的坞编号为276、274、272和270。如图所示,标识和勾勒每个坞中的细胞。
图13A是坞内水性介质中细胞的明场图像,其中坞被油包封以将每个坞中的溶液与其他坞中的溶液分离开。在图13A中,通道1318充满油,但是过程的替代实施例或步骤可以包括从通道的大部分移除油并且使一种或多种空气或水性介质(其可以包含试剂、溶解气体等)流动,同时留下限定厚度(例如,5-50微米)的包封层覆盖隔绝坞中的水性介质。在该方法的其他变型中,在实验期间没有从通道移除油,但是油被灌注并且可以包含油溶性试剂、营养物和可选地,如本文别处提到的,用适当的气体饱和。图13B是同一坞的荧光图像,其中,荧光读数指示由每个隔绝坞内的细胞分泌的小分子的浓度。油充当防止小分子扩散到隔绝坞之外的屏障。如图13B所示,隔绝坞276中的单个细胞看起来具有最大的荧光表达,表明小分子的最大表达。请注意,隔绝坞的边界(壁)可以为图像贡献一些自发荧光。然而,在图像处理过程中可以减去这种自发荧光,以确保准确量化每个隔绝坞内细胞分泌的小分子的浓度。
图13C和图13D示出了在测定开始16小时后的同一组坞。荧光信号可以随时间积分并且可以提供度量,例如,产量(例如,产物产量、细胞产量、基于产生的荧光信号与其中于荧光关联的成分之间的相关性而与可量化成分对应的产量)。图13C是示出酵母细胞已经分裂的明场图像,其中,增长的细胞堆的轮廓提供了生长的视觉指示。图13D是对应的荧光图像。图13D中标记了四个不同的酵母菌株。隔绝坞276(4)和272(2)中的细胞是高表达酵母菌株。来自这两个坞的发射(例如,荧光)强度很高,与菌株的已知行为一致。隔绝坞274(3)中的细胞来自低表达酵母菌株。正如预期的那样,隔绝坞274表现出低荧光强度。位于隔绝坞270中的阴性对照菌株(1)也示出低荧光强度。
图14A和图14B示出了每个酵母菌株(阴性对照菌株(1);菌株(2),高表达;菌株(3),低表达;和菌株(4),高表达)的光密度、荧光强度、生长速率和生产速率的时间进程图。光密度是在纳米坞(例如,隔绝坞)的明场图像中强度的降低,这是由于与空坞相比存在细胞。它与在使用的边界/参数内在给定时间的纳米坞内的总生物量成正比。荧光强度是在绿色荧光通道中记录的坞图像的平均强度(例如,根据需要调整以减去坞壁自发荧光等)。生长率是由当前光密度归一化的光密度随时间的变化。它描述了纳米坞内菌落扩增的速率(与其当前的生物量无关)。生产速率是荧光强度的由其当前的光密度归一化的随时间的变化。它描述了给定时间单位生物量的比生产率。
如图14A所示,3小时窗口内的光密度和荧光强度显示低表达菌株(3)和阴性对照菌株(1)的细胞密度随时间增大,表明资源被转移到生长和分裂而不是生产小分子。高表达菌株(2)和(4)以慢得多的速率分裂,如图14A的顶部方格中的低光密度变化所示,20小时的时段内对应的生长速率和生产速率数据分别在图14B的顶部和底部方格中示出。对于高表达酵母菌株(2)和(4),在20小时时段的大部分时间里,酵母菌株分泌的小分子的生产率测量结果较高。相反,低表达菌株(3)示出随时间缓慢持续分泌小分子。高分泌菌株的生产力下降较大可归因于坞内资源的消耗,而低分泌菌株在实验过程中不会耗尽生产所需的营养。阴性对照菌株(1)示出生产率为0,表明该酵母菌株不表达任何荧光小分子。高分泌菌株的生长速率的调节表明各种代谢过程内的转变(例如,有氧代谢到无氧代谢)。
图15示出了针对三个不同OptoSelect芯片中每一个上的四个菌株的每一个在四个不同时间点(7.5、12.5、17.5和22.5小时)的包括平均表达水平的累积数据,其中第一标准偏差、第二标准偏差和第三标准偏差由深灰色到浅灰色阴影表示。图15示出了如何通过菌株的比生产力(强度/生物量)选择用于对菌株进行排序的最佳时间点。具体而言,变异系数(CV)在17.5小时时最小。(浅灰色:+-3StDev,中灰色:+-2StDev,深灰色+-1StDev)。数据揭示,使用该测定可以很容易地区分不同的菌株。
当特征或元素在本文中被称为位于另一特征或元素“之上”时,其可以直接位于另一特征或元素上或者可以存在中间特征和/或元素。反之,当特征或元素被称为“直接”位于另一特征或元素“之上”时,不存在中间特征或元素。还将理解,当特征或元素被称为“连接”、“附着”或“耦接”至另一特征或元素时,其可直接地连接、附着或耦接到另一特征或元素或者可以存在中间特征或元素。反之,当特征或元素被称为“直接连接”、“直接附着”或“直接耦接”至另一特征或元素时,不存在中间特征或元素。尽管关于一个实施例描述或示出,但如此描述或示出的特征和元素可以适用于其它实施例。本领域技术人员还应该理解,提及“相邻”另一特征设置的结构或特征可以具有与该相邻特征重叠或位于相邻特征下方的部分。
本文所使用的术语仅出于描述特定实施例的目的,而并不旨在限制本发明。例如,如本文所使用的,除非上下文中另有明确指示,否则单数形式“一(a)”、“一个(an)”以及“该(the)”也旨在包括复数形式。还应该理解,术语“包括(comprises)”和/或“包含(comprising)”在用于本说明书中时指定所陈述的特征、步骤、操作、元素和/或部件的存在,但并不排除一个或多个其它特征、步骤、操作、元素、部件和/或其群组的存在或添加。如本文所使用的,术语“和/或”包括相关联的所列项目中的一个或多个的任一以及所有组合,并且可以缩写为“/”。
空间相关术语,诸如“下”、“下方”、“下部”、“上”、“上部”等可以在本文中为了便于描述而使用,以描述附图中所示的一个元素或特征相对于另一元素或特征的关系。应该理解,空间相关术语旨在包含除了附图中所描绘的定向之外,在使用和操作中的装置的不同定向。例如,如果附图中的装置被倒转,则被描述为在另外的元素或特征“下”或“之下”的元素将被定向为在另外的元素或特征“上”。因此,示例性的术语“下”可包含上和下两个定向。该装置还能以其它方式定向(旋转90度或者以其它定向),并且本文所使用的与空间相关的描述语被相应地解释。类似地,除非另有具体说明,否则术语“向上”、“向下”、“竖直”、“水平”等仅用于说明目的。
尽管术语“第一”和“第二”在本文中可以用于描述各种特征/元素(包括步骤),但这些特征/元素不应受限于这些术语,除非上下文另有说明。这些术语可用于区分一个特征/元素与另一特征/元素。因此,下面所讨论的第一特征/元素可被称为第二特征/元素,并且类似地,下面讨论的第二特征/元素可在不脱离本发明的教导的情况下被称为第一特征/元素。
如在本文的说明书及权利要求中所使用的,包括如在示例中所使用且除非另外明确地指定,所有数值可当作有前置词“约”或“近似地”,即使该术语未明确出现。短语“约”或“近似地”可在描述量和/或位置时使用,以指示所描述的值和/或位置在值和/或位置的合理预期范围内。例如,数值可以具有作为所陈述的值(或值范围)的+/-0.1%、所陈述的值(或值范围)的+/-1%、所陈述的值(或值范围)的+/-2%、所陈述的值(或值范围)的+/-5%、所陈述的值(或值范围)的+/-10%等的某个值。本文所给出的任何数值还应被理解为包括约或近似为该值,除非上下文另外指示。例如,如果公开了值“10”,则也公开了“约10”。本文所述的任何数值范围旨在包括其中包含的所有子范围。还应理解,当公开了值时,也公开了“小于或等于”该值、“大于或等于”该值以及值之间的可能范围,如本领域技术人员适当理解的。例如,如果公开了值“X”,则还公开了“小于或等于X”以及“大于或等于X”(例如,其中X是数值)。还应理解,在整个申请中,数据以多种不同格式提供,并且该数据表示终点和起点,以及数据点的任何组合的范围。例如,如果公开了特定数据点“10”和特定数据点“15”,则应该理解,认为公开了大于、大于或等于、小于或等于、以及等于10和15,以及在10至15之间。还应该理解,两个特定单元之间的每个单元也被公开。例如,如果公开了10和15,则也公开了11、12、13和14。
尽管上面描述了各种说明性实施例,但在不脱离如权利要求所述的本发明的范围的情况下,可对各种实施例作出任何多种改变。例如,各种所述方法步骤执行的顺序通常可在替代实施例中改变,并且在其它替代实施例中可完全略过一个或多个方法步骤。还应当注意的是,虽然本文使用了术语步骤,但是该术语可以仅用于引起对描述的方法的不同部分的关注,因此不旨在描绘该方法的任何部分的起始点或停止点,或者以任何其他方式进行限制。各种装置及系统实施例的可选特征可以包括在一些实施例中而不包括在其它实施例中。因此,主要出于示例性目的提供前述描述,并且不应解释为限制如其在权利要求中所阐述的本发明的范围。
包括在本文中的示例和说明以说明而非限制的方式示出可在其中实践主题的具体实施例。如所述,可以利用和从中推导出其它实施例,使得在不脱离本公开的范围的情况下可以作出结构性及逻辑性的取代及变化。仅为方便起见,本发明的主题的这样的实施例可以在本文中单独地或共同地由术语“发明”所指代,并且如果实际上公开多于一个的发明或发明概念,则不旨在自愿地将本申请的范围限制为任何单一发明或发明概念。因此,尽管本文已经说明和描述了具体实施例,但被推断为实现相同目的的任何布置可以取代所示的具体实施例。本公开旨在涵盖各种实施例的任何及所有调整或变型。对于本领域技术人员而言,在审阅上述描述之后,上述实施例的组合及本文中未具体描述的其它实施例将是显而易见的。
本公开的一些实施例的列举
1.一种用于将细胞包封在微流体装置中的过程,所述微流体装置具有围栏,所述围栏包括通道和所述多个腔室,所述多个腔室中的每个腔室具有将腔室流体连接到所述通道的开口(例如,单个开口),其中,形成通道的表面的靠近通向所述多个腔室中的每个腔室的开口的至少一部分和/或形成所述多个腔室中的每个腔室的表面的靠近所述通道的至少一部分包括疏水涂层,所述过程包括:用第一水性介质填充所述微流体装置的围栏中的通道和所述多个腔室;将第一细胞置于所述多个腔室中的第一腔室中;将第二细胞置于所述多个腔室中的第二腔室中;以及使与水不混溶的流体介质流入所述通道中,基本上置换通道中的所有第一水性介质,而基本上不置换所述多个腔室的腔室中的第一水性介质,从而可逆地将所述第一细胞和所述第二细胞包封在它们相应的腔室中。
2.根据实施例1所述的过程,其中,靠近并围绕通向所述多个腔室中的每个腔室的开口的所有通道表面可以包括所述疏水涂层。
3.根据实施例1或2所述的过程,其中,在通向所述多个腔室中的每个腔室的开口的10微米内的所有通道表面可以包括所述疏水涂层。
4.根据实施例1至3中任一项所述的过程,其中,疏水涂层可具有约45度至约100度的接触角度。
5.根据实施例1至4中任一项所述的过程,其中,所述疏水涂层可以共价结合到形成靠近通向所述多个腔室中的每个腔室的开口的通道的表面的至少一部分。
6.根据实施例1至5中任一项所述的过程,其中,所述与水不混溶的流体介质可包括烷烃、氟代烷烃、油、疏水聚合物或其任意组合。
7.根据实施例1至6中任一项所述的过程,还包括:将所述与水不混溶的流体介质吸出所述通道。
8.根据实施例7所述的过程,其中,将所述与水不混溶的流体介质吸出所述通道的速率可以处于0.01μl/sec和1.0μl/sec或在0.01μl/sec至1.0μl/sec之间。
9.根据实施例7或8所述的过程,其中,吸取所述与水不混溶的流体介质还可以包括:随后将第二水性介质吸入到所述通道中。
10.根据实施例9所述的过程,其中,所述第二水性介质可包括表面活性剂。
11.根据实施例7至10中任一项所述的过程,其中,形成所述多个腔室中的每个腔室的表面的至少一部分可以包括所述疏水涂层,并且其中,腔室表面的具有所述疏水涂层的上述至少一部分可以位于通向所述通道的开口附近,其中,所述过程还可以包括:在所述多个腔室中的每个腔室中生成与水不混溶的流体介质的包封层,其中,所述多个腔室中的每个腔室的包封层紧邻所述通道定位并且与腔室中的所述第一水性介质共享界面,以将腔室中的所述第一水性介质与所述通道中存在的介质(例如,所述第二水性介质、空气、CO
12.根据实施例11所述的过程,其中,靠近并围绕所述多个腔室中的每个腔室的开口的所有腔室表面可包括所述疏水涂层。
13.根据实施例11或12所述的过程,其中,在所述多个腔室中的每个腔室的开口的10微米内的所有腔室表面可以包括所述疏水涂层。
14.根据实施例11至13中任一项所述的过程,其中,所述通道表面的疏水涂层可以与所述腔室表面的疏水涂层相同。
15.根据实施例11至14中任一项所述的过程,其中,所述多个腔室中的每个腔室的包封层可具有约5微米至约50微米的平均厚度。
16.根据实施例11至15中任一项所述的过程,其中,所述过程还可以包括:选择其中布置有细胞的所述第一腔室和所述第二腔室中的一个(或多个);以及移除由所述与水不混溶的流体介质在通向选定的腔室的通道的开口处形成的包封层,从而产生解包封的腔室
17.根据实施例16所述的过程,其中,选择性地移除所述包封层可以包括:在所述腔室内产生气泡(例如,靠近所述包封层产生气泡)。
18.根据实施例17所述的过程,其中,产生所述气泡可以包括:将激光引导到所述腔室的基部的内表面上靠近所述第一水性介质与所述与水不混溶的流体介质之间的界面的位置。
19.根据实施例16至18中任一项所述的过程,其中,该过程还可包括:使第三水性介质流入所述通道中。
20.根据实施例19所述的过程,其中,所述第三水性介质可以包括试剂,例如,测定试剂或裂解试剂(例如,所述第三水性介质可以是裂解缓冲液),或输出缓冲液。
21.根据实施例1至20中任一项所述的过程,其中,该过程还可包括:将捕获珠粒(例如,结合生物材料的珠粒,诸如非特异性捕获珠粒、抗原特异性捕获珠粒、酶捕获珠粒或核酸捕获珠粒等)置于所述第一腔室和所述第二腔室中的一个或两个中。
22.根据实施例21所述的过程,其中,该过程还可以包括:从所述解包封的腔室中释放所述捕获珠粒(例如,以及进一步分析结合到所述捕获珠粒的材料);以及可选地,从所述微流体装置输出所述捕获珠粒(例如,以及进一步分析结合到所述捕获珠粒的材料)。
23.根据实施例1至22中任一项所述的过程,其中,将所述第一细胞和所述第二细胞置于所述第一腔室和所述第二腔室中可以包括:使含有细胞的水性介质流入所述微流体装置的通道中,所述含有细胞的水性介质包括多个细胞;以及从所述微流体装置的通道中的含有细胞的水性介质中的所述多个细胞中选择所述第一细胞和所述第二细胞,以将其分别置于所述第一腔室和所述第二腔室中的每一个中。
24.根据实施例23所述的过程,其中,可以使用DEP力(例如,光致动DEP力)分别将选定的第一细胞和第二细胞从通道单独地移动到所述第一腔室和第所述二腔室。
25.根据实施例1至24中任一项所述的过程,其中,所述多个腔室中的每个腔室可以是隔绝坞,所述隔绝坞具有通向所述通道的单个开口并且可以包括隔离区域(例如,具有单个开口)和将所述隔离区域流体连接到所述通道的连接区域。
26.根据实施例25所述的过程,其中,每个隔绝坞的连接区域可以包括通向所述通道的近端开口和通向所述隔离区域的远端开口,连接区域的所述近端开口具有范围从约20微米至约100微米的宽度W
27.根据实施例26所述的过程,其中,每个隔绝坞的所述近端开口处的宽度W
28.根据实施例26或27所述的过程,其中,所述连接区域的长度L
29.根据实施例26或27所述的过程,其中,所述连接区域的长度L
30.根据实施例26至29中任一项所述的过程,其中,所述连接区域的长度L
31.根据实施例25至30中任一项所述的过程,其中,所述通道(例如,具有基本均匀的宽度的通道)的宽度W
32.根据实施例1至30中任一项所述的过程,其中,所述通道(例如,具有基本均匀的宽度的通道)在所述多个腔室中的每个腔室的开口处(例如,在通向隔绝坞的连接区域的近端开口处)的宽度W
33.根据实施例1至30中任一项所述的过程,其中,所述通道(例如,具有基本均匀的宽度的通道)在所述多个腔室中的每个腔室的开口(例如,通向隔绝坞的连接区域的近端开口)处的宽度W
34.根据实施例1至33中任一项所述的过程,其中,所述通道在所述多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的高度可以在约20微米至约100微米之间(例如,约30微米至约50微米、约50微米至约70微米、约70微米至约90微米、约35微米至约45微米、约45微米至约55微米、约55微米至约65微米、约65微米至约75微米、或约75微米至约85微米)。
35.根据实施例1至34中任一项所述的过程,其中,所述多个腔室中的每个腔室(或每个隔绝坞)的体积可以在从约2x 10
36.根据实施例1至35中任一项所述的过程,其中,形成所述通道的表面的总表面积的小于或等于50%可包括所述疏水涂层。
37.根据实施例1至35中任一项所述的过程,其中,形成所述通道的表面的总表面积的大于或等于50%可包括所述疏水涂层。
38.根据实施例1至37中任一项所述的过程,其中,所述多个腔室中的每个腔室可包括形成所述腔室的多个表面,其中,多个腔室表面中的至少一个腔室表面可包括亲水涂层。
39.根据实施例38所述的过程,其中,所述多个腔室可以包括多个隔绝坞,每个隔绝坞具有通向所述通道的单个开口并且可以包括隔离区域(例如,具有单个开口)和将所述隔离区域流体连接到所述通道的连接区域,并且其中,形成每个隔绝坞的隔离区域的至少一个表面(例如,所有表面)可以包括所述亲水涂层。
40.根据实施例39所述的过程,其中,形成每个隔绝坞的连接区域的至少一个表面(例如,所有表面)可以包括所述亲水涂层。
41.根据实施例40所述的过程,其中,形成所述连接区域的至少一个表面(例如,所有表面)中的每一个表面可以包括靠近所述隔离区域的具有所述亲水涂层的部分和靠近所述通道的具有所述疏水涂层的部分,并且可选地,当形成所述连接区域的所有表面可以包括靠近所述通道的具有所述疏水涂层的部分时,提供包围所述连接区域的紧邻所述通道的部分的疏水涂层。
42.根据实施例1至41中任一项所述的过程,其中,所述疏水涂层可以包括第一共价结合的表面修饰,其可以包括:第一链接基团和第一部分,其中,所述第一部分是非极性的(例如,油酸部分、炔基部分、炔基封端的PEG部分或氟化部分)。
43.根据实施例42所述的过程,其中,所述亲水涂层可以包括多个第二共价结合的表面修饰,其每一个包括第二链接基团和第二部分,其中,所述第二部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
44.根据实施例42或43所述的过程,其中,所述疏水涂层可以通过以下方式形成:使形成所述通道的表面的所述至少一部分与第一改性剂接触;以及使所述第一改性剂与形成所述通道的表面的所述至少一部分上的多个第一反应性部分反应。
45.根据实施例43或44所述的过程,其中,所述亲水涂层可以通过以下方式形成:使所述腔室(例如,隔绝坞)的至少一个表面与亲水改性剂接触;以及使第二改性剂与所述腔室的所述至少一个表面上的多个第二反应性部分反应。
46.一种测定微流体装置中包封的细胞的过程,所述微流体装置具有围栏,所述围栏包括通道和多个腔室,所述多个腔室中的每个腔室具有将腔室流体连接到所述通道的开口(例如,单个开口),其中,形成通道的表面的靠近所述多个腔室中的每个腔室的至少一部分和/或形成所述多个腔室中的每个腔室的表面的靠近所述通道的至少一部分包括疏水涂层,其中,所述过程包括:用第一水性介质填充所述微流体装置的围栏中的所述通道和所述多个腔室;将第一细胞置于所述多个腔室中的第一腔室中;将第二细胞置于所述多个腔室中的第二腔室中;使与水不混溶的流体介质流入所述通道中,基本上置换所述通道中的所有第一水性介质,而基本上不置换所述多个腔室中的任意腔室中的第一水性介质,从而可逆地将所述第一细胞和所述第二细胞包封在它们相应的腔室中;以及监测包封在所述第一腔室和所述第二腔室中的细胞的活性。
47.根据实施例46所述的过程,其中,靠近并围绕通向所述多个腔室中的每个腔室的开口的所有通道表面可以包括所述疏水涂层。
48.根据实施例46或47所述的过程,其中,在通向所述多个腔室中的每个腔室的开口的10微米内的所有通道表面可以包括所述疏水涂层。
49.根据实施例46至48中任一项所述的过程,其中,所述疏水涂层可具有约45度至约100度的接触角度。
50.根据实施例46至49中任一项所述的过程,其中,所述疏水涂层可以共价结合到形成通道的表面的靠近所述多个腔室中的每个腔室的部分。
51.根据实施例46至50中任一项所述的过程,其中,所述与水不混溶的流体介质可包括烷烃、氟代烷烃、油、疏水聚合物或其任意组合。
52.根据实施例46至51中任一项所述的过程,还包括:将所述与水不混溶的流体介质吸出所述通道。
53.根据实施例52所述的过程,其中,将所述与水不混溶的流体介质吸出所述通道的速率可以处于0.01μl/sec和1.0μl/sec或在0.01μl/sec至1.0μl/sec之间。
54.根据实施例52或53所述的过程,其中,吸取所述与水不混溶的流体介质还可以包括:随后将第二水性介质吸入到所述通道中。
55.根据实施例54所述的过程,其中,所述第二水性介质可包括表面活性剂。
56.根据实施例52至55中任一项所述的过程,其中,形成所述多个腔室中的每个腔室的表面的至少一部分可以包括疏水涂层,并且其中,腔室表面的具有疏水涂层的至少一部分位于通向所述通道的开口附近,其中,所述过程还可以包括:在所述多个腔室中的每个腔室中生成与水不混溶的流体介质的包封层,其中,所述多个腔室中的每个腔室的包封层可以紧邻所述通道定位并且可以与所述腔室中的第一水性介质共享界面,以将所述腔室中的第一水性介质与通道中存在的介质(例如,第二水性介质、空气、CO
57.根据实施例56所述的过程,其中,靠近并围绕所述多个腔室中的每个腔室的开口的所有腔室表面可包括所述疏水涂层。
58.根据实施例56或57所述的过程,其中,在所述多个腔室中的每个腔室的开口的10微米内的所有腔室表面可以包括所述疏水涂层。
59.根据实施例56至58中任一项所述的过程,其中,所述通道表面的疏水涂层可以与所述腔室表面的疏水涂层相同。
60.根据实施例56至59中任一项所述的过程,其中,所述多个腔室中的每个腔室的包封层可具有约5微米至约50微米的平均厚度。
61.根据实施例56至60中任一项所述的过程,还包括:选择其中布置有细胞的至少两个腔室中的一个(或多个);以及移除由不混溶性流体介质在通向选定的腔室的通道的开口处形成的包封层,从而产生解包封的腔室。
62.根据实施例61所述的过程,其中,选择性地移除所述包封层可以包括:在所述腔室内产生气泡(例如,靠近所述包封层产生气泡)。
63.根据实施例62所述的过程,其中,产生所述气泡可以包括:将激光引导到所述腔室的基部的内表面上靠近所述第一水性介质与与水不混溶的流体介质之间的界面的位置。
64.根据实施例61至63中任一项所述的过程,还包括:使第三水性介质流入所述通道中。
65.根据实施例64所述的过程,其中,所述第三水性介质可以包括试剂(例如,测定试剂或裂解试剂(例如,所述第三水性介质可以是裂解缓冲液))或输出缓冲液。
66.根据实施例46至65中任一项所述的过程,还包括:将捕获珠粒(例如,结合生物材料的珠粒,诸如非特异性捕获珠粒、抗原捕获珠粒、酶捕获珠粒或核酸捕获珠粒等)置于所述第一腔室和所述第二腔室中的一个或两个中。
67.根据实施例66所述的过程,还包括:从所述解包封的腔室中释放所述捕获珠粒(例如,进一步分析结合到所述捕获珠粒的材料);以及可选地,从所述微流体装置输出所述捕获珠粒(例如,以及进一步分析结合到所述捕获珠粒的材料)。
68.根据实施例46至67中任一项所述的过程,其中,将所述第一细胞和所述第二细胞置于所述第一腔室和所述第二腔室中可以包括:使水性介质流入所述微流体装置的通道中,所述水性介质包括多个细胞;以及从所述微流体装置的通道中的含有细胞的水性介质中选择所述第一细胞和所述第二细胞,以将其分别置于所述第一腔室和所述第二腔室中。
69.根据实施例68所述的过程,其中,可以使用DEP力(例如,光致动DEP力)分别将选定的第一细胞和第二细胞从所述通道单独地移动到所述第一腔室和所述第二腔室。
70.根据实施例46至69中任一项所述的过程,其中,所述多个腔室中的每个腔室可以是隔绝坞,所述隔绝坞具有通向所述通道的单个开口并且可以包括隔离区域(例如,具有单个开口)和将所述隔离区域流体连接到所述通道的连接区域。
71.根据实施例70所述的过程,其中,每个隔绝坞的连接区域可以包括通向所述通道的近端开口和通向所述隔离区域的远端开口,连接区域的所述近端开口具有范围从约20微米至约100微米的宽度W
72.根据实施例71所述的过程,其中,每个隔绝坞的所述近端开口处的宽度W
73.根据实施例71或72所述的过程,其中,所述连接区域的长度L
74.根据实施例71或72所述的过程,其中,所述连接区域的长度L
75.根据实施例71至74中任一项所述的过程,其中,所述连接区域的长度L
76.根据实施例46至75中任一项所述的过程,其中,所述通道(例如,具有基本均匀的宽度的通道)的宽度W
77.根据实施例46至76中任一项所述的过程,其中,所述通道(例如,具有基本均匀的宽度的通道)在所述多个腔室中的每个腔室的开口处(或者在每个隔绝坞的连接区域的近端开口处)的宽度W
78.根据实施例46至76中任一项所述的过程,其中,所述通道(例如,具有基本均匀的宽度的通道)在所述多个腔室中的每个腔室的开口处(或者在每个隔绝坞的连接区域的近端开口处)的宽度W
79.根据实施例46至78中任一项所述的过程,其中,所述通道在所述多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的高度可以在约20微米至约100微米之间(例如,约30微米至约50微米、约50微米至约70微米、约70微米至约90微米、约35微米至约45微米、约45微米至约55微米、约55微米至约65微米、约65微米至约75微米、或约75微米至约85微米)。
80.根据实施例46至79中任一项所述的过程,其中,所述多个腔室中的每个腔室(或每个隔绝坞)的体积可以在从约2x 10
81.根据实施例46至80中任一项所述的过程,其中,形成所述通道的表面的总表面积的小于或等于50%可包括所述疏水涂层。
82.根据实施例46至80中任一项所述的过程,其中,形成所述通道的表面的总表面积的大于或等于50%可包括所述疏水涂层。
83.根据实施例46至82中任一项所述的过程,其中,所述多个腔室中的每个腔室可包括形成所述腔室的多个表面,其中,多个腔室表面中的至少一个腔室表面可包括亲水涂层。
84.根据实施例83所述的过程,其中,所述多个腔室可以包括多个隔绝坞,每个隔绝坞具有通向所述通道的单个开口并且可以包括隔离区域(例如,具有单个开口)和将所述隔离区域流体连接到所述通道的连接区域,并且其中,形成所述多个隔绝坞中的每个隔绝坞的隔离区域的至少一个表面(例如,所有表面)可以包括所述亲水涂层。
85.根据实施例84所述的过程,其中,形成所述多个隔绝坞中的每个隔绝坞的连接区域的至少一个表面(例如,所有表面)可以包括所述亲水涂层。
86.根据实施例85所述的过程,其中,形成所述连接区域的至少一个表面(例如,所有表面)中的每一个可以包括靠近所述隔离区域的具有所述亲水涂层的部分和靠近所述通道的具有所述疏水涂层的部分,并且可选地,当形成所述连接区域的所有表面可以包括靠近所述通道的具有所述疏水涂层的部分时,它们提供包围所述连接区域紧邻所述通道的部分的疏水涂层。
87.根据实施例46至86中任一项所述的过程,其中,所述疏水涂层可以包括第一共价结合的表面修饰,其包括:第一链接基团和第一部分,其中,所述第一部分是非极性的(例如,油酸部分、炔基部分、炔基封端的PEG部分或氟化部分)。
88.根据实施例87所述的过程,其中,所述亲水涂层可以包括多个第二共价结合的表面修饰,其每一个包括第二链接基团和第二部分,其中,所述第二部分可以是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
89.根据实施例46至88中任一项所述的过程,还包括:在监测所述第一细胞和所述第二细胞的活性之前将包封在所述第一腔室和所述第二腔室中的所述第一细胞和所述第二细胞孵育第一时间段。
90.根据实施例46至88中任一项所述的过程,还包括:将包封在所述第一腔室和所述第二腔室中的每一个中的所述第一细胞和所述第二细胞孵育第一时间段并且在所述第一时间段期间的多个时间点监测所述第一细胞和所述第二细胞的活性。
91.根据实施例90所述的过程,还包括:在所述第一时间段期间基本上连续地监测孵育中的第一细胞和第二细胞的活性。
92.根据实施例89至91中任一项所述的过程,其中,所述第一时间段可以是至少30分钟。
93.根据实施例89至92中任一项所述的过程,其中,所述第一时间段可以在4小时至24小时之间(例如,8小时至12小时之间、12小时至16小时之间、16小时至20小时之间)。
94.根据实施例46至93中任一项所述的过程,还包括:在18℃至50℃之间(例如,25℃至37℃之间)的温度下孵育细胞。
95.根据实施例46至94中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以表达不同量的关注的分子或报告分子。
96.根据实施例95所述的过程,其中,所述关注的分子可以是小分子。
97.根据实施例95所述的过程,其中,所述关注的分子可以是蛋白质。
98.根据实施例95所述的过程,其中,所述关注的分子可以是核酸。
99.根据实施例95至98中任一项所述的过程,其中,所述关注的分子可以是分泌的。
100.根据实施例95至99中任一项所述的过程,其中,分别监测包封在所述第一腔室和所述第二腔室中的所述第一细胞和所述第二细胞的活性可以包括:检测存在于所述第一腔室和所述第二腔室中的每一个中的关注的分子或报告分子。
101.根据实施例100所述的过程,其中,检测所述关注的分子或所述报告分子可以包括:检测与所述关注的分子或所述报告分子相关联的或由所述关注的分子或所述报告分子产生的荧光信号。
102.根据实施例100或101所述的过程,其中,检测所述关注的分子或所述报告分子可以包括:检测所述关注的分子或所述报告分子与固体基质的结合,其中,所述固体基质(例如,珠粒)可以包括所述关注的分子的受体。
103.根据实施例46至102中任一项所述的过程,其中,监测所述第一细胞和所述第二细胞的活性可以包括:分别对所述第一腔室和所述第二腔室成像。
104.根据实施例103所述的过程,其中,所述第一细胞和所述第二细胞可被成像以监测细胞的一个或多个表型参数。
105.根据实施例103或104所述的过程,其中,监测所述第一细胞和所述第二细胞的活性可以包括监测细胞生长。
106.根据实施例46至105中任一项所述的过程,其中,已流过所述通道/正流过所述通道的与水不混溶的流体介质可以包括可溶性氧。
107.根据实施例46至106中任一项所述的过程,其中,所述第一水性介质可以包括碳源/能源和可选的其他矿物质和营养物。
108.根据实施例46至107中任一项所述的过程,还包括:基于检测到的细胞活性(例如,基于预定标准或相对于所述微流体装置的其他腔室中检测到的细胞活性),从所述第一细胞和所述第二细胞中选择关注的细胞以进行附加的测定。
109.根据实施例108所述的过程,其中,选择可基于关注的分子的表达量、细胞生长量或其组合。
110.根据实施例46至109中任一项所述的过程,还包括:将微物体置于所述多个腔室中的所述第一腔室和所述第二腔室中的每一个中,其中,所述微物体可以包括分子,其被配置为影响或测试置于腔室中的所述第一细胞和所述第二细胞的生物活性。
111.根据实施例110所述的过程,其中,所述分子可以非共价地与所述微物体相关联。
112.根据实施例110或111所述的过程,其中,将所述微物体置于所述第一腔室和所述第二腔室中的每一个中可以在将所述第一细胞和所述第二细胞包封在它们相应的腔室内之前执行。
113.根据实施例110至112中任一项所述的过程,还包括:在将所述微物体引入第一腔室和第二腔室中之后,将释放试剂引入所述第一腔室和所述第二腔室中的每一个中,其中,所述释放试剂被配置为触发分子从所述微物体的释放。
114.根据实施例113所述的过程,其中,将所述释放试剂引入所述第一腔室和所述第二腔室中的每一个中可以在将所述第一细胞和所述第二细胞包封在它们相应的腔室内之前执行。
115.根据实施例113或114所述的过程,还包括:触发分子从所述微物体的释放。
116.根据实施例115所述的过程,其中,触发分子从所述微物体的释放可包括:提高所述微流体装置的所述第一腔室和所述第二腔室中的每一个的温度。
117.根据实施例113至116中任一项所述的过程,其中,触发释放可以包括:将激光照明引导到所述第一腔室和所述第二腔室中的每一个中的微物体处。
118.根据实施例113至117中任一项所述的过程,还包括:评估所述微物体所包括的分子是否改变第一细胞或第二细胞对所述关注的分子(或所述报告分子)的表达。
119.根据实施例118所述的过程,还包括:量化所述第一细胞和所述第二细胞的关注的分子(或报告分子)的表达的变化(例如,量化所述第一细胞相对于所述第二细胞的变化,反之亦然,或相对于置于所述多个腔室中除所述第一腔室和所述第二腔室之外的腔室中的一个或多个细胞而量化)。
120.根据实施例113至119中任一项所述的过程,其中,所述微物体还可包括标识符,其被配置为允许跟踪所述分子的身份。
121.根据实施例1至120中任一项所述的过程,其中,所述多个腔室中的每个腔室从所述通道横向开口。
122.根据实施例1至121中任一项所述的过程,其中,所述微流体装置的围栏还可以包括:基部;微流体回路结构,设置在所述基部的内表面上;以及盖,设置在所述微流体回路结构上方,其中,所述基部、所述微流体回路结构和所述盖共同限定所述通道和所述多个腔室。
123.根据实施例122所述的过程,其中,其中,所述基部的内表面和/或所述盖的内表面可以包括金属、金属氧化物、玻璃、聚合物或其任意组合。
124.根据实施例122或123所述的过程,其中,所述微流体装置的盖或基部可包括DEP配置。
125.根据实施例124所述的过程,其中,所述DEP配置可以被光学致动。
126.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是酵母细胞。
127.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是源自丝状真菌的孢子。
128.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是哺乳动物细胞。
129.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是免疫细胞。
130.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是T细胞。
131.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是B细胞。
132.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞是细菌细胞。
133.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是植物细胞。
134.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是胎儿细胞。
135.根据实施例1至125中任一项所述的过程,其中,所述第一细胞和所述第二细胞可以是干细胞或祖细胞。
136.一种微流体装置,其具有围栏,所述围栏包括通道和多个腔室,所述多个腔室中的每个腔室具有将所述腔室流体连接到所述通道的开口(例如,单个开口),其中,所述多个腔室中的每个腔室由具有总表面积的多个表面形成,其中,每个腔室的所述总表面积的第一部分包括疏水涂层,每个腔室的所述总表面积的第二部分包括亲水涂层,并且其中,每个腔室的所述总表面积的第一部分可以位于靠近腔室开口与所述通道之间的边界。
137.根据实施例136所述的微流体装置,其中,所述多个腔室中的每个腔室的总表面积的第一部分靠近并围绕腔室通向所述通道的开口(例如,形成腔室的开口的每个表面可以在靠近腔室开口与通道之间的边界的位置处包括所述疏水涂层)。
138.根据实施例136或137所述的微流体装置,其中,所述多个腔室中的每个腔室的位于腔室开口与通道之间的边界的约10微米内(例如,约20微米内、约25微米内、约30微米内、约35微米内、约40微米内、约45微米内、约50微米内、约55微米内、约60微米内或更多内)的所有总表面积可以包括所述疏水涂层。
139.根据实施例136至138中任一项所述的微流体装置,其中,所述通道可由具有总表面积的多个表面形成,其中通道的总表面积的一个或多个部分包括疏水涂层(例如,与所述多个腔室相同的疏水涂层)。
140.根据实施例139所述的微流体装置,其中,所述通道的总表面积的包括所述疏水涂层的一个或多个部分中的每一个可以定位为靠近通道与所述多个腔室中的对应的腔室之间的边界。
141.根据实施例139或140所述的微流体装置,其中,通道的位于通道与所述多个腔室的开口之间的边界的约10微米内(例如,约20微米内、约25微米内、约30微米内、约35微米内、约40微米内、约45微米内、约50微米内、约55微米内、约60微米内或更多内)的所有总表面积可以包括所述疏水涂层。
142.根据实施例141所述的微流体装置,其中,所述通道的基本上所有(例如,至少80%、85%、90%、95%、98%、99%或更多)总表面积可包括所述疏水涂层。
143.根据实施例136至142中任一项所述的微流体装置,其中,所述多个腔室的疏水涂层可具有约45度至约100度的接触角度。
144.根据实施例136至143中任一项所述的微流体装置,其中,所述多个腔室中的每个腔室可以是隔绝坞,所述隔绝坞包括隔离区域和将所述隔离区域流体连接到所述通道的连接区域。
145.根据实施例144所述的微流体装置,其中,每个隔绝坞的疏水涂层可以存在于所述连接区域中,并且基本上不存在于所述隔离区域中(例如,形成隔离区域的腔室表面的总表面积可以包括小于5%、4%、3%、2%、1.5%、1%、0.5%的所述疏水涂层)。
146.根据实施例145所述的微流体装置,其中,形成每个隔绝坞的连接区域的腔室表面的总表面积的小于或等于50%可包括所述疏水涂层。
147.根据实施例145所述的微流体装置,其中,形成每个隔绝坞的连接区域的腔室表面的总表面积的大于或等于50%可包括所述疏水涂层。
148.根据实施例145所述的微流体装置,其中,形成每个隔绝坞的连接区域并且包括所述疏水涂层的腔室表面可以形成围绕连接区域的近端的环(例如,从通道与连接区域的近端开口之间的边界开始并且延伸到所述连接区域中)。
149.根据实施例144至148中任一项所述的微流体装置,其中,形成每个隔绝坞的隔离区域的腔室表面的总表面积的大于或等于50%可包括亲水涂层。
150.根据实施例144至148中任一项所述的微流体装置,其中,形成每个隔绝坞的隔离区域的腔室表面的基本上所有总表面积(例如,至少80%、85%、90%、95%、98%、99%或更多)可以包括亲水涂层。
151.根据实施例144至150中任一项所述的微流体装置,其中,每个隔绝坞的连接区域可以包括通向所述通道的近端开口和通向所述隔离区域的远端开口,连接区域的近端开口具有范围从约20微米至约100微米(例如,约20微米至约60微米,或约30微米至约90微米)的宽度W
152.根据实施例151所述的微流体装置,其中,所述连接区域的长度L
153.根据实施例151所述的微流体装置,其中,所述连接区域的长度L
154.根据实施例151所述的微流体装置,其中,所述连接区域的长度L
155.根据实施例136至154中任一项所述的微流体装置,其中所述通道(例如,具有基本均匀的宽度的通道)的宽度W
156.根据实施例136至155中任一项所述的微流体装置,其中,所述通道(例如,具有基本均匀的宽度的通道)在所述多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的宽度W
157.根据实施例136至156中任一项所述的微流体装置,其中,所述通道(例如,具有基本均匀的宽度的通道)在所述多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的宽度W
158.根据实施例136至157中任一项所述的微流体装置,其中,所述通道在所述多个腔室中的每个腔室的开口处(或在每个隔绝坞的连接区域的近端开口处)的高度可以在约20微米至约100微米之间(例如,约30微米至约50微米)。
159.根据实施例136至157中任一项所述的微流体装置,其中,所述多个腔室中的每个腔室(或每个隔绝坞)的体积可以在从约2x 10
160.根据实施例136至159中任一项所述的微流体装置,其中,所述微流体装置的围栏还可以包括:基部;微流体回路结构,设置在所述基部的内表面上;以及盖,设置在所述微流体回路结构上方,其中,所述基部、所述微流体回路结构和所述盖共同限定所述通道和所述多个腔室。
161.根据实施例136至160中任一个所述的微流体装置,其中,所述疏水涂层可以包括第一共价结合的表面修饰,其可以包括:第一链接基团和第一部分,其中,所述第一部分是非极性的(例如,油酸部分、炔基部分、PEG链接的炔基或氟化部分)。
162.根据实施例161所述的微流体装置,其中,所述亲水涂层可以包括多个第二共价结合的表面修饰,其每一个包括第二链接基团和第二部分,其中,所述第二部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分)。
163.一种用于包封细胞的试剂盒,包括:具有围栏的微流体装置,所述围栏包括通道和多个腔室,所述多个腔室中的每个腔室具有将所述腔室流体连接到通道的开口(例如,单个开口),其中,形成所述通道和每个腔室的内表面的至少一部分可以包括多个反应性部分;第一表面改性剂,其可以包括被配置为与所述反应性部分共价结合的第一链接基团,并且可以包括第一表面接触部分,其中,所述第一表面接触部分可以是非极性的(例如,油酸部分、炔基部分、PEG链接的炔基或氟化部分);以及第二表面改性剂,包括被配置为与所述反应性部分共价结合的第二链接基团,并且包括第二表面接触部分,其中,所述第二表面接触部分是极性的(例如,甲氧基封端的PEG部分、羧酸、羧酸封端的PEG部分、醇部分或醇封端的PEG部分),其中,所述试剂盒可用于产生根据实施例135至161中任一项所述的微流体装置。
164.根据实施例163的试剂盒,其中,所述多个反应性部分可以包括叠氮部分或炔基部分。
165.根据实施例163或164的试剂盒,还包括多个捕获珠粒(例如,结合生物材料的珠粒,诸如非特异性捕获珠粒、抗原捕获珠粒、酶捕获珠粒或核酸捕获珠粒等)。
166.根据实施例163至165中任一项的试剂盒,还可包括水性介质、与水不混溶的流体介质(例如,烷烃、氟代烷烃、油、疏水聚合物或其任意组合)、测定试剂(例如,裂解试剂,诸如裂解缓冲液等)、或输出缓冲液中的一种或多种。
- 一种适用于单细胞真核藻类基因组大小的测定方法
- 用于包封和测定细胞的方法
- 用于包封和测定细胞的方法
