一种具有免疫调控和骨诱导功能的外泌体修饰金属植入物及其制备方法与应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于生物医用新材料领域,具体涉及一种具有免疫调控和骨诱导功能的外泌体修饰金属植入物及其制备方法与应用。
背景技术
细胞外囊泡(如外泌体)是一种几乎所有类型细胞均可分泌的、含有磷脂双分子层结构的囊泡,这些囊泡可参与炎症、自身免疫反应、内皮功能障碍/损伤、促凝血、血管生成和内膜增生、成骨分化等病理相关过程,在细胞治疗过程中具有举足轻重的作用。外泌体多携带着诸如细胞因子、生长因子、信号脂质、DNA和调节性miRNA等多种功能基团。其中,早期成骨分化中的间充质干细胞(MSC)衍生的外泌体(MSC-EVs)在抗炎、细胞粘附和成骨分化方面都显示出积极作用,是理想的骨整合调节物质。与其它干细胞、蛋白质药物和合成化学品相比,MSC-EVs的天然多组分能够以安全、低成本和高效的方式诱导复杂而持久的细胞反应,而不受免疫和生物毒性的限制,对于提高假体的表面骨整合具有明显的优势。
假体植入治疗是骨骼和关节功能重建最成功的治疗策略之一,然而假体植入后的免疫反应会阻碍骨整合,影响骨整合效果,从而导致骨科植入物失败率升高。在假体植入治疗中,骨骼的生物质量是通过骨重塑过程来维持的。而骨代谢和免疫炎症反应是骨重塑过程中影响成骨的主要因素。骨代谢的特征主要集中在骨形成减弱,以及骨形成的生化标志物的循环水平降低。除了骨代谢原因外,影响成骨的更重要因素是炎症免疫反应。研究表明,在假体植入者体内可检测到由免疫细胞释放的炎性细胞因子,这其中巨噬细胞起着关键作用。当假体植入人体后,外源性生物材料会加重局部免疫反应,在术后数小时内巨噬细胞将被招募到植入物表面,并引发早期炎症级联反应。长期的炎症暴露会引起周围纤维环的形成,发展成为影响假体生存率的关键因素为骨整合造成屏障阻碍。此外,长期暴露于这种炎症环境还会导致MSC活性和成骨分化能力损害。目前,假体同骨之间的整合及骨重塑仍然是影响临床疗效的严峻挑战,迫切需要制定有效的策略来促进患者假体周围的骨重塑。
现有研究表明,通过免疫调节手段促进骨形成,可提高假体表面的骨整合,然而,基于细胞、囊泡或大分子生物活性物质的灵活修饰策略依然存在探索空间,特别是通过用生物质修饰医用植入物获得高性能假体的工艺严重不足,亟待开发应用MSC-EVs进行植入物表面修饰以改善假体表面骨整合的新颖而有效的策略。
发明内容
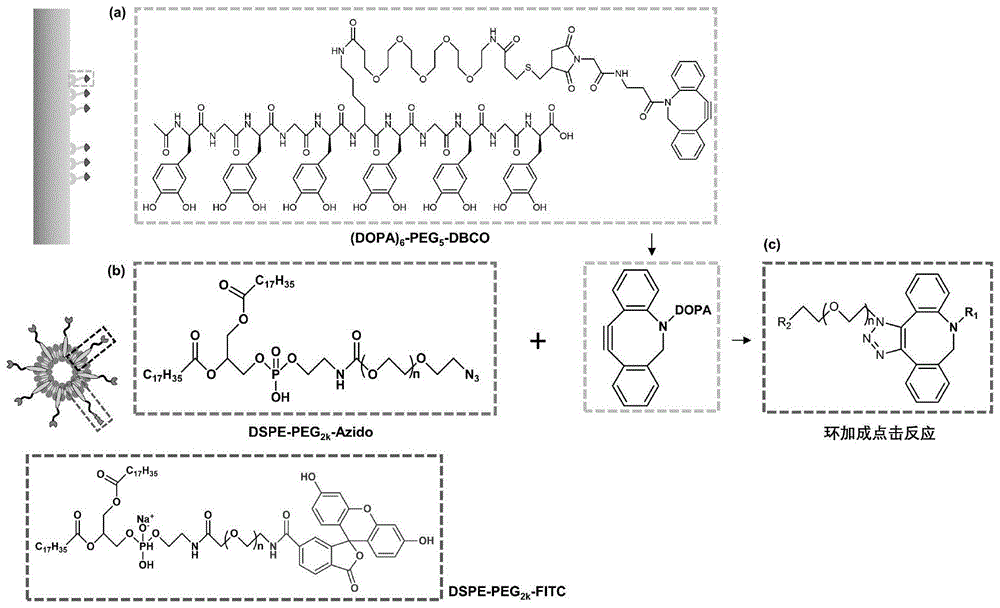
为了解决现有技术中的一些问题,本发明提供了一种具有免疫调控和骨诱导功能的外泌体修饰金属植入物及其制备方法与应用。本发明通过生物可点击基团DBCO合成一种含可粘附在钛基材料表面,且可同链接有外泌体的叠氮基团发生点击反应的贻贝衍生多肽((DOPA)
为了实现上述目的,本发明采用如下技术方案:
本发明提供了一种具有免疫调控和骨诱导双效功能的外泌体修饰医用植入物,所述的外泌体修饰医用植入物在钛基材料表面进行贻贝衍生粘附多肽修饰和叠氮化外泌体表面点击化学修饰来实现免疫调控和骨诱导的双重功效。
优选的,所述的外泌体修饰医用植入物在钛基材料表面修饰有可同链接有外泌体的叠氮基团发生点击反应的贻贝衍生多肽(DOPA)
在某一具体实施方案中,本发明还提供了一种具有免疫调控和骨诱导双效功能的外泌体修饰医用植入物的制备方法,所述方法包括如下步骤:
(1)贻贝衍生粘附多肽的设计及制备;采用固相多肽合成法,将无铜点击化学试剂二苯并环辛炔(DBCO)、丙酮和Fmoc保护的左旋多巴氨基酸Fmoc-DOPA(acetonide)-OH合成贻贝衍生多肽,将所得贻贝衍生多肽记为(DOPA)
(2)医用植入物表面的衍生肽修饰:采用溶液浸泡法将医用植入物浸入步骤(1)获得的(DOPA)
(3)外泌体表面的叠氮化分子修饰:
将MSC来源的外泌体(EV)与叠氮偶联试剂1,2-二硬脂酰基-sn-甘油-3-氢化乙醇胺磷酸酯(DSPE-PEG
(4)医用植入物表面的外泌体点击化学修饰:将步骤(2)获得的DOPA-植入物浸泡到步骤(3)中得到的EV-DSPE-PEG
步骤(1)中,所述贻贝衍生多肽序列的结构简式为:Ac-[(DOPA)-G]
具体结构中,步骤(1)合成的贻贝衍生多肽中含有间隔的甘氨酸(G)或赖氨酸(K),通过单个甘氨酸或赖氨酸将左旋多巴氨基酸(DOPA)间隔开来;并借助赖氨酸(K)的侧链氨基,通过短链聚乙二醇(PEG
步骤(1)中所述贻贝衍生粘附多肽的合成过程中,单个分子多肽内部的多巴基团通过单个甘氨酸来间隔;所述贻贝衍生多肽的整体链长为5、9、13或17个氨基酸基团,连接方式为线形。
本发明以丙酮作为保护试剂对左旋多巴氨基酸(DOPA)中的儿茶酚基团进行保护。
步骤(2)中所述的医用植入物可选为钛合金材料,优选为钛片、钛棒或钛钉。步骤(2)中所述(DOPA)
步骤(3)中所述EV与DSPE-PEG
步骤(4)中所述EV-DSPE-PEG
进一步地,本发明还提供了如上所述的一种具有免疫调控和骨诱导双效功能的外泌体修饰医用植入物在制备人工假体植入材料领域中的应用。
优选的,所述的外泌体修饰医用植入物在制备糖尿病患者的人工假体植入材料领域中的应用。
与现有技术相比,本发明的有益效果是:
本发明受海洋贻贝的启发,本发明将仿贻贝粘附分子的金属-酚配位化学与生物正交点击化学修饰策略相结合,设计了一种具有儿茶酚基团的贻贝衍生粘附多肽。通过强大的儿茶酚/钛(Ti)协调相互作用对金属Ti植入物进行修饰,将其与叠氮化改性的外泌体进行连接,获得具有免疫调控和骨诱导双效功能的外泌体修饰医用植入物,无损将外泌体修饰在医用金属植入材料表面,赋予植入材料免疫调节功能和骨诱导活性。
本发明通过仿贻贝粘附机制和生物正交点击反应,将具有多重生物活性的、早期成骨分化的、间充质干细胞来源外泌体修饰到骨内植入物的表面。可调控巨噬细胞极化表型,发挥免疫-成骨级联调控作用,进而改善植入物的性能。可减轻高血糖微环境下的炎症反应,减少IL-1β、IL-6和TNF-α相关炎症因子的表达;促进高血糖微环境下BMSC的成骨分化能力;促进DM环境下假体周围骨整合,促进骨形成,增加骨密度;所得外泌体修饰医用植入物具有很好的生物相容性,促进巨噬细胞向抗炎M2表型的极化,协同改善骨-内植物界面的免疫微环境诱导和骨内植物界面的最佳成骨性能和骨整合效应。相比于传统化学修饰的复杂性以及潜在毒性和破坏性,本发明涉及的仿贻贝粘附和点击修饰策略,制备方法反应快速、温和且不会破坏外泌体的结构稳定性,为医用金属植入物表面高效修饰功能化外泌体提供了新的方法。尤其对于提高糖尿病患者假体植入的生存率有深远影响,在医疗领域具有广阔的前景。
附图说明
图1是原代MSC标志物流式细胞术鉴定图;
图2是外泌体鉴定图;图中,A是NTA粒径分析以及透射电镜TEM图像;B是外泌体标志蛋白表达鉴定图;
图3是贻贝衍生肽组成部分分子结构示意图;图中,a是代表性的贻贝衍生肽(DOPA)
图4是代表性的(DOPA)
图5是DSPE-PEG
图6是FITC荧光显微镜直接观测图像;
图7是原子力显微镜(AFM)表面形貌检测图;
图8是X射线光电子能谱(XPS)表面元素成分检测图;
图9是水接触角检测(WCA)图;
图10是MSC和RAW 264.7细胞扫描电镜SEM图;
图11是平均细胞铺展面积分析及细胞增殖活力检测图;
图12是细胞活死染色图像(**p<0.01);
图13是EV-DOPA直接促成骨作用活性氧检测荧光图像;
图14是EV-DOPA直接促成骨作用活性氧检测流式定量图;
图15是EV-DOPA直接促成骨作用染色图:图中,A是ALP染色;B是ARS染色;
图16是EV-DOPA直接促成骨作用ALP活力检测图和ARS吸光度检测图;
图17是EV-DOPA直接促成骨作用成骨分化相关基因RT-qPCR检测图;
图18是相关蛋白Runx2和OCN表达免疫荧光染色结果图;
图19是EV-DOPA调控巨噬细胞极化表型转变实验示意图;
图20是巨噬细胞iNOS与F4/80免疫荧光共染图像;
图21是巨噬细胞Arg-1与F4/80免疫荧光共染图像;
图22是免疫荧光染色相对平均荧光强度分析图;
图23是巨噬细胞M1极化表型CD86流式定量分析图;
图24是巨噬细胞M2极化表型CD206流式定量分析图;
图25是炎症细胞因子RT-qPCR检测图;
图26是高通量测序炎症因子表达量分析图;
图27是EV-DOPA调控免疫条件下染色图:图中,A是ALP染色;B是ARS染色;
图28是EV-DOPA调控免疫条件下ALP阳性染色面积与ARS染色吸光度检测图;
图29是EV-DOPA调控免疫条件下成骨分化相关基因RT-qPCR检测图;
图30是成骨分化相关蛋白Runx2、OCN免疫荧光染色图像;
图31是DM大鼠建模血糖监测图:A各周龄阶段空腹血糖检测;B糖耐量检测;
图32是CD86免疫荧光共染图像和平均荧光强度分析图;
图33是CD206免疫荧光共染图像和平均荧光强度分析图;
图34是健康大鼠与DM大鼠股骨钛棒植入前后的骨量三维重建图像与骨体积分数分析图;图中,A是钛棒植入前,B是钛棒植入后;
图35是EV-DOPA对DM大鼠假体周围骨整合作用的Micro-CT骨三维重建图像;
图36是EV-DOPA对DM大鼠假体周围骨整合作用的骨体积分数分析、图骨密度分析图及骨小梁厚度分析图;
图37是EV-DOPA对DM大鼠假体周围骨整合作用的H&E染色图像;
图38是甲苯胺蓝染色图像;
图39是纤维环厚度分析图及骨-假体接触比分析图;
图40是EV-DOPA对DM大鼠假体周围成骨指标影响的钙黄绿素荧光图像;
图41是OCN与COL1A1蛋白免疫荧光染色图像。
具体实施方式
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
成骨诱导培养基购自于上海逍鹏生物科技有限公司,Fmoc-DOPA(acetonide)-OH购自于强耀生物科技有限公司,DSPE-PEG2k-Azido购自于西安瑞禧生物科技有限公司,ALP碱性磷酸酶染色试剂盒购自于碧云天生物技术有限公司,NanoDrop-2000购自于ThermoFisher,PrimeScriptRTMaster Mix、Ex Taq
本发明提供了一种具有免疫调控和骨诱导双效功能的外泌体修饰医用植入物的制备方法,所述方法包括如下步骤:
(1)贻贝衍生粘附多肽的设计及制备;采用固相多肽合成法,将无铜点击化学试剂二苯并环辛炔(DBCO)、丙酮和Fmoc保护的左旋多巴氨基酸Fmoc-DOPA(acetonide)-OH合成贻贝衍生多肽,将所得贻贝衍生多肽记为(DOPA)
(2)医用植入物表面的衍生肽修饰:采用溶液浸泡法将医用植入物浸入步骤(1)获得的(DOPA)
(3)外泌体表面的叠氮化分子修饰:
将MSC来源的外泌体(EV)与100~10000倍数量比的叠氮偶联试剂1,2-二硬脂酰基-sn-甘油-3-氢化乙醇胺磷酸酯(DSPE-PEG
(4)医用植入物表面的外泌体点击化学修饰:将步骤(2)获得的DOPA-植入物浸泡到步骤(3)中得到的EV-DSPE-PEG
实施例1:预分化MSC的外泌体的提取与鉴定
购买6-8周龄SD大鼠(体重200g,SPF级,苏州大学动物实验中心),麻醉处死提取长骨内的原代骨髓间充质干细胞(BMSC)。使用含无外泌体血清的成骨诱导培养基培养3天后,提取上清液,离心去除细胞碎片等,随后,采用超离法提取外泌体。应用NTA粒径分析以及蛋白标志物检测对外泌体进行检测。
图1是原代MSC标志物流式细胞术鉴定图;图2是外泌体鉴定图;图中,A是NTA粒径分析以及透射电镜TEM图像;B是外泌体标志蛋白表达鉴定图;由图1-图2可见,通过流式细胞术鉴定结果表明MSCs细胞呈现CD34,CD45阴性以及CD29,CD90阳性;NTA粒径分析结果表明所提取微小囊泡直径分布集中在100~200nm;外泌体标志物CD9、CD63、TSG101检测阳性,这表明已成功获得原代骨髓间充质干细胞的外泌体。
实施例2:EV-DOPA涂层修饰植入物的制备
(1)贻贝衍生肽的合成
使用丙酮保护的Fmoc-DOPA(acetonide)-OH,采用固相多肽合成法,合成贻贝衍生多肽,其结构简式为:Ac-[(DOPA)-G]
(2)钛合金植入物的多肽化处理
将医用钛片浸入(DOPA)
(3)外泌体的叠氮化
将实施例1所得成骨分化过程中MSC来源的外泌体与DSPE-PEG
(4)EV-DOPA涂层修饰植入物的制备
将步骤(3)获得的叠氮化外泌体溶液3:1(w:w)加入步骤(2)中,与DOPA粘附后的钛基材料充分点击连接12h。通过叠氮与二苯基环辛炔(DBCO)基团之间的环加成生物正交点击化学反应实现外泌体的特异性携载,得到具有免疫调控和骨诱导双效功能(EV-DOPA)的外泌体修饰医用植入物材料,记为EV-DOPA-Ti。
实施例3:荧光标记的EV-DOPA涂层修饰植入物的制备
为了更好的对植入物修饰效果进行观测,本实施例提供一种可选的荧光标记EV-DOPA修饰涂层制备方案。其与实施例2的区别在于,将步骤(3)获得的叠氮化外泌体溶液DSPE-PEG
实施例4:EV-DOPA涂层修饰植入物的表面性能
对EV-DOPA涂层修饰策略获得的植入物和其他方法修饰植入物的表面性能进行对比验证。分别将实施例3制备的EV-DOPA涂层修饰植入物和其他对比植入物置于荧光显微镜下观察。其中,Control组是普通PBS浸泡的钛片,EV组是仅修饰有外泌体的钛片,DOPA组是实施例1中步骤(2)获得的仅修饰有DOPA基团的钛片。图6是FITC荧光显微镜直接观测图像;由图6可见,携带FITC基团的FITC-EV-DOPA钛表面观察到绿色点状荧光,而在其他组别未观察到荧光。图7是原子力显微镜(AFM)表面形貌检测图;由图7可见,与普通PBS浸泡的钛片相比,DOPA组表面粗糙度增加,EV组无明显改变,而在EV-DOPA组观察到大量外泌体球状突起。图8是X射线光电子能谱(XPS)表面元素成分检测图;由图8可见,与普通PBS浸泡的钛片相比,改性后的钛基材料表面“N”元素含量明显增加;图9是水接触角检测(WCA)图;由图9可见,与普通PBS浸泡的钛片相比,EV-DOPA组水接触角显著降低,亲水性更好,EV在钛合金表面进行有效修饰,且没有破坏EV的整体结构。
分别将MSCs与RAW264.7细胞(自制)接种于各组钛表面。图10是MSC和RAW 264.7细胞扫描电镜SEM图;图11是平均细胞铺展面积分析及细胞增殖活力检测图;图12是细胞活死染色图像(**p<0.01);由图10-图12可见,SEM图像显示EV-DOPA组细胞铺展更完全。活死染色未观察到明显的死细胞。细胞增殖检测结果显示相较于Control组,EV-DOPA组细胞增殖活性更高。以上结果表明:EV被成功修饰在植入物表面,并具有细胞贴附铺展性能,展示良好的生物相容性。
实施例4:EV-DOPA体外促成骨性能表征
(1)EV-DOPA的抗氧化应激作用
购买6-8周龄SD大鼠,麻醉处死提取长骨内的原代MSC。分别接种于Control组(普通PBS浸泡的钛片)、EV组(仅修饰有外泌体的钛片)、DOPA组(实施例1中步骤(2)获得的仅修饰有DOPA基团的钛片)及EV-DOPA组(EV-DOPA-Ti)上,在模拟糖尿病(DM)条件的高糖和炎症微环境下进行成骨诱导培养。24小时后,吸去培养基,根据使用说明,使用碧云天活性氧检测试剂盒进行标记处理,随后使用荧光显微镜采集图片数据,流式细胞术定量分析。
图13是EV-DOPA直接促成骨作用活性氧检测荧光图像;图14是EV-DOPA直接促成骨作用活性氧检测流式定量图;是由图13、图14可见,活性氧荧光和流式检测结果显示,DM微环境下,Control组与EV组活性氧产生较多,与Control组相比,EV-DOPA组的BMSCs内产生的活性氧显著降低。
(2)ALP与ARS染色
将原代MSC细胞分别接种于Control组、EV组、DOPA组及EV-DOPA组上,在DM微环境下,诱导成骨分化。在诱导第7天时,吸除培养基,PBS清洗后,使用ALP碱性磷酸酶染色试剂盒染色,光学显微镜采集图像。阳性染色细胞呈蓝色。在诱导第21天时,吸除培养基,固定后,使用ARS茜素红染色液进行染色,光学显微镜采集图像。图15是EV-DOPA直接促成骨作用染色图:图中,A是ALP染色;B是ARS染色;图16是EV-DOPA直接促成骨作用ALP活力检测图和ARS吸光度检测图;由图15-图16可见,阳性染色钙结节呈红色,Control组ALP水平低下,与Control组相比,EV-DOPA组MSC细胞的氧化应激水平显著降低,ALP阳性染色面积和ALP活力均有显著升高(***p<0.001)。Control组内无明显钙结节形成,而与之相比,EV-DOPA组有显著增多的钙结节阳性着色和更高的吸光度值(***p<0.001)。
(3)成骨分化指标
采用RT-qPCR来表征成骨分化情况。测试过程中,使用TRIzol提取总RNA。通过NanoDrop-2000评估mRNA的浓度和纯度。PrimeScriptRT Master Mix用于逆转录。使用SYBR1预混物Ex Taq
通过对成骨分化相关指标的基因和蛋白检测结果显示,EV-DOPA修饰促进了成骨相关基因的表达(Alp,Runx2,Ocn,Col1a1,Sp7)以及成骨分化早期指标Runx2和中晚期指标OCN的蛋白表达。随后将RAW264.7细胞分别接种于不同分组的钛片表面,并在DM模拟微环境中培养。图17是EV-DOPA直接促成骨作用成骨分化相关基因RT-qPCR检测图;图18是相关蛋白Runx2和OCN表达免疫荧光染色结果图;由图17-图18可见,RT-qPCR结果显示,EV-DOPA修饰组相较于对照组,促炎细胞因子表达更低。在DM微环境下,与Control组相比,EV-DOPA组中Alp、Runx2、Ocn、Col1a1以及Sp7的基因表达水平均显著升高(*p<0.05,**p<0.01,***p<0.001)。通过蛋白免疫荧光染色分析,与Control组相比,EV-DOPA组中早期Runx2以及中晚期OCN蛋白的表达均增多(*p<0.05,**p<0.01,***p<0.001),本部分结果证实,EV-DOPA修饰抑制了巨噬细胞向促炎的M1型分化,并增加了抗炎M2型巨噬细胞的数量。EV-DOPA具有直接抗氧化、促成骨分化功能。
实施例5:EV-DOPA调控体外巨噬细胞极化介导的免疫反应
(1)巨噬细胞极化表型改变
通过免疫荧光染色法表征巨噬细胞极化。图19是EV-DOPA调控巨噬细胞极化表型转变实验示意图。具体操作如下:去除细胞培养基,PBS清洗后,加入4%多聚甲醛固定液,冰上固定15分钟。随后PBS清洗3遍,加入Triton液处理10分钟,PBS清洗。加入免疫染色封闭液,冰上封闭1小时后,加入一抗工作液,4℃孵育12小时。回收一抗,PBS清洗3遍,加入荧光二抗工作液,室温避光孵育1小时。抗荧光淬灭封片剂封片后,荧光共聚焦显微镜下采集图像。
图20是巨噬细胞iNOS与F4/80免疫荧光共染图像;图21是巨噬细胞Arg-1与F4/80免疫荧光共染图像;图22是免疫荧光染色相对平均荧光强度分析图;由图20-图22可见,细胞免疫荧光染色结果显示DM微环境下,巨噬细胞内iNOS的表达量较多,而Arg-1表达量较少;与Control组相比,EV-DOPA组细胞iNOS的表达减少,而Arg-1表达有所升高。图23是巨噬细胞M1极化表型CD86流式定量分析图;图24是巨噬细胞M2极化表型CD206流式定量分析图;由图23-图24可见,与Control组相比,EV-DOPA组CD11b/CD86阳性的M1巨噬细胞占比显著降低,而CD11b/CD206阳性的M2巨噬细胞占比增高(*p<0.05,**p<0.01,***p<0.001)。
(2)炎症细胞因子
采用RT-qPCR测试表征炎症细胞因子,具体实施同实施例4中步骤(3)。图25是炎症细胞因子RT-qPCR检测图;由图25可见,RT-qPCR结果显示在DM微环境下,与Control组相比,EV-DOPA组中促炎细胞因子IL-1β、IL-6以及TNF-α的基因表达水平均显著降低,而抗炎的IL-10基因表达升高(*p<0.05,**p<0.01,***p<0.001)。图26是高通量测序炎症因子表达量分析图;由图26可见,通过对高通量测序结果分析EV-DOPA能够显著降低DM微环境下大部分炎症相关因子的表达。结果证实,EV-DOPA能够调控巨噬细胞极化介导的免疫反应。
实施例6:EV-DOPA通过免疫调控,间接促进体外成骨细胞分化
(1)ALP与ARS染色
ALP与ARS染色操作同实施例4中步骤(2),将EV-DOPA修饰的假体与巨噬细胞培养制备的条件培养基共培养后,图27是EV-DOPA调控免疫条件下染色图:图中,A是ALP染色;B是ARS染色;图28是EV-DOPA调控免疫条件下ALP阳性染色面积与ARS染色吸光度检测图;由图27、图28可见,CM
(2)成骨分化指标
采用RT-qPCR测试表征成骨分化情况,具体实施同实施例4中步骤(3)。图29是EV-DOPA调控免疫条件下成骨分化相关基因RT-qPCR检测图;由图29可见,在DM微环境下,与CM
实施例7:EV-DOPA促进DM大鼠体内假体周围骨整合
(1)动物模型的建立
建立链脲佐菌素(STZ;Sigma Aldrich)诱导的糖尿病模型。将体重为100g的5周龄雄性SD大鼠进行适应性喂养1周。将STZ按照1%(w/v)的浓度加入到pH值为4.2~4.5的柠檬酸缓冲液中,制得STZ溶液。将大鼠禁食12小时后,通过腹腔注射,按照35mg/kg的剂量注射STZ。每周获取大鼠尾静脉血以分析非空腹血糖水平(BGL),BGL>16.7mM被确认为建模成功。进一步进行葡萄糖耐量试验(GTT)以检测胰岛功能。大鼠在测试前12小时禁食。从尾静脉采集血液,腹腔注射葡萄糖溶液(1g/kg)前测定血糖为对照值,在注射30、60、90和120分钟测量血糖进行对比,观察糖耐量水平。结果表明糖尿病模型已经成功建立。
STZ注射建模3周后进行钛棒植入术。在大鼠膝关节的中线开一个口,暴露出股骨远端。取中心钻一个孔,分别将各组钛棒(直径:1.5毫米,长度:10毫米)平行于股骨纵轴方向植入股骨远端。根据植入材料修饰方式的不同,将动物分为4组:PBS浸泡组(Control)、DOPA修饰组(DOPA)、EV简单浸泡组(EV)和EV-DOPA修饰组(EV-DOPA)。
各组动物在建模期间可在笼内自由活动,正常进食,进水量增加,尿量增多,体重无明显上升。精神状态无明显变化。图31是DM大鼠建模血糖监测图:A各周龄阶段空腹血糖检测;B糖耐量检测;由图31可见,建模一周后,大鼠血糖显著上升。植入术术后无切口无红肿、渗液等感染、炎性反应,均一期愈合。实验过程中无动物死亡。
(2)早期假体周围巨噬细胞极化改变
采用免疫组织荧光染色来观察假体周围巨噬细胞极化情况,具体操作如下:
1)脱蜡和水化
脱蜡前,将切片在60℃恒温箱中烘烤30分钟。切片置于二甲苯中浸泡10分钟,更换二甲苯后再浸泡10分钟;无水乙醇中浸泡5分钟;95%乙醇中浸泡5分钟;70%乙醇中浸泡5分钟;
2)抗原修复
酶消化方法:常用0.1%胰蛋白酶,胰蛋白酶使用前预热至37℃,切片也预热至37℃,每张切片滴加0.2ml消化液覆盖完全组织,于37℃温箱内消化约5~30分钟,避光。
3)免疫组织荧光染色
PBS洗2~3次各5分钟;滴加正常山羊血清封闭液,室温20分钟。甩去多余液体;滴加Ⅰ抗100μl,4℃过夜或者37℃孵育1小时;PBS洗3次各5分钟;滴加Ⅱ抗40~50μl,室温静置,或37℃1小时;PBS洗3次各5分钟;滴加20μl含DAPI抗荧光淬灭封片剂,盖玻片覆盖封片,荧光显微镜下观察。
图32是CD86免疫荧光共染图像和平均荧光强度分析图;图33是CD206免疫荧光共染图像和平均荧光强度分析图;由图32-图33可见,钛棒假体植入后2周,PBS对照组假体周围组织内M1巨噬细胞标志蛋白CD86的表达水平较高,CD68/CD86染色双阳性细胞数更多,而CD86/CD206染色阳性(M2巨噬细胞)的细胞数量较少,M2巨噬细胞表达低下。与之相比,EV-DOPA组CD86的表达量显著降低,CD68/CD86阳性的M1型巨噬细胞数量减少明显,而CD86/CD206阳性的M2型巨噬细胞数量有所增加(*p<0.05,**p<0.01,***p<0.001)。这些结果证实EV-DOPA假体表面功能化修饰能够调控假体周围巨噬细胞极化表型。
(3)Micro-CT检测
使用比利时SkyScan公司生产的高分辨显微CT SkyScan 1076对小鼠后肢进行扫描分析。扫描前将标本从固定液中取出,晾干。将每个标本放置在Micro-CT测试试管杯中,每次5只,每个标本间用泡沫塑料片隔开;标本要摆放整齐,避免碰到试管壁。扫描参数设置为:电压50kV,电流800μA,扫描时间1750ms,空间分辨率18μm,扫描完成后,采用SkyScan1176自带软件进行小鼠踝关节进行三维重建。使用CT Analyzer分析软件分析以下参数:骨密度(BMD;mg/cm
运用Micro-CT扫描实验大鼠骨组织并进行三维图像重建及定量分析,可以较为准确的描述骨量和骨微结构,从而判定大鼠模型骨参数变化和假体周围骨整合情况。图34是健康大鼠与DM大鼠股骨钛棒植入前后的骨量三维重建图像与骨体积分数分析图;图中,A是钛棒植入前,B是钛棒植入后;由图34可见,相较于健康大鼠,DM模型大鼠长骨骨密度下降;并在钛棒假体植入后假体周围骨整合能力不足(#p<0.05,##p<0.01)。对不同分组实验组织进行骨三维重建和骨参数分析,图35是EV-DOPA对DM大鼠假体周围骨整合作用的Micro-CT骨三维重建图像;图36是EV-DOPA对DM大鼠假体周围骨整合作用的骨体积分数分析、图骨密度分析图及骨小梁厚度分析图;由图35-图36可见,对照组假体周围骨量较低,骨密度(BMD)、骨体积分数(BV/TV)和骨小梁数(Tb.N)均呈现较低水平;在EV-DOPA组,假体周围骨密度、骨体积分数和骨小梁数指标与Control组相比均有明显上升(*p<0.05,**p<0.01,***p<0.001)。这些结果证实EV-DOPA能够有效提高假体周围骨量。
(4)组织形态学染色
采用H&E苏木素-伊红染色法和甲苯胺蓝染色法来观察组织形态学。H&E苏木素-伊红染色法具体操作如下:
1)股骨组织标本由EDTA脱钙液脱钙完成后,对标本进行修剪,以及石蜡包埋,使用组织切片机对石蜡包埋标本进行切片,最终制作成层厚是6μm的石蜡切片。
2)石蜡切片经二甲苯(10min×3次)脱蜡后,依次经过100%、95%、90%,85%的乙醇溶液至水浸泡,每道5min;蒸馏水冲洗3min后,苏木素溶液染色5min,自来水冲洗5min;1%盐酸酒精溶液分化60s,自来水冲洗1min;10%氨水溶液中返蓝60s,自来水冲洗1min;1%伊红溶液复染3min,自来水冲洗1min;常规梯度乙醇溶液及二甲苯脱水、透明,树脂封片。
甲苯胺蓝染色法步骤如下:组织标本行硬组织切片后,用水稀释甲苯胺蓝染液(按所期望染色程度,凭实验经验决定稀释度,由1:100稀释起始)。在稀释好的染色液中短暂浸泡玻片,然后在水中浸泡数次,按选定方法进行压片固定。
图37是EV-DOPA对DM大鼠假体周围骨整合作用的H&E染色图像;图38是甲苯胺蓝染色图像;图39是纤维环厚度分析图及骨-假体接触比分析图;由图37-图39可见,假体植入术后8周,组织H&E染色结果显示,Control组和EV组均有明显的纤维环出现;与Control组相比,EV-DOPA组假体周围的纤维环厚度显著降低(***p<0.001)。甲苯胺蓝染色结果显示,Control组和EV组假体周围新生骨量较少,与之相比,EV-DOPA组假体周围的新生骨显著增多,同时,骨组织与假体表面接触面积比显著增高(***p<0.001)。这些结果证实EV-DOPA抑制了假体周围纤维环的形成,并促进新骨形成和假体表面的骨整合。
(5)成骨指标检测
采用钙黄绿素荧光染色法表征材料的成骨性能。图40是EV-DOPA对DM大鼠假体周围成骨指标影响的钙黄绿素荧光图像;由图40可见,钙黄绿素荧光结果显示Control组和EV组中,假体周围钙黄绿素荧光面积小,且间隙不明显,提示骨形成低下;与Control组相比,EV-DOPA组假体周围出现更多的钙黄绿素荧光,荧光间隙显著增宽。图41是OCN与COL1A1蛋白免疫荧光染色图像。由图41可见,根据成骨分化指标OCN和COL1A1的免疫组织荧光染色结果,Control组成骨指标蛋白表达较低,而相比之下,EV-DOPA组中OCN和COL1A1的表达均显著升高,这些结果提示EV-DOPA功能化修饰能有效促进DM微环境下假体周围的成骨分化。
本发明结果数据采用SPSS11.0统计软件分析,数据用均数±标准差(x±s)表示,多组比较选用单因素方差分析(one-wayANOVA检验),两两比较在总体方差齐的条件下,选用LSD及Dunnett-t法进行分析。p<0.05为差异有统计学意义。
所述实施例为本发明的优选的实施方式,但本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员能够做出的任何显而易见的改进、替换或变型均属于本发明的保护范围。
- 一种具有诊疗功能外泌体及其制备方法
- 无创超声处理细胞在制备外泌体中的应用、外泌体及其制备方法和应用
- 一种基于表面修饰的功能化红细胞及其制备方法和在分离外泌体中的应用
- 一种基于表面修饰的功能化红细胞及其制备方法和在分离外泌体中的应用
