用于治疗慢性疲劳综合症和肌痛性脑脊髓炎/慢性疲劳综合症(ME/CFS)的拉氟酰胺及其衍生物
文献发布时间:2024-05-31 01:29:11
技术领域
本发明涉及拉氟酰胺(Lauflumide)及其衍生物在预防和/或治疗慢性疲劳综合症中的用途,特别是当慢性疲劳综合症归因于由SARS-Cov2病毒所引起的COVID-19疾病时。
背景技术
截至2022年6月,2019冠状病毒疾病(COVID-19)的全球确诊病例数超过5.34亿例(Coronavirus disease(COVID-19),2022),超过30%的感染COVID-19的个体(包括无症状病例)可能会经历COVID后神经精神晚期后遗症
疲劳、睡眠障碍(例如昼夜节律障碍)、认知障碍以及其它持久的神经精神病(例如焦虑、抑郁),被通俗地称为“长期COVID(long COVID)”
国家卫生与临床优化研究所(National Institute for Health and CareExcellence,NICE)将“COVID-19后综合症”(PCS)定义为这样的一系列症状,其在COVID-19感染期间或感染后出现,持续超过12周,并且无法通过可选择诊断进行充分解释(https://www.nice.org.uk/guidance/ng188)。
COVID-19后病症被定义为通常发生在既往确诊或可能感染SARS-CoV-2的个体发病后3个月并且持续至少2个月的持续症状,其无法通过可选择诊断进行解释(
疲劳、认知障碍和睡眠障碍一直被分别报道为PCS最常见的使人衰弱的特征,并且构成显著的全球经济负担
ME/CFS是在20世纪80年代确定的。这种综合症的特征在于,在日常活动中感到极度疲劳和疼痛,劳累后不适和睡眠不良(unrefreshing sleep)。也可能出现其它继发性症状,例如记忆力或集中注意力的能力受损和直立不耐受。
根据如按照Reeves等人
CFS导致显著的发病率,在美国和世界范围内估计有0.42%的人(主要是女性)出现CFS。早先的研究有力地表明,这种复杂的多症状疾病具有涉及神经、内分泌和免疫系统的多系统发病机制。应激反应异常已被确定为CFS症状的潜在诱因或媒介。
83.6万至250万美国人患有ME/CFS。每年给社会造成的直接和间接经济成本估计在170亿至240亿美元之间
ME/CFS的病因主要是病毒感染后。急性病毒感染和随后的重叠免疫反应是ME/CFS症状发作的既定诱因。已经表明,先前的病毒流行病(SARS病毒、MERS病毒)导致了作为长期后果的ME/CFS发生率增加
到目前为止,仍然没有有效且安全的治疗;没有FDA批准的用于COVD后或长期COVID后遗症(例如疲劳、认知障碍、昼夜节律障碍)的药物
唯一在疲劳评分和集中注意力方面具有统计学显著改善的CNS药物的双盲RCT是使用哌甲酯。然而,考虑到与该药物相关的显著不良反应和潜在的依赖性,它不是治疗ME/CFS的理想选择
Xyrem(羟丁酸钠,SXB)也显示出严重的副作用,而且不是特别有效。FDA宣布了诸如SXB的危险药物不能被批准用于涉及大量人群的适应症(例如ME/CFS或纤维肌痛),因为这将有利于非法用作强奸药物和娱乐性物质
爵士制药公司(Jazz Pharmaceuticals)正在探究ME/CFS领域:由于
神经肽Y(NPY)存在于中枢和外周神经系统中。在外周神经系统中,NPY单独或与儿茶酚胺一起集中在交感神经末梢中并从交感神经末梢释放出来。NPY的释放发生在诸如剧烈运动、惊恐障碍和寒冷暴露的应激之后。在外周中,NPY激活并刺激应激反应,但在大脑中,NPY抗焦虑,抑制交感神经活性,并致使血压和心率下降。NPY在大脑中的浓度高于其它神经肽,尤其是在边缘系统中,包括杏仁核和下丘脑,大脑中与情绪有关的所有区域。
NPY已被发现是可用于CFS的生物标志物
即使对NPY1产生轻度的激动剂反向抑制剂作用也可在情绪障碍治疗
Lauflumide(拉氟酰胺)[2-((双(4-氟苯基)甲基)亚磺酰基)乙酰胺]是下一代的选择性多巴胺(DA)再摄取抑制剂,其是对映异构体过量大于95%的光学纯的对映异构体形式(R),是莫达非尼的双(对氟)苯环取代的衍生物(已发布的USPTO专利申请20130295196,Lauflumide and the enantiomers thereof,method for preparing same andtherapeutic uses thereof)。
Lauflumide是一种没有嗜睡反弹迹象的高效促醒剂,作为一种强效兴奋剂,在对有效性睡眠反弹的效力和作用以及睡眠谱分析方面
Lauflumide作为一种具有潜在认知益处和抗冲动作用的促醒剂,显示出副作用风险(例如动脉高血压或睡眠反弹)较低,从而可用于治疗ADHD和与唤醒有关的疾病(例如伴有或未伴有猝倒的发作性睡病和特发性嗜睡症)
与莫达非尼和大多数清醒剂相反,Lauflumide不能刺激去甲肾上腺素(NE)交感神经系统,导致对心血管系统的有害影响,在长期处理中伴有严重的动脉高血压。
与Lauflumide相比,莫达非尼是一种弱DAT抑制剂。最重要的是,莫达非尼的促醒作用被认为依赖于儿茶酚胺能(DA和NE)信号传导
过去和最近对莫达非尼类似物的研究表明,DAT抑制与对动物的促醒作用无关,许多对DAT没有任何显著抑制的类似物仍然产生促醒作用
另一项研究发现,莫达非尼的作用时间长,其促醒特性主要源于多巴胺能活性
除了DAT抑制剂之外,清醒作用的其它可能机制包括食欲素系统的间接激活
关于行为数据,据报道,莫达非尼(128mg/kg)强烈恢复了大鼠消退后的可卡因条件性位置偏爱,从而表明莫达非尼可诱导复发或增加成瘾者对环境诱因的强化作用的脆弱性
出人意料地,本发明人观察到Lauflumide是NPY1的反向激动剂抑制剂。
事实上,发现了Lauflumide与神经肽Y1(NPY1)弱结合,可作为一种反向激动剂抑制剂(27.3%),在以1.0x10-05 M测试时可能发挥组胺能H2受体介导的诱导剂的一些作用(>40%),并且根据Eurofins验证标准操作程序(Eurofins validation StandardOperating Procedure),其结合特性被计算为对特异于每种靶标的放射性标记配体的结合的抑制百分比(Study 100014859Eurofins CEREP 20/03/14,未发布的数据)。
早先的研究结果已经表明,松弛素-3/RXFP3系统控制疼痛传递,通过靶向对慢性疼痛病症(例如纤维肌痛)中所改变的几种行为产生影响的神经肽系统,为用于疼痛管理的治疗工具的开发提供了新的机会。
其它研究结果表明,在关键的下丘脑和边缘回路中的松弛素-3/RXFP3信号传导能够通过调节负责促进食欲和目标导向(动机)行为的网络来整合与应激相关的外部和内部信息
在昼夜节律和唤醒方面,松弛素-3/RXFP3信号传导促进一系列完成行为,与其在更多方面地驱动唤醒和动机行为中的可能的主要作用一致
本发明人假定松弛素-3/RXFP3信号传导通过DAT抑制来参与ME/CFS回路。
RXFP3影响代谢的神经内分泌控制,要强调的是,靶向RXFP3受体的Lauflumide可潜在地治疗与进食有关的疾病
Lauflumide是一种强效DAT抑制剂,以所测试的三种剂量改善了冲动性,其较莫达非尼具有更优的显著应答。
作用于RXFP3受体(23.9%)并作为DAT再摄取抑制剂(84.4%)的Lauflumide可以解释为什么在相同的实验条件下,与莫达非尼相比,Lauflumid不会导致嗜睡反弹
由于基于NPY1受体的激动剂反向抑制剂作用,Lauflumide可在情绪障碍治疗中具有相关性,并且作用于组胺H2受体还可以改善与情境恐惧有关的记忆保留,作用于RXFP3受体和DAT抑制还可以改善唤醒和冲动性的动机行为。
Lauflumide被认为是COVID-19后疲劳药物治疗的潜在候选物。
Lauflumide作为一种具有潜在认知益处和抗冲动作用的促醒剂,显示出副作用风险(例如动脉高血压或睡眠反弹)较低,从而可用于与唤醒有关的疾病和COVID-19感染后的CFS(COVID后综合症,长期COVID)。
发明内容
本发明的目的是一种式(I)的化合物或者其药学上可接受的异构体、盐和/或溶剂化物,其用于预防和/或治疗慢性疲劳综合症的用途,
其中R1=卤素原子,所述卤素原子选自:F、Cl、Br、I,并且R2=H或OH。
本发明的另一个目的是一种药物组合物,其包含式(I)的化合物或者其药学上可接受的异构体、盐和/或溶剂化物以及药学上可接收的赋形剂,其用于预防和/或治疗慢性疲劳综合症的用途。
附图说明
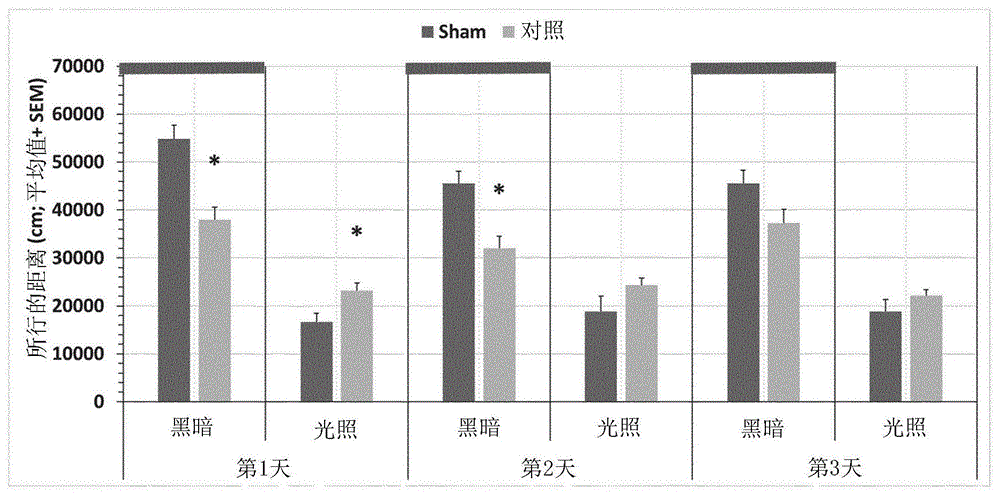
[图1]Sham组和对照组在第1、2和3天的整个24小时时段中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图2]Sham组和对照组在第1、2和3天的整个24小时时段(黑暗阶段+光照阶段)中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图3]Sham组和对照组在第1、2和3天的黑暗阶段与光照阶段之间的所行距离之差(以cm计;平均值+SEM)。与Sham组相比的差异:
[图4]Sham组和对照组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,Sham组与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图5]Sham组、对照组和莫达非尼组在第1、2和3天的12小时黑暗阶段和12小时光照阶段中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图6]Sham组、对照组和莫达非尼组在第1、2和3天的整个24小时时段(黑暗阶段+光照阶段)中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图7]Sham组、对照组和莫达非尼组在第1、2和3天的黑暗阶段与光照阶段之间的所行距离之差(以cm计;平均值+SEM)。与Sham组相比的差异:
[图8]Sham组、对照组和莫达非尼32组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,与Sham组相比的差异和与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图9]Sham组、对照组和莫达非尼64组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,与Sham组相比的差异和与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图10]Sham组、对照组和莫达非尼128组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,与Sham组相比的差异和与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图11]Sham组、对照组和NLS-4组在第1、2和3天的12小时黑暗阶段和光照阶段中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图12]Sham组、对照组和NLS-4组在第1、2和3天的整个24小时时段中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图13]Sham组、对照组和NLS-4组在第1、2和3天的黑暗阶段与光照阶段之间的所行距离之差(以cm计;平均值+SEM)。与Sham组相比的差异:
[图14]Sham组、对照组和NLS-4 16组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,与Sham组相比的差异和与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图15]Sham组、对照组和NLS-4 32组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,与Sham组相比的差异和与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图16]Sham组、对照组和NLS-4 64组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,与Sham组相比的差异和与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图17]Sham组、对照组和NLS-4 128组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,与Sham组相比的差异和与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图18]Sham组、对照组和NLS-4 256组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,与Sham组相比的差异和与对照组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图19]Sham组、对照组、莫达非尼组和NLS-4组在第1、2和3天的12小时黑暗阶段和光照阶段中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图20]Sham组、对照组、莫达非尼组和NLS-4组在第1、2和3天的整个24小时时段中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图21]Sham组、对照组、莫达非尼组和NLS-4组在第1、2和3天的黑暗阶段与光照阶段之间的所行距离之差(以cm计;平均值+SEM)。与Sham组相比的差异:
[图22]Sham组、对照组、莫达非尼32组、莫达非尼64组和NLS-4 16组在第1、2和3天的12小时黑暗阶段和12小时光照阶段中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图23]Sham组、对照组、莫达非尼32组、莫达非尼64组和NLS-4 16组在第1、2和3天的整个24小时时段中所行的距离(以cm计;平均值+SEM)。与Sham组相比的差异:
[图24]Sham组、对照组、莫达非尼32组、莫达非尼64组和NLS-4 16组在第1、2和3天的黑暗阶段与光照阶段之间的所行距离之差(以cm计;平均值+SEM)。与Sham组相比的差异:
[图25]Sham组、对照组、莫达非尼32组(上图)、莫达非尼64组(下图)和NLS-4 16组在第1、2和3天的黑暗阶段和光照阶段的2小时时段中所行的距离(以cm计;平均值±SEM)。对于每个12小时时段,NLS-4 16组与Sham组、对照组、莫达非尼32组和莫达非尼64组相比的差异:G=组效果,G×P=组×时段相互作用;ns=不显著,
[图26]在开始前、在疲劳程序(F-D1-7)中和在测试期(T-D1-D3+24h)中的体重(以g计;平均值,SEM)。
具体实施方式
本发明的第一主题涉及一种式(I)的化合物或者其药学上可接受的异构体、盐和/或溶剂化物,其用于预防和/或治疗慢性疲劳综合症(CFS)的用途,
其中R1=卤素原子,所述卤素原子选自:F、Cl、Br、I,优选F,并且R2=H或OH,优选R2=H。
式(I)具有在亚砜(-S=O)基团的手性中心。
因此,“异构体”优选地意指“对映异构体”。
根据本发明,当未另行规定时,术语“式(I)的化合物”是指外消旋体形式或对映异构体形式的式(Ⅰ)的化合物。
“光学纯的式(I)的化合物”意指对映异构体过量大于95%,优选大于96%,更优选大于97%,甚至更优选大于98%,特别优选大于99%的对映异构体。
优选地,R1=F并且R2=H。
当R1=F且R2=H时,光学纯的R-对映异构体的式(I)的化合物是Lauflumide,2-[(R)-((双(4-氟苯基)甲烷)亚磺酰基)乙酰胺及其盐。
优选地,本发明的主题为一种式(I)的化合物,其用于预防和/或治疗病毒感染后的CFS,更优选SARS-Cov2感染后的CFS(即长期COVID病症)的用途。
式(I)的化合物优选地以介于50mg/天至500mg/天之间,更优选80mg/天至320mg/天之间的治疗剂量使用。
式(I)的化合物优选地以介于1mg/kg/天至5mg/kg/天之间的治疗剂量使用。
本发明的第二主题涉及一种预防和/或治疗慢性疲劳综合症的方法,其包括向有需要的患者施用式(I)的化合物或者其药学上可接受的异构体、盐和/或溶剂化物,
其中R1=H或卤素原子,所述卤素原子选自:F、Cl、Br、I,优选F,并且R2=H或OH。
本发明的第三主题涉及一种药物组合物,其用于预防和/或治疗慢性疲劳综合症的用途,所述药物组合物包含如上所定义的式(I)的化合物或者其药学上可接受的异构体、盐和/或溶剂化物,以及药学上可接收的赋形剂,。
根据本发明的用途的药物组合物优选地适合于口服施用或肠胃外施用。
优选地,根据本发明的用途的药物组合物适合于口服施用或者肠胃外施用,例如以片剂、胶囊、糖浆、溶液、粉末的形式口服施用,或者例如以溶液(例如可注射的溶液)或透皮递送系统(TDS)的形式肠胃外施用。
本发明的第四主题涉及一种预防和/或治疗慢性疲劳综合症的方法,其包括向有需要的患者施用如上所定义的药物组合物。
实施例
Lauflumide的合成路线:
测试了10-5M的Lauflumide,计算出对特异于每种靶标的放射性标记配体的对照特异性结合的抑制%。
根据Eurofins标准操作程序(www.eurofins.fr),这种结合谱检测组套(bindingprofile panel)由大致相同数量的选择性的中枢和外周治疗相关靶标多方面地定义,包括天然动物组织、放射性配体和参与细胞周期调节中涉及的特异性酶。
对于放射性配体结合实验,通过使用希尔方程曲线拟合的竞争曲线的非线性回归分析(经由计算机软件)来确定出半数最大抑制浓度(IC
将结果表示为在测试化合物的存在下所获得的对照特异性结合%([所测量的特异性结合/对照特异性结合]×100)和对照特异性结合的抑制%(100-[(所测量的特异性结合/对照特异性结合)×100])。
显示抑制(或刺激)低于25%的结果被认为是不显著的,可主要归因于围绕对照水平的信号变异性。
低至中等负值没有实际意义,可归因于围绕对照水平的信号变异性。
大于50%的抑制或刺激被认为是测试化合物的显著作用,而在25%至50%之间的抑制或刺激表示弱至中度的作用,该作用应通过进一步测试加以确认,因为它们是在可能发生更大实验间变异性的范围内。
50%是进一步研究的常用界值(即从浓度-应答曲线中确定IC
表1中分别呈现出了Lauflumide的这些结合测定的重要显著性或相关研究结果。
表1.Lauflumide的结合活性位点
Lauflumide选择性地与多巴胺转运体(DAT)结合,具有84.4%的DA再摄取抑制,因此可能通过破坏DAT的多巴胺转运从而提高多巴胺(DA)的细胞外浓度来发挥其一些促醒作用,从而致使清醒(Study 100014859CEREP 20/03/14,未发布的数据)。在Lauflumide的结合谱中发现了对其他涉及增强清醒的药理学靶标的其它潜在作用。
发现了Lauflumide与RXFP3受体弱结合(Study US073-0006869-Q Eurofins/leadHunter 8/1/19;未公布的数据)(表1)。
在这些测定中,与该设计相匹配地用GPCR生物传感器测定法在激动剂和拮抗剂模式下测试了化合物:
细胞处理
1、根据标准程序从冷冻储备液中扩增cAMP Hunter细胞系。
2、将总体积为20μL的细胞接种到白色有壁的384孔微孔板中,并在测试前在37℃孵育适当时间。
3、使用DiscoverX HitHunter cAMP XS+测定法来确定cAMP调节。
Gs激动剂形式
1、为了激动剂测定,用样品孵育细胞以诱导应答。
2、从细胞中吸出培养基,并更换为15μL的2:1HBSS/10mM Hepes:cAMP XS+Ab试剂。
3、对样品储备液进行中间稀释,以产生在测定缓冲液中的4X样品。
4、将5μL的4x样品添加至细胞,并在37℃或室温孵育30或60分钟。载剂浓度为1%。
Gi激动剂形式
1、为了激动剂测定,在EC80毛喉素存在下用样品孵育细胞以诱导应答。
2、从细胞中吸出培养基,并更换为15μL的2:1HBSS/10mM Hepes:cAMP XS+Ab试剂。
3、对样品储备液进行中间稀释,以产生在测定缓冲液中的含有4x EC80毛喉素的4X样品。
4、将5μL的4x样品添加至细胞,并在37℃或室温孵育30或60分钟。最终测定载剂浓度为1%。
变构调节形式
1、为了变构测定,用样品预孵育细胞,然后在EC20浓度下进行激动剂诱导。
2、从细胞中吸出培养基,并更换为10μL的1:1HBSS/10mM Hepes:cAMP XS+Ab试剂。
3、对样品储备液进行中间稀释,以产生在测定缓冲液中的4X样品。
4、将5μL的4X化合物添加至细胞,并在室温或37℃孵育30分钟。
5、将5μL的4X EC20激动剂添加至细胞,并在室温或37℃孵育30或60分钟。对于Gi偶联的GPCR,包含EC80毛喉素。
反向激动剂形式(仅Gi)
1、为了反向激动剂测定,在EC20毛喉素存在下用样品预孵育细胞。
2、从细胞中吸出培养基,并更换为15μL的2:1HBSS/10mM Hepes:cAMP XS+Ab试剂。
3、对样品储备液进行中间稀释,以产生在测定缓冲液中的含有4x EC20毛喉素的4X样品。
4、将5μL的4x样品添加至细胞,并在37℃或室温孵育30或60分钟。最终测定载剂浓度为1%。
拮抗剂形式
1、为了拮抗剂测定,用样品预孵育细胞,然后在EC80浓度下进行激动剂竞争(agonist challenge)。
2、从细胞中吸出培养基,并更换为10μL的1:1HBSS/Hepes:cAMP XS+Ab试剂。
3、将5μL的4X化合物添加至细胞,并在37℃或室温孵育30分钟。
4、将5μL的4X EC80激动剂添加至细胞,并在37℃或室温孵育30或60分钟。对于Gi偶联的GPCR,包含EC80毛喉素。
信号检测
1、在适当的化合物孵育之后,通过以下方式产生测定信号:在室温下,用20μLcAMPXS+ED/CL裂解混合物孵育一个小时,然后用20μL cAMP XS+EA试剂孵育三个小时。
2、在用PerkinElmer EnvisionTM仪器产生信号以进行化学发光信号检测之后读取微孔板。
数据分析
1、使用CBIS数据分析套件(ChemInnovation,CA)分析化合物活性。
2、对于Gs激动剂模式测定,使用以下公式计算出活性百分比:
活性%=100%x(测试样品的平均RLU-载剂对照的平均RLU)/(MAX对照的平均RLU-载剂对照的平均RLU)。
3、对于Gs正向变构模式测定,使用以下公式计算出调节百分比:http://www.eurofinsdiscoveryservices.com Confidential 6/25/2021
5%调节=100%x(测试样品的平均RLU-EC20对照的平均RLU)/(MAX对照的平均RLU-EC20对照的平均RLU)。
4、对于Gs拮抗剂或反向变构模式测定,使用以下公式计算出抑制百分比:抑制%=100%x(1-(测试样品的平均RLU-载剂对照的平均RLU)/(EC80对照的平均RLU-载剂对照的平均RLU))。
5、对于Gi激动剂模式测定,使用以下公式计算出活性百分比:
活性%=100%x(1-(测试样品的平均RLU-MAX对照的平均RLU)/(载剂对照的平均RLU-MAX对照的平均RLU))。
6、对于Gi正向变构模式测定,使用以下公式计算出调节百分比:调节%=100%x(1-(测试样品的平均RLU-MAX对照的平均RLU)/(EC20对照的平均RLU-MAX对照的平均RLU))。
7、对于Gi反向激动剂模式测定,使用以下公式计算出活性百分比:反向激动剂活性%=100%x((测试样品的平均RLU-EC20毛喉素的平均RLU/(毛喉素阳性对照的平均RLU-EC20对照的平均RLU))
8、对于Gi拮抗剂或反向变构模式测定,使用以下公式计算出抑制百分比:抑制%=100%x(测试样品的平均RLU-EC80对照的平均RLU)/(毛喉素阳性对照的平均RLU-EC80对照的平均RLU)。
对于激动剂和拮抗剂测定,将数据归一化为在对照配体和载剂存在下所观察到的最大和最小应答。
对于Gi cAMP测定,使用以下毛喉素浓度:
RXFP3 cAMP:20μM毛喉素
RXFP4 cAMP:20μM毛喉素
使用以下EC80浓度:
RXFP3 cAMP:0.0003μM松弛素-3
RXFP4 cAMP:0.01μM松弛素-3
Lauflumide在大鼠严重疲劳模型中的作用
在以下实施例中,Lauflumide也称为NLS-4。
材料和方法
为了将应激降至最低,对动物进行了仔细的操作。所有实验均是按照法国农业部对用实验动物实验的指南(2013-118号法则)进行的。
实验在标准条件(T°=22.0±1.5℃)下进行,在安静条件(除通风和实验所用设备产生的噪音外,无噪音)下使用人造光。
实验以盲法进行。
在研究之前,动物没有经受过其他实验。
动物
药物
睡眠剥夺程序
将动物单独饲养在透明聚碳酸酯笼子(1354G欧洲标准IV型笼子,Tecniplast,意大利,595×380×200mm,占地面积=1820cm
在12/12小时光照/黑暗循环的相同时段在正常条件下饲养Sham组。
每天对动物称重。
昼夜节律活动记录
疲劳期结束之后,在12小时/12小时循环下,将动物置于透明聚碳酸酯笼(E型,Iffa-Credo,法国,450×300×200mm,占地面积=1032cm
各组
使76只动物经受如上所述的疲劳程序和测试。将12只动物(Sham组)在标准条件下进行饲养。
疲劳程序结束之后,将动物分为10组,在测试前接受(总计:3次施用)经口(p.o.,口腔灌胃)施用:
-Sham(无疲劳)组(N=12):载剂。
-对照组(N=11):载剂。
-莫达非尼32(N=10):莫达非尼(32mg/kg)。
-莫达非尼64(N=10):莫达非尼(64mg/kg)。
-莫达非尼128(N=5):莫达非尼(128mg/kg)。
-NLS-4 16(N=5):NLS-4(16mg/kg)。
-NLS-4 32(N=10):NLS-4(32mg/kg)。
-NLS-4 64(N=10):NLS-4(64mg/kg)。
-NLS-4 128(N=10):NLS-4(128mg/kg)。
-NLS-4 256(N=5):NLS-4(256mg/kg)。
数据分析
读数:在24小时时段、12小时黑暗和光照时段以及2小时时段中所行的距离。
将数据表示为平均值和平均值的标准差(SEM)。
统计学分析:学生t检验,重复测量的ANOVA。
在p≤0.05时,差异被认为统计学上显著。
结果
昼夜节律活动
对睡眠剥夺的作用
如图1所示:
-在第1天和第2天,对照组在黑暗阶段中所行的距离低于Sham组,而在第3天,组之间没有显著差异。
-在第1天,对照组在光照阶段中所行的距离高于Sham组,而在第2天和第3天,组之间没有显著差异。
如图2所示:
-在第1天,对照组在两个阶段(整个24小时时段)中所行的总距离倾向于低于Sham组,而在第2天和第3天,对照组与Sham组之间没有显著差异。
如图3所示:
-在第1天、第2天和第3天,对照组在黑暗阶段与光照阶段之间的所行距离之差低于Sham组。
图4中示出了在黑暗阶段和光照阶段的每个2小时时段中所行的距离。
在第1天,重复测量ANOVA表明:
-在黑暗阶段中,如上所述对照组所行的总距离低于Sham组(显著的组效果),并且在12小时时段中的移动活动变化在组之间有差异(显著的组×时段相互作用)。
-在光照阶段中,如上所述对照组所行的总距离高于Sham组(显著的组效果),但在12小时时段中的移动活动变化在组之间没有显著差异(组×时段相互作用:ns)。
在第2天,重复测量ANOVA表明:
-在黑暗阶段中,如上所述对照组所行的总距离低于Sham组(显著的组效果),但在12小时时段中的移动活动变化在组之间没有显著差异(组×时段相互作用:ns)。
-在光照阶段中,如上所述所行的总距离在组之间没有显著差异(组效果:ns),但在12小时时段中的移动活动变化在组之间有差异(显著的组×时段相互作用)。
在第3天,重复测量ANOVA表明:
-在黑暗阶段中,如上所述对照组所行的总距离倾向于低于Sham组(几乎显著的组效果),并且在12小时时段中的移动活动变化在组之间有差异(显著的组×时段相互作用)。
-在光照阶段中,如上所述所行的总距离在组之间没有显著差异(组效果:ns),但在12小时时段中的移动活动变化在组之间有差异(显著的组×时段相互作用)。
结论:
莫达非尼的作用
如所示Erreur!Source du renvoi introuvable.,用莫达非尼处理的大鼠在黑暗阶段和光照阶段中所行的距离:
-在第1、2和3天的黑暗时段和光照时段中在莫达非尼32组与对照组之间没有显著差异。
-在黑暗时段中莫达非尼64组高于对照组,而在第1、2和3天的光照时段中在这两组之间没有显著差异。
-在仅第1天和第2天的黑暗时段中莫达非尼128组高于对照组,而在第1、2和3天的光照时段中在这两组之间没有显著差异;但应该注意的是,莫达非尼(128mg/kg)还使得在第1天的黑暗阶段中所行的距离与Sham组相比是增加的。
如图6所示:
-在整个24小时时段中的总距离:
ο在第1、2和3天莫达非尼32组与对照组之间没有显著差异。
ο在第1、2和3天莫达非尼64组高于对照组。
-在仅第1天莫达非尼128组高于对照组;但应该注意的是,莫达非尼(128mg/kg)还使得在第1天所行的距离与Sham组相比是增加的。
如图7所示:
-在黑暗阶段与光照阶段之间的所行距离之差:
ο在第1、2和3天莫达非尼32组与对照组之间没有显著差异。
ο在第1、2和3天莫达非尼64组高于对照组。
ο在仅第1天和第2天莫达非尼128组高于对照组。
图8、图9和图10中示出了在黑暗阶段和光照阶段的每个2小时时段中所行的距离。如上所述,这些结果表明,莫达非尼可以使得在黑暗阶段中所行的距离增加,而诱导在光照时段中对活动的作用较小。
结论:
Lauflumide(NLS-4)的作用
如所示Erreur!Source du renvoi introuvable.,用NLS-4处理的大鼠在黑暗阶段和光照阶段中所行的距离:
-在第1、2和3天的黑暗阶段中NLS-4 16组高于对照组,而在光照阶段中在NLS-416组与对照组之间没有显著差异;但应该注意的是,NLS-4(16mg/kg)还使得在第1天的光照阶段中以及在第3天的黑暗阶段中所行的距离与Sham组相比是增加的。
-在第1、2和3天的黑暗阶段中NLS-4 32组高于对照组,而在光照阶段中在NLS-432组与对照组之间没有显著差异;但应该注意的是,NLS-4(32mg/kg)还使得在第1、2和3天的光照阶段中以及在第2天和第3天的黑暗阶段中所行的距离与Sham组相比是增加的。
-在第1、2和3天的黑暗阶段中以及在仅第3天的光照阶段中NLS-4 64组高于对照组;应该注意的是,NLS-4(64mg/kg)还使得在第1、2和3天的黑暗阶段和光照阶段中所行的距离与Sham组相比均是增加的。
-在第1、2和3天的黑暗阶段和光照阶段中NLS-4 128组均高于对照组;应该注意的是,NLS-4(128mg/kg)还使得在第1、2和3天的黑暗阶段和光照阶段中所行的距离与Sham组相比均是增加的。
-在第1、2和3天的黑暗阶段和光照阶段中NLS-4 256组均高于对照组;应该注意的是,NLS-4(256mg/kg)还使得在第1、2和3天的黑暗阶段和光照阶段中所行的距离与Sham组相比均是增加的。
如图12所示:
-在第1、2和3天NLS-4 16组、32组、64组、128组和256组在整个24小时时段中所行的总距离高于对照组;但应该注意的是,NLS-4(32-256mg/kg)还使得在第1、2和3天所行的距离与Sham组相比是增加的。
如图13所示:
-在第1、2和3天NLS-4 16组、32组、64组、128组和256组在黑暗阶段与光照阶段之间的所行距离之差高于或倾向于高于对照组;但应该注意的是,NLS-4(16-256mg/kg)还使得在仅第3天(16mg/kg、32mg/kg和256mg/kg)以及在第1、2和3天(64mg/kg和128mg/kg)所行的距离与Sham组相比是增加的。
图14、图15、图16、图17和图18中示出了在黑暗阶段和光照阶段的每个2小时时段中所行的距离。如上所述,这些结果表明,NLS-4剂量依赖性地增加了在黑暗阶段中所行的距离并诱导了在光照时段中对活动的作用较小,而且NLS-4在施用后使得在前2小时时段(16mg/kg)中、在8小时时段(32mg/kg)中以及在10小时时段(64-256mg/kg)中所行的距离显著增加。
结论:
NLS-4与莫达非尼的比较
图19中示出了所有组的大鼠在黑暗阶段和光照阶段中所行的距离。
如上所述,通过莫达非尼(128mg/kg)和NLS-4(32mg/kg、64mg/kg、128mg/kg和256mg/kg)显著增加了在整个24小时时段中所行的总距离(图20)。此外,如图21所示,通过疲劳程序显著降低了黑暗阶段与光照阶段之间的所行距离之差,表明昼夜节律活动受损。与对照(疲劳)组相比,莫达非尼(64mg/kg、128mg/kg)和所有剂量的NLS-4显著增加了黑暗阶段与光照阶段之间的所行距离之差。
较高剂量的莫达非尼和NLS-4具有高度显著的运动刺激作用。因此,我们将NLS-4组与莫达非尼组的比较集中于NLS-4 16组、莫达非尼32组和莫达非尼64组。
图22示出了在黑暗阶段和光照阶段中所行的距离:
-对于莫达非尼32组:
ο在第1、2和3天的黑暗时段和光照时段中与对照组均没有显著差异。
ο在仅第1天和第2天的黑暗阶段中低于Sham组,而在仅第1天的光照阶段中高于Sham组。
-对于莫达非尼64组:
ο在第1、2和3天的黑暗时段中高于对照组,而在第1、2和3天的光照阶段中与对照组没有显著差异。
ο在第1、2和3天的黑暗时段和光照时段中与Sham组均没有显著差异。
-对于NLS-4 16组:
ο在第1、2和3天的黑暗时段中高于对照组,并且在仅第1天的光照时段中也高于对照组。
ο在仅第3天的黑暗时段中高于Sham组,并且在仅第1天的光照时段中高于对照组。
ο在仅第3天的黑暗时段中以及在仅第1天的光照时段中高于莫达非尼32组。
ο在第1、2和3天的黑暗时段和光照时段中与莫达非尼64组均没有显著差异。
如图23所示,在整个24小时时段中的总距离:
-对于莫达非尼32组:
ο在第1、2和3天与对照组和Sham组均没有显著差异。
-对于莫达非尼64组:
ο在第1、2和3天高于对照组。
ο在第1、2和3天与Sham组没有显著差异。
-对于NLS-4 16组:
ο在第1、2和3天高于对照组。
ο在第1、2和3天与Sham组没有显著差异。
ο在仅第3天高于莫达非尼32组。
ο在第1、2和3天与莫达非尼64组没有显著差异。
如图24所示,在黑暗阶段与光照阶段之间的所行距离之差:
-对于莫达非尼32组:
ο在第1、2和3天与对照组没有显著差异。
ο在仅第1天和第2天不低于Sham组。
-对于莫达非尼64组:
ο在第1、2和3天高于对照组。
ο在第1、2和3天与Sham组没有显著差异。
-对于NLS-4 16组:
ο在第1、2和3天高于或倾向于高于对照组。
ο在仅第3天高于Sham组。
ο在仅第2天和第3天高于莫达非尼32组。
ο在第1、2和3天与莫达非尼64组没有显著差异。
图25中示出了在黑暗阶段和光照阶段的每个2小时时段中所行的距离。这些结果表明,莫达非尼(32mg/kg、64mg/kg)和NLS-4(16mg/kg)在给药后使得在前2小时时段中的运动活动增加。在接下来的22小时中莫达非尼(32mg/kg)几乎没有或根本没有诱导活动改变。莫达非尼(64mg/kg)和NLS-4(16mg/kg)所诱导的运动活动的增加更具可持续性,尤其是在第2天和第3天,并且NLS-4(16mg/kg)倾向于比莫达非尼(64mg/kg)更为明显。
NLS-4 16组和莫达非尼64组在统计学上没有差异,除了显著的组×时段相互作用,该相互作用在第1天有显著差异,因为在第一次给药后莫达非尼64组在前2小时时段中的过度活跃高于NLS-4 16组。另一方面,在第2天和第3天的黑暗时段中,NLS-4 16组与莫达非尼32组有显著差异,即更活跃。
结论:
体重
疲劳程序诱导了体重下降。疲劳程序中断后,体重增长曲线恢复正常,体重减轻在测试期间保持不变。莫达非尼(32-128mg/kg)和NLS-4(16mg/kg)没有改变体重减轻,但NLS-4(32-256mg/kg)加重了体重减轻。
参考文献
1.Tenforde MW,Kim SS,Lindsell CJ,等人,Symptom Duration and RiskFactors for Delayed Return to Usual Health Among Outpatients with COVID-19ina Multistate Health Care Systems Network-United States,2020年3月-6月.MMWRMorb Mortal Wkly Rep.2020;69(30):993-998.doi:10.15585/mmwr.mm6930e1
2.Hellwig S,Domschke K.[Post-COVID syndrome-Focus fatigue].Nervenarzt.5月23日在线发布,2022:1-7.doi:10.1007/s00115-022-01306-1
3.Huang B,Niu Y,Zhao W,Bao P,Li D.Reduced Sleep in the Week Prior toDiagnosis of COVID-19is Associated with the Severity of COVID-19.Nat SciSleep.2020;12:999-1007.doi:10.2147/NSS.S263488
4.Huang C,Huang L,Wang Y,等人,6-month consequences of COVID-19 inpatients discharged from hospital:a cohort study.Lancet.2021;397(10270):220-232.doi:10.1016/S0140-6736(20)32656-8
5.Premraj L,Kannapadi NV,Briggs J,等人,Mid and long-term neurologicaland neuropsychiatric manifestations of post-COVID-19syndrome:Ameta-analysis.JNeurol Sci.2022;434:120162-120162.doi:10.1016/j.jns.2022.120162
6.Alwan NA,Johnson L.Defining long COVID:Going back to the start.Med(N Y).2021;2(5):501-504.doi:10.1016/j.medj.2021.03.003
7.Renaud-Charest O,Lui LMW,Eskander S,等人,Onset and frequency ofdepression in post-COVID-19syndrome:A systematic review.Journal ofPsychiatric Research.2021;144:129-137.doi:10.1016/j.jpsychires.2021.09.054
8.Benítez ID,Moncusí-Moix A,Vaca R,等人,Sleep and Circadian Health ofCritical COVID-19Survivors 3Months After Hospital Discharge.Crit CareMed.2022;50(6):945-954.doi:10.1097/CCM.0000000000005476
9.Boiko DI,Skrypnikov AM,Shkodina AD,Hasan MM,Ashraf GM,RahmanMH.Circadian rhythm disorder and anxiety as mental health complications inpost-COVID-19.Environ Sci Pollut Res Int.2022;29(19):28062-28069.doi:10.1007/s11356-021-18384-4
10.Ceban F,Ling S,Lui LMW,等人,Fatigue and cognitive impairment inPost-COVID-19Syndrome:A systematic review and meta-analysis.Brain,Behavior,and Immunity.2022;101:93-135.doi:10.1016/j.bbi.2021.12.020
11.McCarthy MJ.Circadian rhythm disruption in MyalgicEncephalomyelitis/Chronic Fatigue Syndrome:Implications for the post-acutesequelae of COVID-19.Brain,Behavior,&Immunity-Health.2022;20:100412.doi:10.1016/j.bbih.2022.100412
12.Wong TL,Weitzer DJ.Long COVID and Myalgic Encephalomyelitis/Chronic Fatigue Syndrome(ME/CFS)-A Systemic Review and Comparison of ClinicalPresentation and Symptomatology.Medicina(Kaunas).2021;57(5).doi:10.3390/medicina57050418
13.Fukuda K,Straus SE,Hickie I,Sharpe MC,Dobbins JG,Komaroff A.Thechronic fatigue syndrome:a comprehensive approach to its definition andstudy.International Chronic Fatigue Syndrome Study Group.Ann Intern Med.1994;121(12):953-959.doi:10.7326/0003-4819-121-12-199412150-00009
14.Reeves WC,Lloyd A,Vernon SD,等人,Identification of ambiguities inthe 1994chronic fatigue syndrome research case definition and recommendationsfor resolution.BMC Health Serv Res.2003;3(1):25.doi:10.1186/1472-6963-3-25
15.Beyond Myalgic Encephalomyelitis/Chronic Fatigue Syndrome:Redefining an Illness.National Academies Press(US);2015.doi:10.17226/19012
16.Lam MHB,Wing YK,Yu MWM,等人,Mental morbidities and chronic fatiguein severe acute respiratory syndrome survivors:long-term follow-up.ArchIntern Med.2009;169(22):2142-2147.doi:10.1001/archinternmed.2009.384
17.Moldofsky H,Patcai J.Chronic widespread musculoskeletal pain,fatigue,depression and disordered sleep in chronic post-SARS syndrome;a case-controlled study.BMC Neurol.2011;11:37.doi:10.1186/1471-2377-11-37
18.Komaroff AL,Bateman L.Will COVID-19Lead to MyalgicEncephalomyelitis/Chronic Fatigue Syndrome?Front Med(Lausanne).2020;7:606824.doi:10.3389/fmed.2020.606824
19.Toogood PL,Clauw DJ,Phadke S,Hoffman D.Myalgic encephalomyelitis/chronic fatigue syndrome(ME/CFS):Where will the drugs come from?PharmacolRes.2021;165:105465.doi:10.1016/j.phrs.2021.105465
20.Advisory Panel Members Worry About Potential for Abuse of DrugThat’sSimilar to GHB.FDA Panel Rejects Xyrem as FibromyalgiaTreatment.www.webmd.com/fibromyalgia/news/20100820/fda-panel-rejects-xyrem-as-fibromyalgi a-treatment
21.A Trial of Solriamfetol in the Treatment of MyalgicEncephalomyelitis/Chronic Fatigue Syndrome.https://clinicaltrials.gov/ct2/show/NCT04622293
22.Fletcher MA,Rosenthal M,Antoni M,等人,Plasma neuropeptide Y:abiomarker for symptom severity in chronic fatigue syndrome.Behav BrainFunct.2010;6:76.doi:10.1186/1744-9081-6-76
23.Morales-Medina JC,Dumont Y,Benoit CE,等人,Role of neuropeptide YY1and Y2receptors on behavioral despair in a rat model of depression with co-morbid anxiety.Neuropharmacology.2012;62(1):200-208.doi:10.1016/j.neuropharm.2011.06.030
24.Giovannini MG,Efoudebe M,Passani MB,等人,Improvement in fearmemory by histamine-elicited ERK2 activation in hippocampal CA3cells.JNeurosci.2003;23(27):9016-9023.doi:10.1523/JNEUROSCI.23-27-09016.2003
25.
26.Silva-Marques B,
27.Milgram NW.Adrafinil:Anovel vigilance promoting agent.CNSDrugReview.1999;5(3):193-212.
28.Lucas I,Mulraney M,Sciberras E.Sleep problems and daytimesleepiness in children with ADHD:Associations with social,emotional,andbehavioral functioning at school,a cross-sectional study.Behav SleepMed.2019;17(4):411-422.doi:10.1080/15402002.2017.1376207
29.Wisor JP,Nishino S,Sora I,Uhl GH,Mignot E,Edgar DM.Dopaminergicrole in stimulant-induced wakefulness.J Neurosci.2001;21(5):1787-1794.doi:10.1523/JNEUROSCI.21-05-01787.2001
30.Wisor JP,Dement WC,Aimone L,Williams M,Bozyczko-CoyneD.Armodafinil,the R-enantiomer of modafinil:wake-promoting effects andpharmacokinetic profile in the rat.Pharmacol Biochem Behav.2006;85(3):492-499.doi:10.1016/j.pbb.2006.09.018
31.Bobak MJ,Weber MW,Doellman MA,等人,Modafinil Activates PhasicDopamine Signaling in Dorsal and Ventral Striata.J Pharmacol Exp Ther.2016;359(3):460-470.doi:10.1124/jpet.116.236000
32.Dunn D,Hostetler G,Iqbal M,等人,Wake-promoting agents:search fornext generation modafinil:part II.Bioorg Med Chem Lett.2012;22(6):2315-2317.doi:10.1016/j.bmcl.2012.01.064
33.Turner C,Belyavin AJ,Nicholson AN.Duration of activity and mode ofaction of modafinil:Studies on sleep and wakefulness in humans.JPsychopharmacol.2014;28(7):643-654.doi:10.1177/0269881113508173
34.Mereu M,Bonci A,Newman AH,Tanda G.The neurobiology of modafinil asan enhancer of cognitive performance and a potential treatment for substanceuse disorders.Psychopharmacology(Berl).2013;229(3):415-434.doi:10.1007/s00213-013-3232-4
35.Mereu M,Chun LE,Prisinzano TE,Newman AH,Katz JL,Tanda G.The uniquepsychostimulant profile of(±)-modafinil:investigation of behavioral andneurochemical effects in mice.Eur J Neurosci.2017;45(1):167-174.doi:10.1111/ejn.13376
36.Rambert FA,Pessonnier J,de Sereville JE,Pointeau AM,Duteil J.[Aunique psychopharmacologic profile of adrafinil in mice].J Pharmacol.1986;17(1):37-52.
37.Bernardi RE,Broccoli L,Spanagel R,Hansson AC.Sex differences indopamine binding and modafinil conditioned place preference in mice.DrugAlcohol Depend.2015;155:37-44.doi:10.1016/j.drugalcdep.2015.08.016
38.Wuo-Silva R,Fukushiro DF,
39.Bayard S,Langenier MC,Dauvilliers Y.Effect of psychostimulants onimpulsivity and risk taking in narcolepsy with cataplexy.Sleep.2013;36(9):1335-1340.doi:10.5665/sleep.2958
40.Ma S,Smith CM,Blasiak A,Gundlach AL.Distribution,physiology andpharmacology of relaxin-3/RXFP3 systems in brain.Br J Pharmacol.2017;174(10):1034-1048.doi:10.1111/bph.13659
41.Ma S,Gundlach AL.Ascending control of arousal and motivation:roleof nucleus incertus and its peptide neuromodulators in behavioural responsesto stress.J Neuroendocrinol.2015;27(6):457-467.doi:10.1111/jne.12259
42.Smith CM,Shen PJ,Banerjee A,等人,Distribution of relaxin-3andRXFP3 within arousal,stress,affective,and cognitive circuits of mouse brain.JComp Neurol.2010;518(19):4016-4045.doi:10.1002/cne.22442
43.Voglsanger LM,Read J,Ch’ng SS,等人,Differential Level of RXFP3Expression in Dopaminergic Neurons Within the Arcuate Nucleus,DorsomedialHypothalamus and Ventral Tegmental Area of RXFP3-Cre/tdTomato Mice.FrontNeurosci.2020;14:594818.doi:10.3389/fnins.2020.594818。
- N-3-2-氨基-5-(1,1-二氟乙基)-4,4a,5,7-四氢呋喃并3,4-d1,3噁嗪-7a-基-4-氟-苯基-5-(三氟甲基)吡啶-2-甲酰胺及其(4aR,5S,7aS)异构体作为选择性BACE1抑制剂用于治疗如阿尔茨海默病的用途
- 用于诊断和治疗的放射性谷氨酰胺衍生物及其制备方法
- 肌痛性脑脊髓炎/慢性疲劳综合症(ME/CFS)的生物标志物
- 用于治疗或预防纤维肌痛或慢性疲劳综合症的含有二胺氧化酶的组合物
