人体组织边缘QME检测系统
文献发布时间:2023-06-19 18:32:25
技术领域
本发明属于OCT检测技术领域,具体涉及一种人体组织边缘QME检测系统。
背景技术
现有的冷冻切片病理分析、细胞学印片以及近年来涌现的多种基于光谱学、显微成像、断层成像和荧光成像的新型成像方法,理论上均具备一定的癌变组织检测能力。但这些技术均未得到临床上的普遍应用。其主要原因是上述方法很难兼顾癌症检测的准确性和成像技术的临床实用性。
因此,亟需一种能够在外科手术过程中及时获取开放性手术切除边界的信息(如残余肿瘤的确证)的术中成像与检测仪器。
发明内容
本发明提供了一种人体组织边缘QME检测系统解决上述提到的技术问题,具体采用如下的技术方案:
一种人体组织边缘QME检测系统,包含:
OCT扫描成像装置,用于对待扫描生物样本进行扫描获取扫描数据;
图像采集装置,用于采集待扫描生物样本的图像数据;
处理器,用于根据所述图像采集装置采集到的图像数据确定待扫描生物样本的轮廓数据;
位移装置,连接至所述图像采集装置,所述位移装置根据所述处理器计算出的轮廓数据将所述OCT扫描成像装置移动到待扫描生物样本的上方区域;
力学激发装置,设置在所述OCT扫描成像装置和待扫描生物样本之间;
载物台,用于放置待扫描生物样本,所述载物台还用于对待扫描生物样本施加预应力将其向所述力学激发装置按压,使待扫描生物样本和所述力学激发装置保持紧密贴合;
所述处理器连接至所述OCT扫描成像装置、所述图像采集装置、所述位移装置、所述力学激发装置和所述载物台以控制上述装置;
所述处理器控制所述力学激发装置以一定频率和一定幅度上下挤压待扫描生物样本;
所述处理器还控制所述OCT扫描成像装置以对应的频率获取待扫描生物样本在挤压前的扫描数据和挤压后的扫描数据;
所述处理器根据所述OCT扫描成像装置获取到的待扫描生物样本在挤压前的扫描数据和挤压后的扫描数据计算待扫描生物样本的弹性模量,并将所述弹性模量与正常值进行比较判断待扫描生物样本的特性。
进一步地,所述力学激发装置包含:
力学激励器,用于产生固定频率的振动;
成像窗口,连接至所述力学激励器下方;
力学传感器,连接至所述成像窗口的下方,所述力学传感器用于与待扫描生物样本接触;
所述力学激励器电连接至所述处理器。
进一步地,所述人体组织边缘QME检测系统还包含:
信号发生器,连接至所述控制器,并在所述控制器的控制下产生预设频率的力学激发信号;
信号放大器,连接至所述信号发生器和所述力学激励器,所述信号放大器用于对所述信号发生器产生的力学激发信号进行放大,并将放大后的所述力学激发信号发送至所述力学激励器,所述力学激励器接收到所述力学激发信号后产生对应频率的振动从而上下挤压待扫描生物样本。
进一步地,所述力学激励器的振动幅度范围为大于等于5μm且小于等于10μm。
进一步地,所述力学传感器为硅酮力学传感器。
进一步地,所述处理器计算待扫描生物样本的弹性模量的方法为:
计算挤压前的扫描数据和挤压后的扫描数据差值,进行矢量积分计算得到待扫描生物样本的纵向位移,将所述纵向位移代入力学传感器预先标定好的应力应变曲线得到待扫描生物样本的所述弹性模量。
进一步地,所述处理器在待扫描生物样本的轮廓数据大于预设值时,将所述轮廓数据划分成多个子区域,所述位移装置按照划分的多个子区域逐一将所述OCT扫描成像装置移动至对应的所述子区域的上方进行数据采集,最后将每个子区域的数据进行拼接得到完整的扫描数据。
进一步地,所述OCT成像装置包含OCT扫描探头和OCT光电集成系统,所述OCT扫描探头内部采用共光路结构。
进一步地,所述图像采集装置为双目摄像头,所述图像采集装置连接至所述OCT扫描探头或所述位移装置上。
进一步地,所述位移装置为机械臂,所述机械臂的一端固定,所述OCT扫描探头固定至所述机械臂的另一端。
本发明的有益之处在于所提供的人体组织边缘QME检测系统,能够在外科手术过程中及时获取开放性手术过程中切除的生物组织的信息,便于医生及时判断手术的进展情况。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1是本发明的一种人体组织边缘QME检测系统的示意图;
图2是本发明的一种人体组织边缘QME检测系统的力学激发装置的示意图;
图3是本发明的对大视场分割的示意图;
图4是本发明的OCT扫描探头中的光路图。
具体实施方式
下面详细描述本发明的实施例,实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
在本发明的描述中,除非另有明确的规定和限定,术语“相连”、“连接”、“固定”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
在本发明中,除非另有明确的规定和限定,第一特征在第二特征之“上”或之“下”可以包括第一和第二特征直接接触,也可以包括第一和第二特征不是直接接触而是通过它们之间的另外的特征接触。而且,第一特征在第二特征“之上”、“上方”和“上面”包括第一特征在第二特征正上方和斜上方,或仅仅表示第一特征水平高度高于第二特征。第一特征在第二特征“之下”、“下方”和“下面”包括第一特征在第二特征正下方和斜下方,或仅仅表示第一特征水平高度小于第二特征。
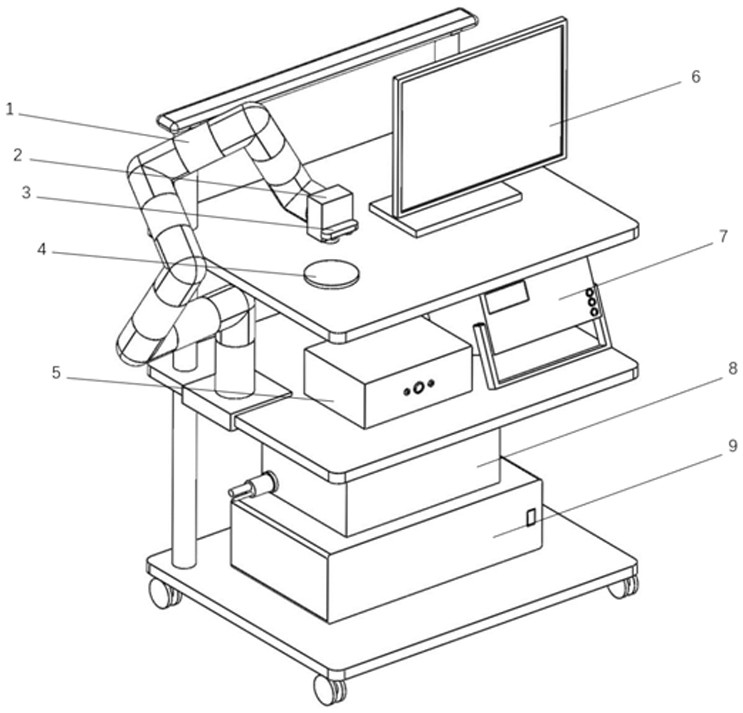
为了能够在手术过程中及时对生物组织进行信息判断,本申请提出了一种基于OCT(Optical Coherence Tomography)扫描成像的定量微观弹性成像技术QME(Quantitative Micro-Elastography)。具体地,如图1所示为本申请的一种人体组织边缘QME检测系统,包含:OCT扫描成像装置、图像采集装置3、处理器9、位移装置1、力学激发装置和载物台4。其中,OCT扫描成像装置用于对待扫描生物样本14进行扫描获取扫描数据。图像采集装置3用于采集待扫描生物样本14的图像数据。处理器9用于根据图像采集装置3采集到的图像数据确定待扫描生物样本14的轮廓数据。处理器9通过对图像采集装置3采集到的图像数据进行图像处理、分析以及数据计算得到待扫描生物样本14的轮廓的三维数据。位移装置1连接至图像采集装置3,位移装置1根据处理器9计算出的轮廓数据将OCT扫描成像装置移动到待扫描生物样本14的上方区域。力学激发装置设置在OCT扫描成像装置和待扫描生物样本14之间。载物台4用于放置待扫描生物样本14。载物台4还用于对待扫描生物样本14施加预应力将其向力学激发装置按压,使待扫描生物样本14和力学激发装置保持紧密贴合。可以理解的是,载物台4中设有驱动电机,控制器控制驱动电机,驱动载物台升高,从而将待扫描生物样本14压向力学激发装置。
待扫描生物样本14置于载物台4上,力学激发装置用于对待扫描生物样本14施加预应力。
具体地,处理器9连接至OCT扫描成像装置、图像采集装置3、位移装置1、力学激发装置和载物台4以控制上述装置。处理器9控制力学激发装置以一定频率和一定幅度上下挤压待扫描生物样本14。处理器9还控制OCT扫描成像装置以对应的频率获取待扫描生物样本14在挤压前的扫描数据和挤压后的扫描数据。处理器9根据OCT扫描成像装置获取到的待扫描生物样本14在挤压前的扫描数据和挤压后的扫描数据计算待扫描生物样本14的弹性模量,并将弹性模量与正常值进行比较,根据两者的差异判断待扫描生物样本14的特性。正常生物组织的弹性模量与肿瘤生物组织的弹性模量是存在差异的。因此,通过将计算得到的弹性模量与正常值进行比较能够判断待扫描生物组织是否存在肿瘤。
作为一种优选的实施方式,如图2所示,力学激发装置包含: 力学激励器10、成像窗口11和力学传感器13。具体地,力学激励器10为环形力学激励器10,其用于产生固定频率的振动。成像窗口11为玻璃材质制成,连接至力学激励器10下方。成像窗口11的下表面为参考基准面12。载物台4对待扫描生物样本14施加预应力将其向成像窗口11的下表面按压,使之更加靠近成像窗口11。力学传感器13连接至成像窗口11的下方,力学传感器13用于与待扫描生物样本14接触。力学激励器10电连接至处理器9。
具体而言,力学激励器10的振动幅度范围为大于等于5μm且小于等于10μm。在本申请中,力学激励器10的振动幅度为5μm。优选的,力学传感器13为硅酮力学传感器13,优选地,力学传感器为硅酮薄膜。
如图1所示,人体组织边缘QME检测系统还包含:信号发生器7和信号放大器5。
信号发生器7连接至控制器,并在控制器的控制下产生预设频率的力学激发信号。在本申请中,信号发生器7的型号为Keysight33500BSeries Trueform。信号放大器5连接至信号发生器7和力学激励器10,信号放大器5用于对信号发生器7产生的力学激发信号进行放大,并将放大后的力学激发信号发送至力学激励器10,力学激励器10接收到力学激发信号后产生对应频率的振动,力学激励器10在振动的同时,通过连接在其上的成像窗口11和力学传感器13,上下挤压待扫描生物样本14。在本申请中,信号放大器5的型号为德国Piezomechanik GmbH公司的LE/200/070/EBW,力学激励器10的型号采用德国Piezomechanik GmbH公司的定制款。
在本申请中,处理器9计算待扫描生物样本14的弹性模量的方法为:
计算挤压前的扫描数据和挤压后的扫描数据差值,进行矢量积分计算得到待扫描生物样本14在每个平面坐标点(参考基准面12的坐标点)的纵向位移,将纵向位移代入力学传感器13预先标定好的应力应变曲线,得到该平面坐标点对应的待扫描生物样本14的弹性模量。
作为一种优选的实施方式,处理器9在待扫描生物样本14的轮廓数据大于预设值时,将轮廓数据划分成多个子区域,位移装置1按照划分的多个子区域逐一将OCT扫描成像装置移动至对应的子区域的上方进行数据采集,最后将每个子区域的数据进行拼接得到完整的扫描数据。
可以理解的是,在本申请中,OCT成像装置一次性能够实现15mm*15mm的扫描。因此,若待扫描生物样本14不超过这个数值范围,则单次扫描即可完成扫描数据的获取。当待扫描生物样本14超过这个范围时,如图3所示,处理器9会先将大视场划分为多个子区域15。位移装置1将OCT扫描成像装置分别移动至每一个子区域15的上方进行扫描,采集数据。当完成对每个子区域15进行扫描后,将每个子区域15的数据进行拼接得到完整的扫描数据。
作为一种优选的实施方式,OCT成像装置包含OCT扫描探头2和OCT光电集成系统8,本申请中,OCT成像装置采用共光路结构。OCT扫描探头2中的光路图参考图4。具体地,由单模光纤导入的光源16经过准直仪17形成平行光束,通过棱镜18改变光路方向,进入分光器19后,平行光束进入样本光路,通过两个扫描振镜20配合,调节光路至合适的角度,进入最后的扫描镜头22,反射回来的干涉光21经过扫描振镜20后,被图2中的光谱仪接收后进一步分析。在本申请中,采用共光路结构,将参考光路去掉。光源全部进入样本光路。而成像窗口11的下表面提供了较强的镜面反射,从而成为新的参考基准面12。光路改进后其中一个优势在于,光路部分简化,使得OCT扫描探头2更加轻便,从而适于位移装置1夹持。同时,由于参考光路与样本光路在到达参考基准面12之前的部分均相同,光的色散以及偏振效应相同,不再需要旧的分光光路结构中所需的后续数据色散补偿操作。从而对光学信号相位的检测稳定性也更高,对于矢量积分算法有了物理上稳定性的支撑。
图像采集装置3为双目摄像头,图像采集装置3连接至OCT扫描探头2上跟随OCT扫描探头2一起运动。可以理解的是,也可以将图像采集装置3设置在位移装置1上跟随位移装置1一起运动。位移装置1为机械臂,机械臂一端固定,OCT扫描探头2固定至机械臂的另一端。
优选的是,人体组织边缘QME检测系统还设有显示装置,用于展示扫描结果和相关数据。
以上显示和描述了本发明的基本原理、主要特征和优点。本行业的技术人员应该了解,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 血管图像组织结构的边缘检测及血管内膜检测方法和系统
- 血管图像组织结构的边缘检测及血管内膜检测方法和系统
