一种N-磺酸化肝素前体寡糖的制备方法
文献发布时间:2024-01-17 01:27:33
技术领域
本发明涉及一种N-磺酸化肝素前体寡糖的制备方法,属于生物工程技术领域。
背景技术
肝素(Heparin)是一种高度磺酸化的糖胺聚糖,以低分子量肝素或五糖肝素形式进行抗凝血、抗血栓形成的临床治疗,但目前商品化低分子量肝素或五糖肝素主要通过动物源肝素产物解聚、化学合成等方式获得,容易存在产物结构不均一、功能基团丢失、化学试剂污染等问题。
肝素合成所需的磺酸化修饰过程中,首先需要硫酸乙酰肝素双功能N-脱乙酰/N-磺基转移酶对肝素前体进行N-脱乙酰和N-磺酸化,最终获得N-磺酸化肝素前体。N-磺酸化区域的分布不仅影响了后续修饰酶(葡萄糖醛酸异构酶、2-O-磺酸转移酶、6-O-磺酸转移酶和3-O磺酸转移酶)的磺酸化修饰水平,还对肝素终产物展现出的药物活性有重要影响。
现阶段肝素前体寡聚糖底物的获取方式主要依靠延伸糖链骨架、肝素裂解酶I解聚或化学合成,主要以偶数糖为主,常带有化学基团,同时由于硫酸乙酰肝素双功能N-脱乙酰/N-磺基转移酶的活性较低,更不利于N-磺酸化前体寡糖的获得。由于N-磺酸化底物的限制,针对后续肝素修饰酶的天然底物特异性研究仍有不足。因此开发一个无化学基团引入、特定尺寸的肝素前体寡糖及N-磺酸化前体寡糖制备方法对后续磺酸转移酶的相关研究、肝素寡糖产物的结构功能研究具有重要的意义。
发明内容
[技术问题]
本发明要解决的技术问题是提供一种全酶法制备肝素前体寡糖以及酶法制备N-磺酸化肝素前体寡糖的方法。
[技术方案]
本发明提供了一种制备肝素前体寡糖的方法,以高分子量肝素前体为底物,利用肝素裂解酶III和不饱和葡萄糖醛酸酶依次进行催化反应。
在一种实施方式中,所述方法具体步骤如下:
(1)利用500~8000U/L的肝素裂解酶III催化高分子量肝素前体,得不饱和偶数寡糖;
(2)利用0.1mg/ml~0.5mg/ml不饱和葡萄糖醛酸酶催化步骤(1)中的不饱和偶数寡糖,得饱和奇数寡糖。
在一种实施方式中,步骤(1)中,40~60℃温度下催化0.5~7h。
在一种实施方式中,步骤(2)中,25~35℃下催化1~15h。
在一种实施方式中,所述高分子量肝素前体的大小为2000~3000kDa。
在一种实施方式中,所述肝素裂解酶III的氨基酸序列如SEQ ID NO.1所示。
在一种是实施方式中,所述不饱和葡萄糖醛酸酶是NCBI Reference Sequence:WP_015808640.1所示序列。
在一种实施方式中,所述不饱和偶数寡糖包括不饱和二糖、四糖、六糖、八糖、十糖。
所述肝素前体不饱和偶数寡糖的结构为:
其中,n=0、1、2、3、4。
在一种实施方式中,所述饱和奇数寡糖包括饱和三糖、五糖、七糖、九糖。
所述肝素前体饱和奇数糖的结构为
其中,n=0、1、2、3。
本发明提供一种重组双功能N-脱乙酰/N-磺基转移酶,所述重组双功能N-脱乙酰/N-磺基转移酶由麦芽糖结合蛋白、接头序列和双功能N-脱乙酰/N-磺基转移酶NDST组成。
在一种实施方式中,所述NDST的氨基酸序列如SEQ ID NO.3所示。
在一种实施方式中,所述接头序列的序列为5’-GGCGGCGGCGGCAGC-3’。
在一种实施方式中,所述麦芽糖结合蛋白的氨基酸序列如SEQ ID NO.2示。
在一种实施方式中,NDST通过接头序列在N端连接麦芽糖结合蛋白。
本发明提供一种制备N-磺酸化肝素前体寡糖的方法,根据上述方法制备的肝素前体寡糖作为底物,在含有重组双功能N-脱乙酰/N-磺基转移酶的反应体系中催化得到N-磺酸化肝素前体寡糖。
在一种实施方式中,所述反应体系中含有3’-磷酸腺苷-5’-磷酸硫酸(PAPS)、甘油和CaCl
在一种实施方式中,反应体系中肝素前体寡糖的浓度为10mg/L-10g/L。
本发明提供了上述方法在制备医疗用品、保健品、食品及化妆品中的应用。
本发明提供了上述方法在合成肝素寡糖方面的应用。
[有益效果]
1、本发明采用生物酶法降解高分子量肝素前体,通过控制酶的添加量实现特定聚合度的肝素前体寡糖的制备,利用肝素裂解酶III和不饱和葡萄糖醛酸酶对高分子量肝素前体的依次降解,成功制备获得不同聚合度的不饱和偶数寡糖和饱和奇数寡糖。
2、同时,使用双功能N-脱乙酰/N-磺基转移酶进行N-磺酸化修饰后的肝素前体寡糖具有长聚合度、多样性的优点,对于后续特定尺寸肝素寡糖的合成、结构与功能关系的相关研究以及后续修饰酶的催化研究具有重要的意义。
3、本发明提供的双功能N-脱乙酰/N-磺基转移酶的N端通过接头序列连接有氨基酸序列如SEQ ID NO.2所示的麦芽糖结合蛋白,成功提高N-脱乙酰/N-磺基转移酶的酶活,与未融合麦芽糖结合蛋白的N-脱乙酰/N-磺基转移酶(4×10
附图说明
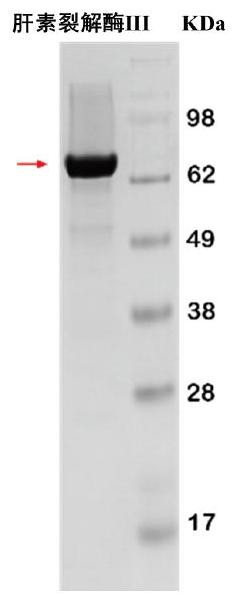
图1是肝素裂解酶III纯化酶的SDS-PAGE图。
图2a是两种酶浓度下的肝素裂解酶III裂解高分子量肝素前体的分子量变化趋势图。图2b为不同浓度的肝素裂解酶III裂解时高分子量肝素前体的分子量变化。
图3是所制备的不饱和偶数寡糖的结构示意图:肝素前体不饱和二糖(a)、四糖(b)、六糖(c)、八糖(d)、十糖(e)。
图4a是不同诱导浓度下不饱和糖醛酸酶的表达比较。图4b是不饱和糖醛酸酶纯化酶的SDS-PAGE图。图4c是不饱和糖醛酸酶的催化反应鉴定图。
图5是所制备的饱和奇数寡糖的结构示意图:肝素前体饱和三糖(a)、五糖(b)、七糖(c)、九糖(d)。
图6是硫酸乙酰肝素双功能N-脱乙酰/N-磺基转移酶的表达(a)和活性检测(b)。
图7是实施例6中双功能酶催化不饱和奇数四糖后检测到的N-磺酸化肝素前体四糖的质谱图。
图8是实施例6中双功能酶催化饱和奇数五糖后检测到的N-磺酸化肝素前体五糖的质谱图。
图9是对比例中肝素裂解酶III继续裂解饱和奇数糖的鉴定图(9a)和示意图(9b)。
具体实施方式
LB固体培养基(g/L):蛋白胨10,酵母粉5,氯化钠10,琼脂粉20。
LB液体培养基(g/L):蛋白胨10,酵母粉5,氯化钠10。
TB液体培养基(g/L):蛋白胨12,酵母粉24,甘油10,72mM K
YPD培养基(g/L):蛋白胨20,酵母粉10,葡萄糖20。
BMGY培养基(g/L):蛋白胨20,酵母粉10,YNB 13.4,生物素4×10
BMMY培养基(g/L):蛋白胨20,酵母粉10,YNB 13.4,生物素4×10
PB平衡缓冲液(pH 8.0):20mM NaH
PB洗脱缓冲液(pH 8.0):1M NaCl,20mM NaH
高分子量肝素前体(2000-3000kDa):制备方法参见文献Biosynthesis ofnon-sulfated high-molecular-weight glycosaminoglycans and specific-sized oligosaccharides.Carbohydr.Polym.2022,295,119829.
肝素前体分子量的测定:使用凝胶渗透色谱(GPC-HPLC)进行检测,以0.1M NaNO
不饱和葡萄糖醛酸酶酶活检测方法:酶活力单位定义为在30℃条件下每分钟修复1μmol不饱和葡萄糖醛酸所需的酶量。反应体系包括1.5mg/mL肝素钠裂解物(使用肝素裂解酶III裂解肝素钠)和200μL不饱和葡萄糖醛酸酶,混匀后使用分光光度计检测232nm波长下的吸光值变化。质谱检测体系中含有0.2mg/ml不饱和葡萄糖醛酸酶,1g/L不饱和偶数寡糖,于30℃条件下孵育12h后,加热灭活。灭活反应物使用0.22μm滤膜进行过滤,并使用超高效液相色谱串联四极杆飞行时间质谱联用仪鉴定分析。
摇瓶培养重组大肠杆菌制备肝素裂解酶III,所述重组大肠杆菌是以大肠杆菌为宿主表达了来源于拟杆菌的肝素裂解酶III E105R/S264F,所述重组大肠杆菌的构建方法参见文献:Engineering the heparin-binding pocket to enhance the catalyticefficiency ofa thermostable heparinase III fromBacteroidesthetaiotaomicron.Enzyme andMicrobial Technology,2020,137:109549.
首先,挑取重组大肠杆菌单菌落于LB培养基中制备种子液,然后以1%(v/v)的接种量转接到TB液体培养基中,在30℃下转速220rpm下培养3h后使用0.5mM IPTG进行诱导,于25℃继续进行培养16-20h。将发酵液于4℃进行离心(6000rpm、10min),弃掉上清,使用20mM Tris-HCl缓冲液重悬菌体2-3次,使用超声细胞破碎仪破碎后于12000rpm高速离心20min,获得粗酶液。粗酶液使用0.22μm滤膜进行过滤,并将过滤后的上清液通过AKTA纯化系统加载至镍柱上,使用含有20mM Tris-HCl缓冲液、500mM咪唑、500mM NaCl的洗脱液进行洗脱,获得纯化酶液用于裂解高分子量肝素前体。结果如图1所示,获得了肝素裂解酶IIIE105R/S264F的纯化酶液。
(1)高分子量底物解聚
使用实施例1制备的肝素裂解酶III E105R/S264F对高分子量肝素前体进行解聚。
将高分子量肝素前体粉末使用去离子水溶解至终浓度为10g/L,分别添加终浓度为500U/L、1000U/L的肝素裂解酶III E105R/S264F,在50℃温度下分别裂解0.5h、1h、2h、3h、4h、5h、6h,7h,反应结束后收集样品,沸水加热灭活,冷却后12000rpm离心10min,取上清液并经0.22μm滤膜过滤,收集样品。使用凝胶渗透色谱(GPC-HPLC)对样品进行分子量测定,根据保留时间计算裂解后的肝素前体的分子量。图2a所示为在肝素裂解酶III E105R/S264F两种不同浓度的裂解处理下,不同裂解时间高分子量肝素前体的分子量变化趋势图,可以看出,利用不同浓度的肝素裂解酶III E105R/S264F处理高分子量肝素前体可以得到不同分子量的肝素前体裂解物。
根据图2a结果,分别添加终浓度为500U/L、1000U/L、2000U/L、5000U/L、8000U/L的肝素裂解酶III E105R/S264F,在50℃温度下裂解1h,沸水加热灭活,冷却后12000rpm离心10min,取上清液并经0.22μm滤膜过滤,收集样品。使用凝胶渗透色谱(GPC-HPLC)对样品进行分子量测定,根据保留时间计算裂解后的肝素前体的分子量。图2b为不同浓度的肝素裂解酶III E105R/S264F裂解时高分子量肝素前体的分子量变化,得到一系列不同分子量的肝素前体裂解物。
(2)不饱和偶数寡糖的分离
使用PB平衡缓冲液(pH 8.0)和含有1M NaCl的PB洗脱缓冲液(pH 8.0)在阴离子交换柱HiPrep 16/10Q(柱体积:20mL)对步骤(1)制备的肝素前体裂解物进行分离。以3mL/min流速进行平衡并上样10mL步骤(1)中收集的样品,用洗脱液进行线性梯度洗脱,NaCl的浓度范围从0-1M进行梯度变化,洗脱体积为3倍柱体积,在AKTA蛋白纯化仪上配备96孔板进行单一峰收集,将96孔板的液体收集后进行浓缩,将浓缩液经凝胶脱盐柱,收集在232nm下的寡糖峰,用超高效液相色谱串联四极杆飞行时间质谱联用仪(MALDI SYNAPT MS)鉴定收集产物,实现肝素前体不饱和二糖、四糖、六糖、八糖、十糖的分离,不饱和偶数寡糖结构如图3所示。
使用标准的PCR扩增体系和程序,合成不饱和葡萄糖醛酸酶的基因并将所得基因连接至pET32a质粒BamHI和HindIII酶切位点上,获得重组质粒,将重组质粒转入Escherichia coli BL21(DE3)中,培养后得到转化子,转化子经验证正确的即为阳性转化子,为表达不饱和葡萄糖醛酸酶的重组大肠杆菌菌株。
(1)摇瓶培养
将表达不饱和葡萄糖醛酸酶的的重组大肠杆菌接种于LB液体培养基中,经过37℃过夜培养后,将重组大肠杆菌转接于装有TB液体培养基的250mL三角摇瓶中,37℃培养2h,分别加入终浓度为0.1、0.2、0.5、1mM的IPTG诱导后,并置于25℃培养16-20h,收集发酵液。将发酵液在4℃进行离心(6000rpm,10min),弃掉上清后,使用20mM Tris-HCl缓冲液重悬菌体2-3次,使用超声细胞破碎仪破碎后于12000rpm高速离心20min,获得粗酶液。
(2)蛋白的纯化
将步骤(1)获得的粗酶液使用0.22μm滤膜进行过滤,并将过滤后的上清液通过AKTA纯化系统加载至镍柱上,使用含有20mM Tris-HCl缓冲液、500mM咪唑、500mM NaCl的洗脱液进行洗脱,获得纯化的不饱和葡萄糖醛酸酶。为了进一步确认对不饱和偶数寡糖的催化效果,不饱和葡萄糖醛酸酶纯化液以不饱和偶数寡糖作为底物检测活性,于30℃条件下孵育12h后,加热灭活。灭活反应物使用0.22μm滤膜进行过滤,并使用超高效液相色谱串联四极杆飞行时间质谱联用仪鉴定分析。
结果如图4a所示,比较了IPTG诱导浓度(0.1mM、0.2mM、0.5mM、1mM)对酶表达量的差异,各诱导浓度下均可获得可溶性蛋白。如图4b所示,经过培养和纯化处理,获得了条带单一的重组酶。如图4c所示,重组酶(71U/L)能够完全水解不饱和四糖中的不饱和葡萄糖醛酸,获得饱和三糖。
使用实施例3制备的不饱和葡萄糖醛酸酶(≥0.2mg/mL或≥5U/L)对实施例2步骤(1)中未经过分离的不饱和偶数寡糖混合物(肝素前体裂解物)或实施例2步骤(2)中经分离纯化后的不饱和偶数寡糖进行水解处理,于30℃下孵育12h,处理液灭活处理,上清液使用0.22μm滤膜进行过滤,按照实施例2步骤(2)中的方法进行分离和脱盐,收集210nm的寡糖峰。实现肝素前体饱和三糖、五糖、七糖、九糖的分离,饱和奇数寡糖结构如图5所示。
使用标准的PCR扩增体系和程序,扩增人源肝素双功能N-脱乙酰/N-磺基转移酶的基因(氨基酸序列如SEQ ID NO.3所示),使用Gibson组装技术将所得基因通过接头序列G4S(5’-GGCGGCGGCGGCAGC-3’)在N端连接麦芽糖结合蛋白(氨基酸序列如SEQ ID NO.2示)连接至pPIC9k质粒的多克隆位点上,获得重组质粒,将重组质粒转入PichiaPastoris GS115中,培养后得到转化子,筛选的转化子经验证正确的即为阳性转化子,为表达人源肝素双功能N-脱乙酰/N-磺基转移酶的重组毕赤酵母菌株。
(1)摇瓶培养
将表达人源肝素双功能N-脱乙酰/N-磺基转移酶的重组毕赤酵母接种于YPD培养基中,经过30℃过夜培养后,将重组毕赤酵母转接于装有BMGY培养基的250mL三角摇瓶中,30℃培养24h,将发酵液收集离心后,使用生理盐水重悬洗涤,使用BMMY培养基按原体积重悬菌体,每隔24h加入1%(v/v)甲醇诱导,25℃继续培养96h。将发酵液于4℃进行离心(6000rpm、10min),弃掉上清,使用20mM Tris-HCl缓冲液重悬菌体2-3次,使用高压匀浆破碎后于12000rpm高速离心20min,获得粗酶液。
(2)蛋白的纯化
将步骤(1)获得的粗酶液使用0.22μm滤膜进行过滤,并将过滤后的上清液通过AKTA纯化系统加载至MBP纯化柱上,使用含有20mM Tris-HCl缓冲液、10mM麦芽糖、150mMNaCl的洗脱液进行洗脱,获得纯化的人源肝素双功能N-脱乙酰/N-磺基转移酶酶液。
(3)活性酶的验证
将步骤(2)获得的纯化酶液加入反应体系中,反应体系包括50mM PNPS,0.5mMPAP,2mgAST IV,10%(v/v)甘油,1mg/mL高分子量肝素前体和200μL硫酸乙酰肝素双功能N-脱乙酰/N-磺基转移酶,于37℃条件下孵育12h,加热灭活后取上清。使用显色反应检测400nm下的吸光值。上清液使用肝素裂解酶III解聚12小时,加热灭活结束反应,使用0.22μm滤膜进行过滤,并利用超高效液相色谱串联四极杆飞行时间质谱联用仪进一步确认。
结果如图6a所示,经过培养和纯化处理,获得了条带较单一的重组酶。与未融合麦芽糖结合蛋白的N-脱乙酰/N-磺基转移酶(4×10
肝素双功能N-脱乙酰/N-磺基转移酶对肝素前体寡糖进行催化反应,本实施例以肝素前体不饱和偶数四糖或饱和奇数五糖为例,说明肝素双功能N-脱乙酰/N-磺基转移酶可以实现不饱和偶数寡糖和饱和奇数寡糖的N-磺酸化修饰:
反应体系中加入4mM PAPS,10%(v/v)甘油,1mg/mL肝素前体寡糖和100μg/mL肝素双功能N-脱乙酰/N-磺基转移酶,10mM-50mM CaCl
或,反应体系中加入50mM PNPS,0.5mM PAP,2mgAST IV,10%(v/v)甘油,1mg/mL肝素前体寡糖,100μg/mL肝素双功能N-脱乙酰/N-磺基转移酶和10mM-50mM CaCl
结果如图7所示,经过肝素双功能N-脱乙酰/N-磺基转移酶催化,获得了N-磺酸化肝素前体不饱和四糖。如图8所示,经过肝素双功能N-脱乙酰/N-磺基转移酶催化,获得了N-磺酸化肝素前体饱和五糖。
对比例1
本对比例以实施例4中制备的肝素前体饱和奇数糖为例,说明肝素裂解酶III能够继续对奇数糖进行裂解,不利于饱和奇数糖的获取。反应体系中加入1mg/mL肝素前体饱和奇数五糖和8000U/L肝素裂解酶III,置于37℃恒温孵育12h后,使用超高效液相色谱串联四极杆飞行时间质谱联用仪检测实验组与对照组(灭活酶)。
结果如图9a所示,在肝素裂解酶III的作用下,饱和奇数五糖被再次解聚为饱和奇数三糖和不饱和偶数二糖,裂解模式如图9b所示。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
