一种耐低温植物乳杆菌及其在菊芋青贮中的应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于微生物领域,具体公开了一种耐低温植物乳杆菌及其在菊芋青贮中的应用。
背景技术
青海省位于青藏高原东部,是我国四大牧区之一,平均海拔3000m以上,年均气温≤5℃,属于典型高寒地区
青贮作为饲料一种贮藏方式,通过乳酸菌(Lact ic acid bacter ia,LAB)发酵产生有机酸,保证饲料鲜嫩及营养价值,还能刺激家畜食欲,增加采食量。菊芋发酵后乳酸、干物质、氨氮含量均符合优等青贮饲料比例。环境温度是影响LAB活性的重要因素。通常菊芋青贮在室温40~45d完成发酵,但青海省在菊芋收获期间日平均气温10℃左右,夜间有时达到0℃以下,低温会延缓发酵进程,增加发酵时间,促进有害菌生长。研究表明,环境温度较低时,添加低温LAB可以有效提高青贮质量。李平以玉米(Zeamays)和苜蓿(Lotuscorniculatus)为青贮原料,15℃下添加3株低温LAB,pH值和NH
发明内容
针对目前存在的技术上的问题,本发明提供了一种耐低温植物乳杆菌及其在菊芋青贮中的应用。
本发明包括以下技术方案:
一种耐低温植物乳杆菌,所述乳杆菌为植物乳杆菌菌株,保藏日期为2023年9月25日,保藏单位为中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCCNo.28535。
进一步的,上述耐低温植物乳杆菌筛选自高寒地区菊芋青贮材料中。
进一步的,述耐低温植物乳杆菌筛选自青芋2号。
进一步的,上述耐低温植物乳杆菌的筛选方法,包括以下步骤:待菊芋生长至成熟期,刈割地上部茎叶粉碎裹包青贮,90d后开包削去外层10cm青贮料,取内层青贮材料200g放入无菌自封袋密封并加入冰袋,每次取样3次重复,2h内带到实验室开展乳酸菌分离纯化。
进一步的,上述耐低温植物乳杆菌的筛选方法,所述乳酸菌分离纯化包括以下步骤:
1)称取20g青贮样品放置于锥形瓶中,加180mL无菌水充分震荡1h混匀,静置30min后取上清液依次稀释为10
2)取各梯度稀释液10uL涂布于MRS固体培养基,30℃倒置培养48h,综合菌落形态特征进行辨别及编号,挑选单菌落划线扩大培养3次;
3)编号菌株依次进行革兰氏染色镜检、接触酶、葡萄糖产气试验,初步判定革兰氏染色试验阳性、接触酶阴性为乳酸菌株,葡萄糖产气阴性为兼性异型发酵乳酸菌,阳性为专性异型发酵乳酸菌;
4)所筛选的乳酸菌株贮存于NB培养基,-80℃保存。
进一步的,上述耐低温植物乳杆菌的筛选方法,还包括以下鉴定步骤:
a.乳酸菌耐低温能力测定;
b.低温乳酸菌功能测定;
c.乳酸菌16S rDNA测序及系统发育树构建;
d.数据分析。
本发明还公开了上述耐低温植物乳杆菌在菊芋青贮中的应用。
进一步的,上述耐低温植物乳杆菌在菊芋青贮中的应用,包括在低温时在菊芋青贮中添加所述低温植物乳杆菌;优选的,所述低温植物乳杆菌添加剂量为10
进一步的,上述耐低温植物乳杆菌在菊芋青贮中的应用,所述低温为气温≤5℃。
本发明具有如下有益效果:
为筛选可提升高寒地区菊芋青贮发酵品质的耐低温乳酸菌,本发明以‘青芋2号’菊芋青贮物料为材料,利用平板培养法分离乳酸菌株,分析菌株生理生化特性,并通过16SrRNA测序进行菌株种属鉴定。结果表明,菊芋青贮物料中共分离得到34株乳酸菌株,经低温及生理生化筛选获得12株耐低温乳酸菌株,包括10株兼性异型发酵乳酸菌和2株专性异型发酵乳酸菌,其耐酸性和耐盐性均较强;经产酸和生长能力对比,GN02菌株生长最快(OD2.63),GN10菌株具有更强的产酸能力(pH 3.59),XN25兼具较强的生长和产酸能力;16SrRNA测序鉴定出9株植物乳杆菌、1株戊糖乳杆菌、1株棒状乳杆菌、1株短乳杆菌。本发明筛选出适合高寒地区菊芋青贮发酵的耐低温植物乳杆菌、戊糖乳杆菌、短乳杆菌各1株。
实施例证明,本发明所述的耐低温植物乳杆菌在菊芋青贮中的具有良好的应用价值,具体来说,接种耐低温LAB能缓解菊芋青贮中低温造成的不利影响,保存营养物质,尤其是添加Lactobacillus plantarum GN02能使LA含量增加,pH迅速下降,从而在青贮早期维持稳定的酸性环境,此外,还保存了较多的DM和WSC,抑制营养物质的非正向降解,提高了菊芋低温青贮饲料品质,为青藏高原菊芋冬季青贮提供理论依据,进一步促进青海绿色有机农畜产品输出地建设。
本发明保藏的乳杆菌为GN02菌株,保藏日期为2023年9月25日,保藏单位为中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCCNo.28535。
附图说明
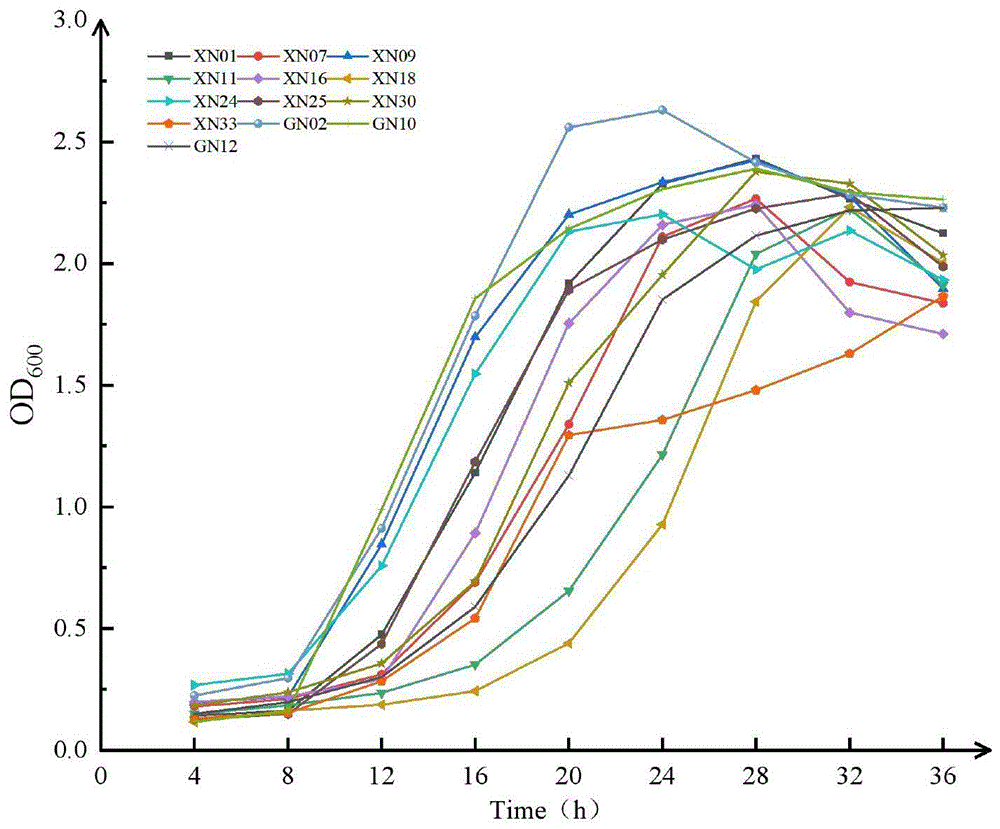
图1耐低温乳酸菌菌株生长情况;
图2耐低温乳酸菌菌株产酸情况;
图3耐低温乳酸菌菌株系统发育树;
图4青贮发酵过程中pH(A)、LA(B)、AA(C)和PA(D)变化;pH,potentialofhydrogen;LA,乳酸;AA,乙酸;PA,丙酸;F0,菊芋原料;FS,无菌水;FD,L.brevis;FZ,L.plantarum;FZD,L.brevis+L.plantarum;不同小写字母表示不同处理在相同或不同青贮日差异显著(p<0.05);不同处理间有相同小写字母表示差异不显著(p>0.05);
图5青贮发酵过程中DM(A)、WSC(B)、CP(C)、NH
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明了,下面通过附图及实施例,对本发明进行进一步详细说明。但是应该理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限制本发明的范围。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本发明的概念。
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
实施例1
菌株筛选
1材料与方法
1.1试验材料
供试材料选取青海大学农林科学院自主选育菊芋品种‘青芋2号’。供试材料‘青芋2号’于2021年5月上旬种植在西宁市(XN)青海大学农林科学院园艺创新基地试验田(E101°44′57.7572″,N36°43′8.346″,海拔2266.6m)及贵南县(GN)茫曲镇加土乎村(E100°46′24.7656″,N35°33′59.4539″,海拔3084.0m)农田中。
1.2试验设计
待菊芋生长至成熟期,2021年10月5日刈割地上部茎叶粉碎裹包青贮,90d后开包削去外层10cm青贮料,取内层青贮材料200g放入无菌自封袋密封并加入冰袋,每次取样3次重复,2h内带到实验室开展乳酸菌分离纯化。
1.3指标测定及方法
1.3.1乳酸菌分离纯化
称取20g青贮样品放置于锥形瓶中,加180mL无菌水充分震荡1h混匀,静置30min后取上清液依次稀释为10
1.3.2乳酸菌耐低温能力测定
将贮存于-80℃的乳酸菌株4℃解冻,MRS液体培养基活化24h,定菌数到1×10
1.3.3低温乳酸菌功能测定
菌种制备:取100uL定菌数到1×10
产酸:每2h测定pH,设置3次重复,初始pH为6.5,24h后绘制产酸曲线。
生长:每4h测定OD
耐酸:用HCl溶液调节管内MRS培养基pH为3.0、3.5、4.0、6.0、7.0、8.0,接种72h后分析耐酸能力。
耐盐:配置含3.0%和6.5%NaCl的MRS培养基,接种72h后分析耐盐能力
1.3.4乳酸菌16S rDNA测序及系统发育树构建
DNA制备:菌株活化后于MRS液体培养基培养24h,收菌体无菌水清洗3次用于DNA提取。利用天根细菌基因组DNA提取试剂盒,参照试剂盒说明书提取各菌株DNA,-20℃保存备用。
16S rDNA扩增测序:采用细菌16S rDNA通用引物F27(5’-AGAGTTTGATCCTGGCTCAG-3’)和R1492(5’-AAGTCGTAACAAGGTAACC-3’),引物合成于华大基因科技有限公司。PCR反应体系:2×PCRMaster Mix 10μL,ddH
构建系统发育树:将NCBI数据库中已知菌株相关序列与所测得菌株16SrRNA序列进行比对,确定所测菌株种属。MEGA 11.0进行菌株序列比对与系统进化树的构建。
1.4数据分析
采用Excel 2019软件对数据进行基础统计;采用Origin 2022软件分析菌株生长能力及产酸能力;采用SPSS21.0软件对菌株各时间段内生长能力及产酸能力数据统计分析,用平均值和标准误表示测定结果,并对所得数据进行单因素ANOVA分析及Duncan法多重比较,P<0.05表示差异显著。
实施例2
1结果与分析
1.1乳酸菌分离纯化及耐低温能力鉴定
通过观察菌落形态特征,从MRS培养基中挑选出298株乳酸菌株,经革兰氏染色、过氧化氢酶和葡萄糖产气试验,最终筛选出34株乳酸菌株,其中兼性异型发酵乳酸菌26株、专性异型发酵乳酸菌8株(表1);将筛选出的34株乳酸菌株在0、5、10、15℃下培养3d后进行筛选,发现在0℃下菌株均不能生长;5℃下有13株能生长,分别为菌株XN07、XN25、GN02、XN01、XN09、XN11、XN16、XN18、XN24、XN30、XN33、GN10、GN12;10℃下23株能生长;15℃下均能生长。根据菌株在低温下的生长能力,选取在5℃下能生长的13株菌株进行后续试验(表1)。
表1乳酸菌特征及耐低温能力鉴定
“XN”西宁分离的乳酸菌株;“GN”贵南分离的乳酸菌株;“++”生长强;“+”生长正常;“W”生长弱;“-”不生长;下表同
"XN"LAB isolatedfromXining;"GN"LAB isolatedfromGuinan;"++"thrives;"+"normal;"W"sluggish;"-"none;similarly forthe followingtables
1.2耐低温乳酸菌糖酵解及生理生化特性
所筛选菌株XN18、XN25为专性异型发酵乳酸菌,其余均为兼性异型发酵乳酸菌。糖酵解试验中兼性异型发酵乳酸菌株能共同发酵的糖有葡萄糖、果糖、乳糖、半乳糖、麦芽糖、蔗糖、纤维二糖、果聚糖、棉籽糖、山梨醇、水杨苷、七叶灵、甘露醇,菌株GN10能发酵鼠李糖,所有兼性异型发酵乳酸菌株均不能发酵淀粉;专性异型发酵乳酸菌株中,菌株XN18不能发酵纤维二糖、果聚糖、淀粉,菌株XN25不能发酵纤维二糖、淀粉、鼠李糖、山梨醇、水杨苷、甘露醇(表2)。
13株耐低温乳酸菌株中,菌株XN01、XN07、XN09、XN24、XN30、GN02、GN10能在pH3.0条件下生长,且均为兼性异型发酵乳酸菌,对低pH耐受性较强;除专性异型发酵乳酸菌株XN18、XN25外,其余菌株均能在pH 3.5条件下生长;pH4.0~8.0、NaCl 3%~6.5%条件下,所有菌株都能生长,表现出了较强的耐酸性及耐盐性(表2)。
表2耐低温乳酸菌糖酵解及生理生化特性
1.3耐低温乳酸菌生长及产酸能力分析
由图1可知,所得菌株生长曲线均呈先上升后下降的趋势。其中菌株XN09、XN24、GN02、GN10生长8h后进入对数生长期,OD值迅速上升,菌株GN02在24h时OD值为2.63,最早达到生长峰值,且显著高于其余菌株(P<0.05),菌株XN09、GN10于28h时达到生长峰值(表3);菌株XN01、XN07、XN16、XN25、XN30、XN33、GN12在12h后开始迅速生长,于28、32h相继达到生长峰值,菌株XN33在20h时生长速率变缓;菌株XN11、XN18最晚进入对数生长期,32h达到峰值;36h后,菌株GN02、GN10、GN12生长趋于平稳,OD值分别为2.23、2.26、2.23,显著高于其余菌株(P<0.05)(表3)。
所有菌株的产酸曲线均呈下降趋势(图2)。0~8h内菌株产酸较慢,仅有菌株GN12产酸较快(pH 5.23),最终pH为4.29;菌株XN25在第8h时降幅开始增大,12h时趋于平稳,最终pH为4.69(表4);10~16h时多数菌株都开始迅速产酸,菌株GN02在第10h时降幅变大,菌株XN01、XN07、XN24、XN33在第12h时降幅变大,菌株XN09、GN10在第16h时降幅变大,并始终保持下降趋势;20~24h内,所有菌株产酸速率基本趋于平缓;全部产酸过程中,菌株XN11、XN16、XN18、XN30、GN12降幅较为稳定;第24h时,所有兼性异型发酵乳酸菌pH均在4.3以下,显著高于专性异型发酵乳酸菌,菌株XN07、XN09、XN24、GN02、GN10 pH均在3.8以下,分别为3.72、3.65、3.72、3.64、3.59,显著高于其余菌株(P<0.05)(表4)。
1.4菊芋青贮耐低温乳酸菌16SrRNA序列分析
通过16SrRNA测序分析测得13株耐低温乳酸菌序列并上传至NCBI数据库获得登录号(表5)。由表5和图3可知,菌株GN12与植物乳杆菌L.plantarumc10归为同一族群,进化亲缘度74%,序列相似度98.95%;菌株XN09与植物乳杆菌L.plantarum KB-7归为同一族群,进化亲缘度93%,序列相似度98.40%;菌株GN02与植物乳杆菌L.plantarum HBUAS59622归为同一族群,进化亲缘度73%,序列相似度99.44%;菌株XN33与植物乳杆菌L.plantarum2652归为同一族群,进化亲缘度70%,序列相似度98.75%;菌株XN16与植物乳杆菌L.plantarum AR113归为同一族群,进化亲缘度84%,序列相似度97.72%;菌株XN25与短乳杆菌L.brevis 2033归为同一族群,进化亲缘度100%,序列相似度99.30%;菌株XN18与棒状乳杆菌L.coryniformis HBUAS56116归为同一族群,进化亲缘度100%,序列相似度99.23%。菌株XN07、XN11、XN30与植物乳杆菌L.plantarum 3334、L.plantarum 8276、L.plantarum 1417归为同一族群,进化亲缘度84%,序列相似度分别为99.09、98.68、99.16。菌株XN01、GN10与植物乳杆菌L.plantarum HBUAS67128、L.plantarum UIWO2,戊糖乳杆菌L.pentosus HBUAS68361、L.pentosus c18、L.pentosus MRKAK3归为同一族群,进化亲缘度82%,两种菌株与植物乳杆菌、戊糖乳杆菌的序列相似度均相同。菌株XN24与植物乳杆菌L.plantarum HBUAS53364、戊糖乳杆菌L.pentosus HBUAS68361的序列相似度都为95.25%。
表3耐低温乳酸菌菌株生长情况
表4耐低温乳酸菌菌株产酸情况
表5耐低温乳酸菌菌株相似序列比对
讨论与结论:
低温是延缓青贮发酵进程的主要因素之一,尤其在常年气温较低的高寒地区,低温延长了青贮饲料的发酵时间,导致青贮饲料中的可溶性物质大量流失,降低了饲料整体营养水平。有研究表明,低温青贮时添加耐低温乳酸菌可以有效改善发酵进程,调控低温对青贮造成的负面影响,提升青贮品质。Zhu在燕麦青贮中添加耐低温乳酸菌FO3,5℃青贮60d后pH值、NH
乳酸菌根据糖发酵模式分为三个代谢类群:不发酵戊糖或葡糖糖酸盐的专性同型发酵乳酸菌、发酵戊糖或葡糖糖酸盐的兼性异型发酵乳酸菌、从葡萄糖产生等量乳酸、CO
本发明从高寒地区青贮90d的菊芋青贮材料中筛选出13株能在5℃条件下生长的耐低温乳酸菌,其中11株兼性异型发酵乳酸菌,2株专性异型发酵乳酸菌,兼性异型发酵乳酸菌表现出更强的耐酸性。有研究表明玉米、燕麦等作物在青贮60d后优势菌群为专性异型发酵乳酸菌,但在本研究筛选菌种中占比更高的是兼性异型发酵乳酸菌,专性异型发酵乳酸菌仅有2株,这可能是因为在发酵初期,外界环境温度比发酵中后期要高,青贮环境中的耐低温兼性异型发酵乳酸菌逐渐成为优势菌群,抑制了专性异型发酵乳酸菌的繁殖;随着发酵时间的推进,专性异型发酵乳酸菌一般在发酵7~14d后开始出现,但由于环境温度逐渐降低,低温抑制了专性异型发酵乳酸菌的繁殖,最终导致在青贮90d后兼性异型发酵乳酸菌依然是青贮环境中的优势菌群,此情况下兼性异型发酵乳酸菌会不断消耗材料中的可溶性糖,加速营养物质流失。
青贮生产中一般选用生长能力快、产酸能力强的乳酸菌添加剂,在青贮发酵起始阶段能快速繁殖产酸,使青贮环境pH迅速下降,有效抑制有害微生物,保证优良的青贮品质。本研究中,各菌株生长曲线呈先上升后下降的趋势,产酸曲线呈下降趋势,与前人研究结果一致,菌株GN02、GN10表现出更强的生长能力及产酸能力。这也是前人研究中兼性异型发酵乳酸菌适合作为低温发酵添加剂的依据之一,但也有研究表明专性异型发酵乳酸菌能提升青贮饲料的有氧稳定性。本发明中,专性异型发酵乳酸菌株XN25产酸能力与生长能力均高于XN18,在5℃条件下能正常生长,具有作为低温青贮发酵添加剂的潜力,这与李海萍的研究结果相似,但相关研究较少,需进一步挖掘菌株的特异性功能。
基于16SrRNA编码基因测序技术是如今划分细菌种类最常用的技术之一,在不断的实践中发现细菌种间进化亲缘度高于70%,序列相似度大于97%可以判定为同种细菌。本研究中,菌株XN01、GN10与植物乳杆菌和戊糖乳杆菌进化亲缘度为82%,且植物乳杆菌和戊糖乳杆菌在序列上的差异仅有2bp;依据《乳酸细菌分类鉴定及试验方法》,植物乳杆菌不能发酵鼠李糖,戊糖乳杆菌能发酵鼠李糖;因此结合糖酵解结果鉴定出菌株XN01为植物乳杆菌,菌株GN10为戊糖乳杆菌;菌株XN24序列相似度为95.25%,小于97%不满足鉴定条件,无法判定其种别。
实施例3
本发明筛选到的菌株GN02以及XN25在菊芋青贮发酵中的应用。
1材料与方法
1.1青贮物料制备
供试材料选取青海大学农林科学院自主选育菊芋品种‘青芋2号’。供试材料‘青芋2号’于2022年4月20日种植在中国青海省西宁市青海大学农林科学院园艺创新基地试验田中(E101°44′57.7572″,N36°43′8.346″,海拔2266.6m)。2022年10月21日刈割地上部茎叶粉碎(粉碎长度2±1cm),用作菊芋青贮原料。试验所用耐低温LAB取自实验室前期筛选的Lactobacillus plantarum GN02、Lactobacillus brevis XN25,NCBI登录号分别为OP740787、OP740791。试验前,保存在-80℃的2株耐低温乳酸菌在4℃下解冻,MRS液体培养基连续活化2次,随后在液体MRS培养基中静态培养18h后通过OD值检测其活菌数并离心(4000rpm,5min),再用无菌水重悬至活菌数大约为1×10
1.2发酵参数测定
取20g样品与180mL蒸馏水于榨汁机中高速匀浆30s,将所得混合物用4层医用纱布进行过滤并收集滤液,滤液离心(5000rpm,10min)后使用玻璃电极pH计(pH S-2F,LEICI,Shanghai,China)测定滤液pH,-20℃保存用于LA、AA、丙酸(PA)及NH
1.3统计分析
采用Excel 2019软件对数据进行基础统计;采用IBM SPSS27.0软件对青贮发酵参数数据统计分析,用平均值和标准误表示测定结果,并对所得数据进行单因素ANOVA分析及Duncan法多重比较,p<0.05表示差异显著,所得结果采用Origin 2022软件绘制柱状图。
2结果分析
2.1发酵特性
青贮发酵期间,各组pH较F0均呈下降趋势(图4A),第7、60d时,各组间pH差异显著,仅有FZ组pH<5(4.81、4.53),显著低于其余组;FS、FD组LA含量随时间逐渐上升(图4B),但FZ、FZD组却随时间下降,与pH相同,LA含量在第7、60d时各组间均差异显著,其中,FZ组LA含量在第7、60d时均为最高,分别为(26.93g/kg、24.09g/kg FM),而FS组LA含量均为最低,分别为(0.57g/kg、4.08g/kg FM);所有组AA含量均随时间逐渐上升(图4C),其中,第7、60d时,FD组AA含量均显著高于其余组,分别为(11.66g/kg、16.37g/kg FM);与AA含量相反,所有组PA含量均随时间逐渐下降(图4D),FS组PA含量在第7、60d时显著高于其余组,FZ组显著低于其余组(2.15g/kg、2.17g/kg FM)。
2.2化学参数
青贮发酵期间,各组DM含量随时间逐渐降低(图5A),7d时各组DM含量无显著差异,FS组在发酵过程中下降较快且60d时显著低于其余组,FZ组60d时DM(333.17g/kg)含量显著高于FS、FZD组;各组WSC含量随时间下降幅度较大(图5B),均显著低于F0,在发酵过程中,FD组WSC(24.83g/kg、12.85g/kg DM)含量高于其余组,但在60d时FD、FZ组无显著差异;各组CP含量随时间略有上升(图5C),在7d时FZD组显著高于其余组,60d时各组无显著差异;与F0组相比,除FZD组外,7d时NH3-N含量各组均有所下降(图5D),FZD组显著高于其余组,值得注意的是,60d时FD组NH3-N(17.61g/kg FM)含量大幅增加,显著高于其余组;各组NDF含量较F0均上升(图5E),7d时FZ组含量最高且显著大于其余组,60d时各组差异不显著;与NDF相同,各组ADF含量较F0均上升(图5F),7d时各组差异不显著,60d时FZ、FZD组含量较高,二者间无显著差异,有趣的是,7、60d时FS组与FZ、FZD组间无显著差异,均高于FD组。
3讨论
青贮发酵过程中,贮藏温度是影响青贮成败的关键因素。青藏高原受低温影响,易导致青贮发酵不完全,造成生物资源浪费、营养物质流失,制约青藏高原畜牧业高质量发展。Li的研究表明,青藏高原燕麦青贮受冻融影响,导致pH过高,LA、AA含量低,有氧稳定性差,达不到优质燕麦青贮饲料标准。LAB是青贮发酵中的重要菌群,主导青贮发酵的进行,其最适生长温度为30~37℃,但有些耐低温LAB能耐受5℃的低温并正常生长,为低温青贮发酵提供了可能性。pH是衡量青贮发酵优劣的重要指标,青贮过程中pH低于4.6时可抑制不良微生物和蛋白水解酶的活性。本研究中,添加耐低温LAB后,所有处理组pH均随时间逐渐下降,这直接说明接种耐低温LAB后能有效降低青贮饲料pH。但仅有FZ组有较快的酸化速率(4.53),这与耐低温LAB的功能有关,接种耐低温Lactobacillusplantarum在发酵初期能快速利用WSC产生更多的LA,使pH迅速下降。Chen也发现耐低温LAB会产生更多的LA,降低pH。相反,未接种FS组pH始终大于6,可能是低温抑制了原料中LA的产生,而接种耐低温LAB能够弥补低温引起的pH升高,从而保证物料的酸性环境,使青贮发酵正向进行。LA、AA含量是衡量发酵是否成功的重要指标,同型发酵LAB在发酵过程中快速产生LA降低青贮pH,形成酸性环境;异型发酵LAB在青贮中产生LA和AA提高青贮有氧稳定性。本研究中,接种同型发酵LAB提高了FZ、FZD组LA浓度,降低pH,这与Chen的研究结果一致。FZ、FZD组发酵后期LA含量下降,可能是因为FZ组青贮发酵前期WSC含量高,同型发酵LAB能产生大量LA,而当发酵时间延长,WSC过量消耗,发酵由同型发酵向着异型发酵转化,LA被消耗转化为CO
青贮发酵过程中,原料DM、WSC是保证发酵质量的重要因素。一般认为,原料中DM含量在25~35%,WSC含量50g/kg以上就能保证青贮发酵底物充足。本研究中,原料F0中DM为35.02%,WSC为61.21g/kg,满足优质青贮原料特性。所有组随着青贮发酵时间的延长,DM均呈下降趋势,说明随着发酵的进行,微生物代谢使DM中可利用的营养成分转化为更易保存的有机酸等物质,60d时FZ组DM最高,这可能是因为pH较低的酸性环境抑制了营养物质的降解。与原料F0相比,各组WSC含量显著下降,这是因为LAB能将WSC分解为有机酸。接种同型发酵LAB和异型发酵LAB组间WSC含量存在显著差异,接种同型发酵LAB组青贮各时期WSC含量低于接种异型发酵LAB组,可能是由于接种同型发酵LAB组在发酵阶段经历同型发酵向异型发酵转化,整个发酵过程始终消耗WSC,而异型发酵LAB组,发酵前期微生物活动缓慢,后期逐渐升高,保留较多的WSC。NH
4结论
接种耐低温LAB能缓解菊芋青贮中低温造成的不利影响,保存营养物质,尤其是添加Lactobacillus plantarum GN02能使LA含量增加,pH迅速下降,从而在青贮早期维持稳定的酸性环境,此外,还保存了较多的DM和WSC,抑制营养物质的非正向降解,提高了菊芋低温青贮饲料品质,为青藏高原菊芋冬季青贮提供理论依据,进一步促进青海绿色有机农畜产品输出地建设。
综合上述实施例可以发现,本发明从高寒地区菊芋青贮材料中筛选出12株耐低温乳酸菌,分别为植物乳杆菌XN01、XN07、XN09、XN11、XN16、XN30、XN33、GN02、GN12,戊糖乳杆菌GN10,棒状乳杆菌XN18,短乳杆菌XN25。综合产酸及生长能力,优选出植物乳杆菌GN02、戊糖乳杆菌GN10、短乳杆菌XN25适合作为青海高原菊芋青贮发酵乳酸菌添加剂。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,因此,基于本发明的创新理念,对本文所述实施例进行的变更和修改,或利用本发明说明书及附图内容所作的等效结构或等效流程变换,直接或间接地将以上技术方案运用在其他相关的技术领域,均包括在本发明专利的保护范围之内。
- 一种高墩群小半径曲线现浇梁贝雷梁支架施工体系
- 一种小半径曲线预制板梁的施工方法
- 一种钢横隔梁小半径曲线梁桥装配建造模板及施工方法
