一种土壤团聚体生态位微生物DNA的提取方法
文献发布时间:2024-01-17 01:26:37
技术领域
本发明涉及一种土壤团聚体微生物DNA的提取方法。
背景技术
土壤微生物是土壤结构形成和物质循环的重要推动者。目前,土壤微生物生态学的研究多集中在原状土壤样品,但是由于微生物在不同土壤空间尺度上存在的固有异质性,选择适当的空间尺度对土壤微生物开展研究对深入解析土壤生态系统多样性和功能来说至关重要。
土壤团聚体是矿物颗粒、有机和生物基质强烈结合而形成的大小不同的复合体,是土壤生态系统基本的结构和功能单元。根据其粒径大小分为大团聚体(2000~250μm)、微团聚体(250~53μm)和粉-黏团聚体(<53μm)。多级团聚化过程使得粒径大小不同的土壤团聚体的物理结构和生物化学性质常有所差异,例如不同的孔径和连通性,不同的水分和氧气可用性以及不同的有机质含量和复杂性,进而在团聚体内部形成独特的微生物生态位,能够选择特定的微生物群落定植。因此,解析团聚体这一微米尺度下土壤微生物的群落动态有助于我们更好地理解元素的生物地球化学循环。
阐明不同大小土壤团聚体内部微生物间的联系,必须尽可能的保留土壤微生物和团聚体的原位空间关系,故而选择正确有效的团聚体微生物DNA的提取方法是急需解决的首要问题。提取团聚体生态位微生物DNA的第一步就是要分离得到粒径大小不同的团聚体样品,目前,团聚体的分离方法主要分为干筛法和湿筛法。但是这两种分离方式都存在一定的问题,例如,干筛法需要将土壤样品风干至“最佳水分含量”状态(含水量10~14%),这一干燥过程会对微生物多样性产生影响;干筛法还会导致获得的大团聚体较多,同时无法将粉-黏团聚体分离出来,在一定程度上掩盖了团聚体之间微生物的差异。而湿筛法的浸润过程可能会引起土壤微生物从大团聚体向微团聚体的重新分布,使其原有的生态位发生改变。干筛法和湿筛法均对土壤团聚体生态位微生物DNA提取的准确性有一定的影响。
发明内容
本发明为了解决现有技术中土壤团聚体生态位微生物DNA提取的准确性不足的问题,而提供了一种土壤团聚体生态位微生物DNA的提取方法。
本发明土壤团聚体生态位微生物DNA的提取方法按照以下步骤进行:
一、采集田间原状土壤,对土壤进行预处理后,将土壤样品平铺于筛组的顶层,筛组由筛孔大小分别为2000μm、250μm、53μm的筛网上下依次叠放后置于桶内,然后向桶内加入无菌水,使水面没过2000μm筛网表面0.8~1.2cm,浸泡;
二、浸泡结束后,按照20~30次/min的频率上下振动筛组2~3min;
三、振动结束后,将250μm和53μm筛网上的组分分别进行离心,离心后弃上清,得到大团聚体沉淀A和微团聚体沉淀B;
四、将筛落桶内的组分均匀混合后进行离心,离心后弃上清,得到粉-黏团聚体沉淀C;
五、将大团聚体沉淀A、微团聚体沉淀B和粉-黏团聚体沉淀C分别放入冷冻干燥机中冻干,然后用土壤DNA提取试剂盒提取,即得到大团聚体(2000~250μm)、微团聚体(250~53μm)和粉-黏团聚体(<53μm)三种团聚体生态位的微生物DNA。
进一步:所述步骤一中采集田间原状土壤时,尽量不扰动土壤。采集方法:首先,在每个位点挖出一个长20cm、宽10cm、高25cm的土坑,形成一个小的土壤剖面,再平行于土壤剖面由上至下用铁锹采集0~20cm的原状土壤样品。
进一步:所述步骤一中土壤预处理的方法为:将原状土壤样品中的石头、植物残渣以及大型土壤动物等杂物去除,然后将其中的土块沿其自然断裂面破碎为直径约1cm的小土块,最后在避光条件下阴干土壤样品12h,使得土壤含水量达到19~23%。
进一步:所述步骤一中称取平铺于筛组顶层的土壤样品质量为50g。
进一步:所述步骤一中无菌水是蒸馏水在121℃0.12MPa的条件下,灭菌30min后冷却至室温约20℃左右得到的。
进一步:所述步骤一中浸泡时间为8~12min。
进一步:所述步骤二中上下振动幅度为5cm。
进一步:所述步骤三和四中离心条件是:温度为4℃,转速为7500r/min,时间为5min。
进一步:所述步骤五中冻干的温度为-40℃,时间为24h。
本发明的有益效果:
本发明操作起来简单易行,聚焦从田间土壤样品采集到团聚体分离后干燥的全过程,首先减少田间取样和预处理操作对团聚体结构的破坏,使样品处于分离前的最佳状态,其次通过控制包括浸泡时间、振动幅度、离心以及干燥条件在内的团聚体筛分流程,在保证不同粒径大小团聚体充分分离的同时避免浸泡过程引起微生物在团聚体间的再分布。一系列的优化过程有效的降低了污染,保留土壤微生物和团聚体的原位空间关系,实现团聚体生态位微生物DNA的准确提取,以便揭示微生物群落间存在的真实差异,更好地解答不同团聚体生态位下微生物群落的组成、结构、功能以及它们之间存在什么样的相互作用关系等土壤微生物生态学问题。
本发明在不同粒径大小团聚体充分分离的前提下,有效的减少污染并保留土壤微生物和团聚体的原位空间关系,实现团聚体生态位的微生物DNA的准确提取。
附图说明
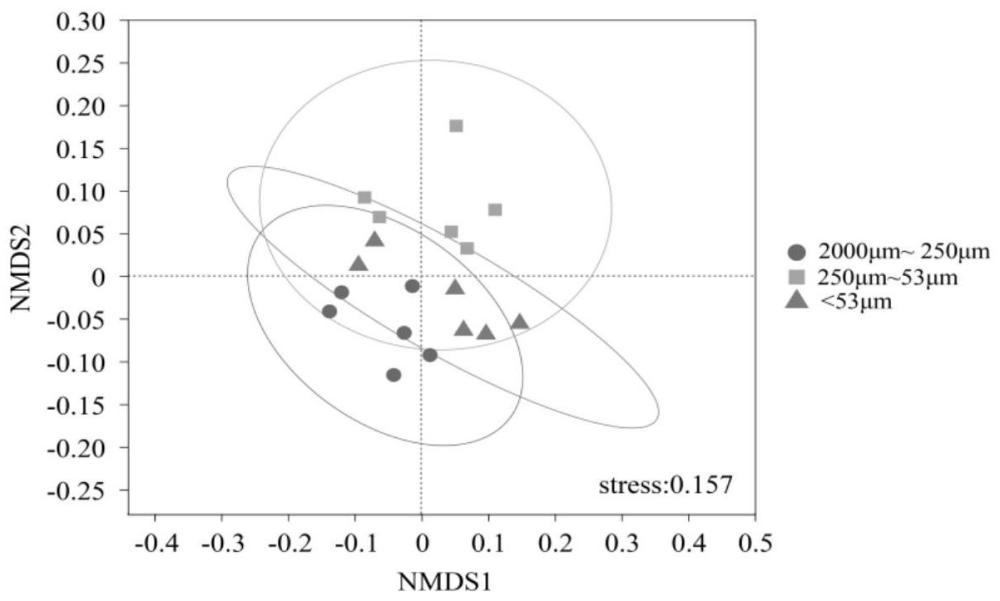
图1为不同团聚体生态位细菌群落结构的非度量多维尺度分析(不施肥处理地块);
图2为不同团聚体生态位细菌群落结构的非度量多维尺度分析(化肥处理地块);
图3为不同团聚体生态位细菌群落结构的非度量多维尺度分析(有机肥处理地块)。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
具体实施方式一:本实施方式土壤团聚体生态位微生物DNA的提取方法按照以下步骤进行:
一、采集田间原状土壤,对土壤进行预处理后,将土壤样品平铺于筛组的顶层,筛组由筛孔大小分别为2000μm、250μm、53μm的筛网上下依次叠放后置于桶内,然后向桶内加入无菌水,使水面没过2000μm筛网表面0.8~1.2cm,浸泡;
二、浸泡结束后,按照20~30次/min的频率上下振动筛组2~3min;
三、振动结束后,将250μm和53μm筛网上的组分分别进行离心,离心后弃上清,得到大团聚体沉淀A和微团聚体沉淀B;
四、将筛落桶内的组分均匀混合后进行离心,离心后弃上清,得到粉-黏团聚体沉淀C;
五、将大团聚体沉淀A、微团聚体沉淀B和粉-黏团聚体沉淀C分别放入冷冻干燥机中冻干,然后用土壤DNA提取试剂盒提取,即得到大团聚体(2000~250μm)、微团聚体(250~53μm)和粉-黏团聚体(<53μm)三种团聚体生态位的微生物DNA。
本实施方式所述步骤一中采集田间原状土壤时,尽量不扰动土壤,采集方法:首先,在每个位点挖出一个长20cm、宽10cm、高25cm的土坑,形成一个小的土壤剖面,再平行于土壤剖面由上至下用铁锹采集0~20cm的原状土壤样品。
本实施方式所述步骤一中土壤预处理的方法为:将原状土壤样品中的石头、植物残渣以及大型土壤动物等杂物去除,然后将其中的土块沿其自然断裂面破碎为直径约1cm的小土块,最后在避光条件下阴干土壤样品12h,使得土壤含水量达到19~23%。
本实施方式所述步骤一中称取平铺于筛组顶层的土壤样品质量为50g。
本实施方式所述步骤一中无菌水是蒸馏水在121℃0.12MPa的条件下,灭菌30min后冷却至室温18~20℃得到的。
本实施方式步骤四中筛落桶内的组分是收集的<53μm的粉-黏团聚体组分。
本实施方式步骤五称取0.5g冻干后组分进行DNA提取,土壤DNA提取试剂盒是TheFast
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一中平铺于筛组的顶层的土壤样品质量为50g。其他步骤及参数与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一不同的是:步骤一中浸泡时间为8~12min。其他步骤及参数与具体实施方式一相同。
具体实施方式四:本实施方式与具体实施方式一不同的是:所述步骤二中上下振动幅度为5cm。其他步骤及参数与具体实施方式一相同。
具体实施方式五:本实施方式与具体实施方式一不同的是:所述步骤三和四中离心条件是:离心温度为4℃,离心转速为7500r/min,时间为5min。其他步骤及参数与具体实施方式一相同。
具体实施方式六:本实施方式与具体实施方式一不同的是:步骤五中冻干条件是温度为-40℃、时间为24h。其他步骤及参数与具体实施方式一相同。
实施例1利用本发明的方法针对黑土土壤团聚体生态位微生物DNA的提取方法,供试黑土来自黑龙江省海伦市前进镇光荣村(47°21’N,126°50’E),田间施肥方式不同的三个地块,具体田间施肥方式包括不施肥、化肥和有机肥三种,于2022年大豆的鼓粒期采集,然后采用团聚体生态位微生物DNA提取方法进行DNA提取,具体步骤如下:
步骤一:在供试地块的对角线上随机选取三个位点挖出三个长20cm、宽10cm、高25cm的土坑,形成三个小的土壤剖面,再平行于每个土壤剖面由上至下用铁锹分别采取0~20cm的土壤,均匀混合后进行预处理,其中预处理的方法:去除新鲜土壤样品中的石头、植物残渣以及大型土壤动物等杂物,然后将其中较大的土块沿其自然断裂面破碎为直径约1cm的小土块,并在避光条件下阴干12h,使得土壤含水量达到19~23%;
步骤二:将筛组按筛孔大小叠放后置于桶内(由上至下分别为2000μm、250μm、53μm),并在距离顶层2000μm筛子筛网表面1cm处用记号笔画上刻度线位置;然后称取50g预处理后的土壤样品平铺于筛组的顶层,并沿桶壁向桶内加入经过121℃0.12MPa灭菌30min后冷却至20℃的无菌蒸馏水,使得水面恰好达到提前标记好的刻度线的位置,浸泡10min;
步骤三:浸泡结束后,以5cm的振动幅度上下振动,其中振动频率为25次/min,振动时间为2min;
步骤四:筛分2min后,在桶内用无菌蒸馏水分别冲洗各筛子外侧,以确保两侧无泥土残留;然后把250μm和53μm筛上组分洗到无菌培养皿中,再各自转移至50ml无菌离心管,4℃7500r/min离心5min后,弃上清,最后将大团聚体沉淀A(2000~250μm)和微团聚体沉淀B(2000~250μm)分别转移至0号自封袋中;其中,53μm筛上水不易流下,可用洗瓶冲洗筛网表面,以加速水的下漏;
步骤五:将筛落桶内的组分(桶内为粒径<53μm的粉-黏团聚体组分)均匀混合后,用5ml移液枪吸取部分于50ml无菌离心管中,4℃7500r/min离心5min后,弃上清,将得到的粉-黏团聚体沉淀C(<53μm)转移至0号自封袋中;
步骤六:将收集到的装有大团聚体(2000~250μm)、微团聚体(250~53μm)和粉-黏团聚体(<53μm)的自封袋放入冷冻干燥机中,-40℃冻干24h后称取0.5g,用土壤DNA提取试剂盒The Fast
本实施方式提取后将不同团聚体生态位微生物DNA进行细菌16S高通量测序,测序结果分析后发现,不同团聚体内的细菌群落存在明显分离并且差异显著。图1~图3为不同团聚体生态位细菌群落结构的非度量多维尺度分析(Non-metric MultidimensionalScaling,NMDS,注:基于Bray-Curtis距离),其图1为不施肥处理地块,图2为化肥处理地块、图3为有机肥处理地块,图中●表示大团聚体(2000~250μm)、■表示微团聚体(250~53μm)、
表1不同团聚体生态位细菌群落结构差异的Adonis分析
注:基于Bray-Curtis距离。星号(*)表示差异显著(*P<0.05,**P<0.01,***P<0.001)。
