一种野生大豆组织培养的方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于植物生物技术领域,具体涉及一种野生大豆组织培养的方法。
背景技术
野生大豆(Glycine soja),起源于中国,为豆科大豆属的缠绕草本植物,主要生长在田边、河岸、沼泽、树林和芦苇丛等环境中。野生大豆的生物学特征是:茎杆细,一般攀援外物生长,没有外物时可相互缠绕匍匐地面生长;三片叶,叶子比栽培大豆的小,一般呈卵圆形,且叶子正反面都有绒毛;总状花序腋生,花比较小,一般为白色或者淡紫色,花萼呈钟形,花冠呈蝶形,旗瓣近圆形;荚果较小有绒毛,一般每荚中有2~4粒种子,成熟种子呈黑褐色。
野生大豆是栽培大豆的近缘野生种,在我国分布广泛,自然资源较为丰富,现有资源6000余份,占世界总数的90%以上,野生大豆被列为国家二级保护植物,其在大豆育种中具有重要的价值。野生大豆的丰产潜力较大、品质优异、抗逆性和适应能力较强、含有很多抗病虫基因等,是扩大品种遗传基础的最好物种。近年来,全国的大豆专家瞄准野生大豆开展研究,目的是要通过挖掘并发挥野生大豆的基因潜力,以创新选育出优良的大豆新品种,提高我国的大豆产出,从而减少对海外大豆的依赖,保障我国的粮食安全。
研究建立野生大豆的组织培养技术,可以技术支撑野生大豆的种苗快繁、种质资源保存、诱变育种、倍性育种、遗传转化等,具有重要意义。
目前有关大豆组织培养技术的报道主要集中于栽培大豆,而对野生大豆进行组织培养的研究报道较少,主要存在以下问题:1.由于野生大豆和栽培大豆是两个不同的物种,它们在形态、基因组和遗传多样性等方面存在显著的差异,栽培大豆的组织培养技术体系不适用于野生大豆;2.目前的野生大豆组织培养技术是通过种子培养后形成愈伤组织,再通过愈伤组织的分化形成苗。此技术的问题是愈伤组织的遗传变异性较大,其分化成的苗难于稳定地保持母株的遗传背景;3.野生大豆的种子存在硬实休眠现象,一般很难发芽,目前的野生大豆组织培养时,往往是通过破除种皮或者切除子叶和下胚轴连接的部位或者切开种子等处理后再进行培养。此技术的问题是会出现不同程度损伤培养材料,影响种子的萌发,且这些技术处理是否会提高种子的萌发率尚未见数据报道;5.目前野生大豆组织培养的过程中缺乏野生大豆愈伤组织的增殖培养,难于实现种苗数量的扩繁;6.野生大豆愈伤组织不易分化出苗,分化率较低,仅为25%左右;7.从野生大豆愈伤组织上再生的幼苗生长缓慢,表现为,一般在培养40d后才分化出苗,出苗后30d左右只有3~5片叶子;8.野生大豆不同部位(上胚轴、下胚轴、根轴、子叶等)诱导来的愈伤组织生根能力不同,有的愈伤组织不易生根,而有的愈伤组织分化生根率可达70%以上;9.野生大豆组织培养的培养基复杂,用到了4种不同的培养基。
因此,如何克服现有技术的不足是目前植物生物技术领域亟需解决的问题。
发明内容
本发明的目的是为了解决现有技术的不足,提供一种野生大豆组织培养的方法,该方法可以高效、快速、大量地培养出优质野生大豆组培苗,可应用于野生大豆的种苗快繁、种质资源保存、诱变育种、倍性育种、遗传转化等方面,具有重要意义。
为实现上述目的,本发明采用的技术方案如下:
一种野生大豆组织培养的方法,包括以下步骤:
A、种子的采收和处理:在野生大豆生长季,当野生大豆成熟后,采收饱满、无病虫害、完好且无开裂的野生大豆豆荚,然后自然阴干处理;
B、种子的清洗和灭菌:将经A步骤处理后的豆荚剥开,挑选出饱满、无病虫害的种子,然后进行种子的清洗和灭菌处理;
C、初代培养:将经B步骤处理后的种子接种到初代培养基中,于25±2℃下培养,当种子萌发生长成高5.0~7.0cm、生长健壮的植株时,完成初代培养;
所述的初代培养基为:基础培养基MS+6-苄氨基嘌呤0~0.8mg/L+萘乙酸0~0.01mg/L+白砂糖25~30g/L+琼脂粉5.5~5.8g/L,pH为5.8~6.0;
D、成苗培养:将C步骤得到的植株切成含腋芽的茎段;然后将含腋芽的茎段接种到成苗培养基中,于25±2℃下培养成苗;
所述的成苗培养基为:改良的基础培养基MS+6-苄氨基嘌呤0.5~1.0mg/L+萘乙酸0.01~0.05mg/L+白砂糖25~30g/L+琼脂粉5.5~5.8g/L,pH为5.8~6.0;所述的改良的基础培养基MS是N H
进一步,优选的是,A步骤中,自然阴干处理的具体方法为:
将野生大豆豆荚装入40目的尼龙网袋,不碰撞、不挤压豆荚,并放置于清洁、通风、无鼠害、常温、阴凉的环境中,放置的时间长为1.0年~1.5年,以让其充分的自然阴干。
进一步,优选的是,B步骤中,种子清洗的具体方法为:
先用体积浓度为1%~2%的洗洁精水溶液浸泡15~20s,然后无菌水浸洗5~10s,最后用体积分数75%的酒精浸泡消毒10~15s。
进一步,优选的是,B步骤中,种子灭菌的具体方法为:
先用质量分数0.2%升汞溶液灭菌6~8min,再用无菌水浸泡清洗20~25min,最后用无菌滤纸吸干种子的表面水分。
进一步,优选的是,C步骤中,培养时,光照强度为2900~3400Lx,光照时间为12~14h/d,培养时间为13~15d。
进一步,优选的是,D步骤中,所述的含腋芽的茎段长为0.8~1.5cm。
进一步,优选的是,D步骤中,培养时,光照强度为3500~4000Lx,光照时间为15~17h/d,成苗培养的时间为18~20d。
进一步,优选的是,D步骤中,还包括增殖培养,具体为:将成苗切成含腋芽的茎段,所述的含腋芽的茎段长为0.8~1.5cm;然后将含腋芽的茎段接种到成苗培养基中,于25±2℃下培养成苗;依此反复循环。
进一步,优选的是,D步骤中,增殖培养的继代周期为18~20d。
本发明中,琼脂粉的强度为1200g/cm
本发明C步骤中,初代培养时的种子发芽率达96%以上。
本发明D步骤中,野生大豆成苗培养时的生长速度较快,成苗率为100%,生根率达100%,根系发达,根从基部发出,基部无愈伤组织,苗生长势较好、健壮,无玻璃化;增殖时的增殖系数可达3.00以上。
本发明将C步骤得到的植株切成含腋芽的茎段时,茎段包括顶端的茎尖在内;含有茎尖这部分的茎段长度优选为0.8~1.0cm,其余茎段长度优选为1.0~1.5cm。
本发明与现有技术相比,其有益效果为:
(1)本发明通过野生大豆的种子培养形成植株,再经过植株的含腋芽的茎段成苗培养后形成完整的苗,全过程不经过愈伤组织产生的阶段,属于“直接器官发生”途径的培养,可成功获得优质的组培苗,且可以高度保持野生大豆母株的遗传稳定性;
(2)本发明采用简单、成本低的方法自然阴干处理野生大豆的种子,有效破解了野生大豆种子因休眠导致的发芽困难、生长速度慢等瓶颈问题,初代培养时的种子发芽率高达96%以上,种子萌发后生长速度较快,从种子萌发至长成高5.0~7.0cm的植株,仅需13~15d;
(3)本发明研究提出了一种高效、成熟、完善的野生大豆组织培养技术体系:①优化了种子的清洗方法,实现了野生大豆的种子的高效灭菌;②成苗培养实现了一种培养基促使增殖和生根同步进行,省去了常规的单独增殖培养、单独生根培养两个步骤中的一步,简化了培养步骤,缩短了培养周期,降低了培养成本;③野生大豆属于喜光植物,所以在培养时,相比一般常用的培养条件(光照强度约2500Lx,光照时间为12h/d),本发明通过增加光照强度、延长光照时间的培养方法,提高了培养质量,培养出的植株显示生长健壮;④本发明中,野生大豆的组织培养全过程只用了2种培养基,培养时生长迅速,初代培养时间为13~15d,成苗培养的时间为18~20d,培养出的野生大豆成苗率达100%,种苗生长健壮,增殖系数可达3.00以上,生根率达100%,根系发达,根系质量较好(根是从基部发出且无愈伤组织),非常有利于幼苗成活,本发明实现了野生大豆组织培养的高效优质;
(4)本发明的技术步骤简单、成本低、成效显著,可高效、优质实现野生大豆的组织培养,易于实施和推广。
附图说明
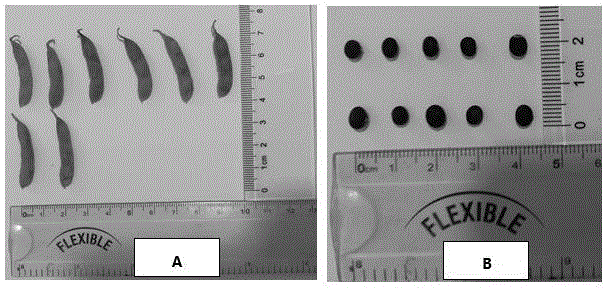
图1为本发明实施例中的经过自然阴干处理后的野生大豆种子图;其中,A图为豆荚,B图为剥开豆荚后的种子;
图2为本发明实施例4中的野生大豆初代培养图;图中显示,经初代培养后,种子萌发形成了高约6.4cm、生长健壮的野生大豆植株;
图3为本发明实施例4中的野生大豆成苗培养图。图中显示,经成苗培养后,形成了根系发达、生长健壮、高约6.9cm的野生大豆苗。
具体实施方式
下面结合实施例对本发明作进一步的详细描述。
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用材料或设备未注明生产厂商者,均为可以通过购买获得的常规产品。
实施例1
一种野生大豆组织培养的方法,包括以下步骤:
A、种子的采收和处理:在野生大豆生长季,当野生大豆成熟后,采收饱满、无病虫害、完好且无开裂的野生大豆豆荚,然后自然阴干处理;
B、种子的清洗和灭菌:将经A步骤处理后的豆荚剥开,挑选出饱满、无病虫害的种子,然后进行种子的清洗和灭菌处理;
C、初代培养:将经B步骤处理后的种子接种到初代培养基中,于25±1℃下培养,当种子萌发生长成高5.5~6.5cm、生长健壮的植株时,完成初代培养;
所述的初代培养基为:基础培养基MS+6-苄氨基嘌呤0.4mg/L+萘乙酸0.005mg/L+白砂糖28g/L+琼脂粉5.6g/L,pH为5.9;
D、成苗培养:将C步骤得到的植株切成含腋芽的茎段;然后将含腋芽的茎段接种到成苗培养基中,于25±2℃下培养成苗;
所述的成苗培养基为:改良的基础培养基MS+6-苄氨基嘌呤0.8mg/L+萘乙酸0.03mg/L+白砂糖28g/L+琼脂粉5.7g/L,pH为5.9;所述的改良的基础培养基MS是N H
实施例2
一种野生大豆组织培养的方法,包括以下步骤:
A、种子的采收和处理:在野生大豆生长季,当野生大豆成熟后,采收饱满、无病虫害、完好且无开裂的野生大豆豆荚,然后自然阴干处理;
B、种子的清洗和灭菌:将经A步骤处理后的豆荚剥开,挑选出饱满、无病虫害的种子,然后进行种子的清洗和灭菌处理;
C、初代培养:将经B步骤处理后的种子接种到初代培养基中,于23℃—25℃下培养,当种子萌发生长成高5.0~6.0cm、生长健壮的植株时,完成初代培养;
所述的初代培养基为:基础培养基MS+6-苄氨基嘌呤0mg/L+萘乙酸0mg/L+白砂糖25g/L+琼脂粉5.58g/L,pH为5.8;
D、成苗培养:将C步骤得到的植株切成含腋芽的茎段;然后将含腋芽的茎段接种到成苗培养基中,于23℃—25℃下培养成苗;
所述的成苗培养基为:改良的基础培养基MS+6-苄氨基嘌呤0.5mg/L+萘乙酸0.01mg/L+白砂糖25g/L+琼脂粉5.5g/L,pH为5.8;所述的改良的基础培养基MS是N H
其中,A步骤中,自然阴干处理的具体方法为:
将野生大豆豆荚装入40目的尼龙网袋,不碰撞、不挤压豆荚,并放置于清洁、通风、无鼠害、常温、阴凉的环境中,放置的时间长为1.0年,以让其充分的自然阴干。
B步骤中,种子清洗的具体方法为:
先用体积浓度为1%的洗洁精水溶液浸泡15s,然后无菌水浸洗5s,最后用体积分数75%的酒精浸泡消毒10s。
B步骤中,种子灭菌的具体方法为:
先用质量分数0.2%升汞溶液灭菌6min,再用无菌水浸泡清洗20min,最后用无菌滤纸吸干种子的表面水分。
C步骤中,培养时,光照强度为2900~3000Lx,光照时间为12h/d,培养时间为13d。
D步骤中,所述的含腋芽的茎段长为0.8~1.2cm。
D步骤中,培养时,光照强度为3500~3600Lx,光照时间为15h/d,成苗培养的时间为18d。
实施例3
一种野生大豆组织培养的方法,包括以下步骤:
A、种子的采收和处理:在野生大豆生长季,当野生大豆成熟后,采收饱满、无病虫害、完好且无开裂的野生大豆豆荚,然后自然阴干处理;
B、种子的清洗和灭菌:将经A步骤处理后的豆荚剥开,挑选出饱满、无病虫害的种子,然后进行种子的清洗和灭菌处理;
C、初代培养:将经B步骤处理后的种子接种到初代培养基中,于25℃—27℃下培养,当种子萌发生长成高6.5~7.0cm、生长健壮的植株时,完成初代培养;
所述的初代培养基为:基础培养基MS+6-苄氨基嘌呤0.8mg/L+萘乙酸0.01mg/L+白砂糖30g/L+琼脂粉5.8g/L,pH为6.0;
D、成苗培养:将C步骤得到的植株切成含腋芽的茎段;然后将含腋芽的茎段接种到成苗培养基中,于25℃—27℃下培养成苗;
所述的成苗培养基为:改良的基础培养基MS+6-苄氨基嘌呤1.0mg/L+萘乙酸0.05mg/L+白砂糖30g/L+琼脂粉5.8g/L,pH为6.0;所述的改良的基础培养基MS是N H
其中,A步骤中,自然阴干处理的具体方法为:
将野生大豆豆荚装入40目的尼龙网袋,不碰撞、不挤压豆荚,并放置于清洁、通风、无鼠害、常温、阴凉的环境中,放置的时间长为1.5年,以让其充分的自然阴干。
B步骤中,种子清洗的具体方法为:
先用体积浓度为2%的洗洁精水溶液浸泡20s,然后无菌水浸洗10s,最后用体积分数75%的酒精浸泡消毒15s。
B步骤中,种子灭菌的具体方法为:
先用质量分数0.2%升汞溶液灭菌8min,再用无菌水浸泡清洗25min,最后用无菌滤纸吸干种子的表面水分。
C步骤中,培养时,光照强度为3300~3400Lx,光照时间为14h/d,培养时间为15d。
D步骤中,所述的含腋芽的茎段长为1.0~1.5cm。
D步骤中,培养时,光照强度为3900~4000Lx,光照时间为17h/d,成苗培养的时间为20d。
实施例4
一种野生大豆组织培养的方法,包括以下步骤:
A、种子的采收和处理:在野生大豆生长季,当野生大豆成熟后,采收饱满、无病虫害、完好且无开裂的野生大豆豆荚,然后自然阴干处理;
B、种子的清洗和灭菌:将经A步骤处理后的豆荚剥开,挑选出饱满、无病虫害的种子,然后进行种子的清洗和灭菌处理;
C、初代培养:将经B步骤处理后的种子接种到初代培养基中,于25±2℃下培养,当种子萌发生长成高6.0~6.5cm、生长健壮的植株时,完成初代培养;
所述的初代培养基为:基础培养基MS+6-苄氨基嘌呤0.5mg/L+萘乙酸0.006mg/L+白砂糖28g/L+琼脂粉5.7g/L,pH为5.9;
D、成苗培养:将C步骤得到的植株切成含腋芽的茎段;然后将含腋芽的茎段接种到成苗培养基中,于25±1℃下培养成苗;
所述的成苗培养基为:改良的基础培养基MS+6-苄氨基嘌呤0.8mg/L+萘乙酸0.04mg/L+白砂糖28g/L+琼脂粉5.6g/L,pH为5.9;所述的改良的基础培养基MS是N H
其中,A步骤中,自然阴干处理的具体方法为:
将野生大豆豆荚装入40目的尼龙网袋,不碰撞、不挤压豆荚,并放置于清洁、通风、无鼠害、常温、阴凉的环境中,放置的时间长为1.2年,以让其充分的自然阴干。
B步骤中,种子清洗的具体方法为:
先用体积浓度为1.5%的洗洁精水溶液浸泡18s,然后无菌水浸洗8s,最后用体积分数75%的酒精浸泡消毒12s。
B步骤中,种子灭菌的具体方法为:
先用质量分数0.2%升汞溶液灭菌7min,再用无菌水浸泡清洗24min,最后用无菌滤纸吸干种子的表面水分。
C步骤中,培养时,光照强度为3000~3200Lx,光照时间为13h/d,培养时间为14d。
D步骤中,所述的含腋芽的茎段长为0.9~1.1cm。
D步骤中,培养时,光照强度为3600~3800Lx,光照时间为16h/d,成苗培养的时间为19d。
实施例5
一种野生大豆组织培养的方法,包括以下步骤:
A、种子的采收和处理:在野生大豆生长季,当野生大豆成熟后,采收饱满、无病虫害、完好且无开裂的野生大豆豆荚,然后自然阴干处理;
B、种子的清洗和灭菌:将经A步骤处理后的豆荚剥开,挑选出饱满、无病虫害的种子,然后进行种子的清洗和灭菌处理;
C、初代培养:将经B步骤处理后的种子接种到初代培养基中,于25±1℃下培养,当种子萌发生长成高5.0~5.5cm、生长健壮的植株时,完成初代培养;
所述的初代培养基为:基础培养基MS+6-苄氨基嘌呤0mg/L+萘乙酸0mg/L+白砂糖25g/L+琼脂粉5.5g/L,pH为5.8;
D、成苗培养:将C步骤得到的植株切成含腋芽的茎段;然后将含腋芽的茎段接种到成苗培养基中,于25±1℃下培养成苗;
所述的成苗培养基为:改良的基础培养基MS+6-苄氨基嘌呤0.5mg/L+萘乙酸0.01mg/L+白砂糖25g/L+琼脂粉5.5g/L,pH为5.8;所述的改良的基础培养基MS是N H
其中,A步骤中,自然阴干处理的具体方法为:
将野生大豆豆荚装入40目的尼龙网袋,不碰撞、不挤压豆荚,并放置于清洁、通风、无鼠害、常温、阴凉的环境中,放置的时间长为1.0年,以让其充分的自然阴干。
B步骤中,种子清洗的具体方法为:
先用体积浓度为1%的洗洁精水溶液浸泡15s,然后无菌水浸洗5s,最后用体积分数75%的酒精浸泡消毒10s。
B步骤中,种子灭菌的具体方法为:
先用质量分数0.2%升汞溶液灭菌6min,再用无菌水浸泡清洗20min,最后用无菌滤纸吸干种子的表面水分。
C步骤中,培养时,光照强度为2900~3000Lx,光照时间为12h/d,培养时间为13d。
D步骤中,所述的含腋芽的茎段长为0.8~1.2cm。
D步骤中,培养时,光照强度为3500~3600Lx,光照时间为15h/d,成苗培养的时间为18d。
D步骤中,还包括增殖培养,具体为:将成苗切成含腋芽的茎段,所述的含腋芽的茎段长为0.8~1.2cm;然后将含腋芽的茎段接种到成苗培养基中,于25±1℃下培养成苗;依此反复循环。
D步骤中,增殖培养的继代周期为18d。
实施例6
一种野生大豆组织培养的方法,包括以下步骤:
A、种子的采收和处理:在野生大豆生长季,当野生大豆成熟后,采收饱满、无病虫害、完好且无开裂的野生大豆豆荚,然后自然阴干处理;
B、种子的清洗和灭菌:将经A步骤处理后的豆荚剥开,挑选出饱满、无病虫害的种子,然后进行种子的清洗和灭菌处理;
C、初代培养:将经B步骤处理后的种子接种到初代培养基中,于25±2℃下培养,当种子萌发生长成高6.5~7.0cm、生长健壮的植株时,完成初代培养;
所述的初代培养基为:基础培养基MS+6-苄氨基嘌呤0.8mg/L+萘乙酸0.01mg/L+白砂糖30g/L+琼脂粉5.8g/L,pH为6.0;
D、成苗培养:将C步骤得到的植株切成含腋芽的茎段;然后将含腋芽的茎段接种到成苗培养基中,于25±2℃下培养成苗;
所述的成苗培养基为:改良的基础培养基MS+6-苄氨基嘌呤1.0mg/L+萘乙酸0.05mg/L+白砂糖30g/L+琼脂粉5.8g/L,pH为6.0;所述的改良的基础培养基MS是N H
其中,A步骤中,自然阴干处理的具体方法为:
将野生大豆豆荚装入40目的尼龙网袋,不碰撞、不挤压豆荚,并放置于清洁、通风、无鼠害、常温、阴凉的环境中,放置的时间长为1.5年,以让其充分的自然阴干。
B步骤中,种子清洗的具体方法为:
先用体积浓度为2%的洗洁精水溶液浸泡20s,然后无菌水浸洗10s,最后用体积分数75%的酒精浸泡消毒15s。
B步骤中,种子灭菌的具体方法为:
先用质量分数0.2%升汞溶液灭菌8min,再用无菌水浸泡清洗25min,最后用无菌滤纸吸干种子的表面水分。
C步骤中,培养时,光照强度为3200~3400Lx,光照时间为14h/d,培养时间为15d。
D步骤中,所述的含腋芽的茎段长为1.0~1.5cm。
D步骤中,培养时,光照强度为3800~4000Lx,光照时间为17h/d,成苗培养的时间为20d。
D步骤中,还包括增殖培养,具体为:将成苗切成含腋芽的茎段,所述的含腋芽的茎段长为1.0~1.5cm;然后将含腋芽的茎段接种到成苗培养基中,于25±2℃下培养成苗;依此反复循环。
D步骤中,增殖培养的继代周期为20d。
实施例7
一种野生大豆组织培养的方法,包括以下步骤:
A、种子的采收和处理:在野生大豆生长季,当野生大豆成熟后,采收饱满、无病虫害、完好且无开裂的野生大豆豆荚,然后自然阴干处理;
B、种子的清洗和灭菌:将经A步骤处理后的豆荚剥开,挑选出饱满、无病虫害的种子,然后进行种子的清洗和灭菌处理;
C、初代培养:将经B步骤处理后的种子接种到初代培养基中,于25±0.5℃下培养,当种子萌发生长成高5.5~6.5cm、生长健壮的植株时,完成初代培养;
所述的初代培养基为:基础培养基MS+6-苄氨基嘌呤0.4mg/L+萘乙酸0.005mg/L+白砂糖28g/L+琼脂粉5.7g/L,pH为5.9;
D、成苗培养:将C步骤得到的植株切成含腋芽的茎段;然后将含腋芽的茎段接种到成苗培养基中,于25±1℃下培养成苗;
所述的成苗培养基为:改良的基础培养基MS+6-苄氨基嘌呤0.8mg/L+萘乙酸0.03mg/L+白砂糖26g/L+琼脂粉5.6g/L,pH为5.9;所述的改良的基础培养基MS是N H
其中,A步骤中,自然阴干处理的具体方法为:
将野生大豆豆荚装入40目的尼龙网袋,不碰撞、不挤压豆荚,并放置于清洁、通风、无鼠害、常温、阴凉的环境中,放置的时间长为1.4年,以让其充分的自然阴干。
B步骤中,种子清洗的具体方法为:
先用体积浓度为1.5%的洗洁精水溶液浸泡18s,然后无菌水浸洗6s,最后用体积分数75%的酒精浸泡消毒13s。
B步骤中,种子灭菌的具体方法为:
先用质量分数0.2%升汞溶液灭菌7min,再用无菌水浸泡清洗24min,最后用无菌滤纸吸干种子的表面水分。
C步骤中,培养时,光照强度为3100~3200Lx,光照时间为13h/d,培养时间为14d。
D步骤中,所述的含腋芽的茎段长为0.9~1.3cm。
D步骤中,培养时,光照强度为3700~3800Lx,光照时间为16h/d,成苗培养的时间为19d。
D步骤中,还包括增殖培养,具体为:将成苗切成含腋芽的茎段,所述的含腋芽的茎段长为0.9~1.3cm;然后将含腋芽的茎段接种到成苗培养基中,于25±1℃下培养成苗;依此反复循环。
D步骤中,增殖培养的继代周期为19d。
试验结果
1.野生大豆的种子发芽率
不同方法处理种子对种子萌发效果产生了显著的影响。设置本发明的种子处理、对照的种子处理(野生大豆种子成熟后立即采收试验,即:不做带豆荚自然阴干的处理)两个试验处理,处理后的种子经灭菌、初代培养后试验种子发芽的效果。试验结果显示,通过本发明的方法处理种子后,初代培养时的种子发芽率为96.67%,而通过对照的方法处理种子后,初代培养时的种子发芽率为18.33%,前者高于后者78.34个百分点,这主要是因为本发明处理了种子后,打破并解除了种子的休眠(野生大豆在常温下的休眠期为7个月(张秀玲,2010)),极大地促进了种子萌发和生长,而对照种子具有较强的休眠性,所以导致了其较低的发芽率。
2.野生大豆的种子灭菌
将野生大豆的种子经质量分数0.2%升汞(HgCl
表1野生大豆种子的灭菌效果
不同方法清洗种子对种子灭菌效果产生了明显的影响。设置本发明的种子清洗方法、对照的种子清洗方法(采用组培上常用的外植体清洗法:先用流水冲洗2min;再用洗洁精水溶液浸泡3min;浸泡后流水冲洗2min,最后用体积分数75%的酒精浸泡消毒30s。)两个试验处理,处理后的种子经质量分数0.2%升汞灭菌种子7min试验灭菌效果。试验结果显示,通过本发明的方法清洗种子后灭菌,细菌污染率为13.75%,而通过对照的方法清洗种子后灭菌,细菌污染率为32.46%,前者低于后者18.71个百分点,这主要是因为:野生大豆的种子被豆荚包裹,种子相对干净,不需要采用常规方法清洗;野生大豆的种子经过1.0年~1.5年的阴干处理,种子的含水量较低,当清洗时若种子接触水的时间越长,就会更多地吸收水中的细菌,增加了灭菌难度,降低了灭菌效果。
3.初代培养
野生大豆种子经5种处理初代培养基的培养后,均能分化长成植株,但处理间的植株生长势差别明显,其中,植株生长势最好的处理是1、2,它们的植株生长势是较好、健壮(见表2),说明了这些培养基对野生大豆种子具有较好的培养效果。因此,适宜野生大豆种子初代培养的培养基是基础培养基MS+6-BA0~0.8mg/L+NAA0~0.01mg/L+白砂糖25g/L+琼脂粉(强度1200g/cm
表2不同处理对野生大豆初代培养的影响
注:表中的各种培养基含有白砂糖25g/L,琼脂粉(强度1200g/cm2)5.8g/L,pH为5.8,下同。
4.成苗培养
野生大豆的含腋芽的茎段经9种处理的成苗培养基培养后,均能成苗,成苗率达100%,处理间的增殖系数、苗生长势、株高、生根等表现出了明显的差异,其中生长势较好(健壮)、生根率较大(100%)、生根质量较好(根从基部发出,基部无愈伤组织)的处理是1、2、4、5(见表3和表4);同样的植物调节剂条件下,不同的基础培养基对野生大豆成苗培养的影响差异明显,主要表现在苗的长势和根粗(见表5和表6)。因此,适宜野生大豆成苗培养的培养基是改良的基础培养基MS+6-BA0.5~1.0mg/L+NAA0.01~0.05mg/L+白砂糖25g/L+琼脂粉(强度1200g/cm
表3不同处理对野生大豆成苗培养的影响
表4不同处理对野生大豆成苗培养的影响(续表3)
表5不同处理对野生大豆成苗培养的影响
表6不同处理对野生大豆成苗培养的影响(续表5)
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
