抗TROP-2抗体药物偶联物及其医药用途
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物医药领域,具体地说,本发明涉及抗TROP-2抗体偶联物及其医药用途。
背景技术
随着对肿瘤基因组学、蛋白组学及信号传导途径研究的不断深入,人们对肿瘤细胞的癌基因和抑癌基因的相互作用以及它们对肿瘤微环境的影响已经越来越清楚,这也使得针对肿瘤的特异性分子靶点设计抗肿瘤治疗新方案成为可能。
肿瘤的分子靶向治疗是一种有异于传统手术、放疗、化疗的新治疗模式,其优点在于药物通常仅与相应的靶位结合,通过直接影响其靶位分子的功能,或所携带的物理或化学效应分子来达到杀伤或抑制目标细胞的作用。由于靶位明确,该类药物通常具有很高的选择性,既可有效杀伤或抑制靶细胞,又对正常组织细胞不产生或仅产生较小的毒副作用。因此,研制分子靶向药物成为肿瘤临床研究的热点。
人滋养层细胞表面抗原2(human trophoblast cell surface antigen 2,TROP-2)是由TACSTD2基因编码的细胞表面糖蛋白。TROP-2由323个氨基酸构成,其中信号肽26个氨基酸,胞外区248个氨基酸,跨膜区23个氨基酸,胞质区26个氨基酸。TROP-2细胞外结构域中存在4个非均质N结合糖基化位点,添加糖链后,表观分子量增加11至13KD。TACSTD基因家族中,细胞外结构域具有特征性的甲状腺球蛋白(TY)序列,通常认为其与癌细胞的增殖、浸润、转移有关。
大量临床研究和文献报道表明TROP-2在胃癌、肺癌、大肠、卵巢癌、乳腺癌、前列腺癌、胰癌、肝癌、食道癌等多种上皮源癌肿中过度表达。与此相对,TROP-2在成年人正常组织中很少表达或不表达,仅限于上皮区域的细胞有少量表达,表达水平也比癌肿中低,表明TROP-2与肿瘤形成有关。TROP-2在肿瘤组织中的过表达与患者的预后不良和癌细胞的转移密切相关,同时影响患者的总生存率。因此,TROP-2已成为肿瘤分子靶向治疗中引人注目的靶标。
已经报告了几种抗hTROP-2抗体的抗肿瘤效果的研究:
美国专利第5840854号报告了与细胞毒素结合的抗hTROP-2单克隆抗体(BR110)对人癌细胞株H3619、H2987、MCF-7、H3396及H2981的细胞毒性。
美国专利第6653104号中公开了一种抗体(RS7),使用经放射性物质标记的抗体在体内模型中进行了试验,在裸小鼠异种移植模型中显示出抗肿瘤活性,但没有报告仅裸抗时的抗肿瘤效果。
美国专利第7420040号还报道了由人卵巢癌组织免疫小鼠而得的杂交瘤细胞株AR47A6.4.2或AR52A301.5产生的分离单克隆抗体与hTROP-2结合,并且在裸小鼠异种移植模型中显示抗肿瘤活性。
CN102827282A公开了一种人源抗TROP-2基因工程抗体IgG及其应用,体外试验结果表明该抗TROP-2抗体IgG对胰腺癌细胞的增殖具有显著的抑制作用。
CN104114580A公开了一种与hTROP-2特异性反应且在体内具有抗肿瘤活性的抗体(特别是人源化抗体),以及产生该抗体的杂交瘤、该抗体与药剂的复合物、肿瘤的诊断用或治疗用药物组合物、肿瘤的检测方法、肿瘤的检测用或诊断用试剂盒。
发明内容
本发明的目的在于提供一种通式(I)所示的抗体药物偶联物或其药学上可接受的盐或溶剂化合物,
其中:
W选自-(CR
R
X
g、u、v或h各自独立地选自1、2、3或4;优选地,g、u或h各自独立地选自1、2、3;更优选为2;v优选1或2,更优选1;
y为1~20,优选1~10,更优选2~8,进一步优选4、6或8;
mAb为抗TROP-2抗体或其抗原结合片段。
在本发明进一步优选的实施方式中,所述mAb抗体或其抗原结合片段包含重链可变区和轻链可变区,所述的抗体重链可变区包含至少1个选自以下序列所示的HCDR:SEQ IDNO:3,SEQ ID NO:4,SEQ ID NO:5;所述的抗体轻链可变区包含至少1个选自以下序列所述的LCDR:SEQ ID NO:6,SEQ ID NO:7,SEQ ID NO:8。
在本发明优选的实施方案中,根据本发明的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,其中所述的抗体重链可变区包含:
SEQ ID NO:3所示的HCDR1、
SEQ ID NO:4所示的HCDR2和
SEQ ID NO:5所示的HCDR3。
在本发明优选的实施方案中,根据本发明的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,其中所述的抗体轻链可变区包含:
SEQ ID NO:6所示的LCDR1、
SEQ ID NO:7所示的LCDR2和
SEQ ID NO:8所示的LCDR3。
在本发明优选的实施方案中,根据本发明的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,其中所述的抗体重链可变区包含:
SEQ ID NO:3所示的HCDR1、
SEQ ID NO:4所示的HCDR2和
SEQ ID NO:5所示的HCDR3;以及
所述的抗体轻链可变区包含:
SEQ ID NO:6所示的LCDR1、
SEQ ID NO:7所示的LCDR2和
SEQ ID NO:8所示的LCDR3。
在本发明优选的实施方案中,根据本发明的抗体-药物偶联物或其药学上可接受的盐或溶剂化合,所述抗TROP-2抗体或其抗原结合片段选自鼠源抗体或其抗原结合片段、嵌合抗体或其抗原结合片段、人抗体或其抗原结合片段、人源化抗体或其抗原结合片段。
在本发明优选的实施方案中,根据本发明的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,所述抗TROP-2抗体或其抗原结合片段进一步包含源自人IgG1、IgG2、IgG3或IgG4的重链恒定区或其变体。
在本发明进一步优选的实施方案中,所述抗TROP-2抗体或其抗原结合片段进一步包含源自人IgG1、IgG2或IgG4的重链恒定区或其变体。
在本发明进一步优选的实施方案中,所述抗TROP-2抗体或其抗原结合片段进一步包含如SEQ ID NO:48,或如SEQ ID NO:49所示的重链恒定区。
在本发明优选的实施方案中,根据本发明的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,所述抗TROP-2抗体或其抗原结合片段进一步包含源自人抗体κ链、λ链的轻链恒定区或其变体。
在本发明进一步优选的实施方案中,所述抗TROP-2抗体或其抗原结合片段进一步包含源自人抗体κ链的轻链恒定区;
在本发明进一步优选的实施方案中,所述抗TROP-2抗体或其抗原结合片段进一步包含如SEQ ID NO:50所示的轻链恒定区。
在本发明优选的实施方案中,根据本发明的所述的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,所述抗TROP-2抗体或其抗原结合片段包含选自以下序列所示的重链可变区,或与以下序列相比具有至少70%,75%,80%,85%,90%,95%或99%同一性的重链可变区:SEQ ID NO:9、SEQ ID NO:11、SEQ ID NO:13、SEQ ID NO:15、SEQ ID NO:17、SEQ ID NO:19、SEQ ID NO:21、SEQ ID NO:23或SEQ ID NO:25。
在本发明优选的实施方案中,根据本发明所述的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,其中所述抗TROP-2抗体或其抗原结合片段包含选自以下序列所示的轻链可变区,或与以下序列相比具有至少70%,75%,80%,85%,90%,95%或99%同一性的轻链可变区:SEQ ID NO:10、SEQ ID NO:12、SEQ ID NO:14、SEQ ID NO:16、SEQ ID NO:18、SEQ ID NO:20、SEQ ID NO:22、SEQ ID NO:24或SEQ ID NO:26。
在本发明优选的实施方案中,根据本发明所述的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,所述抗TROP-2抗体或其抗原结合片段含有选自如下序列所示的重链,或与以下序列相比具有至少80%,85%,90%,95%或99%同一性的重链:SEQ ID NO:27、SEQ ID NO:29、SEQ ID NO:31、SEQ ID NO:33、SEQ ID NO:35、SEQ ID NO:37、SEQ IDNO:39、SEQ ID NO:41、SEQ ID NO:43、SEQ ID NO:45或SEQ ID NO:46。
在本发明优选的实施方案中,根据本发明所述的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,所述抗TROP-2抗体或其抗原结合片段含有选自以下序列所示的轻链,,或与以下序列相比具有至少80%,85%,90%,95%或99%同一性的轻链:SEQ ID NO:28、SEQ ID NO:30、SEQ ID NO:32、SEQ ID NO:34、SEQ ID NO:36、SEQ ID NO:38、SEQ IDNO:40、SEQ ID NO:42或SEQ ID NO:44。
在本发明优选的实施方案中,根据本发明所述的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,其中所述抗TROP-2抗体或其抗原结合片段包含:
(1)SEQ ID NO:9所示的重链可变区和SEQ ID NO:10所示的轻链可变区;或,
(2)SEQ ID NO:11所示的重链可变区和SEQ ID NO:12所示的轻链可变区;或,
(3)SEQ ID NO:13所示的重链可变区和SEQ ID NO:14所示的轻链可变区;或,
(4)SEQ ID NO:15所示的重链可变区和SEQ ID NO:16所示的轻链可变区;或,
(5)SEQ ID NO:17所示的重链可变区和SEQ ID NO:18所示的轻链可变区;或,
(6)SEQ ID NO:19所示的重链可变区和SEQ ID NO:20所示的轻链可变区;或,
(7)SEQ ID NO:21所示的重链可变区和SEQ ID NO:22所示的轻链可变区;或,
(8)SEQ ID NO:23所示的重链可变区和SEQ ID NO:24所示的轻链可变区;或,
(9)SEQ ID NO:25所示的重链可变区和SEQ ID NO:26所示的轻链可变区。
在本发明优选的实施方案中,根据本发明所述的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物,其中所述抗TROP-2抗体包含:
(1)SEQ ID NO:27所示的重链和SEQ ID NO:28所示的轻链;或,
(2)SEQ ID NO:29所示的重链和SEQ ID NO:30所示的轻链;或,
(3)SEQ ID NO:31所示的重链和SEQ ID NO:32所示的轻链;或,
(4)SEQ ID NO:33所示的重链和SEQ ID NO:34所示的轻链;或,
(5)SEQ ID NO:35所示的重链和SEQ ID NO:36所示的轻链;或,
(6)SEQ ID NO:37所示的重链和SEQ ID NO:38所示的轻链;或,
(7)SEQ ID NO:39所示的重链和SEQ ID NO:40所示的轻链;或,
(8)SEQ ID NO:41所示的重链和SEQ ID NO:42所示的轻链;或,
(9)SEQ ID NO:43所示的重链和SEQ ID NO:44所示的轻链;或,
(10)SEQ ID NO:45所示的重链和SEQ ID NO:38所示的轻链;或,
(11)SEQ ID NO:46所示的重链和SEQ ID NO:28所示的轻链。
在本发明进一步优选的实施方式中,所述的抗体药物偶联物或其药学上可接受的盐或溶剂化合物,其选自如通式(II)所示的体药物偶联物或其药学上可接受的盐或溶剂化合物,或其互变异构体、内消旋体、外消旋体、对映异构体、非对映异构体、或其混合物形式:
y选自2-10,优选4-10,更优选4、6、8或10。
在本发明进一步优选的实施方式中,所述的抗体药物偶联物或其药学上可接受的盐或溶剂化合物,其选自如通式(III)所示的体药物偶联物或其药学上可接受的盐或溶剂化合物:
mAb选自上述的抗TROP-2抗体或其抗原结合片段;
y选自2-10,优选4-10,更优选4、6、8或10;
v为1或2。
在本发明进一步优选的实施方式中,所述的抗体药物偶联物或其药学上可接受的盐或溶剂化合物,所述抗体药物偶联物或其药学上可接受的盐或溶剂化合物选自如下结构:
/>
/>
/>
其中,y选自2-10,优选4-10,更优选4、6、8或10。
本发明还提供一种制备如通式(I)所示的抗体-药物偶联物或其药学上可接受的盐或溶剂化物的方法,其包括以下步骤:
mAb还原后,与通式(F)偶联反应,得到通式(I)所示的化合物;
其中,W如前述内容所定义。
mAb选自上述的抗TROP-2抗体或其抗原结合片段;
y为1~20;优选4-10;更优选4、6、8或10。
另一方面,本发明提供了一种药物组合物,其包含本发明所述的抗体-药物偶联物或所述抗体-药物偶联物药学上可接受的盐或溶剂化合物,和一种或多种可药用的赋形剂、稀释剂或载体。
另一方面,本发明提供一种医药用途,本发明涉及抗TROP-2抗体药物偶联物或所述抗体药物偶联物药学上可接受的盐或溶剂化合物或其药物组合物在用于治疗或预防TROP-2介导的疾病或病症的用途。
另一方面,本发明还提供了通式(I)所述的抗体-药物偶联物或所述抗体-药物偶联物药学上可接受的盐或溶剂化合物或其药物组合物在制备用于治疗与人TROP-2相关疾病的药物中的应用。
在本发明更优选的实施方案中,所述与人TROP-2相关的疾病为制备用于治疗TROP-2高表达的癌症的药物中的应用,所述的癌症选自三阴性乳腺癌、小细胞肺癌、尿路上皮癌、人脑星形胶质母细胞瘤、人咽头癌、肾上腺肿瘤、AIDS-相关癌症、腺泡状软组织肉瘤、星形细胞瘤、膀肮癌、骨癌、脑和脊髓癌、转移性脑瘤、乳腺癌、颈动脉体瘤、宫颈癌、软骨肉瘤、脊索瘤、肾嫌色细胞癌、透明细胞癌、结肠癌、结肠直肠癌、促结缔组织增生性小圆细胞肿瘤、室管膜细胞瘤、尤文肿瘤、骨外黏液样软骨肉瘤、骨纤维发育不全、骨纤维性发育不良、胆囊或胆管癌、胃癌、妊娠滋养细胞病、生殖细胞瘤、头颈癌、肝细胞癌、胰岛细胞瘤、卡波因肉瘤、肾癌、白血病、脂肪肉瘤、恶性脂肪瘤性肿瘤、肝癌、淋巴瘤、肺癌、成神经管细胞瘤、黑色素瘤、脑膜瘤、多发性内分泌瘤病、多发性骨髓瘤、骨髓增生异常综合征、成神经细胞瘤、神经内分泌肿瘤、卵巢癌、胰腺癌、乳头状甲状腺癌、甲状旁腺瘤、小儿癌症、外周神经鞘瘤、嗜铭细胞瘤、垂体肿瘤、前列腺癌、后葡萄膜黑色素瘤、肾转移性癌、横纹肌样瘤、横纹肌肉瘤、肉瘤、皮肤癌、软组织肉瘤、鳞状细胞癌、滑膜肉瘤、辜丸癌、胸腺癌、胸腺瘤、甲状腺转移性癌和子宫癌。
本发明的抗体-药物偶联物或其药学上可接受的盐或溶剂化合物能够特异性结合靶抗原,内吞效率高,体内半衰期时间长,在保证安全性的同时,显著杀伤肿瘤。
本发明的抗体药物偶联物及其可药用盐或溶剂化合物具有显著的抗肿瘤效果和良好的安全性,同是具有良好的体内代谢活性,体内药效时间长,临床应用前景广阔。
发明详述
一、术语
为了更容易理解本申请,以下具体定义了某些技术和科学术语。除显而易见在本文件中的它处另有明确定义,否则本文使用的所有其它技术和科学术语都具有本申请所属领域的一般技术人员通常理解的含义。
本申请所用氨基酸三字母代码和单字母代码如J.Biol.Chem,243,p3558(1968)中所述。
本申请所述的术语“抗体”指免疫球蛋白,是由两条相同的重链和两条相同的轻链通过链间二硫键连接而成的四肽链结构。免疫球蛋白重链恒定区的氨基酸组成和排列顺序不同,故其抗原性也不同。据此,可将免疫球蛋白分为五类,或称为免疫球蛋白的同种型,即IgM、IgD、IgG、IgA和IgE,其相应的重链分别为μ链、δ链、γ链、α链和ε链。同一类Ig根据其铰链区氨基酸组成和重链二硫键的数目和位置的差别,又可分为不同的亚类,如IgG可分为IgG1、IgG2、IgG3、IgG4。轻链通过恒定区的不同分为κ链或λ链。五类Ig中第每类Ig都可以有κ链或λ链。
在本申请中,本申请所述的抗体轻链可变区可进一步包含轻链恒定区,所述的轻链恒定区包含人源或鼠源的κ、λ链或其变体。
在本申请中,本申请所述的抗体重链可变区可进一步包含重链恒定区,所述的重链恒定区包含人源或鼠源的IgG1、IgG2、IgG 3、IgG 4或其变体。
抗体重链和轻链靠近N端的约110个氨基酸的序列变化很大,为可变区(V区);靠近C端的其余氨基酸序列相对稳定,为恒定区(C区)。可变区包括3个高变区(HVR)和4个序列相对保守的骨架区(FR)。3个高变区决定抗体的特异性,又称为互补性决定区(CDR)。每条轻链可变区(VL)和重链可变区(VH)由3个CDR区4个FR区组成,从氨基端到羧基端依次排列的顺序为:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。轻链的3个CDR区指LCDR1、LCDR2,和LCDR3;重链的3个CDR区指HCDR1、HCDR2和HCDR3。本申请所述的抗体或抗原结合片段的VL区和VH区的CDR氨基酸残基在数量和位置符合已知的Kabat编号规则和Kabat或ABM定义规则(http://bioinf.org.uk/abs/)。
术语“抗原呈递细胞”或“APC”是在其表面上展示与MHC复合的外来抗原的细胞。T细胞利用T细胞受体(TCR)识别这种复合物。APC的实例包括但不限于树突细胞(DC)、外用血单个核细胞(PBMC)、单核细胞、B淋巴母细胞和单核细胞衍生的树突细胞。
术语“抗原呈递”是指APC捕获抗原和使它们能够被T细胞识别的过程,例如作为MHC-I/MHC-II偶联物的组分。
术语“TROP-2”包括由细胞天然表达的TROP-2的任何变体或同种型。本发明的抗体可与得自非人物种的TROP-2交叉反应。作为另一种选择,该抗体也可以是人TROP-2特异性的,可不表现出与其他物种的交叉反应性。TROP-2或其任何变体或同种型可从天然表达它们的细胞或组织中分离而得,或使用本领域通用以及本文所述的那些技术通过重组技术产生。优选地,抗TROP-2抗体靶向具有正常糖基化模式的人源TROP-2。
术语“重组人抗体”包括通过重组方法制备、表达、创建或分离的人抗体,所涉及的技术和方法在本领域中是熟知的,诸如:
1.从人免疫球蛋白基因的转基因、转染色体动物(例如小鼠)或由其制备的杂交瘤中分离的抗体;
2.从经转化以表达抗体的宿主细胞如转染瘤中分离的抗体;
3.从重组组合人抗体文库中分离的抗体;以及
4.通过将人免疫球蛋白基因序列剪接到其他DNA序列等方法制备、表达、创建或分离的抗体。
此类重组人抗体包含可变区和恒定区,这些区域利用特定的由种系基因编码的人种系免疫球蛋白序列,但也包括随后诸如在抗体成熟过程中发生的重排和突变。
术语“鼠源抗体”在本发明中为根据本领域知识和技能制备的对人TROP-2的单克隆抗体。制备时用TROP-2抗原注射试验对象,然后分离表达具有所需序列或功能特性的抗体的杂交瘤。在本发明一个优选的实施方案中,所述的鼠源TROP-2抗体或其抗原结合片段,可进一步包含鼠源κ、λ链或其变体的轻链恒定区,或进一步包含鼠源IgG1、IgG2、IgG3或IgG4或其变体的重链恒定区。
术语“人抗体”包括具有人种系免疫球蛋白序列的可变和恒定区的抗体。本申请的人抗体可包括不由人种系免疫球蛋白序列编码的氨基酸残基(如通过体外随机或位点特异性诱变或通过体内体细胞突变所引入的突变)。然而,术语“人抗体”不包括这样的抗体,即其中已将衍生自另一种哺乳动物物种(诸如小鼠)种系的CDR序列移植到人骨架序列上(即“人源化抗体”)。
术语“人源化抗体(humanized antibody)”,也称为CDR移植抗体(CDR-graftedantibody),是指将小鼠的CDR序列移植到人的抗体可变区框架中产生的抗体。人源化抗体可以克服嵌合抗体由于携带大量小鼠蛋白成分,从而诱导的强烈的免疫应答反应的缺点。为避免在免疫原性下降的同时引起活性的下降,可对所述的人抗体可变区可进行最少反向突变,以保持活性。
术语“嵌合抗体(chimeric antibody)”,是将鼠源性抗体的可变区与人抗体的恒定区融合而成的抗体,可以减轻鼠源性抗体诱发的免疫应答反应。建立嵌合抗体,要选建立分泌鼠源性特异性单抗的杂交瘤,然后从小鼠杂交瘤细胞中克隆可变区基因,再要据需要对人抗体的恒定区基因进行克隆,将小鼠可变区基因与人恒定区基因连接成嵌合基因后插入人载体中,最后在真核工业系统或原核工业系统中表达嵌合抗体分子。人抗体的恒定区可选自人源IgG1、IgG2、IgG3或IgG4或其变体的重链恒定区,优选包含人源IgG1、IgG2或IgG4重链恒定区,或者使用氨基酸突变后增强ADCC(antibody-dependent cell-mediatedcytotoxicity,抗体依赖的细胞介导的细胞毒作用)毒性的IgG1重链恒定区。
术语“抗原结合片段”是指抗体的抗原结合片段及抗体类似物,其通常包括至少部分母体抗体(parental antibody)的抗原结合区或可变区(例如一个或多个CDR)。抗体片段保留母体抗体的至少某些结合特异性。通常,当基于摩尔来表示活性时,抗体片段保留至少10%的母体结合活性。优选地,抗体片段保留至少20%、50%、70%、80%、90%、95%或100%或更多的母体抗体对靶标的结合亲和力。抗原结合片段实例包括但不限于:Fab、Fab’、F(ab’)2、Fv片段、线性抗体(linear antibody)、单链抗体、纳米抗体、结构域抗体和多特异性抗体。工程改造的抗体变体综述于Holliger和Hudson,2005,Nat.Biotechnol.23:1126-1136中。
“Fab片段”由一条轻链和一条重链的CH1及可变区组成。Fab分子的重链不能与另一个重链分子形成二硫键。
“Fc”区含有包含抗体的CH2和CH3结构域的两个重链片段。两个重链片段由两个或多个二硫键并通过CH3结构域的疏水作用保持在一起。
“Fab’片段”含有一条轻链和包含VH结构域和CH1结构域以及CH1和CH2结构域之间区域的一条重链的部分,由此可在两个Fab’片段的两条重链之间形成链间二硫键以形成F(ab’)2分子。
“F(ab’)2片段”含有两条轻链和两条包含CH1和CH2结构域之间的恒定区的部分的重链,由此在两条重链间形成链间二硫键。因此,F(ab’)2片段由通过两条重链间的二硫键保持在一起的两个Fab’片段组成。
“Fv区”包含来自重链和轻链二者的可变区,但缺少恒定区。
术语“多特异性抗体”按其最广义使用,涵盖具有多表位特异性的抗体。这些多特异性抗体包括但不限于:包含重链可变区VH和轻链可变区VL的抗体,其中该VH-VL单元具有多表位特异性;具有两个或多个VL和VH区的抗体,每个VH-VL单元与不同的靶点或同一个靶点的不同表位结合;具有两个或更多个单可变区的抗体,每个单可变区与不同的靶点或同一个靶点的不同的表位结合;全长抗体、抗体片段、双抗体(diabodies)、双特异性双抗体和三抗体(triabodies)、己共价或非共价连接在一起的抗体片段等。
术语“单链抗体”是由抗体的重链可变区VH和轻链可变区VL通过一段连接肽连接而成的单链重组蛋白,它是具有完全抗原结合位点的最小抗体片段。
术语“结构域抗体片段”是仅含有重链可变区或轻链可变区链的具有免疫学功能的免疫球蛋白片段。在某些情况下,两个或多个VH区与肽接头共价连接以形成二价结构域抗体片段。二价结构域抗体片段的两个VH区可靶向相同或不同抗原。
本申请的术语“与TROP-2结合”,指能与人TROP-2相互作用。
本申请的术语“抗原结合位点”指本申请抗体或抗原结合片段识别的三维空间位点。
术语“表位”是指抗原上与免疫球蛋白或抗体特异性结合的位点。表位可以由相邻的氨基酸、或通过蛋白质的三级折叠而并列的不相邻的氨基酸形成。由相邻的氨基酸形成的表位通常在暴露于变性溶剂后保持,而通过三级折叠形成的表位通常在变性溶剂处理后丧失。表位通常以独特的空间构象包括至少3-15个氨基酸。确定什么表位由给定的抗体结合的方法在本领域中是熟知的,包括免疫印迹和免疫沉淀检测分析等。确定表位的空间构象的方法包括本领域中的技术和本文所述的技术,例如X射线晶体分析法和二维核磁共振等。
本申请所用的术语“特异性结合”、“选择性结合”是指抗体与预定的抗原上的表位结合。通常,当使用人TROP-2作为分析物并使用抗体作为配体,在仪器中通过表面等离子体共振(SPR)技术测定时,抗体以大约低于10
术语“交叉反应”是指本申请的抗体与来自不同物种的TROP-2结合的能力。例如,结合人TROP-2的本申请的抗体也可以结合另一物种的TROP-2。交叉反应性是通过在结合测定(例如SPR和ELISA)中检测与纯化抗原的特异性反应性,或与生理表达TROP-2的细胞的结合或功能性相互作用来测量。确定交叉反应性的方法包括如本文所述的标准结合测定,例如表面等离子体共振(SPR)分析,或流式细胞术。
术语“抑制”或“阻断”可互换使用,并涵盖部分和完全抑制/阻断这两者。配体的抑制/阻断优选地降低或改变无抑制或阻断的情况下发生配体结合时出现活性的正常水平或类型。抑制和阻断也旨在包括与抗TROP-2抗体接触时,与未与抗TROP-2抗体接触的配体相比,任何可测量的配体结合亲和力降低。
术语“抑制生长”(例如涉及细胞)旨在包括细胞生长任何可测量的降低。
术语“诱导免疫应答”和“增强免疫应答”可互换使用,并指免疫应答对特定抗原的剌激(即,被动或适应性的)。针对诱导CDC或ADCC的术语“诱导”是指剌激特定的直接细胞杀伤机制。
本申请中所述的“ADCC”,即antibody-dependent cell-mediated cytotoxicity,抗体依赖的细胞介导的细胞毒作用,是指表达Fc受体的细胞通过识别抗体的Fc段直接杀伤被抗体包被的靶细胞。可通过对IgG上Fc段的修饰,增强或降低降低或消除抗体的ADCC效应功能。所述的修饰指在抗体的重链恒定区进行突变。
生产和纯化抗体和抗原结合片段的方法在现有技术中熟知和能找到,如冷泉港的抗体实验技术指南,5-8章和15章。如,小鼠可以用人TROP-2或其片段免疫,所得到的抗体能被复性、纯化,并且可以用常规的方法进行氨基酸测序。抗原结合片段同样可以用常规方法制备。发明所述的抗体或抗原结合片段用基因工程方法在非人源的CDR区加上一个或多个人FR区。人FR种系序列可以从ImMunoGeneTics(IMGT)的网站http://imgt.cines.fr得到,或者从免疫球蛋白杂志,2001ISBN012441351上获得。
本申请工程化的抗体或抗原结合片段可用常规方法制备和纯化。相应抗体的cDNA序列可以克隆并重组至GS表达载体。重组的免疫球蛋白表达载体可以稳定地转染CHO细胞。作为一种更推荐的现有技术,哺乳动物类表达系统会导致抗体的糖基化,特别是在FC区的高度保守N端。通过表达与人源抗原特异性结合的抗体得到稳定的克隆。阳性的克隆在生物反应器的无血清培养基中扩大培养以生产抗体。分泌了抗体的培养液可以用常规技术纯化、收集。抗体可用常规方法进行过滤浓缩。可溶的混合物和多聚体,也可以用常规方法去除,比如分子筛、离子交换。得到的产物需立即冷冻,如-70℃,或者冻干。
本申请的抗体指单克隆抗体。本申请所述的单克隆抗体(mAb),指由单一的克隆细胞株得到的抗体,所述的细胞株不限于真核的,原核的或噬菌体的克隆细胞株。单克隆抗体或抗原结合片段可以用如杂交瘤技术、重组技术、噬菌体展示技术、合成技术(如CDR-grafting)、或其它现有技术进行重组得到。
“施用”、“给予”和“处理”当应用于动物、人、实验受试者、细胞、组织、器官或生物流体时,是指外源性药物、治疗剂、诊断剂或组合物与动物、人、受试者、细胞、组织、器官或生物流体的接触。“施用”、“给予”和“处理”可以指例如治疗、药物代谢动力学、诊断、研究和实验方法。细胞的处理包括试剂与细胞的接触,以及试剂与流体的接触,其中所述流体与细胞接触。“施用”、“给予”和“处理”还意指通过试剂、诊断、结合组合物或通过另一种细胞体外和离体处理例如细胞。“处理”当应用于人、兽医学或研究受试者时,是指治疗处理、预防或预防性措施,研究和诊断应用。
“治疗”意指给予患者内用或外用治疗剂,诸如包含本申请的任一种抗体,所述患者具有一种或多种疾病症状,而已知所述治疗剂对这些症状具有治疗作用。通常,在受治疗患者或群体中以有效缓解一种或多种疾病症状的量给予治疗剂,无论是通过诱导这类症状退化还是抑制这类症状发展到任何临床右测量的程度。有效缓解任何具体疾病症状的治疗剂的量(也称作“治疗有效量”)可根据多种因素变化,例如患者的疾病状态、年龄和体重,以及药物在患者产生需要疗效的能力。通过医生或其它专业卫生保健人士通常用于评价该症状的严重性或进展状况的任何临床检测方法,可评价疾病症状是否已被减轻。尽本申请的实施方案(例如治疗方法或制品)在缓解每个患都有的目标疾病症状方面可能无效,但是根据本领域已知的任何统计学检验方法如Student t检验、卡方检验、依据Mann和Whitney的U检验、Kruskal-Wallis检验(H检验)、Jonckheere-Terpstra检验和Wilcoxon检验确定,其在统计学显著数目的患者中应当减轻目标疾病症状。
整个说明书和权利要求书中使用的术语“基本上由……组成”或其变形表示包括所有所述元件或元件组,并且任选包括与所述元件类似或不同性质的其它元件,所述其它元件非显著改变指定给药方案、方法或组合物的基本性质或新性质。
本申请所述的应用于某个对象的术语“天然存在的”是指这样的事实,即该对象可在自然界中发现。例如存在于可从自然界来源分离得到的生物体(包括病毒)、且未经人工在实验室中有意修饰的多肽序列或多核苷酸序列即是天然存在的。
“有效量”包含足以改善或预防医字病症的症状或病症的量。有效量还意指足以允许或促进诊断的量。用于特定患者或兽医学受试者的有效量可依据以下因素而变化:如待治疗的病症、患者的总体健康情况、给药的方法途径和剂量以及副作用严重性。有效量可以是避免显著副作用或毒性作用的最大剂量或给药方案。
“外源性”指要据背景在生物、细胞或人体外产生的物质。
“内源性”指根据背景在细胞、生物或人体内产生的物质。
“同源性”是指两个多核苷酸序列之间或两个多肽之间的序列相似性。当两个比较序列中的位置均被相同碱基或氨基酸单体亚基占据时,例如如果两个DNA分子的每一个位置都被腺嘌呤占据时,那么所述分子在该位置是同源的。两个序列之间的同源性百分率是两个序列共有的匹配或同源位置数除以比较的位置数×100%的函数。例如,在序列最佳比对时,如果两个序列中的10个位置有6个匹配或同源,那么两个序列为60%同源。一般而言,当比对两个序列而得到最大的同源性百分率时进行比较。
本文使用的表述“细胞”、“细胞系”和“细胞培养物”可互换使用,并且所有这类名称都包括其后代。因此,单词“转化体”和“转化细胞”包括原代受试细胞和由其衍生的培养物,而不考虑转移数目。还应当理解的是,由于故意或非有意的突变,所有后代在DNA含量方面不可能精确相同。包括具有与最初转化细胞中筛选的相同的功能或生物学活性的突变后代。“任选”或“任选地”意味着随后所描述地事件或环境可以但不必发生,该说明包括该事件或环境发生或不发生地场合。例如,“任选包含1-3个抗体重链可变区”意味着特定序列的抗体重链可变区可以但不必须存在。
“药物组合物”表示含有一种或多种本文所述抗体或其抗原结合片段,以及其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
“可药用盐”是指本发明抗体-药物偶联物的盐,这类盐用于哺乳动物体内时具有安全性和有效性,其具有应有的生物活性。本发明抗体-药物偶联物至少含有一个氨基,因此可以与酸形成盐,可药用盐的非限制性实例包括:盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、柠檬酸盐、乙酸盐、琥珀酸盐、抗坏血酸盐、草酸盐、硝酸盐、梨酸盐、磷酸氢盐、磷酸二氢盐、水杨酸盐、柠檬酸氢盐、酒石酸盐、马来酸盐、富马酸盐、甲酸盐、苯酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐。
“溶剂化合物”指本发明的抗体-药物偶联物化合物与一种或多种溶剂分子形成可药用的溶剂化合物,溶剂分子的非限制性实例包括:水、乙醇、乙腈、异丙醇、乙酸乙酯。
“细胞毒性药物”在用于本发明时指抑制细胞的功能和/或引起细胞死亡或破坏的物质。
“微管蛋白抑制剂”是指通过抑制微管蛋白的聚合或促进微管蛋白的集合而干扰细胞有丝分裂过程,从而发挥抗肿瘤效果的一类化合物。其非限制性实例包括:美登素类、卡利奇霉素、紫杉烷类、长春新碱、秋水仙碱、尾海兔素/奥瑞他汀/单甲基奥瑞他汀E(MMAE)/单甲基奥瑞他汀F(MMAF)。
“接头”指包含是抗体共价附着于药物的共价键或原子链的化学模块。接头的非限制性实例包括:亚芳基、亚杂芳基、PEG、聚亚甲基氧基、琥珀酸酯、琥珀酰胺、二乙醇酸酯、丙二酸酯和己酰胺。
“药物载荷”(DAR)由y表示,即通式(I)中每个抗体的平均细胞毒性药物数。本发明中的药物荷载范围可以为每个抗体1-20个细胞毒性药物。通式(I)的抗体-药物偶联物为偶联有一定范围(1-20个)细胞毒性药物的抗体的集合。来自偶联反应的抗体-药物偶联物中的药物载荷(DAR)可通过常规手段表征,诸如质谱,HPLC和ELISA等。通过这些手段可以测定抗体-药物偶联物在y值上的定量分布。
本发明还包括各种氘化形式的通式(I)化合物。与碳原子连接的各个可用的氢原子可独立地被氘原子替换。本领域技术人员能够参考相关文献合成氘化形式的式(I)化合物。在制备氘代形式的通式(I)化合物时可使用市售的氘代起始物质,或它们可使用常规技术采用氘代试剂合成,氘代试剂包括但不限于氘代硼烷、三氘代硼烷四氢呋喃溶液、氘代氢化锂铝、氘代碘乙烷和氘代碘甲烷等。
术语“药物组合物”表示含有一种或多种本文所述化合物或其生理学上/可药用的盐或前体药物与其他化学组分的混合物,以及其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。常规的药物组合物的制备见中国药典。
术语“药学上可接受的盐”或“可药用盐”是指本发明抗体药物偶联物的盐,或本发明中所述的化合物的盐,这类盐用于哺乳动物体内时具有安全性和有效性,且具有应有的生物活性,本发明配体药物偶联物至少含有一个氨基,因此可以与酸形成盐,可药用盐的非限制性实例包括:盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、柠檬酸盐、乙酸盐、琥珀酸盐、抗坏血酸盐、草酸盐、硝酸盐、梨酸盐、磷酸氢盐、磷酸二氢盐、水杨酸盐、柠檬酸氢盐、酒石酸盐、马来酸盐、富马酸盐、甲酸盐、苯甲酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐。
术语“载药量”是指通式(I)分子中每个抗体或其抗原片段上加载的细胞毒性药物平均数量,也可以表示为药物量和抗体量的比值,药物载量的范围可以是每个配体连接0-12个,优选1-10个细胞毒性药物。在本发明的实施方案中,载药量表示为y,也可称为DAR值,示例性的为1、2、3、4、5、6、7、8、9、10的均值。可用常规方法如UV/可见光光谱法、质谱、ELISA试验和HPLC特征鉴定偶联反应后每个ADC分子的药物品均数量。
本发明的一些实施方式中,细胞毒性药物通过连接单元偶联在配体的N端氨基和/或赖氨酸残基的ε-氨基上,在本发明的另一些实施方式中,细胞毒性药物通过连接单元偶联在配体的巯基上。一般地,偶联反应中能与抗体偶联的药物分子数将小于理论上的最大值。
可以用以下非限制性方法控制配体细胞毒性药物偶联物的载量,包括:
(1)控制连接试剂和单抗的摩尔比,
(2)控制反应时间和温度,
(3)选择不同的反应试剂。
本发明的抗体药物偶联物或其可药用盐或溶剂化合物具有显著的抗肿瘤效果和良好的安全性。
附图说明
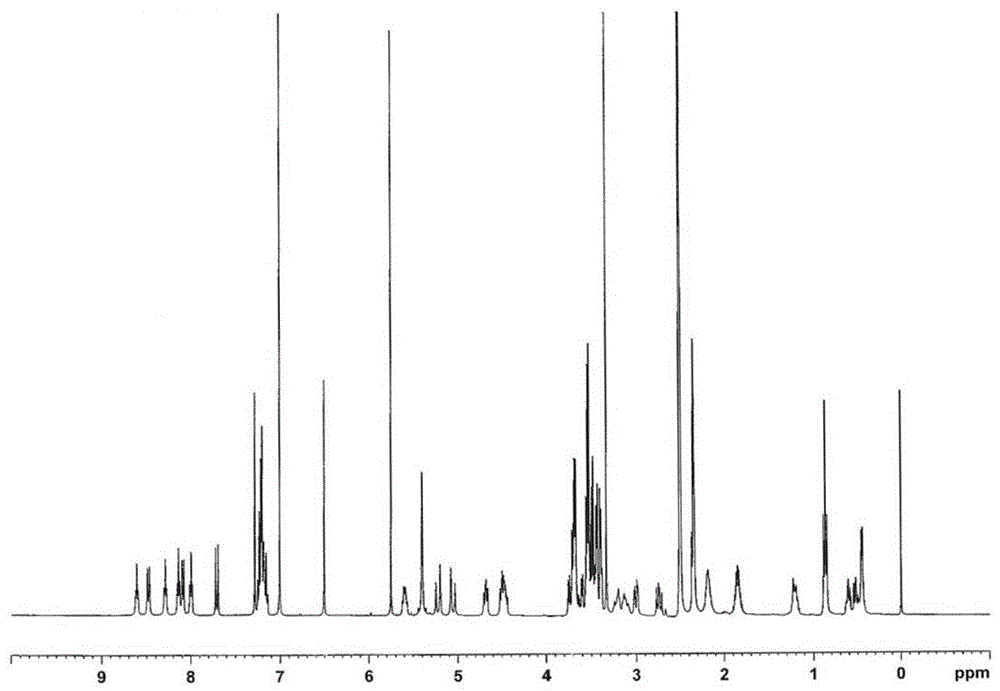
图1为化合物D的
具体实施方式
以下结合实施例用于进一步描述本发明,但这些实施例并非限制着本发明的范围。本发明实施例中未注明具体条件的实验方法,通常按照常规条件,如冷泉港的抗体技术实验手册,分子克隆手册;或按照原料或商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常规试剂。
实施例1抗原准备
编码带His标签的人TROP-2(TROP-2-His)蛋白由SinoBiologics公司合成(10428-H08H)。
TROP-2-His序列:
MARGPGLAPPPLRLPLLLLVLAAVTGHTAAQDNCTCPTNKMTVCSPDGPGGRCQCRALGSGMAVDCSTLTSKCLLLKARMSAPKNARTLVRPSEHALVDNDGLYDPDCDPEGRFKARQCNQTSVCWCVNSVGVRRTDKGDLSLRCDELVRTHHILIDLRHRPTAGAFNHSDLDAELRRLFRERYRLHPKFVAAVHYEQPTIQIELRQNTSQKAAGDVDIGDAAYYFERDIKGESLFQGRGGLDLRVRGEPLQVERTLIYYLDEIPPKFSMKRLTAGLIAVIVVVVVALVAGMAVLVITNRRKSGKYKKVEIKELGELRKEPSLHHHHHHHH
SEQ ID NO:47
实施例2鼠杂交瘤及抗体序列的获得
用人抗原TROP-2-His进行动物免疫,共5只Balb/c和5只A/J小鼠,雌性,10周龄,使用Sigma完全弗氏佐剂(CFA)和Sigma不完全弗氏佐剂(IFA),免疫原和免疫佐剂以1:1的比例充分混合乳化,制成稳定“油包水”液体;注射剂量25μg/200μL/小鼠。
表1.免疫方案
对免疫小鼠血清使用如实施例4所述的间接ELISA法评估血清效价及结合细胞表面抗原的能力,对照效价检测情况(大于10万倍稀释度)决定启动细胞融合。选择血清效价、亲和力和FACS结合强的免疫小鼠进行一次终免疫后处死小鼠,取脾细胞和SP2/0骨髓瘤细胞融合后铺板获得杂交瘤,通过间接ELISA筛选到目标杂交瘤,并通过有限稀释法建株为单克隆细胞株。得到的阳性抗体株进一步使用间接ELISA进行筛选,从而选定结合重组蛋白的杂交瘤。收集对数生长期杂交瘤细胞,用Trizol(Invitrogen,15596-018)提取RNA并反转录(PrimeScript
鼠单抗M1的重链和轻链可变区序列如下:
M1 HCVR
QVQLQQPGAELVRPGASVKLSCRASGYTFT
SEQ ID NO:1
M1 LCVR
DIVMTQSHKFMSTSVGDRVSITC
SEQ ID NO:2
表2.鼠单抗M1的重链和轻链可变区CDR序列
实施例3抗体的体外结合活性检测方法
(1)体外间接ELISA结合实验:
用pH7.4的PBS将TROP-2His蛋白(Sino Biological Inc.,cat#10428-H08H)稀释至1μg/ml浓度,以100μl/孔的体积加入96孔高亲和力酶标板中,于4℃冰箱孵育过夜(16-20小时)。用PBST(pH7.4 PBS含0.05%Tween-20)洗板4次后,加入用PBST稀释的3%牛血清白蛋白(BSA)封闭液150μl/孔,室温孵育1小时进行封闭。封闭结束后,弃去封闭液,并用PBST缓冲液洗板4次。
用含3%BSA的PBST稀释待测抗体,1μM起始,10倍梯度,10个剂量,以100μl/孔加到酶标板中,放于室温孵育1小时。孵育结束后用PBST洗板4次,加入100μl/孔用含3%BSA的PBST稀释的HRP标记羊抗人二抗(Abcam,cat#ab97225),室温孵育1小时。用PBST洗板4次后,加入100μl/孔TMB显色底物(Cell Signaling Technology,cat#7004S),于室温避光孵育1分钟,加入100μl/孔终止溶液(Cell Signaling Technology,cat#7002S)终止反应,用酶标仪(BioTek,型号Synergy H1)在450nm处读取吸收值,分析数据。做浓度信号值曲线分析结果,如下表所示:
表3.鼠抗体对人TROP-2抗原的亲和力(EC
实施例4小鼠抗体人源化实验
鼠源抗人TROP-2单克隆抗体人源化如本领域许多文献公示的方法进行。简言之,使用人恒定结构域替代亲本(鼠源抗体)恒定结构域,根据鼠源抗体和人抗体的同源性选择人种抗体序列,本发明将鼠源抗体M1进行人源化。
在所获得的鼠源抗体VH/VL CDR典型结构的基础上,将重、轻链可变区序列与人源抗体种系数据库比较,获得同源性高的人种系模板。
将鼠源抗体M1的CDR区移植到选择好的相应人源化模板上。然后,以鼠源抗体的三维结构为基础,对包埋残基、与CDR区有直接相互作用的残基,以及对VL和VH的构象有重要影响的残基进行回复突变,经表达测试和回复突变数量对比,选择出设计了人源化重链可变区HCVR和轻链可变区LCVR序列组合而成的抗体,序列如下:
HU1 HCVR
QVQLVQSGAEVKKPGSSVKVSCKASGYTFTNYWMNWVRQAPGKGLEWVGRIDPNDSETHYNQKFKDRFTITRDNSKNTLYLQMNSLRAEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSS
SEQ ID NO:9
HU1 LCVR
AIRMTQSPFSLSASVGDRVTITCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTRIPPRFSGSGYGTDFTLTINNIESEDAAYYFCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:10
HU2 HCVR
EVQLLESGGGLVQPGGSLRLSCAASGFTFSNYWMNWVRQAPGKGLEWIGRIDPNDSETHYNQKFKDRVTISVDKSKNQFSLKLSSVTAADTAVYYCARSGFGSTYWFFDVWGQGTTVTVSS
SEQ ID NO:11
HU2 LCVR
ETTLTQSPAFMSATPGDKVNISCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:12
HU3 HCVR
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTISVDKSKNQFSLKLSSVTAADTAVYYCARSGFGSTYWFFDVWGQGTMVTVSS
SEQ ID NO:13
HU3 LCVR
DIVMTQTPLSLPVTPGEPASISCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPSRFSGSGSGTDFTLTINSLEAEDAATYYCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:14
HU4 HCVR
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWMNWVRQAPGKGLEWIGRIDPNDSETHYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARSGFGSTYWFFDVWGQGTMVTVSS
SEQ ID NO:15
HU4 LCVR
DIVMTQSPDSLAVSLGERATINCKASQDVSTAVAWYQQKPGQAPRLLIYSASYRYTGVPSRFSGSGSGTDFTLTINSLEAEDAATYYCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:16
HU5 HCVR
EVQLVESGGGLVQPGGSLRLSCAASGFTVSNYWMNWVRQAPGKGLEWIGRIDPNDSETHYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSS
SEQ ID NO:17
HU5 LCVR
DIQMTQSPSSLSASVGDRVTITCKASQDVSTAVAWYQQKPGKAPKLFIYSASYRYTGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:18
HU6 HCVR
EVQLLESGGGLVQPGGSLRLSCAASGFTVSNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTISVDKSKNQFSLKLSSVTAADTAVYYCARSGFGSTYWFFDVWGQGTTVTVSS
SEQ ID NO:19
HU6 LCVR
DVVMTQSPLSLPVTLGQPASISCKASQDVSTAVAWYQQKPGKAPKLFIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:20
HU7 HCVR
EVQLVESGGGLIQPGGSLKLSCAASGFTVSNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSS
SEQ ID NO:21
HU7 LCVR
AIRMTQSPFSLSASVGDRVTITCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:22
HU8 HCVR
QVQLVQSGAEVKKPGASVKVSCKASGYTFTNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSS
SEQ ID NO:23
HU8 LCVR
AIRMTQSPFSLSASVGDRVTITCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPSRFSGSGSGTDFTLKISRVEAEDVGVYYCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:24
HU9 HCVR
EVQLVESGGGLIQPGGSLRLSCAASGFTVSNYWMNWVRQAPGQGLEWMGRIDPNDSETHYNQKFKDRLTITKDTSKNQVVLTMTNMDPVDTATYYCARSGFGSTYWFFDVWGQGTTVTVSS
SEQ ID NO:25
HU9 LCVR
DIVMTQTPLSLPVTPGEPASISCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQHYSTPLTFGQGTRLEIK
SEQ ID NO:26
将设计的重链和轻链可变区序列分别与IgG重链恒定区和人抗体轻链恒定区序列连接,示例性的重链恒定区和轻链恒定区序列如下:
IgG1 C1
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:48
IgG1 C2
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:49
Ig kappa C
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:50
得到重链和轻链序列如下(其中,HU1-HU9重链来自于将序列SEQ ID NO:9、SEQ IDNO:11、SEQ ID NO:13、SEQ ID NO:15、SEQ ID NO:17、SEQ ID NO:19、SEQ ID NO:21、SEQ IDNO:23、SEQ ID NO:25分别连接于序列SEQ ID NO:49;HU6DL和HU10重链来自于将序列SEQID NO:19、SEQ ID NO:9分别连接于序列SEQ ID NO:48):
HU1 HC
QVQLVQSGAEVKKPGSSVKVSCKASGYTFTNYWMNWVRQAPGKGLEWVGRIDPNDSETHYNQKFKDRFTITRDNSKNTLYLQMNSLRAEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:27
HU1 LC
AIRMTQSPFSLSASVGDRVTITCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTRIPPRFSGSGYGTDFTLTINNIESEDAAYYFCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:28
HU2 HC
EVQLLESGGGLVQPGGSLRLSCAASGFTFSNYWMNWVRQAPGKGLEWIGRIDPNDSETHYNQKFKDRVTISVDKSKNQFSLKLSSVTAADTAVYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:29
HU2 LC
ETTLTQSPAFMSATPGDKVNISCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:30
HU3 HC
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTISVDKSKNQFSLKLSSVTAADTAVYYCARSGFGSTYWFFDVWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:31
HU3 LC
DIVMTQTPLSLPVTPGEPASISCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPSRFSGSGSGTDFTLTINSLEAEDAATYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:32
HU4 HC
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWMNWVRQAPGKGLEWIGRIDPNDSETHYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARSGFGSTYWFFDVWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:33
HU4 LC
DIVMTQSPDSLAVSLGERATINCKASQDVSTAVAWYQQKPGQAPRLLIYSASYRYTGVPSRFSGSGSGTDFTLTINSLEAEDAATYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:34
HU5 HC
EVQLVESGGGLVQPGGSLRLSCAASGFTVSNYWMNWVRQAPGKGLEWIGRIDPNDSETHYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:35
HU5 LC
DIQMTQSPSSLSASVGDRVTITCKASQDVSTAVAWYQQKPGKAPKLFIYSASYRYTGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:36
HU6 HC
EVQLLESGGGLVQPGGSLRLSCAASGFTVSNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTISVDKSKNQFSLKLSSVTAADTAVYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:37
HU6 LC
DVVMTQSPLSLPVTLGQPASISCKASQDVSTAVAWYQQKPGKAPKLFIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:38
HU7 HC
EVQLVESGGGLIQPGGSLKLSCAASGFTVSNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:39
HU7 LC
AIRMTQSPFSLSASVGDRVTITCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:40
HU8 HC
QVQLVQSGAEVKKPGASVKVSCKASGYTFTNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:41
HU8 LC
AIRMTQSPFSLSASVGDRVTITCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPSRFSGSGSGTDFTLKISRVEAEDVGVYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:42
HU9 HC
EVQLVESGGGLIQPGGSLRLSCAASGFTVSNYWMNWVRQAPGQGLEWMGRIDPNDSETHYNQKFKDRLTITKDTSKNQVVLTMTNMDPVDTATYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:43
HU9 LC
DIVMTQTPLSLPVTPGEPASISCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:44
HU6DL HC
EVQLLESGGGLVQPGGSLRLSCAASGFTVSNYWMNWVRQAPGKGLEWMGRIDPNDSETHYNQKFKDRVTISVDKSKNQFSLKLSSVTAADTAVYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:45
HU6DL LC
DVVMTQSPLSLPVTLGQPASISCKASQDVSTAVAWYQQKPGKAPKLFIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:38
HU10 HC
QVQLVQSGAEVKKPGSSVKVSCKASGYTFTNYWMNWVRQAPGKGLEWVGRIDPNDSETHYNQKFKDRFTITRDNSKNTLYLQMNSLRAEDTAVYYCARSGFGSTYWFFDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:46
HU10 LC
AIRMTQSPFSLSASVGDRVTITCKASQDVSTAVAWYLQKPGQSPQLLIYSASYRYTRIPPRFSGSGYGTDFTLTINNIESEDAAYYFCQQHYSTPLTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:28
表4.抗体及其重链、轻链、可变区的序列编号
根据以上各人源化抗体轻链和重链的氨基酸序列合成cDNA片段,插入到pcDNA3.1表达载体(Life Technologies Cat.No.V790-20)中。将表达载体和转染试剂PEI(Polysciences,Inc.Cat.No.23966)以1:2的比例转染HEK293细胞(Life TechnologiesCat.No.11625019),并置于CO
表5.各人源化抗体的浓度和纯度
实施例5体外结合亲和力和动力学实验
使用实施例4(1)体外间接ELISA结合实验测定的各人源化抗体对人TROP-2抗原的亲和力(EC
表6.各人源化抗体对人TROP-2抗原的亲和力(EC
为检测各人源化抗体与肿瘤细胞上的靶标蛋白TROP-2的结合能力,使用实施例4(2)体外细胞结合实验测定的各人源化抗体对HCC827肿瘤细胞(非小细胞肺癌)、MAB-MB-468肿瘤细胞(乳腺癌,浸润型导管癌)的亲和力(EC
表7.各人源化抗体对HCC827肿瘤细胞的亲和力(EC
/>
实施例6人源化抗体介导的肿瘤细胞杀伤作用
人源化抗体可以从多个方面发挥对肿瘤细胞的杀伤作用,其中之一是介导免疫细胞对肿瘤细胞的杀伤作用。为检测本发明人源化抗体介导的免疫细胞对肿瘤细胞的杀伤作用,采用人外周血单个核细胞(PBMC)与HCC827肿瘤细胞(非小细胞肺癌)共培养的系统进行评估。收集HCC827细胞,离心计数后用完全培养基调整细胞密度为0.44×10
表8.人源化抗体介导的对肿瘤细胞的杀伤作用
采用同样方法测定HU6抗体对HCC827肿瘤细胞的杀伤作用,结果显示最高剂量杀伤效果为52.3%。
实施例7人源化抗体介导的TROP-2内吞
为研究人源化抗体介导的TROP-2蛋白在肿瘤细胞中的内吞,将SW780细胞使用胰酶消化,收集细胞并用预冷的PBS重悬,调整细胞浓度为1×10
表9.人源化抗体介导的TROP-2蛋白内吞
实施例8人源化抗体与抗原的竞争性结合
研究不同抗体与抗原的结合方式和结合位点,通常采用竞争性结合实验。用pH7.4的PBS将hRS7抗体蛋白稀释至1μg/ml浓度,以100μl/孔的体积加入96孔高亲和力酶标板中,于4℃冰箱孵育过夜(16-20小时)。用PBST(pH7.4 PBS含0.05%Tween-20)洗板4次后,加入用PBST稀释的2%牛血清白蛋白(BSA)封闭液150μl/孔,室温孵育1小时进行封闭。封闭结束后,弃去封闭液,并用PBST缓冲液洗板4次。
用含2%BSA的PBST稀释待测抗体至100μg/ml,以50μl/孔加到酶标板中。用含2%BSA的PBST稀释TROP-2His蛋白(Sino Biological Inc.,cat#10428-H08H),以50μl/孔加到酶标板中。将酶标板放于室温孵育1小时。孵育结束后用PBST洗板4次,加入100μl/孔用含2%BSA的PBST稀释的anti-His HRP标记二抗(Abcam,cat#ab197049),室温孵育1小时。用PBST洗板4次后,加入100μl/孔TMB显色底物(Cell Signaling Technology,cat#7004S),于室温避光孵育1分钟,加入100μl/孔Stop Solution(Cell Signaling Technology,cat#7002S)终止反应,用酶标仪(BioTek,型号Synergy H1)在450nm处读取吸收值,分析数据,如下表所示。本发明的人源化抗体对hRS7抗体与TROP2蛋白的结合抑制率很低,提示本发明的人源化抗体与hRS7抗体不竞争结合相同的表位。
表10.人源化抗体与hRS7的抗原竞争结合
实施例9-1化合物a的合成
取原料a-1(4.1g,9.71mmol)、原料a-2(4.3g,8.09mmol,含4%氨基异构体杂质)置于250mL反应瓶中,氮气保护下加入DCM(54mL),MeOH(18mL)搅拌并冷至0℃,加入DMTMM(3.6g,12.1mmol),三乙胺(2.5g,24.2mmol),并保持0℃搅拌反应1h,HPLC中控显原料原料a-2反应完全,减压(<25℃)蒸干反应液,加入MTBE(120mL)搅拌打浆(泥状物),倒出溶液过滤,泥状物再次加入120mL MTBE打浆(固体),过滤,滤饼用水(60mL×2)洗,晾干得粗品,粗品用二氯甲烷和甲醇溶解,湿法上样柱层析两次(洗脱剂DCM:MeOH=40:1-20:1)分离得到化合物a纯品(6.2g,7.37mmol),纯度:99.3%,收率91%。
实施例9-2化合物b的合成
取化合物a(5.7g,6.77mmol)置于500mL三口瓶中,氮气保护下加入干燥的THF(114mL),搅拌溶解并冷却内温至-10℃左右,加入DBU(3.09g,20.31mmol),滴加过程中保持内温-10至-5℃,5min加毕,滴毕后,保持内温-10至-5℃,反应2.5h,固体析出。
冷却内温至-20℃,加入MTBE(114mL),期间保持内温-20至-10℃,产物完全析出,过滤,滤饼用MTBE(57mL×2)洗,抽干后得到化合物b粗品6g,-78℃保存待用。
实施例9-3化合物e的合成
将化合物c(651mg,1mmol)溶于10mL的DCM里,冰浴冷却下开启搅拌,滴入DBU(456mg,3mmol)。冰浴下反应一个小时后反应完成,依次加入化合物d(257mg,1mmol)和HATU(420mg,1.1mmol),在冰浴下搅拌30分钟后,LCMS显示反应完成,反应液在25℃条件下浓缩,残留物用过柱机反相柱纯化(ACN in H
MS:691.3[M+23]。
实施例9-4化合物f的合成
将化合物e(130mg,0.19mmol)溶于DCM,加入苯甲醚(62mg,0.57mmol)和二氯乙酸(245mg,1.9mmol),反应在室温下搅拌过夜,共16小时,取样LC-MS中控,显示原料完全消耗,停止反应,将反应液在25℃条件下浓缩,残留物用过柱机反相柱纯化(ACN/H
MS:519.2[M+1]。
实施例9-5化合物D的合成
将化合物f(23mg,0.044mmol)和化合物b(27mg,0.044mmol)溶于DCM(3mL)和MeOH(1mL),在氮气保护下冷却到-30℃。加入DMTMM(20mg,0.067mmol),反应在-20℃~-10℃控温反应1小时,取样LC-MS中控,显示原料完全消耗。控制温度在-10℃,加入10mL水淬灭反应,加入30mL的DCM分层。水相用DCM/MeOH=10/1(50mL)萃取。合并有机相,用无水硫酸钠干燥,在25℃条件下减压浓缩,残留物经制备纯化(ACN/H
MS:1120.3[M+1]。
实施例10:抗体偶联药物的制备
1.1ADC1的制备
在37℃条件下,向抗体HU6DL的PBS缓冲水溶液(pH=6.5的0.05M的PBS缓冲水溶液;7.3ml,13.8mg/ml,0.681μmol)加入配置好的三(2-羧乙基)膦的水溶液(10mM,0.239mL,1.70μmol),置于水浴振荡器,于37℃振荡反应3小时,停止反应;将反应液用水浴降温至25℃,稀释至14.0ml,并取出3.3ml溶液往下反应。
将化合物D(3.0mg,3.72μmol)溶解于0.15mL DMSO中,加入到上述3.3ml溶液中,置于水浴振荡器,于25℃下振荡反应3小时,停止反应。将反应液用Sephadex G25凝胶柱脱盐纯化(洗脱相:pH为6.5的0.05M的PBS缓冲水溶液,含0.001M的EDTA),得到mAb2抗体偶联物的示例性产物ADC1的PBS缓冲液(1.35mg/mL,13mL),于4℃冷冻储液。
采用紫外法测定平均值y。将装有琥珀酸钠缓冲液的比色皿分别置于参比吸收池和样品测定吸收池中后,扣除溶剂空白后,再将装有供试品溶液的比色皿置于样品测定吸收池中,测定280nm和370nm处吸光度。
数据处理:
通过建立标准曲线,测定280nm波长下的吸收,确定抗体含量Cmab,测定370nm波长下的吸收,确定小分子含量CDrug。
药物载量平均值y=CDrug/Cmab。
通过以上方法测定产物ADC1的y值为4。通过UV-HPLC纯化获得ADC1(y=4)样品。
实施例11抗体药物偶联物的细胞杀伤活性
为检测本公开的抗体-药物偶联物对肿瘤细胞的杀伤作用,采用Trop-2阳性细胞株MDA-MB-468(南京科佰,CBP60387)进行评估。用胰酶消化培养的MDA-MB-468单层细胞,加入培养基重悬,离心后计数,用完全培养基调整细胞密度为4×10
表11.抗体偶联药物对肿瘤细胞的杀伤作用
通过比较细胞杀伤IC
实施例12抗体偶联药物的药代动力学
利用人源FcRn转基因小鼠模型评价抗Trop-2抗体药物偶联物ADC1在小鼠体内的药物代谢情况。将平均体重为18-22g,6-8周龄的人源FcRn转基因小鼠随机分为2组,每组3只动物,受试药物偶联物均以5mg/kg,I.V.,单次的方式给药,PBS溶媒作为阴性对照组,分别在1、2、4、8、24、48、96、144、240、小时采血分离血浆,冻存于-20℃冰箱,之后利用重组人Trop-2蛋白包被高亲和力96孔瓶底板,加入稀释的待测血浆样品,再利用HRP标记二抗检测小鼠血浆中Trop-2 ADC浓度,并利用PKSolver软件中非房室模型,血管内给药模型分析其PK参数。实验结果详见下表
表12.抗体-药物偶联物的药代动力学参数
综合上表中药物代谢动力学关键参数,ADC1显示出较好的代谢特性。
实施例13抗体偶联药物的体内抗肿瘤作用
为进一步研究抗体-药物偶联物对体内形成的肿瘤的杀伤作用,采用Trop-2阳性肿瘤细胞人三阴性乳腺癌MDA-MB-468肿瘤细胞移植物小鼠模型评价候选分子体内抑制肿瘤增殖效果。将5x10
抑瘤率=100%-(第28天给药组肿瘤体积-第0天给药组肿瘤体积)/(第28天对照组肿瘤体积-第0天对照组肿瘤体积)。
表13.抗体-药物偶联物对肿瘤的杀伤作用
实验结果表明,在每周注射一次,剂量为2mg/kg,ADC1(y=4)显示出较好抑瘤效果。
