一株成都肠杆菌D3及其应用
文献发布时间:2024-01-17 01:24:51
技术领域
本发明涉及微生物技术领域,更具体的说是涉及一株成都肠杆菌D3及其应用。
背景技术
紫花苜蓿是多年生豆科、苜蓿属植物,主要作为牲畜的口粮及蛋白饲料。但随着苜蓿种植面积的不断扩大,连作4年以上的地块苜蓿生产能力逐年下降、根系活力渐渐衰退、种子发芽率严重降低、根腐病发生严重、补播或重播难以成活。本研究前期研究发现对香豆酸是苜蓿连作障碍产生的最重要的自毒物质之一,在生理水平上,当对香豆酸积累到一定程度,幼苗体内超氧化物歧化酶、过氧化物酶和过氧化氢酶活性以及可溶性糖和α-淀粉酶含量降低,丙二醛含量升高,促进类激素与脱落酸的比值以及叶绿素含量均降低;转录组学和代谢组学联合分析表明,胁迫初期,植物主要通过调节ABC转运蛋白和黄酮类物质的生物合成来响应对香豆酸胁迫;此外,对香豆酸积累还会使中苜1号根际土壤的主要养分碱解氮、速效磷、速效钾的含量、主要酶多酚氧化酶、蔗糖酶、中性磷酸酶的活性以及有益微生物中慢生根瘤菌的相对丰度降低。进一步研究发现,对香豆酸对玉米、大豆和水稻的化感作用比对紫花苜蓿的强;同时,对香豆酸对玉米茎基腐病的病原菌禾谷镰孢的菌丝生长、孢子萌发和产生,对大豆根腐病和水稻立枯病的病原菌尖镰孢的孢子萌发和产生均表现出了一定程度的促进作用,且随着浓度的增加促进作用加强,同时对香豆酸还能促进病原菌定殖,进而危害作物生长。因此,在北方寒地不适宜采用苜蓿–玉米/大豆/水稻轮作模式缓解因自毒作用而引起的连作障碍。
因此,如何消减对香豆酸造成的紫花苜蓿连作障碍是本领域技术人员亟需解决的问题。
发明内容
有鉴于此,本发明提供了一种成都肠杆菌D3及其应用,以缓解作物连作障碍。
为了实现上述目的,本发明采用如下技术方案:
一株成都肠杆菌D3,所述成都肠杆菌D3,于2023年3月23日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.26871,保藏地址北京市朝阳区北辰西路1号院3号,分类命名为Enterobacter chengduensis。
本发明的又一目的是,提供上述成都肠杆菌D3的应用。
作为优选的技术方案,所述成都肠杆菌D3的降解条件为pH7,温度25℃。
作为优选的技术方案,所述应用为降解对香豆酸、阿魏酸、香草酸和对羟基苯甲酸中的一种或多种。
更优选的,所述应用为降解对香豆酸和阿魏酸中的一种或多种。
作为优选的技术方案,所述应用为缓解由对香豆酸、阿魏酸、香草酸和对羟基苯甲酸中的一种或多种物质引起的植物连作障碍。
作为优选的技术方案,所述植物为紫花苜蓿、玉米、大豆、水稻。
更优选的,所述植物为紫花苜蓿。
本发明的又一目的是,提供一种消减对香豆酸和/或阿魏酸和/或香草酸和/或对羟基苯甲酸的菌剂,包含上述成都肠杆菌D3。
本发明的又一目的是,提供一种缓解对香豆酸和/或阿魏酸和/或香草酸和/或对羟基苯甲酸引起的连作障碍的菌剂,包含上述成都肠杆菌D3。
经由上述的技术方案可知,本发明公开提供了一株成都肠杆菌D3及其应用。成都肠杆菌D3对对香豆酸、阿魏酸、香草酸、对羟基苯甲酸均有很好的降解效果,以对香豆酸、阿魏酸更为显著,可以消减由上述物质引起的植物连作障碍。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1为本发明成都肠杆菌D3的菌落图片。
图2为利用邻接法基于gyrB基因构建成都肠杆菌D3的系统发育树。
图3为成都肠杆菌D3在液体培养基中的生长曲线和降解曲线。
图4为成都肠杆菌D3在土壤中的生长曲线和降解曲线。
图5为不同培养条件下成都肠杆菌D3的生长曲线和对对香豆酸的降解速率。
图6为成都肠杆菌D3降解对香豆酸的降解产物的成分分析。
图7为成都肠杆菌D3及其降解产物对中苜1号的影响,其中A为对照,B为对香豆酸,C为D3,D为对香豆酸+D3。
图8为外源接种对香豆酸、成都肠杆菌D3及(对香豆酸+D3)对中苜1号幼苗生理的影响。
图9为外源接种对香豆酸、成都肠杆菌D3及(对香豆酸+D3)对中苜1号根际土壤酶活力的影响。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1成都肠杆菌D3的分离筛选、鉴定及保藏
(1)分离
称取10g连作14年的苜蓿根际土壤放入装有100mL无菌水的锥形瓶(250mL)中,30℃、180rpm下振荡培养30min,静置,所得上清液即为土壤浸出液。在装有45mL LB培养基的锥形瓶(100mL)中加入5mL土壤浸出液,且这50mL溶液中对香豆酸浓度为100mg/L,30℃、180rpm振荡培养72h。取5mL LB培养的菌液转移至装有45mL LB培养基的新锥形瓶中(含对香豆酸100mg/L),30℃,180rpm振荡培养,每隔72h重复一次,重复三次后将菌液用无菌的NaCl溶液(0.85%)稀释10
(2)鉴定
A生理生化鉴定:
形态特征:将分离所得D3菌株接种于LB培养基中,振荡培养24h,将所得菌悬液稀释10
革兰氏染色:将D3菌株分别用结晶紫染液和番红复染液染色,经过水洗干燥后,观察颜色变化。结果显示D3为革兰氏阴性菌。
生理生化指标:接触酶试验,需氧性测定,V-P测定,甲基红(M.R.)试验,明胶液化试验,硝酸盐还原试验,H
表1
可见,D3菌株兼性厌氧,发酵包括蔗糖、鼠李糖、山梨醇在内的10种糖类,不能发酵肌醇和乳糖,不产生H
B分子生物学鉴定:
利用植物基因组提取试剂盒(康维生物科技,北京,中国)提取降解菌的DNA,并用16S rDNA基因(正向引物:5'-GGTTACCTT GTTACGACTT-3',SEQ ID NO.1/反向引物:5'-AGAGTTGATCCTG GCTCAG-3',SEQ ID NO.2)和gyrB基因(正向引物:5'-GAAGTC ATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3',SEQ ID NO.3/反向引物:5'-AGCAGGGTACGGATGTGCGAGCCRTCNACRT CNGCRTCNGTCAT-3',SEQ ID NO.4)进行扩增。扩增产物送至上海生工测序,测序结果与GenBank数据库进行比较。
利用通用引物进行16S rRNA基因序列的PCR扩增,经双向测序后得到1422bp的核苷酸序列(GenBank登录号:OQ642283)。经BLAST比对分析发现,该基因序列对于相似种的分辨率有限,无法明确区分肠杆菌(Enterobacter spp.)、沙门氏菌(Salmonella spp.)、拉乌尔菌(Raoultella spp.)和柠檬酸杆菌(Citrobacter spp.)的种类。为此,对gyrB基因序列进行扩增,经测序后得到1177bp的核苷酸序列(SEQ ID NO.5),经BLAST比对分析,该菌株与成都肠杆菌模式菌株Enterobacter chengduensis WCHECl-C4(GenBank登录号:KY979143.1)相似度达97%,进一步利用MEGA 6.06构建系统发育树,结果表明,D3菌株与成都肠杆菌模式菌株E.chengduensis WC HECl-C4显示出了高达94%的相似性(参见附图2)。
gyrB基因序列扩增产物:
5’-TTGACGATACTCCTATAAAGTTTCCGGCGGCCTGCACGGCGT AGGCGTCTCCGTGGTTAACGCCCTGTCGCAGAAGCTGGAGCTGGTGATCCAGCGCGAAGGCAAAATTCACCGTCAGCTCTATACGCACGGCGTGCCGCAGGCACCGCTGGCCGTTACCGGCGATACCGACAAAACCGGTACCATGGTGCGTTTCTGGCCGAGCCATGAAACCTTCACCAACGTCACCGAATTCGAGTACGACATCCTGGCGAAACGCCTGCGTGAACTGTCGTTCCTGAACTCCGGCGTCTCTATCCGCCTGCGCGACAAGCGTGACGGCAAAGAAGACCACTTCCACTACGAAGGCGGTATCAAGGCGTTCGTTGAGTATCTGAACAAGAACAAAACGCCTATTCACCCGAATATCTTCTACTTCTCCACCGAAAAAGACGGTATCGGCGTGGAAGTGGCGCTGCAGTGGAACGACGGTTTCCAGGAAAACATCTACTGCTTCACCAACAACATTCCACAGCGTGACGGCGGTACGCACCTTGCAGGCTTCCGTGCGGCGATGACCCGTACCCTGAACGCCTACATGGACAAAGAAGGCTACAGCAAGAAAGCAAAAGTCAGCGCCACCGGTGATGACGCCCGTGAAGGCTTGATTGCCGTTGTCTCCGTGAAAGTGCCGGATCCGAAGTTCTCCTCCCAGACCAAAGACAAGCTGGTCTCTTCCGAGGTGAAATCGGCGGTTGAACAGCAGATGAACGAACTGCTGAGCGAATACCTGCTGGAAAACCCGTCCGACGCGAAAATCGTGGTGGGTAAAATTATTGATGCGGCGCGTGCCCGTGAAGCGGCGCGTAAAGCCCGTGAAATGACCCGTCGTAAAGGCGCGCTGGACTTAGCAGGCCTGCCGGGCAAACTGGCTGACTGCCAGGAACGTGACCCGGCGCTGTCCGAACTGTACCTCGTGGAAGGGGACTCCGCGGGCGGTTCTGCGAAGCAGGGCCGTAACCGTAAGAACCAGGCTATCCTGCCGCTGAAGGGTAAAATCCTCAACGTTGAGAAAGCCCGTTTCGACAAGATGCTCTCTTCTCAGGAAGTGGCGACGCTCATTACCGCGCTGGGCTGCGGCATCGGCCGTGATGAGTACAACCCGGACAAACTGCGCTACCACAGCATCATCATCAGA-3’,SEQ ID NO.5。
D3菌株依据菌落、菌体形态、生理生化反应以及系统发育树综合分析,确定为成都肠杆菌。
(3)保藏
D3菌株于2023年3月23日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.26871,保藏地址北京市朝阳区北辰西路1号院3号,分类命名为Enterobacter chengduensis。
实施例2成都肠杆菌D3对对香豆酸的降解
(1)液体培养基中的效果
将D3菌株接种于100mL LB培养基中,在30℃,180rpm下振荡培养10-12h,使细菌数量达到约4×10
结果显示,在液体培养条件下,D3培养96h达到最大生长量(1.98×10
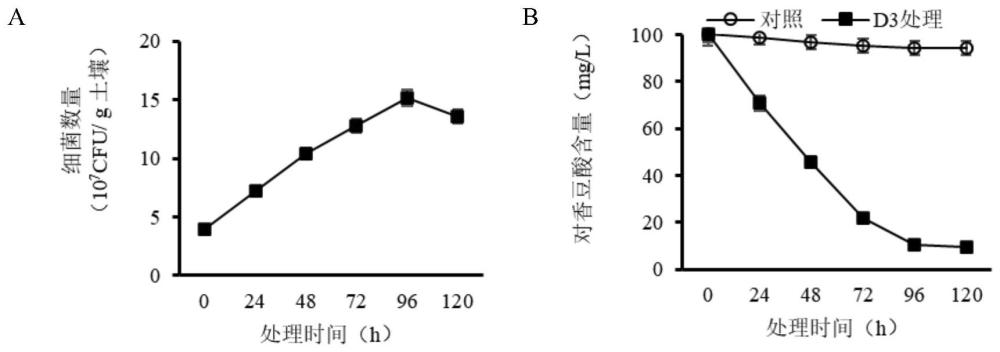
(2)土壤中的效果
取100g未种植过紫花苜蓿的土壤,121℃高压蒸汽灭菌1h,向其中加入对香豆酸溶液使土壤中对香豆酸浓度为100mg/kg,再加入用等体积NaCl溶液(0.85%)重新溶解的细菌母液10mL使土壤中细菌含量约为4×10
结果显示,在土壤培养的条件下,D3的生长速率同样是在96h达到最大细菌数量(1.52×10
综上可知,D3无论在液体还是土壤环境中,都展现出了极佳的生长和降解能力。
实施例3成都肠杆菌D3培养条件的优化
将D3接种于LB液体培养基中,30℃、180r/min,孵育24h,然后取一定量的细菌悬浮液加入到以下不同处理的锥形瓶(细菌初始浓度:4×10
(1)不同浓度对香豆酸:用LB培养液配制出含对香豆酸的浓度为50、100、200、400mg/L的培养基,30℃,180rpm振荡培养。
(2)不同pH:以(1)中降解速率最快的含对香豆酸的LB作为母液,分别调pH到3.0、5.0、7.0、9.0,30℃,180rpm振荡培养。
(3)不同温度:以(2)中降解速率最快的含对香豆酸的LB作为母液,分别置于20、25、30、35℃的温度条件下,180rpm振荡培养。
(4)不同酚酸种类:在(3)中降解速率最快的条件下,分别制备含有对香豆酸、香草酸、阿魏酸、对羟基苯甲酸的LB溶液,180rpm振荡培养。
结果显示,不同条件下,D3在生长和降解能力方面都表现出了显著性差异(参见附图5)。除了pH试验,其它3个降解试验结果均表明,D3的生长情况与对香豆酸降解速率呈现出了很大的相关性。随着条件的改变,细菌生长和对香豆酸降解的变化趋势基本都相同。在对香豆酸浓度试验中,D3的生长速率会随着对香豆酸浓度的增加而表现出先上升后快速下降的趋势,在200mg/L时会达到生长速率的最大值。D3对对香豆酸的降解速率表现出与生长速率相同的变化趋势,在200mg/L时达到降解速率的最大值。在相同浓度下,180rpm振荡培养120h后,对对香豆酸的降解率达到了92.85%。
在pH试验中,D3的生长和降解情况则表现出不同的趋势,在pH 3-5的时候,D3的生长能力较弱,但是当pH增加到7时,D3的生长速率陡然增加,而当pH增加到9时,D3的生长速率又表现出下降趋势,由此可见pH 7适合D3生长;D3的降解速率在pH 3-7时无明显差异,180rpm振荡培养120h后,对对香豆酸的降解率均达到了93.00%以上,在pH 9时显著下降。
在温度试验中,D3的生长和降解速率则均表现出了明显的先增后降的趋势,25℃是D3生长和降解的最佳温度,180rpm振荡培养120h后,对对香豆酸的降解率高达94.60%,温度偏高或者偏低都会显著影响其生长和降解速率。
D3对苜蓿连作自毒物质中不同种类的酚酸均表现出一定的降解作用,其对对香豆酸和阿魏酸的降解速率较高,细菌的生长速率快,对香草酸和对羟基苯甲酸的降解速率低,细菌的生长速率也相对较慢。180rpm振荡培养120h后,降解率从高到低依次为对香豆酸(94.60%),阿魏酸(79.15%),香草酸(45.50%)和对羟基苯甲酸(22.50%)。
综上,对香豆酸降解菌D3降解条件优化后为对香豆酸浓度最适浓度为200mg/L、pH值为7和温度25℃。
实施例4成都肠杆菌D3降解产物GC-MS分析
接种D3于100mL LB中培养,对香豆酸浓度为200mg/L,25℃、180rpm振荡培养,取培养了120h的菌液5mL于5000rpm离心10min,取上清液用5mL乙酸乙酯萃取2次,然后用旋转蒸发仪将其蒸干得到降解产物,加入1mL硅烷化试剂BSTFA+TMCS 99:1混合物溶解后将所得溶液再蒸干,最后加入甲醇(1mL)溶解,将所得溶液过0.22μm有机滤膜,然后送至上海微析科技有限公司使用气相色谱质谱联用(GC-MS)进行降解产物检测,测定条件和参数设置参考朱炜(2016)的方法(朱炜.桃树根系自毒物质及自毒作用生理生化机制研究[D].武汉:华中农业大学,2016)。
接种D3培养了120h后,用GC-MS进行成分分析鉴定,对香豆酸分解产生了多种物质,其中的主要物质为3-羟基丙烷肼(3-hydroxypropanehydrazide)(参见附图6),而最初没有接种D3的时候,培养基内测出的有机成分仍是对香豆酸。
实施例5成都肠杆菌D3对紫花苜蓿的影响
(1)对紫花苜蓿种子萌发的影响
本试验采用玻璃皿培养法进行,即在铺有两层灭菌滤纸的玻璃培养皿(Φ=9cm)中,均匀摆放用75%酒精消毒3-5min,并用蒸馏水洗净的紫花苜蓿种子(50粒/皿)。处理溶液包括:无菌水(对照),200mg/L对香豆酸溶液,4×10
表2
结果显示,接种降解菌D3的紫花苜蓿种子发芽率、发芽势、简易活力指数以及鲜重均明显高于对照(P<0.05),不会抑制紫花苜蓿的种子萌发。200mg/L的对香豆酸处理紫花苜蓿种子后,种子的各项指标均显著低于对照(P<0.05),抑制作用明显。但当200mg/L的对香豆酸处理中接种降解菌D3后,紫花苜蓿种子的发芽率、发芽势和鲜重与对照之间无明显差异,简易活力指数甚至显著高于对照,抑制作用完全消失。综上,降解菌D3对紫花苜蓿种子没有毒害作用,并且能消减对香豆酸对紫花苜蓿种子的毒害作用。
2.对紫花苜蓿幼苗生长的影响
本试验采用土壤培养法,于播种10d后,向装有盆栽基质(未种植过苜蓿的土壤:蛭石=2:1)的塑料盆里添加不同处理溶液。处理溶液包括:无菌水(对照),200mg/L对香豆酸溶液,4×10
表3
结果显示,接种降解菌D3的紫花苜蓿幼苗株高、根长、干重和鲜重均明显高于对照(P<0.05),不会抑制紫花苜蓿的幼苗生长。200mg/L的对香豆酸接种处理紫花苜蓿幼苗后,幼苗的各项指标均显著低于对照(P<0.05),抑制作用明显。但当200mg/L对香豆酸处理的土壤中接种降解菌D3后,紫花苜蓿幼苗的株高与对照之间无明显差异,根长、鲜重和干重甚至显著高于对照,抑制作用完全消失。综上,降解菌D3对紫花苜蓿幼苗没有毒害作用,并且能完全消减对香豆酸对紫花苜蓿幼苗的毒害作用。
(3)对紫花苜蓿幼苗生理的影响
取上述留存的试验材料根据试剂盒使用方法测定苜蓿幼根的超氧化物歧化酶(SOD)(试剂盒型号为G0101F,苏州格锐思生物科技有限公司,中国)、过氧化物酶(POD)(试剂盒型号为G0107F,苏州格锐思生物科技有限公司,中国)和过氧化氢酶(CAT)(试剂盒型号为G0106F,苏州格锐思生物科技有限公司,中国)活性,以及丙二醛(MDA)(试剂盒型号为G0109F,苏州格锐思生物科技有限公司,中国)、可溶性糖(试剂盒型号为D799391-0050,生工生物工程(上海)股份有限公司,中国)和α-淀粉酶(试剂盒型号为G0510W,苏州格锐思生物科技有限公司,中国)含量(参见附图8)。
由附图8A,B,C可知,降解菌D3、对香豆酸以及混合(对香豆酸+降解菌D3)接种对紫花苜蓿幼苗根系抗氧化系统中的主要酶活性产生了不同程度的影响。外源接种降解菌D3后紫花苜蓿幼苗根系的SOD、POD和CAT活性明显升高,并明显高于对照组。200mg/L对香豆酸处理的紫花苜蓿幼苗根系的抗氧化酶活性大幅度降低,抑制作用明显。但当200mg/L对香豆酸处理的土壤中接种降解菌D3后,紫花苜蓿幼苗根系的SOD和POD活性与对照无明显差异,CAT活性甚至显著高于对照,抑制作用完全消失。以上结果表明,降解菌D3可通过提高紫花苜蓿体内的SOD、POD和CAT活性来清除过量的活性氧以降低膜质过氧化对植物细胞的损伤。
由附图8D可知,外源接种降解菌D3后紫花苜蓿幼苗根系的MDA含量与对照相比无明显变化(P>0.05)。200mg/L对香豆酸处理的紫花苜蓿幼苗根系MDA含量明显升高,远高于对照组,细胞质膜受损严重。但当200mg/L对香豆酸处理的土壤中接种降解菌D3后,紫花苜蓿幼苗根系的MDA含量与对照无明显差异,细胞质膜无损伤表现。结果表明,降解菌D3不会损伤紫花苜蓿幼苗细胞质膜,并且对对香豆酸造成的损伤具有一定的修复能力。
外源接种降解菌D3后紫花苜蓿幼苗根系的可溶性糖和可溶性蛋白含量与对照相比无明显变化(P>0.05)。200mg/L对香豆酸处理的紫花苜蓿幼苗根系的可溶性糖和可溶性蛋白含量明显降低,显著低于对照组,抑制作用明显。但当200mg/L对香豆酸处理的土壤中接种降解菌D3后,紫花苜蓿幼苗根系的可溶性糖和可溶性蛋白含量与对照无明显差异,抑制作用完全消失(附图8E,F)。由上述结果分析可得,降解菌D3不会影响紫花苜蓿幼苗根系的渗透势,并且能消减对香豆酸带来的不利影响。
综上所述,降解菌D3对紫花苜蓿幼苗生理无毒害作用,并且能消减对香豆酸对紫花苜蓿幼苗生理的毒害作用。
实施例6成都肠杆菌D3对根际微生态的影响
(1)对土壤主要养分的影响
取不同处理溶液包括:无菌水(对照),200mg/L对香豆酸溶液,4×10
表4
结果显示,外源接种降解菌D3后,紫花苜蓿根际土壤中碱解氮(N)和速效磷(P)含量较对照差异不显著,速效钾(K)含量明显升高。200mg/L对香豆酸处理的紫花苜蓿根际土壤中碱解氮(N)、速效磷(P)和速效钾(K)的含量均下降,明显低于对照。但当200mg/L对香豆酸处理的土壤中接种降解菌D3后,紫花苜蓿根际土壤中主要养分含量碱解氮(N)和速效钾(K)的含量与对照无明显差异,速效磷(P)含量则明显高于对照。
表明,外源接种降解菌D3不会使紫花苜蓿根际土的理化性质恶化,并且能消减对香豆酸对土壤理化性质的不良影响。
(2)对土壤酶活力的影响
取不同处理溶液包括:无菌水(对照),200mg/L对香豆酸溶液,4×10
土壤过氧化氢酶和多酚氧化酶这两个氧化还原酶活性变化参见附图9,外源接种降解菌D3后,紫花苜蓿根际土壤中过氧化氢酶活性与对照组均无明显差异,多酚氧化酶活性明显高于对照。200mg/L对香豆酸处理的紫花苜蓿根际土壤中过氧化氢酶和多酚氧化酶活性均降低。但当200mg/L对香豆酸处理的土壤中接种降解菌D3后,紫花苜蓿根际土壤中过氧化氢酶和多酚氧化酶活性趋于正常水平。上述结果表明,外源接种降解菌D3能促进土壤中酚酸转化,降低土壤中酚酸浓度,从而消减自毒作用。
土壤蔗糖酶、脲酶和中性磷酸酶三种水解酶活性变化情况如附图9C,D,E所示,外源接种降解菌D3后,紫花苜蓿根际土壤中这三种水解酶活性均上升,且明显高于对照。200mg/L对香豆酸处理的紫花苜蓿根际土壤中这三种水解酶活性均降低,抑制作用明显。当200mg/L对香豆酸处理的土壤中接种降解菌D3后,紫花苜蓿根际土壤中中性磷酸酶活性趋于正常,而蔗糖酶和脲酶活性甚至高于正常水平,这表明外源接种降解菌D3可促进土壤中碳水化合物和尿素水解以及有机磷的转化,并且能够消减对香豆酸产生的毒害作用。
总之,外源接种降解菌D3不会对紫花苜蓿根际土壤中氧化还原酶及水解酶活性产生不良影响,并且能消减对香豆酸积累导致的毒害作用,从而使土壤中有效养分含量升高。
综上,本发明从苜蓿连作根际土中分离到一株成都肠杆菌(Enterobacterchengduensis)D3。降解菌D3对对香豆酸、阿魏酸、香草酸和对羟基苯甲酸均有很好的降解效果,可以消减由上述物质引起的作物连作障碍。
降解菌D3对紫花苜蓿种子和幼苗无毒害作用,甚至可以促进紫花苜蓿生长、改善土壤微生态环境,并且可以使对香豆酸对紫花苜蓿的抑制作用减弱甚至完全消失,从而有效地消减对香豆酸对紫花苜蓿的自毒作用。因此,对香豆酸降解菌D3可用于实际生产中缓解北方寒地苜蓿连作障碍。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
