5-羟基色氨酸的用途及其与PD-1抗体的组合物及其用途
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于生物医药领域,具体地,涉及5-羟基色氨酸在肿瘤治疗中的用途及其与PD-1抗体的组合物及其用途。
背景技术
近年来,肿瘤免疫治疗已成为晚期恶性肿瘤治疗的重要手段之一。肿瘤免疫治疗并不直接攻击癌细胞,而是通过重新启动并维持肿瘤-免疫循环,恢复机体正常的抗肿瘤免疫反应。PD-1/PD-L1作为一对免疫抑制分子参与免疫调节,也是肿瘤细胞抑制免疫应答的重要“帮手”之一。肿瘤细胞通过高表达PD-L1,与效应T细胞表面的PD-1分子结合,抑制T细胞活化。PD-1/PD-L1抑制剂疗法,正是阻断了这一过程,重新活化效应T细胞。PD-1/PD-L1抗体在临床肿瘤治疗上取得了令人瞩目的疗效,成为了多种肿瘤治疗的基础用药。然而,抗体类药物因其免疫原性问题及肿瘤组织穿透性差,带来免疫相关的副作用及响应率不高的问题。PD-1/PD-L1抗体的临床客观响应率一般低于30%,并且会诱发自身免疫反应和急性心肌炎等多种严重副作用。因而,靶向PD1/PD-L1的小分子药物开发,克服抗体疗法的不足,已成为抗肿瘤免疫药物研发的一个热点。靶向PD1/PD-L1蛋白相互作用界面或抑制肿瘤细胞PD-L1蛋白表达的小分子抑制剂,可以实现对PD1/PD-L这一免疫逃逸机制的抑制,增强抗肿瘤免疫,为克服肿瘤免疫逃逸提供新的治疗手段,规避抗体类药物的不足,还有望与现有免疫疗法进行联用产生更佳的抗肿瘤疗效,从而开发出全新的联用组合治疗方案。
发明内容
本发明的一个技术目的是提供5-羟基色氨酸(5-HTP)在肿瘤治疗中的新用途。
本发明的另一个技术目的是提供一种包含5-羟基色氨酸和PD-1抗体的组合物。
本发明的另一个技术目的是提供所述组合物在制备用于治疗肿瘤的药物中的用途。
本发明的另一个技术目的是提供所述组合物在制备用于治疗并具有抑郁症状的肿瘤的药物中的用途。
一方面,本发明提供了5-羟基色氨酸在制备用于在肿瘤患者中治疗肿瘤的药物中的用途。
在具体实施方式中,5-羟基色氨酸通过调节肿瘤免疫微环境而抑制肿瘤生长。
在具体实施方式中,所述肿瘤包括各种血液及实体肿瘤类型,包括但不限于结肠癌、非小细胞肺癌和卵巢癌。
在具体实施方式中,所述肿瘤患者并具有抑郁症状。
另一方面,本发明提供一种药物组合物,其包含治疗有效量的5-羟基色氨酸和PD-1抗体,以及任选地,药学上可接受的辅料。
再一方面,本发明提供上述药物组合物在制备用于在肿瘤患者中治疗肿瘤的药物中的用途。
在具体实施方式中,所述肿瘤包括各种血液及实体肿瘤类型,包括但不限于结肠癌、非小细胞肺癌和卵巢癌。
在具体实施方式中,所述肿瘤患者并具有抑郁症状。
有益效果
本发明通过研究发现5-羟色胺的前体5-羟基色氨酸能够抑制肿瘤细胞PD-L1的转录表达,调节肿瘤免疫微环境,抑制恶性肿瘤的生长,其具有抗肿瘤和缓解病人抑郁的双重功效,用于肿瘤治疗具有其特有优势。
另外,本发明的含有5-羟基色氨酸和PD-1抗体的药物组合物在抑制肿瘤生长中呈现出协同增效的作用。
附图说明
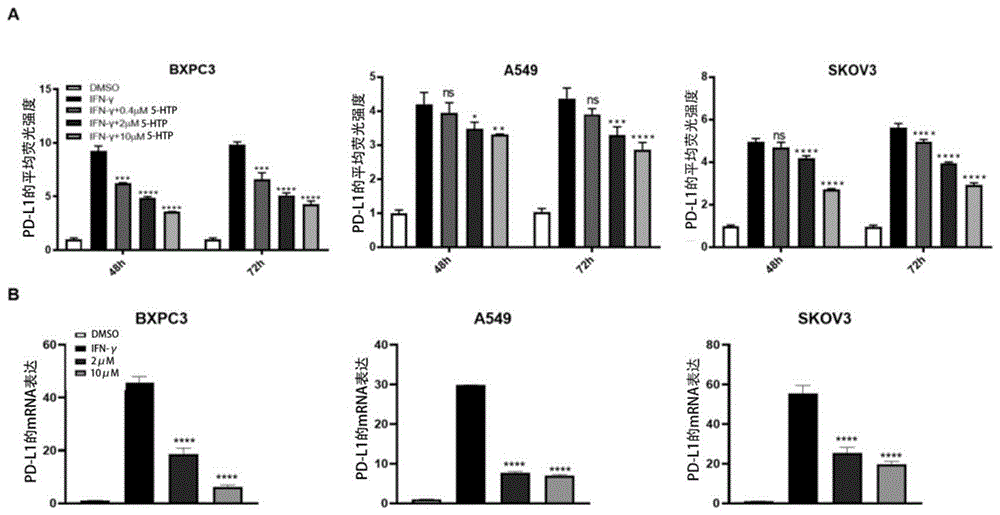
图1:5-羟基色氨酸在多种肿瘤细胞系(BXPC3、A549和SKOV3)中对于PD-L1的诱导性表达的抑制作用(ns P>0.05,*P<0.05,**P<0.01,***P<0.001和****P<0.0001)。其中,A:流式检测细胞表面PD-L1蛋白水平;B:转录水平。
图2:5-羟基色氨酸在结肠癌MC38同源模型中的抗肿瘤效应(ns P>0.05,*P<0.05,**P<0.01,***P<0.001和****P<0.0001)。A:对肿瘤体积的影响;B:对肿瘤重量的影响;C:肿瘤照片;D:对小鼠体重的影响。
图3:5-羟基色氨酸在结肠癌CT26同源模型中的抗肿瘤效应(ns P>0.05,*P<0.05,**P<0.01,***P<0.001和****P<0.0001)。A:对肿瘤体积的影响;B:对肿瘤重量的影响;C:肿瘤照片;D:对小鼠体重的影响。
图4:5-羟基色氨酸在免疫完整小鼠(C57)和免疫缺陷小鼠(Nude)中的抗肿瘤药效差异(ns P>0.05,*P<0.05,**P<0.01,***P<0.001和****P<0.0001)。A:在免疫完整小鼠(C57)中对肿瘤体积的影响;B:在免疫缺陷小鼠(Nude)对肿瘤体积的影响;C:对两种小鼠中肿瘤重量的影响;D:两种小鼠中的肿瘤照片。
图5:在上述MC38(A)和CT26(B)同系小鼠肿瘤模型上5-羟基色氨酸在体内对肿瘤细胞PD-L1表达的下调作用(ns P>0.05,*P<0.05,**P<0.01,***P<0.001和****P<0.0001)。
图6:MC38肿瘤浸润肿瘤T细胞流式细胞分析(ns P>0.05,*P<0.05,**P<0.01,***P<0.001和****P<0.0001)。A:总的T细胞;B:CD4阳性T细胞:C:细胞毒性T细胞;D:活化的细胞毒性T细胞。
图7:5-羟基色氨酸和PD-1抗体联合在结肠癌MC38同源模型中的协同抗肿瘤效应(ns P>0.05,*P<0.05,**P<0.01,***P<0.001和****P<0.0001)。A:对肿瘤体积的影响;B:对肿瘤重量的影响;C:肿瘤照片;D:对小鼠体重的影响。
图8:在并具抑郁症状的肿瘤小鼠模型上5-羟基色氨酸的抗抑郁和抗肿瘤的双重效果(ns P>0.05,*P<0.05,**P<0.01,***P<0.001和****P<0.0001)。A:造模示意图;B:对肿瘤体积的影响;C:悬尾实验结果;D:蔗糖偏好实验结果。
具体实施方式
以下为结合实施例对本发明做进一步说明。所有实施例所用细胞、化合物、给药剂量、检测方法均按以下说明进行。
一、材料
1.细胞株:小鼠结肠癌细胞MC38和CT26均由上海复旦大学基础医学院赠予。
2.动物:4-6周龄雌性C57、BALB/c、Nude、CD1小鼠购买于上海灵畅实验动物有限公司。C57用于构建MC38同系小鼠肿瘤模型,BALB/c用于构建CT26同系小鼠肿瘤模型。3.试剂:高糖RPMI-1640培养基均购买于Hyclone公司;胎牛血清、青霉素-链霉素溶液、胰酶等均购买于GIBCO公司;干扰素γ购于北京同立海源公司;TRIZOL裂解液购于诺维赞公司;5-羟基色氨酸在MCE公司购买;PD-1抗体购于Bio X Cell公司;胶原酶、透明质酸酶、DNA酶、二甲亚砜(DMSO)均于Sigma公司购买;RPE溶液购于生工生物工程(上海)股份有限公司。
4.仪器:CO2细胞培养箱;显微镜;细胞培养超净工作台;细胞计数器;酶标仪;流式细胞仪等。
5.抗体:CD45、CD4、CD8、颗粒酶B抗体均购于优宁维公司。
二、药物配制
1.动物实验:5-羟基色氨酸溶于含5%DMSO的灭菌PBS溶液中,剂量为100mg/kg;PD-1抗体用灭菌PBS溶液稀释至给药浓度,剂量为150μg/只。
三、定量逆转录PCR
1.吸取细胞上清,用1mL TRIZOL裂解细胞,加入200μL氯仿,振荡30s,静置3min。
2. 4℃离心12000rpm,10min。
3.吸取上清至干净的1.5mL ep管中,加入1/2倍体积的无水乙醇,上柱。
4.静置2min,12000rpm,3min,弃废液。
5.加入500μL RPE溶液,静置2min,10000rpm,30s,弃废液。
6.重复步骤5。
7. 10000rpm,3min,离去多余的液体,将柱子置于干净的1.5mL ep管中。
8.加入30μL DEPC水,静置5min,室温12000rpm,2min,获得RNA。
9.测定RNA浓度。
10.定量1000ng RNA进行反转录,得cDNA。
11.以cDNA为模板进行定量逆转录PCR反应,再运用双Delta CT值分析方法进行定量分析。
四、同源肿瘤细胞系异种移植模型
1.取对数生长期的MC38细胞和CT26细胞,离心后弃去培养基,用预冷的PBS洗两次细胞以去除血清,灭菌PBS重悬计数并调整细胞密度为3×10
2.用剃毛器给小鼠剃毛,每只小鼠于右前肢腋下皮下注射100μL混悬液,即每只小鼠3×10
3.种瘤第二天开始给药,观察小鼠成瘤情况,每隔三天用游标卡尺测量小鼠瘤体测量以计算肿瘤体积和小鼠体重,其中肿瘤体积=a×b
4.记录数据并绘制肿瘤生长曲线和小鼠体重曲线。当溶剂组小鼠肿瘤体积长到伦理最大体积时,处死小鼠,剥取肿瘤组织称重记录,绘制肿瘤重量图。
五、肿瘤浸润流式细胞术
1.在动物实验终点解剖小鼠,取500mg新鲜的肿瘤组织。
2.于2ml EP管中,加入200ul消化液,用剪刀剪碎成肉糜
4.补充消化液至2mL,并转移肿瘤样本中至37℃摇床孵育40min。
5.将消化好的肿瘤组织用70μm尼龙网过滤至提前加入4ml PBS的15mL离心管中。
6. 1800rpm 5min离心,加入PBS清洗一次,弃上清,加入1ml红细胞裂解液去除红细胞,静置2min后加入2mL PBS终止,
7. 800rpm 5min离心,弃上清,用适当体积的PBS重悬得到单细胞悬液。
8.用不含蛋白的500μL PBS重悬细胞,加入0.125μL AF700染色,室温孵育15min;
9.加入500μL含2%FBS的PBS终止,离心,弃上清;
10.封闭,blocking Fc受体,首先每个样品加入50μL孵育液,冰上孵育10min;
11.配置表面markers的抗体孵育液,每个样品50μL,上述步骤6不需清洗,直接加入50μL的抗体混悬液直接孵育;4℃孵育30min;
12.加入1mL的PBS终止,离心1800rpm 5min;
13.加入50μL PBS进行重悬;
14.加入250μL的固定破膜液进行混匀,4℃,20min;
15.加入1mL破膜/清洗液,离心;
16.用100μL的破膜/清洗液配制颗粒酶B抗体,重悬细胞;4℃孵育30min,中间混匀2次;
17. 1mL破膜/清洗液终止,400g离心,弃上清;
18. 400μL含2%FBS的PBS重悬,放入流式管中,进行流式检测。
六、并具抑郁症状的肿瘤小鼠模型构建及抑郁行为表型检测
1.将C57小鼠随机分成五组,分别是组一:正常对照组;组二:社会挫败(CSDS)造模+肿瘤移植+溶剂组;组三:社会挫败(CSDS)+肿瘤移植+给药组;组四:社会挫败(CSDS)+溶剂组;组五:社会挫败(CSDS)+给药组。
2.第0天组二、组三内每只小鼠于右前肢腋下皮下注射100μL MC38细胞混悬液,即每只小鼠3×10
3.第1天至第20天,每天对小鼠进行腹腔注射给药,观察小鼠成瘤情况,每隔三天用游标卡尺测量小鼠瘤体测量以计算肿瘤体积和小鼠体重,其中肿瘤体积=a×b
4.第3天到第12天对组二、三、四、五进行社会挫败(CSDS)造模。将7-9月龄CD1雄鼠放入鼠笼进行刺激,每天攻击5min,再将CD1雄鼠置于透明隔板另一侧恐吓,造成心理压力。
5.第21天开始对小鼠进行抑郁行为表型检测,包括蔗糖偏好、悬尾实验。
6.悬尾实验:将小鼠头朝下,尾巴固定,准备计时器,监测小鼠5min内静止和挣脱摆动的时间。
7.蔗糖偏好实验:第一天将小鼠分笼,每笼一只,并加上纯水和2%蔗糖水各一瓶,处理24h(中间调换一下两个水瓶的位置);适应24小时后,第二天移去水和食物,饥饿处理24小时;第三天加上20ml纯水和20ml 2%蔗糖水,处理6h(中间调换一下两个水瓶的位置),6h后检测剩余的纯水及糖水的量。
实验例1:5-羟基色氨酸在多种肿瘤细胞系中均能下调PD-L1的诱导性表达
如图1所示,同时给予胰腺癌细胞BXPC3、非小细胞肺癌细胞A549、卵巢癌细胞SKOV3 500IU/mL的干扰素γ和所示浓度分别为0.4μM,2μM和10μM的药物5-HTP,处理48小时。分别从蛋白水平(图1A)和转录水平(图1B)检测5-羟基色氨酸对PD-L1的诱导性表达的调控作用。具体实验操作过程请见上文第三项中的详细描述。
结果显示,5-羟基色氨酸在多种肿瘤细胞系中均能在转录水平下调PD-L1的诱导性表达。
实验例2:5-羟基色氨酸在结肠癌MC38同源模型中发挥抗肿瘤效应
如图2所示,每天给小鼠腹腔注射100mg/kg 5-羟基色氨酸,每隔三天测量一次瘤体积以及体重并记录,在实验终点18天处死小鼠剥取瘤组织,称重拍照(图2C),记录数据绘制瘤体积曲线(图2A)、瘤重图(图2B)和体重曲线(图2D)。具体实验操作过程请见上文第四项中的详细描述。
结果显示,相比于溶剂组,给药组能显著延缓MC38肿瘤生长,且小鼠体重没有明显变化,说明耐受性较好。
实验例3:5-羟基色氨酸在结肠癌CT26同源模型中发挥抗肿瘤效应
除了检测MC38模型,本发明还在CT26同源模型检测5-羟基色氨酸的抗肿瘤效应。按图3中所示给药浓度,每天给小鼠腹腔注射100mg/kg 5-羟基色氨酸,每隔三天测量一次瘤体积以及体重并记录,在实验终点18天处死小鼠剥取瘤组织,称重拍照(图3C),记录数据绘制瘤体积曲线(图3A)、瘤重图(图3B)和体重曲线(图3D)。具体实验操作过程请见上文第四项中的详细描述。
结果显示,相比于溶剂组,给药组能显著延缓CT26肿瘤生长,小鼠体重没有明显变化。
实验例4:5-羟基色氨酸的抗肿瘤药效依赖其对免疫微环境的调控
为了探究5-羟基色氨酸在体内发挥抗肿瘤效应的机制,本发明比较了5-羟基色氨酸在免疫完整小鼠(C57)和免疫缺陷小鼠(Nude,裸鼠)中的抗肿瘤药效差异。每天给小鼠腹腔注射100mg/kg 5-羟基色氨酸,每隔三天测量一次瘤体积以及体重并记录,在实验终点18天处死小鼠剥取瘤组织,称重拍照(图4D),记录数据绘制瘤体积曲线(图4A和B)、瘤重图(图4C)。具体实验操作过程请见上文第四项中的详细描述。
比较5-羟基色氨酸在免疫完整小鼠(C57)和免疫缺陷小鼠(Nude)中的抗肿瘤药效差异,结果显示,在免疫缺陷的小鼠体内,5-羟基色氨酸的抗肿瘤药效丧失,说明5-羟基色氨酸发挥抗肿瘤药效依赖于免疫系统的存在。
实验例5:5-羟基色氨酸在体内下调肿瘤细胞PD-L1表达
为进一步探究组合药物在动物体内的抗肿瘤作用,分别在图2和图3的动物实验终点处死解剖小鼠。取得新鲜肿瘤组织后消化过滤获得单细胞悬液。通过用CD45抗体对肿瘤细胞(CD45阴性)和免疫细胞(CD45阳性)分群,检测5-羟基色氨酸对肿瘤细胞表面的PD-L1表达的影响。具体实验操作过程请见上文第五项中的详细描述。
结果如图5所示,从图中可以看出,通过流式细胞分析,在同系小鼠动物模型(A:MC38,B:CT26)上5-羟基色氨酸给药在体内显著下调肿瘤细胞表面的PD-L1表达。
实验例6:5-羟基色氨酸促进肿瘤T细胞浸润,增加CD8阳性颗粒酶B阳性的活化效应T细胞比例
在图2、3的动物实验终点处死解剖小鼠。取得新鲜肿瘤组织后消化过滤获得单细胞悬液。通过用CD45抗体对肿瘤细胞(CD45阴性)和免疫细胞(CD45阳性)分群,检测5-羟基色氨酸对肿瘤浸润的T细胞进行分析。具体实验操作过程请见上文第五项中的详细描述。
结果显示,相比于溶剂组,5-羟基色氨酸给药组中肿瘤浸润的总T细胞(CD45阳性CD3阳性)显著增加(图6A);CD4阳性T细胞没有显著性变化(图6B);CD8阳性杀伤性T细胞比例增加(图6C),同时活化的杀伤性T细胞比例(%CD8
实验例7:5-羟基色氨酸和PD-1抗体联合在结肠癌MC38同源模型中增强抗肿瘤效应
在MC38同源肿瘤模型中,每天给小鼠腹腔注射100mg/kg 5-羟基色氨酸并在第8、12、16天给药150μg/只PD-1抗体。给药的同时监测小鼠体重和状态,每隔三天测量一次瘤体积以及体重并记录(图7D),在实验终点18天处死小鼠剥取瘤组织,称重拍照(图7C),记录数据绘制瘤体积曲线(图7A)、瘤重图(图7B)。具体实验操作过程请见上文第四项中的详细描述。
实验结果表明,相比于对照组和单用组,5-羟基色氨酸和PD-1抗体联用能显著延缓肿瘤的生长,而且联用组合对小鼠体重影响很小,说明组合药物的毒性作用较小,具有一定的安全性和耐受性。
实验例8:在并具抑郁症状的肿瘤小鼠模型上5-羟基色氨酸具有缓解小鼠抑郁和抗肿瘤的双重功效
按照图8A所示,对肿瘤移植小鼠进行抑郁症状造模,分别每天给予溶剂和100mg/kg 5-HTP处理,每隔三天测量一次瘤体积(图8B)并记录,于第21天开始进行抑郁行为表型检测,评价实验包括悬尾实验(图8C)和蔗糖偏好实验(图8D)。具体实验操作过程请见上文第六项中的详细描述。
实验结果表明,在并具抑郁症状的肿瘤小鼠中,5-羟基色氨酸在缓解肿瘤生长的同时能显著改善小鼠悬尾时间和蔗糖偏好的抑郁表型,因此,5-羟基色氨酸具有缓解小鼠抑郁和抗肿瘤的双重功效。
