一种化学发光法侧流免疫检测方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及测流免疫检测技术领域,尤其是涉及一种化学发光法侧流免疫检测方法。
背景技术
侧流免疫分析法(LFIA)发明于1956年,由于在各种医疗卫生、食品安全、环境监测等方面的广泛使用,它已经受到越来越多的关注。LFIA试纸的开发对于临床蛋白质生物标志物的诊断尤为重要,这进一步实现了侧流免疫分析的家庭设置应用。由于生物液体中的临床生物标志物浓度很低,因此非常需要超灵敏的检测。例如,急性心肌梗死(AMI)是全球十大“死亡疾病”之首。cTnI被认为是早期诊断AMI的“黄金标准生物标志物”,因为其浓度变化与AMI的不同发展阶段直接相关。然而,在正常情况下,人血清中的cTnI可低至0.05ng/ml。因此,在AMI发病的前3小时,cTnI的浓度太低,无法检测。更重要的是,cTnI的浓度随AMI发病的不同阶段而变化。对AMI患者来说,高度敏感和特异的cTnI检测是非常必要的。
提高侧流免疫测定的灵敏度对许多生物标志物的检测至关重要。近年来,人们致力于开发具有高灵敏度的新试纸,主要是通过将抗原或抗体与纳米材料共轭,如金纳米粒子(AuNPs)、磁性纳米粒子、量子点、和荧光微球。在这些方法中,将抗体和辣根过氧化物酶(HRP)同时连接到AuNPs上,可以产生有效的、超灵敏的化学发光免疫测定(CL-LFIAs)。而导致假阳性错误的原因主要是抗原和抗体之间以及蛋白质和硝酸纤维素膜之间的非特异性吸附。因此,LFIA急需一种将交叉反应降至最低的方法来实现其高精确度。
为减少假阳性错误以提高检测精度,其中一个有效的方法是去除抗体的Fcre-gion,这是导致非特异性的主要原因。除此之外,也可以使用生物素化的抗体。将抗原-抗体的相互作用转换为阿维菌素-生物素的相互作用,特异性结合大大增强,从而提高了敏感性和特异性。然而,这两种方法都涉及到抗体结构的改变,可能会进一步影响结合反应性。另一种方法是一种基于水基两相系统的ELISA方法,它将检测抗体固定在水环境中的某个区域内,抗体被阻止相互作用,而交叉反应被消除了。然而,这种方法需要一个精确的微吸管,使其不适合大规模和快速检测。研究了具有增强的分散性的疏水性镉基量子点,作为检测SARS-CoV-2的探针,可以最大限度地减少交叉反应,提高准确性。其他纳米粒子,如金纳米粒子(NPs)、上转换NPs、和磁性氧化铁NPs也被用于检测生物标志物,具有很高的准确性和敏感性。例如,利用抗体功能化的磁性氧化铁纳米粒子来减少非特异性信号,并以高精确度检测双标志物。利用AuNPs结合的二级抗体,通过检测AuNPs的SPR信号,实现了对三种激素的多重检测,且无交叉反应。然而,这些方法涉及到纳米粒子的合成,而且程序比较复杂。此外,这些NPs的聚集也可能由于纳米粒子的相互作用而导致错误的信号。使用超声波驻波技术来分散AuNPs,以消除抗体和AuNPs之间的非特异性相互作用,将多联免疫测定的灵敏度提高了近1000倍。但是,超声波设备可能无法满足医疗点的检测。
减少纳米粒子免疫分析中的假阳性错误的关键因素是提高分散性和减少纳米粒子的聚集。目前的研究表明,纳米粒子的聚乙二醇(PEG)化可以减少蛋白质和细胞的吸附,并且随着PEG的分子量和密度的增加,效率会更高。然而,化学发光LFIA的AuNPs的PEG化,到目前为止还没有被研究。
发明内容
本发明的目的是提供一种化学发光法侧流免疫检测方法,通过AuNPs的PEG化可以有效减少蛋白质的吸附和非特异性的反应,最大程度地减少交叉反应,进一步提高检测的准确性和灵敏度。
为实现上述目的,本发明提供了一种化学发光法侧流免疫检测方法,该方法用于在检测蛋白质分析物时减少交叉反应和假阳性,通过金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物在检测试纸上进行侧流免疫反应,进行特异性分析物的检测。
优选的,所述金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物的制备方法包括以下步骤:
S1、使用物理吸附法将HRP结合的分析物的检测抗体与AuNPs连接:将碳酸钠溶液加入到AuNP溶液中,然后再加入HRP标记的检测抗体,然后在旋转器上轻轻搅拌;
S2、通过Au-S键将mPEG共价连接到AuNPs上:向步骤S1中的混合物中加入mPEG溶液,在旋转器上轻轻搅拌,进一步孵化;
S3、将BSA溶液与AuNPs孵育,在旋转器上轻轻搅拌,以阻断AuNPs上的额外反应位点,然后离心,之后加入pH8-9的硼酸盐缓冲溶液,得到金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物;
S4、将步骤S3得到的金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物悬浮在回收液中,回收液包含0.5-10%BSA、1-10%蔗糖和0.01-1%tween20的硼酸盐缓冲溶液,并储存备用。
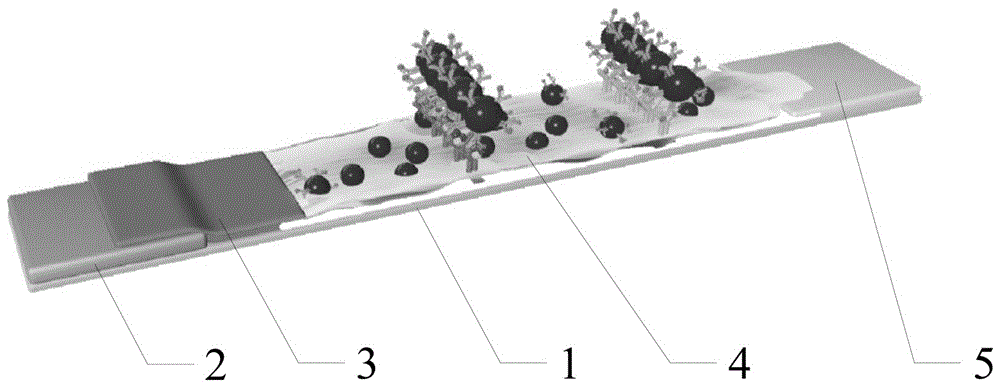
优选的,所述检测试纸包括底板、样品垫、结合垫、硝酸纤维素膜和吸水垫,样品垫、结合垫、硝酸纤维素膜和吸水垫依次排列粘附在底板表面;硝酸纤维素膜表面设置有测试线和控制线,测试线是由捕获抗体点样到硝酸纤维素膜表面形成的,控制线是由IgG抗体点样到硝酸纤维素膜表面形成的,结合垫含有金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物。
优选的,所述检测试纸的制备方法包括以下步骤:
a、将捕获抗体点样在硝酸纤维素膜上,形成测试线,然后将IgG抗体点样在硝酸纤维素膜上,形成控制线;
b、将制备的金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物喷点到结合垫上;
c、将样品垫、结合垫、硝酸纤维素膜和吸水垫依次粘附在底板上,然后切成1-10毫米宽的条状物,将条状物放在室温的干燥环境中备用。
上述的化学发光法侧流免疫检测方法,包括以下步骤:
将分析物加入检测试纸的样品垫或结合垫中,检测试纸结合垫中含有金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物,然后等待0.5-10分钟,加入化学发光底物,发光后,照相记录。
优选的,所述检测试纸包括底板、样品垫、结合垫、硝酸纤维素膜和吸水垫,样品垫、结合垫、硝酸纤维素膜和吸水垫依次排列粘附在底板表面;硝酸纤维素膜表面设置有测试线和控制线,测试线是由捕获抗体点样到硝酸纤维素膜表面形成的,控制线是由IgG抗体点样到硝酸纤维素膜表面形成的,结合垫不含有金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物。
优选的,所述检测试纸的制备方法包括以下步骤:
a、将分析物的捕获抗体点样在硝酸纤维素膜上,形成测试线,然后将IgG抗体点样在硝酸纤维素膜上,形成控制线;
b、将样品垫、结合垫、硝酸纤维素膜和吸水垫依次粘附在底板上,然后切成1-10毫米宽的条状物,将条状物放在室温的干燥环境中备用。
上述的化学发光法侧流免疫检测方法,包括以下步骤:
将分析物与金纳米颗粒-抗体-辣根过氧化物酶-聚乙二醇AuNP-Ab-HRP-PEG共轭物混合成混合液,然后将混合液加入检测试纸的样品垫或结合垫中,然等待0.5-10分钟,加入化学发光底物,发光后,照相记录。
本发明所述的一种化学发光法侧流免疫检测方法的优点和积极效果是:
1、本发明通过AuNPs的PEG化可以有效减少蛋白质的吸附和非特异性的反应,最大程度地减少交叉反应,进一步提高蛋白质分析物检测的准确性和灵敏度。
2、本发明中AuNPs被HRP结合的检测抗体功能化,mPEG-SH通过Au-S共价键与AuNPs共轭,在酶的化学发光底物存在的情况下,HRP可以有效地催化酶促反应,发出足够强的化学发光,可以被带有CMOS摄像头的手机轻松检测到。
3、本发明中AuNP-Ab-HRP-PEG共轭物被研究用于cTnI化学发光检测的侧流试验,还被研究用于不同及多种不同分析物的检测;通过AuNPs的PEG功能化,可以为便携式免疫分析装置获得更高的灵敏度和准确度,并且检测时间短,程序简单,不仅可用于侧流化学发光检测,还可用于其他检测,如基于纳米颗粒的颜色检测,以及其他检测方法。
下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。
附图说明
图1为本发明实施例中AuNP-Ab-HRP-PEG共轭物的制备示意图;
图2为本发明实施例中PEG化AuNPs以提高CL-LFIA生物传感器的性能的说明图;
图3为本发明实施例中AuNPs、AuNP-PEG、AuNP-PEG-Ab和、AuNP-Ab共轭物的动态光散射结果图;
图4为本发明实施例中不同共轭物的紫外-可见光光谱图和FTIR光谱图,其中A为不同共轭物的紫外-可见光谱图,B为A中500nm-600nm波长的放大吸光度曲线图,C为 AuNP-PEG共轭物的FTIR光谱图,D为C中2000 cm
图5为本发明实施例中AuNP-Ab-HRP-PEG共轭物应用于CL-LFIA进行检测的说明图;
图6为本发明实施例中CL-LFIA测试优化中不同参数对LFIR试纸条的灵敏度和特异性的影响结果示意图,其中A为PEG浓度对测试线和控制线信号强度的影响示意图,分析器浓度为0,B为PEG浓度对测试线和控制线信号强度的影响示意图,分析器浓度为100 ng·mL
图7为本发明实施例中在CL-LFIA测试优化的基础上, PBS缓冲液中cTnI的测定结果图,其中A为10 pg·mL
附图标记
1、底板;2、样品垫;3、结合垫;4、硝酸纤维素膜;5、吸水垫。
具体实施方式
以下通过附图和实施例对本发明的技术方案作进一步说明。除非另外定义,本发明使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。
所有实验材料均为常规市购产品。
实施例
AuNP-Ab-HRP-PEG共轭物的制备方法包括以下步骤:
S1、使用物理吸附法将HRP结合的抗cTnI检测抗体与AuNPs连接:将20 μL的0.02M碳酸钠溶液加入到0.5 mL的AuNP溶液中,然后再加入12.5 μL的1 mg·mL
S2、通过Au-S键将mPEG共价连接到AuNPs上:向步骤S1中的混合物中加入20μL 5%的mPEG溶液,在水平旋转器上轻轻搅拌,进一步孵化30分钟;
S3、将50μL的10% BSA溶液与AuNPs孵育30分钟,在水平旋转器上轻轻搅拌,以阻断AuNPs上的额外反应位点,然后在10000 rpm下离心3次,12分钟后加入硼酸盐缓冲溶液,得到AuNP-Ab-HRP-PEG共轭物;
S4、将步骤S3得到的AuNP-Ab-HRP-PEG共轭物悬浮在200μL回收液中,并储存在4℃条件下备用。
其中,硼酸盐缓冲溶液的pH=8.5,回收液为包含1%BSA、2%蔗糖和0.05%tween20的硼酸盐缓冲溶液。
没有PEG化的AuNP-Ab-HRP共轭物采用上述同样的方法制备,不同之处在于步骤S2中不添加mPEG溶液。
成功制备两种共轭物后,进行了不同的表征方法:
使用激光光散射光谱仪测量不同共轭物的水合物颗粒大小。不同共轭物的紫外-可见光谱是通过使用Shimadzu UV3600Plus紫外-可见-近红外分光光度计获得的。共轭物的傅里叶变换红外(FTIR)光谱是通过使用FTIR分光光度计获得的。
用AuNP-Ab-HRP-PEG共轭物进行化学发光侧流免疫测定(CL-LIFA)的原理为:首先通过物理吸附将HRP结合的抗体(Ab)与AuNPs共轭,然后通过Au-S共价键将其进一步与mPEG-SH共轭,如图1所示。
如图2所示,在对AuNPs进行PEG化处理后(图2中A所示),与没有进行PEG功能化处理的AuNPs相比(图2中C所示),其他抗原在AuNPs上的非特异性吸附明显减少(图2中B所示)。
AuNP-Ab-HRP-PEG共轭物的特征:通过动态光散射(DLS)评估了不同共轭物的流体力学直径分布,包括AuNPs(图3中A所示)、AuNP-PEG(图3中B所示)、AuNP-PEG-Ab(图3中C所示)和AuNP-Ab共轭物(图3中D所示),其中左侧纵坐标表示共轭物直径的差异性分布,右侧纵坐标表示共轭物直径的累积分布。图3中A的差异分布线呈现两个明显的峰值,主要是因为一些AuNPs在PBS缓冲液中的聚集,在AuNP溶液中加入PEG可以使AuNPs在PBS缓冲液中更加分散。图3中A与图3中B比较、图3中C与图3中D比较,都表明聚集的纳米粒子的数量减少了,因为PEG化后的平均直径明显减少。PEG化可以防止纳米粒子聚集的原因主要是纳米粒子上覆盖的PEG层可以减少非特异性的相互作用。
图3中A的AuNPs曲线与图3中D的AuNPs-Ab曲线相比,图3中D的差异分布曲线中只有一个峰,这表明抗体和AuNPs之间的共轭。此外,如表1所示,加入抗体后,AuNPs的流体力学直径从51.79n m明显增加到86.64 nm,表明抗体被成功地结合到AuNPs上。如表1所示,在PEG化之后,AuNPs的平均流体力学直径从51.79 nm下降到50.96 nm,表明胶体金溶液变得更加分散。如表1所示,在PEG化之后,AuNP-Ab的平均流体力学直径从86.64纳米下降到71.90纳米,表明AuNP-Ab共轭物的聚集也被抑制。综合实验结果表明,PEG的加入减少了颗粒的平均直径,增加了扩散系数,表明聚集的AuNPs的数量减少。
表1不同共轭物的动态光散射结果
根据动态光散射的结果,可以得出PEG化的AuNP提高CL-LFIA的性能的机制。考虑到血液或其他溶液中有许多不同的蛋白质和分子,不含PEG的共轭物可能通过静电吸引来吸附非特异性抗原,如图2中B所示;因为金纳米球表面有足够的空间,PEG化后,额外的活性位点被mPEG-SH占据,这改善了AuNP和非特异性抗原之间结合的立体阻碍,如图2中C所示。因此,非特异性吸附的减少将提高CL-LFIA的特异性和准确性。
此外,加入PEG后,AuNPs的聚集倾向于停留在测试线上,通常会导致LFIA的假阳性线,然而,在AuNP表面的PEG可能会降低纳米颗粒之间的静电吸引力,这可能会阻止AuNPs之间的吸附,如图2中A所示,溶液会更加分散,这已经被DLS的结果所证实。
AuNP-Ab-HRP-PEG共轭物通过紫外可见分光光度计和FTIR分光光度计进行了表征:
由图4可知,AuNPs的吸收峰在波长534nm处,如图4中A和图4中B所示,表明AuNPs存在。AuNP-Ab共轭物的吸收峰从534纳米转移到541纳米,表明检测抗体被成功吸收到Au纳米颗粒上。AuNP-PEG-Ab的峰值波长介于AuNP和AuNP-Ab之间,是因为添加了mPEG-SH,防止了AuNPs的聚集,使胶体颗粒更加多样化。PEG化使流体力学直径从86.64nm下降到71.90nm,进一步改善了Au-Ab的分散性,并获得了紫外-可见光谱的蓝移。图4中C和图4中D的FTIR光谱进一步证明PEG已经成功地与颗粒共轭。在1650cm
一种化学发光法侧流免疫检测试纸(CL-LFIA)的第一种制备方法,包括以下步骤:
a、将1.08 mg·mL
b、将制备的AuNP-Ab-HRP-PEG共轭物喷点到结合垫3上;
c、将样品垫2、结合垫3、硝酸纤维素膜4和吸水垫5依次粘附在底板1上,然后切成2毫米宽的条状物,将条状物放在室温的干燥环境中备用。
检测方法为:检测时,将分析物加入样品垫2或结合垫3中,然后等待0.5-10分钟,然后加入化学发光底物,发光后,照相记录。
一种化学发光法侧流免疫检测试纸(CL-LFIA)的第二种制备方法,制备过程中不添加AuNP-Ab-HRP-PEG共轭物,其他步骤与第一种制备方法相同。
检测方法为:检测时,将分析物与AuNP-Ab-HRP-PEG共轭物混合,然后将混合液滴入样品垫2或结合垫3中,然后等待0.5-10分钟,然后加入化学发光底物,发光后,照相记录。
AuNP-Ab-HRP-PEG共轭物应用于上述的第一种制备方法制备的一种化学发光法侧流免疫检测试纸,如图5所示。将心肌肌钙蛋白cTnI与AuNP-Ab-HRP-PEG共轭物混合后,心肌肌钙蛋白cTnI将与AuNP-Ab-HRP-PEG共轭物上的山羊抗鼠IgG抗体结合。将混合物涂在化学发光法侧流免疫检测试纸条上,抗原会进一步与试纸条上的固定化抗体结合,并在测试线上形成一个三明治结构。额外的AuNP-Ab-HRP-PEG共轭物被控制线上的山羊抗鼠IgG抗体捕获。最后,由于金纳米粒子的红色,硝酸纤维素膜上有两条红线,表明成功检测到目标。
化学发光法侧流免疫检测试纸(CL-LFIA)测试的优化基于第一种制备方法制得的试纸。
化学发光法侧流免疫检测试纸(CL-LFIA)测试的优化:为了在试纸上获得最密集的光信号,对一些基本参数进行了评估和优化,包括抗体的浓度、PEG的浓度和检测时间。
(1)抗体的浓度的优化:
首先,将不同体积(1、2、3、4和5 μL)的1 mg·mL
(2)PEG的浓度的优化:
PEG浓度对减少CL-LFIA试纸条中AuNPs聚集的影响。如图6中A所示,在没有分析物cTnI的情况下,不同PEG浓度的控制线的光强度都非常大,而测试线的光强度则小得多。控制线上的信号表明试纸条是有效的,而测试线上的信号表明测试线上有假阳性信号。当PEG浓度为0时,测试线处的光信号很强,假阳性非常明显。当PEG浓度足够高时,测试线处的假阳性减弱了。至于控制线,在PEG浓度为1-3 mg·mL
(3)检测时间的优化:
AuNP-Ab-HRP-PEG共轭物和分析物cTnI的混合时间也得到了优化,不同的混合时间(1、2、3、5、10和30分钟)之间没有明显差异。因此,一旦分析物cTnI和AuNP-Ab-HRP-PEG共轭物溶液充分混合,就可以将混合物加入试纸条中。最后,加入CL底物后,HRP结合的检测抗体的浓度和检测时间得到了优化,如图6中C和图6中D所示。浓度是通过每毫升的AuNP溶液中有多少微克的抗体来计算的,最佳的抗体浓度为40微克/毫升
在化学发光法侧流免疫检测试纸(CL-LFIA)测试的优化的基础上,研究了LFIA条的灵敏度和特异性:为了评估灵敏度,将10 μL一定浓度的cTnI溶液(从0.01到100 ng·mL
在化学发光法侧流免疫检测试纸(CL-LFIA)测试的优化的基础上,研究了PBS缓冲液中cTnI的测定:如图7所示,10 pg·mL
在未使用PEG的对照组实验中,检测高浓度的分析物时没有明显的差异。然而,当检测低浓度的cTnI时,出现了假阳性错误,大大影响了结果。当cTnI的浓度为0或不超过0.1ng·mL
因此,本发明采用上述的一种化学发光法侧流免疫检测试纸及其制备方法,通过AuNPs的PEG化可以有效减少蛋白质的吸附和非特异性的反应,最大程度地减少交叉反应,进一步提高检测的准确性和灵敏度。
最后应说明的是:以上实施例仅用以说明本发明的技术方案而非对其进行限制,尽管参照较佳实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对本发明的技术方案进行修改或者等同替换,而这些修改或者等同替换亦不能使修改后的技术方案脱离本发明技术方案的精神和范围。
