氮掺杂碳点在激发植物细胞区隔化盐分提高耐盐性中的应用
文献发布时间:2023-06-29 06:30:04
技术领域
本发明涉及氮掺杂碳点在激发植物细胞区隔化盐分提高耐盐性中的应用,属于新型植物抗逆剂领域。
背景技术
土地盐渍化是威胁土壤环境健康和人类粮食产量与安全的主要危害之一。为应对土壤盐碱化所造成的离子胁迫、渗透胁迫及氧化胁迫,植物自身会试图通过一系列生理生化机制调控离子稳态、渗透平衡和解毒作用,以维持植物的正常生长,但该防御能力有限。人工纳米材料(Engineered Nanomaterials,ENMs)在增强植物耐盐性方面具有较大潜力,纳米生物作为新兴的生物技术,在提高植物应对非生物胁迫耐受性的同时,可减少农业技术对环境的负面影响。
目前,关于ENMs提高植物耐盐性的研究主要集中于植物光合作用和抗氧化能力的提升,然而植物细胞对离子稳态的有效调节才是植物耐盐的首要机制。氮掺杂碳点(N-CDs)作为新型碳基环境功能材料,具有突出的生物相容性和纳米安全性,可通过提高光合作用的光转化和诱导碳水化合物生产促进植物生长。此外,N-CDs在缓解氧化应激和激活系统获得性抗性方面具有一定潜力。那么,这种ENMs能否作为调节离子稳态的激发子,其感知和刺激植物耐盐信号网络的最优浓度和最佳时期又是如何,目前尚不可知。
发明内容
[技术问题]
目前并未有文献报道如何利用纳米材料激发植物细胞区隔化盐分从而提高植物细胞的耐盐性。
[技术方案]
为了解决上述问题,本发明利用N-CDs作为调节离子稳态的激发子,激发植物细胞区隔化盐分,从而提高植物细胞的耐盐性。
本发明的第一个目的是提供氮掺杂碳点在激发植物细胞区隔化盐分提高耐盐性中的应用,所述的应用是在植物细胞溶液中加入N-CDs溶液。
在本发明的一种实施方式中,所述的N-CDs的粒径为1-3nm。
在本发明的一种实施方式中,所述的N-CDs在植物细胞溶液中的浓度为0.05-0.5mg/L。
在本发明的一种实施方式中,所述的N-CDs溶液的溶剂为水,浓度为2-10mg/L。
在本发明的一种实施方式中,所述的N-CDs是通过三聚氰胺和乙二胺四乙酸的热聚合制备;具体是将乙二胺和三聚氰胺混合在马弗炉内高温煅烧;之后将得到的溶液透析纯化,最后进行冷冻干燥获得;其中乙二胺和三聚氰胺的摩尔比为2:1;高温煅烧是650℃下煅烧6h;透析纯化是采用分子量=500Da的透析袋进行透析纯化。
在本发明的一种实施方式中,所述的植物细胞为烟草BY-2、玉米细胞、水稻细胞中的一种。
在本发明的一种实施方式中,所述的植物细胞是处于指数生长阶段的植物细胞。
在本发明的一种实施方式中,所述的耐盐性是指植物细胞可以在氯化钠的浓度为100mM以下的环境中保持活性。
在本发明的一种实施方式中,所述的植物细胞溶液是将植物细胞置于培养基中得到,其中,植物细胞和培养基的用量比为0.8g:15-25mL;培养基为1/2MS培养基。
[有益效果]
(1)本发明采用的N-CDs对盐胁迫所造成植物细胞损伤具有显著的缓解作用;浓度为0.5mg/L的N-CDs处理12h可使植物耐盐性增强14.5%。
(2)本发明采用的N-CDs可作为K
(3)本发明方法适用于植物细胞应对长期盐胁迫环境。
附图说明
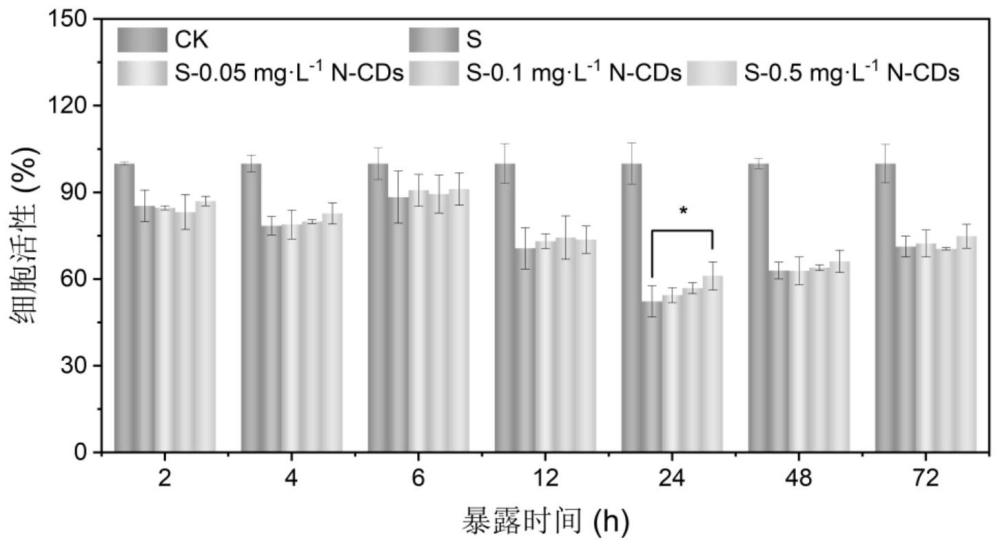
图1为实施例1和对比例1、2中不同浓度N-CDs处理下BY-2细胞的活性变化。
图2为实施例1中24h暴露于N-CDs细胞活性的检测结果;其中(a)为PI/FDA染色检测细胞活性;(b)为TTC检测细胞活力。
图3为实施例1中N-CDs对BY-2细胞耐盐指数的影响。
图4为实施例1中暴露48h后BY-2细胞内的N-CDs,(b)为(a)中选定区域的放大图片。
图5为实施例1中N-CDs处理下细胞内耐盐相关基因的动态时间表达结果。
图6为实施例1和对比例1、2中N-CDs对细胞内Na(a)、K(b)含量的影响。
图7为实施例1中耐盐记忆的测试结果,其中,(a)为耐盐记忆测试过程:通过TTC测定评估N-CDs;(b)为启动的耐盐记忆。
图8为对比例3中0.1mg/L CeO
图9为对比例4中1.64μg/L或2.66μg/L的CeCl
图10为对比例5中不同浓度nTiO
图11为对比例6中不同浓度nSe处理下BY-2细胞的活性变化。
图12为对比例7中不同浓度nMnFe
图13为对比例8中不同浓度nSiO
图14为对比例9中不同浓度CDs处理下BY-2细胞的活性变化。
图15为对比例10中不同浓度nFe
具体实施方式
以下对本发明的优选实施例进行说明,应当理解实施例是为了更好地解释本发明,不用于限制本发明。
测试方法:
1、细胞活力的测试:
采用2、3、5-三苯四唑氯化铵(TTC)方法测定每个时间点不同处理方式后的细胞活力。具体步骤如下:
每个样品取1mL BY-2细胞溶液于1.5mL离心管中,静置10min,小心吸去上清液,用PBS缓冲液(0.1M,pH 7.2)洗涤细胞,重复3次,向去除上清液后的细胞中加入1mL的TTC溶液(0.3%v/v,溶剂为0.05M PBS,pH 7.2),使细胞重新悬浮;
将洗涤好的细胞样品放置于25℃下黑暗孵育8h后,6000rpm离心并除去上清液,加入1mL 95%乙醇,涡旋使细胞分散,60℃下水浴15min,细胞发白后,6000rpm离心5min,取200μL上清液加至酶标板,用酶标仪485nm下测定吸光度,以相应时间点的CK作为基准进行归一化处理,计算细胞活性;
细胞活性测定试验设置3个生物学重复,且以上操作过程全程保持无菌操作。
2、活细胞比例的测试:
采用双荧光素二乙酸(FDA)/碘化丙啶(PI)荧光染色测定活细胞比例,进一步确认不同处理方式下的细胞活性。具体步骤如下:
在选定浓度(0.5mg/L N-CDs)和时间点(2、6、24h)下,对各处理组BY-2细胞进行PI-FDA染色(染料浓度均为20mg/L),使用荧光显微镜拍摄明场、红色荧光场(Tx Red)以及绿色荧光场(FITC)照片(每个视野内确保有100个细胞)。统计活细胞和死细胞的数量(NISViewer和imageJ软件),计算活细胞比例。
3、耐盐性能的测试:
将盐胁迫下的植物细胞中加入N-CDs后,于2、4、6、12、24、48、72h,对各处理组取14mL BY-2细胞悬浮液并静置20min,取4mL培养基上清液用于测定电导率。剩余部分滤除培养基,用PBS缓冲液(0.1M,pH 7.2)清洗并滤干,测定鲜重(Fresh Weight,FW),细胞经60℃48h烘干,测定干重(Dry Weight,DW)。
耐盐指数(STI)计算公式为:STI(%)=(盐胁迫下总干重或添加ENMs的盐胁迫下总干重/对照组总干重)×100。
4、纳米材料在细胞内的分布和表征:
采用TEM进行观察。
5、纳米材料的表征:
用Milli-Q超纯水将N-CDs配置成10mg/L的水溶液低温水浴超声30min,取20μL悬液滴于铜网上,待自然风干后,通过透射电镜(TEM)对N-CDs粒径和形态进行表征,并使用Nano Measurer计算两种材料的粒径。
6、盐胁迫耐受性信号通路相关基因的动态变化:
用实时荧光定量PCR分析盐响应基因的表达。具体包括如下步骤:
盐胁迫下BY-2细胞暴露N-CDs后,滤除2、4、6、12、24、48、72h各时间点BY-2细胞培养基,用PBS清洗并滤干,充分研磨后用植物RNA提取试剂盒提取BY-2细胞中的总RNA;
利用Nanodrop测定所提取总RNA的浓度和质量,并用反转录试剂合成cDNA。以EF1α为内参基因。以cDNA为模板,加入荧光染料和相应的引物,以荧光定量PCR检测系统进行PCR扩增(反应程序为:预变性95℃10min;变性95℃15s,退火/延伸60℃1min,重复40个循环;以PCR仪默认程序进行融解曲线分析,根据Ct值进行基因相对表达分析。采用比较法(2
7、细胞内Ca、Na、K含量的测试:
采用NMT测定Na
采用尖端直径为4.5±0.5μm的传感器,并向其内注入长约1cm的灌充液(Na
取1mL细胞悬液置于特制玻片表面,固定10min加入5mL测试液,稳定10min后更换测试液。将传感器尖端置于细胞表面距离细胞核最近的位置并持约1-2μm的距离,每次测定步进为20μm,每个处理设置至少7个生物学重复,结果以平均值±标准误差表示。通量数据采用imFluxes V2.2软件进行处理。
8、耐盐记忆的测试:
将盐胁迫下暴露24h N-CDs的BY-2细胞从原始培养基中取出(滤除ENMs),转移至新的含盐培养基中,利用TTC法连续测定2、4、6、12、24、48、72h 7个时间点的细胞活性。
实施例中采用的各原料的参数:
烟草BY-2细胞来源于山东农业大学生命科学学院,并于本实验连续继代培养;
N-CDs的粒径为2.5±0.4nm,是通过三聚氰胺和乙二胺四乙酸的热聚合制备得到,具体是:将乙二胺和三聚氰胺按照摩尔比2:1混合在马弗炉内高温(650℃)煅烧6h后,将得到的溶液通过透析袋(分子量=500Da)透析48h进行纯化,之后进行冷冻干燥获得。
实施例1
氮掺杂碳点在激发植物细胞区隔化盐分提高耐盐性中的应用,包括如下步骤:
在超净工作台中,用200目细胞筛过滤旧培养基,称取0.8g处于指数生长阶段的烟草BY-2悬浮细胞(Nicotiana tabacum L.cv.Bright Yellow 2suspension cell)在20mL1/2MS培养基中,控制锥形瓶中细胞鲜重的初始浓度均为40g/L,得到植物细胞溶液;之后在其中加入氯化钠,使得氯化钠的浓度为100mM,适应24h,得到盐胁迫的烟草BY-2细胞溶液;
在盐胁迫的烟草BY-2细胞溶液中加入不同用量浓度为2mg/L的N-CDs水溶液,使得N-CDs在烟草BY-2细胞溶液中的浓度为0.05mg/L,0.1mg/L,0.5mg/L;继续培养2-72h。
对比例1对照组(CK)
省略实施例1中100mM氯化钠和N-CDs的加入,其他和实施例1保持一致,进行培养。
对比例2S处理组(S)
省略实施例1中N-CDs的加入,其他和实施例1保持一致,进行培养。
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如下:
图1为不同浓度的N-CDs处理下BY-2细胞的活性变化,从图1可以看出:对盐胁迫下BY-2细胞施加N-CDs后,0.5mg/L N-CDs在多个时间点均可提升盐胁迫下BY-2细胞的活性,并且在24h时显著提升(增长8.8%),表明0.5mg/L N-CDs具有增强BY-2细胞耐盐性的作用。
图2为实施例1中24h暴露于N-CDs的细胞活性的检测结果,从图2可以看出:0.5mg/L N-CDs使细胞活力恢复了4.0%。
图3为N-CDs对BY-2细胞耐盐指数的影响,从图3可以看出:0.5mg/L N-CDs处理下12h,其耐盐性有显著改善(14.5%)。
图4为实施例1中暴露48h后BY-2细胞内的N-CDs,(b)为(a)中选定区域的放大图片,从图4可以看出:N-CDs被细胞吸收进入细胞液中。
图5为N-CDs处理下细胞内耐盐相关基因的动态时间表达结果,从图5可以看出:N-CDs暴露6h后,NHX1的表达显著增强7.8倍,随后又显著下降,表明Na
图6为N-CDs对细胞内Na(a)、K(b)含量的影响,从图6可以看出:细胞暴露N-CDs后,K
图7为耐盐记忆的测试结果,其中,(a)为耐盐记忆测试过程;通过TTC测定评估N-CDs;(b)启动的耐盐记忆;从图7可以看出:在盐胁迫下6h后,经N-CDs预处理的细胞活力提高了31.6%,且在相对长期暴露(24-72h)条件下,这种耐盐记忆显著提升102.3-229.2%,表明N-CDs预处理增强了植物细胞获得性耐盐性。
对比例3
省略实施例1中N-CDs的加入,将浓度为2mg/L的CeO
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如图8:
从图8可以看出:0.1mg/L的CeO
对比例4
省略实施例1中N-CDs的加入,将浓度为2mg/L的CeCl
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如图9:
从图9可以看出:CeCl
对比例5
调整实施例1中N-CDs为nTiO
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如图10:
从图10可以看出:nTiO
对比例6
调整实施例1中N-CDs为nSe(粒径为~70nm,通过室温固相反应合成制备,具体方法参考文献(王润霞,张胜义,刘明珠.抗坏血酸还原法,室温固相反应制备纳米硒[J].安徽师范大学学报(自然科学版),2004(03):302-305.)),nSe在烟草BY-2细胞溶液中的浓度为0.05、0.1、0.5mg/L;其他和实施例1保持一致,进行培养。
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如图11:
从图11可以看出:nSe改善盐胁迫下细胞活性的效果不如N-CDs。
对比例7
调整实施例1中N-CDs为nMnFe
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如图12:
从图12可以看出:nMnFe
对比例8
调整实施例1中N-CDs为nSiO
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如图13:
从图13可以看出:nSiO
对比例9
调整实施例1中N-CDs为CDs(粒径为<10nm,具体制备方法参考文献(Cheng B,Chen F,Wang C,et al.The molecular mechanisms of silica nanomaterialsenhancing the rice(Oryza sativa L.)resistance to planthoppers(Nilaparvatalugens Stal)[J].Science of the Total Environment,2021,767:144967.)),CDs在烟草BY-2细胞溶液中的浓度为0.05、0.1、0.5mg/L;其他和实施例1保持一致,进行培养。
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如图14:
从图14可以看出:CDs对于改善盐胁迫下细胞活性无明显效果。
对比例10
调整实施例1中N-CDs为nFe
取2、4、6、12、24、48、72h培养后的溶液进行细胞活力测试,测试结果如图15:
从图15可以看出:nFe
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
