一种知母多糖-锌配合物的制备方法和应用
文献发布时间:2024-01-17 01:24:51
技术领域
本发明属于生物医药技术领域,具体为一种具有免疫调节功能的知母多糖-锌配合物及其制备方法和应用。
背景技术
免疫系统在维持宿主健康状态方面发挥着关键作用,提高机体免疫力是预防和治疗多种疾病的关键策略。多糖是一种能够与免疫系统相互作用,增强宿主特异性反应而无副作用的化合物。然而,目前大多数多糖的免疫调节活性较低,不能满足临床应用要求,其开发和应用仍受到很大限制。因此,迫切需要开发增强多糖免疫调节活性的方法,通过微量金属元素进行结构修饰是一种潜在的有效策略。
锌(Zn)是人体内一种重要的必需微量元素,对机体的免疫系统有极其重要的影响。研究表明,锌可通过调节肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和IL-1β等细胞因子产生的途径调节人体免疫系统,适量地摄入锌对增强免疫力和对抗疾病具有重要意义。然而,锌无法在体内合成,只能通过膳食补充剂摄取。现有的补锌方法普遍存在生物利用度低、锌吸收不良、存在毒副作用等缺点。与单一的锌补充剂或者单一的多糖相比,含锌多糖具有利用率高、胃肠刺激小、生物活性高和安全性高的优势,是结合多糖和锌的优点制备出具有理想特性的新分子的有效方法。
鉴于多糖和锌都具有显著的免疫调节活性,初步认定锌修饰的多糖是一种将锌和多糖的优势有机结合起来,构建具有更强的免疫调节活性的新分子的有效方法。根据我们先前的研究,知母多糖(AAII-1-1)作为一种免疫果聚糖,可以通过促进巨噬细胞吞噬作用,调节细胞因子的分泌等方式直接或间接与免疫系统相互作用,从而调节免疫。然而,目前还没有研究报道关于知母多糖锌配合物的免疫调节活性和相应的分子机制。
发明内容
为了获得安全高效的免疫调节剂,本发明公开了一种具有免疫调节作用的知母多糖-锌配合物的制备方法及其应用。本发明制备方法简单,反应条件温和;此外,本发明对锌与AAII-1-1之间的潜在相互作用机制进行了研究;同时,初步探讨了AAII-1-1和AAII-1-1-Zn激活巨噬细胞,增强免疫调节的分子机制,为新型免疫调节剂的开发和应用提供了一种新的生物活性分子。
为实现上述目的,本发明提供如下技术方案:
在第一方面,本发明提供一种知母多糖-锌配合物的制备方法,包括以下步骤:
S1、制备知母多糖:取知母药材,提取知母多糖;
S2、制备知母多糖-锌配合物:将知母多糖溶于水中,加入锌盐溶液反应,制备成知母多糖-锌配合物。
优选地,所述知母多糖为均一性多糖。
更优选地,制备知母多糖的步骤包括先制备粗多糖,再精制成均一性多糖的步骤。
更进一步,精制方法包括对粗多糖进行层析纯化。
更进一步,所述均一性知母多糖的分子量为2720Da,单糖组成为葡萄糖和果糖,葡萄糖和果糖的比例为1:16。
优选地,所用锌盐为氯化锌。
优选地,知母多糖与氯化锌的质量比为1:0.1~1:5。
另外优选地,知母多糖与锌盐溶液反应的过程包括:知母多糖与锌盐溶液混合后,第一次加酸溶液后使pH保持在1~6,反应温度5~90℃,反应1~20min;第一次加碱溶液后使pH保持在1~14,反应温度5~90℃,反应1~48h;第二次加酸溶液后使pH保持在1~14;反应液透析24~72h。
在第二方面,本发明提供了一种知母多糖-锌配合物,其中知母多糖为均一性知母多糖,其中所述均一性知母多糖的分子量为2720Da,单糖组成为葡萄糖和果糖,葡萄糖和果糖的比例为1:16,知母多糖与锌盐的质量比为1:0.1~1:5。
在第三方面,本发明提供了一种知母多糖-锌配合物用于调节免疫作用的用途。
在第四方面,本发明提供了一种用于调节免疫作用的组合物,包含知母多糖-锌配合物作为活性成分,以及医药学上可接受的载剂。
与现有技术相比,本发明的有益效果是:
(1)本发明方法简单易操作,反应条件温和,制备的知母多糖-锌配合物在水溶液中具有一定的溶解性;
(2)本发明通过表征手段进一步明确了知母多糖-锌配合物的理化性质,并对锌与AAII-1-1之间的潜在相互作用机制进行了研究;
(3)本发明得到的知母多糖-锌配合物可显著增强RAW264.7巨噬细胞的吞噬能力,促进TNF-α、IL-6、IL-1β和IL-18等相关基因的表达,同时能提高斑马鱼胚胎体内NO和活性氧(ROS)的含量,有效增强了斑马鱼胚胎的免疫功能。为知母多糖-锌配合物作为生物医药或功能食品领域潜在的免疫调节剂提供了现代科学依据。
附图说明
图1为AAII-1-1和AAII-1-1-Zn的HPGPC和单糖组成分析。
图2为AAII-1-1和AAII-1-1-Zn的UV和FT-IR分析。
图3为AAII-1-1和AAII-1-1-Zn的SEM图像及AAII-1-1-Zn的EDS分析。
图4为AAII-1-1和AAII-1-1-Zn的XPS分析。
图5为AAII-1-1和AAII-1-1-Zn对巨噬细胞活力和吞噬能力的影响。
图6为AAII-1-1和AAII-1-1-Zn(200μg/mL)对TNF-α、IL-6、IL-1β和IL-18相对mRNA表达的影响。
图7为AAII-1-1和AAII-1-1-Zn(200μg/mL)对NF-κB信号通路关键蛋白的影响
图8为AAII-1-1和AAII-1-1-Zn(200μg/mL)对MAPKs信号通路关键蛋白表达的影响
图9为AAII-1-1和AAII-1-1-Zn(200μg/mL)对斑马鱼胚胎NO和ROS生成的影响。
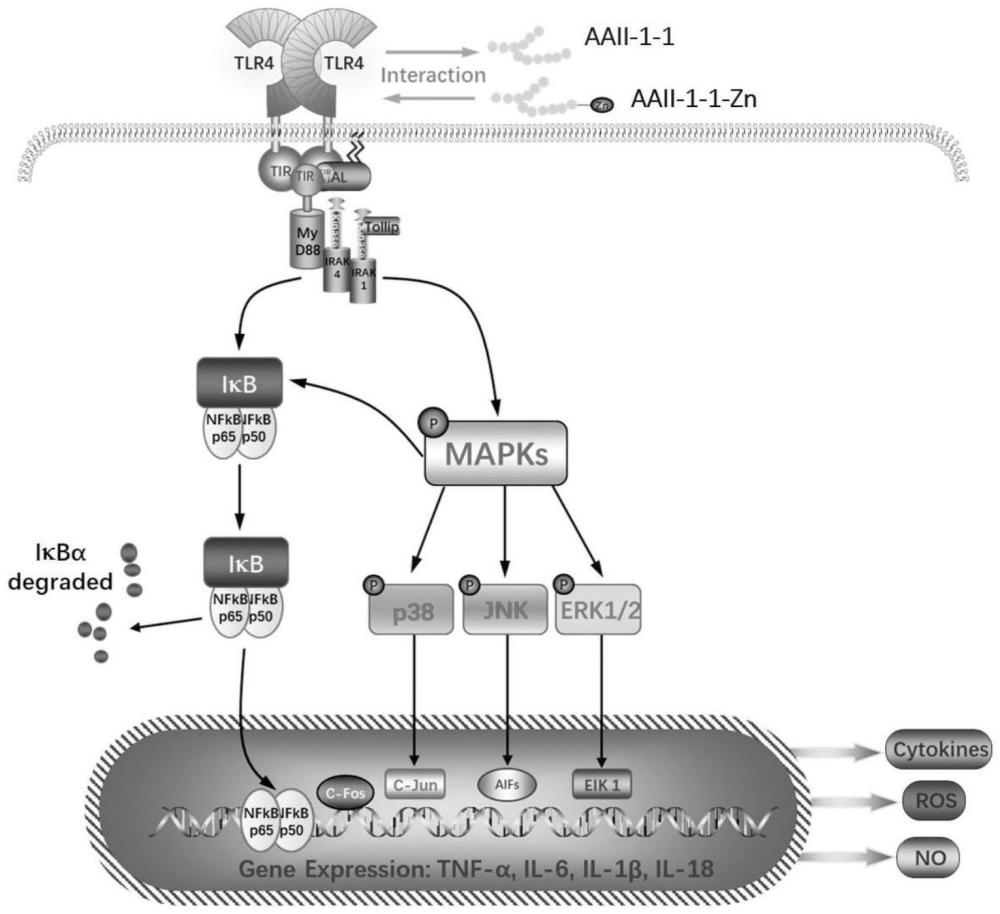
图10为图AAII-1-1和AAII-1-1-Zn激活巨噬细胞的机制。
具体实施方式
本发明涉及知母多糖-锌配合物及其制备方法和应用,本发明的方法包括从知母中提取纯化的知母均一多糖,向知母均一多糖溶液中加入锌的酸溶液,加热,反应液用碱溶液调节pH,反应结束后,溶液继续用酸溶液调节pH,反应液经透析、冻干后得到知母多糖-锌配合物。
在本发明的方法中,所用知母多糖为均一性多糖。所述均一性知母多糖的制备步骤为:
(1)知母粗多糖的制备:将知母药材清洗、干燥、粉碎得到知母药材片,往知母药材片中加入适量去离子水,80℃条件下提取3h,提取2次,合并提取液,离心,取上清减压浓缩至原体积1/10,浓缩结束后向浓缩液中加入无水乙醇至终浓度为50%,4℃条件下静置过夜,取上清液I,向上清液I中加入无水乙醇至终浓度为70%,4℃条件下静置过夜,分离上清液II,所得褐色沉淀经Sevag试剂脱蛋白、透析、冻干后得知母II粗多糖;
(2)知母均一多糖的制备:取步骤(1)中知母II粗多糖溶于去离子水后进行离子交换柱层析,用0~2M的NaCl进行梯度洗脱,使用苯酚-硫酸法跟踪洗脱曲线,根据洗脱曲线分别收集糖部分,浓缩、冷冻干燥;再分别用水进行溶解,离心,取上清液;将上清液再进行分子筛凝胶柱层析,用水进行洗脱,利用苯酚-硫酸法检测洗脱曲线,根据洗脱曲线收集糖部分,浓缩、冷冻干燥,得AAII-1-1。
在本发明的优选方案中,知母均一多糖:锌加入的质量比为1:(0.1~5)。在制备中,第一次加酸溶液后pH保持在1~6,反应温度5~90℃,反应1~20min;第一次加碱溶液后pH保持在1~14,反应温度5~90℃,反应1~48h;第二次加酸溶液后pH保持在1~14;反应液透析24~72h。
本发明进一步对制备的知母多糖-锌配合物进行了表征,表征方法包括:
1、取知母多糖-锌配合物样品,完全溶解后,经高效凝胶渗透色谱检测其均一性;
2、取知母多糖-锌配合物样品,完全酸水解,水解产物利用氨基柱进行单糖组成检测;
3、取知母多糖-锌配合物样品,完全溶解后,进行紫外光谱检测;
4、取知母多糖-锌配合物样品,干燥,压片,红外光谱检测;
5、取知母多糖-锌配合物样品,干燥,进行扫描电子显微镜(SEM)和能量色散谱(EDS)分析;
6、取知母多糖-锌配合物样品,进行X射线光电子能谱(XPS)分析。
根据本发明制备的知母多糖-锌配合物可以用于制备增强免疫力的药物或保健品。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
在本发明的描述中,需要说明的是,术语“上”、“下”、“内”、“外”“前端”、“后端”、“两端”、“一端”、“另一端”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性。
本发明人为了获得安全高效的免疫调节剂,通过大量实验研究得到本发明,以具有免疫调节作用的知母均一多糖和锌盐例如氯化锌为原料,采用修饰法合成了一种新的知母多糖-锌配合物。理化表征表明,锌被成功引入AAII-1-1的聚合物链中,且未对AAII-1-1的结构造成破坏,配合物中的锌主要通过形成Zn-O键或Zn-OH键的方式与AAII-1-1相互作用。进一步的体外细胞实验和斑马鱼体内胚胎实验证实,AAII-1-1和AAII-1-1-Zn均能通过NF-κB和MAPKs信号通路有效激活巨噬细胞,引发免疫反应。由于锌的引入,AAII-1-1-Zn对巨噬细胞活化的促进作用优于AAII-1-1,最终产物AAII-1-1-Zn可作为潜在的免疫调节剂候选物应用于在生物医药或功能食品领域。
在一个例示性实施例中,本发明的技术方案如下:
S1知母粗多糖的制备:
将知母药材清洗、干燥、粉碎得到知母药材片,往知母药材片中加入适量去离子水,80℃条件下提取3h,提取2次,合并提取液,离心,取上清减压浓缩至原体积1/10,浓缩结束后向浓缩液中加入无水乙醇至终浓度为50%,4℃条件下静置过夜,取上清液I,向上清液I中加入无水乙醇至终浓度为70%,4℃条件下静置过夜,分离上清液II,所得褐色沉淀经Sevag试剂脱蛋白、透析、冻干后得知母II粗多糖;
S2知母均一多糖的制备:
取以上步骤S1中知母II粗多糖溶于去离子水后进行离子交换柱层析,用0~2M的NaCl进行梯度洗脱,使用苯酚-硫酸法跟踪洗脱曲线,根据洗脱曲线分别收集糖部分,浓缩、冷冻干燥;再分别用水进行溶解,离心,取上清液;将上清液再进行分子筛凝胶柱层析,用水进行洗脱,利用苯酚-硫酸法检测洗脱曲线,根据洗脱曲线收集糖部分,浓缩、冷冻干燥,得AAII-1-1;
S3知母多糖-锌配合物的制备:
将制得的知母均一多糖溶于水中,然后向知母均一多糖溶液中加入锌的酸溶液,加热,反应液用碱溶液调节pH,反应结束后,继续用酸溶液调节溶液pH,反应液经透析、冻干后得到知母多糖-锌配合物。
下面通过具体实施例和附图对本发明做进一步说明,需要指出的是,以下说明仅仅是对本发明要求保护的技术方案的举例说明,但并不因此而限制本发明。本发明的保护范围以所附权利要求书记载的内容为准。
实施例1知母粗多糖的制备方法
所述知母粗多糖的制备方法包括以下步骤:
将知母药材清洗、干燥、粉碎得到知母药材片,往知母药材片中加入适量去离子水,80℃条件下提取3h,提取2次,合并提取液,离心,取上清减压浓缩至原体积1/10,浓缩结束后向浓缩液中加入无水乙醇至终浓度为50%,4℃条件下静置过夜,取上清液I,向上清液I中加入无水乙醇至终浓度为70%,4℃条件下静置过夜,分离上清液II,所得褐色沉淀经Sevag试剂脱蛋白、透析、冻干后得知母II粗多糖。
实施例2知母均一多糖的制备方法
所述知母均一多糖是由实施例1所得知母粗多糖二次纯化所得,具体方法如下:
(1)离子交换柱层析:取200mg实施例1所得知母II粗多糖,溶于5mL的去离子水中,上样于DEAE-FF柱,用0~2M的NaCl进行梯度洗脱,使用苯酚-硫酸法跟踪洗脱曲线,根据洗脱曲线分别收集糖部分,浓缩、冷冻干燥;再分别用水进行溶解,离心,取上清液;
(2)分子筛凝胶层析:将上述冻干后的多糖样品,用水进行溶解,离心,取上清液,上Sephadex G-75柱,用水进行洗脱,使用苯酚-硫酸法跟踪洗脱曲线,出现一个单一对称峰,收集主峰,浓缩,冷冻干燥,得到知母均一多糖AAII-1-1。
实施例3知母多糖-锌配合物的制备方法
将实施例2所得的知母均一多糖AAII-1-1溶于水中,然后加入ZnCl
实施例4知母多糖-锌配合物的表征方法
(一)试验材料:知母多糖AAII-1-1,知母多糖-锌配合物AAII-1-1-Zn。
(二)试验方法:
1.均一性分析
将5mgAAII-1-1或5mgAAII-1-1-Zn完全溶解在1mL蒸馏水中,并通过0.45μm滤膜过滤用于高效液相凝胶渗透色谱(HPGPC)系统进行分析。
色谱条件:
色谱柱:TSK-Gel G3000 PW
2.单糖组成分析
样品处理:
精确称取AAII-1-1或AAII-1-1-Zn样品各4.0mg试验材料于具塞试管中,加入2M三氟乙酸(TFA)2.0mL,置于油浴锅中在60℃油浴水解30min。冷却至室温,重复加甲醇旋干,去除TFA,然后用0.45μm滤膜过滤后供HPLC进样分析。
色谱条件:
色谱柱:Waters XBridgAmide column,4.6×250mm,3.5μm;检测器:示差折光检测器(Shimadzu,RID-10A);流动相:含0.2%三乙胺的乙腈-水(75:25,v/v)溶液;流速:0.6mL/min;柱温:35℃。
3.紫外光谱分析和红外光谱检测
使用UV-Vis分光光度计(Shimadzu,UV-Vis 2450,Japan)在200-400nm范围内获得AAII-1-1和AAII-1-1-Zn(1mg/mL)的紫外光谱图。
将1mgAAII-1-1或AAII-1-1-Zn与100mg溴化钾(KBr)粉末混合,并在室温下使用模具压制成片。然后使用BrukerTensor 37光谱仪(Bruker Optics,Ettlingen,Germany)以4cm
4.扫描电子显微镜和能谱仪分析
使用扫描电子显微镜(SEM)结合能谱仪(EDS)检测AAII-1-1-Zn的形态和元素分布。将AAII-1-1或AAII-1-1-Zn的干燥粉末固定在样品台上,并用金溅射镀膜。然后使用FE-SEM在15kV的加速电压下对镀金样品进行成像。同时使用EDS同时分析Zn含量和C、O和Zn的元素分布。
5.X射线光电子能谱分析
使用带有单色Al Kα源(1486.6eV)的ESCALab 250Xi(Thermo Scientific)光谱仪记录AAII-1-1或AAII-1-1-Zn的XPS光谱。压力、电压和功率分别设置为2.67×107Pa、15kV和200W。通过固定C1s结合能,使用Advantage软件(版本5.9922)收集和分析数据。
(三)试验结果:
1.结构特征分析
(1)均一性分析
如图1A所示,AAII-1-1和AAII-1-1-Zn在相应的HPGPC图谱中都显示出均一对称峰,表明Zn的引入不影响AAII-1-1的均一性。此外,AAII-1-1-Zn的保留时间与AAII-1-1的保留时间相同,表明在AAII-1-1-Zn的合成过程中,AAII-1-1的主链或支链没有降解。
(2)单糖组成分析
如图1B所示,由HPLC图谱可知,AAII-1-1-Zn与AAII-1-1的单糖组成相同,仅含有果糖和葡萄糖,且果糖和葡萄糖的含量相似,表明AAII-1-1的一级结构在合成AAII-1-1-Zn的过程中没有被破坏。
(3)紫外光谱和红外光谱分析
如图2A所示,由紫外光谱可知,AAII-1-1和AAII-1-1-Zn都不含蛋白质或核酸;与AAII-1-1相比,AAII-1-1-Zn的吸收强度显著改变,推测可能是由AAII-1-1中的助色团或发色团与Zn
如图2B所示,AAII-1-1-Zn的特征吸收带与AAII-1-1的特征吸收带相似,表明AAII-1-1-Zn的主链在锌修饰过程中没有被改变。此外,AAII-1-1在3381cm
(4)扫描电子显微镜和能谱仪分析
如图3A-B所示,由扫描电镜图像可知,锌改性前,AAII-1-1主要呈不规则球形颗粒,锌改性后呈不规则片状。
如图3C-D所示,由能谱仪分析可知,Zn均匀分布在AAII-1-1-Zn中,表明Zn已成功引入AAII-1-1-Zn中。此外,AAII-1-1-Zn中的Zn含量为0.2%。
(5)X射线光电子能谱分析
如图4所示,由XPS图像可知,Zn主要通过形成Zn–OH和Zn–O键与AAII-1-1相互作用。
实施例5知母多糖-锌配合物体外免疫调节活性评价
(一)试验材料:知母多糖AAII-1-1,知母多糖-锌配合物AAII-1-1-Zn。
(二)试验对象:RAW 264.7细胞。
(三)试验方法:
1.细胞培养和处理:
Raw 264.7细胞在添加10%胎牛血清和1%抗生素的RIPM 1640培养基中培养,抗生素为100U/mL青霉素和100μg/mL链霉素(Invitgen,NY,USA)。培养箱为M3111二氧化碳培养箱(Thermo Fisher Scientific,MA,USA),设定条件为37℃和5%CO
2.细胞活力测定
用四甲基偶氮唑盐比色法(MTT法)测定细胞存活率。将RAW 264.7细胞(5×10
3.吞噬作用测定
将RAW 264.7细胞(每孔5×10
(四)试验结果:
如图5A所示,AAII-1-1和AAII-1-1-Zn在50-200μg/mL浓度范围内对巨噬细胞均无毒性作用。
如图5B所示,AAII-1-1(200μg/mL)和AAII-1-1-Zn(100μg/mL,200μg/mL)均能显著提高巨噬细胞的吞噬功能(P<0.001),表明AAII-1-1和AAII-1-1-Zn均能通过激活巨噬细胞吞噬功能发挥免疫调节作用。此外,AAII-1-1-Zn(200μg/mL)对巨噬细胞吞噬作用的增强作用显著高于AAII-1-1(200μg/mL),表明锌已成功引入AAII-1-1的聚合物链中,并且锌的引入可有效增强AAII-1-1的免疫调节活性(P<0.01)。除此之外,AAII-1-1-Zn处理组(200μg/mL)和阳性对照组(LPS,1μg/mL)之间没有观察到显著差异,表明AAII-1-1-Zn对巨噬细胞吞噬活性的促进作用与LPS处理组相当(P>0.05)。
实施例6知母多糖-锌配合物潜在分子机制分析
(一)试验材料:知母多糖AAII-1-1,知母多糖-锌配合物AAII-1-1-Zn。
(二)试验对象:RAW 264.7细胞。
(三)试验方法:
1.实时定量聚合酶链式反应(qRT-PCR)检测
将RAW 264.7细胞接种到6孔板中,加入AAII-1-1和AAII-1-1-Zn(200μg/mL)处理24h,以脂多糖(LPS,1μg/mL)为阳性对照。收集所有细胞,使用RNA提取试剂盒(Vazyme,Nanjing,China)提取总RNA,用HiScrip III RT SuperMix for qPCR(+gDNAwiper)试剂盒(Vazyme,Nanjing,China)逆转录成cDNA。
用Taq Pro Universal SYBRqPCR试剂盒(Vazyme,Nanjing,China)进行RT-PCR测定。使用AppliedBiosystems 7500快速实时PCR系统(Thermo Fisher Scientific,MA,USA)检测TNF-α、IL-6、IL-1β和IL-18的mRNA表达水平。GAPDH用作标准化对照,该测定中使用的所有引物均列于表1中。
表1用于qRT-PCR反应的引物序列
2.蛋白质印迹(WB)测定
用浓度为200μg/mL的AAII-1-1和AAII-1-1-Zn处理细胞24h。然后收集细胞并在冰上用放射免疫沉淀分析缓冲液(RIPA)进行裂解。根据制造商的方案(Thermo FisherScientific,MA,USA),使用BCA试剂盒计算蛋白质浓度。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离各处理组的等量蛋白质(15μg)。随后,将凝胶转移到聚偏二氟乙烯(PVDF)膜上,用5%(w/v)脱脂奶粉在含有0.1%Tween-20(TBST)缓冲液的Tris缓冲盐水中封闭2h,然后在4℃下与适当的一抗孵育过夜。之后用ECL发光液处理膜,然后使用AZURE c600凝胶成像系统(Azurebiosystem,CA,USA)进行检测。使用ImageJ软件分析并定量p-p38、p38、p-JNK、JNK、p-ERK1/2、ERK1/2、GAPDH、TLR4、Myd88、p-NF-κB、NF-κB和IL-6的表达。
(四)实验结果:
1.qRT-PCR分析
如图6A-D所示,AAII-1-1和AAII-1-1-Zn作用于巨噬细胞24h后,巨噬细胞TNF-α、IL-6、IL-1β和IL-18mRNA的相对表达水平均显著升高(P<0.001),表明AAII-1-1和AAII-1-1-Zn均可以通过促进TNF-α、IL-6、IL-1β和IL-18的基因表达而发挥免疫调节作用。
此外,AAII-1-1-Zn处理组的巨噬细胞中TNF-α、IL-6、IL-1β和IL-18的基因表达水平分别比AAII-1-1处理组高45.5%、28.0%、24.9%和19.3%(P<0.001,P<0.005),进一步证实了锌的引入有效地增强了机体的免疫能力。
2.蛋白质印迹(WB)分析
如图7A-B所示,经AAII-1-1和AAII-1-1-Zn(200μg/mL)处理24小时后,TLR4蛋白的相对表达水平显著上调(P<0.01,P<0.001),表明AAII-1-1或AAII-1-1-Zn主要与TLR4蛋白相互作用以激活与免疫调节相关的下游途径。
如图7C-E所示,经AAII-1-1和AAII-1-1-Zn处理后,参与NF-κB信号通路的关键蛋白Myd88、NF-κB p65和IL-6的表达显著上调(P<0.01,P<0.001;P<0.05,P<0.001;P<0.05,P<0.001),表明AAII-1-1和AAII-1-1-Zn均主要通过激活NF-κB信号通路来激活巨噬细胞。此外,与AAII-1-1处理组相比,AAII-1-1处理组与AAII-1-1-Zn处理组之间存在明显差异(P<0.05,P<0.01,P<0.05),表明锌的引入可以有效增强AAII-1-1激活NF-κB信号通路的能力。
如图8所示,AAII-1-1和AAII-1-1-Zn处理后巨噬细胞中p-p38、p-JNK和p-ERK1/2的表达水平显着上调(P<0.05,P<0.01,P<0.001),表明AAII-1-1和AAII-1-1-Zn可通过MAPKs信号通路有效激活巨噬细胞,增强免疫功能。值得一提的是,AAII-1-1-Zn对p38、JNK和ERK1/2表达的上调作用明显优于AAP70(P<0.001,P<0.05,P<0.05),推测是由于在AAII-1-1中引入了锌。
实施例7体内免疫调节活性确认
(一)试验材料:知母多糖AAII-1-1,知母多糖-锌配合物AAII-1-1-Zn。
(二)试验对象:斑马鱼。
(三)试验方法:
成年AB斑马鱼每天两次给鱼喂食丰年虾饲料,并在14h光照/10h黑暗周期环境中饲养。繁殖后,收集、冲洗合适的胚胎,并将其保存在胚胎缓冲液中。
利用斑马鱼胚胎中NO和ROS的释放量来评估AAII-1-1和AAII-1-1-Zn的体内免疫调节活性。将受精后7-8小时后的斑马鱼胚胎置于12孔板中,分别用200μg/mL的AAII-1-1和AAII-1-1-Zn处理24h。24h后,将斑马鱼胚胎从12孔培养皿转移到24孔培养皿中,并用DCF-DA(20μg/mL)或DAF-FM DA(5μM)溶液在黑暗中孵育2h。孵育结束后,用新鲜的胚胎培养基洗涤斑马鱼胚胎以去除多余的荧光染料,随后用0.02%的三卡因麻醉。使用激光共聚焦显微镜(Leica TCS SP8,Leica,Germany)对NO和ROS的表达进行成像,并使用ImageJ软件(NIH,Bethesda,Maryland,USA)进行斑马鱼幼鱼体内相对荧光强度进行定量分析。
(四)实验结果:
如图9所示,经AAII-1-1和AAII-1-1-Zn处理后,斑马鱼胚胎中ROS和NO的产生量显著增加(分别为P<0.05和P<0.01),表明AAII-1-1和AAII-1-1-Zn均能通过刺激NO和ROS分泌,有效增强机体的免疫调节功能。此外,在AAII-1-1和AAII-1-1-Zn处理组之间均观察到显著差异(P<0.01),表明Zn的引入增强了AAII-1-1的免疫调节活性。
通过进一步整合上述结果,AAII-1-1和AAII-1-1-Zn激活巨噬细胞增强机体免疫调节能力的潜在机制如图10所示。
综上所述,本发明以之前所获得的免疫知母多糖AAII-1-1为原料,制备多糖锌复合物AAII-1-1-Zn。在锌改性后,经过表征,我们证实锌成功地引入AAII-1-1的聚合物链中,而没有破坏结构。FT-IR和XPS结果表明,Zn主要通过形成Zn-O或Zn-OH键与AAII-1-1相互作用。进一步的体外细胞实验和体内斑马鱼实验表明,AAII-1-1和AAII-1-1-Zn都能有效激活巨噬细胞,通过NF-κB和MAPKs信号通路启动免疫反应。由于锌的引入,AAII-1-1-Zn对巨噬细胞活化的促进作用优于AAII-1-1。总的来说,这项目前的研究为如何提高植物多糖的免疫激活作用和提供新的生物活性提供了有用的信息。
本发明未详述之处,均为本领域技术人员的公知技术。
最后所要说明的是:以上具体实施方式仅用以说明本发明的技术方案而非限制,尽管参照实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改和等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
