CPG两亲分子及其用途
文献发布时间:2023-06-19 09:29:07
序列表
本申请包含序列表,该序列表已经以ASCII格式电子提交,并且通过引用整体并入本文。所述ASCII副本在______________创建,名为__________________________,大小为_______个字节。
背景技术
与人乳头瘤病毒(HPV)相关的癌症是世界上发展最快的癌症之一。总体而言,全世界所有癌症中有5%可归因于HPV感染。仍然需要进一步和更有效的癌症治疗。
发明内容
本发明提供了可用于治疗方法的化合物。
因此,在第一方面,本发明的特征在于一种化合物,该化合物由核苷酸序列5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’(SEQ ID NO:1)组成,在其5’端通过接头键合或连接至以下脂质:
或其盐,
其中X是O或S。
在本发明的第一方面的一个实施方案中,核苷酸序列与脂质键合。
在本发明第一方面的另一个实施方案中,连结5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’(SEQ ID NO:1)中核苷的所有核苷间基团均为硫代磷酸酯。
在第二方面,本发明的特征在于一种治疗人类患者的癌症的方法。该方法包括向患者施用本发明的第一方面的化合物,包括以下氨基酸序列蛋白质:
MHQKRTAMFQ DPQERPRKLP QLCTELQTTI HDIILECVYC KQQLLRREVY DFAFRDLCIVYRDGNPYAVG DKCLKFYSKI SEYRHYCYSL YGTTLEQQYN KPLCDLLIRC INGQKPLCPE EKQRHLDKKQRFHNGRGRWT GRCMSCCRSS RTRRETQL(SEQ ID NO:2),以及包括以下氨基酸序列的蛋白质:
MHGDTPTLHE YMLDLQPETT DLYGYGQLND SSEEEDEIDG PAGQAEPDRA HYNIVTFCCKCDSTLRLCVQ STHVDIRTLE DLLMGTLGIV CPICSQKP(SEQ ID NO:3)。
在本发明第二方面的一个实施方案中,癌症是人乳头瘤病毒(HPV)阳性(例如,HPV16型阳性)。
在本发明第二方面的另一个实施方案中,所述癌症是头或颈部鳞状细胞癌。
在本发明第二方面的另一个实施方案中,患者正在接受或已经接受了含铂的化疗。在另一个实施方案中,将抗PD-1抗体(例如,派姆单抗(pembrolizumab)或纳武单抗(nivolumab))施用于患者。
在本发明第二方面的另一个实施方案中,本发明第一方面的化合物和包括SEQ IDNO:2和SEQ ID NO:3的氨基酸序列的蛋白质同时施用。
在本发明第二方面的另一个实施方案中,本发明第一方面的化合物和包括SEQ IDNO:2和SEQ ID NO:3的氨基酸序列的蛋白质顺序施用。
在另一方面,本发明特征在于治疗人类患者中的癌症的另一种方法。该方法包括向患者施用本发明的第一方面的化合物,包括以下氨基酸序列蛋白质:
MHQKRTAMFQ DPQERPRKLP QLCTELQTTI HDIILECVYC KQQLLRREVY DFAFRDLCIVYRDGNPYAVG DKCLKFYSKI SEYRHYCYSL YGTTLEQQYN KPLCDLLIRC INGQKPLCPE EKQRHLDKKQRFHNGRGRWT GRCMSCCRSS RTRRETQL(SEQ ID NO:2),包括以下氨基酸序列蛋白质:
MHGDTPTLHE YMLDLQPETT DLYGYGQLND SSEEEDEIDG PAGQAEPDRA HYNIVTFCCKCDSTLRLCVQ STHVDIRTLE DLLMGTLGIV CPICSQKP(SEQ ID NO:3),以及
抗PD-1抗体(例如派姆单抗或纳武单抗)。
在第三方面,本发明的特征在于药物组合物,其包括本发明第一方面的化合物和药学上可接受的载体。
在第三方面的一个实施方案中,药物组合物还包括含有以下氨基酸序列的蛋白质:MHQKRTAMFQ DPQERPRKLP QLCTELQTTI HDIILECVYC KQQLLRREVY DFAFRDLCIVYRDGNPYAVG DKCLKFYSKI SEYRHYCYSL YGTTLEQQYN KPLCDLLIRC INGQKPLCPE EKQRHLDKKQRFHNGRGRWT GRCMSCCRSS RTRRETQL(SEQ ID NO:2),以及含有以下氨基酸序列的蛋白质:MHGDTPTLHE YMLDLQPETT DLYGYGQLND SSEEEDEIDG PAGQAEPDRA HYNIVTFCCK CDSTLRLCVQSTHVDIRTLE DLLMGTLGIV CPICSQKP(SEQ ID NO:3)。
在第四方面,本发明的特征在于一种试剂盒,该试剂盒包括(i)本发明第一方面的化合物或本发明第二方面的组合物,和(ii)包括以下氨基酸序列的蛋白质:MHQKRTAMFQDPQERPRKLP QLCTELQTTI HDIILECVYC KQQLLRREVY DFAFRDLCIV YRDGNPYAVG DKCLKFYSKISEYRHYCYSL YGTTLEQQYN KPLCDLLIRC INGQKPLCPE EKQRHLDKKQ RFHNGRGRWT GRCMSCCRSSRTRRETQL(SEQ ID NO:2),
以及包括以下氨基酸序列的蛋白质:MHGDTPTLHE YMLDLQPETT DLYGYGQLNDSSEEEDEIDG PAGQAEPDRA HYNIVTFCCK CDSTLRLCVQ STHVDIRTLE DLLMGTLGIV CPICSQKP(SEQ ID NO:3)。
定义
如本文所用,“接头”是指一价或二价基团,其中一个化合价共价键合到一个生物功能基团,而另一个化合价共价键合到另一生物功能基团。在一个实例中,接头将例如CpG寡核苷酸的核苷酸序列连结至脂质(例如,-P(X)(OH)-O-CH(CH
如本文所用,“药学上可接受的载体”是指能够悬浮或溶解活性化合物并且在患者中具有无毒和非炎性的性质的媒介物。此外,药学上可接受的载体可以包括药学上可接受的添加剂,例如在药物制剂领域中已知或使用的防腐剂、抗氧化剂、香料、乳化剂、染料或赋形剂,并且不会显著干扰活性剂的生物活性的治疗效果,并且对患者无毒。
术语“治疗”(“treat”)、“治疗”(“treatment”)和“正在治疗”(“treating”)是指旨在逆转、减轻、改善、抑制、减慢或停止与疾病或病症(例如癌症)相关的状况的进展或严重程度的治疗方法。这些术语包括减少或减轻状况、疾病或病症的至少一种不良影响或症状。如果减少一种或多种症状或临床标志,或如果诱导希望的应答(例如特异性免疫应答),则治疗通常是“有效的”。或者,如果疾病的进展减少或停止,则治疗是“有效的”。
本发明具有几个优点。例如,在包括脂质部分和任选的接头的情况下,本发明的某些化合物在其所施用的受试者中与内源性白蛋白结合,这增强了化合物向受试者的淋巴结的递送。这促进了针对例如向受试者施用HPV蛋白的治疗性免疫应答的诱导,导致有效的癌症治疗。
通过下面的详细描述、附图和权利要求,本发明的其他特征和优点将变得显而易见。
附图说明
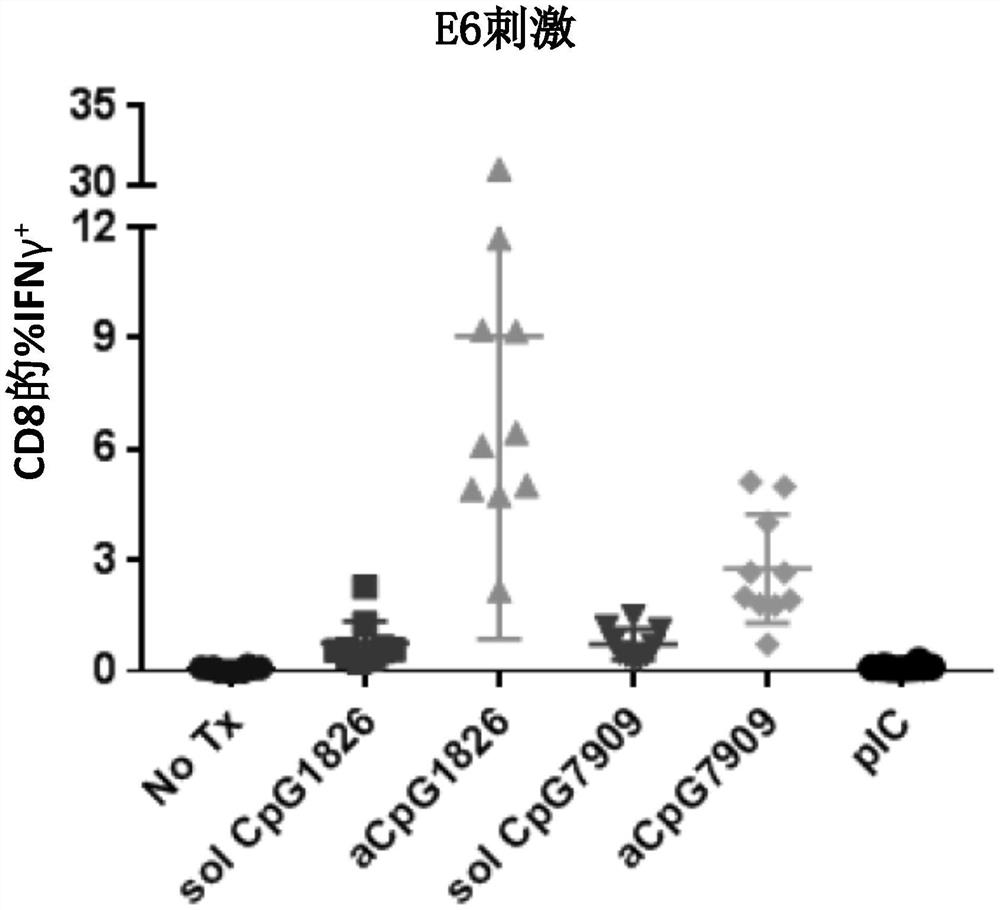
图1是显示针对HPV16 E6的免疫应答的图。
图2是显示针对HPV16 E7的免疫应答的图。
图3是显示HPV16 E7的四聚体染色分析的图。
图4是一系列图,其显示与两亲分子-CpG(aCpG)单独或不处理(无Tx)相比,将HPV16 E6和HPV16 E7与aCpG一起施用可减小肿瘤大小。
图5是显示在不同时间点,与可溶性CpG疫苗相比,aCpG疫苗具有更好的HPV四聚体应答的图。
图6是显示每周或每两周一次施用aCpG而持续的HPV四聚体应答随时间变化的图。
图7是显示对E7疫苗治疗的肿瘤大小应答的图。
图8是显示在植入了TC-1肿瘤细胞的经E7疫苗治疗的C57BL6小鼠中改善的存活率的图。
图9是一系列图,其显示了给药后血清细胞因子水平的变化。
图10是显示HPV16 E7/aCpG疫苗随时间的四聚体应答的图。
图11是显示对HPV16 E7/aCpG疫苗接种加上或减去施用抗PD-1抗体的肿瘤生长应答的图。
图12是显示HPV16 E7/aCpG疫苗接种加上或减去施用抗PD-1抗体对携带TC-1肿瘤的小鼠中存活的影响的图。
图13是显示针对aCpG剂量递增的四聚体分析的图。
图14显示了两亲分子-CpG-7909的结构;5’-(二酰基脂质(Diacyl lipid))TCGTCG TTT TGT CGT TTT GTC GTT-3’(SEQ ID NO:1)。所有碱基都是DNA。所有键都是亚磷酰胺,包括二酰基脂质和寡脱氧核苷酸之间的键。
发明详述
本发明提供了可用于治疗方法的化合物。所述化合物包括CpG寡脱氧核苷酸(ODN)(例如,具有序列5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’(SEQ ID NO:1)的CpG ODN)。CpG ODN在其5’端与脂质连接,例如:
或其盐,
其中X是O或S。优选地,X是S。CpG寡核苷酸可以直接键合到脂质上。或者,CpG可以通过接头例如GG与脂质连接。在CpG寡核苷酸中,所有核苷间基团均为硫代磷酸酯(例如,化合物中的所有核苷间基团均可为硫代磷酸酯)。
CpG ODN可充当佐剂以在受试者中引起免疫应答,例如针对癌症抗原(例如HPV抗原)的免疫应答。这样,本发明的化合物和组合物可以用于治疗方法。特别地,如果施用含CpG ODN的化合物与一种或多种HPV蛋白的组合,则该化合物可诱导对HPV阳性癌细胞的免疫应答。因此,本发明提供了通过向受试者施用一种或多种本发明的化合物或组合物来治疗受试者(例如人类患者)的癌症的方法。在各种实例中,癌症是HPV阳性(例如,HPV 16型阳性)癌症。
HPV阳性癌症可以是头或颈部鳞状细胞癌、子宫颈癌、肛门癌、外阴癌、头颈癌、口咽癌、阴茎癌、阴道癌、病毒诱发癌、膀胱癌、胰腺癌、肺癌、肝癌、卵巢癌、结肠癌、胃癌、神经母细胞瘤、乳腺癌、前列腺癌、肾癌、白血病、肉瘤、癌(carcinoma)、基底细胞癌(basal cellcarcinoma)、非小细胞肺癌(non-small cell lung carcinoma)、非霍奇金淋巴瘤、急性髓细胞性白血病(AML)、慢性淋巴细胞性白血病(CLL)、B细胞慢性淋巴细胞性白血病(B-CLL)、多发性骨髓瘤(MM)、红细胞白血病、肾细胞癌、肉瘤、黑素瘤、星形细胞瘤、少突星形细胞瘤、胆道癌、绒毛膜癌、CNS癌症、喉癌、小细胞肺癌、非小细胞肺癌(non-small cell lungcancer)(NSCLC)、腺癌、巨细胞(或燕麦细胞)瘤(giant(or oat)cell carcinoma)、鳞状细胞癌(squamous cell carcinoma)、口腔癌、皮肤癌、基底细胞癌(basal cell cancer)、鳞状细胞癌(squamous cell cancer)、睾丸癌、甲状腺癌、子宫癌、直肠癌、呼吸系统癌或泌尿系统癌。
任选地,本发明的方法可以进一步包括施用本发明的化合物或组合物与第二种(或附加的)不同治疗方法的组合。
本发明还提供了试剂盒,每个试剂盒包括例如第一容器,所述第一容器包括一种或多种本发明化合物,任选地与第二容器一起,所述第二容器包括癌症抗原,例如本文所述的HPV蛋白。
CpG
CpG ODN是在特定序列范围内包括未甲基化的CpG二核苷酸的短合成单链DNA分子。与DNA分子中的天然磷酸二酯(PO)骨架相反,CpG ODN具有部分或完全的硫代磷酸酯(PS)骨架。基于人类外周血单核细胞(PBMC),特别是B细胞和浆细胞样树突状细胞(pDC)的结构特征和活性,已鉴定出三类主要的刺激性CpG ODN。这三个类是A类(D型)、B类(K型)和C类。
CpG1826和CpG7909均属于B类CpG。B类CpG ODN包括带有一个或多个CpG二核苷酸的完整PS骨架。它们强烈激活B细胞和TLR9依赖性NF-κB信号传导,但弱刺激IFN-α分泌。
突变HPV
可将C70G、C113G和I135G的点突变(在下面加下划线)引入野生型HPV16 E6病毒蛋白中,以防止与人p53的立体化学相互作用。该组分作为抗原的性能由蛋白质的序列决定,蛋白质的结构与预期功能无关。
mHPV 16E6(158aa;SEQ ID NO:2)
MHQKRTAMFQ DPQERPRKLP QLCTELQTTI HDIILECVYC KQQLLRREVY DFAFRDLCIVYRDGNPYAV
可将C24G和E26G的点突变(在下面加下划线)引入野生型HPV16 E7病毒蛋白中,以防止与人Rb1的立体化学相互作用。同样,该组分作为抗原的性能由蛋白质的序列决定,蛋白质的结构与预期功能无关。
mHPV 16E7(98aa;SEQ ID NO:3)
MHGDTPTLHE YMLDLQPETT DLY
CpG ODN可以直接键合或通过接头连接脂质。这些化合物可以使用本领域已知的普通亚磷酰胺化学方法制备。在一些示例中,CpG ODN或CpG ODN-GG可以与以下化合物反应:
产生中间体,该中间体经例如硫化剂(例如3-((N,N-二甲基氨基亚甲基)氨基)-3H-1,2,4-二噻唑-5-硫酮)氧化(例如,本领域已知的亚磷酸氧化方法)并被氰乙基基团水解后,可能会产生本发明的化合物。
为了更充分地理解本发明,阐述了以下实施例。这些实施例仅出于说明的目的,而不应以任何方式解释为限制本发明的范围。
实施例
实施例1:HPV16 E6和HPV16 E7蛋白与CpG两亲分子佐剂的组合生成免疫应答
预防性免疫小鼠,并在HPV16 E6和HPV16 E7(E6/E7)刺激下通过E7-四聚体染色和IFNγ细胞内细胞因子染色(ICS)记录生成的免疫应答。
实验设计包括以下6组小鼠(每组n=10)
1.未免疫
2.E6/E7+可溶性CpG1826
3.E6/E7+两亲分子CpG1826(aCpG1826)
4.E6/E7+可溶性CpG7909
5.E6/E7+两亲分子CpG7909(aCpG7909;图14)
6.E6/E7+polyIC(pIC)
pIC被用作基准佐剂对照。
将蛋白质原液溶解在8M尿素中。将佐剂原液溶解在水中。最终注射液用1X磷酸盐缓冲盐水(PBS)(尿素C
对于aCpG1826,使用的序列是可溶性CpG1826序列(5’-tccatgacgttcctgacgtt-3’;SEQ ID NO:4),在5’端添加了两个鸟嘌呤(5’-gg tccatgacgttcctgacgtt-3’;SEQ IDNO:5)。可溶性CpG1826和aCpG1826使用的浓度为每100μl注射剂5nmol。CpG1826是最佳的小鼠序列,而CpG7909对人类是最佳的,并且在小鼠中的活性较弱。CpG1826和CpG7909属于同一CpG类(B类),通常在其各自的物种中具有相似的活性谱。
对于aCpG7909和可溶性CpG7909而言,使用的序列为5’-tcgtcgttttgtcgttttgtcgtt-3’(SEQ ID NO:6),浓度为每100μl注射剂5nmol。
使用在C70G、C113G和I135G处具有点突变的突变HPV16 E6(在下面加下划线)进行免疫。下面提供了使用的氨基酸序列。
mHPV 16E6(158aa;SEQ ID NO:2)
MHQKRTAMFQ DPQERPRKLP QLCTELQTTI HDIILECVYC KQQLLRREVY DFAFRDLCIVYRDGNPYAV
使用在C24G和E26G处具有点突变的突变HPV16 E7(在下面加下划线)进行免疫。下面提供了使用的氨基酸序列。
mHPV 16E7(98aa;SEQ ID NO:3)
MHGDTPTLHE YMLDLQPETT DLY
对于E6/E7,每100μl注射液分别使用10μg突变HPV16 E6和10μg突变HPV16 E7。
雌性C57BL/6J小鼠(B6)用初次剂量(E6/7+aCpG)皮下注射(s.c.)免疫,并在2周后进行一次加强剂量免疫。
加强剂量免疫后7天对H-2Db HPV16 E7(RAHYNIVTF;SEQ ID NO:7)进行四聚体分析(图3)。
加强剂量免疫后7天,对外周血进行了IFNγ的细胞内细胞因子染色(ICS),以分析对E6/E7的免疫应答。
E6刺激使用以下肽:(E6-10:EVYDFAFRDL(SEQ ID NO:8);E649-57:VYDFAFRDL(SEQID NO:9);E6 37-45:CVYCKQQLL;(SEQ ID NO:10);E6 72-80:KCLKFYSKI(SEQ ID NO:11);和E6 100-108:NKPLCDLLI(SEQ ID NO:12)以生成图1所示的数据。
E6刺激的反卷积(deconvolution)显示,E49-57是导致刺激的唯一肽。
对于E7刺激,使用以下肽:RAHYNIVTF(SEQ ID NO:13)。该肽用于生成图2所示的数据。
如图1和2所示,使用aCpG1826生成了针对突变HPV16 E6和突变HPV16 E7的强免疫应答。
同样如图1和2所示,对人类最佳且通常在小鼠中表现较差的aCpG7909的使用令人惊讶地生成了针对突变HPV16 E6和突变HPV16 E7的强免疫应答。
与单独使用aCpG或不处理相比,E6/E7+aCpG降低了肿瘤的生长,相应地提高了存活率(图4)。
实施例2:确定HPV 16E7和aCPG的给药时间表
为了确定针对E7+aCpG在植入TC-1肿瘤的雌性C57BL/6U(B6)小鼠中抗肿瘤功效的最佳给药方案,将每周给药与每2周给药和基线(仅初次免疫)进行比较。将E7+aCpG与E7+可溶性CpG进行比较。所有疫苗均施用3次(初次免疫和两次加强免疫)。
在第0天和第12天后,在雌性C57BL/6J小鼠(B6)的侧面皮下接种50,000TC-1细胞;将小鼠分成治疗组并按表1所示进行治疗。
表1
a将蛋白质原液溶解在8M尿素中。将佐剂原液溶解在水中。最终注射液用1X PBS(尿素C
b相当于8μg
NA=不适用;PBS=磷酸盐缓冲盐水;ROA=施用途径;SC=皮下
·在整个研究中,直至接种后第40天,隔两天测量一次肿瘤大小,并监测动物的存活。每次施用疫苗7天后,进行H-2Db HPV16 E7(RAHYNIVTF)的四聚体分析。
·在每次施用疫苗后1小时和4小时采集aCpG组的血清样品,并通过流式细胞小球微阵列分析细胞因子的表达(IFNγ、TNFα、IL-6、IL-10、IL-12p70、MCP-1)。
·初次接种疫苗14天后分析抗E7血清抗体滴度。ELISA板涂有全蛋白E7,在该全蛋白E7上捕获血清抗体并用抗Fc抗体检测。
在单剂量和重复剂量后,对蛋白质/两亲性CpG疫苗的HPV-四聚体特异性T细胞应答均优于对蛋白质/可溶性CpG疫苗的HPV-四聚体特异性T细胞应答(图5)。施用加强免疫接种后,对蛋白质/aCpG的HPV-四聚体应答进一步增强,分别在每周一次和每两周一次的方案中,这种增加持续到第28天和第35天(图6)。与接种可溶性CpG的动物相比,aCpG组中强烈的HPV-四聚体应答与肿瘤大小的减少相关(图7)并提高了存活(图8)。在可溶性和aCpG组之间,与治疗相关的全身细胞因子的增加是可比较的,除了IL-10(其与可溶性CpG相比,aCpG的IL-10较低)和IFNγ(其与可溶性CpG相比,aCpG的IFNγ较高)(图9)。
实施例3:在添加或不添加抗PD-1抗体的情况下,E7蛋白与可溶性或两亲性CpG的组合的抗肿瘤功效
为了评估在添加或不添加抗PD-1抗体的情况下E7蛋白与可溶性或两亲性CpG的组合的抗肿瘤功效,在雌性C57BL/6J小鼠(B6)的基线侧面接种50,000个TC-1细胞。接种后11天,将小鼠分成表2所示的5组。比较组为未处理。
表2
a将蛋白质原液溶解在8M尿素中。将佐剂原液溶解在水中。最终注射液用1X PBS(尿素C
IP=腹膜内;NA=不适用;PBS=磷酸盐缓冲盐水;ROA=施用途径;SC=皮下
在整个研究中,直到接种后第40天隔两天测量一次肿瘤大小,并监测动物存活。每次施用疫苗7天后,进行H-2Db HPV16 E7(RAHYNIVTF)的四聚体分析。
在不加或不加抗PD-1抗体的情况下,施用E7/两亲分子-CpG疫苗会导致对HPV16E7(RAHYNIVTF;SEQ ID NO:13)肽特异性的HPV四聚体+CD8细胞大量增加(图10)。这些应答早在第一次给药后就清晰可见,在第二次给药时达到峰值,并持续到第三次给药(与E7/CpG观察到的较低应答相反,尽管同时施用抗PD-1可使应答增强,但这种应答并未持续)。
对应于这些强烈的HPV四聚体+CD8应答,在第24天左右肿瘤生长停止,并在以E7/两亲分子-CpG第一次给药(有或没有抗PD-1)后逆转,并且肿瘤大小一直很小并且稳定到结束研究,与其他组相反,该其他组的生长持续(图11)。
同样,对应于肿瘤大小的影响,用E7/aCpG疫苗(有或没有抗PD-1抗体)治疗对存活有显著影响,结果为对于E7/aCpG不加抗体,6/7(85%)治愈,以及对于E7/aCpG加抗PD-1抗体,8/10(80%)治愈(图12)。
实施例4:aCpG剂量递增研究
为了确定在6次剂量过程中产生最高抗原特异性四聚体+CD8应答的aCpG剂量,使用固定剂量的10μg卵清蛋白(OVA)作为抗原进行了剂量递增研究。可溶性CpG用作比较剂。还评估了耐受性(基于体重和一般观察结果)。表3概述了研究设计。
表3
ROA=施用途径;SC=皮下
每2周间隔施用最多6次剂量的疫苗,总研究时间为11周。
每次注射后7天收集外周血样品,并使用H-2Kb OVA(SIINFEKL;SEQ ID NO:14)对CD8+细胞上的四聚体进行流式细胞仪分析。
仅在用aCpG+OVA处理的组中观察到四聚体+CD8+细胞的显着增加,其中6nmol产生最大的药理作用(图13)。没有观察到体重减轻、兴趣/食欲丧失或伤口/损伤。
其他实施方式
尽管已经结合本发明的特定实施例描述了本发明,但是应当理解,本发明能够进行进一步的修改,并且本申请旨在覆盖通常遵循本发明的原理的本发明的任何变型、用途或修改。本发明以及包括与本公开的这种偏离落入本发明所属领域内的已知或惯常实践中,并且可以应用于上文阐述的基本特征。
所有出版物、专利和专利申请都通过引用以其整体并入本文,其程度与每个单独的出版物、专利或专利申请均被明确地并单独地以引用的方式全文并入本文的程度相同。
本发明的一些实施例在以下编号的段落内。
1.一种化合物,其由核苷酸序列5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’(SEQ ID NO:1)组成,在其5’端通过接头键合或连接至以下脂质:
或其盐,
其中X是O或S。
2.根据段落1所述的化合物,其中所述核苷酸序列与脂质键合。
3.根据段落1或2所述的化合物,其中连结5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’(SEQID NO:1)中的核苷的所有核苷间基团均为硫代磷酸酯。
4.一种在人类患者中治疗癌症的方法,其包含对所述患者施用段落1至3中任一项所述的化合物、包含以下氨基酸序列的蛋白质:
MHQKRTAMFQ DPQERPRKLP QLCTELQTTI HDIILECVYC KQQLLRREVY DFAFRDLCIVYRDGNPYAVG DKCLKFYSKI SEYRHYCYSL YGTTLEQQYN KPLCDLLIRC INGQKPLCPE EKQRHLDKKQRFHNGRGRWT GRCMSCCRSS RTRRETQL(SEQ ID NO:2),
以及包含以下氨基酸序列的蛋白质:
MHGDTPTLHE YMLDLQPETT DLYGYGQLND SSEEEDEIDG PAGQAEPDRA HYNIVTFCCKCDSTLRLCVQ STHVDIRTLE DLLMGTLGIV CPICSQKP(SEQ ID NO:3)。
5.根据段落4所述的方法,其中所述癌症是人乳头瘤病毒(HPV)阳性。
6.根据段落5所述的方法,其中所述癌症是HPV 16型阳性。
7.根据段落4至6中任一项所述的方法,其中所述癌症是头或颈部鳞状细胞癌。
8.根据段落4至7中任一项所述的方法,其中所述患者正在接受或已经接受了含铂化疗。
9.根据段落4所述的方法,其中段落1所述化合物和包含SEQ ID NO:2和SEQ IDNO:3的氨基酸序列的蛋白质同时施用。
10.根据段落4所述的方法,其中段落1所述化合物和包含SEQ ID NO:2和SEQ IDNO:3的氨基酸序列的蛋白质顺序施用。
11.一种药物组合物,其包含段落1至3中任一项所述的化合物和药学上可接受的载体。
12.根据段落11所述的药物组合物,其中所述组合物还包含含有以下氨基酸序列的蛋白质:
MHQKRTAMFQ DPQERPRKLP QLCTELQTTI HDIILECVYC KQQLLRREVY DFAFRDLCIVYRDGNPYAVG DKCLKFYSKI SEYRHYCYSL YGTTLEQQYN KPLCDLLIRC INGQKPLCPE EKQRHLDKKQRFHNGRGRWT GRCMSCCRSS RTRRETQL(SEQ ID NO:2),
以及含有以下氨基酸序列的蛋白质:
MHGDTPTLHE YMLDLQPETT DLYGYGQLND SSEEEDEIDG PAGQAEPDRA HYNIVTFCCKCDSTLRLCVQ STHVDIRTLE DLLMGTLGIV CPICSQKP(SEQ ID NO:3)。
13.一种试剂盒,其包含(i)段落1至3中任一项所述的化合物或段落11所述的组合物,和(ii)包含以下氨基酸序列的蛋白质:MHQKRTAMFQ DPQERPRKLP QLCTELQTTIHDIILECVYC KQQLLRREVY DFAFRDLCIV YRDGNPYAVG DKCLKFYSKI SEYRHYCYSL YGTTLEQQYNKPLCDLLIRC INGQKPLCPE EKQRHLDKKQ RFHNGRGRWT GRCMSCCRSS RTRRETQL(SEQ ID NO:2),
以及包含以下氨基酸序列的蛋白质:
MHGDTPTLHE YMLDLQPETT DLYGYGQLND SSEEEDEIDG PAGQAEPDRA HYNIVTFCCKCDSTLRLCVQ STHVDIRTLE DLLMGTLGIV CPICSQKP(SEQ ID NO:3)。
其他实施例在以下权利要求书之内。
- CPG两亲分子及其用途
- 制备基于功能两亲分子或者大分子的纳米颗粒的方法和其用途
