一种竹节诱导愈伤组织再生植株的方法
文献发布时间:2023-06-19 09:30:39
技术领域
本发明属于植物组织培养技术领域,具体涉及一种竹节诱导愈伤组织再生植株的方法。
背景技术
竹子有着特殊的开花习性,开花周期长,难以预测,且开花后竹子通常会死亡,且结实率低(林树燕等,2008),难以通过有性繁殖途径进行繁殖和选育新品种;无性繁殖又因长距离运输困难、移栽存活率低、有限的生根能力及季节依赖等因素导致造林成本高。组织培养具有繁殖速度快、增殖系数高、花费少等优点,且不受季节限制,广泛应用于植物的离体快繁(沈春修,2018;谭宏超等,2017)。植物遗传育种改良可通过遗传转化技术,但建立一个稳定高效的再生体系是遗传转化技术成功的前提。目前关于遗传转化的报道仅限麻竹(Dendrocalamus latiflorus)(YES et al.,2017)、马来甜龙竹(Dendrocalamus asper)(诸葛菲,2018)和梁山慈竹(Dendrocalamus farinosus)(李晓瑞等,2012),主要原因是建立竹类再生体系困难。1968年,Alexander等首次利用离体培养技术,以竹子的成熟种胚为外植体成功获得了完整植株。而后竹子的组织培养技术逐渐得到发展,目前已有近80多个竹种获得再生植株(臧巧路等,2016)。Metha等(1982)首次报道了利用印度箣竹(Bambusaarundinacea)的体细胞胚胎建立其再生体系,而后研究出多种外植体来建立其再生体系,包括以种子为外植体的牡竹(Dendrocalamus strictus)(RAO et al.,1985)、墨西哥雨竹(Otatea acuminatea aztecorum)(Woods et al.1992)、麻竹(Sinocalamus latiflora)(Yeh et al.1987)、版纳甜龙竹(Dendrocalamus hamiltoniiNees et Arn.exMunro)(张宁,2010)、孝顺竹(Bambusa multiplex)(Yuan2009)、和马来甜龙竹(Dendrocalamusasper)(诸葛菲2018);以花药为外植体的麻竹(D.latiflorus)(Tsay et al.1990);以幼嫩花序为外植体的绿竹(Bambusaoldhami)(Yeh et al.1986)、孝顺竹(B.multiplex)(袁金玲等,2009)、吊丝球竹(Bambusa beecheyana)(Yeh et al.1986)的;以芽为外植体的版纳甜龙竹(Dendrocalamus hamiltonii Neeset Arn.ex Munro)(张宁等,2016)、绿竹(Bambusaoldhami)、翠竹(Sasa pygmaea)、凤凰竹(Bambusa multiplex)、和罗汉竹(phyllostachysaurea)(Huang et al.1988)。但因为竹子特有的开花特性,种子和花药获取困难,不能随时进行取材。而竹节居间分生组织材料充足,可随时取材,外植体选择有较大优势。
关于竹子愈伤组织再生体系的报道仍旧很少,目前只集中在少数丛生竹和唯一的散生型竹种毛竹上,而混生型竹种的愈伤组织再生体系目前还尚未见报道,主要困难集中在可选择能再生的外植体较少、有效愈伤组织诱导率低、愈伤组织分化困难,这些使竹种再生频率非常低,与其他禾本科植物或模式植物无法比拟,大大限制基因功能验证的研究进程。
发明内容
有鉴于此,本发明的目的在于提供一种竹节诱导愈伤组织再生植株的方法,以竹节为外植体,配合独特培养基配方诱导愈伤组织,取得了诱导率高且分化率高的再生植株。
本发明提供了一种竹节诱导愈伤组织再生植株的方法,包括以下步骤:
1)将消毒的试管苗切取带芽竹节为外植体,接种至愈伤组织诱导培养基上诱导培养,得到愈伤组织;
所述愈伤组织诱导培养基为含1~3mg·L
所述带芽竹节的长度为0.1~8cm;
2)将所述愈伤组织接种至增殖培养基上增殖培养,得到颗粒致密的愈伤组织;所述增殖培养基为含有0.5~1mg·L
3)将所述颗粒致密的愈伤组织接种至分化培养基上进行分化培养,得到再生苗;
所述分化培养基为含0.5~2mg·L
优选的,所述带芽竹节的长度为1~8cm。
优选的,所述带芽竹节包括长度为5~8cm的基部带芽竹节。
优选的,所述愈伤组织生成14~21d后进行增殖培养。
优选的,所述增殖培养后,还包括进行继代培养;所述继代培养的次数为1~2次。
优选的,所述试管苗包括混生型竹种。
优选的,所述混生型竹种包括花叶矢竹(Pseudosasa japonica f.akebonosuji)。
优选的,所述诱导培养或增殖培养的温度为23~27℃;所述诱导培养或增殖培养的光照条件为黑暗培养;所述诱导培养或增殖培养的环境为干燥无菌的环境中进行。
优选的,所述分化培养的光暗周期为16h/8h;光照强度为2000~2500Lux;
所述分化培养的温度为23~27℃;
所述分化培养在无菌培养室内进行。
本发明提供了一种竹节诱导愈伤组织再生植株的方法,包括以下步骤:
1)将消毒的试管苗切取带芽竹节为外植体,接种至愈伤组织诱导培养基上诱导培养,得到愈伤组织;所述愈伤组织诱导培养基为含1~3mg·L
进一步的,本发明具体限定了外植体带芽竹节的位置。本发明实验表明,不同竹节的位置对愈伤组织的诱导率有显著影响。与顶端带芽竹节和中间带芽竹节相比,基部带芽竹节的诱导愈伤率及致密愈伤率均达到最高,且呈显著性差异。
进一步的,本发明具体限定了外植体带芽竹节的具体长度。本发明实验表明,不同竹节的长度对愈伤组织的诱导率有显著影响。与长度1~3cm带芽竹节和长度小于1cm的带芽竹节相比,长度大于5cm的带芽竹节的诱导愈伤率及致密愈伤率均达到最高,且呈显著性差异。
进一步的,本发明具体限定了增殖培养时愈伤组织的培养时间。实验表明,愈伤组织的生成时间在14d~21d时,愈伤组织生长情况良好,有利于致密颗粒状愈伤组织生成,而生成时间太长(28d)或太短(7d),其增殖倍数均较低,且愈伤组织的形态不佳,影响可见,不同的生成时间影响愈伤组织的生长状况。
进一步的,本发明具体限定了继代培养的次数。实验表明,愈伤组织继代次数对其增殖也有影响。愈伤组织继代0次时,增殖倍数为1.31,显著低于其他处理,且此时的愈伤组织多为乳白色,不适宜进行分化。继代次数为2次时,增殖倍数最高,达4.42,显著高于其他处理,且此时的愈伤组织多为致密颗粒状的淡黄色愈伤,分化能力强,最适宜用于愈伤组织分化试验。
附图说明
图1为2,4-D对愈伤组织诱导的影响;
图2为6-BA对愈伤组织诱导的影响;
图3为NAA对愈伤组织诱导的影响;
图4为褐化愈伤组织形态;
图5为生根愈伤组织形态;
图6为不同长度茎秆及其位置的竹节对愈伤组织诱导的影响;
图7为经分化培养后愈伤组织逐渐出现绿点的形态图;
图8为经分化培养后,逐渐长成分化苗的形态图;
图9为分化苗成簇状长大的形态图。
具体实施方式
本发明提供了一种竹节诱导愈伤组织再生植株的方法,包括以下步骤:
1)将消毒的试管苗切取带芽竹节为外植体,接种至愈伤组织诱导培养基上诱导培养,得到愈伤组织;
所述愈伤组织诱导培养基为含1~3mg·L
所述带芽竹节的长度为0.1~8cm;
2)将所述愈伤组织接种至增殖培养基上增殖培养,得到颗粒致密的愈伤组织;所述增殖培养基为含有0.5~1mg·L
3)将所述颗粒致密的愈伤组织接种至分化培养基上进行分化培养,得到再生苗;
所述分化培养基为含0.5~2mg·L
本发明将消毒的试管苗切取带芽竹节为外植体,接种至愈伤组织诱导培养基上诱导培养,得到愈伤组织。
本发明对所有竹种,尤其是混生型竹种均适用,为了具体说明组织培养方法及其取得的效果,本发明实施例以花叶矢竹(Pseudosasajaponica f.akebonosuji)为例加以说明,但不能理解为对本发明保护范围的限制。
本发明所述消毒的方法没有特殊限制,采用本领域所熟知的外植体消毒方法即可。所述带芽竹节的长度为0.1~8cm,优选为0.1~1cm、1~3cm或5~8cm,最优选为0.1~1cm。所述带芽竹节根据位置分可以划分为顶端带芽竹节、中部带芽竹节和基部带芽竹节。所述顶端带芽竹节为从试管苗的顶端测量一定长度截取的竹节。所述基部带芽竹节是从与根连接的茎部向上延伸截取的一定长度的竹节。所述带芽竹节更优选为长度为5~8cm的基部带芽竹节,其作为外植体培养,诱导愈伤率及致密愈伤率均达到最高,为93.33%和36.67%。
在本发明中,所述愈伤组织诱导培养基优选为含1mg·L
在本发明中,所述诱导培养或增殖培养的温度优选为23~27℃,更优选为25℃。所述诱导培养或增殖培养的光照条件优选为黑暗培养;所述诱导培养或增殖培养的环境为干燥无菌的环境中进行。
得到愈伤组织后,本发明将所述愈伤组织接种至增殖培养基上增殖培养,得到颗粒致密的愈伤组织;所述增殖培养基为含有0.5~1mg·L
在本发明中,所述愈伤组织生成优选14~21d后进行增殖培养,更优选为生成21d时殖倍数最高,为2.48,是7d处理的1.95倍。
在本发明中,所述增殖培养后,优选还包括进行继代培养;所述继代培养的次数为1~2次。
在本发明中,所述分化培养的光暗周期优选为16h/8h;光照强度优选为2000~2500Lux,更优选为2000Lux;所述分化培养的温度优选为23~27℃,更优选为25℃。所述分化培养在无菌培养室内进行。
在本发明中,所述分化培养基为含0.5~2mg·L
本发明提供的方法是针对特定竹种类型、外植体类型结合独特培养基配方诱导愈伤组织和分化丛生芽,得到一种诱导率高且分化率高、配方简单成本低的再生植株的方法。首先以典型的地下茎混生型竹种花叶矢竹为代表,目前竹子愈伤组织再生的研究多数集中在丛生竹和散生竹毛竹的研究与探索中,混生竹本身再生能力弱,关于混生竹愈伤组织再生研究较为稀少;其次,本发明中诱导愈伤组织的外植体,选用试管苗的竹节居间分生组织,基部愈伤组织(H3)诱导率达到93.33%,这在竹子上乃至木本植物是非常难以达到的效率,主要是因为研究中发现了具有较高活力的居间分生组织部位,通过适当的培养基诱导下获得较高诱导率;最后,愈伤组织形成后,添加到四种激素组合的培养基,从不同角度刺激愈伤组织的分化,直接获得壮芽苗。
下面结合实施例对本发明提供的一种竹节诱导愈伤组织再生植株的方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
花叶矢竹的愈伤组织诱导
从消毒灭菌后的花叶矢竹容器苗上切取长度0.5cm左右的带芽竹节作为外植体,以MS培养基为基础培养基,研究不同浓度(0.05、0.5、2mg/L)下细胞分裂素6-BA、KT、TDZ与生长素2,4-D、NAA、IBA不同浓度及组合对愈伤组织诱导的影响,共计61个处理。愈伤组织诱导培养均在干燥无菌的培养室内黑暗培养,培养温度控制在25±2℃范围内。
通过61种激素配比方案研究不同植物生长调节剂对愈伤组织诱导的影响,5d后有的竹节诱导出愈伤组织,20d后统计的愈伤组织诱导率如表1所示。处理7-9愈伤组织诱导率≥30%,当只添加2,4-D时,愈伤组织诱导率高于其他处理,而2,4-D与其他激素组合时愈伤组织诱导率均较低,说明只添加2,4-D的处理更适宜竹节诱导愈伤组织。
表1不同植物生长调节剂对容器苗竹节愈伤组织诱导及芽诱导的影响
实施例2
研究不同浓度的植物生长调节剂对愈伤组织诱导的影响
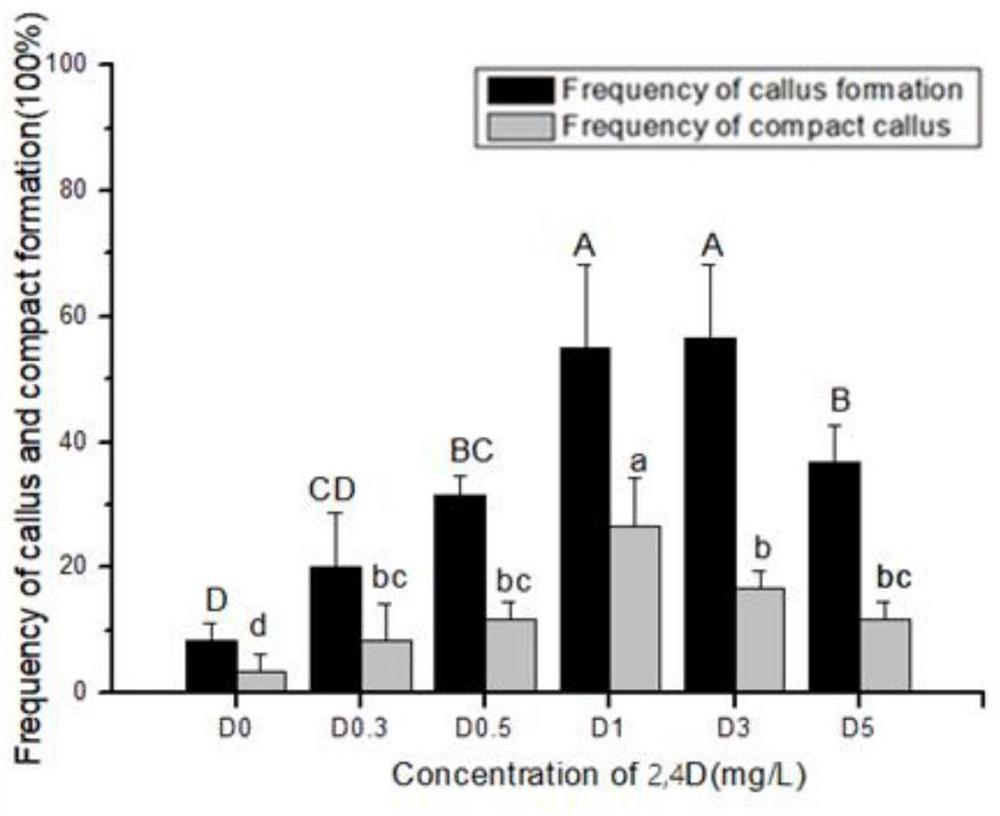
切取无菌花叶矢竹试管苗长度0.5cm左右竹节为外植体,接种于含有不同浓度2,4-D(0、0.3、0.5、1、3、5mg·L
不同浓度的2,4-D对愈伤组织诱导的影响
诱导培养5d左右,花叶矢竹竹节处膨大,形成淡黄色愈伤组织,且竹节两端逐渐开始褐化,经过3周左右的诱导后,愈伤组织直径可达3mm左右。如图1所示。当不添加2,4-D时,愈伤组织诱导率仅为8.33%,诱导率较低。当2,4-D浓度在(0~3)mg·L
BA对愈伤组织增殖与分化的影响
结果如图2所示。在添加6-BA的情况下,随着6-BA浓度的升高,愈伤组织及致密颗粒状愈伤组织诱导率呈现逐渐降低的趋势,当6-BA浓度为0时,愈伤组织及致密颗粒状愈伤组织诱导率分别达46.67%和25%,诱导率显著大于其他添加6-BA的处理。通过观察发现添加6-BA会诱导出的愈伤组织容易褐化和生根,不利于后续的增殖与分化(图4)。因此,6-BA不适于花叶矢竹愈伤组织的诱导,故诱导培养基中不加入6-BA。
NAA对愈伤组织增殖与分化的影响
如图3所示。随着NAA浓度的升高,愈伤组织及致密颗粒状愈伤组织诱导率呈现逐渐降低的趋势,添加0.5mg·L
实施例3
研究不同长度茎秆来源及其位置对诱导竹节愈伤组织的影响
分别选取长度为>5cm、1~3cm、<1cm的三种单根无菌花叶矢竹芽苗,其中长度>5cm的单根苗切取三个部位,每切段节在中间,根据节在单枝中所处位置设置:顶部1~2cm长,定编号为H1、中部2cm长定编号为H2、靠近根处的基部1cm编号定为H3;长度1~3cm的单根苗也切取三部分:顶部(长度0.3~1cm),编号为M1;中部长度(0.3~1cm),编号为M2;基部(长度0.3~1)cm,编号为M3;<1cm的单根苗不再切割,只有一节,编号为L。将上述有编号的材料放入添加有1mg·L
不同位置与长度的外植体对愈伤组织诱导的差异分析结果
挑选三种不同长度的茎秆为研究对象,以竹节为外植体,放入含有2,4-D浓度为1mg·L
茎秆长度大于5cm的竹节材料的1cm基部材料作为外植体时,(H3)诱导愈伤及致密愈伤率均达到最高,为93.33%和36.67%,其中茎秆长度为1~3cm的基部竹节(M3)和茎秆长度为<1cm的基部带芽竹节(L)诱导率达到86.67%和91.67%,且H3与M3之间没有显著差异。致密愈伤组织诱导率H3>M3>L,但三者无显著差异。致密愈伤组织诱导率H2最低,只有11.67%,与M1的致密愈伤诱导率(23.33%)无显著差异,与其他处理差异显著。综上所述,花叶矢竹最适合愈伤组织诱导的茎秆位置为基部带芽竹节。
实施例4
愈伤组织分化与增殖时间的选择
将实施例3制备的愈伤组织,在生成7d、14d、21d、28d后分别接种到增殖培养基进行增殖培养。25d后统计愈伤组织增殖倍数,愈伤组织增殖倍数=增殖后的愈伤组织重量/增殖前的愈伤组织重量。
由表2可知,愈伤组织生成时间对其增殖的影响较大,7d、14d、21d、28d的处理均差异显著,21d增殖倍数最高,为2.48,是7d处理的1.95倍。当生成时间为28d时,愈伤组织褐化明显。生成时间在14d和21d时,愈伤组织生长情况良好,有致密颗粒状愈伤组织生成。
表2愈伤组织生成时间对增殖的影响
实施例5
愈伤组织增殖次数的选择
将上述实施例3制备的愈伤组织分别按照增殖次数0、增殖培养1及增值培养2次,25d后观察愈伤组织生长状况。
结果表明,愈伤组织继代次数对其增殖也有影响。如表3所示,愈伤组织继代0次时,增殖倍数为1.31,显著低于其他处理,且此时的愈伤组织多为乳白色,不适宜进行分化。继代次数为2次时,增殖倍数最高,达4.42,显著高于其他处理,且此时的愈伤组织多为致密颗粒状的淡黄色愈伤,分化能力强,最适宜用于愈伤组织分化试验。
表3愈伤组织继代次数对其增殖的影响
实施例6
不同激素组合对愈伤组织分化
以MS为基本培养基,设计不同浓度6-BA(0.5、1、2)mg·L
愈伤组织分化培养基配方的筛选
选取生长状态一致的直径大小约为5~7mm的致密颗粒状淡黄色愈伤组织,接种到分化培养基上,结果如表4所示。培养3d后,处理9愈伤组织表面最开始出现绿点,7d后陆续出现绿点(图7),培养25d后,绿点率基本稳定,并能陆续分化出苗(图8)。继续培养25d后,分化苗成簇状长大(图9)。如表4所示,在MS培养基中添加0.5mg·L
表4不同植物激素组合对愈伤组织分化的影响
实施例7
花叶矢竹的竹节诱导愈伤组织再生植株的方法
将消毒的花叶矢竹试管苗切取长度为5cm的基部带芽竹节为外植体,接种至愈伤组织诱导培养基上诱导培养,愈伤组织诱导培养基为含1mg·L
将得到的愈伤组织形成21d后接种至增殖培养基上增殖培养,增殖培养基为含有1mg·L
将得到的大量颗粒致密的愈伤组织接种至分化培养基上进行分化培养,每个培养基接种10块愈伤组织,分化培养均放置在在光周期16h/8h、温度25±2℃无菌培养室内,分化培养基为含0.5mg·L
经统计,愈伤组织培养基中2,4-D浓度为1mg·L
实施例8
花叶矢竹的竹节诱导愈伤组织再生植株的方法
将消毒的花叶矢竹试管苗切取长度为0.5cm的顶部带芽竹节为外植体,接种至愈伤组织诱导培养基上诱导培养,愈伤组织诱导培养基为含3mg·L
将得到的愈伤组织形成14d后接种至增殖培养基上增殖培养,增殖培养基为含有1mg·L
将上述制备的颗粒致密的愈伤组织接种至分化培养基上进行分化培养,每个培养基接种10块愈伤组织,分化培养均放置在在光周期16h/8h、温度25±2℃无菌培养室内,分化培养基为含2mg·L
经统计,愈伤组织培养基中2,4-D浓度为3mg·L
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种竹节诱导愈伤组织再生植株的方法
- 一种花药快速诱导胚性愈伤组织再生植株的方法
