结晶曲尼司特盐及其药物用途
文献发布时间:2023-06-19 09:33:52
相关申请的交叉引用
本申请要求于2018年8月14日提交的美国专利申请号62/718,563的优先权,其通过引用并入本文。
技术领域
本发明涉及结晶曲尼司特盐、该结晶盐的治疗用途以及含有该结晶盐的药物组合物。
背景技术
曲尼司特(Tranilast),(2-[3-(3,4-二甲氧基苯基)-1-氧代-2-丙烯基]氨基]苯甲酸,在下文中示出),由于其抑制炎性介质(诸如组胺)从肥大细胞和嗜碱细胞释放的能力,最初是作为一种抗过敏药物开发的(P.Zampini.Int J Immunopharmacol.1983;5(5):431-5)。
曲尼司特已经由Kissei Pharmaceutical Co.Ltd以
近年来,许多研究者研究了曲尼司特的抗增殖作用,以评估其在纤维化和癌性病症中的潜力。其抗增殖作用被认为是由于其抑制转化生长因子β(TGF-β)的能力(H.Suzawa.Jpn J Pharmacol.1992Oct;60(2):91-96)。纤维化是一种可影响身体大部分器官的病症,成纤维细胞增殖、分化和胶原合成被认为是大多数类型纤维化进展的关键因素。曲尼司特已被证明在体内在多种纤维化病症中具有潜在的有益作用。曲尼司特已被证明在体内对肺纤维化(M.Kato.Eur Respir J.2013;42(57):2330)、肾纤维化(DJ Kelly,J AmSoc Nephrol.2004;15(10):2619-29)、心脏纤维化(J Martin,Cardiovasc Res.2005;65(3):694-701)、眼纤维化(M J Moon,BMC Opthalmol.2016;16:166)和肝纤维化(M Uno,Hepatology.2008;48(1):109-18)具有潜力。
最近还证明了曲尼司特的体外和体内抗肿瘤作用。曲尼司特已被证明能抑制包含乳腺癌(R.Chakrabarti.Anticancer Drugs.2009Jun;20(5):334-45)和前列腺癌(S.Sato.Prostate.2010Feb;70(3):229-38)细胞系在内的几种细胞系的增殖、凋亡和迁移。在一项对小鼠的乳腺癌研究中,曲尼司特被发现可明显减少转移(R.Chakrabarti.Anticancer Drugs.2009Jun;20(5):334-45)。在一项对人类的初步研究中,曲尼司特被证明具有改善晚期去势抵抗性前列腺癌患者的预后的潜力(K.Izumi.Anticancer Research.2010Jul;30:73077-81)。体外研究还显示曲尼司特在神经胶质瘤(M Platten.Int J Cancer.2001;93:53-61)、胰腺癌(M Hiroi,J Nippon Med Sch.2002;69:224-234)和胃癌(M Yashiro,Anticancer Res.2003;23:3899-3904)的治疗潜力。
考虑到曲尼司特可能对广泛的纤维化病症和癌症具有潜在治疗益处,以及需要治疗的不同的患者类型和身体的特定部位,预期患者将从具有用于施用曲尼司特的多种递送方法(以便最适合患者的需求)中受益。药物组合物可包含例如固体口服剂量、液体口服剂量、可注射组合物、可吸入组合物、局部组合物或透皮组合物。
Kissei Pharmaceutical Co.Ltd探索了曲尼司特在预防冠状动脉介入治疗相关再狭窄中的抗增殖作用。在一项II期临床研究中,Kissei发现目前批准的曲尼司特的剂量(300mg/d)不足以预防再狭窄,且发现需要600mg/d的更高剂量以实现再狭窄率的降低(H.Tamai,Am Heart J.1999;138(5):968-75)。然而,发现600mg的日剂量会导致患者间该药物的血浆浓度十倍的可变性(30-300μmol/L)(H Kusama,Atherosclerosis.1999;143:307-313)并且在曲尼司特预防再狭窄的III期研究中,剂量进一步增加至每天900mg(DHolmes,Circulation.2002;106(10):1243-1250)。
曲尼司特的市售口服形式
预期曲尼司特的极低溶解性是该药物口服生物利用度的限制因素。考虑到任何药物必须首先在胃肠道中溶解然后被吸收到血流中的时间有限,随着曲尼司特的口服剂量增加,这个问题将变得更加具有限制性。曲尼司特溶解性差也可能是高剂量曲尼司特药代动力学报告的高患者间可变性的关键因素。作为一种BCS II类药物(低溶解性/高渗透性),预期来自胃肠道的吸收会受到药物在胃肠介质中的溶解速率及其总溶解性的限制。对于慢性增殖性疾病诸如纤维化和癌症的治疗,药物的递送方法产生维持在最小有效浓度以上的一致的、可预测的血浆水平是至关重要的。为了以更高的剂量实现曲尼司特的有效口服递送,需要具有高溶解性和快速溶解速率的新固体形式的药物。
考虑到涉及癌症或纤维化的病症的严重程度,还需要全身治疗方案,通过这种方案,曲尼司特可以由医疗专家递送,其不需要患者吞咽固体口服剂型。适用于这些需要的替代剂型可包含例如可注射组合物、液体口服制剂或雾化吸入制剂。这些将需要适于全身递送的曲尼司特的液体制剂。
考虑到曲尼司特具有治疗眼部疾病(诸如过敏性结膜炎)的潜力,KisseiPharmaceutical Co.Ltd认识到需要开发用于局部治疗的曲尼司特滴眼剂制剂。然而,除了具有非常低的水溶性之外,曲尼司特在储存于溶液中时也是光化学不稳定的,导致显著降解(N Hori,Chem.Pharm.Bull.1999;47(12):1713-1716)。因此,Kissei能够获得曲尼司特的滴眼剂液体组合物的唯一方式是在制剂中使用增溶剂和稳定剂(美国专利5356620)。所得的0.5%(w/v)滴眼剂制剂目前也以
因此,仍然需要适于全身递送的曲尼司特的水性药物组合物。考虑到曲尼司特长期储存在溶液中的潜在光化学降解问题以及储存基于大体积溶液的制剂所需的较大储存设施的缺点,开发一种稳定的高度可溶的曲尼司特的固体形式还是有利的,其可以在患者或医疗服务提供者治疗时快速溶解以产生所需的液体制剂。
在努力制备曲尼司特的液体制剂后,Kissei发表声明称曲尼司特及其药学上可接受的盐太不溶于水以至于不能制备水溶液(美国专利5356620)。自该美国专利以来,已经公布的唯一结晶性药学上可接受的盐为钠盐(N Geng,Cryst.Growth Des.2013;13:3546-3553)。与Kissei的发现相一致,这篇文章的作者指出,结晶曲尼司特钠盐的表观溶解性甚至低于纯曲尼司特。此外,当他们进行曲尼司特在含钠介质中的溶解研究时,他们发现随着曲尼司特的溶解,曲尼司特以其钠盐形式逐渐从溶液中沉淀出来,表明钠盐具有比纯药物更低的热力学溶解性。这篇文章的作者还成功地制备了曲尼司特的非药学上可接受的结晶胞嘧啶盐。尽管与纯结晶曲尼司特相比,该结晶胞嘧啶盐显示出约两倍的溶解性改善,但该结晶胞嘧啶盐不仅由于胞嘧啶不具有FDA可接受性而不适用于全身递送至患者,而且这种溶解性的改善不会大到足以产生高剂量曲尼司特液体制剂(诸如可注射制剂)。
专利申请EP1946753公开了制备曲尼司特的外用制剂的尝试,并要求保护曲尼司特与有机胺的离子液体盐的制备。发明人要求保护曲尼司特与有机胺共混产生液体形式。该申请没有公开与有机胺形成任何固态的结晶曲尼司特盐。他们证明曲尼司特的这些离子液体形式在适于皮肤外用的溶剂中具有更高的溶解性,并且这些制剂在相同制剂中具有比纯曲尼司特更高的光稳定性。然而,这种改善的光稳定性仍然导致相当大比例的曲尼司特被光降解,因此将不适于长期储存。此外,用于制备这些离子液体盐制剂的溶剂不适于曲尼司特的内部递送。此外,在EP1946753中未提及在水性或生物相关介质中改善的溶解性。
发明内容
本发明涉及结晶曲尼司特盐。具体地,本发明涉及结晶1:1曲尼司特n-甲基葡糖胺I型盐;结晶1:1曲尼司特n-甲基葡糖胺II型盐;结晶1:1曲尼司特l-赖氨酸盐;结晶1:1曲尼司特二乙胺盐;结晶1:1曲尼司特n-乙基葡糖胺盐;结晶1:1曲尼司特钾盐一水合物;结晶1:1曲尼司特二乙醇胺盐;以及结晶1:1曲尼司特乙醇胺盐。本发明涉及含有本发明的结晶曲尼司特盐和药学上可接受的载体的药物组合物。曲尼司特具有抗过敏、抗纤维化、抗炎、抗肿瘤、促进神经发生和抑制血管生成等特性,因此如上所述可用于治疗与这些特性相关的疾病、障碍和病症。本发明的结晶曲尼司特盐可以以与曲尼司特相同的方式使用,但与曲尼司特和其它形式的曲尼司特相比具有改善的性质。本发明还涉及制备液体药物组合物的方法和根据该方法制备的液体药物组合物,该方法包括将根据本发明的结晶曲尼司特盐溶解于药学上可接受的溶剂中的步骤。
附图说明
图1描述了结晶1:1曲尼司特N-甲基葡糖胺I型盐的XRPD图谱。
图2描述了结晶1:1曲尼司特N-甲基葡糖胺I型盐的DSC曲线。
图3描述了结晶1:1曲尼司特N-甲基葡糖胺I型盐的TGA曲线。
图4描述了结晶1:1曲尼司特N-甲基葡糖胺I型盐的红外光谱。
图5描述了结晶1:1曲尼司特N-甲基葡糖胺I型盐的GVS等温线图。
图6描述了结晶1:1曲尼司特N-甲基葡糖胺II型盐的XRPD图谱。
图7描述了结晶1:1曲尼司特N-甲基葡糖胺II型盐的DSC曲线。
图8描述了结晶1:1曲尼司特N-甲基葡糖胺II型盐的TGA曲线。
图9描述了结晶1:1曲尼司特N-甲基葡糖胺II型盐的红外光谱。
图10描述了结晶1:1曲尼司特N-甲基葡糖胺II型盐的GVS等温线图。
图11描述了结晶1:1曲尼司特L-赖氨酸盐的XRPD图谱。
图12描述了结晶1:1曲尼司特L-赖氨酸盐的DSC曲线。
图13描述了结晶1:1曲尼司特L-赖氨酸盐的TGA曲线。
图14描述了结晶1:1曲尼司特L-赖氨酸盐的红外光谱。
图15描述了结晶1:1曲尼司特二乙胺盐的XRPD图谱。
图16描述了结晶1:1曲尼司特二乙胺盐的DSC曲线。
图17描述了结晶1:1曲尼司特二乙胺盐的TGA曲线。
图18描述了结晶1:1曲尼司特二乙胺盐的红外光谱。
图19描述了结晶1:1曲尼司特N-乙基葡糖胺盐的XRPD图谱。
图20描述了结晶1:1曲尼司特N-乙基葡糖胺盐的DSC曲线。
图21描述了结晶1:1曲尼司特N-乙基葡糖胺盐的TGA曲线。
图22描述了结晶1:1曲尼司特N-乙基葡糖胺盐的红外光谱。
图23描述了结晶1:1曲尼司特钾盐一水合物的XRPD图谱。
图24描述了结晶1:1曲尼司特钾盐一水合物的ORTEP图。
图25描述了结晶1:1曲尼司特钾盐一水合物在100K下的计算的XRPD图谱。
图26描述了结晶1:1曲尼司特钾盐一水合物在295K下的计算的XRPD图谱。
图27描述了结晶1:1曲尼司特钾盐一水合物的DSC曲线。
图28描述了结晶1:1曲尼司特钾盐一水合物的TGA曲线。
图29描述了结晶1:1曲尼司特钾盐一水合物的红外光谱。
图30描述了结晶1:1曲尼司特二乙醇胺盐的XRPD图谱。
图31描述了结晶1:1曲尼司特二乙醇胺盐的DSC曲线。
图32描述了结晶1:1曲尼司特二乙醇胺盐的TGA曲线。
图33描述了结晶1:1曲尼司特二乙醇胺盐的红外光谱。
图34描述了结晶1:1曲尼司特乙醇胺盐的XRPD图谱。
图35描述了结晶1:1曲尼司特乙醇胺盐的ORTEP图。
图36描述了结晶1:1曲尼司特乙醇胺盐在293K下的计算的XRPD图谱。
图37描述了结晶1:1曲尼司特乙醇胺盐的DSC曲线。
图38描述了结晶1:1曲尼司特乙醇胺盐的TGA曲线。
图39描述了结晶1:1曲尼司特乙醇胺盐的红外光谱。
图40描述了结晶1:1曲尼司特盐、结晶1:1曲尼司特烟酰胺共晶和
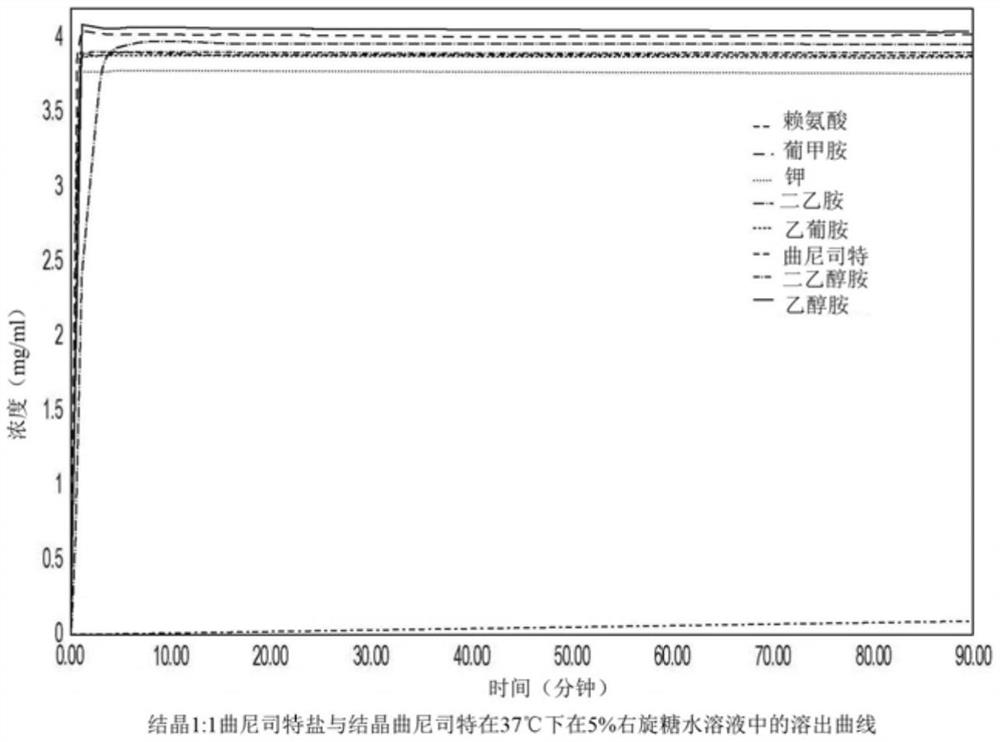
图41描述了结晶1:1曲尼司特盐与结晶曲尼司特在37℃下在5%右旋糖水溶液中的溶解曲线。
具体实施方式
本发明涉及结晶曲尼司特盐。本发明的结晶曲尼司特盐、其制备及其表征在下文描述并在附图中显示。本发明涉及含有本发明的结晶曲尼司特盐和药学上可接受的载体的药物组合物。本发明还涉及治疗上述疾病的方法以及治疗有效量的本发明的结晶曲尼司特盐在该治疗中的用途。
当两种固体组分成功地一起结晶以形成具有新的独特固态结晶结构的双组分分子复合物时,这可产生盐或共晶。形成盐还是共晶取决于在复合物的两种不同组分之间是否发生质子转移。如果质子从一种组分转移到另一种组分,导致离子键合,则产生结晶盐。如果没有发生质子转移并且组分保持其中性状态,仅通过氢键、范德华键等保持在一起,则形成共晶。是否发生质子转移取决于各组分的酸性和碱性官能团的pKa值的差异。存在‘三的规则’,其规定,如果pKa(质子化碱)-pKa(酸)(ΔpKa)大于三,则将形成盐(P.Stahl.Handbook of pharmaceutical salts:properties,selection and use,International Union of Pure and Applied Chemistry,VHCA;Wiley-VCH:Weinheim,NewYork,2002)。
曲尼司特含有pKa为3.25的羧酸基团。表1列出了用于形成本发明的结晶曲尼司特化合物的分子的质子化碱性官能团的pKa值。可以看出,在这些分子中的每一个与曲尼司特之间形成分子复合物的ΔpKa为5.63-12.45。表中的每种化合物与曲尼司特之间的pKa(ΔpKa)如此大的差异表明本发明的新型结晶复合物为盐。
表1
因此,本发明涉及结晶1:1曲尼司特n-甲基葡糖胺I型盐;结晶1:1曲尼司特n-甲基葡糖胺II型盐;结晶1:1曲尼司特l-赖氨酸盐;结晶1:1曲尼司特二乙胺盐;结晶1:1曲尼司特n-乙基葡糖胺盐;结晶1:1曲尼司特钾盐一水合物;结晶1:1曲尼司特二乙醇胺盐;以及结晶1:1曲尼司特乙醇胺盐。结晶曲尼司特盐、其制备及其表征在下文描述并在附图中显示。
结晶曲尼司特盐的治疗用途
本发明还涉及本发明的结晶曲尼司特盐,结晶1:1曲尼司特n-甲基葡糖胺I型盐;结晶1:1曲尼司特n-甲基葡糖胺II型盐;结晶1:1曲尼司特l-赖氨酸盐;结晶1:1曲尼司特二乙胺盐;结晶1:1曲尼司特n-乙基葡糖胺盐;结晶1:1曲尼司特钾盐一水合物;结晶1:1曲尼司特二乙醇胺盐;以及结晶1:1曲尼司特乙醇胺盐的治疗用途。如上所述,曲尼司特已被证明具有抗过敏、抗纤维化、抗炎、抗肿瘤、促进神经发生和抑制血管生成的特性。然后,本发明的结晶曲尼司特盐可用于治疗与这些特性相关的疾病、障碍和病症,例如上述那些。因此,本发明涉及治疗这种疾病、障碍或病症的方法,该方法包括向有此需要的患者施用治疗有效量的本发明的结晶曲尼司特盐的步骤或向有此需要的患者施用含有本发明的结晶曲尼司特盐的治疗组合物的步骤。
术语“治疗(treatment)”或“治疗(treating)”是指哺乳动物中的疾病、障碍或病症的任何治疗,包含:预防或防止疾病、障碍或病症,即,引起临床症状不发展;抑制(inhibiting)疾病、障碍或病症,即阻止(arresting)或抑制(suppressing)临床症状的发展;和/或减轻疾病、障碍或病症(包含减轻与病症或障碍相关的不适),即引起临床症状消退。本领域技术人员将理解,在人类医学中,并不总是可以在“预防(preventing)”和“抑制(suppressing)”之间进行区分,因为一个或多个最终诱发事件可能是未知的、潜在的,或者患者直到一个或多个事件发生后才被确定。因此,如本文所用,术语“预防(prophylaxis)”旨在作为“治疗”的要素,以涵盖“预防(preventing)”和“抑制(suppressing)”疾病、障碍或病症。术语“保护(protection)”意在包含“预防(prophylaxis)”。
含有结晶曲尼司特盐的药物组合物
本发明还涉及药物组合物,其包括治疗有效量的根据本发明的结晶曲尼司特盐和药学上可接受的载体(还称为药学上可接受的赋形剂)、基本上由其组成或由其组成。如上所述,这些药物组合物在治疗上可用于治疗或预防诸如上述那些障碍。本发明的药物组合物可以是用本发明的结晶曲尼司特盐制备的固体剂型或溶液。
本发明的药物组合物可以是含有根据本发明的结晶曲尼司特盐的任何剂型。该药物组合物可为例如片剂、胶囊、口服溶液、可注射组合物、局部用组合物、可吸入组合物或透皮组合物。液体药物组合物可使用本发明的曲尼司特盐制备,并代表本发明的一具体实施方式。对于液体药物组合物,可以在护理的时间和地点将曲尼司特盐溶解在溶剂(例如水)中。药物组合物通常含有例如约0.1重量%至约99.9重量%的本发明的结晶曲尼司特盐,例如约0.5重量%至约99重量%的本发明的结晶曲尼司特盐和例如99.5重量%至0.5重量%的至少一种合适的药物赋形剂或溶剂。在一个实施方式中,组合物可为约5重量%至约75重量%的本发明的结晶曲尼司特盐,其余为至少一种合适的药物赋形剂、溶剂或至少一种其它佐剂,如下所述。
“根据本发明的结晶曲尼司特盐的治疗有效量”是与当口服施用约50mg-约900mg、约50mg-约200mg、约100mg-约800mg、约250mg-约750mg、约300mg-约700mg、约550mg-约650mg、约100mg或约600mg曲尼司特本身时当前达到的治疗效果相关的量。如上所述,曲尼司特是由Kissei Pharmaceutical Co.Ltd在日本和韩国以
在固体剂型中或当作为吸入固体施用时,本发明的结晶曲尼司特盐的治疗有效量可以在上述范围内,但也可以在约0.1mg至约250mg、0.5mg至约150mg,甚至约1mg至约100mg的结晶曲尼司特盐本身的范围内。
为了克服曲尼司特在溶液中储存的光化学不稳定性(N Hori,Chem.Pharm.Bull.1999;47(12):1713-1716)以及大体积溶液基制剂的长期储存的缺点,结晶曲尼司特盐的药物组合物可以有利地为固体组合物,其可以在使用时原位溶解,以得到作为液体剂型立即递送至患者的溶液。再次有利地,液体剂型然后可以用于每单位剂量施用上述任何剂量或其他高剂量,例如600mg、750mg、900mg或更高。这种剂型可适合用作例如可注射、吸入或口服溶液剂型。根据本发明的结晶曲尼司特盐的药物溶液的治疗有效量也可以在上述范围内,尽管对于避免首过代谢的递送方法(诸如可注射或吸入递送),可以理解的是,也可以在较低剂量下实现功效。药物的治疗有效量可以取决于本领域已知的施用途径。例如,在局部应用(诸如乳膏剂、滴眼剂或肺部递送)中,治疗有效量可很小,例如约0.1mg至约250mg、0.5mg至约150mg,以及甚至约1mg至约100mg的结晶曲尼司特盐本身。
治疗任何特定患者的任何特定疾病、障碍或病症所需的实际量可取决于多种因素,包含例如所治疗的特定疾病、障碍或病症;所治疗的疾病状态及其严重程度;所采用的具体药物组合物;患者的年龄、体重、总体健康状况、性别和饮食;施用方式;施用时间;施用途径;以及曲尼司特的排泄率;治疗的持续时间;与所使用的具体化合物组合或同时使用的任何药物;以及医学领域中公知的其他此类因素。这些因素在Goodman和Gilman的“ThePharmacological Basis of Therapeutics”,Tenth Edition,A.Gilman,J.Hardman andL.Limbird,eds.,McGraw-Hill Press,155-173,2001中进行了讨论,该文献通过引用并入本文。
取决于药物组合物的类型,药学上可接受的载体可选自本领域已知的任何一种载体或载体的组合。药学上可接受的载体的选择取决于药物形式和所要采用的施用方法。对于本发明的药物组合物,即含有本发明的结晶曲尼司特盐的药物组合物,应选择保持晶型的载体。换言之,载体不应实质上改变结晶曲尼司特盐。载体也不应与所用的结晶曲尼司特盐不相容,诸如通过产生任何不期望的生物效应或以有害的方式与药物组合物的任何其它组分相互作用。
本发明的药物组合物可通过药物制剂领域中已知的方法制备,例如,参见Remington's Pharmaceutical Sciences,18
药物制剂领域中已知的药学上可接受的佐剂也可用于本发明的药物组合物中。这些包含但不限于防腐剂、润湿剂、悬浮液、甜味剂、调味剂、芳香剂、乳化剂和分散剂。可以通过包含各种抗细菌剂和抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等)来确保防止微生物的作用。还可能需要包含等渗剂(例如,糖、氯化钠等)。如果需要,本发明的药物组合物还可含有少量辅助物质,诸如润湿剂或乳化剂、pH缓冲剂、抗氧化剂等,诸如例如柠檬酸、脱水山梨糖醇单月桂酸酯、油酸三乙醇胺酯、丁基化羟基甲苯等。
如上所述的固体剂型可用包衣和壳层制备,诸如肠溶衣和其它,如制药领域已知的。它们可含有安抚剂,并且也可以具有这样的组合物,它们在肠道的某个部分以延迟的方式释放一种或多种活性化合物。可以使用的包埋组合物的非限制性示例为聚合物质和蜡。如果合适,活性化合物也可为具有一种或多种上述赋形剂的微胶囊化形式。
除活性化合物外,悬浮液还可含有悬浮剂,诸如例如乙氧基化异硬脂醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶或这些物质的混合物等。液体剂型可为水性的,可含有药学上可接受的溶剂以及本领域已知的常规液体剂型赋形剂,其包含但不限于缓冲剂、调味剂、甜味剂、防腐剂和稳定剂。
用于直肠给药的组合物为例如栓剂,其可通过将本发明的结晶曲尼司特盐与例如合适的无刺激性赋形剂或载体(诸如可可脂、聚乙二醇或栓剂蜡)混合来制备,其在常温下可为固体,但在体温下可为液体,因此在合适的体腔中熔化并在其中释放活性组分。
适于局部施用的组合物包含液体或半液体制剂,诸如擦剂、洗剂、凝胶剂、涂剂、水包油或油包水乳剂诸如乳膏剂、软膏剂、糊剂或泡沫剂;或溶液剂或悬浮液诸如滴剂,如本领域已知的。本发明的组合物可用于局部施用,在这种情况下,载体可适当地包括溶液、乳液、软膏或凝胶基底。载体或基底例如可包括一种或多种以下物质:凡士林、羊毛脂、聚乙二醇、蜂蜡、矿物油、稀释剂(诸如水和醇)以及乳化剂和稳定剂。增稠剂可存在于用于局部施用的药物组合物中。如果旨在用于透皮施用,则组合物可包含透皮贴剂或离子电渗装置。局部用制剂可含有浓度为约0.1至约10%w/v(重量/单位体积)的本发明化合物。
除了上述局部施用方法之外,还有多种将本发明的活性结晶曲尼司特盐局部施用于肺的方法。一种这样的方法可以涉及包含本发明的结晶曲尼司特盐的可吸入颗粒的干粉吸入制剂,该制剂被治疗的患者吸入。干粉制剂通常包含载体颗粒,结晶曲尼司特盐颗粒可粘附在载体颗粒上。该载体颗粒可为任何可接受的药理学惰性材料或材料的组合。例如,载体颗粒可由选自以下的一种或多种材料组成:糖醇;多元醇,例如山梨糖醇、甘露糖醇或木糖醇,以及结晶糖(包含单糖和二糖);无机盐诸如氯化钠和碳酸钙;有机盐,诸如乳酸钠;以及其它有机化合物诸如脲、多糖(例如环糊精和糊精)。载体颗粒可为结晶糖,例如单糖诸如葡萄糖或阿拉伯糖,或二糖诸如麦芽糖、蔗糖、右旋糖或乳糖。结晶曲尼司特盐将分散至呼吸道中,随后以药学有效量与下肺接触。
将活性化合物局部施用于受试者眼睛的另一种方法将涉及施用滴眼剂或洗眼剂形式的局部液体/液体悬浮液。用于制备滴眼剂或洗眼剂制剂的活性化合物的液体药物组合物可以通过本领域技术人员已知的技术将活性化合物与合适的媒介物(诸如无菌无热原水或无菌盐水)组合来制备。
除了上述局部施用方法外,还有多种通过这些方法全身施用本发明的活性结晶曲尼司特盐的方法。一种这样的方法将涉及包含本发明的结晶曲尼司特盐的可吸入颗粒的气雾悬浮液,该气雾悬浮液被治疗的患者吸入。结晶曲尼司特盐将以药学有效量经由肺被吸收到血流中。该可吸入颗粒可以是液体或固体,其粒度足够小以在吸入时可通过口和喉。
因为在制备过程中可以保持结晶曲尼司特盐的晶型,所以固体剂型是本发明的药物组合物的一个实施方式。可以使用用于口服施用的剂型,其包含胶囊、片剂、丸剂、粉剂、颗粒剂和悬浮液。可以使用用于肺部施用的剂型,其包含定量吸入制剂、干粉吸入制剂或气雾制剂。在这种固体剂型中,活性化合物可与至少一种惰性的药学上可接受的赋形剂(也称为药学上可接受的载体)混合。
根据本发明的结晶曲尼司特盐也可用于配制液体或可注射的药物组合物。施用纯形式的结晶曲尼司特盐或合适的药物组合物形式的结晶曲尼司特盐可通过任何接受的施用方式或用于发挥类似效用的药剂来进行。因此,施用可为例如口服、含服、经鼻、经肺、肠胃外(静脉内、肌肉内或皮下)、局部、经皮、阴道内、膀胱内、全身内、眼或直肠施用,以固体、半固体、冻干粉末或液体剂型的形式,诸如例如片剂、栓剂、丸剂、软弹性和硬明胶胶囊剂、粉剂、溶液剂、悬浮液或气雾剂等,诸如例如适于简单施用精确剂量的单位剂型。一种施用途径可为口服施用,使用可根据待治疗病症的严重程度进行调整的方便的日剂量方案。
对于患者可能不能吞服固体口服剂型的病症诸如纤维化和癌症,结晶曲尼司特盐的组合物可为液体形式,诸如例如可由医疗专家施用的可注射或液体口服制剂。
本发明还涉及制备液体药物组合物的方法和根据该方法制备的液体药物组合物,该方法包括将根据本发明的结晶曲尼司特盐溶解在药学上可接受的溶剂中的步骤。生理上可接受的水性媒介物可用作溶剂,以制备本发明的结晶曲尼司特盐的液体制剂。优选水或药学上可接受的等渗水溶液。水性媒介物应使曲尼司特盐溶解并保留在溶液中。应避免使用盐水,因为盐水中存在的钠可从溶液中沉淀出部分或全部曲尼司特。如上所述,本发明的液体药物组合物可口服、肠胃外(包含通过吸入)和静脉内施用。
示例
以下分析方法用于表征本发明的曲尼司特盐:
示例1:结晶1:1曲尼司特N-甲基葡糖胺I型盐
1.1结晶1:1曲尼司特N-甲基葡糖胺I型盐的制备
如下制备用于表征的一批结晶1:1曲尼司特N-甲基葡糖胺I型盐:
将曲尼司特(1.00g)和N-甲基葡糖胺(596mg)称重,置于圆底烧瓶中。向烧瓶中加入乙醇(30ml)。将所得黄色浆液逐渐加热至70℃,然后在该温度下保持1小时。使所得白色浆液逐渐冷却,然后在室温下搅拌15小时。将烧瓶在冰箱中放置3小时,然后在真空下过滤产物。将所得无色晶体在真空烘箱中在40℃下干燥过夜。
1.2结晶1:1曲尼司特N-甲基葡糖胺I型盐的XRPD表征
结晶1:1曲尼司特N-甲基葡糖胺I型盐的实验XRPD图谱显示于图1中。表2列出了在图1的实验XRPD图谱中鉴定的峰的角度°2θ±0.2°2θ和d值。峰或相应的d值的整个列表或其子集可足以表征结晶盐,以及基本上类似于图1的XRPD图谱。例如,结晶1:1曲尼司特N-甲基葡糖胺I型盐可通过选自在7.3、8.4、9.7、12.2、14.4和16.2°2θ±0.2°2θ处的峰中的至少四个峰或其相应的d值来表征。
表2
1.3结晶1:1曲尼司特N-甲基葡糖胺I型盐的DSC
图2的差示扫描量热法(DSC)曲线显示出峰最大值为157.2℃的单个吸热峰。
1.4结晶1:1曲尼司特N-甲基葡糖胺I型盐的TGA
图3的热重分析(TGA)曲线显示在250℃之前没有明显的重量损失。
1.5结晶1:1曲尼司特N-甲基葡糖胺I型盐的红外光谱
结晶1:1曲尼司特N-甲基葡糖胺I型盐的实验红外光谱示于图4。在图4的实验红外光谱中鉴定的显著峰为3402、1662、1589、1507、1451、1423、1378、1341、1296、1272、1244、1217、1134、1091、1029、965、948、809、749、700、662、590、571、551、532和517cm
1.6结晶1:1曲尼司特N-甲基葡糖胺I型盐的重量蒸气吸附(GVS)分析
对于结晶1:1曲尼司特N-甲基葡糖胺I型盐获得的水分吸附等温线图示于图5中。发现结晶1:1曲尼司特N-甲基葡糖胺I型盐在25℃下在90%湿度范围内可逆吸收1.4%w/w。在0%RH和90%RH下对样品进行的XRPD分析证实样品在整个湿度范围内均保持为结晶1:1曲尼司特N-甲基葡糖胺I型盐,并且在这些条件下未显示任何形式转化。
示例2:结晶1:1曲尼司特N-甲基葡糖胺II型盐
2.1结晶1:1曲尼司特N-甲基葡糖胺II型盐的制备
如下制备用于表征的一批结晶1:1曲尼司特N-甲基葡糖胺II型盐:
将曲尼司特(3.00g)和N-甲基葡糖胺(1.79g)称重,置于圆底烧瓶中。向烧瓶中加入丁烷-1-醇(30ml)。将所得黄色浆液在室温搅拌12小时。然后将产物在真空下过滤,并将所得无色晶体在真空烘箱中在40℃下干燥过夜。
2.2结晶1:1曲尼司特N-甲基葡糖胺II型盐的XRPD表征
结晶1:1曲尼司特N-甲基葡糖胺II型盐的实验XRPD图谱示于图6中。表3列出了在图6的实验XRPD图谱中鉴定的峰的角度°2θ±0.2°2θ和d值。峰或相应的d值的整个列表或其子集可足以表征结晶盐,以及基本上类似于图6的XRPD图谱。例如,结晶1:1曲尼司特N-甲基葡糖胺II型盐可由选自在10.8、14.0、14.6、15.2、15.9、16.7和18.9°2θ±0.2°2θ处的峰中的至少四个峰或其相应的d值来表征。
表3
2.3结晶1:1曲尼司特N-甲基葡糖胺II型盐的DSC
图7的差示扫描量热法(DSC)曲线显示峰最大值为160.1℃的单个吸热峰。
2.4结晶1:1曲尼司特N-甲基葡糖胺II型盐的TGA
图8的热重分析(TGA)曲线显示在250℃之前没有明显的重量损失。
2.5结晶1:1曲尼司特N-甲基葡糖胺II型盐的红外光谱
结晶1:1曲尼司特N-甲基葡糖胺II型盐的实验红外光谱示于图9中。在图9的实验红外光谱中鉴定的显著峰为3419、1655、1585、1519、1443、1417、1377、1335、1301、1287、1258、1235、1169、1142、1079、1044、1007、965、842、795、745、699、670、590、566、550、526、484和463cm
2.6结晶1:1曲尼司特N-甲基葡糖胺II型盐的重量蒸气吸附(GVS)分析
对于结晶1:1曲尼司特N-甲基葡糖胺II型盐获得的水分吸附等温线图示于图10中。发现结晶的1:1曲尼司特N-甲基葡糖胺II型盐在25℃下在90%湿度范围内可逆地吸收0.42%w/w。在0%RH和90%RH下对样品进行的XRPD分析证实样品在整个湿度范围内均保持为结晶1:1曲尼司特N-甲基葡糖胺II型盐,并且在这些条件下未显示任何形式转化。
示例3:1:1曲尼司特N-甲基葡糖胺盐的多晶型物的固态稳定性
进行研究以检验结晶1:1曲尼司特N-甲基葡糖胺盐多晶型物在加速条件下对于固体形式随时间的转化的物理稳定性。将1:1曲尼司特N-甲基葡糖胺盐(50mg)的I和II型分别置于40℃和75%相对湿度的密封容器中,并在这些条件下储存7天。此后,通过XRPD分析每个样品,以观察任何可能的形式变化。XRPD分析显示,两个样品都保留其原始晶型,并且在这些条件下未发生固体形式的转化。
进行第二项研究以探索结晶1:1曲尼司特N-甲基葡萄糖胺盐多晶型物在高湿度下的固态稳定性。将1:1曲尼司特N-甲基葡糖胺盐(50mg)的I和II型分别置于25℃和100%相对湿度的密封容器中,并在这些条件下储存7天。此后,通过XRPD分析每个样品,以观察任何可能的形式变化。XRPD分析显示,两个样品都保留其原始晶型,并且在这些条件下未发生固体形式的转化。
进行第三项研究以探索结晶1:1曲尼司特N-甲基葡萄糖胺盐多晶型物在高储存温度下的固态稳定性。将1:1曲尼司特N-甲基葡糖胺盐(50mg)的I和II型在90℃的烘箱中储存7天。此后,通过XRPD分析每个样品,以观察任何可能的形式变化。XRPD分析显示,两个样品都保留其原始晶型,并且在这些条件下未发生固体形式的转化。
这些研究表明,结晶1:1曲尼司特N-甲基葡糖胺盐的I和II型在不同的温度和相对湿度下均为稳定的晶型。未发生多晶型物的相互转化。
示例4:结晶1:1曲尼司特L-赖氨酸盐
4.1结晶1:1曲尼司特L-赖氨酸盐的制备
如下制备用于表征的一批结晶1:1曲尼司特L-赖氨酸盐:
将曲尼司特(100mg)和L-赖氨酸(44.6mg)称重,置于玻璃小瓶中。向小瓶中加入甲醇(1.5ml)。将所得黄色浆液置于振荡器中,并在环境温度下振荡约24小时。然后将产物在真空下过滤,并将所得无色晶体在真空烘箱中在40℃下干燥过夜。
4.2结晶1:1曲尼司特L-赖氨酸盐的XRPD表征
结晶1:1曲尼司特L-赖氨酸盐的实验XRPD图谱示于图11中。表4列出了在图11的实验XRPD图谱中鉴定的峰的角度°2θ±0.2°2θ和d值。峰或相应的d值的整个列表或其子集可足以表征结晶盐,以及基本上类似于图11的XRPD图谱。例如,结晶1:1曲尼司特L-赖氨酸盐可通过选自在11.8、12.3、15.1、16.0、18.5、20.9和21.5°2θ±0.2°2θ处的峰中的至少四个峰或其相应的d值来表征。
表4
4.3结晶1:1曲尼司特L-赖氨酸盐的DSC
图12的差示扫描量热法(DSC)曲线显示峰最大值为241.1℃和248.0℃的双吸热峰。
4.4结晶1:1曲尼司特L-赖氨酸盐的TGA
图13的热重分析(TGA)曲线显示在255℃之前没有明显的重量损失。
4.5结晶1:1曲尼司特L-赖氨酸盐的红外光谱
结晶1:1曲尼司特L-赖氨酸盐的实验红外光谱示于图14。在图14的实验红外光谱中鉴定的显著峰为3204、1670、1602、1584、1516、1493、1415、1371、1335、1277、1254、1232、1159、1135、1020、983、838、815、770、755和553cm
示例5:结晶1:1曲尼司特二乙胺盐
5.1结晶1:1曲尼司特二乙胺盐的制备
如下制备用于表征的一批结晶1:1曲尼司特二乙胺盐:
将曲尼司特(100mg)称重,置于玻璃小瓶中。向小瓶中加入二乙胺(0.5ml)和甲醇(1.0ml)。将所得黄色浆液置于振荡器中,并在环境温度下振荡约24小时。然后将产物在真空下过滤,并将所得无色晶体在真空烘箱中在40℃下干燥过夜。
5.2结晶1:1曲尼司特二乙胺盐的XRPD表征
结晶1:1曲尼司特二乙胺盐的实验XRPD图谱示于图15中。表5列出了在图15的实验XRPD图谱中鉴定的峰的角度°2θ±0.2°2θ和d值。峰或相应的d值的整个列表或其子集可足以表征结晶盐,以及基本上类似于图15的XRPD图谱。例如,结晶1:1曲尼司特二乙胺盐可通过选自在7.6、12.7、13.2、14.5、16.6、18.0和20.0°2θ±0.2°2θ处的峰中的至少四个峰或其相应的d值来表征。
表5
5.3结晶1:1曲尼司特二乙胺盐的DSC
图16的差示扫描量热法(DSC)曲线显示峰最大值为170.9℃的宽吸热峰。
5.4结晶1:1曲尼司特二乙胺盐的TGA
图17的热重分析(TGA)曲线显示重量损失开始于约155℃。
5.5结晶1:1曲尼司特二乙胺盐的红外光谱
结晶1:1曲尼司特二乙胺盐的实验红外光谱示于图18中。在图18的实验红外光谱中鉴定的显著峰为2987、2515、1669、1618、1579、1495、1467、1419、1361、1303、1272、1231、1155、1138、1027、977、838、808、771、707、663、606、545和465cm
示例6:结晶1:1曲尼司特N-乙基葡糖胺盐
6.1结晶1:1曲尼司特N-乙基葡糖胺盐的制备
如下制备用于表征的一批结晶1:1曲尼司特N-乙基葡糖胺:
将曲尼司特(100mg)和N-乙基葡糖胺(63.9mg)称重,置于玻璃小瓶中。向小瓶中加入丙酮(1.5ml)。将所得黄色浆液置于振荡器中,并在环境温度下振荡约24小时。然后将产物在真空下过滤,并将所得无色晶体在真空烘箱中在40℃下干燥过夜。
6.1结晶1:1N-乙基葡糖胺盐的XRPD表征
结晶1:1曲尼司特N-乙基葡糖胺盐的实验XRPD图谱显示于图19中。表6列出了在图19的实验XRPD图谱中鉴定的峰的角度°2θ±0.2°2θ和d值。峰或d值的整个列表或其子集可足以表征结晶盐,以及基本上类似于图19的XRPD图谱。例如,结晶1:1曲尼司特N-乙基葡糖胺盐可通过选自在6.9、11.1、13.8、15.2、16.1、16.8和18.2°2θ±0.2°2θ处的峰中的至少四个峰或其相应的d值来表征。
表6
6.2结晶1:1曲尼司特N-乙基葡糖胺盐的DSC
图20的差示扫描量热法(DSC)曲线显示峰最大值为161.7℃的单个吸热峰。
6.3结晶1:1曲尼司特N-乙基葡糖胺盐的TGA
图21的热重分析(TGA)曲线显示在255℃之前没有明显的重量损失。
6.4结晶1:1曲尼司特N-乙基葡糖胺盐的红外光谱
结晶1:1曲尼司特N-乙基葡糖胺I型盐的实验红外光谱示于图22。在图22的实验红外光谱中鉴定的显著峰为1660、1589、1504、1441、1423、1403、1374、1295、1273、1244、1134、1087、1028、974、809、748、700、662和530cm
示例7:结晶1:1曲尼司特钾盐一水合物
7.1结晶1:1曲尼司特钾盐一水合物的制备
如下制备用于表征的一批结晶1:1曲尼司特钾盐一水合物:
将曲尼司特(200mg)称重,置于玻璃小瓶中。向小瓶中加入甲醇(2.0ml),得到黄色浆液。加入2.0M氢氧化钾溶液(2.0ml)后,形成溶液。将小瓶放置在振荡器中,并在环境温度下振荡约24小时,此时形成灰白色沉淀。然后将产物在真空下过滤,并将所得晶体在真空烘箱中在40℃下干燥过夜。
7.2结晶1:1曲尼司特钾盐一水合物的XRPD表征
结晶1:1曲尼司特钾盐一水合物的实验XRPD图示于图23中。表7列出了在图23的实验XRPD图谱中鉴定的峰的角度°2θ±0.2°2θ和d值。峰或相应的d值的整个列表或其子集可足以表征结晶盐,以及基本上类似于图23的XRPD图谱。例如,结晶1:1曲尼司特钾盐一水合物可通过选自在7.9、10.6、11.7、14.9、17.0、19.8和20.6°2θ±0.2°2θ处的峰中的至少四个峰或其相应的d值来表征。
表7
7.3晶体1:1曲尼司特钾盐一水合物的SCXRD表征
用于单晶结构测定的晶体选自如上所述制备的一批晶体。单晶数据和结构细化参数记录在下表8中。图24显示了来自结晶1:1曲尼司特钾盐一水合物的结晶结构的不对称单元的ORTEP图,其显示了所采用的原子编号方案。非氢原子的各向异性原子位移椭球体以50%概率水平显示,氢原子显示为任意半径的球体。基于晶体1:1曲尼司特钾盐一水合物在100K下的单晶数据和结构计算的XRPD图谱示于图25中。还注意到,由于实验XRPD图谱是在室温下收集的,而计算的XRPD图谱示在100K下收集的数据导出的,因此在一些峰中存在一些小的温度偏移。由于优选的取向效应,在实验图谱中也存在小的强度差异。
表8
环境温度下1:1曲尼司特钾盐一水合物的第二SCXRD数据集。
在295K下测量的结构的单晶数据和结构细化参数记录在下表9中。
基于晶体1:1曲尼司特钾盐一水合物在295K下的单晶数据和结构计算的XRPD图谱示于图26中。可以看出,在这种情况下,在室温下收集的实验XRPD图谱(图23)和由295K下收集的数据得到的计算XRPD图谱之间具有良好的一致性。由于在实验图谱中存在优选的取向效应,存在小的强度差异。
表9
7.4结晶1:1曲尼司特钾盐一水合物的DSC
图27的差示扫描量热法(DSC)曲线显示峰最大值为185℃的宽吸热峰,接着是峰最大值为268℃的尖锐吸热峰。
7.5结晶1:1曲尼司特钾盐一水合物的TGA
图28的热重分析(TGA)曲线显示在105℃至170℃之间的重量损失为4.7%,其对应于一摩尔水。
7.6结晶1:1曲尼司特钾盐一水合物的红外光谱
结晶1:1曲尼司特钾盐一水合物的实验红外光谱示于图29中。在图29的实验红外光谱中鉴定的显著峰为1670、1583、1497、1422、1370、1292、1259、1222、1184、1155、1127、969、812、756、702、664、645、599、547、524和490cm
示例8:结晶曲尼司特二乙醇胺盐
8.1结晶1:1曲尼司特二乙醇胺盐的制备
将曲尼司特(150mg)和二乙醇胺(48mg)称重,置于玻璃小瓶中。向小瓶中加入甲醇(2ml)。将小瓶密封并摇动,直至所有固体溶解。除去瓶盖,并蒸发溶剂,得到无色结晶固体。将所得无色晶体在真空烘箱中在40℃下干燥过夜。
8.2结晶1:1曲尼司特二乙醇胺盐的XRPD表征
结晶1:1曲尼司特二乙醇胺盐的实验XRPD图谱示于图30中。表10列出了在图30的实验XRPD图谱中鉴定的峰的角度°2θ±0.2°2θ和d值。峰或相应的d值的整个列表或其子集可足以表征结晶盐,以及基本上类似于图30的XRPD图谱。例如,结晶1:1曲尼司特二乙醇胺盐可通过选自在7.5、11.8、12.5、16.8、18.5、19.1和19.9°2θ±0.2°2θ处的峰中的至少四个峰或其相应的d值来表征。
表10
8.3结晶1:1曲尼司特二乙醇胺盐的DSC
图31的差示扫描量热法(DSC)曲线显示峰最大值为155.5℃的单个吸热峰。
8.4结晶1:1曲尼司特二乙醇胺盐的TGA
图32的热重分析(TGA)曲线显示在约215℃开始的明显重量损失。
8.5结晶1:1曲尼司特二乙醇胺盐的红外光谱
结晶1:1曲尼司特二乙醇胺盐的实验红外光谱示于图33中。在图33的实验红外光谱中鉴定的显著峰为3289、2947、1652、1580、1494、1422、1363、1346、1266、1233、1186、1159、1137、1109、1090、1067、1035、1015、999、981、935、857、831、812、770、721、704、663、612、601、540和468cm
示例9:结晶曲尼司特乙醇胺盐
9.1结晶1:1曲尼司特乙醇胺盐的制备
将曲尼司特(150mg)和乙醇胺(28mg)称重,置于玻璃小瓶中。向小瓶中加入甲醇(2ml)。将小瓶密封并摇动,直至所有固体溶解。除去瓶盖,并蒸发溶剂,得到无色结晶固体。将所得无色晶体在真空烘箱中在40℃下干燥过夜。
9.2结晶1:1曲尼司特乙醇胺盐的XRPD表征
结晶1:1曲尼司特乙醇胺盐的实验XRPD图示于图34中。表11列出了在图34的实验XRPD图谱中鉴定的峰的角度°2θ±0.2°2θ和d值。峰或其相应的d值的整个列表或其子集可足以表征结晶盐,以及基本上类似于图34的XRPD图谱。例如,结晶1:1曲尼司特乙醇胺盐可通过选自在10.4、11.4、12.2、14.5、15.8、19.5和20.4°2θ±0.2°2θ处的峰中的至少四个峰或其相应的d值来表征。
表11
9.3 1:1曲尼司特乙醇胺盐的SCXRD表征
用于单晶结构测定的晶体选自如上所述制备的一批晶体。单晶数据和结构细化参数记录在下表12中。图35显示了来自1:1曲尼司特乙醇胺盐的结晶结构的不对称单元的ORTEP图,显示了所采用的原子编号方案。非氢原子的各向异性原子位移椭球体以50%概率水平显示,氢原子显示为任意半径的球体。基于1:1曲尼司特乙醇胺盐在293K下的单晶数据和结构计算的XRPD图谱示于图36中。可以看出,在这种情况下,在室温下收集的实验XRPD图谱(图34)和由在293K下收集的数据得到的计算XRPD图之间具有良好的一致性。由于在实验图谱中存在优选的取向效应,存在小的强度差异。
表12
9.4结晶1:1曲尼司特乙醇胺盐的DSC
图37的差示扫描量热法(DSC)曲线显示峰最大值为158.3℃的尖锐吸热峰。
9.5结晶1:1曲尼司特乙醇胺盐的TGA
图38的热重分析(TGA)曲线显示在160℃之前没有明显的重量损失。
9.6结晶1:1曲尼司特乙醇胺盐的红外光谱
结晶1:1曲尼司特N-甲基葡糖胺I型盐的实验红外光谱示于图39。在图39的实验红外光谱中鉴定的显著峰为3154、1668、1611、1585、1496、1438、1375、1359、1336、1323、1293、1277、1255、1232、1161、1131、1072、1017、997、955、842、806、765、750、692、664、599、549和527cm
示例10:固态加速稳定性研究
进行研究以检查1:1结晶曲尼司特盐在加速条件下随时间的固体形式转化或潮解的物理稳定性。结晶1:1曲尼司特L-赖氨酸盐、结晶1:1曲尼司特N-乙基葡糖胺盐、结晶1:1曲尼司特钾盐一水合物、结晶1:1曲尼司特二乙胺盐、结晶1:1曲尼司特二乙醇胺盐和结晶1:1曲尼司特乙醇胺盐各50mg,分别置于40℃和75%相对湿度的密封容器中,并在这些条件下储存7天。此后,所有样品保持为固体,没有潮解迹象。通过XRPD分析每个样品,以观察任何可能的形式变化。XRPD分析表明,所有的样品都保留其原始晶体形式,并且本发明的结晶曲尼司特盐在这些条件下都没有发生固体形式的转化。
示例11:溶液光稳定性研究
已知曲尼司特一旦溶解于溶液中就是光化学不稳定的,在UV暴露后转化成顺式异构体和二聚体形式(N.Hori,Chem Pharm Bull.1999;47:1713-1716)。因此,决定研究1:1曲尼司特N-甲基葡糖胺II型盐、1:1曲尼司特N-乙基葡糖胺盐、1:1曲尼司特L-赖氨酸盐和1:1曲尼司特二乙胺盐一旦溶解于溶液中的光稳定性,以观察这些形式是否还会显示溶液降解的迹象。将所研究的四种盐形式的2mg样品各自称重,置于透明玻璃小瓶中。将各样品溶于水(1ml)中。将小瓶放入Vindon Scientific Photostability室中,并用UV光照射(平均Klux=13.9(13.9Lux/h),平均UV W/m
表13
表14
从表13可以看出,即使在2小时后,所有四种曲尼司特盐已经开始显示出降解的迹象,其中在24小时后每种溶液中仅残留了低水平的曲尼司特。这些结果证实这些曲尼司特盐不适于在溶液中储存。
示例12:固态光稳定性研究
已知虽然纯结晶曲尼司特以固体形式是光稳定的,但API的一些其它固体形式不是光稳定的(S.Onoue,Eur J Pharm Sci.2010;39:256-262)。因此,进行研究以确定结晶的1:1N-甲基葡糖胺II型盐、结晶1:1曲尼司特N-乙基葡糖胺盐、结晶1:1曲尼司特L-赖氨酸盐和结晶1:1曲尼司特二乙胺盐的固态光稳定性,以观察它们在以其固体形式储存期间是否将保持光稳定性。将所研究的每种曲尼司特形式的6-10mg样品铺展在透明玻璃小瓶的底面上。将小瓶放入Vindon Scientific Photostability柜中,并用UV光照射(平均Klux=18.2(18.2Lux/小时),平均UV值=2.55瓦/分钟,温度=31.0-32.0℃)。在2、6和24小时使用HPLC测定每个样品中仍未降解为顺式异构体、二聚体或任何其他降解产物的曲尼司特残留百分比。所用的HPLC方法描述于表13中。该研究的结果示于表15中。从表15可以看出,在固态结晶1:1N-甲基葡糖胺II型盐、结晶1:1曲尼司特N-二乙基葡糖胺、结晶1:1曲尼司特L-赖氨酸和结晶1:1曲尼司特二乙胺在这些条件下都是光稳定的,没有任何光降解迹象。这些综合结果表明,虽然在溶液中储存这些曲尼司特盐将导致可忽略的光降解,但以其结晶形式储存应不存在光稳定性问题。
表15
示例13:水溶性研究
曲尼司特几乎不溶于水(14.5μg/ml)(Society of JapanesePharmacopoeia.2002),且美国专利5356620指出曲尼司特的药学上可接受的盐太不溶于水以至于不能制备水溶液。曲尼司特钠盐也作为先前文献中所述的曲尼司特的唯一药学上可接受的盐(N Geng,Cryst.Growth Des.2013;13:3546-3553),并且该出版物的作者描述了这种盐如何具有比纯曲尼司特更低的表观溶解性,不可能预测本申请中公开的曲尼司特的新结晶盐形式是否具有比结晶曲尼司特更高或更低的水溶性。因此,进行研究以测定结晶1:1N-甲基葡糖胺I型盐、结晶1:1N-甲基葡糖胺II型盐、结晶1:1曲尼司特N-乙基葡糖胺盐、结晶1:1曲尼司特L-赖氨酸盐、结晶1:1曲尼司特钾盐一水合物、结晶1:1曲尼司特二乙胺盐、结晶1:1曲尼司特二乙醇胺盐和结晶1:1曲尼司特乙醇胺盐在水中的水溶性。加入水(0.5ml,pH 7.0)以增加每种盐的量,并在25℃下振荡所得浆液。如果观察到所有固体溶解,则再加入少量等分的相关盐,直到摇动一小时后固体颗粒仍然保持不溶解。将浆液振荡24小时以检查已经达到饱和点。在总共加入500mg I或II型的结晶1:1曲尼司特N-甲基葡糖胺盐后,仍未达到饱和点,因此,将这些溶液静置24小时,以观察是否会发生任何沉淀。24小时后,1:1曲尼司特N-甲基葡糖胺I和II型均仍保留在溶液中,因此可以理解,1:1曲尼司特N-甲基胺盐的两种多晶型物的水溶性均大于1000mg/ml。1:1曲尼司特N-乙基葡糖胺、1:1曲尼司特L-赖氨酸、1:1曲尼司特钾一水合物、1:1曲尼司特二乙胺、1:1曲尼司特二乙醇胺和1:1曲尼司特乙醇胺在24小时后均保持为悬浮液。表16显示了以溶解的曲尼司特的质量计的溶解性研究的结果。可以看出,本发明的所有1:1结晶盐都比纯曲尼司特更易溶。还可以看出,用1:1曲尼司特二乙胺盐检测的盐的溶解性有很大差异,仅显示出18-20mg/ml的溶解性,而1:1曲尼司特N-甲基葡糖胺的多晶型物I和II均显示出>626mg/ml的溶解性。
表16
考虑到本发明的许多结晶曲尼司特盐的出乎意料的高水溶性,可以预期许多这些盐形式可用于制备用于原位递送至患者的曲尼司特的即时高剂量液体制剂。
示例14:溶解研究
对于BCS II类药物(诸如曲尼司特),在胃肠介质中使用的药物形式的溶解速率可以是整体吸收的控制因素,从而控制口服药物的生物利用度。这随着药物剂量的增加变得更具影响力。对于成功治疗可能需要较高剂量的曲尼司特的病症(诸如纤维化或癌症),寻找具有高溶解速率的曲尼司特形式非常重要。因此,进行研究以检查结晶1:1曲尼司特N-甲基葡糖胺II型盐、结晶1:1曲尼司特N-乙基葡糖胺盐、结晶1:1曲尼司特L-赖氨酸盐、结晶1:1曲尼司特钾盐一水合物、1:1曲尼司特二乙胺盐、1:1曲尼司特二乙醇胺盐和1:1曲尼司特乙醇胺盐的溶解速率,与市售形式的曲尼司特
研究结果示于图40中。可以看出,结晶1:1曲尼司特N-甲基葡糖胺II型盐、结晶1:1曲尼司特N-乙基葡糖胺盐、结晶1:1曲尼司特L-赖氨酸盐、结晶1:1曲尼司特钾盐一水合物、结晶1:1曲尼司特二乙醇胺盐和结晶1:1曲尼司特乙醇胺盐在30秒内实现完全溶解,表明在这种生物相关介质中几乎是瞬时溶解的,并保持了超过20分钟的这种高溶解性。新型结晶1:1曲尼司特盐形式中的六种在30秒内已完全溶解,而当前市售形式的曲尼司特
美国专利9,512,064 B2公开了各种曲尼司特共晶,包含1:1的曲尼司特烟酰胺共晶。如美国专利9,512,064 B2的示例10和图32中的溶解研究所示,1:1的烟酰胺共晶具有所公开的共晶的最佳溶解曲线,所有这些均优于结晶曲尼司特。因此,在该溶解性研究中选择结晶1:1曲尼司特烟酰胺共晶作为与本发明结晶盐的对比。从图40可以看出,虽然1:1曲尼司特烟酰胺共晶在30秒内达到2.7mg/ml的最大溶解性,但快速发生沉淀,5分钟后溶解性降至1.95mg/ml,然后在20分钟内进一步降至1.7mg/ml。尽管该1:1曲尼司特烟酰胺共晶在该生物相关介质中在前几分钟内与
由于本发明还涉及制备用于(例如,作为可注射制剂、液体口服制剂或雾化吸入制剂)递送的曲尼司特的液体药物制剂的方法,因此还进行研究以探索本发明的结晶曲尼司特盐在合适的介质中的溶解速率。由于液体药物制剂通常在床边原位配制用于立即递送,因此重要的是这些曲尼司特的新固体形式几乎立即溶解,以使其适用于液体药物制剂。虽然液体口服制剂可以通过在给药前简单地将药物溶解于水中来实现(新型结晶曲尼司特盐的高水溶性将使其成为可能),但是用于吸入或静脉内递送的液体制剂需要溶解介质是等渗的。这通常通过使用盐水(0.9%氯化钠水溶液)作为液体制剂介质来实现。然而,考虑到1:1曲尼司特钠盐的溶解性极低,盐水与曲尼司特不相容,因为1:1曲尼司特钠盐的形成和随后从溶液中沉淀的可能性很高。适用于制备用于吸入或静脉内施用的液体药物制剂的替代等渗介质为5%右旋糖水溶液。因此进行研究以检查结晶1:1曲尼司特N-甲基葡糖胺II型盐、结晶1:1曲尼司特N-乙基葡糖胺盐、结晶1:1曲尼司特L-赖氨酸盐、结晶1:1曲尼司特钾盐一水合物、1:1曲尼司特二乙胺盐、1:1曲尼司特二乙醇胺盐和1:1曲尼司特乙醇胺盐在50ml 5%葡萄糖水溶液中的溶解速率,与结晶曲尼司特相比,所用每种曲尼司特形式的量相当于200mg曲尼司特。该研究的结果可见于图41。可以看出,结晶1:1曲尼司特N-甲基葡糖胺II型盐、结晶1:1曲尼司特N-乙基葡糖胺盐、结晶1:1曲尼司特L-赖氨酸盐、结晶1:1曲尼司特钾盐一水合物、结晶1:1曲尼司特二乙醇胺盐和结晶的1:1曲尼司特乙醇胺盐在不到1分钟内实现完全溶解,在90分钟后保持该相同的溶解水平,使其成为适于制备用于立即递送的曲尼司特的液体药物制剂候选物。相反,纯结晶曲尼司特在1分钟之后仅达到1μg/ml的溶解性,并且在1小时之后仅达到60μg/ml。
- 结晶曲尼司特盐及其药物用途
- 异色满基化合物的盐及其结晶形式、制备方法、治疗用途和药物组合物
