基于双抗体夹心均相化学发光法猪瘟病毒检测试剂盒及其制备方法和应用
文献发布时间:2023-06-19 09:38:30
技术领域
本发明属于生物诊断试剂技术领域,尤其涉及基于一种基于双抗体夹心化学发发光法猪瘟病毒检测试剂盒和应用。
背景技术
猪瘟(Classical swine fever,CSF或Hog cholera,HC),又称经典猪瘟或古典猪瘟,是猪的一种高传染性疾病。猪瘟会导致患病猪发烧、厌食、腹泻、死亡等,并可能伴有神经症状。母猪可能会流产或产下死猪崽。猪瘟为世界动物卫生组织所列的A类中16种法定传染病之一。古典猪瘟病毒(Classical swine fevervirus,CSFV)为黄病毒科瘟疫病毒属。同属的病毒还有感染反刍动物的牛病毒性腹泻病毒(Bovine Viral Diarrhoeavirus,BVDV)及羊的边界病病毒(Border Disease virus,BDV)。猪是古典猪瘟病毒的唯一宿主和传播源。受到感染的猪在发病前和发病期间都会排毒。
CSFV为有囊膜病毒,40-60nm,单股正链RNA。CSFV基因组长约123kb,仅含有一个大的开放性阅读框架(ORF),此ORF翻译成含3898个氨基酸残基,分子量约438kDa的多聚蛋白,并进一步在病毒和宿主细胞蛋白酶的作用下加工为成熟蛋白。CSFV的所有结构蛋白和非结构蛋白均由该ORF所编码,ORF两侧是5’-端非翻译区(5’-UTR)和3’-端非翻译区(3’-UTR),且5’-端无帽子结构,3’-端无poly(A)尾巴。这一大前体蛋白以共翻译和后翻译的形式在细胞蛋白酶和病毒特异蛋白酶作用下,加工成结构蛋白和非结构蛋白,其结构蛋白和非结构蛋白在病毒RNA上的编码顺序为Npro、c、Erns(E0)、E1、E2、 P7、NS2-3、NS4A、NS4B、NS5A、NS5B。NS2-3可被加工成NS2、NS3(P80),除c、E0、E1和E2为结构蛋白外.其余均为非结构蛋白。
E2为CSFV的囊膜糖蛋白,是病毒主要的抗原蛋白,也是三个病毒糖蛋白中保守性最低.最易变异的分子。E2常以100kDa的同源二聚体及与E1形成 75kDa的异源二聚体形式存在于病毒粒子及CSFV感染的细胞表面。在体外E2 可诱导产生病毒的中和抗体,体内可诱导产生抗CSFV的攻击的抗体。E2的蛋白骨架由370个氨基酸(ORF编码的690-1060氨基酸残基)组成.并以其c端的40个疏水氨基酸锚定在膜上。由于糖基化程度不同。E2的分子量可为51-58kDa。E2分子内的15个Cys残基在属内均保守,其中N端6个Cys残基参与抗原结构域的形成,c端9个Cys残基则参与同源、异源二聚体的形成。因此,猪瘟E2蛋白可作为防治和检测猪瘟的一种靶蛋白。
国内外许多实验室已经研发出许多猪瘟病毒的检测方法,例如酶联免疫吸附实验法,胶体金免疫层析法,荧光免疫层析法等等。荧光PCR检测方法耗时耗力;胶体金和荧光免疫层析法属于定性和半定量检测,结果准确度不高。迫切需要精准、快速的检测产品,化学发光法是最好的选择,但磁微粒化学发光成本较高,且对仪器设备的要求就高,因此均相化学发光技术是一个合适的选择。该技术与荧光PCR检测方法相比,操作简单,反应时间短,该方法敏感性与精确度好,检测范围广。
发明内容
本发明的目的是为了解决当前市场上猪瘟病毒诊断试剂存在的成本高、耗时长、精度低等问题,从而提出的一种双抗体夹心均相化学发光法猪瘟病毒检测试剂盒。
因此,本发明一方面提供了一种双抗体夹心均相化学发光法猪瘟病毒检测试剂盒,所述的试剂盒包括试剂R1、试剂R2、试剂R3、阳性对照和阴性对照,其中:所述试剂R1包括标记链霉亲和素的供体微球的缓冲液,所述供体微球能够在680nm光下激发产生单体氧;所述试剂R2包括标记抗猪瘟病毒单克隆抗体的受体微球的缓冲液,所述受体微球能够与单体氧反应生成可检测的615nm 化学发光信号;所述试剂R3为生物素化的抗猪瘟病毒单克隆抗体的缓冲液。
优选地,本发明所述的试剂R2中标记抗猪瘟病毒单克隆抗体的受体微球为标记抗猪瘟病毒E2蛋白单克隆抗体的受体微球,所述的缓冲液为0.01M PBS缓冲液、2%BSA、0.1%Proclin 300、5%蔗糖、0.1%Tween-20,其余为纯化水,pH 为7.2。
优选地,本发明所述的试剂R3中生物素化的抗猪瘟病毒单克隆抗体为生物素化的抗猪瘟病毒E2蛋白的单克隆抗体,所述生物素化的抗猪瘟病毒E2蛋白的单克隆抗体的浓度为0.5μg/mL,所述的缓冲液为0.01M PBS缓冲液、2% BSA、0.1%Proclin 300、5%蔗糖、0.1%Tween-20,其余为纯化水,pH为7.2。
优选地,本发明所述的阳性对照为灭活的猪瘟病毒荧光PCR CT值在25±1 之间的猪血清;所述阴性对照为灭活的猪瘟病毒荧光PCR无CT值的猪血清。
优选地,本发明所述的供体微球和受体微球的直径均为150nm。
优选地,本发明所述的试剂R1中供体微球的浓度为5μg/mL;所述的试剂 R2中受体微球的浓度为2μg/mL。
优选地,本发明所述试剂R1的缓冲液组分为0.01M PBS缓冲液、2%BSA、 0.1%Proclin 300、0.1%Tween-20,其余为纯化水,pH值为7.2。
另一方面,本发明还还提供了一种制备所述试剂盒的方法,所述方法包括以下步骤:
1)试剂R1制备:
a)供体微球准备:量取10mg 150nm的供体微球和1mg链霉亲和素,迅速混匀,再加入pH值为6.0的0.05M MES缓冲液调节供体微球浓度至 10mg/mL;b)反应:加入100μLpH值为6.0的0.05M MES配制的50mg/mL 的NaBH3CN溶液,迅速混匀,室温旋转反应12~16h;c)封闭:加入pH值为6.0的0.05M MES缓冲液配制的浓度为100mg/mL的BSA溶液,其与反应液体积比为1:4,迅速混匀,室温旋转反应3小时;d)清洗:反应好的溶液4℃ 12000rpm离心60min,弃去上清,加入2mLpH值为6.0的0.05M MES缓冲液超声悬浮,再次离心,弃去上清,最后用0.01M PBS缓冲液、2%BSA、0.1%Proclin 300、0.1%Tween-20,其余为纯化水,pH值为7.2的缓冲液溶解清洗好的供体微球,使其终浓度为5μg/mL,超声分散后置于4℃保存备用;
2)试剂R2制备:
a)受体微球准备:量取10mg 150nm的受体微球和2mg的抗猪瘟病毒E2 蛋白单克隆抗体,迅速混匀,再加入pH值为6.0的0.05M MES缓冲液调节受体微球浓度至10mg/mL;b)反应:加入100μL的pH值为6.0的0.05M MES 配制的浓度为50mg/mL的NaBH3CN溶液,混匀,室温旋转反应12~16h;c) 封闭:加入pH值为6.0的0.05M MES配制的浓度为100mg/mL的BSA溶液进行封闭,其与反应液体积比为1:4,迅速混匀,室温旋转反应3小时;d)清洗:反应好的溶液4℃12000rpm离心60min,弃去上清,加入2mLpH值为6.0的 0.05M MES缓冲液超声悬浮,再次离心,弃去上清,最后用0.01M PBS缓冲液、 2%BSA、0.1%Proclin 300、5%蔗糖、0.1%Tween-20,其余为纯化水,pH为7.2 的缓冲液溶解上述步骤中制备的受体微球,使其终浓度为2μg/ml,超声分散后置于4℃保存备用;
3)试剂R3制备
a)生物素活化:量取1mg生物素加入到100μL DMF溶液中并充分混匀,再用PBS溶液定容到0.5mL,准确称取EDC 2mg,加入该溶液中,室温活化1h; b)反应:量取一定量的抗猪瘟病毒E2蛋白单克隆抗体于PBS溶液中4℃过夜透析,测定抗体浓度并调节至2mg/mL,将活化好的生物素溶液加入抗猪瘟病毒 E2蛋白单克隆抗体溶液中,充分混匀并在室温反应6h;c)纯化:将生物素化抗猪瘟病毒E2蛋白单克隆抗体溶液加入载留分子量为10KD的透析袋中,用PBS 溶液作为缓冲液,在4℃透析24小时,取样测定抗体浓度,将质检合格的生物素化抗猪瘟病毒E2蛋白单克隆抗体浓度用0.01M PBS缓冲液、2%BSA、0.1% Proclin 300、5%蔗糖、0.1%Tween-20,其余为纯化水,pH为7.2的缓冲液调节至0.5μg/mL,4℃保存备用。
再一方面,本发明还提供了一种使用所述的猪瘟病毒检测试剂盒的检测方法,其特征在于,所述方法包括以下步骤:
1)将检测样品或者阳性对照或者阴性对照与试剂R1、试剂R2、试剂R3 按照体积比为10μL:30μL:30μL:30μL的量混合,混合液置于37℃下避光温育10min;
2)在温育后,立即通过光电倍增管检测该溶液的化学发光信号,检测时间 3s,记录阳性对照、阴性对照和样本的化学发光值;
3)根据化学发光值,计算S/P值,其中S/P值=(样品化学发光值-阴性对照化学发光值)/(阳性对照化学发光值-阴性对照化学发光值);当S/P值≥0.4 时,判为猪瘟病毒阳性;当S/P值<0.4时,判为猪瘟病毒阴性。
再一方面,本发明还提供了一种所述的试剂盒在检测猪瘟病毒中的应用。
本发明所述供体微球能够在激发状态产生活性氧;所述受体微球能够与活性氧反应生成可检测的化学发光信号(供体微球和受体微球在分散状态下是不能发出化学发光信号,只有两者临近时才能发出可以检测的化学发光信号)。因此在检测时不需要清洗和分离,可以直接检测化学发光信号,从而实现猪瘟病毒的检测。另外,本发明的试剂盒10min内即可完成抗体检测,且本发明的试剂盒的特异性、敏感性、重复性都很好。另外,本发明所述的试剂盒既可以应用于管式化学发光,也可以应用于板式化学发光。当然,在现有发明的基础上删除链霉亲和素-生物素系统,也应属于本发明的保护范围之内。
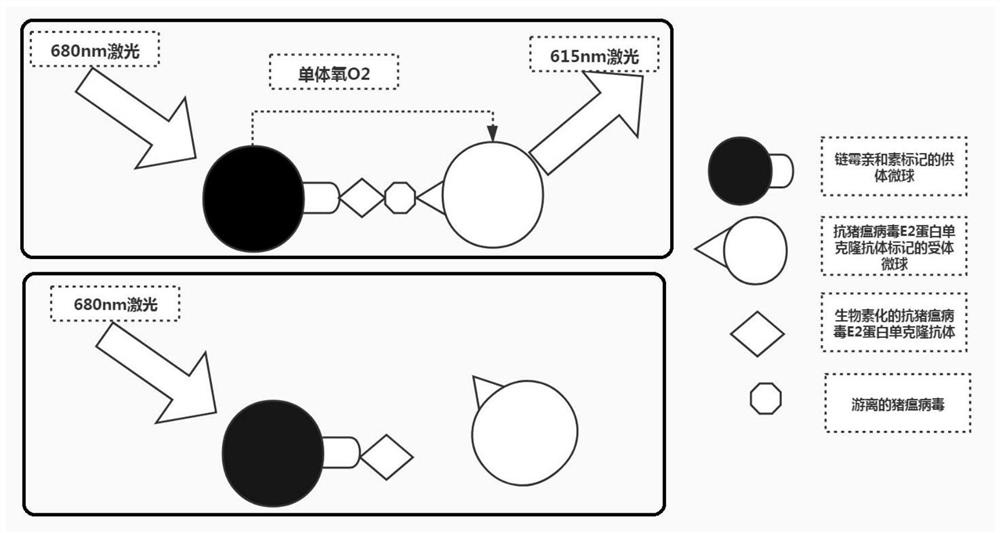
基于竞争法的猪瘟病毒均相化学发光检测反应体系中,包含标记链酶亲和素的供体微球,标记抗猪瘟病毒E2蛋白单克隆抗体的受体微球,生物素化的抗猪瘟病毒E2蛋白单克隆抗体。采用双抗体夹心法(两株抗体识别不同的抗原位点)检测样品中的猪瘟病毒时,当样品中存在猪瘟病毒时,待测样品池中的生物素化抗猪瘟病毒E2蛋白单克隆抗体能够与猪瘟病毒结合,再与标记抗猪瘟病毒E2蛋白单克隆抗体的单克隆抗体的受体微球结合,然后生物素能与链霉亲和素的供体微球结合,最后形成链霉亲和素标记的受体微球-生物素化抗猪瘟病毒 E2蛋白-猪瘟病毒-标记抗猪瘟病毒E2蛋白的供体微球这样一个复合体,激光 (680nm)的照射下,供体微球上的光敏剂将周围环境中的氧气转化为更为活跃的单体氧,单体氧扩散至受体微球,与其上的化学发光剂反应,进一步激活了同样在受体微球上的发光基团,使之产生化学发光,波长为615nm,此时发光值最高,单体氧在其4μs的半衰期内可扩散的距离为200nm左右,光信号可被高通量化学发光检测仪检测到;如果不存在抗原抗体的特异性反应,也就说如果未形成链霉亲和素标记的受体微球-生物素化抗猪瘟病毒E2蛋白单克隆抗体- 猪瘟病毒-标记抗猪瘟病毒E2蛋白单克隆抗体的供体微球的复合体,单体氧将无法扩散至距离较远的受体微球,则不会产生化学发光作用。双抗体夹心均相化学发光检测猪瘟病毒的原理如图1所示。
本发明使用的两株单克隆抗体均为抗猪瘟病毒E2蛋白的单克隆抗体,作为本领域的技术人员来说,替换其它的抗猪瘟病毒的单克隆抗体的相似方案也在本发明的保护范围之内。
附图说明
图1:双抗体夹心均相化学发光猪瘟病毒检测试剂盒原理图。
图2:猪瘟病毒E2蛋白标准曲线图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明中的一部分实施例,而不是全部的实施例。
本发明所涉及的化学试剂均为国产试剂。猪瘟病毒E2蛋白由浙江海隆生物科技有限公司惠赠。两种抗猪瘟病毒单克隆抗体均由杭州洪晟惠赠。供体微球和受体微球由杭州洪桥中科基因技术有限公司惠赠。链霉亲和素及生物素购自北京索莱宝公司。
实施例1双抗夹心均相化学发光法猪瘟病毒检测试剂盒的建立
1试剂R1制备:
a)供体微球准备:量取10mg 150nm的供体微球和1mg链霉亲和素,迅速混匀,再加入pH值为6.0的0.05M MES缓冲液调节供体微球浓度至 10mg/mL;b)反应:加入100μLpH值为6.0的0.05M MES配制的50mg/mL 的NaBH3CN溶液,迅速混匀,室温旋转反应12~16h;c)封闭:加入pH值为6.0的0.05M MES缓冲液配制的浓度为100mg/mL的BSA溶液,其与反应液体积比为1:4,迅速混匀,室温旋转反应3小时;d)清洗:反应好的溶液4℃ 12000rpm离心60min,弃去上清,加入2mLpH值为6.0的0.05M MES缓冲液超声悬浮,再次离心,弃去上清,最后用0.01M PBS缓冲液、2%BSA、0.1%Proclin 300、0.1%Tween-20,其余为纯化水,pH值为7.2的缓冲液溶解清洗好的供体微球,使其终浓度为5μg/mL,超声分散后置于4℃保存备用;
2试剂R2制备:
a)受体微球准备:量取10mg 150nm的受体微球和2mg的抗猪瘟病毒E2 蛋白单克隆抗体,迅速混匀,再加入pH值为6.0的0.05M MES缓冲液调节受体微球浓度至10mg/mL;b)反应:加入100μL的pH值为6.0的0.05M MES 配制的浓度为50mg/mL的NaBH3CN溶液,混匀,室温旋转反应12~16h;c) 封闭:加入pH值为6.0的0.05M MES配制的浓度为100mg/mL的BSA溶液进行封闭,其与反应液体积比为1:4,迅速混匀,室温旋转反应3小时;d)清洗:反应好的溶液4℃12000rpm离心60min,弃去上清,加入2mLpH值为6.0的 0.05M MES缓冲液超声悬浮,再次离心,弃去上清,最后用0.01M PBS缓冲液、 2%BSA、0.1%Proclin 300、5%蔗糖、0.1%Tween-20,其余为纯化水,pH为7.2 的缓冲液溶解上述步骤中制备的受体微球,使其终浓度为2μg/ml,超声分散后置于4℃保存备用;
3试剂R3制备
a)生物素活化:量取1mg生物素加入到100μL DMF溶液中并充分混匀,再用PBS溶液定容到0.5mL,准确称取EDC 2mg,加入该溶液中,室温活化1h; b)反应:量取一定量的抗猪瘟病毒E2蛋白单克隆抗体于PBS溶液中4℃过夜透析,测定抗体浓度并调节至2mg/mL,将活化好的生物素溶液加入抗猪瘟病毒 E2蛋白单克隆抗体溶液中,充分混匀并在室温反应6h;c)纯化:将生物素化抗猪瘟病毒E2蛋白单克隆抗体溶液加入载留分子量为10KD的透析袋中,用PBS 溶液作为缓冲液,在4℃透析24小时,取样测定抗体浓度,将质检合格的生物素化抗猪瘟病毒E2蛋白单克隆抗体浓度用0.01M PBS缓冲液、2%BSA、0.1%Proclin 300、5%蔗糖、0.1%Tween-20,其余为纯化水,pH为7.2的缓冲液调节至0.5μg/mL,4℃保存备用。
4、阳性对照与阴性对照制备
(1)阳性对照
免疫用仔猪的筛选:选择28日龄仔猪采血进行下列抗原筛查,挑选符合如下标准的抗原阴性仔猪作为健康仔猪。标准为:猪流行性腹泻病毒:荧光PCR 试剂盒检测阴性;猪口蹄疫病毒(O型):荧光PCR检测试剂盒检测阴性;猪传染性胃肠炎病毒:荧光PCR检测试剂盒检测阴性;猪瘟病毒:荧光PCR检测试剂盒检测阴性;猪伪狂犬病毒:荧光PCR检测试剂盒检测阴性;猪圆环病毒:荧光PCR检测试剂盒检测阴性;猪繁殖与呼吸综合征病毒:荧光PCR检测试剂盒检测阴性。所述试剂盒均购自广州达安基因。
攻毒方法:取健康仔猪3头,颈部肌肉多点注射猪瘟病毒(浙江诗华诺倍威生物惠赠)。
血清测定:攻毒每隔7日进行采血,采用荧光PCR检测,当CT值大于20 时采血,分离血清,4℃保存待检。
阳性血清的制备:对满足条件的实验猪进行颈动脉放血,每头猪的血液保存在一个灭菌的三角烧瓶中,将析出的血清转移到离心瓶中,3,000r/min离心5 分钟,取上清,上清56℃灭活30min后将上清混匀后0.22μm滤膜过滤除菌。定量分装,1mL/瓶,标记为“阳性血清”,注明收获日期和批号等,之后进行性状检验、无菌检验、特异性及荧光PCR测定,检验合格后封口后置-20℃以下保存。
阳性对照制备:用含2%BSA的PBST缓冲液(含0.1%的Proclin300)将检验合格的阳性血清稀释成1:50、1:100、1:200、1:400共4个稀释度,各稀释度均用应该PCR进行检测,选择CT值在25±1的最高稀释倍数,用2%BSA的 PBST缓冲液(含0.1%的Proclin300)按该稀释倍数将阳性血清进行稀释,混合均匀,用0.22μm滤膜过滤除菌,定量分装(1mL/管、3mL/管),置﹣20℃以下保存备用。
(2)阴性对照
阴性猪的筛查:选择28日龄仔猪采血进行下列抗原筛查,挑选符合如下标准的阴性仔猪作为健康仔猪。标准为:猪流行性腹泻病毒:荧光PCR试剂盒检测阴性;猪口蹄疫病毒(O型):荧光PCR检测试剂盒检测阴性;猪传染性胃肠炎病毒:荧光PCR检测试剂盒检测阴性;猪瘟病毒:荧光PCR检测试剂盒检测阴性;猪伪狂犬病毒:荧光PCR检测试剂盒检测阴性;猪圆环病毒:荧光PCR 检测试剂盒检测阴性;猪繁殖与呼吸综合征病毒:荧光PCR检测试剂盒检测阴性。
测定:各实验猪采血分离血清,用荧光PCR检测,如无CT值,则将猪用于阴性对照制备。
阴性对照制备:对猪进行颈动脉放血致死,血液置于灭菌洁净的三角烧瓶中,将析出的血清转移到离心瓶中,3,000r/min离心5分钟,取上清,将上清混匀后在56℃灭活30min,然后用0.22μm滤膜过滤除菌,并加入0.1%的 Proclin300。定量分装(1mL/管、3mL/管),注明批号、收获日期等,置﹣20℃以下保存备用。
5使用1-4制备的试剂盒检测猪瘟病毒的方法,所述方法包括以下步骤:
1)将检测样品或者阳性对照或者阴性对照与试剂R1、试剂R2、试剂R3 按照体积比为10μL:30μL:30μL:30μL的量混合,混合液置于37℃下避光温育10min;
2)在温育后,立即通过光电倍增管检测该溶液的化学发光信号,检测时间 3s,记录阳性对照、阴性对照和样本的化学发光值;
3)根据化学发光值,计算S/P值,其中S/P值=(样品化学发光值-阴性对照化学发光值)/(阳性对照化学发光值-阴性对照化学发光值);当S/P值≥0.4 时,判为猪瘟病毒阳性;当S/P值<0.4时,判为猪瘟病毒阴性。
实施例2双抗体夹心均相化学发光法猪瘟病毒检测试剂盒校准品的制备与检测
(1)猪瘟病毒E2蛋白校准品用含2%BSA、0.1Proclin的PBS(0.01mol/L pH7.4)缓冲液进行倍比稀释,将猪瘟病毒E2蛋白校准品母液稀释到检测所需用的各个梯度浓度(0ng/mL、2ng/mL、5ng/mL、25ng/mL、100ng/mL、500ng/mL、 3000ng/mL)。
(2)于反应管内添加校准品、试剂R1、试剂R2、试剂R3,置于恒温振荡器中,在37℃温度条件下进行避光温育10min。
(3)在温育后,立即通过光电倍增管检测该溶液的化学发光信号,检测时间3s,记录各校准品的化学发光值,并将校准品浓度作横坐标、发光值作为纵坐标作图,其标准曲线如图2所示。从结果来看,标准曲线很好,最低检测限能达到2ng/mL,且该试剂盒的线性范围很好。
实施例3双抗体夹心均相化学发光法猪瘟病毒检测试剂盒的性能验证
(1)特异性实验
用实施例1建立的试剂盒分别检测PPV、PRV、CSFV、PRRSV阳性血清各 1份,大肠杆菌阳性血清2份,同时使用商品化的猪瘟病毒荧光PCR检测试剂盒(购自广州达安基因)进行平行检测,验证本方法的特异性。
建立的试剂盒检测PPV、PRV、CSFV、PRRSV、大肠杆菌阳性血清均为阴性,S/P值均小于0.2,无交叉反应,试剂盒特异性良好。与商品化的猪瘟病毒检测试剂盒检测结果一致。
(2)敏感性试验
将阳性质控样本用PBST按1:10、1:100、1:1000、1:10000、1:100000、 1:1000000稀释,分别用实施例1建立的试剂盒以及商品化猪瘟病毒荧光PCR 检测试剂盒进行检测,验证建立方法的敏感性。
建立的试剂盒检测到最大稀释倍数为1:100000的阳性质控样品,市售的商品化猪瘟病毒检测试剂盒也能检测到1:100000倍稀释的阳性质控样品。这说明该试剂盒的敏感性与该商品化试剂盒基本一致。
(3)重复性试验
按照实施例1制备的3批试剂盒并按照其检测方法对已知强阳性血清、阳性血清、弱阳性血清和阴性血清(各5份)进行重复性检验,计算批内变异系数;再从3批试剂盒中按批次分别各随机挑选出2个试剂盒,每个试剂盒分别对已知强阳性血清、阳性血清、弱阳性血清和阴性血清进行重复性检验,计算批间变异系数。结果显示,3批试剂盒对阳性血清检测结果批内变异系数在3%~ 7%,批间变异系数在5%~9%;对阴性血清检测结果批内变异系数在6%~11%,批间变异系数在7%~12%。实验结果表明试剂盒的重复性良好。
实施例3双抗体夹心均相化学发光法猪瘟病毒检测试剂盒的比对试验
(1)将1220份待检测样本、阳性对照、阴性对照分别于反应管内与试剂 R1、试剂R2、试剂盒R3按照体积比为10μL:30μL:30μL:30μL的量混合,置于恒温振荡器中,在37℃温度条件下进行避光温育10min。
(2)温育完成后,立即通过光电倍增管检测该溶液的化学发光信号,检测时间3s,记录各样品的发光值。
(3)根据化学发光值,计算S/P值,其中S/P值=(样品化学发光值-阴性对照化学发光值)/(阳性对照化学发光值-阴性对照化学发光值);当S/P值≥ 0.4时,判为猪瘟病毒阳性;当S/P值<0.4时,判为猪瘟病毒阴性。
(4)将1220份待检测的样本用市售的商品化荧光PCR试剂盒(购自广州达安基因)进行检测,其检测方法及检测标准按照试剂盒说明书严格操作。检测结果并做详细记录。
(5)将发明中的双抗体夹心均相化学放光猪瘟病毒试剂盒的检测结果与市售的猪瘟病毒荧光PCR试剂盒的检测结果进行对比分析。
本发明中的双抗体夹心均相化学发光猪瘟病毒检测试剂盒检测样品,其检测结果与PCR检测结果的阳性符合率为151/160=94.4%,阴性符合率为 1060/1060=100%,总符合率为99.3%。本发明的双抗体夹心均相化学发光猪瘟病毒检测试剂盒与荧光PCR的符合率很高。
综上所述,本发明的试剂盒操作简单,可以在10分钟左右出检测报告,大大缩短了临床检验标本周转时间,适合兽医急诊检测需求。使用本发明的试剂盒在双抗体夹心均相化学发光免疫竞争法的基础上检测猪瘟病毒,其结果准确,精密度高,耗时短。本发明的样品在进行检测时,无需稀释,不存在HOOK效应。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 基于双抗体夹心均相化学发光法猪瘟病毒检测试剂盒及其制备方法和应用
- 基于均相化学发光法检测猪瘟病毒抗体的试剂盒及其制备方法和应用
