用于口服递送胰岛素的病毒样纳米衣壳
文献发布时间:2023-06-19 09:41:38
相关申请
本发明要求2018年3月13日提交的第62/642,356号美国专利申请的优先权,出于所有目的将其内容以其整体通过引用特此并入。
关于联邦赞助的研究和开发下作出的发明的权利的声明
本发明是在国立卫生研究院授予的和USDA国家食品和农业研究所拨款的AI095382、EB021230和CA198880合同下由政府支持完成的。政府拥有本发明的某些权利。
发明背景
病毒样颗粒(VLP)可用作用于靶向递送诊断方案和治疗方案(例如DNA/RNA和各种化疗剂)的纳米载体。戊型肝炎病毒(HEV)是引起人类急性肝炎的肠道传播病毒。HEV病毒样颗粒(HEV VLP)是衣壳蛋白二十面体笼,其可以通过在真核表达系统中主要衣壳蛋白HEV开放阅读框2(ORF2)的表达而产生。HEV VLP在酸和蛋白水解环境中是稳定的,这是HEV的自然传递途径所必需的特征。因此,HEV VLP代表了可被开发的例如用于递送治疗剂、成像剂或疫苗的有希望的纳米载体。
已经考虑纳米载体用于治疗的一种疾病是糖尿病,这是非常普遍的疾病,特别是在发达国家。尽管已经开发了许多其它药物来治疗糖尿病,但胰岛素仍然是治疗1型糖尿病(T1D)和晚期2型糖尿病(T2D)的首选药物。尽管糖尿病患者的发病率和死亡率因胰岛素而大大降低,但是60%的患者仍未能获得长期的葡萄糖控制[1]。这可能是由胰岛素给药中与针的典型用法有关的不适和病耻感引起的。相反,胰岛素的口服递送被认为是方便的、成本有效的并具有最高患者依从性的优选给药方法。此外,口服途径模拟了从胰腺通过肝门静脉到肝脏的内源性胰岛素分泌途径,以实现更好的葡萄糖体内平衡[2-4]。由于胰岛素在胃肠(GI)道中作为蛋白质降解,以及其通过肠上皮的渗透性差,因此胰岛素的生物利用度低,这已经严重阻碍了口服胰岛素递送的进展[4,5]。尽管如此,口服递送仍然是相对于针注射的有吸引力的替代方案,特别是因为曾经有利的肺部途径错过了作为真实前景的预测[6]。
已经提出了几种口服胰岛素递送药物,其利用通过诸如片剂、胶囊、肠贴剂、水凝胶、微粒和纳米颗粒的平台通过回肠和结肠的细胞旁和/或跨细胞转运。在几篇综述文献[4,7-10]中,对口服胰岛素的发展现状和临床试验不同阶段的进展进行了综述。其中,以色列的Oram Pharmaceuticals Inc.拥有专利蛋白质口服递送(POD
自1970年代末克隆胰岛素基因并在培养的细胞中表达时,基因疗法的发展也被提议作为糖尿病的可能的治愈方法[11]。Madison,WI-based startup,Insulete试图将诱导患者肝细胞中产生胰岛素的基因疗法商业化。它们靶向肝脏,而不是胰腺,因为它具有再生的能力。在先前的动物试验中,单次注射裸胰岛素DNA质粒可提供长达6周的血糖控制[12]。然而,该系统缺乏特定的组织/细胞靶向递送,这仍然需要被解决以进行有效治疗。因此,在糖尿病治疗中迫切需要开发用于胰岛素递送的新的有效手段。本发明满足了这种和其它相关的需要。
发明的简要概述
本发明提供了旨在靶向递送胰岛素的HEV VLP以及使用这种HEV VLP递送胰岛素的方法。
在第一方面,本发明提供了组合物,其包含(a)修饰的衣壳蛋白,其包含戊型肝炎病毒(HEV)开放阅读框2(ORF2)蛋白的至少一部分,并且能够形成HEV病毒样颗粒(VLP);和(b)包封在由修饰的衣壳蛋白形成的HEV VLP内的蛋白质形式或多核苷酸编码序列形式的胰岛素。通常,修饰的ORF2蛋白短于全长的野生型蛋白(例如,SEQ ID NOs:1-6中提供的任何一种)。ORF2蛋白的具体修饰可以是本发明人在先前的公开中描述的那些,参见,例如,美国专利号8,906,862和8,906,863、WO2015/179321。
在一些实施方案中,修饰的衣壳蛋白短于全长的HEV ORF2蛋白;其包含SEQ IDNO:1、2、3、4、5或6的HEV ORF2蛋白的片段452-606;并且其包含在SEQ ID NO:1、2、3、4、5或6的片段483-490、530-535、554-561、573-577、582-593或601-603内插入到HEV ORF2蛋白的部分中的异源多肽序列。在一些实施方案中,紧接在SEQ ID NO:1、2、3、4、5或6的残基Y485之后插入异源多肽序列。在一些实施方案中,异源多肽可参与靶向肝细胞以递送胰岛素,例如,最广泛使用的归巢肽,RGD(Arg-Gly-Asp)肽或环状RGD肽[1],其显示对整联蛋白vb 3和vb 5的强亲和力,或特异性靶向HCC的归巢肽,包括TTPRDAY[2]、FQHPSFI(HCBP1)[3]、SFSIIHTPILPL(SP94)[4]、RGWCRPLPKGEG(HC1)[5]、AGKGTPSLETTP(A54)[6]、KSLSRHDHIHHH(HCC79)[7]和AWYPLPP[8]。
在一些实施方案中,修饰的衣壳蛋白能够形成酸和蛋白水解稳定的HEV VLP,并且具有被半胱氨酸或赖氨酸取代的SEQ ID NO:1、2、3、4、5或6的至少一个残基Y485、T489、S533、N573或T586,并且所述半胱氨酸或赖氨酸任选地被化学衍生化。在一些实施方案中,半胱氨酸或赖氨酸被烷基化、酰化、芳基化、琥珀酰化、氧化,或与可检测标记或肝细胞靶向配体缀合。例如,可检测标记可以包括荧光团、超顺磁性标记、MRI造影剂、正电子发射同位素或原子序数大于20的第3族至第18族元素的簇。在一些实施方案中,可检测标记包括金纳米簇。在另一个实例中,肝细胞靶向配体是异源多肽,其可以参与靶向肝细胞以用于递送胰岛素,例如,最广泛使用的归巢肽,RGD(Arg-Gly-Asp)或环状RGD肽[1],或特异性靶向HCC的归巢肽,包括TTPRDAY[2]、FQHPSFI(HCBP1)[3]、SFSIIHTPILPL(SP94)[4]、RGWCRPLPKGEG(HC1)[5]、AGKGTPSLETTP(A54)[6]、KSLSRHDHIHHH(HCC79)[7]和AWYPLPP[8]。
在一些实施方案中,所述组合物可还包含药学上可接受的赋形剂,或其可被配制用于口服施用,例如用于治疗糖尿病患者。
在第二方面,本发明提供了将胰岛素靶向递送至肝细胞的方法,所述方法包括使肝细胞与上文和本文所述的任何种类的组合物接触,尤其是肝细胞与肝细胞靶向配体如RGD(环状RGD)肽接触的步骤[1]。
在一些实施方案中,肝细胞在患者体内,并且接触步骤包括向患者施用包含有效量的上文和本文所述的HEV VLP的组合物。在一些实施方案中,所述施用是口服施用。在一些实施方案中,修饰的衣壳蛋白包含与金纳米簇缀合的半胱氨酸或赖氨酸。在一些实施方案中,患者已被诊断患有糖尿病。在一些实施方案中,患者是动物,特别是哺乳动物,例如灵长类动物,包括人。
附图的简要说明
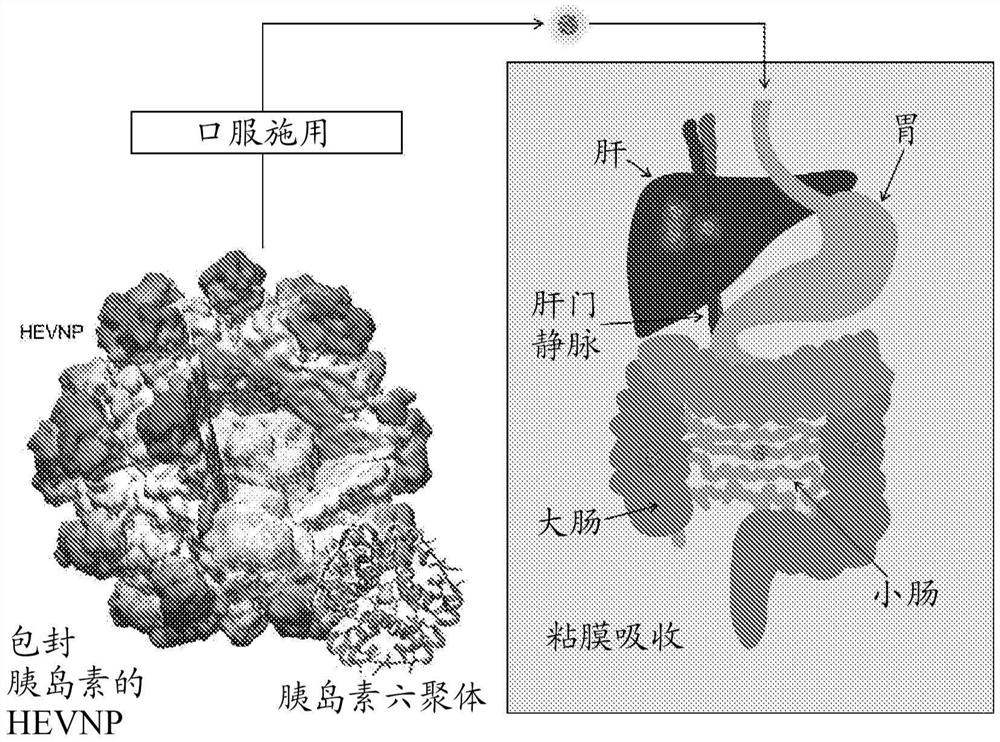
图1:包封胰岛素的HEVNP的示意图。(左图)包封胰岛素的HEVNP的口服递送途径。HEVNP将通过胃肠道,然后通过肝门静脉到达肝脏。(右图)
图2:胰岛素的TEM显微照片(A);包封胰岛素的HEVNP(B);在TEM观察下的包封胰岛素的HEVNP的大小分布。它们中的大多数具有约52nm的大小(C);包封胰岛素的HEVNP的TEM图像。该条棒的长度为100nm。
图3:包封胰岛素的HEVNP的TEM显微照片:没有胃蛋白酶处理作为对照(A);在pH3、37℃下胃蛋白酶(38U/ml)处理5min后(B);在pH 4、37℃下胃蛋白酶(38U/ml)处理5min(C)。该条棒的长度为100nm。
图4:HEVNP的胰岛素包封:优化封装条件以提高HEVNP中胰岛素包封效率。
图5:HEVNP的胰岛素包封:优化封装条件以提高通过Bradford测定和ELISA测试的HEVNP中胰岛素包封效率;声处理介导的有效载荷增强(下图)。
图6:尺寸排阻柱分析:显示如ELISA所示的具有重叠的胰岛素和HEVNP的不同峰(由在条件#16和#32之间的+符号表示)。
图7:HEVNP的胰岛素包封:冷冻电子显微镜结构引导的胰岛素封装的优化,随后进行胰岛素封装的3D建模和封装机制的计算验证。采集电子显微镜断层扫描倾斜序列数据以重建HEVNP-胰岛素的3D表达。
图8:高稳定性和保存期:将HEVNP-胰岛素样品在4℃储存超过一年,并用cryo-EM检查。显微照片显示完整的颗粒,其在储存条件下显示高稳定性。
图9:经由AuNC的HEVNP的增强的稳定性:基于衣壳表面修饰,经由簇集的金属原子增强的HEVNP稳定性的CryoArm 300kV显微术和3D图像重建。高分辨率结构测定是优化HEVNP粘膜递送的关键。
定义
本说明书和所附权利要求书中使用的单数形式“一个”,“一种”和“该/所述”包括复数引用,除非上下文另外明确规定。
“戊型肝炎病毒”或“HEV”是指病毒、病毒类型或病毒种类,其i)引起水传播的、传染性肝炎;ii)在血清学特征方面区别于甲型肝炎病毒(HAV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)或丁型肝炎病毒(HDV);和iii)含有与pTZKF1(ET1.1)中插入的1.33kb cDNA同源的基因组区域,所述pTZKF1(ET1.1)是在美国模式培养物保藏中心(ATCC)存放的登记号为67717的大肠杆菌菌株中呈现的质粒。
关于HEV的术语“衣壳蛋白”和“修饰的衣壳蛋白”是指成熟的或修饰的(例如,截短的、重组突变的或化学衍生的)HEV开放阅读框2(ORF2)多肽。如本文所用,提及这样的ORF2多肽或蛋白意味着包括全长多肽及其片段,并且还包括对ORF2蛋白进行的任何取代、缺失或插入或其它修饰。衣壳蛋白必须能够形成病毒样颗粒(VLP)。通常,衣壳蛋白至少含有HEVORF2的残基112-608,尽管衣壳蛋白可以容忍各种另外的取代、缺失或插入,只要它们耐受而不会消除VLP形成即可。
在一个实施方案中,术语“修饰的衣壳蛋白”是指衣壳蛋白或其部分(即,短于全长的衣壳蛋白),其中存在修饰,例如添加、缺失、取代中的一种或多种,但所得修饰的衣壳蛋白仍然能够形成VLP。这些修饰包括在美国专利号8,906,862和8,906,863、WO2015/179321中描述的那些。例如,可以将异源多肽插入衣壳蛋白或其部分中,在诸如片段483-490、530-535、554-561、573-577、582-593或601-603内的位置插入,或者紧接在残基Y485之后插入,参见美国专利号8,906,862和8,906,863。作为另一个实例,WO2015/179321描述了修饰的衣壳蛋白的其它实例,其中HEV ORF2的P结构域的表面可变环被修饰以掺入一个或多个半胱氨酸或赖氨酸,半胱氨酸或赖氨酸不存在于野生型衣壳蛋白序列中。或者,或另外地,术语“修饰的衣壳蛋白”是指衣壳蛋白或其部分,其中HEV ORF2的C-末端(例如,位置608)被修饰以掺入一个或多个半胱氨酸或赖氨酸,半胱氨酸或赖氨酸不存在于野生型衣壳蛋白序列中。或者,或另外地,术语“修饰的衣壳蛋白”是指衣壳蛋白或其部分,其中半胱氨酸或赖氨酸(例如,HEV ORF2的P-结构域的表面可变环的半胱氨酸或赖氨酸或在位置608处重组引入的半胱氨酸/赖氨酸)被化学衍生化以共价缀合至蛋白质至少一个异源原子或分子。可以插入半胱氨酸或赖氨酸,使得HEV ORF2蛋白长度增加,或者半胱氨酸或赖氨酸可以替换P-结构域表面可变环和/或C-末端的一个或多个残基。
通常,修饰的衣壳蛋白保留了形成HEV VLP的能力。在一些情况下,一个或多个半胱氨酸或赖氨酸与生物活性剂(例如,细胞靶向配体,例如肽LXY30)缀合。P-结构域表面可变环包括例如HEV ORF 2(SEQ ID NO:1、2、3、4、5或6)的残基475-493;残基502-535;残基539-569;残基572-579;和残基581-595中的一个或多个。P-结构域表面可变环还包括多肽的残基,其包含与SEQ ID NO:1、2、3、4、5或6中的一个或多个具有至少约80%、85%、90%、95%、99%或更多同一性的并且对应于SEQ ID NO:1、2、3、4、5或6的残基475-493;残基502-535;残基539-569;残基572-579;和残基581-595中的一个或多个的氨基酸序列。
如本文所用,术语“病毒样颗粒”(VLP)是指由衣壳蛋白形成的二十面体壳(例如,T1或T3)。VLP由于缺少病毒基因组而不是感染性的。“VLP”是指衍生自戊型肝炎病毒衣壳蛋白HEV ORF2或其部分的非复制二十面体病毒壳。VLP可以在适当的表达系统中蛋白质的重组表达时自发地形成。在一些实施方案中,VLP由修饰的衣壳蛋白形成,例如在HEV ORF2或其部分的表面可变环中含有一个或多个半胱氨酸/赖氨酸残基的衣壳蛋白。HEV VLP可以含有修饰的和/或未修饰的HEV ORF2蛋白的混合物。
在HEV VLP的上下文中,术语“酸和蛋白水解稳定的”是指对哺乳动物消化系统的酸和蛋白水解环境具有抗性的HEV VLP。评价酸和蛋白水解稳定性的方法描述于Jariyapong et al.,2013中,并且包括但不限于使HEV VLP经受酸(例如,pH为或约为6、5.5、5、4.5、4、3.5、3、2.5或2)和/或蛋白水解环境(例如,胰蛋白酶和/或胃蛋白酶),并且通过电子显微术、凝胶过滤色谱法或其它合适的方法检查接触的HEV VLP以确定HEV VLP的四级结构(例如,T=1,T=3,二十面体,十二面体等)是否被保留。HEV VLP群体(例如,修饰的或未修饰的)可以在酸和/或蛋白水解条件下孵育合适的时间段(例如,至少或至少约1、2、3、4、5、10、15、20、30、45或60分钟),然后测试以确定四级结构保留的程度。在本文中,酸和蛋白水解稳定的修饰的HEV VLP是指修饰的HEV VLP当在酸和/或蛋白水解条件下作为VLP群体进行孵育并通过电子显微术进行分析时,该群体的至少10%、25%、50%、75%、90%、95%、99%或100%的VLP保持它们的四级结构。
或者,HEV VLP可以通过口服途径递送至个体,并且通过检测和/或定量如下内容评价递送效率:(i)对HEV VLP内的抗原的免疫应答;(ii)与HEV VLP缀合的、重组引入至HEVVLP内的或被HEV VLP包封的可检测标记;或(iii)由于向细胞递送与HEV VLP相关(例如,重组引入至HEV VLP内、与HEV VLP缀合或被HEV VLP包封)的生物活性剂而引起的生物应答。在本文中,酸和蛋白水解稳定的修饰的HEV VLP是指保留未修饰的HEV VLP的至少10%、25%、50%、75%、90%、95%、99%或100%的口服递送功效和/或细胞进入活性的修饰的HEV VLP。
在描述两个元件的相对位置的上下文中使用的术语“异源的”是指在相同的相对位置处不是天然发现的两个元件,例如核酸(例如,启动子或蛋白编码序列)或蛋白质(例如,HEV ORF2蛋白,或其部分,或修饰的衣壳蛋白和另一种蛋白)。因此,基因的“异源启动子”是指与该基因不是天然可操作性连接的启动子。类似地,在HEV VLP或HEV衣壳蛋白的上下文中的“异源多肽”或”异源核酸”是衍生自非HEV源的一种。
已知戊型肝炎病毒(HEV)引起严重的急性肝衰竭。HEV属于肝炎病毒科(Hepeviridae)家族中的肝炎病毒(Hepevirus)属。HEV含有约7.2-kb的单链正义RNA分子。该RNA是3'聚腺苷酸化的并且包括三个开放阅读框(ORF)。ORF1编码病毒非结构蛋白,位于基因组的5'一半。ORF2编码蛋白质形成病毒衣壳,位于基因组的3'末端的。ORF3编码13.5-kDa蛋白质,与ORF1的C-末端和ORF2的N-末端重叠。ORF3与膜以及与细胞骨架部分有关。
本文所用的术语“包封”或“包封的”是指在本文所定义的VLP内包封异源物质,例如异源核酸或蛋白质、化学治疗剂、成像剂、铁氧体纳米颗粒等。
术语“生物活性剂”是指靶向特定生物位置(靶向剂)和/或提供可在体内或体外证实的一些局部或全身性生理或药理学作用的任何药剂、药物、化合物或其混合物。非限制性实例包括药物、激素、疫苗、抗体、抗体片段、维生素和辅因子、多糖、碳水化合物、类固醇、脂质、脂肪、蛋白质、肽、多肽、核苷酸、寡核苷酸、多核苷酸和核酸(例如,mRNA、tRNA、snRNA、RNAi、DNA、cDNA、反义构建体、核酶等)。
“药学上可接受的”或“药理学上可接受的”材料为不是生物学上有害的或在其它方面不合需要的材料,即,该材料可以与衣壳蛋白或HEV VLP或本发明的组合物一起施用于个体而不引起任何不合需要的生物效应。该材料不会以有害的方式与其中包含该材料的组合物的任何组分相互作用。
术语“赋形剂”是指可存在于本发明组合物的最终剂型中的任何基本上辅助物质。例如,术语“赋形剂”包括媒介物、粘合剂、崩解剂、填充剂(稀释剂)、润滑剂、助流剂(流动增强剂)、压制助剂、着色剂、甜味剂、防腐剂、助悬剂/分散剂、成膜剂/包衣剂、矫味剂和印刷油墨。
术语“佐剂”是指当与抗原联合施用时增强对抗原的免疫应答,但当单独施用时不产生对抗原的免疫应答的化合物。佐剂可以通过几种机制增强免疫应答,包括淋巴细胞募集、刺激B细胞和/或T细胞和刺激巨噬细胞。
对抗原或组合物的“免疫原性应答”是在个体中发展对所关注的组合物中存在的抗原的体液免疫应答和/或细胞免疫应答。为了本公开的目的,“体液免疫应答”是指由抗体分子介导的免疫应答,而“细胞免疫应答”是由T-淋巴细胞和/或其它白细胞介导的免疫应答。细胞免疫的一个重要方面涉及通过溶细胞性T细胞(“CTL”)的抗原特异性应答。CTL对肽抗原具有特异性,所述肽抗原与由主要组织相容性复合物(MHC)编码的并在细胞表面上表达的蛋白质联合存在。CTL有助于诱导和促进细胞内微生物的破坏,或这些微生物感染的细胞的溶解。细胞免疫的另一方面涉及通过辅助T细胞的抗原特异性应答。辅助性T细胞有助于帮助刺激非特异性效应细胞的功能,并将非特异性效应细胞的活性集中于在其表面上显示与MHC分子相联系的肽抗原的细胞。“细胞免疫应答”还指产生细胞因子、趋化因子和其它这样的由活化的T细胞和/或其它白细胞(包括衍生自CD4+和CD8+T细胞的那些)产生的分子。因此,免疫应答可包括一种或多种以下效果:通过B细胞产生抗体;和/或特异性针对存在于所关注的组合物或疫苗中的一种或多种抗原的抑制性T细胞和/或γΔT细胞的活化。这些应答可有助于中和感染性,和/或介导抗体-补体,或抗体依赖性细胞介导的细胞毒性(ADCC)以提供对免疫的宿主的保护。这种应答可以使用本领域熟知的标准免疫测定和中和测定来测定。
“标记”、“可检测标记”或“可检测部分”是通过光谱学、光化学、生物化学、免疫化学、化学或其它物理手段可检测的组合物。例如,有用的标记包括
本申请中使用的术语“治疗(treat)”或“治疗(treatment)”描述了导致相关病况的任何症状的消除、减少、缓解、逆转或预防或延迟发作或复发的行为。换句话说,“治疗”病况包括对该病况的治疗和预防性干预。
本文所用的术语“有效量”是指给定物质的在数量上足以产生所需效果的量。例如,包封胰岛素的HEV纳米颗粒(HEVNP)的有效量是实现可检测效果的所述HEVNP的量,使得出于治疗目的在已经给予HEVNP的患者中,目标疾病(例如,糖尿病)的症状、严重性和/或复发机会被减轻、逆转、消除、预防或延迟发作。足以实现此目的的量被定义为“治疗有效剂量”。剂量范围随所施用的治疗剂的性质和其它因素(例如施用途径和患者病况的严重程度)而变化。
本文所用的术语“患者”是指脊椎动物,例如鸟类或哺乳动物的物种,尤其是哺乳动物(例如公牛/母牛、猪、绵羊/山羊、马、兔、啮齿类、狗、猫、狐等),包括灵长类如黑猩猩、猴或人。
发明的详细说明
A.引言
本公开涉及基于病毒的纳米衣壳,其在化学上稳定并且对胃肠道中的酶活性具有抗性,用于胰岛素的口服递送。众所周知,在糖尿病治疗中包括不良的患者依从性在内的某些限制归因于与用于胰岛素给药的普遍使用的针注射相关的不适和不良作用。尽管口服递送是胰岛素(分子量为5.8kDa的蛋白质)的最有利的递送途径,但是它面临着挑战,这包括在胃肠道中被蛋白水解酶降解和严重的酸生理条件以及在吸收和通过肠上皮渗透之后的递送效力。尽管已经开发了几种胰岛素口服递送系统并批准用于临床试验,但需要解决许多与成本相关的因素,包括需要提高低的生物利用度,实现可再现的吸收,获得对膳食依赖性吸收速率和口服施用的胰岛素递送系统的大量生产的理解。
戊型肝炎病毒纳米颗粒(HEVNP)衍生自自组装的非传染性纳米衣壳。HEVNP在酸性环境中是稳定的并且抗蛋白水解消化,因此其作为口服递送媒介物具有巨大的优势。HEVNP可口服施用,然后转运到小肠并最终在HEV的天然传播途径之后转运到肝脏。HEVNP由于其体外解装/重新组装能力,能够包封药物或核酸以将其递送通过胃肠道中的消化系统。特异性靶向配体(例如,靶向递送至肝脏的配体)可以通过基因工程或化学缀合连接至HEVNP的突出结构域。HEVNP结构可以通过缀合单分散的金纳米簇(AuNC)来稳定,以获得口服递送的药物(例如胰岛素)的更好的生物利用度[18]。
本公开的具体方面以及本发明人的较早公开(参见,例如,美国专利号8,906,862和8,906,863,WO2015/179321)概述了HEVNP产生以及在表面修饰、用于口服递送胰岛素至肝脏的包封和模拟其从胰腺至肝脏的生理分泌途径中的方法和应用。
作为口服胰岛素递送胶囊,结构稳定的HEVNP提供以下益处:(1)消除针、相关风险和处置要求;(2)胰岛素,本身作为多肽或多核苷酸编码序列,可以容易地体外包封到HEVNP结构内并递送至肝脏,甚至没有靶向配体。然而,治疗性靶向配体将能够并增强胰岛素(例如,胰岛素基因)特异性递送至胰腺;(3)由衣壳蛋白组成的HEVNP可以通过蛋白降解途径被生物降解,而几乎没有毒理学问题。
各种形式的包封胰岛素的HEVNP的组合可用作综合疗法以更好地控制糖尿病患者的血糖水平。HEVNP的大规模化生产和表达将在关于治疗方案的成本分析的动物测试之后进行。
B.
本发明的一个方面涉及用于生产和纯化衣壳蛋白和由其衍生的VLP的方法(参见Expression and self-assembly of empty virus-like particles of hepatitis Evirus.Li TC,Yamakawa Y,Suzuki K,Tatsumi M,Razak MA,Uchida T,Takeda N,MiyamuraT.,J Virol.1997Oct;71(10):7207-13.Essential elements of the capsid proteinfor self-assembly into empty virus-like particles of hepatitis E virus.Li TC,Takeda N,Miyamura T,Matsuura Y,Wang JC,Engvall H,Hammar L,Xing L,Cheng RH.JVirol.2005Oct;79(20):12999-3006.Niikura M et al,Chimeric recombinanthepatitis E virus-like particles as an oral vaccine vehicle presentingforeign epitopes.Virology 2002;293:273-280)。在一个实施方案中,衣壳蛋白是修饰的衣壳蛋白,衍生自它的VLP是半胱氨酸/赖氨酸修饰的HEV VLP。例如,修饰的衣壳蛋白在HEVORF2或其部分的表面可变环中含有一个或多个半胱氨酸/赖氨酸残基。
各种表达系统可用于表达本发明的衣壳蛋白。可用于产生本发明的病毒样颗粒的表达系统的实例包括但不限于细菌表达系统(例如大肠杆菌)、昆虫细胞、酵母细胞和哺乳动物细胞。本发明优选的表达系统包括使用昆虫细胞的杆状病毒表达系统。用于处理和制备杆状病毒载体和杆状病毒DNA的一般方法以及昆虫细胞培养程序在A Manual ofMethods for Baculovirus Vectors and Insect Cell Culture Procedures(杆状病毒载体和昆虫细胞培养程序的方法手册)的中概述。
可以将本发明的衣壳蛋白克隆到杆状病毒载体中,并用于感染合适的宿主细胞(参见,例如,O'Reilly et al.,"Baculovirus Expression Vectors:A Lab Manual,"Freeman&Co.1992.)。可以用含有编码本发明衣壳蛋白的多核酸的转移载体转化昆虫细胞系(例如Sf9或Tn5)。转移载体包括,例如,线性化的杆状病毒DNA和含有所需多核苷酸的质粒。宿主细胞系可以与线性化的杆状病毒DNA和质粒共转染以产生重组杆状病毒。
本发明的病毒样颗粒的纯化可以根据本领域的标准技术进行(参见Li TC,etal.,J Virol.1997Oct;71(10):7207-13.Li TC,et al.,J Virol.2005Oct;79(20):12999-3006.Niikura M et al,Virology 2002;293:273-280)。然后将纯化的VLP重悬浮于合适的缓冲液中。
在一些实施方案中,修饰的衣壳蛋白或自其衍生的VLP可以与一种或多种生物活性剂化学缀合。例如,可以使用本领域已知的方法将衣壳蛋白的一个或多个半胱氨酸/赖氨酸残基酰化、烷基化、芳基化、琥珀酰化或氧化。在一些情况下,可以使用马来酰亚胺官能团将一个或多个半胱氨酸/赖氨酸残基缀合,以将生物活性剂共价缀合至半胱氨酸或赖氨酸的硫醇部分。在一些情况下,可以使用CLICK化学修饰生物活性剂以引入马来酰亚胺官能团。例如,生物活性剂的炔衍生物可以在CuSO
C.
本发明的另一方面涉及将一种或多种生物活性剂包封在HEV病毒样颗粒(例如半胱氨酸/赖氨酸修饰的HEV VLP)中(参见,DNA vaccine-encapsulated virus-likeparticles derived from an orally transmissible virus stimulate mucosal andsystemic immune responses by oral administration,Gene Therapy 2004.11,628–635.S Takamura,M Niikura,T-C Li,N Takeda,S Kusagawa,Y Takebe,T Miyamura and YYasutomi)。可以使用本领域中的任何标准技术将异源核酸、蛋白质、多肽、化学治疗剂、成像剂、纳米颗粒等包封到本发明的VLP中。示例性的生物活性剂是蛋白质形式或核酸形式的胰岛素。通用程序包括(1)将根据本发明的由衣壳蛋白形成的VLP解装;以及(2)在生物活性剂存在下重建VLPs。本领域技术人员将认识到,优选地在包封程序之前具有纯化的VLP。特别优选地,在包封程序之前,使VLP中的任何不需要的物质(例如,核酸)被耗尽或基本上被耗尽。
可以使用本领域中的任何标准技术进行VLP的解装。重构的病毒样颗粒可以在生理条件下产生(参见美国专利公开号20080131928)。通常,病毒样颗粒的解装需要破坏VLP的组装的试剂,例如还原剂或螯合剂(参见美国专利公开号20040152181)。本领域技术人员将认识到,影响组装和解装的因素和条件包括:pH、离子强度、病毒衣壳蛋白的翻译后修饰、二硫键和二价阳离子键合等等。例如,对于多瘤病毒(Brady et al.,J.Virol,23:717-724,1977)和轮状病毒(Gajardo et al.,J.Virol,71:2211-2216,1997),已经显示了阳离子键合,特别是钙在保持病毒体完整性中的重要性。另外,二硫键对于稳定多瘤病毒(Walter etal.,Cold Spring Har Symp.Quant.Biol,39:255-257,1975;Brady et al.,J.Virol,23:717-724,1977)和SV40病毒(Christansen et al.,J.Virol,21:1079-1084,1977)似乎是重要的。此外,已知诸如pH和离子强度的因素可能通过影响静电相互作用来影响多瘤病毒衣壳稳定性(Brady et al.,J.Virol,23:717-724,1977;Salunke et al.,Cell,46:895-904,1986;Salunke et al.,Biophys.J,56:887-900,1980)。此外,已知一些病毒衣壳蛋白的翻译后修饰可影响衣壳稳定性和组装,例如糖基化、磷酸化和乙酰化(Garcea et al.,Proc.Natl.Acad.Sci.USA,80:3613-3617,1983;Xi et al.,J.Gen.Virol,72:2981-2988,1991)。因此,存在许多可能影响衣壳稳定性、组装和解装的相关因素。
优选地,本发明的VLP通过除去钙离子而被解装(参见,Touze A,Coursaget P.Invitro gene transfer using human papillomavirus-like particles.Nucleic AcidsRes 1998;26:1317-1323;Takamura et al.,DNA vaccine-encapsulated virus-likeparticles derived from an orally transmissible virus stimulate mucosal andsystemic immune responses by oral administration.Gene Therapy 2004;11:628-635)。根据本发明,使用还原剂或螯合剂或两者解装VLP。可以使用各种还原剂。还原剂的优选实施方案包括但不限于二硫苏糖醇(DTT)。可使用各种螯合剂,例如乙二醇四乙酸(EGTA)或乙二胺四乙酸(EDTA)。VLP解装条件的实例包括但不限于以下条件:通过孵育含有50mMTris-HCl(pH 7.5)、150mM NaCl、1mM EGTA和20mM二硫苏糖醇的缓冲液30分钟来破坏纯化的VLP。
技术人员还将认识到,尽管是优选的,,但是不需要完全解装VLP以包封生物活性剂。技术人员还将认识到,在其它情况下,优选部分解装VLP。根据本发明,可以控制用于部分解装VLP的条件以仍然允许生物活性剂的有效包封。VLP的部分解装可以通过单独用还原剂(例如20mM DTT)处理VLP来实现(Sapp et al,J.Gen.Virol.,76:2407-2412,1995.)。根据本发明,一旦VLP被完全或部分地解装,可以通过在生物活性剂存在下重新组装VLP来进行生物活性剂的包封。在一些情况下,利用具有净负电荷的生物活性剂以增强包封可能是有利的。例如,核酸具有净负电荷,并且与具有正电荷或中性电荷的化合物相比,可以被优先包封。
在本发明的一些实施方案中,VLP的重新组装通过将钙离子重新补充到被破坏的VLP来实现。或者,VLP的重新组装通过除去还原剂或螯合剂来实现。任选地,可以调节诸如pH和离子强度的因素,本发明所述的其它因素,以实现VLP的有效重新组装和生物活性剂的有效包封。
在一些实施方案中,如下进行包封:在室温下孵育30分钟后,将在50mM Tris-HCl缓冲液(pH 7.5)和150mM NaCl中的生物活性剂加入到被破坏的VLP制剂中。然后通过用增加浓度的CaCl
在一些实施方案中,将待包封的生物活性剂(例如胰岛素蛋白或编码胰岛素的核酸)或成像剂与衣壳化信号缀合。例如,对应于HEV开放阅读框1的密码子35-59的RNA元件是强的衣壳化信号,允许在体外与HEV衣壳蛋白(包括本文所述的HEV ORF2 VLP的截短形式和/或半胱氨酸/赖氨酸修饰形式)特异性相互作用。为了使用VLP作为治疗剂或成像剂的载体,可以在衣壳自组装之前使用化学接头(例如,LC-SPDP或适配体、线性-树枝状嵌段共聚物),所述化学接头用HEV衣壳化信号(例如,前述RNA元件)标记药剂(例如,化学治疗剂)。
在一些实施方案中,可检测标记(成像剂)被包封。可检测标记可以是使其所连接的分子可通过多种机制(包括化学、酶、免疫学或放射学手段)检测的部分。可检测标记的一些实例包括荧光分子(例如荧光素、若丹明、德克萨斯红和藻红蛋白)和酶分子(例如辣根过氧化物酶、碱性磷酸酶和β半乳糖苷酶),其允许基于荧光发射或酶催化的化学反应的产物进行检测。涉及各种同位素的放射性标记物,例如
在一些实施方案中,生物活性剂被包封。在一些情况下,生物活性剂是化学治疗剂。合适的化疗剂包括但不限于细胞毒性药物。可用于本发明的细胞毒性药物的实例包括:烷基化药物,例如环磷酰胺、异环磷酰胺、苯丁酸氮芥(ehlorambucil)、美法仑、白消安、洛莫司汀、卡莫司汀、chlormethhine(氮芥)、雌莫司汀、曲奥舒凡(treosulfan)、塞替派、二溴甘露醇(mitobronitol);细胞毒性抗生素,例如多柔比星,表柔比星,阿柔比星,伊达比星,柔红霉素,米托蒽醌(mitoxantrone)(米托蒽醌(mitozantrone)),博来霉素,放线菌素和丝裂霉素;抗代谢物,例如甲氨蝶呤,卡培他滨;阿糖胞苷,氟达拉滨,克拉屈滨,吉西他滨,氟尿嘧啶,雷替曲塞(拓优得(Tomudex)),巯嘌呤,替加氟和噻胍(tioguaninc);长春花生物碱,例如长春花碱,长春新碱,长春地辛,长春瑞滨和依托泊苷;其它肿瘤性药物,例如安吖啶、altetarmine、crisantaspase(天冬酰胺酶)、达卡巴嗪和替莫唑胺、羟基尿素(羟基脲)、喷司他丁、铂类化合物,包括:卡铂、顺铂和奥沙利铂、卟吩姆钠、丙卡巴肼、雷佐生;紫杉烷类,包括:多西他赛和紫杉醇;拓扑异构酶I抑制剂,包括INOTECAN和拓扑替康、曲妥珠单抗和维甲酸。在一些情况下,一种或多种前述成像剂和/或生物活性剂或其组合可以另外地或可替代地通过硫醇连接(thiol linkage)与P-结构域表面可变环或C-末端中的半胱氨酸或赖氨酸(例如重组引入的半胱氨酸或赖氨酸)缀合。在一些情况下,一种或多种前述成像剂和/或生物活性剂或其组合可以另外地或可替代地通过硫醇连接与P-结构域表面可变环或C-末端中的第二半胱氨酸或赖氨酸(例如重组引入的半胱氨酸或赖氨酸)缀合。
在一些实施方案中,胰岛素是包封在本发明的HEV VLP构建体中的生物活性剂。在一些情况下使用生物活性多肽形式的胰岛素(其可以包括任选的翻译后修饰,例如糖基化、PEG化或包括D-氨基酸在内的一种或多种人工氨基酸类似物的取代,等等),而在其它情况下,胰岛素是编码胰岛素和/或胰岛素原蛋白的多核苷酸序列形式(例如cDNA),例如,编码胰岛素的核酸是TA1m载体中的人胰岛素基因表达构建体[12]。胰岛素蛋白可以是重组的或者可以分离自天然来源。它可以是人胰岛素或衍生自其它动物,例如牛、猪、猫或犬动物。它可以是胰岛素原。可使用不同形式的胰岛素:速效的(Aspart(天冬胰岛素):Novolog(门冬胰岛素);Glulisine(赖谷胰岛素);Apidra(谷赖胰岛素);Lispro(赖脯胰岛素):Humalog(优泌乐));短效的(常规的:Humulin(优泌林)、Humulin R(优泌林R)、Novolin(诺和灵));中效的(NPH:Humulin N(优泌林N)、Novolin N(诺和灵N));中效至长效(Detemir(地特胰岛素));长效的(例如,Glargine(甘精胰岛素))。此外,生物活性剂可以是胰岛素的类似物,例如市售的胰岛素类似物为Levemir(地特胰岛素/诺和平);或甘精胰岛素,其为长效基础胰岛素类似物并且以名称Lantus(来得时)销售。另外,生物活性剂可以是胰岛素和胰高血糖素样肽(GLP-1)受体或其它药物的组合。GLP-1受体激动剂的实例包括liraglutide(利拉鲁肽)(Victoza(诺和力)、Saxenda(利拉鲁肽))、lixisenatide(利西拉肽)(Lyxumia(利西拉肽))、albiglutide(阿必鲁肽)(Tanzeum(阿必鲁肽))、dulaglutide(度拉糖肽)(Trulicity(度拉鲁肽))和semaglutide(索马鲁肽)(Ozempic(索马鲁肽))。胰岛素的合适形式或组合包括但不限于甘精胰岛素;赖脯胰岛素;天冬胰岛素;地特胰岛素;胰岛素(人);天冬胰岛素+天冬胰岛素鱼精蛋白;赖谷胰岛素;胰岛素(人)+低精蛋白胰岛素[INN];天冬胰岛素+德谷胰岛素;天冬胰岛素+低精蛋白胰岛素[INN];德谷胰岛素+利拉鲁肽;甘精胰岛素+利西拉肽;人胰岛素+低精蛋白胰岛素[INN];低精蛋白胰岛素[INN]+中性胰岛素;人低精蛋白胰岛素[INN]+人胰岛素;胰岛素(牛);德谷胰岛素;人胰岛素锌;低精蛋白胰岛素[INN];人低精蛋白胰岛素[INN];中性胰岛素;人胰岛素+人低精蛋白胰岛素[INN];中性胰岛素+低精蛋白胰岛素[INN];胰岛素(猪);胰岛素,中性;鱼精蛋白锌胰岛素;胰岛素;特戈胰岛素(insulintregopil)[INN];人胰岛素+人胰岛素原;甘精胰岛素+赖脯胰岛素;人胰岛素+醋酸普兰林肽;度拉糖肽;度拉糖肽+甘精胰岛素;艾塞那肽+赖脯胰岛素;甘精胰岛素+利拉鲁肽;赖脯胰岛素+普兰林肽;efpeglenatide[INN];人胰岛素+普兰林肽;艾塞那肽+人胰岛素;赖脯胰岛素+赖脯胰岛素鱼精蛋白;氯碘羟喹[INN]+人胰岛素;甘精胰岛素+赖谷胰岛素;和胰岛素I 131。此外,各种肽基和非肽基胰岛素模拟物,如Nankar et al.(Drug Discovery Today,Volume 18,Issues 15–16,August 2013,Pages 748-755)中描述的那些可用作HEV VLP中包封的生物活性剂。
当使用不同的衣壳蛋白构建体时,VLP的大小可以变化。例如,可以调节衣壳蛋白的N-末端部分以增加或降低VLP的大小和包封能力。在本发明的一些实施方案中,在构建HEV VLP时,利用与一部分的HEV ORF 2蛋白的N-末端融合的一部分的HEV ORF 3蛋白来调节VLP的大小。通常,由至少具有HEV ORF 2的残基112-608的一部分HEV ORF2形成HEV VLP。
D.
本发明还提供了包含HEV VLP的药物组合物或生理组合物,所述HEV VLP由包封生物活性剂(如蛋白形式或核酸形式的胰岛素)的修饰的衣壳蛋白形成。这种药物或生理组合物还包括一种或多种药学上或生理上可接受的赋形剂或载体。本发明的药物组合物适用于多种药物递送系统。用于本发明的合适的制剂可见于Remington's PharmaceuticalSciences,Mack Publishing Company,Philadelphia,PA,17th ed.(1985)。关于药物递送方法的简要综述,参见Langer,Science 249:1527-1533(1990)。
本发明的组合物可以与赋形剂一起施用于宿主。可用于本发明的赋形剂包括但不限于媒介物、粘合剂、崩解剂、填充剂(稀释剂)、润滑剂、助流剂(流动增强剂)、压制助剂、着色剂、甜味剂、防腐剂、助悬剂/分散剂、成膜剂/包衣、矫味剂和印刷油墨。
本发明的一个优点在于本发明的组合物适于口服递送。因为本发明的HEV VLP能够靶向肝细胞,所以可以有效地实现胰岛素的Cite-特异性递送。而且,由于衣壳蛋白的修饰,本发明的HEV VLP在酸性环境中是稳定的,并且在胃肠道中对消化具有抗性,因此它适于口服递送胰岛素。与半胱氨酸或赖氨酸残基缀合的金纳米簇,尤其是在本发明的一些实施方案中被工程化到修饰的衣壳蛋白的表面内的那些金纳米簇,进一步增强HEV VLP的稳定性、生物利用度和递送效率。因此,本发明的组合物的口服递送可以有效地为患有胰岛素不足或失调,例如I型或II型糖尿病以及相关症状的患者提供治疗益处。本发明的HEV VLP可以配制成固体(例如粉末)或液体的形式,使得其可以用作日常生活中消费的普通食品或饮料物品的补充。
另外,本发明的组合物也可以配制用于粘膜递送,例如递送至颊粘膜或唇粘膜或呼吸道粘膜,包括鼻粘膜。
本发明的药物组合物可以通过各种途径施用,例如口服、皮下、透皮、皮内、肌内、静脉内或腹膜内施用。施用药物组合物的优选途径是以约0.01-5000mg、优选5-500mg的HEVVLP的日剂量口服递送。口服施用是优选的施用方式,并且合适的剂量可以以片剂、胶囊的形式施用,或者作为对食物或饮料物品的补充以单一日剂量施用,或者作为以适当间隔提供的分开的剂量施用,例如以每天两次、三次、四次或更多次亚剂量施用。
为了制备本发明的药物组合物,使用惰性的和药学上可接受的载体。药物载体可以是固体或液体。固体形式制剂包括,例如,粉末、片剂、可分散颗粒、胶囊、扁囊剂和栓剂。固体载体可以是一种或多种还可以充当稀释剂、矫味剂、增溶剂、润滑剂、助悬剂、粘合剂或片剂崩解剂的物质;它也可以是包封材料。
在粉末中,载体通常是精细分散的固体,其与精细分散的活性组分混合,例如具有包封的核酸的嵌合病毒样颗粒。在片剂中,将活性成分(具有包封的核酸的嵌合病毒样颗粒)与具有必要结合特性的载体以合适的比例混合,并压制成所需的形状和大小。
对于制备栓剂形式的药物组合物,首先将低熔点蜡如脂肪酸甘油酯和可可脂的混合物熔化,并通过例如搅拌将活性成分分散在其中。然后将熔融的均匀混合物倒入合适尺寸的模具中并使其冷却和固化。
粉末和片剂优选含有约5%重量至约70%重量的活性成分。合适的载体包括,例如,碳酸镁、硬脂酸镁、滑石粉、乳糖、糖、果胶、糊精、淀粉、黄蓍胶、甲基纤维素、羧甲基纤维素钠、低熔点蜡、可可脂等。
药物组合物可以包括活性化合物与作为载体的包封材料的制剂,提供胶囊,其中活性组分(具有或不具有其它载体)被该载体包围,使得该载体因此与化合物结合。以类似的方式,也可以包括扁囊剂。片剂、粉末、扁囊剂和胶囊可用作适于口服施用的固体剂型。
液体药物组合物包括,例如,适于口服或肠胃外施用的溶液、悬浮液和适于口服施用的乳液。活性组分(例如,具有包封的核酸的嵌合病毒样颗粒)的无菌水溶液或活性组分在包括水、缓冲的水、盐水、PBS、乙醇或丙二醇的溶剂中的无菌溶液是适于肠胃外施用的液体组合物的实例。所述组合物可以含有接近生理条件所需的药学上可接受的辅助物质,例如pH调节剂和缓冲剂、张力调节剂、润湿剂、洗涤剂等。还预期HEV VLP可以是预先包装的粉末的片剂/胶囊剂形式或销售的浓缩液体形式。这将进一步由患者添加到食物或包括水的饮料中,然后由患者消费。HEV VLP也可以是液体形式并且不经进一步稀释直接消费。
无菌溶液可以通过将活性组分(例如,具有包封的核酸的嵌合病毒样颗粒)悬浮在所需的溶剂系统中,然后使所得溶液通过膜过滤器以将其灭菌来制备,或者可替代地,通过在无菌条件下将无菌化合物溶解在先前灭菌的溶剂中来制备。可以将所得水溶液包装以照原样使用,或冻干,在施用前将冻干制剂与无菌水性载体组合。制剂的pH通常为3-9,更优选5-8,最优选6-7。
可施用本发明的药物组合物以用于预防性和/或治疗性治疗。在治疗应用中,将组合物以足以防止、治愈、逆转或至少部分减缓或阻止病况及其并发症的症状的量施用于已经患有所述病况的患者。足以实现此目的的量被定义为“治疗有效剂量”。对于这种应用有效的量将取决于疾病或病况的严重程度以及患者的体重和一般状态,但是对于70kg的患者,所述量通常为每天约0.1mg至约2,000mg的组合物,对于70kg的患者,更通常使用的剂量为每天约5mg至约500mg的组合物。
在预防性应用中,本发明的药物组合物以足以延迟或防止症状发作的量施用于易于患有或处于发展疾病或病况(例如糖尿病)的风险中的患者。这样的量被定义为“预防有效剂量”。在这种应用中,组合物的精确量再次取决于患者的健康状态和体重,但是对于70kg患者通常为每天约0.1mg至约2,000mg的抑制剂,对于70kg患者更通常为每天约5mg至约500mg。
组合物的单次或多次施用可以由治疗医师选择的剂量水平和模式来进行。在任何情况下,药物制剂应提供足以在患者中治疗地或预防地实现预期效果的量的本发明的组合物。
实施例
仅以示例性说明的方式而不是以限制的方式提供以下实施例。本领域的技术人员将容易认识到可改变或修改各种非关键参数以产生基本上相同或相似的结果。
I.背景技术
在过去的八十年中,皮下注射(SC)已经成为用于补充次优的胰岛素分泌的主要途径,以施用胰岛素作为糖尿病的治疗。尽管这种方法是有效的,但SC注射是疼痛的、不方便的,并且携带高感染风险,导致患者依从性差。预期由非传染性戊型肝炎病毒衣壳组成的包封胰岛素的戊型肝炎病毒纳米颗粒(HEVNP)在摄入后将胰岛素从胃肠(GI)道递送至肝脏。HEVNP可以是长期寻找的口服施用胰岛素的有效且有效率方法的答案,所述口服施用胰岛素是具有最高患者依从性的最优选的药物递送途径。
II.用于口服递送胰岛素的结构稳定的HEVNP
从生理学的观点来看,口服施用的胰岛素由于其模拟内源性胰岛素分泌途径的潜力而在肝葡萄糖产生的管理中具有治疗优势[4]。在HEV的自然感染途径之后,包封胰岛素的HEVNP可以通过胃肠道穿过门静脉到达肝脏(图1)。相反,胃肠道外或吸入的胰岛素直接吸收到外周循环中,绕过肝提取,因此不能恢复门静脉-外周胰岛素梯度和生理性肝胰岛素化。此外,这些途径使外周靶标相对于肝脏暴露于更高的胰岛素浓度,使患者易受低血糖的高风险,以及高胰岛素血症的有害作用[4]。
衍生自修饰形式的戊型肝炎病毒(HEV)衣壳蛋白的戊型肝炎病毒纳米颗粒(HEVNP)是非传染性的自组装衣壳,其缺乏病毒基因组并且能够细胞结合和进入。因为HEV已经发展用于口腔粘膜传递,所以组装的衣壳蛋白在蛋白水解条件和酸性粘膜条件下类似地稳定[13]。已经通过昆虫细胞表达系统通过杆状病毒载体实现了高产率的HEVNP生产。由于它们的蛋白水解稳定性,可以直接从细胞上清液中提取和纯化自组装的HEVNP,基本上减少了必需的纯化步骤。此外,HEVNP具有通过柔性铰链与稳定的二十面体基底连接的表面暴露的突出结构域(P结构域)。可以通过经由基因工程[13]或化学缀合[14]插入外源肽来修饰P结构域而不损害基本的二十面体结构。由开放阅读框2(ORF2)编码的HEV衣壳蛋白(CP)的P结构域上的三个暴露良好的表面可变环和C末端被设计为至少一种或多种生物活性剂的基因工程化和/或化学缀合位点[14,15]。
已经提出将靶向药物递送至特定器官和细胞区室以减少对非特异性器官/细胞的副作用。已经提出HEVNP作为细胞靶向的递送系统,因为其表面暴露的半胱氨酸或赖氨酸残基可以采用用于组织靶向的合成配体[14,15]。当HEVNP口服递送质粒cDNA至小肠上皮细胞以瞬时表达胰岛素和/或胰岛素原时,其口服递送基因的能力已在先前研究中被证实[16,17]。HEVNP在小鼠模型中采用远红外(FIR)成像的体内生物分布测定(数据未示出)表明口服递送的HEVNP甚至在没有特异性肝靶向配体的情况下在肝中聚积。
HEVNP的包封是基于电荷相互作用,使得带负电荷的核酸和纳米大小的蛋白质/小分子可以被封装以用于治疗应用。HEVNP可以包封商业的胰岛素类似物,Levemir(诺和平)的地特胰岛素(网站:levemir.com),大小为~52nm(图3)。考虑到HEVNP的药物毒理学,它由单个衣壳蛋白ORF2的拷贝组成并且是生物可降解的。另外,HEVNP可包封胰岛素或胰岛素原cDNA用于口服基因递送。可以通过经由连夜化学缀合或耗时但成本有效的基因工程将特异性靶向细胞配体插入到HEVNP的突出结构域内来增加胰腺β细胞和/或肝脏的靶向能力。HEVNP的组织靶向能力使其成为将胰岛素基因转运至胰腺和/或肝脏的有利的口服递送载体,从而允许温和的原位胰岛素表达。
使用HEVNP作为口服递送载体的概念不仅已经被上述的先前研究证实,而且还得到体外稳定性研究的支持。在不同pH和胃蛋白酶消化试验下的体外稳定性测定(未公开的数据)显示,包封胰岛素的HEVNP可以在具有胃蛋白酶消化的pH 3环境中存活5分钟(图2)。HEVNP含有修饰的ORF2衣壳蛋白,其具有在WO2015/179321、美国专利号8,906,862和美国专利号8,906,863中描述的一个或多个修饰。包封的胰岛素的生物利用度可以通过在餐前饮水以避免胃中恶劣的消化环境来进一步确保。此外,可以通过将单分散的金纳米簇(AuNC)化学缀合至HEVNP的五重对称区域上来稳定生物利用度[18]。此外,已经提出AuNC作为体内成像试剂,因为它的FIR可检测信号可以穿透深层组织[19]。HEVNP的功能的组合,包括胰岛素包封、胰岛素/胰岛素原cDNA包封和经由表面缀合能力的组织/细胞靶向,使其成为用于治疗糖尿病的胰岛素本身或胰岛素基因的理想的口服递送系统。该递送系统通过消除针的使用来提高患者依从性。
本发明在于HEVNP平台,其具有(1)缀合至其表面上的组织/细胞靶向配体(特别是能够将HEVNP特异性引导至肝细胞的配体)以增强其吸收,和(2)包封在其内部用于药物/基因递送的胰岛素(胰岛素多肽形式或编码胰岛素的多核苷酸序列的形式)。HEVNP由本发明人根据先前的公开内容构建,包括美国专利号8,906,862、美国专利号8,906,863和WO2015/179321。
III.发明内容
HEVNP为失去病毒感染性的HEV衍生的纳米胶囊,保留了HEV的基本特征,包括胃肠道稳定性,靶细胞结合和细胞进入。结合其在体外的解装/重新组装能力,已经提出HEVNP作为有吸引力的通过饮用的口服递送纳米胶囊。HEVNP的包封是有效载荷和衣壳蛋白之间的静电相互作用,使得带负电荷的核酸和纳米大小的蛋白/小分子可以被封装用于治疗应用。除了包封胰岛素用于经由胃肠道口服递送至肝脏之外,还可以包封胰岛素基因。如果需要,可以通过经由连夜化学缀合或耗时但成本有效的基因工程将特异性细胞靶向配体插入到HEVNP的突出结构域上来增加胰腺β细胞和/或肝脏的靶向能力。因此,HEVNP被装备为细胞靶向的基因递送载体,其可以将胰岛素基因递送至胰腺并在原位瞬时表达胰岛素。预期通过口服施用(优选的药物施用途径),包封胰岛素的HEVNP将胰岛素从胃肠道递送至肝脏。
在综合疗法方案中,采用两种或更多种改善血糖水平控制的糖尿病治疗来治疗糖尿病患者。通过在胰岛素/胰岛素原多肽形式的胰岛素和胰岛素/胰岛素原cDNA形式之间转换有效载荷以实现所递送的胰岛素的不同体内动力学,由HEVNP可以提供多种模式的糖尿病治疗。另一种模式水平来自在HEVNP的突出结构域上缀合不同的组织/细胞靶向配体。通过口服递送包封胰岛素的HEVNP和/或含有胰岛素/胰岛素原cDNA的HEVNP,这些多种模式治疗的组合可以是替代针注射的糖尿病治疗。
IV.材料和方法
1.胰岛素的HEVNP包封
1.1.HEVNP的解装
1.1.1.在4℃下将HEVNP在20mM DTT、10mM EDTA、O/N中解装
1.1.2.在RT下针对50mM Tris、pH7.5、150mM NaCl透析所解装的HEVNP>1H
1.1.3.通过TEM检查,通过分光光度法测量蛋白质浓度
1.2.将胰岛素包封到HEVNP中
1.2.1.在4℃下将所解装的HEVNP与胰岛素在50mM Tris、pH7.5、150mM NaCl中混合,加入CaCl
1.2.2.通过尺寸排阻柱以去除游离的胰岛素。
1.2.3.收集级分并通过分光光度计测量蛋白质浓度
1.2.4.通过TEM检查包封胰岛素的HEVNP
2.HEVNP表征
2.1.使用分光光度计记录A280nm读数和A260/A280 nm比率。HEVNP ORF2的摩尔消光系数为60,280,相当于在280nm处的1.019×蛋白质吸光度值。这如此接近1:1,使得HEVNP的浓度可以通过分光光度计在A280nm处的蛋白质浓度测量值来表示。考虑HEVNP,ORF2的构件块,其分子量为53.318kDa:
例如:根据分光光度计在280nm的测量值,HEVNP具有1mg/mL的浓度,相当于18.8μM的ORF2。(每个ORF2含有1个Cys位点和1个Lys位点用于化学缀合。)
2.2.根据用户手册
2.2.1.将2μl的4x加样缓冲液加入到6μl的蛋白质样品中。在加热块中在100℃下孵育样品混合物10分钟以使蛋白质变性。将蛋白质样品上样到NuPAGE凝胶装置上。
2.2.2.通过将DC电源设置在100V下持续10分钟,然后在150V下持续45分钟运行SDS-PAGE,直到样品运行到凝胶底部上方约1cm处。
2.2.3.用考马斯蓝(0.25%(w/v)考马斯亮蓝R250、30%(v/v)甲醇、10%(v/v)乙酸)将SDS PAGE凝胶染色1小时。
2.2.4.在染色程序之后,除去考马斯蓝染色,并在室温下将脱色(distaining)缓冲液(30%(v/v)甲醇、10%(v/v)乙酸)施加到蛋白凝胶上>12h。
2.2.5.在白光下记录凝胶以确认在52kDa条带处存在HEVNP ORF2。
2.3.使用TEM观察HEVNP
2.3.1.用10mM MES pH6.2制备或稀释HEVNP样品至
2.3.2.用40mA辉光放电将碳涂覆的栅格(grids)电离30秒以产生亲水性碳表面。辉光放电设备可以是EMS辉光放电器。在辉光放电处理后,栅格的亲水性碳表面只能持续30分钟。
2.3.3.握住镊子,将2μL的HEVNP样品加入到栅格中,等待15-30秒,并用滤纸吸干。
2.3.4.立即用ddH
2.3.5.立即将2μL的2%乙酸铀酰加入到栅格中,等待15秒,然后用滤纸吸干。通过将样品栅格置于电子除湿干燥箱中过夜以干燥样品栅格。
2.3.6.将栅格转移到透射电子显微镜(TEM)中并在10K至80K放大倍率下成像。由于不存在病毒RNA,HEVNP在TEM中表现为直径约27nm的空二十面体蛋白。
3.HEVNP与生物素、组织/细胞靶向配体和荧光团的化学缀合
3.1.HEVNP与马来酰亚胺连接的生物素的一步缀合
3.1.1.更换缓冲液:将HEVNP应用于微型透析单元中,并根据制造商的方案(Zeba SpinDesalting Columns,40K MWCO,0.5mL)在室温下对0.01M PBS pH=7.4透析1小时。将HEVNP转移到1.5mL试管中并使用分光光度计在280nm下测量蛋白质浓度。
3.1.2.将1mg/mL的HEVNP(这相当于18.8μM的Cys反应位点(参见步骤2.2.4中的细节))与等量的马来酰亚胺-生物素(100μM)在0.01M PBS pH7.4中混合,以形成1∶5摩尔比,并在4℃下反应O/N。根据制造商的方案(Zeba Spin Desalting Columns,40K MWCO,0.5mL),用40K MWCO Spin Desalting(旋转脱盐)柱程序除去未结合的马来酰亚胺-生物素。
3.1.3.通过标准还原SDS-PAGE分析样品(步骤3.1)。
3.1.4.准备化学发光的蛋白质印迹,HRP连接的链霉亲和素。通过X射线胶片捕获化学发光信号(图2)。
3.2.组织靶向配体(RGD肽)与HEV NP上的表面暴露的半胱氨酸的两步缀合。
3.2.1.更换缓冲液:将HEVNP应用于微型透析单元中,并在室温下对0.01M PBS pH=7.4透析1小时。将HEVNP转移到1.5mL试管中并使用分光光度计在280nm下测量蛋白质浓度。
3.2.2.在含有200μM CuSO
3.2.3.在0.01M PBS pH7.4中将1mg/mL的HEVNP(这相当于18.8μM的Cys反应位点(参见步骤2.2.4中的细节))与约10%体积的Mal-配体X(650μM)混合,以形成1:3摩尔比,并且在4℃下反应O/N。由于相对高浓度的马来酰亚胺连接的LXY30,在混合后反应物(如CuSO
3.2.4.根据制造商的方案(材料表),用40K MWCO旋转脱盐柱除去未结合的马来酰亚胺-点击-配体X。将LXY30-连接的HEVNP(LXY30-HEVNP)保持在4℃。
3.3.LXY30-连接的HEVNP(配体X-HEVNP)与Cy5.5 NHS酯(NHS-Cy5.5)的一步缀合
3.3.1.在0.01M PBS pH7.4中将1mg/ml的配体X-连接的HEVNP(配体X-VLP)(这相当于18.8μM的Cys反应位点(参见步骤2.2.4中的细节))与等体积的Cy5.5 NHS酯(NHS-Cy5.5,100μM)混合,以形成1:5摩尔比,并在4℃下反应O/N。
3.3.2.根据制造商的方案(Zeba Spin Desalting Columns,40K MWCO,0.5mL),通过经过40K MWCO旋转脱盐柱程序除去未结合的Cy5.5-NHS。将RGD,Cy5.5-连接的HEVNP(RGD-HEVNP-Cy5.5)保持在4℃。
I.HEVNP包封设计
在制剂中,HEVNP可以被配制成片剂、胶囊、散剂或包含在饮料中的液体。已经证明HEVNP亚组分是用于人和动物的安全疫苗。与其它建议的口服胰岛素给药增强剂相反,HEVNP胶囊能够作为专注于粘膜的递送系统(mucosa-focused delivery system),其通过口服途径增强诸如胰岛素的蛋白质有效载荷的生物利用度。基于四级结构的有效载荷被设计成利用大分子属性来延长可执行的保留时间的持续时间。
为了优化胰岛素的包封效率,进行多种测定以检查最佳条件。如图4所示,在包封期间和包封之后,胰岛素在HEVNP中的包封在Tris缓冲液中显示出最高的稳定性和结构均匀性。最佳包封条件被缩小至10-50mM Tris、0-150mM NaCl、在中性pH范围内。相反,MES缓冲液对有效载荷包封提供最少的有利条件,而PBS缓冲液产生高度沉淀。由于Tris缓冲液提供了在溶液中具有蛋白质有效载荷的稳定的单分散的HEVNP,在使用Tris缓冲液的条件下进一步鉴定了最高的包封率。
对于包封,将HEVNP亚基与相应摩尔比的蛋白质有效载荷(如胰岛素)一起孵育,利用在系统中所添加的氯化钙以逐渐组装胶囊。按照如下监测和评估胰岛素包封效率:
1.氯化铯密度梯度分离;通过ELISA(针对HEV和胰岛素)显示了HEVNP和胰岛素的共存(图5)。
2.尺寸排阻柱分离;通过(针对HEV和胰岛素)显示了HEVNP和胰岛素的共存(图6)。
II.具有密度评估的HEVNP封装
在优化缓冲液时,CsCl梯度清楚地显示了在ELISA读数的单个峰内胰岛素和HEVNP的共存,以示例性说明在HEVNP中胰岛素包封效率。“+”表示来自ELISA的正读数,以及HEV和胰岛素在级分6-13中共存。
尺寸评估鉴定了携带胰岛素有效载荷的HEVNP的新构象
SEC显示如ELISA所示的具有重叠的胰岛素和HEVNP的不同峰(由在级分#16和#32之间的+符号表示)。
如第一个峰(红色峰)所示,鉴定胰岛素和HEVNP胶囊共存的另外的证据通过分别按照抗胰岛素抗体和抗HEVNP抗体的特异性的ELISA测定来验证。进一步系统地监测了进一步的包封,以鉴定声处理介导的有效载荷优化为新形式的HEVNP(图5下图):单峰(排除超过35的异常值级分),显示具有胰岛素和HEV的统一峰(通过ELISA验证,在492nm下的吸光度读数)。
III.延长的HEVNP保存期
对于有效的药物递送系统,产品的高稳定性和保存期是关键的。将HEVNP-胰岛素样品在4℃下储存超过一年,并用cryo-EM检查。显微照片显示完整的颗粒,其在储存条件下显示高稳定性。如图8所示,利用冷冻电子显微术以检查具有包封的地特胰岛素的HEVNP颗粒。
IV.HEVNP-胰岛素的结构表征:
已经提供了来自电子显微术的表明胰岛素包封的结果;然而,这些纳米颗粒的2维分布和3维结构特征尚未完全表征。使用内部协议和商购的图像处理包的组合,已经收集并分析了大型数据集,以便1)统计分析颗粒分布,和2)确定胰岛素封装的HEVNP的高分辨率3D结构。
评价TEM图像,表明产生了新构象的HEVNP-胰岛素,其直径为~45nm,几乎是我们先前提交的第一代HEVNP(27nm)的两倍。在这些HEVNP中,新的形状和尺寸似乎最优于携带具有可目视的六聚体节点的挤出链(extruded strands of hexameric nodes)的胰岛素有效载荷。通过冷冻电子显微镜进一步进行3D体积表征以实现结构引导的胰岛素封装效率的优化。通过计算建模,实现了新一代的HEVNP对抗,以完善预先加载封装。使用200kV电子显微镜(JEOL 2100F)以1度增量从-60度至+60度,利用数据分割实施电子3D断层扫描倾斜序列数据的收集以重建HEVNP-胰岛素的3D表达以分析封装机制。使用同步迭代重建技术(Simultaneous Iterative Reconstruction Technique)方法进行3D重建,在图7中其清楚地显示了从HEVNP挤出的胰岛素的分段链。
V.通过大动物模型和小动物模型验证的HEVNP包封:
将小鼠随机分配到2个处理组中的一个,并进行如下的胰岛素耐受试验:
A.以0.1U/小鼠口服施用胰岛素(HEVNP包封的)
B.以1U/小鼠口服施用胰岛素(HEVNP包封的)
假设IP胰岛素给药后血糖浓度降低50%,而口服胰岛素给药后血糖浓度平均降低25%,标准偏差为15%,期望的α误差为5%和80%效力,放置10%小鼠亚组以检测组间的显著差异。
使用轻度异氟烷麻醉和柔性管饲针,通过管饲法进行口服递送。将26G针用于IP注射。将胰岛素和/或HEVNP溶解在0.9%盐水中。如果口服胰岛素制剂通过粘膜吸收以实现所预期的血糖水平降低。
此外,对用糖尿病病症建模的8-10只狗作为"患者"进行试验以葡萄糖监测测量。
VI.全动物成像以追踪包封的有效载荷
使用花青-5.5(Cy5.5)-标记的HEVNP的小鼠体内光学成像先前已在Chen等人的"Chemically activatable viral capsid functionalized for cancer targeting."Nanomedicine 11,no.4(2016):377-390中证实,其中乳腺肿瘤靶向分子(LXY30)与工程化的半胱氨酸臂缀合并且Cy5.5与暴露的赖氨酸残基连接。全动物成像证实具有LXY30的HEVNP将在肿瘤部位积聚。这里,在室温下,在含有0.01M PBS,pH=7.2的缓冲液中将包封胰岛素的HEVNP的表面用Cy5.5 NHS酯(Limiprobe)以300∶1的摩尔比(Cy5.5比HEVNP)装饰2h,然后在4℃下孵育过夜。然后通过7000MWCO脱盐柱(Zeba Spin Desalting Columns,ThermoScientific)除去游离的Cy5.5 NHS酯。Cy5.5在682nm下具有最大激发,在702nm下具有最大发射,并且摩尔消光系数为250,000cm^-1M^-1。
进行全动物成像以追踪HEVNP-胰岛素分布,具有关于光学成像的IVIS光谱(具有~20μm–5mm的分辨力)和关于高分辨率CT的MicroXCT-200(具有~1–20μm的分辨力)。口服胰岛素递送途径为经过胃后通过GI的粘膜内层,经肝门静脉向肝脏递送;因此,纳米颗粒在肝脏中积聚并释放胰岛素。
VII.通过电子显微术描述的分子特征
为了在细胞水平上研究HEVNP分布,实施肝活检并采用高压冷冻方法和冷冻固定法包埋组织。将提取的组织用甲醛进行光固定,随后将其置于样品架中。然后将冷冻的组织固定在树脂块中,然后用超微切片机切片并用透射电子显微术(TEM)筛选。HEVNP通过所添加的对比度(通过金原子簇或通过10nm铁氧体氧化物颗粒)来追踪。电子致密的HEVNP颗粒提供了足够的对比度以通过TEM进行识别。
用JEM 2100F电子显微镜,高压冷冻和TEM准备是为获得细胞水平的超微结构的高分辨率3D图像,如下所述,参见例如Paavolainen et al.,"Compensation of missingwedge effects with sequential statistical reconstruction in electrontomography."PloS one 9,no.10(2014):e108978;Soonsawad et al.,"Permeabilitychanges of integrin-containing multivesicular structures triggered bypicornavirus entry."PloS one 9,no.10(2014):e108948;和Soonsawad et al.,"Structural evidence of glycoprotein assembly in cellular membranecompartments prior to Alphavirus budding."Journal of virology 84,no.21(2010):11145-11151。
本申请中引用的所有专利、专利申请和其它出版物,包括GenBank登录号,出于所有目的通过引用整体并入本文。
参考文献
1.Saaddine JB,Cadwell B,Gregg EW,Et Al.Improvements in diabetes processesof care and intermediate outcomes:United states,1988–2002.Annals of InternalMedicine 144(7),465-474(2006).
2.Hoffman A,Ziv E.Pharmacokinetic considerations of new insulinformulations and routes of administration.Clinical pharmacokinetics 33(4),285-301(1997).
3.Owens DR.New horizons--alternative routes for insulin therapy.Naturereviews.Drug discovery 1(7),529-540(2002).
4.Arbit E,Kidron M.Oral Insulin Delivery in a Physiologic Context:Review.J Diabetes Sci Technol 11(4),825-832(2017).
5.Carino GP,Mathiowitz E.Oral insulin delivery1Abbreviations:GI,gastrointestinal;IDDM,insulin-dependent diabetes mellitus;IU,internationalunits;NIDDM,non-insulin-dependent diabetes mellitus;PIN,phase inversionnanoencapsulation;ZOT,zona occludens toxin.1.Advanced drug delivery reviews35(2),249-257(1999).
6.Heinemann L.New ways of insulin delivery.International journal ofclinical practice.Supplement doi:10.1111/j.1742-1241.2010.02577.x(170),31-46(2011).
7.Fonte P,Araujo F,Reis S,Sarmento B.Oral insulin delivery:how far arewe?J Diabetes Sci Technol 7(2),520-531(2013).
8.Zijlstra E,Heinemann L,Plum-Morschel L.Oral insulin reloaded:astructured approach.J Diabetes Sci Technol 8(3),458-465(2014).
9.Zaykov AN,Mayer JP,Dimarchi RD.Pursuit of a perfect insulin.Naturereviews.Drug discovery 15(6),425-439(2016).
10.Wong CY,Martinez J,Dass CR.Oral delivery of insulin for treatment ofdiabetes:status quo,challenges and opportunities.The Journal of pharmacy andpharmacology 68(9),1093-1108(2016).
11.Samson SL,Chan L.Gene therapy for diabetes:reinventing theislet.Trends Endocrinol Metab 17(3),92-100(2006).
12.Alam T,Wai P,Held D,Vakili ST,Forsberg E,Sollinger H.Correction ofDiabetic Hyperglycemia and Amelioration of Metabolic Anomalies by MinicircleDNA Mediated Glucose-Dependent Hepatic Insulin Production.PloS one 8(6),e67515(2013).
13.Jariyapong P,Xing L,Van Houten NE et al.Chimeric hepatitis E virus-like particle as a carrier for oral-delivery.Vaccine 31(2),417-424(2013).
14.Chen CC,Xing L,Stark M et al.Chemically activatable viral capsidfunctionalized for cancer targeting.Nanomedicine(Lond)11(4),377-390(2016).
15.Cheng RH,Xing L,Chen CC,Stark MC:WO/2015/179321(2015).
16.Takamura S,Niikura M,Li TC et al.DNA vaccine-encapsulated virus-likeparticles derived from an orally transmissible virus stimulate mucosal andsystemic immune responses by oral administration.Gene therapy 11(7),628-635(2004).
17.Cheng RH,Xing L:US8906863(2014).
18.Stark MC,Baikoghli MA,Lahtinen T et al.Structural characterization ofsite-modified nanocapsid with monodispersed gold clusters.Scientific reports7(1),17048(2017).
19.Li W,Chen X.Gold nanoparticles for photoacoustic imaging.Nanomedicine10(2),299-320(2015).
- 用于口服递送胰岛素的病毒样纳米衣壳
- 用于口服递送的改进的病毒样纳米颗粒
