双特异性抗BCMAx抗CD3抗体及其用途
文献发布时间:2023-06-19 10:00:31
本申请以引用的方式并入在2019年7月8日创建并含有63,211字节的以计算机可读形式提交为文件10452WO01-Sequence的序列表。
技术领域
本发明涉及对B细胞成熟抗原(BCMA)具有特异性的抗体及其抗原结合片段及其使用方法。本发明包含结合BCMA及CD3的双特异性抗原结合分子(例如双特异性抗体)及其使用方法。
背景技术
B细胞成熟抗原(BCMA)(也称为TNFRSF17或CD269)为缺乏信号肽并含有富含半胱氨酸的细胞外域的第III型跨膜蛋白。BCMA与密切相关的蛋白质一起在不同发育阶段促进B细胞存活。BCMA仅在B细胞谱系细胞中表达,尤其在生发中心的滤泡间区以及在成浆细胞及分化的浆细胞上。BCMA在浆细胞分化期间经选择性诱导,并且为骨髓中长期存活浆细胞的最佳存活所需。在多发性骨髓瘤中,BCMA在恶性浆细胞上以较高水平广泛表达,并且BCMA表达随着从正常细胞向活性多发性骨髓瘤的进展而增加。BCMA还在其它B细胞恶性肿瘤中表达,包含瓦尔登斯特伦氏巨球蛋白血症(
CD3为在T细胞上表达与T细胞受体复合物(TCR)相关联的均二聚或异二聚抗原并且为T细胞活化所需。功能性CD3由四个不同链中的两个的二聚结合物形成:ε、ζ、δ及γ。CD3二聚排列包含γ/ε、δ/ε及ζ/ζ。已展示对抗CD3的抗体在T细胞上聚集CD3,从而以类似于通过肽负载MHC分子参与TCR的方式引起T细胞活化。因此,已提出抗CD3抗体用于涉及T细胞活化的治疗目的。此外,已提出能够结合CD3及靶抗原的双特异性抗体用于涉及靶向对表达靶抗原的组织及细胞的T细胞免疫反应的治疗用途。
靶向BCMA的抗原结合分子(包含结合BCMA及CD3的双特异性抗原结合分子)将在需要表达BCMA的细胞的特异性靶向及T细胞介导杀伤的治疗设定中有用。
发明内容
在一个方面,本发明提供经分离双特异性抗原结合分子,其包括:(a)特异性结合目标肿瘤细胞上的人类B细胞成熟抗原(BCMA)的第一抗原结合域,如通过体外FACS结合分析所测量EC
在一些情况下,双特异性抗原结合分子体外活化T细胞,EC
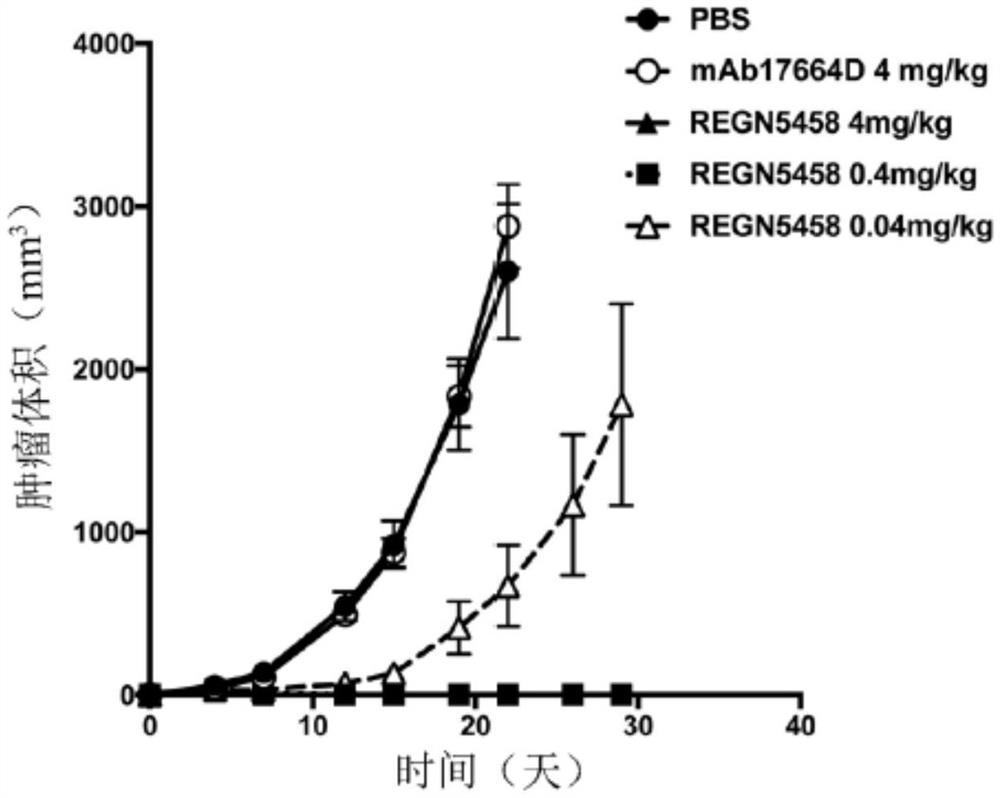
在一些情况下,靶肿瘤细胞为浆细胞。在一些情况下,靶肿瘤细胞来自患有多发性骨髓瘤或另一B细胞病症的患者,所述B细胞病症部分特征在于具有表达BCMA的B细胞。在一些情况下,双特异性抗原结合分子以约0.04mg/kg至约4.0mg/kg的剂量抑制表达BCMA的肿瘤细胞的增殖。在一些情况下,剂量为0.04mg/kg、0.4mg/kg或4mg/kg。在一些实施例中,每周至少两次向有需要的患者给予剂量持续至少七个剂量。在一些情况下,双特异性抗原结合分子抑制BCMA+肿瘤细胞的增殖,所述肿瘤细胞选自由骨髓瘤细胞、淋巴瘤细胞及白血病细胞组成的群组。在一些情况下,双特异性抗原结合分子抑制BCMA+肿瘤细胞的增殖,所述肿瘤细胞选自由H929细胞、MOLP-8细胞及OPM细胞组成的群组。
在一些情况下,双特异性抗原结合分子与食蟹猕猴BCMA交叉反应。在一些情况下,双特异性抗原结合分子不与食蟹猕猴BCMA交叉反应。
在一些实施例中,经分离双特异性抗原结合分子包括第一抗原结合域,所述第一抗原结合域包括:(a)含于包括SEQ ID NO:66的氨基酸序列的重链可变区(HCVR)内的三个重链互补决定区(HCDR1、HCDR2及HCDR3)(b)含于包括SEQ ID NO:82的氨基酸序列的轻链可变区(LCVR)内的三个轻链互补决定区(LCDR1、LCDR2及LCDR3)。在一些情况下,经分离双特异性抗原结合分子包括有包括SEQ ID NO:68的氨基酸序列的HCDR1、包括SEQ ID NO:70的氨基酸序列的HCDR2及包括SEQ ID NO:72的氨基酸序列的HCDR3。在一些情况下,经分离双特异性抗原结合分子包括有包括SEQ ID NO:84的氨基酸序列的LCDR1、包括SEQ ID NO:86的氨基酸序列的LCDR2及包括SEQ ID NO:88的氨基酸序列的LCDR3。在一些情况下,第一抗原结合域包括有包括SEQ ID NO:66的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR。
在一些实施例中,经分离双特异性抗原结合分子包括第二抗原结合域,所述第二抗原结合域包括:(a)含于包括SEQ ID NO:90或SEQ ID NO:98的氨基酸序列的重链可变区(HCVR)内的三个重链互补决定区(HCDR1、HCDR2及HCDR3);及(b)含于包括SEQ ID NO:82的氨基酸序列的轻链可变区(LCVR)内的三个轻链互补决定区(LCDR1、LCDR2及LCDR3)。在一些情况下,第二抗原结合域包括:(a)包括SEQ ID NO:92或SEQ ID NO:100的氨基酸序列的HCDR1;(b)包括SEQ ID NO:94或SEQ ID NO:102的氨基酸序列的HCDR2;及(c)包括SEQ IDNO:96或SEQ ID NO:104的氨基酸序列的HCDR3。在一些情况下,第二抗原结合域包括有包括SEQ ID NO:84的氨基酸序列的LCDR1、包括SEQ ID NO:86的氨基酸序列的LCDR2及包括SEQID NO:88的氨基酸序列的LCDR3。在一些情况下,第二抗原结合域包括:(a)分别包括SEQ IDNO:92、94、96的氨基酸序列的HCDR1、HCDR2、HCDR3域;及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域;或(b)分别包括SEQ ID NO:100、102、104的氨基酸序列的HCDR1、HCDR2、HCDR3域;及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域。在一些情况下,第二抗原结合域包括:(a)包括SEQ ID NO:90的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR;或(b)包括SEQ ID NO:98的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR。
在另一方面,本发明提供经分离双特异性抗原结合分子,其包括:(a)第一抗原结合域,其包括有分别包括SEQ ID NO:68、70、72的氨基酸序列的HCDR1、HCDR2、HCDR3域以及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域;及(b)第二抗原结合域,其包括有分别包括SEQ ID NO:92、94、96的氨基酸序列的HCDR1、HCDR2、HCDR3域以及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域。在一些情况下,经分离双特异性抗原结合分子包括:(a)第一抗原结合域,其包括有包括SEQ ID NO:66的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR;及(b)第二抗原结合域,其包括有包括SEQ ID NO:90的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR。
在另一方面,本发明提供经分离双特异性抗原结合分子,其包括:(a)第一抗原结合域,其包括有分别包括SEQ ID NO:68、70、72的氨基酸序列的HCDR1、HCDR2、HCDR3域以及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域;及(b)第二抗原结合域,其包括有分别包括SEQ ID NO:100、102、104的氨基酸序列的HCDR1、HCDR2、HCDR3域以及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域。在一些情况下,经分离双特异性抗原结合分子包括:(a)第一抗原结合域,其包括有包括SEQ ID NO:66的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR;及(b)第二抗原结合域,其包括有包括SEQ ID NO:98的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR。
在另一方面,本发明提供经分离双特异性抗原结合分子,其包括:(a)第一抗原结合域,其特异性结合人类BCMA并包括有包括选自由SEQ ID NO:2、18、34、50、66、122及124组成的群组的氨基酸序列的HCVR的CDR以及包括选自由SEQ ID NO:10、26、42、58、74、82、123及125组成的群组的氨基酸序列的LCVR的CDR;及(b)第二抗原结合域,其特异性结合人类CD3。在一些情况下,第一抗原结合域包括来自选自由SEQ ID NO:2/10、18/26、34/42、50/58、66/74、122/123、124/125、2/82、18/82、34/82、50/82、66/82、122/82及124/82组成的群组的HCVR/LCVR氨基酸序列对的CDR。在一些情况下,第一抗原结合域包括HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3域,分别选自由SEQ ID NO:4-6-8-12-14-16、20-22-24-28-30-32、36-38-40-44-46-48、52-54-56-60-62-64、68-70-72-76-78-80、4-6-8-84-86-88、20-22-24-84-86-88、36-38-40-84-86-88、52-54-56-84-86-88及68-70-72-84-86-88组成的群组。在一些情况下,第一抗原结合域包括选自由SEQ ID NO:2/10、18/26、34/42、50/58、66/74、122/123、124/125、2/82、18/82、34/82、50/82、66/82、122/82及124/82组成的群组的HCVR/LCVR氨基酸序列对。在一些情况下,第二抗原结合域包括选自由SEQ ID NO:90/82及98/82组成的群组的HCVR/LCVR氨基酸序列对的CDR。
在另一方面,本发明提供竞争结合BCMA或结合BCMA上的与参考抗体相同的表位的经分离双特异性抗原结合分子,其中所述参考抗体包括第一抗原结合域及第二抗原结合域,所述第一抗原结合域包括有包括SEQ ID NO:66/82的氨基酸序列的HCVR/LCVR对,所述第二抗原结合域包括有包括SEQ ID NO:90/82或SEQ ID NO:98/82的氨基酸序列的HCVR/LCVR对。
在另一方面,本发明提供竞争结合人类CD3或结合人类CD3上的与参考抗体相同的表位的经分离双特异性抗原结合分子,其中所述参考抗体包括第一抗原结合域及第二抗原结合域,所述第一抗原结合域包括有包括SEQ ID NO:66/82的氨基酸序列的HCVR/LCVR对,所述第二抗原结合域包括有包括SEQ ID NO:90/82或SEQ ID NO:98/82的氨基酸序列的HCVR/LCVR对。
上文或本文所论述的任何双特异性抗原结合分子可为双特异性抗体。在一些情况下,双特异性抗体包括人类IgG重链恒定区。在一些情况下,人类IgG重链恒定区为同型IgG1。在一些情况下,人类IgG重链恒定区为同型IgG4。在各种实施例中,双特异性抗体包括嵌合铰链,所述嵌合铰链相对于相同同型的野生型铰链减少Fcγ受体结合。
在另一方面,本发明提供一种包括上文或本文所论述的双特异性抗原结合分子(例如双特异性抗体)及药学上可接受的载剂或稀释剂的医药组合物。
在另一方面,本发明提供一种包括编码上文或本文所论述的双特异性抗原结合分子(例如双特异性抗体)的核苷酸序列的核酸分子。
在另一方面,本发明提供一种包括上文所论述的核酸分子的表达载体。
在另一方面,本发明提供一种包括上文所论述的表达载体的宿主细胞。
在另一方面,本发明提供一种抑制个体的浆细胞肿瘤的生长的方法,其包括向个体给予如上文或本文所论述的经分离双特异性抗原结合分子或包括双特异性抗原结合分子的医药组合物。在一些情况下,浆细胞肿瘤为多发性骨髓瘤。在一些情况下,所述方法进一步包括给予第二治疗剂或治疗方案。在一些实施例中,第二治疗剂包括抗肿瘤剂(例如化学治疗剂,包含美法仑(melphalan)、长春新碱(vincristine)(安可平(Oncovin))、环磷酰胺(cyclophosphamide)(癌得星(Cytoxan))、依托泊苷(etoposide)(VP-16)、小红莓(doxorubicin)(阿德力霉素(Adriamycin))、小红莓脂质体(liposomal doxorubicin)(多希(Doxil))、苯达莫司汀(bendamustine)(特瑞达(Treanda))或任何其它已知在治疗个体的浆细胞肿瘤中有效的化学治疗剂)。在一些实施例中,第二治疗剂包括类固醇。在一些实施例中,第二治疗剂包括靶向疗法,包含沙利度胺(thalidomide)、来那度胺(enalidomide)及硼替佐米(bortezomib),所述疗法为批准用于治疗新诊断患者的疗法。来那度胺、泊马度胺(pomalidomide)、硼替佐米、卡非佐米(carfilzomib)、帕比司他(panobinostat)、依萨佐米(ixazomib)、埃罗妥珠单抗(elotuzumab)及达雷木单抗(daratumumab)为有效治疗复发性骨髓瘤的第二治疗剂的实例。在某些实施例中第二治疗剂为包括放射疗法或干细胞移植的方案。在某些实施例中,第二治疗剂可为免疫调节剂。在某些实施例中,第二治疗剂可为蛋白酶体抑制剂,包含硼替佐米(万珂(Velcade))、卡非佐米(凯普罗里斯(Kyprolis))、依萨佐米(恩莱瑞(Ninlaro))。在某些实施例中第二治疗剂可为组蛋白去乙酰基酶抑制剂,如帕比司他(法瑞达克(Farydak))。在某些实施例中,第二治疗剂可为单克隆抗体、抗体药物缀合物、与抗肿瘤剂缀合的双特异性抗体、检查点抑制剂或其组合。
在另一方面,本发明提供一种治疗患有多发性骨髓瘤或患有另一表达BCMA的B细胞恶性肿瘤的患者的方法,其中所述方法包括向个体给予如上文或本文所论述的经分离双特异性抗原结合分子或包括双特异性抗原结合分子的医药组合物。在一些情况下,表达BCMA的B细胞恶性肿瘤选自由以下组成的群组:瓦尔登斯特伦氏巨球蛋白血症、伯基特氏淋巴瘤及弥漫性大B细胞淋巴瘤、非霍奇金氏淋巴瘤(Non-Hodgkin's lymphoma)、慢性淋巴球性白血病、滤泡性淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、淋巴浆细胞淋巴瘤及霍奇金氏淋巴瘤(Hodgkin's lymphoma)。在一些情况下,所述方法进一步包括给予第二治疗剂。在一些实施例中,第二治疗剂包括抗肿瘤剂(化学治疗剂)、DNA烷基化剂、免疫调节剂、蛋白酶体抑制剂、组蛋白去乙酰基酶抑制剂放射疗法、干细胞移植、与在肿瘤细胞表面上表达的抗原相互作用的单克隆抗体、除本文所描述的那些单克隆抗体以外的单克隆抗体(其可与浆细胞表面上的不同抗原相互作用)、双特异性抗体(其具有一个结合肿瘤细胞表面上的抗原的臂及另一结合T细胞上的抗原的臂)、抗体药物缀合物、与抗肿瘤剂缀合的双特异性抗体、检查点抑制剂(例如靶向PD-1或CTLA-4的检查点抑制剂)或其组合。在某些实施例中,检查点抑制剂可选自PD-1抑制剂,如派姆单抗(pembrolizumab)(克珠达(Keytruda))、纳武单抗(nivolumab)(欧狄沃(Opdivo))或赛咪单抗(cemiplimab)(REGN2810)。在某些实施例中,检查点抑制剂可选自PD-L1抑制剂,如阿特珠单抗(atezolizumab)(特森催克(Tecentriq))、阿维鲁单抗(avelumab)(巴文西亚(Bavencio))或德瓦鲁单抗(Durvalumab)(英菲尼(Imfinzi))。在某些实施例中,检查点抑制剂可选自CTLA-4抑制剂,如伊匹单抗(ipilimumab)(易沃伊(Yervoy))。可与本发明抗体结合使用的其它组合为上文所述。
在另一方面,本发明提供一种治疗患有表达BCMA的肿瘤的方法,其中所述方法包括向个体给予如上文或本文所论述的经分离双特异性抗原结合分子或包括其的医药组合物与抗PD-1抗体或其抗原结合片段的组合。在一些情况下,抗PD-1抗体或抗原结合片段为抗PD-1抗体。在一些实施例中,抗PD-1抗体为赛咪单抗(cemiplimab)(REGN2810)。在各种实施例中,抗BCMA x抗CD3双特异性抗原结合分子(例如双特异性抗体)与抗PD-1抗体或抗原结合片段(例如抗PD-1抗体)的组合在治疗表达BCMA的肿瘤中产生协同疗效。
在另一方面,本发明提供上文或本文所论述的双特异性抗原结合分子或上文或本文所论述的医药组合物的用途,其用于治疗与BCMA的表达有关的疾病或病症。在一些情况下,疾病或病症为癌症。在一些实施例中,癌症为多发性骨髓瘤。在一些情况下,疾病或病症为卡斯特莱曼病(Castleman disease)。在一些情况下,抗原结合分子用于与抗PD-1抗体或其抗原结合片段组合使用,任选地其中抗PD-1抗体为赛咪单抗(REGN2810)。
本发明进一步包含上文或本文所论述的双特异性抗原结合分子的用途,用于制造用以治疗与BCMA的表达有关的疾病或病症的药剂。在一些情况下,疾病或病症为癌症。在一些实施例中,癌症为多发性骨髓瘤。
在各种实施例中,上文或本文所论述的实施例的任何特征或组成部分可组合,并且所述组合涵盖于本发明的范围内。上文或本文所论述的任何具体值可与上文或本文所论述的另一相关值组合以叙述具有代表范围的上端及下端值的范围,并且所述范围涵盖于本发明的范围内。
其它实施例将由随后实施方式的综述变得显而易见。
附图说明
图1及图2分别说明利用抗BCMA x抗CD3双特异性抗体REGN5458及REGN5459的表达BCMA的NCI-H929人类多发性骨髓瘤肿瘤细胞的体内预防性剂量依赖性肿瘤抑制。NCI-H929细胞表达高水平的BCMA。
图3及图4分别说明利用抗BCMA x抗CD3双特异性抗体REGN5458及REGN5459的已建立的表达BCMA的NCI-H929人类多发性骨髓瘤肿瘤细胞的体内治疗剂量依赖性肿瘤抑制。NCI-H929细胞表达高水平的BCMA。
图5及图6分别说明利用抗BCMA x抗CD3双特异性抗体REGN5458及REGN5459的表达BCMA的MOLP-8人类多发性骨髓瘤肿瘤细胞的体内预防性剂量依赖性肿瘤抑制。MOLP-8细胞表达中等水平的BCMA。
图7说明相对于对照通过抗BCMA x抗CD3双特异性抗体REGN5458及REGN5459体内治疗性降低表达BCMA的OPM-2人类多发性骨髓瘤肿瘤细胞的已建立的肿瘤负荷。OPM-2细胞表达低水平的BCMA。
具体实施方式
在描述本发明之前,应理解本发明不限于所描述的特定方法及实验条件,因而方法及条件可改变。还应理解,本文所用的术语仅用于描述特定实施例的目的,并且并不意图为限制性的,因为本发明的范围将仅由所附权利要求书限制。
除非另外定义,否则本文所用的所有技术及科学术语具有与本发明所属领域的一般技术人员通常所理解相同的含义。如本文所用,当关于特定叙述数值使用时,术语“约”意指值可在叙述值不超过1%的范围内变化。举例来说,如本文所用,表述“约100”包含99及101以及其间的所有值(例如99.1、99.2、99.3、99.4等)。
尽管类似或等效于本文所描述的方法及材料的任何方法及材料可用于本发明的实践或测试中,但现描述优选方法及材料。本说明书中提及的所有专利、申请及非专利公开均以全文引用的方式并入本文中。
定义
如本文所用,表述“CD3”指代作为多分子T细胞受体(TCR)的部分在T细胞上表达的抗原,并且其由均二聚体或杂二聚体组成,所述均二聚体或杂二聚体由以下四个受体链中的两个的缔合形成:CD3-ε、CD3-δ、CD3-ζ及CD3-γ。人类CD3-ε包括如SEQ ID NO:116中所示的氨基酸序列;人类CD3-δ包括如SEQ ID NO:117中所示的氨基酸序列;人类CD3-ζ包括如SEQ ID NO:118中所示的氨基酸序列;及CD3-γ包括如SEQ ID NO:119中所示的氨基酸序列。除非明确指定为来自非人类物种,否则本文中对蛋白、多肽及蛋白片段的所有参考都意图指对应蛋白、多肽或蛋白片段的人类版本。因此,除非指定为来自非人类物种,例如“小鼠CD3”、“猴CD3”等,否则表述“CD3”意指人类CD3。
如本文所用,“结合CD3的抗体”或“抗CD3抗体”包含特异性识别单一CD3亚单元(例如ε、δ、γ或ζ)的抗体及其抗原结合片段以及特异性识别两个CD3亚单元的二聚复合物(例如γ/ε、δ/ε及ζ/ζCD3二聚体)的抗体及其抗原结合片段。本发明抗体及抗原结合片段可结合可溶性CD3和/或细胞表面表达的CD3。可溶性CD3包含天然CD3蛋白以及重组CD3蛋白变异体,如例如单体及二聚CD3构建体,其缺少跨膜域或以其它方式与细胞膜无关。
如本文所用,表述“细胞表面表达的CD3”意指在体外或体内细胞的表面上表达的一种或多种CD3蛋白,从而CD3蛋白的至少一部分暴露于细胞膜的细胞外侧面并且可接近抗体的抗原结合部分。“细胞表面表达的CD3”包含在细胞膜中的功能性T细胞受体情形内所含的CD3蛋白。表述“细胞表面表达的CD3”包含在细胞表面上作为均二聚体或杂二聚体(例如γ/ε、δ/ε及ζ/ζCD3二聚体)的部分表达的CD3蛋白。表述“细胞表面表达的CD3”还包含在细胞表面上由自身表达(无其它CD3链类型)的CD3链(例如CD3-ε、CD3-δ或CD3-γ)。“细胞表面表达的CD3”可包括在通常表达CD3蛋白的细胞表面上表达的CD3蛋白质或由其组成。或者,“细胞表面表达的CD3”可包括在细胞的表面上表达的CD3蛋白质或由其组成,所述细胞通常不在其表面上表达人类CD3但已经人工工程改造以在其表面上表达CD3。
如本文所用,表述“BCMA”指代B细胞成熟抗原。BCMA(也称为TNFRSF17及CD269)为在恶性浆细胞上表达的细胞表面蛋白并在调节B细胞成熟及分化成产生免疫球蛋白的浆细胞中起中心作用。人类BCMA的氨基酸序列展示于SEQ ID NO:115中,并且也可见于GenBank登录号NP_001183.2中。
如本文所用,“结合BCMA的抗体”或“抗BCMA抗体”包含特异性识别BCMA的抗体及其抗原结合片段。
术语“抗原结合分子”包含抗体及抗体的抗原结合片段,包含例如双特异性抗体。
如本文所用,术语“抗体”意指包括至少一个特异性结合特定抗原(例如BCMA或CD3)或与特定抗原相互作用的互补决定区(CDR)的任何抗原结合分子或分子复合物。术语“抗体”包含包括通过双硫键互连的四个多肽链(两个重(H)链及两个轻(L)链)的免疫球蛋白分子以及其多聚体(例如IgM)。术语“抗体”还包含由通过双硫键互连的四个多肽链(两个重(H)链及两个轻(L)链)组成的免疫球蛋白分子。各重链包括重链可变区(本文中缩写为HCVR或V
如本文所用,术语“抗体”还包含完整抗体分子的抗原结合片段。如本文所用,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”及类似术语包含特异性结合抗原以形成复合物的任何天然存在、以酶方式可获得、合成或经基因工程改造的多肽或醣蛋白。抗体的抗原结合片段可例如使用任何适合的标准技术由完整抗体分子衍生,所述标准技术如蛋白水解消化或涉及操纵及表达编码抗体可变域及任选的恒定域的DNA的重组基因工程改造技术。所述DNA为已知的和/或易于从例如商业来源、DNA库(包含例如噬菌体-抗体库)购得或可合成。DNA可以化学方式或通过使用分子生物学技术定序及操纵,例如将一个或多个可变域和/或恒定域配置成适合配置,或引入密码子,产生半胱氨酸残基,修饰、添加或删除氨基酸等。
抗原结合片段的非限制性实例包含:(i)Fab片段;(ii)F(ab')2片段;(iii)Fd片段;(iv)Fv片段;(v)单链Fv(scFv)分子;(vi)dAb片段;及(vii)由模拟抗体(例如经分离互补决定区(CDR),如CDR3肽)或受限FR3-CDR3-FR4肽的高变区的氨基酸残基组成。其它经工程改造的分子,如域特异性抗体、单域抗体、域缺失抗体、嵌合抗体、CDR移植抗体、双功能抗体、三功能抗体、四功能抗体、微型抗体、纳米抗体(例如单价纳米抗体、二价纳米抗体等)、小模块免疫药物(SMIP)及鲨鱼可变IgNAR域还涵盖在如本文所用的表述“抗原结合片段”内。
抗体的抗原结合片段将通常包括至少一个可变域。可变域可具有任何尺寸或氨基酸组成并且一般将包括至少一个与一个或多个框架序列相邻或同框的CDR。在具有与V
在某些实施例中,抗体的抗原结合片段可含有至少一个共价连接至至少一个恒定域的可变域。可发现于本发明抗体的抗原结合片段内的可变域及恒定域的非限制性示例性配置包含:(i)V
如同完整抗体分子,抗原结合片段可为单特异性或多特异性的(例如双特异性的)。抗体的多特异性抗原结合片段将通常包括至少两个不同可变域,其中各可变域能够特异性结合单独抗原或相同抗原上的不同表位。任何多特异性抗体型式,包含本文所公开的示例性双特异性抗体型式可使用所属领域中可用的常规技术而经调适用于本发明抗体的抗原结合片段的情形下。
本发明抗体可经由补体依赖性细胞毒性(CDC)或抗体依赖性细胞介导的细胞毒性(ADCC)起作用。“补体依赖性细胞毒性”(CDC)指代在补体存在下,表达抗原的细胞由本发明抗体裂解。“抗体依赖性细胞介导的细胞毒性”(ADCC)指代细胞介导的反应,其中表达Fc受体(FcR)的非特异性细胞毒性细胞(例如自然杀伤(NK)细胞、嗜中性粒细胞及巨噬细胞)识别靶细胞上的结合的抗体并且由此引起靶细胞的裂解。可使用所属领域中熟知并且可用的分析测量CDC及ADCC。(参见例如美国专利第5,500,362号及第5,821,337号,以及Clynes等人,(1998)《美国科学院院报(Proc.Natl.Acad.Sci.)》(USA)95:652-656)。抗体的恒定区在抗体固定补体及介导细胞依赖性细胞毒性的能力中至关重要。因此,可基于是否需要抗体介导细胞毒性来选择抗体的同型。
在本发明的某些实施例中,本发明的抗BCMA单特异性抗体或抗BCMA x抗CD3双特异性抗体为人类抗体。如本文所用,术语“人类抗体”意图包含具有衍生自人类生殖系免疫球蛋白序列的可变区及恒定区的抗体。本发明的人类抗体可包含不由人类生殖系免疫球蛋白序列编码的氨基酸残基(例如通过体外无规或位点特异性突变诱发或通过体内体细胞突变引入的突变),例如在CDR并且尤其CDR3中。然而,如本文所用,术语“人类抗体”并不意图包含其中衍生自另一哺乳动物物种(如小鼠)的生殖系的CDR序列已移植至人类框架序列上的抗体。
在一些实施例中,本发明抗体可为重组人类抗体。如本文所用,术语“重组人类抗体”意图包含通过重组方式制备、表达、形成或分离的所有人类抗体,如使用转染至宿主细胞中的重组表达载体表达的抗体(下文进一步描述),从重组、组合人类抗体库分离的抗体(下文进一步描述),从为人类免疫球蛋白基因的转基因的动物(例如小鼠)分离的抗体(参见例如Taylor等人(1992)《核酸研究(Nucl.Acids Res.)》20:6287-6295);或通过涉及将人类免疫球蛋白基因序列拼接至其它DNA序列的任何其它方式制备、表达、形成或分离的抗体。所述重组人类抗体具有衍生自人类生殖系免疫球蛋白序列的可变区及恒定区。然而,在某些实施例中,所述重组人类抗体经受体外突变诱发(或当使用人类Ig序列的动物转基因时为体内体细胞突变诱发),并且因此重组抗体的V
人类抗体可以两种与铰链异质性相关的形式存在。在一种形式中,免疫球蛋白分子包括约150至160kDa的稳定四链构建体,其中二聚体通过链间重链双硫键保持在一起。在第二形式中,二聚体不经由链间双硫键连接并且形成由共价偶联轻链及重链构成的约75至80kDa的分子(半抗体)。这些形式已极难分开,即使在亲和纯化之后也如此。
第二形式在各种完整IgG同型中的出现频率归因于(但不限于)与抗体的铰链区同型有关的结构差异。人类lgG4铰链的铰链区中的单一氨基酸取代可使第二形式的出现显著减少(Angal等人(1993)《分子免疫学(Molecular Immunology)》30:105)至通常使用人类lgG1铰链观察的水平。本发明涵盖在铰链、C
本发明抗体可为经分离抗体。如本文所用,“经分离抗体”意指经鉴别并且从其天然环境的至少一种组分分离和/或回收的抗体。举例来说,出于本发明的目的从生物体的至少一种组分、或从其中抗体天然存在或天然产生的组织或细胞分离或移出的抗体为“经分离抗体”。经分离抗体还包含重组细胞内的原位抗体。经分离抗体为已经受至少一个纯化或分离步骤的抗体。根据某些实施例,经分离抗体可基本上不含其它细胞材料和/或化学物质。
本发明还包含结合BCMA的单臂抗体。如本文所用,“单臂抗体”意指包括单个抗体重链及单个抗体轻链的抗原结合分子。本发明的单臂抗体可包括如表1中所示的任何HCVR/LCVR或CDR氨基酸序列。
与衍生出抗体的对应生殖系序列相比,本文所公开的抗BCMA或抗BCMA x抗CD3抗体可在重链及轻链可变域的框架区和/或CDR区中包括一个或多个氨基酸取代、插入和/或缺失。所述突变可容易地通过比较本文所公开的氨基酸序列与购自例如公共抗体序列数据库的生殖系序列来确定。本发明包含衍生自本文所公开的任何氨基酸序列的抗体及其抗原结合片段,其中一个或多个框架区和/或CDR区内的一个或多个氨基酸突变成衍生出抗体的生殖系序列的对应残基或突变成另一人类生殖系序列的对应残基或突变成对应生殖系残基的保守氨基酸取代(所述序列变化在本文中统称为“生殖系突变”)。所属领域的一般技术人员从本文所公开的重链及轻链可变区序列开始,可容易地产生许多包括一个或多个个别生殖系突变或其组合的抗体及抗原结合片段。在某些实施例中,V
本发明还包含抗BCMA或抗BCMA x抗CD3抗体,其包括本文所公开的任何HCVR、LCVR和/或CDR氨基酸序列的具有一个或多个保守取代的变异体。举例来说,本发明包含具有HCVR、LCVR和/或CDR氨基酸序列的抗BCMA或抗BCMA x抗CD3抗体,所述氨基酸序列相对于在本文表1及表3中所示的任何HCVR、LCVR和/或CDR氨基酸序列或WO 2014/047231或WO 2017/053856(其各自以引用的方式并入本文中)中所公开的抗CD3抗体具有例如10个或更少、8个或更少、6个或更少、4个或更少等的保守氨基酸取代。
术语“表位”指代与称为互补位的抗体分子的可变区中的特异性抗原结合位点相互作用的抗原决定子。单一抗原可具有超过一个表位。因此,不同抗体可结合抗原上的不同区域并且可具有不同生物作用。表位可为构形或线性的。构形表位通过来自线性多肽链的不同链段的空间并列氨基酸产生。线性表位为由多肽链中的相邻氨基酸残基产生的表位。在某些情形下,表位可包含抗原上的醣类、磷酰基或磺酰基部分。
当提及核酸或其片段时,术语“大体一致”或“大体上一致”指示当与经另一核酸(或其互补股)的适当核苷酸插入或缺失最佳比对时,在至少约95%,并且更优选至少约96%、97%、98%或99%的核苷酸碱基中存在核苷酸序列一致性,如通过如下文所论述的序列一致性的任何熟知算法(如FASTA、BLAST或Gap)所测量。在某些情况下,与参考核酸分子大体一致的核酸分子可编码具有与由参考核酸分子所编码的多肽相同或大体上类似的氨基酸序列的多肽。
如应用于多肽,术语“大体类似性”或“大体上类似”意指两个肽序列在如通过程序GAP或BESTFIT使用默认空位权重最佳比对时,具有至少95%序列一致性,甚至更优选至少98%或99%序列一致性。优选地,不一致的残基位置的差异在于保守氨基酸取代。“保守氨基酸取代”是其中一个氨基酸残基经另一具有带有类似化学特性(例如电荷或疏水性)的侧链(R基团)的氨基酸残基取代的取代。一般来说,保守氨基酸取代不会大体上改变蛋白的功能特性。在两个或更多个氨基酸序列因保守取代与彼此不同的情况下,可上调序列一致性或类似性程度百分比以针对取代的保守性质加以校正。进行这一调节的方式为所属领域的技术人员所熟知。参见例如Pearson(1994)《分子生物学方法(Methods Mol.Biol.)》24:307-331,其以引用的方式并入本文中。具有带有类似化学特性的侧链的氨基酸群组的实例包含(1)脂肪族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸及异亮氨酸;(2)脂肪族羟基侧链:丝氨酸及苏氨酸;(3)含酰胺侧链:天冬酰胺及谷氨酰胺;(4)芳香族侧链:苯丙氨酸、酪氨酸及色氨酸;(5)碱性侧链:赖氨酸、精氨酸及组氨酸;(6)酸性侧链:天冬氨酸及谷氨酸,及(7)含硫侧链为半胱氨酸及甲硫氨酸。优选保守氨基酸取代群组为:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、谷氨酸-天冬氨酸及天冬酰胺-谷氨酰胺。可替代地,保守替代为在Gonnet等人(1992)《科学(Science)》256:1443-1445(其以引用的方式并入本文中)中所公开的PAM250对数似然矩阵中具有正值的任何变化。“适度保守”替代为在PAM250对数似然矩阵中具有非负值的任何变化。
多肽的序列类似性(也称为序列一致性)通常使用序列分析软件来测量。蛋白分析软件使用分配至各种取代、缺失及其它修饰(包含保守氨基酸取代)的类似性测量来匹配类似序列。举例来说,GCG软件含有如Gap及Bestfit的程序,其可在默认参数下使用以测定密切相关的多肽(如来自生物体的不同物种的同源多肽)之间或野生型蛋白与其突变蛋白之间的序列同源性或序列一致性。参见例如GCG 6.1版。多肽序列还可使用FASTA(GCG 6.1版中的程序)使用默认或推荐参数进行比较。FASTA(例如FASTA2及FASTA3)提供查询序列与检索序列之间的最佳重叠区的比对及序列一致性百分比(Pearson(2000),见上文)。当比较本发明的序列与含有大量来自不同生物体的序列的数据库时,另一优选算法为使用默认参数的计算机程序BLAST,尤其BLASTP或TBLASTN。参见例如Altschul等人(1990)《分子生物学杂志(J.Mol.Biol.)》215:403-410及Altschul等人(1997)《核酸研究》25:3389-402,其各自以引用的方式并入本文中。
生殖系突变
与衍生出抗体的对应生殖系序列相比,本文所公开的抗CD3抗体可在重链可变域的框架区和/或CDR区中包括一个或多个氨基酸取代、插入和/或缺失。
本发明还包含衍生自本文所公开的任何氨基酸序列的抗体及其抗原结合片段,其中一个或多个框架区和/或CDR区内的一个或多个氨基酸突变成衍生出抗体的生殖系序列的对应残基或突变成另一人类生殖系序列的对应残基或突变成对应生殖系残基的保守氨基酸取代(所述序列变化在本文中统称为“生殖系突变”),并且具有与CD3抗原的弱或不可检测结合。
此外,本发明抗体可在框架区和/或CDR区内含有两个或更多个生殖系突变的任何组合,例如其中某些个别残基突变成特定生殖系序列的对应残基,而不同于原始生殖系序列的某些其它残基维持不变或突变成不同生殖系序列的对应残基。在获得之后,可以测试含有一个或多个生殖系突变的抗体及抗原结合片段的一种或多种所期望的特性,如提高的结合特异性、弱或降低的结合亲和力、提高或增强的药物动力学特性、降低的免疫原性等。以此一般方式在本发明的引导的情况下获得的抗体及抗原结合片段涵盖在本发明内。
本发明还包含抗原结合分子,其包括具有与本文所公开的任何HCVR和/或CDR氨基酸序列大体上一致的HCVR和/或CDR氨基酸序列的抗原结合域,同时维持或提高所需的与CD3抗原的弱亲和力。当提及氨基酸序列时,术语“大体一致”或“大体上一致”意指两个氨基酸序列在最佳比对(如通过程序GAP或BESTFIT使用默认空位权重)时,具有至少95%序列一致性,甚至更优选至少98%或99%序列一致性。优选地,不一致的残基位置的差异在于保守氨基酸取代。在两个或更多个氨基酸序列因保守取代与彼此不同的情况下,可上调序列一致性或类似性程度百分比以针对取代的保守性质加以校正。进行这一调节的方式为所属领域的技术人员所熟知。参见例如Pearson(1994)《分子生物学方法》24:307-331。
多肽的序列类似性(也称为序列一致性)通常使用序列分析软件来测量。蛋白分析软件使用分配至各种取代、缺失及其它修饰(包含保守氨基酸取代)的类似性测量来匹配类似序列。举例来说,GCG软件含有如Gap及Bestfit的程序,其可在默认参数下使用以测定密切相关的多肽(如来自生物体的不同物种的同源多肽)之间或野生型蛋白与其突变蛋白之间的序列同源性或序列一致性。参见例如GCG 6.1版。多肽序列还可使用FASTA(GCG 6.1版中的程序)使用默认或推荐参数进行比较。FASTA(例如FASTA2及FASTA3)提供查询序列与检索序列之间的最佳重叠区的比对及序列一致性百分比(Pearson(2000),见上文)。当比较本发明的序列与含有大量来自不同生物体的序列的数据库时,另一优选算法为使用默认参数的计算机程序BLAST,尤其BLASTP或TBLASTN。参见例如Altschul等人(1990)《分子生物学杂志》215:403-410及Altschul等人(1997)《核酸研究》25:3389-402。
抗体的结合特性
如本文所用,在抗体、免疫球蛋白、抗体结合片段或含Fc蛋白与例如预定抗原(如细胞表面蛋白或其片段)结合的情形下,术语“结合”通常指代最少两个实体或分子结构之间的相互相用或缔合,如抗体-抗原相互作用。
举例来说,当通过例如表面等离子共振(SPR)技术在BIAcore 3000仪器中使用抗原作为配体并且抗体、Ig、抗体结合片段或含Fc蛋白作为分析物(或抗配体)测定时,结合亲和力通常对应于约10
因此,本发明抗体或抗原结合蛋白结合预定抗原或细胞表面分子(受体),所述预定抗原或细胞表面分子具有对应于比其结合非特异性抗原(例如BSA、酪蛋白)的亲和力低至少十倍的K
术语“K
术语“k
术语“k
术语“K
术语“EC50”或“EC
在一个实施例中,降低的结合可定义为能够与半最大量的靶细胞结合的增加的EC
在另一实施例中,EC
双特异性抗原结合分子
本发明抗体可为单特异性、双特异性或多特异性。多特异性抗体可对一种靶多肽的不同表位具有特异性或可含有对超过一种靶多肽具有特异性的抗原结合域。参见例如Tutt等人,1991,《免疫学杂志(J.Immunol.)》147:60-69;Kufer等人,2004,《生物技术趋势(Trends Biotechnol.)》22:238-244。本发明的抗BCMA单特异性抗体或抗BCMA x抗CD3双特异性抗体可与另一功能性分子(例如另一肽或蛋白)连接或共表达。举例来说,抗体或其片段可功能性连接(例如通过化学偶联、基因融合、非共价缔合或以其它方式)至一个或多个其它分子实体,如另一抗体或抗体片段以产生具有第二或其它结合特异性的双特异性或多特异性抗体。
本文中使用表述“抗CD3抗体”或“抗BCMA抗体”意图包含单特异性抗CD3或抗BCMA抗体以及包括CD3结合臂及BCMA结合臂的双特异性抗体。因此,本发明包含双特异性抗体,其中免疫球蛋白的一个臂结合人类CD3,并且免疫球蛋白的另一臂对人类BCMA具有特异性。CD3结合臂可包括如本文表3中所示的任何HCVR/LCVR或CDR氨基酸序列或WO 2014/047231或WO 2017/053856中所公开的抗CD3抗体。
在某些实施例中,CD3结合臂结合人类CD3并且诱导人类T细胞活化。在某些实施例中,CD3结合臂微弱结合人类CD3并且诱导人类T细胞活化。在其它实施例中,在双特异性或多特异性抗体的情形下,CD3结合臂微弱结合人类CD3并且诱导表达肿瘤相关抗原的细胞杀伤。在其它实施例中,CD3结合臂与人类及食蟹猕猴(猴子)CD3微弱结合或缔合,然而结合相互作用不可通过所属领域中已知的体外分析检测。BCMA结合臂可包括如本文表1中所示的任何HCVR/LCVR或CDR氨基酸序列。
根据某些示例性实施例,本发明包含特异性结合CD3及BCMA的双特异性抗原结合分子。所述分子在本文中可称为例如“抗BCMA x抗CD3”或“抗CD3/抗BCMA”或“抗CD3 xBCMA”或“CD3 x BCMA”双特异性分子或其它类似术语(例如抗BCMA/抗CD3)。
如本文所用,除非指定为来自非人类物种(例如“小鼠BCMA”“猴子BCMA”等)否则术语“BCMA”指代人类BCMA蛋白。人类BCMA蛋白具有展示于SEQ ID NO:115中的氨基酸序列。
前述特异性结合CD3及BCMA的双特异性抗原结合分子可包括抗CD3抗原结合分子,所述抗CD3抗原结合分子以微弱结合亲和力结合CD3,如展现如通过体外亲和力结合分析所测量大于约40nM的K
如本文所用,表述“抗原结合分子”意指包括或由至少一个互补决定区(CDR)组成的蛋白、多肽或分子复合物,所述互补决定区单独或与一个或多个其它CDR和/或框架区(FR)组合特异性结合特定抗原。在某些实施例中,抗原结合分子为抗体或抗体的片段,如本文中其它地方所定义的那些术语。
如本文所用,表述“双特异性抗原结合分子”意指包括至少第一抗原结合域及第二抗原结合域的蛋白、多肽或分子复合物。双特异性抗原结合分子内的各抗原结合域包括至少一个CDR,所述CDR单独、或与一个或多个其它CDR和/或FR组合特异性结合特定抗原。在本发明的情形下,第一抗原结合域特异性结合第一抗原(例如BCMA)并且第二抗原结合域特异性结合第二不同抗原(例如CD3)。
在本发明的某些示例性实施例中,双特异性抗原结合分子为双特异性抗体。双特异性抗体的各抗原结合域包括重链可变域(HCVR)及轻链可变域(LCVR)。在包括第一及第二抗原结合域的双特异性抗原结合分子(例如双特异性抗体)的情形下,第一抗原结合域的CDR可以前缀“D1”指定并且第二抗原结合域的CDR可以前缀“D2”指定。因此,第一抗原结合域的CDR在本文中可称为D1-HCDR1、D1-HCDR2及D1-HCDR3;并且第二抗原结合域的CDR在本文中可称为D2-HCDR1、D2-HCDR2及D2-HCDR3。
在某些示例性实施例中,经分离双特异性抗原结合分子包括第一抗原结合域,所述第一抗原结合域包括:(a)含于包括SEQ ID NO:66的氨基酸序列的重链可变区(HCVR)内的三个重链互补决定区(HCDR1、HCDR2及HCDR3);及(b)含于包括SEQ ID NO:82的氨基酸序列的轻链可变区(LCVR)内的三个轻链互补决定区(LCDR1、LCDR2及LCDR3)。在一些情况下,经分离双特异性抗原结合分子包括有包括SEQ ID NO:68的氨基酸序列的HCDR1、包括SEQID NO:70的氨基酸序列的HCDR2及包括SEQ ID NO:72的氨基酸序列的HCDR3。在一些情况下,经分离双特异性抗原结合分子包括有包括SEQ ID NO:84的氨基酸序列的LCDR1、包括SEQ ID NO:86的氨基酸序列的LCDR2及包括SEQ ID NO:88的氨基酸序列的LCDR3。在一些情况下,第一抗原结合域包括有包括SEQ ID NO:66的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR。
在某些示例性实施例中,经分离双特异性抗原结合分子包括第二抗原结合域,所述第二抗原结合域包括:(a)含于包括SEQ ID NO:90或SEQ ID NO:98的氨基酸序列的重链可变区(HCVR)内的三个重链互补决定区(HCDR1、HCDR2及HCDR3);及(b)含于包括SEQ IDNO:82的氨基酸序列的轻链可变区(LCVR)内的轻链互补决定区(LCDR1、LCDR2及LCDR3)。在一些情况下,第二抗原结合域包括:(a)包括SEQ ID NO:92或SEQ ID NO:100的氨基酸序列的HCDR1;(b)包括SEQ ID NO:94或SEQ ID NO:102的氨基酸序列的HCDR2;及(c)包括SEQ IDNO:96或SEQ ID NO:104的氨基酸序列的HCDR3。在一些情况下,第二抗原结合域包括有包括SEQ ID NO:84的氨基酸序列的LCDR1、包括SEQ ID NO:86的氨基酸序列的LCDR2及包括SEQID NO:88的氨基酸序列的LCDR3。在一些情况下,第二抗原结合域包括:(a)分别包括SEQ IDNO:92、94、96的氨基酸序列的HCDR1、HCDR2、HCDR3域;及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域;或(b)分别包括SEQ ID NO:100、102、104的氨基酸序列的HCDR1、HCDR2、HCDR3域;及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域。在一些情况下,第二抗原结合域包括:(a)包括SEQ ID NO:90的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR;或(b)包括SEQ ID NO:98的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR。
在某些示例性实施例中,经分离双特异性抗原结合分子包括:(a)第一抗原结合域,其包括分别包括SEQ ID NO:68、70、72的氨基酸序列的HCDR1、HCDR2、HCDR3域以及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域;及(b)第二抗原结合域,其包括分别包括SEQ ID NO:92、94、96的氨基酸序列的HCDR1、HCDR2、HCDR3域以及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域。在一些情况下,经分离双特异性抗原结合分子包括:(a)第一抗原结合域,其包括有包括SEQ ID NO:66的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR;及(b)第二抗原结合域,其包括有包括SEQ ID NO:90的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR。
在某些示例性实施例中,经分离双特异性抗原结合分子包括:(a)第一抗原结合域,其包括分别包括SEQ ID NO:68、70、72的氨基酸序列的HCDR1、HCDR2、HCDR3域以及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域;及(b)第二抗原结合域,其包括分别包括SEQ ID NO:100、102、104的氨基酸序列的HCDR1、HCDR2、HCDR3域以及分别包括SEQ ID NO:84、86、88的氨基酸序列的LCDR1、LCDR2、LCDR3域。在一些情况下,经分离双特异性抗原结合分子包括:(a)第一抗原结合域,其包括有包括SEQ ID NO:66的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR;及(b)第二抗原结合域,其包括有包括SEQ ID NO:98的氨基酸序列的HCVR以及包括SEQ ID NO:82的氨基酸序列的LCVR。
在某些示例性实施例中,经分离双特异性抗原结合分子包括:(a)第一抗原结合域,其特异性结合人类BCMA并包括有包括选自由SEQ ID NO:2、18、34、50、66、122及124组成的群组的氨基酸序列的HCVR的CDR以及包括选自由SEQ ID NO:10、26、42、58、74、82、123及125组成的群组的氨基酸序列的LCVR的CDR;及(b)第二抗原结合域,其特异性结合人类CD3。在一些情况下,第一抗原结合域包括来自选自由SEQ ID NO:2/10、18/26、34/42、50/58、66/74、122/123、124/125、2/82、18/82、34/82、50/82、66/82、122/82及124/82组成的群组的HCVR/LCVR氨基酸序列对的CDR。在一些情况下,第一抗原结合域包括HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3域,分别选自由SEQ ID NO:4-6-8-12-14-16、20-22-24-28-30-32、36-38-40-44-46-48、52-54-56-60-62-64、68-70-72-76-78-80、4-6-8-84-86-88、20-22-24-84-86-88、36-38-40-84-86-88、52-54-56-84-86-88及68-70-72-84-86-88组成的群组。在一些情况下,第一抗原结合域包括选自由SEQ ID NO:2/10、18/26、34/42、50/58、66/74、122/123、124/125、2/82、18/82、34/82、50/82、66/82、122/82及124/82组成的群组的HCVR/LCVR氨基酸序列对。在一些情况下,第二抗原结合域包括选自由SEQ ID NO:90/82及98/82组成的群组的HCVR/LCVR氨基酸序列对的CDR。
在某些示例性实施例中,经分离双特异性抗原结合分子竞争结合BCMA或结合BCMA上的与参考抗体相同的表位,其中所述参考抗体包括第一抗原结合域及第二抗原结合域,所述第一抗原结合域包括有包括SEQ ID NO:66/82的氨基酸序列的HCVR/LCVR对,所述第二抗原结合域包括有包括SEQ ID NO:90/82或SEQ ID NO:98/82的氨基酸序列的HCVR/LCVR对。
在某些示例性实施例中,经分离双特异性抗原结合分子竞争结合人类CD3或结合人类CD3上的与参考抗体相同的表位,其中所述参考抗体包括第一抗原结合域及第二抗原结合域,所述第一抗原结合域包括有包括SEQ ID NO:66/82的氨基酸序列的HCVR/LCVR对,所述第二抗原结合域包括有包括SEQ ID NO:90/82或SEQ ID NO:98/82的氨基酸序列的HCVR/LCVR对。
上文或本文所论述的双特异性抗原结合分子可为双特异性抗体。在一些情况下,双特异性抗体包括人类IgG重链恒定区。在一些情况下,人类IgG重链恒定区为同型IgG1。在一些情况下,人类IgG重链恒定区为同型IgG4。在各种实施例中,双特异性抗体包括嵌合铰链,所述嵌合铰链相对于相同同型的野生型铰链减少Fcγ受体结合。
第一抗原结合域及第二抗原结合域可直接或间接彼此连接以形成本发明的双特异性抗原结合分子。或者,第一抗原结合域及第二抗原结合域各自连接至单独多聚化域。一个多聚化域与另一多聚化域的缔合促进两个抗原结合域之间的缔合,从而形成双特异性抗原结合分子。如本文所用,“多聚化域”为能够与具有相同或相似结构或构造的第二多聚化域缔合的任何大分子、蛋白、多肽、肽或氨基酸。举例来说,多聚化域可为包括免疫球蛋白C
本发明的双特异性抗原结合分子将通常包括两个多聚化域,例如两个各自独立地为单独抗体重链的部分的Fc域。第一及第二多聚化域可具有相同IgG同型,如例如IgG1/IgG1、IgG2/IgG2、IgG4/IgG4。或者,第一及第二多聚化域可具有不同IgG同型,如例如IgG1/IgG2、IgG1/IgG4、IgG2/IgG4等。
在某些实施例中,多聚化域为含有至少一个半胱氨酸残基长度为1至约200个氨基酸的Fc片段或氨基酸序列。在其它实施例中,多聚化域为半胱氨酸残基或含半胱氨酸的短肽。其它多聚化域包含肽或多肽,所述肽或多肽包括或由亮氨酸拉链、螺旋环圈基序或卷曲螺旋基序组成。
任何双特异性抗体型式或技术均可用于制得本发明的双特异性抗原结合分子。举例来说,具有第一抗原结合特异性的抗体或其片段可功能性地连接(例如通过化学偶联、基因融合、非共价缔合或以其它方式)至一个或多个其它分子实体(如具有第二抗原结合特异性的另一抗体或抗体片段)以产生双特异性抗原结合分子。可用于本发明的情形下的具体示例性双特异性型式包含但不限于例如基于scFv的或双功能抗体双特异性型式、IgG-scFv融合物、双重可变域(DVD)-Ig、四源杂交瘤(Quadroma)、臼包杵、常见轻链(例如具有臼包杵的常见轻链等)、互换Mab、互换Fab、(SEED)体、亮氨酸拉链、Duobody、IgG1/IgG2、双重作用Fab(DAF)-IgG及Mab
在本发明的双特异性抗原结合分子的情形下,与Fc域的野生型、天然存在版本相比,多聚化域(例如Fc域)可包括一个或多个氨基酸变化(例如插入、缺失或取代)。举例来说,本发明包含包括Fc域中的一个或多个修饰的双特异性抗原结合分子,所述修饰产生具有经修饰的Fc与FcRn之间的结合相互作用(例如增强或减弱)的经修饰Fc域。在一个实施例中,双特异性抗原结合分子包括C
本发明还包含包括第一C
在某些实施例中,Fc域可为衍生自超过一种免疫球蛋白同型的嵌合、组合Fc序列。举例来说,嵌合Fc域可包括衍生自人类IgG1、人类IgG2或人类IgG4C
序列变体
与衍生出个别抗原结合域的对应生殖系序列相比,本发明抗体及双特异性抗原结合分子可在重链及轻链可变域的框架区和/或CDR区中包括一个或多个氨基酸取代、插入和/或缺失。所述突变可容易地通过比较本文所公开的氨基酸序列与购自例如公共抗体序列数据库的生殖系序列来确定。本发明的抗原结合分子可包括衍生自本文所公开的任何示例性氨基酸序列的抗原结合域,其中一个或多个框架区和/或CDR区内的一个或多个氨基酸突变成衍生出抗体的生殖系序列的对应残基或突变成另一人类生殖系序列的对应残基或突变成对应生殖系残基的保守氨基酸取代(所述序列变化在本文中统称为“生殖系突变”)。所属领域的一般技术人员从本文所公开的重链及轻链可变区序列开始,可容易地产生许多包括一个或多个个别生殖系突变或其组合的抗体及抗原结合片段。在某些实施例中,V
pH依赖性结合
本发明包含抗BCMA抗体及抗BCMA x抗CD3双特异性抗原结合分子,具有pH依赖性结合特征。举例来说,相比于中性pH,本发明的抗BCMA抗体在酸性pH下可展现减弱的与BCMA的结合。或者,相比于中性pH,本发明的抗BCMA抗体在酸性pH下可展现增强的与BCMA的结合。表述“酸性pH”包含低于约6.2的pH值,例如约6.0、5.95、5.9、5.85、5.8、5.75、5.7、5.65、5.6、5.55、5.5、5.45、5.4、5.35、5.3、5.25、5.2、5.15、5.1、5.05、5.0或更低。如本文所用,表述“中性pH”意指约7.0至约7.4的pH。表述“中性pH”包含约7.0、7.05、7.1、7.15、7.2、7.25、7.3、7.35及7.4的pH值。
在某些情况下,“相比于中性pH在酸性pH下减弱的结合”根据在酸性pH下抗体与其抗原结合的K
具有pH依赖性结合特征的抗体可例如通过筛选相比于中性pH在酸性pH下与特定抗体的结合减弱(或增强)的抗体群体来获得。另外,在氨基酸水平下抗原结合域的修饰可产生具有pH依赖性特征的抗体。举例来说,通过用组氨酸残基取代抗原结合域(例如在CDR内)的一个或多个氨基酸可获得相对于中性pH在酸性pH下抗原结合减弱的抗体。
包括Fc变异体的抗体
根据本发明的某些实施例,提供抗BCMA抗体及抗BCMA x抗CD3双特异性抗原结合分子,其包括Fc域,所述Fc域包括一个或多个增强或减轻抗体与FcRn受体的结合(例如相比于中性pH值,在酸性pH值下)的突变。举例来说,本发明包含在Fc域的C
举例来说,本发明包含抗BCMA抗体及抗BCMA x抗CD3双特异性抗原结合分子,其包括Fc域,所述Fc域包括一个或多个选自由以下组成的群组的突变对或群组:250Q及248L(例如T250Q及M248L);252Y、254T及256E(例如M252Y、S254T及T256E);428L及434S(例如M428L及N434S);及433K及434F(例如H433K及N434F)。前述Fc域突变及本文所公开的抗体可变域内的其它突变的所有可能的组合涵盖于本发明范围内。
抗体及双特异性抗原结合分子的生物学特征
本发明包含以高亲和力(例如或亚纳摩尔K
根据某些实施例,本发明包含结合人类BCMA(例如在25℃下)的抗体及抗体的抗原结合片段,其中如通过表面等离子共振(例如使用如本文实例4中所定义的分析型式)所测量K
本发明还包含结合BCMA的抗体及其抗原结合片段,其中如在25℃下通过表面等离子共振(例如使用如本文实例4中所定义的分析型式或大体上类似的分析)所测量解离半衰期(t1/2)为大于约10分钟或大于约125分钟。在某些实施例中,本发明抗体或抗原结合片段结合BCMA,其中如在25℃下通过表面等离子共振(例如使用如本文实例4中所定义的分析型式或大体上类似的分析)所测量t1/2为大于约3分钟、大于约4分钟、大于约10分钟、大于约20分钟、大于约30分钟、大于约40分钟、大于约50分钟、大于约60分钟、大于约70分钟、大于约80分钟、大于约90分钟、大于100约分钟、大于约110分钟或大于约120分钟。本发明包含双特异性抗原结合分子,例如结合BCMA的双特异性抗体,其中如在25℃下通过表面等离子共振(例如使用如本文实例4中所定义的分析型式或大体上类似的分析)所测量t1/2为大于约10分钟。
本发明还包含如由如实例6中所示的FACS结合分析或大体上类似的分析所确定与表达内源性BCMA(例如NCI-H929、MOLP-8或OMP-2)的人类细胞系特异性结合的抗体及其抗原结合片段。
本发明还包含抗BCMA x抗CD3双特异性抗原结合分子,其展现一个或多个选自由以下组成的群组的特征:(a)压制带有人类多发性骨髓瘤异种移植的免疫功能不全小鼠的肿瘤生长;(b)压制带有人类多发性骨髓瘤异种移植的免疫功能不全小鼠的已建立的肿瘤的肿瘤生长(参见例如实例10至15);及(c)压制经工程改造以在表达人类CD3的免疫活性小鼠中表达人类BCMA的异体同质黑色素瘤及结肠癌瘤细胞的肿瘤生长。
本发明包含以高亲和力结合人类CD3的抗体及其抗原结合片段。本发明还包含以中等或低亲和力(取决于所期望的治疗情形及特定靶向特性)结合人类CD3的抗体及其抗原结合片段。在一些情况下,低亲和力包含以大于300nM、大于500nM或大于1μM的K
本发明包含双特异性抗原结合分子(例如双特异性抗体),其能够同时与人类CD3及人类BCMA结合。与表达CD3的细胞相互作用的结合臂可具有微弱到不可检测的结合,如在适合的体外结合分析中所测量。双特异性抗原结合分子结合表达CD3和/或BCMA的细胞的程度可通过荧光活化细胞分选(FACS)评估,如本文实例5及实例6中所说明。
举例来说,本发明包含抗体、其抗原结合片段及双特异性抗体,其特异性结合表达CD3但不表达BCMA(例如Jurkat)的人类T细胞系和/或表达BCMA的细胞。
本发明包含抗体、其抗原结合片段及双特异性抗体,其以微弱(即低)或甚至不可检测的亲和力结合人类CD3。
本发明包含抗体、其抗原结合片段及双特异性抗体,其以微弱(即低)或甚至不可检测的亲和力结合猴子(即食蟹猕猴)CD3。
本发明包含抗体、其抗原结合片段及双特异性抗体,其结合人类CD3并且诱导T细胞活化。
本发明包含抗BCMA x抗CD3双特异性抗原结合分子,其能够消耗或减少个体的表达肿瘤抗原的细胞(参见例如实例8至16或大体上类似的分析)。举例来说,根据某些实施例,提供抗BCMA x抗CD3双特异性抗原结合分子,其中向个体单次给予或多次给予0.04mg/kg、0.4mg/kg或4mg/kg的双特异性抗原结合分子引起个体的表达BCMA的细胞的数目减少(例如压制或抑制个体的肿瘤生长)。
表位定位及相关技术
本发明的抗原结合分子所结合的CD3和/或BCMA上的表位可由CD3或BCMA蛋白的3个或更多个(例如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个)氨基酸的单一连续序列组成。或者,表位可由CD3或BCMA的多个非连续氨基酸(或氨基酸序列)组成。本发明抗体可与含于单一CD3链(例如CD3-ε、CD3-δ或CD3-γ)内的氨基酸相互作用或可与两个或更多个不同CD3链上的氨基酸相互作用。如本文所用,术语“表位”指代与称为互补位的抗体分子的可变区中的特异性抗原结合位点相互作用的抗原决定子。单一抗原可具有超过一个表位。因此,不同抗体可结合抗原上的不同区域并且可具有不同生物作用。表位可为构形或线性的。构形表位通过来自线性多肽链的不同链段的空间并列氨基酸产生。线性表位为由多肽链中的相邻氨基酸残基产生的表位。在某些情形下,表位可包含抗原上的醣类、磷酰基或磺酰基部分。
所属领域的一般技术人员已知的各种技术可用于确定抗体的抗原结合域是否“与多肽或蛋白内的一个或多个氨基酸相互作用”。示例性技术包含例如常规交叉阻断分析,如所描述的
本发明进一步包含抗BCMA抗体,其结合与本文所描述的任何具体示例性抗体(例如包括如本文表1中所示的任何氨基酸序列的抗体)相同的表位。同样地,本发明还包含抗BCMA抗体,其与本文所描述的任何具体示例性抗体(例如包括如本文表1中所示的任何氨基酸序列的抗体)竞争结合BCMA。
本发明还包含双特异性抗原结合分子,其包括以低或不可检测结合亲和力特异性结合人类CD3和/或食蟹猕猴CD3的第二抗原结合域及特异性结合人类BCMA的第二抗原结合域,其中第二抗原结合域结合CD3上与本文所描述的任何具体示例性CD3特异性抗原结合域相同的表位,和/或其中第二抗原结合域结合BCMA上与本文所描述的任何具体示例性BCMA特异性抗原结合域相同的表位。
同样地,本发明还包含双特异性抗原结合分子,其包括特异性结合人类BCMA的第一抗原结合域及特异性结合人类CD3的第二抗原结合域,其中第一抗原结合域与本文所描述的任何具体示例性BCMA特异性抗原结合域竞争结合BCMA,和/或其中第二抗原结合域与本文所描述的任何具体示例性CD3特异性抗原结合域竞争结合CD3。
通过使用所属领域中已知的常规方法可容易地确定特定抗原结合分子(例如抗体)或其抗原结合域是否结合与本发明的参考抗原结合分子相同的表位或竞争结合。举例来说,为确定测试抗体是否结合BCMA(或CD3)上与本发明的参考双特异性抗原结合分子相同的表位,首先使参考双特异性分子结合BCMA蛋白(或CD3蛋白)。随后,评估测试抗体结合BCMA(或CD3)分子的能力。如果在与参考双特异性抗原结合分子饱和结合后测试抗体能够结合BCMA(或CD3),那么可推断测试抗体结合相比于参考双特异性抗原结合分子不同的BCMA(或CD3)的表位。另一方面,如果测试抗体不能够在与参考双特异性抗原结合分子饱和结合后结合BCMA(或CD3)分子,那么测试抗体可结合与由本发明的参考双特异性抗原结合分子所结合的表位相同的BCMA(或CD3)的表位。随后可进行其它常规实验(例如肽突变及结合分析)以确认所观察到的测试抗体的结合不足实际上是否是因结合与参考双特异性抗原结合分子相同的表位所致,或是否空间阻断(或另一现象)造成所观察到的结合不足。此种实验可使用ELISA、RIA、Biacore、流式细胞测量术或所属领域中可用的任何其它定量或定性抗体结合分析来进行。根据本发明的某些实施例,如果如在竞争性结合分析(参见例如Junghans等人,《癌症研究(Cancer Res.)》1990:50:1495-1502)中所测量,例如1、5、10、20或100倍过量的一种抗原结合蛋白抑制另一抗原结合蛋白的结合至少50%,但优选地75%、90%或甚至99%,那么两个抗原结合蛋白结合相同(或重叠)表位。或者,如果抗原中基本上所有减少或消除一种抗原结合蛋白的结合的氨基酸突变减少或消除另一抗原结合蛋白的结合,那么认为两个抗原结合蛋白结合相同表位。如果仅减少或消除一种抗原结合蛋白的结合的氨基酸突变的子集减少或消除另一抗原结合蛋白的结合,那么认为两个抗原结合蛋白具有“重叠表位”。
为确定抗体或其抗原结合域是否与参考抗原结合分子竞争结合,在以下两个方向进行上述结合方法:在第一方向,在饱和条件下使参考抗原结合分子结合BCMA蛋白(或CD3蛋白),随后评估测试抗体与BCMA(或CD3)分子的结合。在第二方向,在饱和条件下使测试抗体结合BCMA(或CD3)分子,随后评估参考抗原结合分子与BCMA(或CD3)分子的结合。如果在两个方向中,仅第一(饱和)抗原结合分子能够结合于BCMA(或CD3)分子,那么推断测试抗体与参考抗原结合分子竞争结合BCMA(或CD3)。如所属领域的一般技术人员应了解,与参考抗原结合分子竞争结合的抗体可能未必结合与参考抗体相同的表位,但可通过结合重叠或相邻表位而空间上阻断参考抗体的结合。
抗原结合域的制备及双特异性分子的构建
对特定抗原具有特异性的抗原结合域可通过所属领域中已知的任何抗体生产技术制备。在获得之后,对两个不同抗原(例如CD3及BCMA)具有特异性的两个不同抗原结合域可使用常规方法适当地相对于彼此排列以产生本发明的双特异性抗原结合分子。(本文中其它地方提供可用于构建本发明的双特异性抗原结合分子的示例性双特异性抗体型式的论述)。在某些实施例中,本发明的多特异性抗原结合分子的个别组分(例如重链及轻链)中的一个或多个衍生自嵌合、人类化或完全人类抗体。用于制备所述抗体的方法为所属领域中熟知的。举例来说,本发明的双特异性抗原结合分子的重链和/或轻链中的一个或多个可使用VELOCIMMUNE
经基因工程改造的动物可用以制得人类双特异性抗原结合分子。举例来说,可使用不能重排并且表达内源性小鼠免疫球蛋白轻链可变序列的经基因修饰小鼠,其中小鼠仅表达一或两个由可操作地连接于内源性小鼠κ基因座处的小鼠κ恒定基因的人类免疫球蛋白序列编码的人类轻链可变域。所述经基因修饰小鼠可用于产生包括两个不同重链的完全人类双特异性抗原结合分子,所述重链与包括衍生自两个不同人类轻链可变区基因区段中的一者的可变域的一致轻链缔合。(参见例如US 2011/0195454)。完全人类指代包括由DNA编码的氨基酸序列的抗体、或其抗原结合片段或免疫球蛋白域,所述DNA衍生自在抗体或其抗原结合片段或免疫球蛋白域的各多肽的全部长度上的人类序列。在一些情况下,完全人类序列衍生自对于人类为内源性的蛋白。在其它情况下,完全人类蛋白或蛋白序列包括其中各组分序列衍生自人类序列的嵌合序列。尽管未受任何一个理论限制,但例如相比于任何野生型人类免疫球蛋白区或域,嵌合蛋白或嵌合序列一般经设计以将组分序列的接合点中的免疫原性表位的产生减到最少。
生物等效物
本发明涵盖具有不同于本文所公开的示例性分子的那些氨基酸序列的氨基酸序列但保留结合CD3和/或BCMA的能力的抗原结合分子。当与亲本序列比较时,所述变异分子可包括氨基酸的一个或多个添加、缺失或取代,但展现与所描述的双特异性抗原结合分子的生物活性基本上等效的生物活性。
本发明包含抗原结合分子,其为本文所列举的任何示例性抗原结合分子的生物等效物。举例来说,如果两个抗原结合蛋白或抗体为当在类似实验条件下以单次剂量或多次剂量以相同摩尔剂量给予时其吸收速率及程度不展示显著差异的医药等效物或医药替代物,那么将所述两个抗原结合蛋白或抗体视为生物等效。如果一些抗原结合蛋白质在其吸收程度上而非其吸收速率上等效,那么将其视为等效物或医药替代物,并且又可将其视为生物等效的,因为吸收速率中的所述差异为故意的并且反映在标记中,对于在例如长期使用方面达到有效主体药物浓度非必要的,并且对于所研究的特定药品来说被视为医学上无关紧要的。
在一个实施例中,如果两个抗原结合蛋白在安全性、纯度及效价方面不存在临床上有意义的差异,那么其为生物等效的。
在一个实施例中,如果患者可在参考产品与生物产品之间切换一或多次,相比于无所述切换的持续疗法不存在预期的副作用(包含免疫原性的临床显著变化或有效性减弱)风险增加,那么两个抗原结合蛋白为生物等效。
在一个实施例中,如果两个抗原结合蛋白均针对使用条件通过常用机制或作用机制起作用,至所述机制所已知的程度,那么其为生物等效的。
生物等效性可通过体内及体外方法证实。生物等效性测量包含例如(a)人类或其它哺乳动物中的体内测试,其中随时间而变测量血液、血浆、血清或其它生物流体中抗体或其代谢物的浓度;(b)与人类体内生物可用性数据相关并且合理地预测人类体内生物可用性数据的体外测试;(c)人类或其它哺乳动物中的体内测试,其中随时间而变测量抗体(或其靶)的适当急性药理学作用;及(d)建立抗原结合蛋白的安全性、功效或生物可用性或生物等效性的经良好控制的临床试验。
本文所列举的示例性双特异性抗原结合分子的生物等效变异体可通过例如进行残基或序列的各种取代或删除对于生物活性来说非必需的末端或内部残基或序列来构建。举例来说,对于生物活性来说非必需的半胱氨酸残基可删除或用其它氨基酸替代以防止在复性后形成不必要或不恰当的分子内双硫桥键。在其它情形中,生物等效抗原结合蛋白可包含本文所列举的示例性双特异性抗原结合分子的变异体,所述变异体包括修饰分子的醣基化特征的氨基酸变化,例如消除或去除醣基化的突变。
物种选择性及物种交叉反应性
根据本发明的某些实施例,提供结合人类CD3而非来自其它物种的CD3的抗原结合分子。还提供结合人类BCMA而非来自其它物种的BCMA的抗原结合分子。本发明还包含结合人类CD3及来自一种或多种非人类物种的CD3的抗原结合分子;和/或结合人类BCMA及来自一种或多种非人类物种的BCMA的抗原结合分子。
根据本发明的某些示例性实施例,提供抗原结合分子,其结合人类CD3和/或人类BCMA并且可视具体情况结合或不结合以下中的一种或多种:小鼠、大鼠、天竺鼠、仓鼠、沙鼠、猪、猫、狗、兔、山羊、绵羊、牛、马、骆驼、食蟹猕猴、狨猴、恒河猴或黑猩猩CD3和/或BCMA。举例来说,在本发明的特定示例性实施例中,提供包括结合人类BCMA及食蟹猕猴BCMA的第一抗原结合域以及特异性结合人类CD3的第二抗原结合域的双特异性抗原结合分子或包括结合人类BCMA及食蟹猕猴BCMA的第一抗原结合域以及特异性结合人类CD3的第二抗原结合域的双特异性抗原结合分子。
治疗性调配物及给药
本发明提供医药组合物,其包括本发明的抗原结合分子。本发明的医药组合物用适合的载剂、赋形剂及提供提高的转移、递送、耐受性及类似性质的其它试剂调配。可于所有医药化学家已知的处方集中查询众多适当调配物:《雷明顿氏医药科学(Remington'sPharmaceutical Sciences)》,宾夕法尼亚州伊斯顿的马克出版公司(Mack PublishingCompany,Easton,PA)。这些调配物包含例如粉剂、糊剂、软膏、凝胶剂、蜡、油、脂质、含有囊泡的脂质(阳离子型或阴离子型)(如LIPOFECTIN
向患者给予的抗原结合分子的剂量可视患者的年龄及身材、靶向疾病、病况、给予途径等而变化。优选剂量通常根据体重或体表面积计算。当本发明的双特异性抗原结合分子用于成年患者的治疗目的时,宜静脉内给予本发明的双特异性抗原结合分子,通常以约0.01至约20mg/kg体重、更优选约0.02至约7、约0.03到约5或约0.05至约3mg/kg体重的单次剂量。视病况的严重度而定,可调整治疗的频率及持续时间。给予双特异性抗原结合分子的有效剂量及时程可凭经验确定;举例来说,患者进展可通过周期性评估监测,并且相应地调整剂量。此外,可使用所属领域中熟知的方法(例如Mordenti等人,1991,《医药研究(Pharmaceut.Res.)》8:1351)进行剂量的种间按比例调整。。
各种递送系统为已知的并且可用以给予本发明的医药组合物,例如囊封于脂质体中、微粒、微胶囊、能够表达突变病毒的重组细胞、受体介导的内吞作用(参见例如Wu等人,1987,《生物化学杂志(J.Biol.Chem.)》262:4429-4432)。引入方法包含但不限于皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外及经口途径。组合物可通过任何便利途径给予,例如通过输液或快速注射、通过经由上皮或黏膜皮肤内层(例如口腔黏膜、直肠及肠道黏膜等)吸收,并且可与其它生物活性剂一起给予。可全身性或局部给予。
可用标准针及注射器皮下或静脉内递送本发明的医药组合物。此外,就皮下递送来说,笔式递送装置易于应用于递送本发明的医药组合物。此类笔式递送装置可为可再用的或抛弃式的。可再用的笔式递送装置一般利用含有医药组合物的可更换套筒。在套筒内的所有医药组合物已给予并且套筒为空后,空套筒可容易地丢弃并且用含有医药组合物的新套筒替换。随后可再使用笔式递送装置。在抛弃式笔式递送装置中,不存在可替换套筒。确切地说,抛弃式笔式递送装置预填充有保存于装置内的储集层中的医药组合物。在清空储集层的医药组合物后,丢弃整个装置。
许多可再用笔式及自动注射递送装置应用于本发明的医药组合物的皮下递送中。仅举几例,实例包含但不限于AUTOPEN
在某些情形下,医药组合物可在控制释放系统中递送。在一个实施例中,可使用泵(参见Langer,见上文;Sefton 1987《生物医学工程的关键参考(CRCCrit.Ref.Biomed.Eng.)》14:201)。在另一实施例中,可使用聚合材料;参见《控制释放的医药应用(Medical Applications of Controlled Release)》,Langer及Wise(编),1974,佛罗里达州博卡拉顿的CRC出版社(CRC Pres.,Boca Raton,Florida)。在又一实施例中,可将控制释放系统接近组合物的标靶置放,因此仅需要全身性剂量的一部分(参见例如Goodson,1984,《控制释放的医药应用》中,见上文,第2卷,第115-138页)。其它控制释放系统论述于Langer,1990,《科学(Science)》249:1527-1533的综述中。
可注射制剂可包含用于静脉内、皮下、皮内及肌肉内注射;滴液输液等的剂型。这些可注射制剂可通过众所周知的方法制备。举例来说,可注射制剂可例如通过将上文所描述的抗体或其盐溶解、悬浮或乳化于常规地用于注射的无菌水性介质或油性介质中来制备。作为用于注射的水性介质,例如生理盐水、含有葡萄糖及其它辅助剂的等渗溶液等,其可与适当的增溶剂(如醇(例如乙醇)、多元醇(例如丙二醇、聚乙二醇)、非离子型表面活性剂[例如聚山梨醇酯80、HCO-50(氢化蓖麻油的聚氧化乙烯(50mol)加合物)]等)组合使用。作为油性介质,采用例如芝麻油、大豆油等,其可与增溶剂(如苯甲酸苯甲酯、苯甲醇等)组合使用。由此制备的注射液优选填充于适当的安瓿中。
有利地,将上文所描述的用于经口或肠胃外用途的医药组合物制备成呈适合于配合活性成分的剂量的单位剂量的剂型。单位剂量中的所述剂型包含例如锭剂、丸剂、胶囊、注射剂(安瓿)、栓剂等。前述抗体的含量一般为约5至约500mg/剂型/单位剂量;尤其在注射剂型中,优选地前述抗体的含量为约5至约100mg并且对于其它剂型为约10至约250mg。
抗原结合分子的治疗性用途
本发明包含方法,所述方法包括向有需要的个体给予包括抗BCMA抗体或其抗原结合片段或特异性结合CD3及BCMA的双特异性抗原结合分子的治疗性组合物。治疗性组合物可包括如本文所公开的任何抗体或双特异性抗原结合分子及药学上可接受的载剂或稀释剂。如本文所用,表述“有需要的个体”意指展现癌症的一种或多种症状或标志的人类或非人类动物(例如表达肿瘤或患有本文下文提及的任何癌症的个体)或将另外受益于BCMA活性的抑制或减少或BCMA+细胞(例如多发性骨髓瘤细胞)的消耗的个体。
本发明抗体及双特异性抗原结合分子(及包含其的治疗性组合物)尤其适用于治疗其中免疫反应的刺激、活化和/或靶向将为有益的任何疾病或病症。确切地说,本发明的抗BCMA抗体或抗BCMA x抗CD3双特异性抗原结合分子可用于治疗预防和/或减缓与BCMA表达或活性或BCMA+细胞的增殖有关或由其介导的任何疾病或病症。实现本发明的治疗方法的作用机制包含在效应细胞存在下(例如)通过CDC、细胞凋亡、ADCC、噬菌作用或通过这些机制中的两种或更多种的组合杀伤表达BCMA的细胞。可使用本发明的双特异性抗原结合分子抑制或杀伤的表达BCMA的细胞包含例如多发性骨髓瘤细胞。
本发明的抗原结合分子可用以治疗与BCMA表达相关的疾病或病症,包含例如包含多发性骨髓瘤的癌症或其它B细胞或浆细胞癌症,如瓦尔登斯特伦氏巨球蛋白血症、伯基特淋巴瘤及弥漫性大B细胞淋巴瘤、非霍奇金氏淋巴瘤、慢性淋巴球性白血病、滤泡性淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、淋巴浆细胞淋巴瘤及霍奇金氏淋巴瘤。根据本发明的某些实施例,抗BCMA抗体或抗BCMA x抗CD3双特异性抗体适用于治疗罹患多发性骨髓瘤的患者。根据本发明的其它相关实施例,提供包括向罹患多发性骨髓瘤的患者给予如本文所公开的抗BCMA抗体或抗BCMA x抗CD3双特异性抗原结合分子的方法。所属领域中已知的分析/诊断性方法(如肿瘤扫描等)可用以确定患者是否携带多发性骨髓瘤或另一B细胞谱系癌症。
本发明还包含用于治疗个体的残余癌症的方法。如本文所用,术语“残余癌症”意指在用抗癌疗法治疗后,个体中存在或存留一种或多种癌细胞。
根据某些方面,本发明提供用于治疗与BCMA表达相关联的疾病或病症(例如多发性骨髓瘤)的方法,其包括在个体已确定具有多发性骨髓瘤之后向个体给予本文其它地方所描述的一种或多种抗BCMA或双特异性抗原结合分子。举例来说,本发明包含用于治疗多发性骨髓瘤的方法,其包括在个体已接收其它免疫疗法或化学疗法之后1天、2天、3天、4天、5天、6天、1周、2周、3周或4周、2个月、4个月、6个月、8个月、1年或更长时间向患者给予抗BCMA抗体或抗BCMA x抗CD3双特异性抗原结合分子。
组合疗法及调配物
本发明提供包括给予医药组合物的方法,所述医药组合物包括本文所描述的任何示例性抗体及双特异性抗原结合分子与一种或多种其它治疗剂的组合。可与本发明的抗原结合分子组合或与组合给予的示例性其它治疗剂包含例如抗肿瘤剂(例如化学治疗剂,包含美法仑、长春新碱(安可平)、环磷酰胺(癌得星)、依托泊苷(VP-16)、小红莓(阿德力霉素)、小红莓脂质体(多希)、苯达莫司汀(特瑞达)或任何其它已知在治疗个体的浆细胞肿瘤中有效的化学治疗剂)。在一些实施例中,第二治疗剂包括类固醇。在一些实施例中,第二治疗剂包括靶向疗法,包含沙利度胺、来那度胺及硼替佐米,所述疗法为批准用于治疗新诊断患者的疗法。来那度胺、泊马度胺、硼替佐米、卡非佐米、帕比司他、依萨佐米、埃罗妥珠单抗及达雷木单抗为有效治疗复发性骨髓瘤的第二治疗剂的实例。在某些实施例中第二治疗剂为包括放射疗法或干细胞移植的方案。在某些实施例中,第二治疗剂可为免疫调节剂。在某些实施例中,第二治疗剂可为蛋白酶体抑制剂,包含硼替佐米(万珂)、卡非佐米(凯普罗里斯)、依萨佐米(恩莱瑞)。在某些实施例中第二治疗剂可为组蛋白去乙酰基酶抑制剂,如帕比司他(法瑞达克)。在某些实施例中,第二治疗剂可为单克隆抗体、抗体药物缀合物、与抗肿瘤剂缀合的双特异性抗体、检查点抑制剂或其组合。可有利地与本发明的抗原结合分子组合给予的其它试剂包含细胞介素抑制剂,包含小分子细胞介素抑制剂及结合细胞介素(如IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-8、IL-9、IL-11、IL-12、IL-13、IL-17、IL-18)或其相应受体的抗体。还可给予本发明的医药组合物(例如包括如本文所公开的抗BCMA x抗CD3双特异性抗原结合分子的医药组合物)作为包括一种或多种治疗组合的治疗方案的部分,所述治疗组合选自除本文所描述的那些单克隆抗体以外的单克隆抗体(其可与浆细胞表面上的不同抗原相互作用)、双特异性抗体(其具有一个结合肿瘤细胞表面上的抗原的臂及另一结合T细胞上的抗原的臂)、抗体药物缀合物、与抗肿瘤剂缀合的双特异性抗体、检查点抑制剂(例如靶向PD-1或CTLA-4的检查点抑制剂)或其组合。在某些实施例中,检查点抑制剂可选自PD-1抑制剂,如派姆单抗(克珠达)、纳武单抗(欧狄沃)或赛咪单抗(REGN2810)。在某些实施例中,检查点抑制剂可选自PD-L1抑制剂,如阿特珠单抗(特森催克)、阿维鲁单抗(巴文西亚)或德瓦鲁单抗(英菲尼)。在某些实施例中,检查点抑制剂可选自CTLA-4抑制剂,如伊匹单抗(易沃伊)。可与本发明抗体结合使用的其它组合为上文所述。
本发明还包含治疗组合,其包括本文中提及的任何抗原结合分子及以下中的一种或多种抑制剂:VEGF、Ang2、DLL4、EGFR、ErbB2、ErbB3、ErbB4、EGFRvIII、cMet、IGF1R、B-raf、PDGFR-α、PDGFR-β、FOLH1(PSMA)、PRLR、STEAP1、STEAP2、TMPRSS2、MSLN、CA9、尿溶蛋白或前述细胞介素中的任一种,其中抑制剂为适体、反义分子、核糖核酸酶、siRNA、肽体、纳米抗体或抗体片段(例如Fab片段;F(ab')
其它治疗活性组分可在即将给予本发明的抗原结合分子之前、与给予本发明的抗原结合分子同时或在给予本发明的抗原结合分子之后不久给予;(出于本发明的目的,所述给药方案视为“与其它治疗活性组分组合”给予抗原结合分子)。
本发明包含医药组合物,其中本发明的抗原结合分子与如本文其它地方所描述的一种或多种其它治疗活性组分共调配。
给药方案
根据本发明的某些实施例,可在限定时程内向个体给予多个剂量的抗原结合分子(例如抗BCMA抗体或特异性结合BCMA及CD3的双特异性抗原结合分子)。根据本发明的这一方面的方法包括向个体依序给予多个剂量的本发明的抗原结合分子。如本文所用,“依序给予”意指各剂量的抗原结合分子是在不同时间点向个体给予,例如在由预定间隔(例如小时、天、周或月)分隔开的不同天。本发明包含方法,其包括向患者依序给予单一初始剂量的抗原结合分子,接着给予一个或多个第二剂量的抗原结合分子,并且任选地接着给予一个或多个第三剂量的抗原结合分子。
术语“初始剂量”、“第二剂量”及“第三剂量”指代给予本发明的抗原结合分子的时间顺序。因此,“初始剂量”为在治疗方案开始时给予的剂量(也称为“基线剂量”);“第二剂量”为在初始剂量之后给予的剂量;及“第三剂量”为在第二剂量之后给予的剂量。初始、第二及第三剂量均可含有相同量的抗原结合分子,但一般可在给予频率方面彼此不同。然而,在某些实施例中,初始、第二和/或第三剂量中所含的抗原结合分子的量在治疗时程期间彼此不同(例如视需要上调或下调)。在某些实施例中,在治疗方案开始时给予两个或更多个(例如2、3、4或5个)剂量作为“起始剂量(loading dose)”,接着在较低频率基础上给予后续剂量(例如“维持剂量”)。
在本发明一个示例性实施例中,各第二和/或第三剂量在前一剂量之后1至26(例如1、1
根据本发明的这一方面的方法可包括向患者给予任何数量的第二和/或第三剂量的抗原结合分子(例如抗BCMA抗体或特异性结合BCMA及CD3的双特异性抗原结合分子)。举例来说,在某些实施例中,仅向患者给予单一第二剂量。在其它实施例中,向患者给予两个或更多个(例如2、3、4、5、6、7、8或更多个)第二剂量。同样地,在某些实施例中,仅向患者给予单一第三剂量。在其它实施例中,向患者给予两个或更多个(例如2、3、4、5、6、7、8或更多个)第三剂量。
在涉及多个第二剂量的实施例中,各第二剂量可以与其它第二剂量相同的频率给予。举例来说,各第二剂量可在前一剂量之后1至2周向患者给予。类似地,在涉及多个第三剂量的实施例中,各第三剂量可以与其它第三剂量相同的频率给予。举例来说,各第三剂量可在前一剂量之后2至4周向患者给予。或者,向患者给予第二和/或第三剂量的频率可在治疗方案时程内变化。给予频率也可在治疗时程期间在临床检查之后由医师视个别患者的需要来调整。
抗体的诊断性用途
本发明的抗BCMA抗体还可用于检测和/或测量样品中的BCMA或表达BCMA的细胞(例如)用于诊断性目的。举例来说,抗BCMA抗体或其片段可用以诊断特征为BCMA的异常表达(例如过度表达、低表达、缺乏表达等)的病况或疾病。BCMA的示例性诊断性分析可包括例如使获自患者的样品与本发明的抗BCMA抗体接触,其中抗BCMA抗体用可检测标记或报告分子标记。或者,未标记的抗BCMA抗体可与自身可检测地标记的二级抗体组合用于诊断性应用。可检测标记或报告分子可为放射性同位素,如
可用于根据本发明的BCMA诊断性分析中的样品包含可获自在正常或病理病况下含有可检测量的BCMA蛋白或其片段的患者的任何组织或流体样品。一般来说,将测量获自健康患者(例如未罹患异常BCMA水平或活性相关的疾病或病况的患者)的特定样品中的BCMA水平以初始建立BCMA的基线或标准水平。可随后将这一BCMA基线水平对照获自疑似患有BCMA相关疾病(例如含有表达BCMA的细胞的肿瘤)或病况的个体的样品中所测量的BCMA水平比较。
实例
提出以下实例以便为所属领域的一般技术人员提供如何制得及使用本发明的方法及组合物的完整公开内容及描述,并且以下实例并不意图限制本发明人视作其发明的范围。已努力确保关于所用数量(例如量、温度等)的准确度,但应考虑一些实验性误差及偏差。除非另外指明,否则份为重量份,分子量为平均分子量,温度以摄氏度计,并且压力为大气压或接近大气压。
实例1:产生抗BCMA抗体
抗BCMA抗体通过用人类BCMA抗原(例如hBCMA,SEQ ID NO:115)使经基因修饰小鼠免疫或通过用人类BCMA抗原使包括编码人类免疫球蛋白重链及κ轻链可变区的DNA的经工程改造小鼠免疫来获得。
免疫后,从各小鼠采集脾细胞并将其(1)与小鼠骨髓瘤细胞融合以保留其成活力并且形成融合瘤细胞并筛选BCMA特异性或(2)使用人类BCMA片段作为结合并鉴别反应性抗体(抗原阳性B细胞)的分选试剂分选B细胞(如US 2007/0280945A1中所描述)。
初始分离具有人类可变区及小鼠恒定区的BCMA的嵌合抗体。针对所期望的特征(包含亲和力、选择性等)表征及选择抗体。如果需要,用所期望的人类恒定区(例如野生型或经修饰的IgG1或IgG4恒定区)替代小鼠恒定区以产生完全人类抗BCMA抗体。虽然所选恒定区可根据具体用途而改变,但高亲和力抗原结合及靶特异性特征存在于可变区中。
抗BCMA抗体的重链及轻链可变区氨基酸及核酸序列:表1列举本发明的选定抗BCMA抗体的重链及轻链可变区以及CDR的氨基酸序列标识符。对应核酸序列标识符列举于表2中。
表1:氨基酸序列标识符
表2:核酸序列标识符
实例2:产生抗CD3抗体
如WO 2017/053856(其以引用的方式并入本文中)中所描述产生抗CD3抗体。两种所述抗CD3抗体选自根据本发明的双特异性抗BCMA x抗CD3抗体的产物。表3列举选定抗CD3抗体的重链及轻链可变区以及CDR的氨基酸序列标识符。对应核酸序列标识符列举于表4中。用于制备根据本发明的双特异性抗体的其它抗CD3抗体可见于例如WO 2014/047231。
表3:氨基酸序列标识符
表4:核酸序列标识符
实例3:产生结合BCMA及CD3的双特异性抗体
本发明提供结合CD3及BCMA的双特异性抗原结合分子;所述双特异性抗原结合分子在本文中也称为“抗BCMA x抗CD3或抗CD3 x BCMA或抗BCMA x抗CD3双特异性分子”。抗BCMA x抗CD3双特异性分子的抗BCMA部分适用于靶向表达BCMA(也称为CD269)的肿瘤细胞,并且双特异性分子的抗CD3部分适用于活化T细胞。肿瘤细胞上的BCMA及T细胞上的CD3的同时结合有助于通过经活化的T细胞定向杀伤(细胞裂解)靶肿瘤细胞。
使用标准方法构建包括抗BCMA特异性结合域及抗CD3特异性结合域的双特异性抗体,其中抗BCMA抗原结合域及抗CD3抗原结合域各自包括与共同LCVR配对的不同、相异的HCVR。在示例性双特异性抗体中,利用来自抗CD3抗体的重链、来自抗BCMA抗体的重链及来自抗CD3抗体的共同轻链来构建分子(10082)。在其它情况下,可利用来自抗CD3抗体的重链、来自抗BCMA抗体的重链及已知与多种重链臂有效混杂或配对的抗体轻链来构建双特异性抗体。
表5:抗BCMA x抗CD3双特异性抗体的组成部分的概述
表6展示本文所例示的双特异性抗BCMA x抗CD3抗体的氨基酸序列标识符。
表6:抗BCMA x抗CD3双特异性抗体的氨基酸序列
实例4:表面等离子共振所推导出的抗BCMA抗体及抗BCMA x抗CD3双特异性抗体的结合亲和力及动力学常数
使用实时表面等离子共振生物传感器使用Biacore 4000仪器测定hBCMA.mmh(SEQID NO:106)结合经纯化的抗BCMA mAb及抗BCMA x抗CD3双特异性mAb的平衡解离常数(K
如表7中所示,在25℃下,本发明的所有抗BCMA抗体均结合人类BCMA-MMH,K
表7:在25℃下抗BCMA单克隆抗体结合人类BCMA-MMH的结合动力学参数
表8:在25℃下抗BCMA单克隆抗体结合人类BCMA-MFC的结合动力学参数
表9:在25℃下抗BCMA单克隆抗体结合猴子BCMA-MMH的结合动力学参数
表10:在25℃下抗BCMA单克隆抗体结合猴子BCMA-MFC的结合动力学参数
表11:在25℃下抗BCMA单克隆抗体结合小鼠BCMA-MFC的结合动力学参数
实例5:抗BCMA x抗CD3双特异性抗体与表达人类及食蟹猕猴CD3的细胞的FACS结合
利用流动式细胞测量分析以测定BCMA x CD3双特异性抗体与人类及食蟹猕猴CD3(Jurkat细胞、经mfCD3工程改造的Jurkat细胞、原代人类CD8+及食蟹猕猴CD8+T细胞)的结合。简单地说,在FACS洗液存在下在冰上将1e05个细胞/孔与封闭液(PBS+1%经过滤FBS+5%小鼠血清)以及BCMA x CD3及对照抗体的连续稀释液一起培育30分钟。在培育之后,将细胞用冷FACS洗液(PBS+1%经过滤FBS)洗涤两次并且经结合的抗体通过在冰上与Alexa647-缀合抗人类二级抗体一起再培育30分钟来检测。不含抗体或仅含二级抗体的孔用作对照。为了检测猴子及人类T细胞,将CD4、CD8及CD16的人类及食蟹猕猴交叉反应性抗体的混合物添加到抗人类二级抗体。在培育之后,将细胞洗涤,再悬浮于200μL含有1%经过滤FBS的冷PBS中并通过流式细胞测量术在BD FACS Canto II上分析。通过FSC-H通过FSC-A选择单重峰事件接着侧面及正向散射以选择存活事件来门控细胞。对于猴子T细胞,进行CD8+/CD16-细胞上的其它门控。
使用Prism软件中的4参数非线性回归分析计算FACS结合的EC50值。
Jurkat细胞为表达人类CD3的T细胞成淋巴细胞细胞系。REGN5458结合Jurkat细胞及原代人类CD8+T细胞上的人类CD3,中值EC50分别为1.50×10
对于阴性同型对照抗体(指定mAb15260)在任何细胞系上均未观察到结合。
表12:结合表达CD3的细胞:中值EC50
实例6:FACS结合分析评估细胞表面抗原结合力
经由流式细胞测量术测定抗BCMA x CD3抗体、mAb25442D结合BCMA阳性多发性骨髓瘤(NCI-H929、MM.1S、OPM-2及RPMI-8226)、BCMA阳性淋巴瘤(Raji及Daudi)及BCMA阴性(HEK293)细胞的表面的能力。使用细胞解离缓冲液(密理博(Millipore),Cat#S-004-C)从烧瓶采集细胞并在96孔V型底培养板中将细胞接种于染色缓冲液(PBS,不含钙及镁(Irving9240)+2%FBS(ATCC 30-2020))中,密度为500,000个细胞每孔。在4℃下用Alexa647缀合抗BCMA x CD3抗体(mAb25442D-A647)或具有与无关肿瘤靶向臂配对的相同CD3结合臂的Alexa 647缀合同型对照(同型-A647)的两倍连续稀释液将细胞染色30分钟。将细胞用染色缓冲液洗涤两次并根据制造商说明用LIVE/DEAD
表13:与细胞的结合
ND=由于非S形曲线而未确定
实例7:在表达BCMA的细胞存在下经由双特异性抗BCMA x抗CD3抗体的T细胞活化
在Jurkat/NFATLuc报告子生物分析中利用若干具有不同BCMA表面表达水平的细胞系评估抗BCMA x抗CD3双特异性抗体的活性。使Jurkat细胞经工程改造以表达NFAT-荧光素酶报告子(Jurkat/NFATLuc.3C7)并将50,000个Jurkat报告细胞与50,000个BCMA阳性(Daudi、MM1-S、NCI-H929、OPM-2、RPMI-8226、MOLP-8或Raji)或BCMA阴性(HEK293)细胞在Thermo Nunclonδ96白色微孔培养板孔中(Thermo Scientific,Cat#136102)于50ul分析培养基(RPMI培养基,含10%FBS及1%P/S/G)中组合。将BCMA x CD3双特异性抗体(mAb25441D或mAb25442D)或二价抗BCMA抗体(mAb21581)的三倍连续稀释液立即添加于50uL分析缓冲液中。将培养板轻轻搅动并在37℃、5%CO
在表达BCMA的细胞存在下mAb25441D活化Jurkat/NFATLuc细胞,其中EC50在0.61nM至2.1nM范围内并且S:N在8至123范围内。在表达BCMA的细胞存在下mAb25442D活化Jurkat/NFATLuc细胞,其中EC50在2.6nM至11nM范围内并且S:N在7至120范围内。具有较高亲和力CD3结合臂的BCMA x CD3双特异性mAb25441D始终比具有较低亲和力CD3结合臂的mAb25442D更有效;然而,两种双特异性抗体的S:N类似。在HEK293细胞存在下两种抗体皆不活化Jurkat/NFATLuc细胞,并且对照双特异性抗体未显著增加任何测试细胞系的Jurkat报告子活性。结果展示于下表14A及14B中。
表14A:T细胞的活化
表14B:T细胞的活化
实例8:基于FACS的细胞毒性分析评估在抗BCMA x抗CD3双特异性抗体存在下T细胞介导的表达BCMA的多发性骨髓瘤细胞的杀伤
在一组多发性骨髓瘤细胞系上使用Quantum Simply Cellular抗人类IgG试剂盒并按照制造商的说明(Bangs Laboratories)测定市售抗人类BCMA抗体(克隆19F2)的抗体结合能力(ABC)。
简单地说,在4℃下与APC缀合抗hBCMA-19F2抗体的滴定一起培育多发性骨髓瘤(MM)细胞系(H929、MM1S、U266、MOLP8及RPMI8226)及Quantum Simply Cellular珠粒30分钟。在培育之后,将细胞及珠粒洗涤三次,再悬浮于200μL含有1%经过滤FBS的冷PBS中并通过流式细胞测量术分析。使用
通过流式细胞测量术测定由休眠人类或食蟹猕猴T细胞所致的表达BCMA的靶细胞的杀伤。简单地说,将人类或食蟹猕猴外周血液单核细胞(PBMC)以1×10
将人类CD8+T细胞门控为CD45+/CD14-/CD4-/CD8+。将食蟹猕猴CD8+T细胞门控为CD45+/CD20-/CD14-/CD4-/CD8+T细胞,将活化报告为在总体CD8+T细胞中CD25+或CD69+T细胞的百分比。
使用Prism软件中的4参数非线性回归分析计算靶细胞存活及T细胞活化的EC50值。
测试抗BCMA x抗CD3双特异性抗体的活化休眠人类及食蟹猕猴T细胞以杀伤一组具有不同表面BCMA水平的表达BCMA的细胞的能力。在休眠人类T细胞作为效应细胞的情况下,REGN5458介导的5种不同BCMA细胞系的杀伤具有在7.07×10
仅在MM细胞系H929上测试由食蟹猕猴T细胞介导的BCMA x CD3杀伤。由REGN5458及REGN5459介导的细胞毒性的EC
表15A:中值EC
表15B:中值EC
表16:中值EC
实例9:在抗BCMA x抗CD3双特异性抗体存在下自体T细胞介导的原代多发性骨髓瘤母细胞的杀伤的FACS细胞毒性分析
为了通过流式细胞测量术监测多发性骨髓瘤细胞的特异性杀伤,将来自多发性骨髓瘤患者的骨髓单核细胞(BMMC)接种于人类基质细胞(HS5)上并在37℃下静置整夜。分开地,将匹配患者外周血液单核细胞(PBMC)解冻并在37℃下在补充RPMI培养基中以1×10
将T细胞门控为CD2阳性、CD56阴性及CD4或CD8阳性。将T细胞活化报告为在总体CD4或CD8 T细胞中CD25+CD4或CD8 T细胞的百分比。
测试BCMA x CD3双特异性抗体的通过自体供体PBMC再导引原代多发性骨髓瘤母细胞的杀伤的能力。原代MM母细胞的最大BCMA x CD3介导的细胞毒性范围为52%至96%,对于REGN5458来说EC50在9.89×10
表17A:MM%裂解
表17B:MM裂解EC50及T细胞活化
实例10:抗BCMA x抗CD3双特异性抗体在异基因型肿瘤模型中防止体内表达BCMA的肿瘤(NCI-H929)生长
为测定BCMA x CD3双特异性抗体(Ab)的体内功效,进行异基因型肿瘤研究。对免疫缺陷NOD.Cg-Prkdc
同基因型肿瘤的植入及测量:对NSG小鼠植入10×10
同基因型肿瘤生长及抑制的计算:为了通过外部卡尺测定肿瘤体积,测定最大纵向直径(长度以mm计)及最大横向直径(宽度以mm计)。基于卡尺测量的肿瘤体积通过下式计算:体积(mm
BCMA x CD3双特异性Ab防止异基因型肿瘤模型中BCMA
表18:各个时间点的平均肿瘤尺寸
实例11:抗BCMA x抗CD3双特异性抗体在异基因型体内肿瘤模型中以剂量依赖性方式防止表达BCMA的肿瘤(NCI-H929)生长
为测定抗BCMA x抗CD3双特异性抗体(Ab)的体内功效,进行异基因型肿瘤研究。对免疫缺陷NOD.Cg-Prkdc
异基因型肿瘤的植入及测量:对NSG小鼠皮下植入10×10
异基因型肿瘤生长及抑制的计算:为了通过外部卡尺测定肿瘤体积,测定最大纵向直径(长度以mm计)及最大横向直径(宽度以mm计)。基于卡尺测量的肿瘤体积通过下式计算:体积(mm
在这一异基因型体内肿瘤模型中BCMA x CD3双特异性Ab以剂量依赖性方式防止BCMA
表19:各个时间点的平均肿瘤尺寸
实例12:抗BCMA x抗CD3双特异性抗体在异基因型体内肿瘤模型中以剂量依赖性方式减小已建立的表达BCMA的肿瘤(NCI-H929)的尺寸并防止其生长
为测定抗BCMA x抗CD3双特异性抗体(Ab)的体内功效,进行异基因型肿瘤研究。对免疫缺陷NOD.Cg-Prkdc
异基因型肿瘤的植入及测量:对NSG小鼠皮下植入10×10
异基因型肿瘤生长及抑制的计算:为了通过外部卡尺测定肿瘤体积,测定最大纵向直径(长度以mm计)及最大横向直径(宽度以mm计)。基于卡尺测量的肿瘤体积通过下式计算:体积(mm
在此异基因型体内肿瘤模型中抗BCMA x抗CD3双特异性抗体以剂量依赖性方式减小已建立的BCMA
表20:各个时间点的平均肿瘤尺寸
实例13:抗BCMA x抗CD3双特异性抗体在异基因型体内肿瘤模型中以剂量依赖性方式防止表达BCMA的肿瘤(MOLP-8)生长
为测定抗BCMA x抗CD3双特异性抗体(Ab)的体内功效,进行异基因型肿瘤研究。对免疫缺陷NOD.Cg-Prkdc
异基因型肿瘤的植入及测量:对NSG小鼠皮下植入5×10
异基因型肿瘤生长及抑制的计算:为了通过外部卡尺测定肿瘤体积,测定最大纵向直径(长度以mm计)及最大横向直径(宽度以mm计)。基于卡尺测量的肿瘤体积通过下式计算:体积(mm
在此异基因型体内肿瘤模型中抗BCMA x抗CD3双特异性抗体以剂量依赖性方式防止BCMA
表21:各个时间点的平均肿瘤尺寸
实例14:在异基因型体内肿瘤模型中抗BCMA x抗CD3双特异性抗体推迟表达BCMA的肿瘤(MOLP-8)的生长
为测定抗BCMA x抗CD3双特异性抗体(Ab)的体内功效,进行异基因型肿瘤研究。在第11天,对免疫缺陷NOD.Cg-Prkdc
异基因型肿瘤的植入及测量:在第11天,对免疫缺陷NOD.Cg-Prkdc
异基因型肿瘤生长的测量:将BLI成像用于测量肿瘤负荷。对小鼠IP注射150mg/kg的悬浮于PBS中的荧光素酶底物D-荧光素。在此注射之后五分钟,使用Xenogen IVIS系统在异氟醚麻醉下进行小鼠的BLI成像。在D处的视野、1.5cm的对象高度及具有自动曝光时间的中等合并水平情况下通过Living Image软件进行图像采集。使用Living Image软件提取BLI信号:在每个肿瘤块周围绘制关注区并将光子强度记录为p/s/cm2/sr。
在此异基因型体内肿瘤模型中抗BCMA x抗CD3双特异性抗体REGN5458推迟BCMA
表22:各个时间点的平均肿瘤尺寸(以辐射率计)
实例15:抗BCMA x抗CD3双特异性抗体使体内肿瘤(OPM-2)负担降低到背景水平
为测定抗BCMA x抗CD3双特异性抗体(Ab)的体内功效,进行异基因型肿瘤研究。在第0天,向免疫缺陷NOD.Cg-Prkdc
异基因型肿瘤的植入及测量:在第0天向免疫缺陷NOD.Cg-Prkdc
异基因型肿瘤生长的测量:将BLI成像用于测量肿瘤负荷。对小鼠IP注射150mg/kg的悬浮于PBS中的荧光素酶底物D-荧光素。在此注射之后五分钟,使用Xenogen IVIS系统在异氟醚麻醉下进行小鼠的BLI成像。在D处的视野、1.5cm的对象高度及具有自动曝光时间的中等合并水平情况下通过Living Image软件进行图像采集。使用Living Image软件提取BLI信号:在每个肿瘤块周围绘制关注区并将光子强度记录为p/s/cm2/sr。
虽然在经CD3结合对照处理的小鼠中BCMA
表23:各个时间点的平均肿瘤尺寸(以辐射率计)
实例16:BCMA x CD3双特异性抗体以剂量依赖性方式压制体内异体同质肿瘤的生长
为测定抗BCMA x抗CD3双特异性抗体(Ab)的体内功效,在表达人类CD3的小鼠中进行异体同质肿瘤研究。对表达人类CD3deg而非鼠类CD3deg的C57BL/6小鼠(CD3人类化小鼠)皮下植入0.5×10
异体同质肿瘤的植入及测量:对表达人类CD3deg而非鼠类CD3deg的C57BL/6小鼠(CD3人类化小鼠)皮下植入0.5×10
异体同质肿瘤生长及抑制的计算:为了通过外部卡尺测定肿瘤体积,测定最大纵向直径(长度以mm计)及最大横向直径(宽度以mm计)。基于卡尺测量的肿瘤体积通过下式计算:体积(mm
虽然B16/BCMA肿瘤及MC38/BCMA肿瘤在经CD3结合对照处理的小鼠中生长,但BCMAx CD3 REGN5458能够以剂量依赖性方式体内压制两种肿瘤系的生长。结果展示于下表24中。
表24:各个时间点的平均肿瘤尺寸
实例17:通过氢氘交换进行的REGN5458结合BCMA的表位定位
进行H/D交换表位定位质谱(HDX-MS)以测定与REGN5458(BCMA x CD3双特异性抗体)相互作用的BCMA的氨基酸残基(重组人类BCMA,SEQ ID NO:115的氨基酸序列)。H/D交换方法的一般描述阐述于例如Ehring(1999)《分析生物化学》267(2):252-259;及Engen及Smith(2001)《分析化学》73:256A-265A中。
在集成式HDX/MS平台上进行HDX-MS实验,所述平台由以下组成:用于氘标记及淬灭的Leaptec HDX PAL系统、用于样品消化及负载的Waters Acquity M-Class(Auxiliary溶剂管理器)、用于分析型梯度的Waters Acquity M-Class(μBinary溶剂管理器)及用于肽质量测量的Thermo Q Exactive HF质谱仪。
将标记溶液制备成pD 7.0的于D
针对包含BCMA及其随机序列的数据库使用Byonic搜索引擎(Protein Metrics)搜索非氘化BCMA样品的LC-MS/MS数据。使用非特异性酶促消化及人类醣基化作为共享可变修饰将检索参数(在ELN中)设定为默认值。随后将经鉴别的肽的列表导入到HDX Workbench软件(3.3版)中以计算通过LC-MS从所有氘化样品检测到的每种肽的氘吸收。对于给定的肽,将每个时间点的质心质量(强度加权平均质量)用于计算氘吸收(D)及氘吸收百分比(%D):
从单独hBCMA.hFc及与REGN5458样品复合的hBCMA.hFc鉴别出总共8种来自hBCMA.hFc的肽,代表hBCMA的100%序列覆盖度。所有肽的平均标准偏差(SD)评估为1.4%(详细计算定义于ELN及Pascal,BD等人(2012)《美国质谱学会杂志(Journal of theAmerican Society for Mass Spectrometry)》23(9):1512-1521中)。因此,任何展现高于4.2%(平均SD的3倍)的差异性D-吸收百分比值的肽定义为显著受保护。对于hBCMA.hFc,对应于SEQ ID NO:106(MLQMAGQCSQNEYFDSLLHACIPCQLRCSSNTPPLTCQRYCNA;SEQ ID NO:121)的氨基酸1至43的肽显著由REGN5458保护。使用hBCMA.mmH(REGN2744,SEQ ID NO:106的氨基酸序列)证实这些残基由REGN5458保护。
表25:在结合REGN5458后选定BCMA.hFc肽具有显著保护作用
实例18:在与抗BCMA抗体一起培育整夜的后多发性骨髓瘤细胞系上的BCMA x CD3双特异性抗体及其它BCMA抗体的FACS结合分析
利用流动式细胞测量分析以测定多发性骨髓瘤细胞系与抗BCMA抗体一起培育整夜对表面BCMA水平的影响。将MM细胞系(H929、Molp8、U266及MM1.S)洗涤两次并在37℃下在含有66.7或667nM抗BCMA抗体、DAPT(γ-分泌酶抑制剂)的R10培养基(RPMI+10%FBS+pen/strep/glut)或单独培养基中培养。在18小时之后,将孔用冷FACS洗液(PBS+1%经过滤FBS)洗涤并在冰上再悬浮于667nM的于冷染色缓冲液(Miltenyi 130-091-221)中的相同抗BCMA抗体中30分钟。在培育之后,将细胞用冷FACS洗液(PBS+1%经过滤FBS)洗涤两次并且经结合的抗体通过在冰上与适当的抗人类二级抗体(抗hIgG或抗HIS)一起再培育30至45分钟来检测。在培育之后,将细胞洗涤,再悬浮于200μL含有1%经过滤FBS的冷PBS中并通过流式细胞测量术在BD FACS Canto II上分析。通过将先前在BCMA ab或DAPT中培育整夜的染色细胞的MFI除以仅在培养基中培育整夜的染色细胞的MFI来计算染色的增加倍数。
BCMA通过酶γ-分泌酶从细胞表面快速分裂。与γ-分泌酶抑制剂(如DAPT)一起培育整夜防止导致细胞表面上的BCMA水平增加的BCMA裂解。表26至29报告与仅在培养基中培育的细胞相比在抗BCMA抗体或DAPT中培育整夜的细胞上BCMA的中值荧光强度(MFI)的增加倍数。观察到与DAPT一起培育整夜通过抗BCMA抗体(BCMA x CD3双特异性R5458、亲本BCMA抗体mAb15281及其它内部BCMA抗体)使H929、Molp8、U266及MM.1S上所检测到的BCMA水平分别增加2.3至4倍、2.4至8.6倍、5.3至9.0倍及11.9倍。
值得重视地,还观察到将MM细胞系与66.7或667nM REGN5458或亲本二价抗BCMA抗体mAb21581一起培育整夜类似地使得通过FACS所检测的表面BCMA水平增加,表明抗BCMA抗体的结合防止BCMA通过γ-分泌酶裂解。抗体诱导的表面BCMA的增加因细胞系而不同,与H929或U266相比Molp8及MM1S细胞上的增加倍数更大。所述现象不限于REGN5458,因为其也在其它内部BCMA抗体观察到。
表26:相比于仅在培养基中培育的细胞(NCI-H929)的MFI变化倍数
表27:相比于仅在培养基中培育的细胞(Molp8)的MFI变化倍数
表28:相比于仅在培养基中培育的细胞(U266)的MFI变化倍数
表29:相比于仅在培养基中培育的细胞(MM1S)的MFI变化倍数
实例19:在BCMA x CD3双特异性抗体存在下人类及食蟹猕猴浆细胞的自体T细胞介导的杀伤
通过流式细胞测量术评估通过非刺激性自体T细胞特异性杀伤富集的CD138
体外研究评估REGN5458或阴性对照(BCMA结合对照mAb或CD3结合对照bsAb)对原代人类及食蟹猕猴T细胞活化及自体浆细胞细胞毒性的影响。每种供体的细胞毒性及T细胞活化百分比的EC
REGN5458在自体T细胞存在下以浓度依赖性方式介导来自供体1及2的原代人类浆细胞的细胞毒性,EC
REGN5458以浓度依赖性方式介导两种供体中的原代食蟹猕猴浆细胞的细胞毒性;计算出供体1的EC
在BCMA结合对照情况下在所测试的任何浓度下在所评估的任一细胞系中均未观察到靶细胞杀伤。在CD3结合对照情况下在纳摩尔浓度下观察到在来自供体2的浆细胞存在下的一些靶细胞杀伤及T细胞活化。
表30:每种供体的细胞毒性及T细胞活化百分比的EC
实例20:抗BCMA x抗CD3双特异性抗体与抗PD-1抗体协同作用以增强体内抗肿瘤功效
为确定BCMA x CD3双特异性抗体(Ab)是否与PD-1阻断协同作用以提供优良体内抗肿瘤功效,在表达人类CD3的小鼠中进行异体同质肿瘤研究。结果证实组合REGN5458加PD-1阻断提供比单独REGN5458或PD-1阻断优良的抗肿瘤功效。
异体同质肿瘤的植入及测量:对表达人类CD3deg而非鼠类CD3deg的C57BL/6小鼠(CD3人类化小鼠)皮下植入1×10
表31:处理组
在第7天及第11天向小鼠给予这些Ab两次以上,总共三个剂量,并在实验期间评估肿瘤生长。
异体同质肿瘤生长及抑制的计算:为了通过外部卡尺测定肿瘤体积,测定最大纵向直径(长度以mm计)及最大横向直径(宽度以mm计)。基于卡尺测量的肿瘤体积通过下式计算:体积(mm
结果证实组合REGN5458加PD-1阻断提供比单独REGN5458或PD-1阻断优良的抗肿瘤功效。确切地说,结果证实在第24天(收集所有处理组的数据的最后一天)BCMA x CD3双特异性抗体与抗PD-1抗体的组合在抑制肿瘤生长中产生统计学上显著的协同治疗作用(表32,0.04mg/kg的BCMA x CD3及4mg/kg的抗PD-1)。在第24天使用双向ANOVA测试,在(i)REGN5458(0.04mg/kg)+同型与REGN5458(0.04mg/kg)+抗PD-1抗体的组合(第3组对比第4组);(ii)REGN5458(0.24mg/kg)+同型与REGN5458(0.24mg/kg)+抗PD-1抗体的组合(第5组对比第6组);(iii)抗PD-1与REGN5458(0.04mg/kg)+抗PD-1抗体的组合(第2组对比第6组)之间p<0.0001。在第24天使用双向ANOVA测试,在抗PD-1与REGN5458(0.04mg/kg)+抗PD-1抗体的组合(第2组对比第4组)之间p=0.0005。在此实验中与PD-1阻断组合增加BCMA x CD3双特异性抗体(0.24mg/kg)的剂量产生类似于较低双特异性抗体剂量加PD-1阻断的肿瘤抑制。证实与较低剂量双特异性抗体协同为有利的,因为使用较低剂量减小任何不利副作用的风险。类似地,BCMA x CD3双特异性抗体与抗PD-1抗体的组合在实验结束时(第28天)在两种剂量的双特异性抗体(0.04mg/kg及0.24mg/kg)下均展示出对无肿瘤小鼠的数量的协同治疗作用,如表33中所示。
表32:各个时间点的平均肿瘤尺寸
表33:实验结束时的无肿瘤小鼠
实例21:抗BCMA x抗CD3双特异性抗体与抗PD-1抗体协同作用以增强体内抗肿瘤功效
在第二实验中获得类似结果,与上文实例20中所论述一致,不同之处在于每组小鼠的数量=10,并且BCMA x CD3 REGN5458的较高剂量为0.4mg/kg。第二实验的具体处理组展示于下表34中。
表34:处理组
结果证实组合REGN5458加PD-1阻断提供比单独REGN5458或PD-1阻断优良的抗肿瘤功效。确切地说,结果证实在第21天(收集所有处理组的数据的最后一天)BCMA x CD3双特异性抗体与抗PD-1抗体的组合在抑制肿瘤生长中产生协同治疗作用(表35,0.04mg/kg的BCMA x CD3及4mg/kg的抗PD-1)。在第21天使用双向ANOVA测试,在(i)REGN5458(0.04mg/kg)+同型与REGN5458(0.04mg/kg)+抗PD-1抗体的组合(第3组对比第4组);(ii)抗PD-1与REGN5458(0.04mg/kg)+抗PD-1抗体的组合(第2组对比第4组);(iii)抗PD-1与REGN5458(0.4mg/kg)+抗PD-1抗体的组合(第2组对比第6组)之间p<0.0001。如上文实例20中所论述,在此实验中与PD-1阻断组合增加BCMA x CD3双特异性抗体(0.4mg/kg)的剂量产生类似于较低双特异性抗体剂量与PD-1阻断组合的肿瘤抑制。证实与较低剂量双特异性抗体协同为有利的,因为使用较低剂量减小任何不利副作用的风险。类似地,BCMA x CD3双特异性抗体与抗PD-1抗体的组合在实验结束时(第25天)在两种剂量的双特异性抗体(0.04mg/kg及0.4mg/kg)下均展示出对无肿瘤小鼠的数量的协同治疗作用,如表36中所示。
表35:各个时间点的平均肿瘤尺寸
表36:实验结束时的无肿瘤小鼠
本发明的范围不受本文所描述的具体实施例限制。实际上,根据前述描述,除本文所描述的修改以外,本发明的各种修改对所属领域的技术人员来说将变得显而易见。所述修改意图属于所附权利要求书的范围内。
- 双特异性抗BCMAx抗CD3抗体及其用途
- 包含抗间皮素抗体、抗CD3抗体或抗EGFR抗体的融合蛋白、包含所述融合蛋白的双特异性或三特异性抗体,及其用途
