基于球形核酸的级联信号放大高灵敏检测外泌体
文献发布时间:2023-06-19 10:10:17
技术领域
本发明属于分析化学领域,涉及基于球形核酸和酶介导的信号级联放大检测外泌体的原理,过程,实验条件及应用。
发明背景
外泌体是一个装载有蛋白、核酸以及小分子代谢物的膜结构复合体,其内容物组成及变化往往与组织细胞的生理状态密切相关。肿瘤的发生、发展与转移也影响外泌体上膜蛋白、膜内核酸变化。各种不同的细胞均能分泌外泌体并释放到体液中,在全身循环。血液、尿液、唾液中均能发现外泌体的存在。外泌体作为液体活检中一种有巨大潜力的肿瘤标志物,在疾病诊断、治疗预后方面有重要的临床价值。因此,准确、灵敏检测外泌体对于进一步研究外泌体的功能以及临床诊断具有重要意义。
由于外泌体在疾病诊断和预后中的重要作用,研究人员设计了许多方法用于外泌体的检测分析,比如传统的酶联免疫吸附(ELISA)、免疫印迹 (western blotting)和纳米粒子示踪分析(nanoparticle tracking analysis,NTA)。但这些方法一方面操作较为繁琐,需要熟练的技术;另一方面所需的样品量较大,且检测的灵敏度较低。因此发展新的方法用于外泌体简单、灵敏的检测有利于促进外泌体的深入研究与临床应用。当前,利用表面增强拉曼光谱、流式细胞术、微流控、电化学等方法能够对外泌体进行较为灵敏的检测分析。这些方法通常利用抗体或者适体作为特异性检测探针与外泌体膜蛋白结合后用于信号放大。抗体价格较为昂贵且不稳定,需要放于-20℃低温中保存;适体通常需要比较复杂的设计以降低背景信号或者响应靶标发生构象变化。这些方法中使用的抗体和适体可能增大外泌体检测分析的成本和设计难度。为此,设计出一种比较通用型的高灵敏检测外泌体的方法仍然具有挑战。
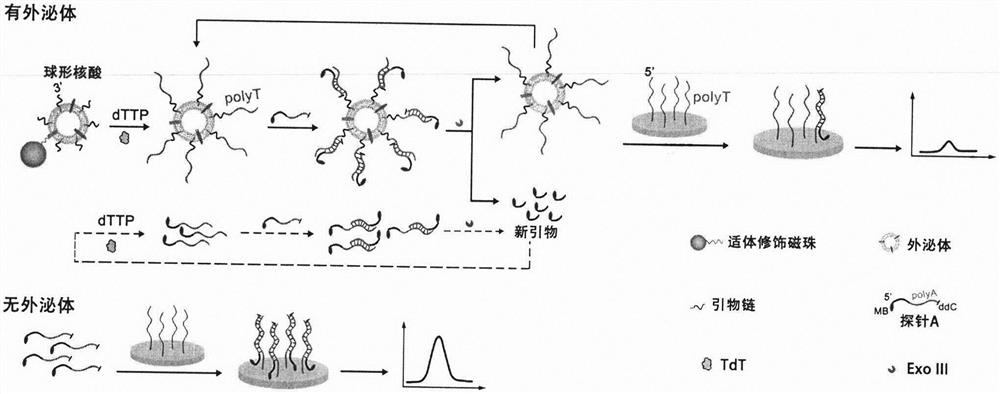
球形核酸(Spherical nucleic acids,SNAs)是一种修饰在球形纳米材料上的一层致密和高度定向的核酸。由于与互补核酸或者受体蛋白结合的亲和力强,球形核酸越来越多地被用于生物监测和药物递送。外泌体是一种由磷脂双分子层组成的球形或类球形囊泡,能够与修饰胆固醇的分子通过疏水作用结合。受此启发,外泌体能够作为一个核心模板大量结合修饰胆固醇的核酸链以形成球形核酸。因此,我们对于外泌体的检测可以转换成对膜蛋白和膜脂的检测。即利用膜蛋白适体特异性捕获外泌体,接着疏水的磷脂双分子层与修饰胆固醇的 DNA单链基于疏水作用力结合形成球形核酸,结合上外泌体的球形核酸则引发信号放大反应。由此,我们提出了一个外泌体膜上核酸结合、生长、切割的循环信号放大方法用于高灵敏检测外泌体。
发明内容
本发明的目的是基于球形核酸的级联信号放大用于高灵敏检测外泌体。
本发明采用以下机理:图1对实验原理进行了详细的解释。具体而言,先在磁珠上修饰结合外泌体膜蛋白的特异性适体,加入外泌体后,外泌体被磁珠捕获。经过磁分离后,再加入胆固醇修饰的单链与外泌体膜结合。此时,外泌体膜上结合了大量含有3’-OH的单链DNA,该单链DNA能够被脱氧核酸末端转移酶(TdT)延长,在以dTTP为底物的前提下,形成polyT聚合物。溶液中存在的富含polyA的探针A与polyT结合后,被核酸外切酶III(ExoIII)切割。切割后的探针A短链又能被TdT识别并延长,重复进行探针A的消耗。探针 A越少,与电极界面上固定的探针B结合量也越少,最后电信号就随之降低。该方法仅需一种无模板引物链,在TdT、Exo III和探针A存在情况下,于同一反应液中进行三重信号放大过程。此外,该方法无需复杂的适体和探针链设计,就能实现信号的循环放大,为推动外泌体的临床应用提供有益的借鉴思路。
根据上述原理,本发明采用如下技术方案:
一、外泌体和电极修饰的表征:
外泌体通过超速离心收集纯化后,通过NTA测得MCF-7细胞的外泌体浓度为1.1×10
2μM探针B通过过夜孵育修饰到电极后,通过电化学阻抗和循环伏安法表征是否修饰上去。如图2C、D所示,在探针B修饰到金电极上后,阻抗增加,循环伏安法中的峰电流也随之下降,说明探针B成功修饰到金电极上。我们观察到阻抗增加值不大,这可能与探针B上的polyT序列与金电极的吸附较弱有关。随后,我们加入探针A与电极孵育30min,观察到阻抗随之进一步增大,循环伏安法中的峰电流也随之下降,这是探针A与探针B杂交结合所致。
二、方法的可行性验证:
首先,我们验证引物链(primer)经过TdT酶延长后,在Exo III酶作用下能不断消耗探针A。如图3A所示,探针A与电极孵育后,能产生较强的亚甲基蓝电信号。探针A与TdT、Exo III两种酶共同孵育后,亚甲基蓝的电信号几乎不变,这说明TdT、Exo III对探针A不起作用。而当引物链、探针A与TdT、 Exo III共反应后,电极上几乎检测不到亚甲基蓝的电信号,这表明引物链被 TdT延长后,在Exo III作用下不断切割探针A,致使没有探针A与电极上的探针B结合,从而没有电信号产生。
在证明引物链在整个检测体系中的关键作用后,我们将该检测方法用于外泌体的检测。当存在外泌体时,外泌体被磁珠捕获。捕获的外泌体膜通过疏水作用与引物链上的胆固醇结合,因此检测体系中的引物链含量多少与捕获的外泌体量呈正相关。加入探针A、TdT、Exo III后,经过TdT的延长与Exo III的切割作用,探针A不断消耗,导致最终与电极上探针B结合的探针A减少,电信号减弱。图3B中外泌体实验组与对照组之间明显的亚甲蓝信号强弱,证明了这种方法可用于外泌体的检测,即验证了该方法的可行性。
三、本发明相关参数的优化:
为获得最优的检测性能,我们对实验中探针结合时间、TdT酶浓度、Exo III浓度、酶反应时间等参数进行了优化。富含polyA的探针A与富含polyT的探针B由于碱基互补配对结合,我们研究在室温下探针A和探针B达到最大结合所需的时间。如图4A所示,探针A与探针B孵育5min后,电信号就比较强,表明基于碱基互补的探针A与探针B杂交效率很高。15min后,SWV电信号最强,因此,探针A与探针B在室温下的最优的结合时间为15min。从图 4B、C中可以观察到,随着TdT、Exo III酶量的增大,所检测到的电信号逐渐减弱,并最终趋于稳定状态,且TdT和Exo III酶量分别为5U和2U时,信号达到稳定。当TdT和Exo III在检测体系中的反应时间逐渐增大,电极上的亚甲基蓝信号逐渐减小,并在120min时达到稳定(图4D)。综上所述,探针结合时间为15min、TdT酶量为5U、Exo III酶量为2U、双酶反应时间为120min作为该实验的优化条件。
四、本发明的灵敏度探究:
在优化了该方法中两种酶的浓度和反应时间后,我们基于该方法对外泌体浓度进行定量分析。首先,用上皮细胞粘附分子(EpCAM)适体与外泌体上的 EpCAM膜蛋白结合捕获外泌体,对不同外泌体浓度进行检测。结果如图5所示,当外泌体浓度处于1.1×10
五、本发明的在复杂生物样品中的分析性能及其在临床诊断上的应用潜力探究:
以上对外泌体的分析都是在成分确定的缓冲盐中进行的,而临床来源的外泌体均是存在于复杂的、成分不确定的生物体液环境里。为了验证本方法在复杂的生物环境中也能对外泌体进行有效检测分析,我们将不同浓度的外泌体稀释在10%胎牛血清(FBS)中,并以PBS中相同的外泌体浓度作为参照分析。复杂样品对该方法的可能干扰在第一步外泌体捕获阶段,由于适体修饰的磁珠负电荷性较大,为降低带正电荷的杂质与磁珠非特异性吸附,我们在第一步磁珠捕获外泌体后用含有0.05%Tween-20缓冲盐清洗磁珠。结果由图6可知,随着含10%FBS的缓冲盐中外泌体浓度的降低,检测体系的电信号值随之增大,且变化趋势与以PBS作为缓冲盐一致。此外,相同浓度的外泌体在10%FBS 与在PBS中检测,最终的信号值没有明显差别,表明该方法能够有效抵抗复杂生物环境的干扰,具有在复杂生物样品中检测外泌体的潜力。
验证该方法在复杂环境中检测能力后,我们将临床上收集到的血清样本用于本方法研究。临床样本经过简单离心分离其中的细胞和大颗粒后,再通过 0.22μm的滤膜以过滤掉大囊泡。之后,将血清样本用PBS稀释10倍后,与修饰了EpCAM适体的磁珠孵育。检测的最后结果如图7所示,癌症患者血清中外泌体EpCAM蛋白显著高于健康组血清中的外泌体EpCAM蛋白。这表明该方法能有效区别肿瘤患者和健康组,具有进一步的临床诊断应用价值。此外,本方法无需经过超高速离心分离外泌体,只需通过普通离心去除细胞,操作简便、成本较低,在临床上具有更大的价值。
六、结论
基于球形核酸和双酶介导的级联信号扩增,我们提出了一种相对简单且高灵敏的方法用于检测外泌体。没有经过复杂的核酸序列设计,该方法获得了三重信号放大:1)一个外泌体结合大量的引物链;2)一条引物链被TdT聚合形成长的polyT序列,并以此为模板在Exo III作用下大量切割探针A;3)新产生的引物链又能循环第二步并不断切割探针A。此外,该方法还可以将适体链换成抗体捕获外泌体。最后,该方法能区分临床样本中的健康组合恶性结直肠癌患者,具有潜在的临床诊断价值。
说明书附图
图1:基于球形核酸和酶介导下级联信号放大检测外泌体的原理图。
图2:(A)用NTA技术检测外泌体的浓度和大小分布。(B)外泌体的透射电子显微镜图像。比例尺为100nm。电化学阻抗(C)和循环伏安法(D)分析金电极界面的逐步修饰,其中,a、b、c分别为裸电极、探针B修饰电极、探针A与电极上修饰的探针B杂交。
图3:实验方法的可行性验证。(A)验证引物链在该方法中的作用。黑色实线是探针A与电极上的探针B杂交后的SWV图。虚线是探针A与TdT酶、Exo III酶于37℃孵育1.5h后,与电极上的探针B结合后的SWV图。黑色点线是探针A与引物链、TdT酶、Exo III酶于37℃孵育1.5h后,与电极上的探针B 结合后的SWV图。(B)验证该方法检测外泌体可行性。黑色实线为不加外泌体的对照组,经过TdT酶、Exo III酶反应,与电极上的探针B杂交后的SWV 图。虚线为修饰适体的磁珠捕获外泌体后,经过TdT酶、Exo III酶反应,与电极上的探针B杂交后的SWV图。
图4:实验参数优化。(A)探针A与电极上的探针B在不同杂交时间所产生的电信号。(B)对反应体系中TdT酶浓度的优化,其中Exo III的酶量为10U,探针A浓度为100nM,反应时间为2.5h。(C)对反应体系中Exo III浓度优化,其中TdT酶量为5U,探针A浓度为100nM,反应时间为2.5h。(D)对 TdT、Exo III两种酶反应时间的优化,其中TdT酶量为5U,Exo III的酶量为 10U,探针A浓度为100nM。图中的误差线为三次重复试验的标准偏差。
图5:(A)该方法的灵敏度探究实验。(A)基于EpCAM适体捕获外泌体,对不同浓度外泌体检测的SWV曲线,其中a→f对应的外泌体浓度分别为:0, 1.1×10
图6:本方法在复杂生物环境中的分析。将相同浓度的外泌体在PBS和含有10%FBS进行分析比较。a、b、c、d组中的外泌体浓度分别为2.2×10
图7:该方法用于临床样本的分析。其中,健康组与疾病对照组的样本量均为 10个,其中疾病组的样本来自恶性结直肠癌患者的血清。(**,P<0.01)。
- 基于球形核酸的级联信号放大高灵敏检测外泌体
- 一种基于杂交和级联信号放大原理的多重核酸检测方法及试剂盒
