包含植物作为原料的凝胶的用途
文献发布时间:2023-06-19 10:18:07
技术领域
本发明涉及包含植物作为原料的凝胶的用途。
背景技术
至今为止,研发了将天然产物,尤其,将植物用作原料的包括食品及美容用途在内的多种用途的组合物。在将植物用作原料的组合物的情况下,包含粉碎植物原料的植物粉末作为组成成分或者包含从植物提取有效成分的提取物作为组成成分来制备。但是,在将植物的粉末本身用作化妆品组合物的组成成分的情况下,组合物的溶液中的植物粉末的分散性低,容易发生在溶液中沉淀或溶剂与粉末相互分离的层分离现象。另一方面,在包含植物提取物作为组合物的有效成分的情况下,提取有效成分的提取工序复杂,需要高额的设备及费用,因此不经济,每个植物种类的有效成分的性质互不相同,因此,具有无法将所具备的提取设备及提取工序适用于多种植物的问题。因此,在将植物用作原料的组合物的制备方法中,需要研发不进行提取工序且可适用于多种植物的对于植物粉末的溶液中的分散性改善方案。
发明内容
技术问题
本发明人为了解决如上所述的问题,研发了如下的凝胶状的组合物的制备方法,即,若对被微细粉碎的各种植物的粉末导入氧化工序,则不添加额外的分散剂或稳定化剂,也具有优秀的分散稳定性及使用感,进而,确认了这种植物性凝胶的皮肤保湿效果、抗衰老效果及美白效果等作为化妆品的优秀功效。因此,本发明的目的在于,提供包含氧化的微粉状(pulverized)植物粉末及剩余量的溶剂的植物凝胶化妆品组合物及它们的用途。
技术方案
根据本发明的一实施方式,本发明提供包含氧化的微粉状植物粉末及剩余量的溶剂的植物凝胶化妆品组合物。
在本发明中,“植物”可以为陆地植物或海洋植物。上述陆地植物指在陆地生长的植物,上述海洋植物指在海洋的海水中或海洋土壤中生长的植物。
在本发明中,根据所要使用的部位,上述陆地植物或海洋植物可分为地上植物、地下植物及全草植物,即使为相同种类的植物,其用途也根据使用目的不同,并不是明确区分的。
在本发明中,上述地上植物指使用植物的茎、叶、花、果实或种子的皮(粕)等的植物。但是,并不仅限定于上述植物的茎、叶、花、果实或种子的皮(粕)。
并且,上述地下植物指使用植物的根或在地下生长的茎等的植物。
在本发明中,上述全草植物指将植物的地上部分和地下部分都使用的植物。
在本发明的一实例中,上述微粉状植物粉末为被微细粉碎的陆地植物的粉末。
在本发明的另一实例中,以植物凝胶化妆品组合物的总重量为基准,能够以0.1~30%(w/v)的浓度包含上述组合物的氧化的微粉状植物粉末。
本发明人按照各个陆地植物/海洋植物的所要使用的部位制备植物凝胶的结果,了解到在各个陆地植物的部位中,很好地形成凝胶的氧化微粉状植物粉末的浓度不同。例如,在陆地植物的全草、根、茎或它们的皮(粕)的情况下,以组合物的总重量为基准,包含1~25%(w/v)的氧化的微粉状植物粉末才能形成凝胶,在陆地植物的叶、果实、种子或它们的皮(粕)的情况下,以组合物的总重量为基准,需包含浓度高于上述全草、根、茎的5~30%(w/v)的氧化的微粉状植物粉末才能很好地形成凝胶,在海洋植物的情况下,包含以低于其的1~20%(w/v)的浓度氧化的微粉状植物粉末才能很好地形成凝胶。
因此,在本发明的一实例中,上述陆地植物为陆地植物的全草、根、茎或它们的皮(粕),在此情况下,以组合物的总重量为基准,上述组合物包含1~25%(w/v)的氧化的微粉状植物粉末。
在上述组合物包含陆地植物的全草、根、茎或它们的皮(粕)的氧化的微粉状植物粉末的情况下,以组合物的总重量为基准,包含1~25%(w/v)、1~20%(w/v)、1~15%(w/v)、1~10%(w/v)、3~25%(w/v)、3~20%(w/v)、3~15%(w/v)、3~10%(w/v)、5~25%(w/v)、5~20%(w/v)、5~15%(w/v)、5~10%(w/v)、10~25%(w/v)、10~20%(w/v)、10~15%(w/v)、15~25%(w/v)、15~20%(w/v)的氧化的微粉状植物粉末,但并不限定于此。但是,经确认,在本发明的组合物包含陆地植物的全草、根、茎或它们的皮(粕)的氧化的微粉状植物粉末的情况下,至少以1%(w/v)以上的浓度包含植物粉末才能很好地形成凝胶。并且,在植物粉末超出25%(w/v)的情况下,由于浓度过高,使用感不佳。
在本发明的一实例中,上述陆地植物的全草、根或它们的皮(粕)选自由红参、人参、红景天、当归、黄芪、白术、牛膝、党参、山养参、羊乳、沙参、桔梗、苍术、葛根、飞来鹤、山药、玉竹、土茯苓、川芎、甘草、芍药、地黄及它们的皮(粕)组成的组中,但并不限定于此。
在本发明的另一实例中,在上述陆地植物中,益母草、三枝九叶草、九节草、夏枯草、白屈菜等为全草植物,主要使用植物的叶和茎,但可使用包括叶和茎、根和花、果实为止的部分。
在本发明的一实例中,上述陆地植物的茎或其皮(粕)选自由铁皮石斛、美花石斛、油菜、爬山虎、甘蔗、桂皮树、黄檗、构树、竹、积雪草及它们的皮(粕)组成的组中,但并不限定于此。
在本发明的另一实例中,积雪草、莓叶委陵菜、大蓟、山莴苣等为地上植物,主要使用茎和叶两者,但可如上所述的仅使用茎或如后所述的仅使用叶。
在本发明的具体实例中,上述陆地植物的全草、根、茎或它们的皮(粕)选自由红参、人参、积雪草及它们的皮(粕)组成的组中,上述组合物可用于皮肤保湿。
如在本发明的实施例中所证明,本发明的红参凝胶、人参凝胶、积雪草凝胶用于增加皮肤表皮内的与保湿相关的因子的表达,因此,可有用地用作用于皮肤保湿的组合物。
在本发明的具体实例中,上述陆地植物的全草、根、茎或它们的皮(粕)选自由人参、红参、积雪草及它们的皮(粕)组成的组中,上述组合物可用于强化皮肤屏障。
如在本发明的实施例中所证明,本发明的红参凝胶、积雪草凝胶用于增加与强化皮肤屏障相关的因子的表达,因此,可有用地用作用于强化皮肤屏障的组合物。
在本发明的具体实例中,上述陆地植物的全草、根、茎或它们的皮(粕)选自由红参、人参、油菜、积雪草、铁皮石斛及它们的皮(粕)组成的组中,上述组合物可用于防止皮肤老化。
如在本发明的实施例中所证明,本发明的红参凝胶、人参凝胶、油菜凝胶、积雪草凝胶、铁皮石斛凝胶用于减少与皮肤皱纹相关的基因的表达量且用于增加与皮肤弹性相关的基因的表达量,因此,可有用地用作用于防止皮肤老化的组合物。
在本发明的具体实例中,上述陆地植物的全草、根、茎或它们的皮(粕)选自由人参、积雪草及它们的皮(粕)组成的组中,上述组合物可用于防紫外线。
如在本发明的实施例中所证明,本发明的人参凝胶、积雪草凝胶具有优秀的紫外线(UVA及UVB)照射后减少与皮肤皱纹相关的基因的表达量、提高细胞功能及细胞再生效果,因此,可有用地用作用于防紫外线的组合物。
在本发明的具体实例中,上述陆地植物的全草、根、茎或它们的皮(粕)为铁皮石斛,上述组合物可用于皮肤美白。
如在本发明的实施例中所证明,本发明的铁皮石斛凝胶用于减少与黑色素生成相关的基因的表达,因此,可有用地用于皮肤美白的组合物。
在本发明的另一实例中,上述陆地植物为陆地植物的叶、果实、种子或它们的皮(粕),在此情况下,以组合物的总重量为基准,上述组合物包含5~30%(w/v)的氧化的微粉状植物粉末。
在上述组合物包含陆地植物的叶、果实、种子或它们的皮(粕)的氧化的微粉状植物粉末的情况下,以组合物的总重量为基准,可包含5~30%(w/v)、5~25%(w/v)、5~20%(w/v)、5~15%(w/v)、5~10%(w/v)、10~30%(w/v)、10~25%(w/v)、10~20%(w/v)、10~15%(w/v)、15~30%(w/v)、15~25%(w/v)、15~20%(w/v)、20~30%(w/v)、25~30%(w/v)的氧化的微粉状植物粉末,但并不限定于此。但是,经确认,在本发明的组合物包含陆地植物的叶、果实、种子或它们的皮(粕)的氧化的微粉状植物粉末的情况下,至少包含5%(w/v)以上的浓度的植物粉末才能很好地形成凝胶。并且,在植物粉末超出30%(w/v)的情况下,由于浓度过高,使用感不佳。
在本发明的一实例中,上述陆地植物的叶选自由山茶叶、绿茶叶、桑树叶及薄荷叶组成的组中,但并不限定于此。
在本发明的一实例中,上述陆地植物的果实、种子或它们的皮(粕)选自由济州绿豆、长湍豆、菜豆、刀豆、扁豆、豌豆、青肉黑豆、黎豆、豇豆、花生、绿豆、嘴豆、红豆等的豆科植物的豆、石榴、五味子、枸杞、山茱萸、软枣猕猴桃、紫葛葡萄、大枣、杏、柑橘、枇杷果、五加皮果、木通、沙梨、木瓜、覆盆子、树莓及它们的皮(粕)组成的组中,但并不限定于此。上述果实不仅包括如上所述的皮,还包括果肉。
在本发明的具体实例中,上述陆地植物的叶、果实、种子或它们的皮(粕)为山茶叶、绿茶叶或它们的组合,上述组合物可用于皮肤保湿。
如在本发明的实施例中所证明,本发明的山茶叶凝胶、绿茶叶凝胶用于增加皮肤表皮内的与保湿相关的因子的表达,因此,可有用地用作用于皮肤保湿的组合物。
在本发明的具体实例中,上述陆地植物的叶、果实、种子或它们的皮(粕)选自由山茶叶、绿茶叶、济州绿豆及它们的皮(粕)组成的组中,上述组合物可用于防止皮肤老化。
如在本发明的实施例中所证明,本发明的山茶叶凝胶、绿茶叶凝胶、济州绿豆凝胶用于减少与皮肤皱纹相关的基因的表达量且用于增加与皮肤弹性相关的基因的表达量,因此,可有用地用作用于防止皮肤老化的组合物。
在本发明的具体实例中,上述陆地植物的叶、果实、种子或它们的皮(粕)为济州绿豆,上述组合物可用于皮肤美白。
如在本发明的实施例中所证明,本发明的济州绿豆凝胶用于减少与黑色素生成相关的基因的表达,因此,可有用地用作用于皮肤美白的组合物。
在本发明的另一实例中,上述微粉状植物粉末为微粉状海洋植物的粉末。
在本发明的一实例中,在上述海洋植物中,以组合物的总重量为基准,植物凝胶化妆品组合物包含1~20%(w/v)的氧化的微粉状植物粉末。在上述组合物包含海洋植物的氧化的微粉状植物粉末的情况下,以组合物的总重量为基准,可包含1~20%(w/v)、1~15%(w/v)、1~10%(w/v)、3~20%(w/v)、3~15%(w/v)、3~10%(w/v)、5~20%(w/v)、5~15%(w/v)、5~10%(w/v)、10~20%(w/v)、10~15%(w/v)、15~20%(w/v)的氧化的微粉状植物粉末,但并不限定于此。但是,经确认,在本发明的组合物包含海洋植物的氧化的微粉状植物粉末的情况下,需至少以1%(w/v)以上的浓度包含植物粉末才能很好地形成凝胶。并且,在植物粉末超出20%(w/v)的情况下,由于浓度过高,使用感不佳。
在本发明的一实例中,上述海洋植物指海洋底栖植物。海洋底栖植物分为海藻类(大型藻类,macroalgae)和海洋被子植物(marine angiosperms)。
在本发明中,上述海藻类(大型藻类,macroalgae)分为绿藻类、褐藻类、红藻类、蓝藻类等。绿藻类有浒苔、礁膜、黄褐盒管藻、刺松藻等,褐藻类有裙带菜、海带、微劳马尾藻、海草、甘苔、鼠尾藻等,红藻类有紫菜、石花菜、海萝藻、新松节藻、小珊瑚藻等,但并不限定于此。
在本发明中,上述海洋被子植物分为海草类(sea grasses)、盐沼植物(saltmarsh plant)及红树属植物(mangroves)。海草类有泰来藻属、大叶藻属及虾海藻属,盐沼植物有染草、橙心草及双子叶灌木,但并不限定于此。
在本发明的具体实例中,上述海洋植物为石花菜,上述组合物可用于皮肤保湿。
如在本发明的实施例中所证明,本发明的石花菜凝胶用于增加皮肤表皮内的与保湿相关的因子的表达,因此,可有用地用作用于皮肤保湿的组合物。
在本发明的具体实例中,上述海洋植物为石花菜,上述组合物可用于防止皮肤老化。
如在本发明的实施例中所证明,本发明的石花菜凝胶用于减少与皮肤皱纹相关的基因的表达量且用于增加与皮肤弹性相关的基因的表达量,因此,可有用地用作用于防止皮肤老化的组合物。
在本发明的具体实例中,上述海洋植物为甘苔,上述组合物可用于皮肤美白。
如在本发明的实施例中所证明,本发明的甘苔凝胶用于减少与黑色素生成相关的基因的表达,因此,可有用地用作用于皮肤美白的组合物。
本发明的植物凝胶,即,组合物通过包括下述步骤的制备方法制备:步骤(a),向被微细粉碎的植物粉末添加至少一种氧化剂来进行反应;步骤(b),提纯植物粉末并在蒸馏水进行稀释;步骤(c),将植物粉末稀释液均质化且进行浓缩或过滤来制备植物凝胶。
在本发明的植物凝胶制备步骤中,上述步骤(a)的被微细粉碎的植物粉末的粒径为1μm至300μm以下。
在本发明的一实例中,上述氧化剂为次卤酸或其金属盐、或者亚卤酸或其金属盐,上述次卤酸或其金属盐以及亚卤酸或其金属盐的“卤素”为氟、氯、溴、碘。
在本发明的另一实例中,上述次卤酸金属盐及亚卤酸金属盐的金属为锂、钾、钠等的碱金属、钙、镁、锶等的碱土金属,更具体地,上述次卤酸盐为次氯酸钠、次氯酸钾、次氯酸钙、次氯酸镁、次氯酸锶、次氯酸铵,但并不限定于此。
在本发明的植物凝胶制备步骤中,上述步骤(a)通过添加硝基自由基化合物作为催化剂来执行。
在本发明的一实例中,上述硝基自由基化合物为(2,2,6,6-四甲基哌啶-1-基)氧基((2,2,6,6-Tetramethylpiperidin-1-yl)oxyl)或其衍生物,具体地,上述硝基自由基化合物的衍生物可以为选自由4-乙酰氨基-2,2,6,6-四甲基哌啶1-氧基(4-Acetamido-2,2,6,6-tetramethylpiperidine 1-oxyl)、4-氨基-2,2,6,6-四甲基哌啶-d
在本发明的植物凝胶制备步骤中,上述步骤(b)的提纯包括向步骤(a)的反应液添加醇来将植物粉末沉淀后过滤所沉淀的植物粉末的步骤。上述醇为C1至C5的低级醇。
在本发明的植物凝胶制备步骤中,上述步骤(b)的提纯包括向步骤(a)的反应液添加蒸馏水并进行膜滤的步骤。
在本发明的植物凝胶制备步骤中,上述步骤(c)的均质化在800bar至1000bar的压力下执行。
并且,在本发明的植物凝胶制备步骤中,上述步骤(c)的浓缩通过在50~65℃的温度下进行减压浓缩来执行。
在本发明的植物凝胶制备步骤中,上述步骤(c)的过滤通过进行膜滤来执行。
在本发明的植物凝胶制备步骤中,在上述步骤(c)中制备的植物凝胶的植物粉末的含量为0.1~30%(w/v)。
以下,详细说明本发明的植物凝胶的制备方法。
步骤(a):微粉状植物粉末的氧化步骤
首先,获取被微细粉碎的植物粉末。可通过购入或通过研磨机粉碎所干燥的植物来获取被微细粉碎的植物的粉末。
在本发明中,上述步骤(a)的被微细粉碎的植物粉末的粒径可制备为1μm至300μm以下。上述被微细粉碎的植物粉末的粒径具有其大小越小,则可在短时间内以高比率进行氧化反应的优点。
在本发明的步骤通过向植物粉末添加至少一种氧化剂来进行氧化反应。上述氧化剂可以为次卤酸或其金属盐、或者亚卤酸或其金属盐。
在本发明的一实例中,上述次卤酸或其金属盐以及亚卤酸或其金属盐中的卤素可以为氯、溴、碘。因此,具体地,可以为次氯酸、次溴酸、次碘酸、亚氯酸、亚溴酸、亚碘酸。
在本发明的另一实例中,上述次卤酸金属盐及亚卤酸金属盐中的金属可以为锂、钾、钠等的碱金属;钙、镁、锶等的碱土金属。因此,作为上述次卤酸盐的具体例,可例举次氯酸钠、次氯酸钾、次氯酸钙、次氯酸镁、次氯酸锶、次氯酸铵等。作为亚卤酸盐的具体例,在亚氯酸的情况下,可例举亚氯酸锂、亚氯酸钾、亚氯酸钠、亚氯酸钙、亚氯酸镁、亚氯酸锶、亚氯酸亚氯酸铵等。并且,还可利用与上述亚氯酸盐相应的亚溴酸盐、亚碘酸盐。
本步骤的氧化反应可通过添加硝基自由基化合物作为催化剂来执行。上述“硝基自由基化合物”可以为硝基自由基化合物或其衍生物。具体地,上述硝基自由基化合物为(2,2,6,6-四甲基哌啶-1-基)氧基,硝基自由基化合物的衍生物可以为选自由4-乙酰氨基-2,2,6,6-四甲基哌啶1-氧基、4-氨基-2,2,6,6-四甲基哌啶-d
本步骤的氧化反应可通过添加卤素和碱金属的盐(碱金属盐)、卤素和碱土金属的盐(碱土金属盐)、铵盐作为辅助催化剂来执行。
作为用于形成上述碱金属盐、碱土金属盐、铵盐的卤素,可例举氯、溴、碘。作为用于形成碱金属盐的碱金属,可例举锂、钾、钠等。作为用于形成碱土金属盐的碱土金属,可例举钙、镁、锶等。
更具体地,可例举溴化锂、溴化钾、溴化钠、碘化锂、碘化钾、碘化钠、氯化锂、氯化钾、氯化钠、溴化钙、溴化镁、溴化锶、碘化钙、碘化镁、碘化锶、氯化钙、氯化镁、氯化锶等,但并不限定于此。并且,作为铵盐,可例举溴化铵、碘化铵、氯化铵。这些辅助催化剂可单独使用或以两种以上的组合使用,这些辅助催化剂形成水合物也可以。
本发明的步骤(a)的氧化反应可在将pH值维持在9~11的同时执行2小时至4小时。
步骤(b):氧化的植物粉末的提纯及稀释步骤
接着,为了从氧化的植物粉末中去除未反应原料和杂质(用于反应的硝基自由基、NaBr、NaClO等的原料及NaCl等的反应加合物),提纯植物粉末,为了追加的微细粒子化(均质化),在蒸馏水进行稀释。
根据本发明的一实例,上述步骤(b)的提纯可通过向步骤(a)的反应液添加醇来沉淀植物粉末后过滤所沉淀的植物粉末的步骤执行。其中,上述醇可使用C1至C5的低级醇,并且,添加醇-沉淀植物粉末-过滤步骤可反复两次以上来执行。
根据本发明的另一实例,上述步骤(b)的提纯可通过向步骤(a)的反应液添加蒸馏水来进行膜滤(超滤)的步骤执行。若使用膜滤方法,则即使不执行上述醇沉淀及蒸馏水稀释步骤,也可通过单一过程去除在植物粉末的氧化步骤中产生的未反应原料和杂质。
步骤(c):植物粉末稀释液的均质化及植物凝胶的制备步骤
最后,通过高压均化机(microfluidizer)使植物粉末稀释液均质化(微细粒子化)并进行浓缩或过滤来制备了本发明的植物凝胶。上述步骤(c)的均质化可在800bar至1000bar的压力下执行。
根据本发明的一实例,上述均质化后的浓缩步骤可在50~65℃的温度下进行减压浓缩或真空浓缩来执行。
根据本发明的另一实例,上述均质化后的过滤步骤还可与步骤(b)相同地进行膜滤来执行。
并且,最终制备的植物凝胶的植物粉末含量可以为0.1~30%(w/v)。根据本发明的一实例,若以具有0.1~30%(w/v)的浓度的方式调节微细粒子化的上述氧化的植物粉末,则载客示出凝胶状的同时示出植物原料自身的功能性。在所制备的上述植物凝胶的植物粉末含量小于0.1%(w/v)的情况下,难以期待根据添加植物粉末的植物原料自身的功效,在所制备的上述植物凝胶的植物粉末含量大于30%(w/v)的情况下,相对于添加量的功效的增大甚微,因此不经济。
根据本发明的另一实施方式,本发明提供0.1~30%(w/v)的氧化的微粉状植物粉末及剩余量的溶剂的植物凝胶。
在本发明的植物凝胶由化妆品组合物制备的情况下,本发明的化妆品组合物能够以选自由溶液、悬浮液、乳浊液、糊剂、化妆水、凝胶、水溶性液体、霜、精华素、含表面活性剂的卸妆产品、油、喷雾、水包油(O/W)型或油包水(W/O)型的基础化妆品剂型;水包油型或油包水型妆前乳、粉底液、遮瑕液、蜜粉、口红、唇彩、眼影、腮红或眉笔类的彩妆品剂型;以及头皮用剂型中的一种剂型制备。并且,本发明的化妆品组合物还可选择性地以气溶胶形态适用于皮肤。
在本发明化妆品组合物的剂型为糊剂、霜或凝胶的情况下,作为载体成分可利用动物油、植物油、蜡、石蜡、淀粉、胺黄树胶、纤维素衍生物、聚乙二醇、硅、膨润土、二氧化硅、滑石粉或氧化锌等。
在本发明的剂型为蜜粉或喷雾的情况下,作为载体成分可利用乳糖、滑石粉、二氧化硅、氢氧化铝、硅酸钙或聚酰胺粉,尤其,在本发明的剂型为喷雾的情况下,还可包含如氯氟烃、丙烷/丁烷或二甲醚的推进剂。
在本发明的剂型为溶液或乳浊液的情况下,作为载体成分利用溶剂、增溶剂或乳化剂,例如,可利用水、乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁基乙二醇油、甘油脂肪酯、聚乙二醇或山梨醇酐脂肪酸酯。
在本发明的剂型为悬浮液的情况下,作为载体成分可利用如水、乙醇或丙二醇的液相稀释剂、如乙氧基化异硬脂醇、聚氧乙烯山梨醇酯及聚氧乙烯山梨糖醇酐酯的悬浮剂、微晶纤维素、甲基氢氧化铝、膨润土、琼脂或胺黄树胶等。
在本发明的剂型为含表面活性剂的卸妆产品的情况下,作为载体成分可利用脂肪醇硫酸盐、脂肪醇醚硫酸盐、磺基琥珀酸单酯、羟乙基磺酸盐、咪唑啉衍生物、甲基牛磺酸盐、肌氨酸盐、脂肪酸酰胺醚硫酸盐、烷基酰胺甜菜碱、脂肪族醇、脂肪酸甘油酯、脂肪酸二乙醇酰胺、植物油、羊毛脂衍生物或乙氧基化甘油脂肪酸酯等。
在包含在本发明的化妆品组合物的成分中,除植物凝胶和载体成分之外,包含通常用于化妆品组合物的成分,例如,可包含如抗氧化剂、稳定化剂、增溶剂、维生素、颜料及香料的常规辅助剂。在本发明的化妆品组合物中,并不特别限定植物凝胶的量,优选地,以能够充分实现植物原料所具有的功效的量包含。
发明的效果
本发明涉及包含植物作为原料的凝胶的用途。在本发明的植物凝胶中,没有如以往的植物提取组合物的根据植物种类的单独提取及分馏工序,也可对多种植物种类同一进行相同的工序来制备将植物粉末用作原料的凝胶状的组合物,因此,具有优秀的有效性,根据各个植物凝胶的原料成分具有皮肤保湿效果、强化皮肤屏障的效果、防止皮肤老化的效果、防紫外线效果及美白效果等多种作为化妆品的有用性,可有用地用作化妆品组合物。
附图说明
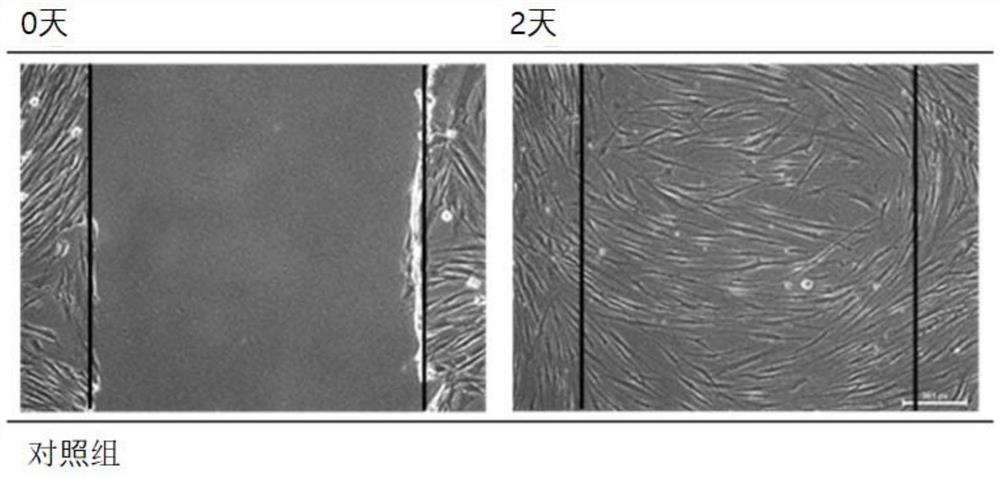
图1a及图1b为为了调查本发明的植物凝胶中的利用积雪草制备的积雪草凝胶的细胞再生功效而以0μg/ml、5μg/ml、10μg/ml、20μg/ml的浓度添加积雪草凝胶来培养人正常成纤维细胞的结果的图。
具体实施方式
以下,通过实施例更详细地说明本发明。这些实施例仅用于更加具体地说明本发明,根据本发明的主旨,本发明的范围并不局限于这些实施例,这对本技术领域的普通技术人员而言是显而易见的。
在本说明书全文中,在未额外提及的情况下,用于示出特定物质的浓度的“%”对于固体/固体为(重量/重量)%、固体/液体为(重量/体积)%以及对于液体/液体为(体积/体积)%。
实验材料
用于本发明的植物凝胶组合物的材料如下。从(株)Sam-do P&F(韩国(Korea))及中药药材市场购买并使用作为本发明的植物原料的红参、人参、油菜、积雪草、山茶叶、绿茶叶、济州绿豆、铁皮石斛、甘苔、石花菜。(2,2,6,6-四甲基哌啶-1-基)氧基(TEMPO)试剂使用Alfa Aesar公司的产品,NaClO使用大井化金(株)的产品,NaBr及NaOH、HCl、乙醇使用DUKSAN药品工业(株)的产品。
实施例1:制备本发明的红参凝胶组合物
利用研磨机粉碎干燥的红参后,通过利用150网格(Mesh)筛选来获取了100μm以下的红参粉末。向15g的粉碎的上述红参粉末添加300mL的蒸馏水并搅拌。之后,添加0.47g的(2,2,6,6-四甲基哌啶-1-基)氧基、3.09g的NaBr来溶解。滴注100mL的NaClO后,利用NaOH将pH值维持在10~11的范围内,在常温条件下氧化15小时。向氧化的上述红参反应液添加HCl来进行中和,使得pH值成为6~7,去除用于上述氧化反应的原料及反应加合物来提纯红参粉末。提纯大致由两种方式进行。
作为第一种方法(乙醇沉淀法),向反应液添加300mL的乙醇来沉淀后,进行过滤来获取了过滤物。向50%的乙醇添加过滤物进行搅拌并清洗后,反复过滤的过程来进行提纯。作为第二种方法(膜滤法),利用膜滤机(FMX-B5,UF的一种,(株)BUKANGTECH),到去除杂质为止,向反应液持续添加蒸馏水并提纯。
向提纯的上述红参粉末添加3L的蒸馏水,利用匀浆机(PRIMIX,ROBOMIXER)在2500RPM的条件下搅拌30分钟来分散。利用高压均化机(M-110Y microfluidizer,Microfluidics Corporation,美国(USA))在800~1000bar的条件下将上述红参粉末分散液通过5次来进行微细化。利用减压浓缩机(R-210set,BUCHI)或膜滤机(FMX-B5,(株)BUKANGTECH)浓缩微细化的上述红参组合物来获取了205g的本发明的红参凝胶。
实施例2:制备人参凝胶
利用研磨机粉碎干燥的人参后,通过利用150网格筛选来获取了100μm以下的人参粉末。通过与实施例1相同的方法制备15g的粉碎的上述人参粉末来获取了210g的本发明的人参凝胶。
实施例3:制备油菜凝胶
利用研磨机粉碎干燥的油菜后,通过利用150网格筛选来获取了100μm以下的油菜粉末。通过与实施例1相同的方法制备15g的粉碎的上述油菜粉末来获取了125g的本发明的油菜凝胶。
实施例4:制备积雪草凝胶
利用研磨机粉碎干燥的积雪草后,通过利用150网格筛选来获取了100μm以下的积雪草粉末。通过与实施例1相同的方法制备15g的粉碎的上述积雪草粉末来获取了160g的本发明的积雪草凝胶。
实施例5:制备山茶叶凝胶
利用研磨机粉碎干燥的山茶叶后,通过利用150网格筛选来获取了100μm以下的山茶叶粉末。通过与实施例1相同的方法制备15g的粉碎的上述山茶叶粉末来获取了108g的本发明的山茶叶凝胶。
实施例6:制备绿茶叶凝胶
利用研磨机粉碎干燥的绿茶叶后,通过利用150网格筛选来获取了100μm以下的绿茶叶粉末。通过与实施例1相同的方法制备15g的粉碎的上述绿茶叶粉末来获取了55g的本发明的绿茶叶凝胶。
实施例7:制备济州绿豆凝胶
利用研磨机粉碎干燥的济州绿豆后,通过利用150网格筛选来获取了100μm以下的济州绿豆粉末。通过与实施例1相同的方法制备15g的粉碎的上述济州绿豆粉末来获取了40g的本发明的济州绿豆凝胶。
实施例8:制备铁皮石斛凝胶
利用研磨机粉碎干燥的铁皮石斛后,通过利用150网格筛选来获取了100μm以下的铁皮石斛粉末。通过与实施例1相同的方法制备15g的粉碎的上述铁皮石斛粉末来获取了285g的本发明的铁皮石斛凝胶。
实施例9:制备甘苔凝胶
利用研磨机粉碎干燥的甘苔后,通过利用150网格筛选来获取了100μm以下的甘苔粉末。通过与实施例1相同的方法制备15g的粉碎的上述甘苔粉末来获取了190g的本发明的甘苔凝胶。
实施例10:制备石花菜凝胶
利用研磨机粉碎干燥的石花菜后,通过与实施例1相同的方法制备15g的粉末来获取了204g的本发明的石花菜凝胶。
实施例11:制备石榴凝胶
利用研磨机粉碎干燥的石榴后,通过与实施例1相同的方法制备15g的粉末来获取了185g的本发明的石榴凝胶。
实施例12:制备红景天凝胶
利用研磨机粉碎干燥的红景天后,通过与实施例1相同的方法制备15g的粉末来获取了110g的本发明的红景天凝胶。
实施例13:本发明的植物粉末的第一提纯方法(乙醇沉淀法)
在(2,2,6,6-四甲基哌啶-1-基)氧基反应后,添加相对于反应液体积相同量的乙醇并搅拌后进行过滤。向过滤的湿饼添加前一工序的相同体积(反应液+乙醇)的50%的乙醇并搅拌来进行过滤。利用蒸馏水稀释过滤的湿饼后,利用高压均化机(Microfluidizer)进行5次均质化。通过对微细粒子化的植物粉末溶液进行减压浓缩来获取了包含3~30%的固体成分的植物凝胶。
实施例14:本发明的植物粉末的第二提纯方法(膜滤法)
在(2,2,6,6-四甲基哌啶-1-基)氧基反应后,使用膜滤机(FMX-B5,(株)BUKANGTECH)去除反应液中的未反应原料及杂质(用于反应的(2,2,6,6-四甲基哌啶-1-基)氧基、NaBr、NaClO等的原料及反应加合物NaCl等),并利用蒸馏水来进行稀释。利用高压均化机对稀释液进行5次均质化(微细化)。再次使用膜滤机(FMX-B5,(株)BUKANGTECH)去除微细粒子化的植物粉末溶液的水,由此获取了包含3~30%的固体成分的植物凝胶。
实验例1:植物凝胶的皮肤保湿功效评价
实验例1-1:对于用于供给皮肤表面水分的水通道(water channel)蛋白3(Aquaporin-3,AQP-3)的基因表达量调查
为了皮肤保湿功效评价,执行了用于确认水通道蛋白-3基因表达的实验。向60mm的培养皿(culture dish(康宁(corning)公司))接种4.5×10
表1
引物(Primers)
表2
水通道蛋白-3信使核糖核酸(AQP-3mRNA)表达量
确认植物凝胶的保湿相关水通道蛋白-3基因表达的结果,在实施例1、实施例5、实施例6、实施例10的情况下,基因表达在多种浓度下增加,由此确认具有皮肤保湿功效。
实验例1-2:作为皮肤保湿因子中的一种的透明质酸机制相关基因表达量调查
1)对于作为透明质酸合成酶的透明质酸合酶-2(Hyaluronic acidsynthase-2,HAS-2)的基因表达量调查
为了皮肤保湿功效评价,执行了用于确认透明质酸合酶-2的基因表达的实验。向60mm的培养皿(康宁(corning)公司)接种4.5×10
表3
透明质酸合酶-2引物(HAS-2Primers)
表4
透明质酸合酶-2信使核糖核酸(HAS-2mRNA)表达量
确认植物凝胶的保湿相关透明质酸合酶-2基因表达的结果,当进行实施例1的处理时,基因表达浓度依赖性地增加,由此确认具有皮肤保湿功效。
2)对于透明质酸受体CD-44的基因表达量调查
执行了用于确认有助于皮肤水合(hydration)作用的保湿因子中的一种的作为透明质酸的受体的CD-44的基因表达的实验。向60mm的培养皿(康宁(corning)公司)接种4.5×10
表5
CD-44引物(CD-44Primers)
表6
CD-44信使核糖核酸(CD-44mRNA)表达量
确认植物凝胶的保湿相关CD-44基因表达的结果,当进行实施例6的处理时,基因表达浓度依赖性地增加,由此确认具有皮肤保湿功效。
实验例1-3:对于皮肤表皮内的天然保湿因子(natural moisturizing factor;NMF)合成的保湿功效评价调查
1)对于皮肤表皮内天然保湿因子转录组丝聚合蛋白原(Pro Filaggrin,Pro FLG)表达的评价
为了皮肤保湿功效评价,执行了用于确认天然保湿因子转录组丝聚合蛋白原的基因表达的实验。向60mm的培养皿(康宁(corning)公司)接种4.5×10
表7
丝聚合蛋白原引物(Pro FLG Primers)
表8
丝聚合蛋白原信使核糖核酸(Pro FLG mRNA)表达量
确认植物凝胶的保湿相关丝聚合蛋白原基因表达的结果,当进行实施例1、实施例5、实施例6、实施例10的处理时,基因表达在多种浓度中增加,由此确认具有皮肤保湿功效。
2)对于皮肤表皮内天然保湿因子转录组丝聚合蛋白(Filaggrin)表达的评价
向100mm的培养皿接种包含人生长因子(human growth factor,gibco公司)的Epilife(gibco公司)培养基和3.5×10
利用刮刀(scrapper)刮掉细胞后,通过离心分离沉淀颗粒(pellet)。之后,添加蛋白质提取溶液(protein extraction solution)并培养后,利用Qubit
利用iBlot Dry Blotting系统进行移植(transfer)后,进行粘连(blocking)。之后,处理一次抗体(丝聚合蛋白、β-肌动蛋白)及二次抗体(GAM-HRP)。在进行抗体处理后使用west save cold ECL溶液进行处理,之后,通过chemi doc LuminoGraphⅡ(ATTO)拍摄带并定量将其数值化的值后在表9示出。
表9
确认植物凝胶的保湿相关丝聚合蛋白的表达的结果,当进行实施例1、实施例2、实施例4的处理时,蛋白质表达在多种浓度中增加,由此确认具有皮肤保湿功效。
3)对于作为参与皮肤表皮内天然保湿因子合成的酶的半胱天冬酶-14(Caspase-14)表达的评价
向100mm的培养皿接种包含人生长因子(gibco公司)的Epilife(gibco公司)培养基和3.5×10
利用刮刀刮掉细胞后,通过离心分离沉淀颗粒。之后,添加蛋白质提取溶液并培养后,利用Qubit
利用iBlot Dry Blotting系统进行移植后,进行粘连。之后,处理一次抗体(半胱天冬酶-14、β-肌动蛋白)及二次抗体(GAM-HRP)。在进行抗体处理后使用west save coldECL溶液进行处理,之后,通过chemi doc LuminoGraphⅡ(ATTO)拍摄带并定量将其数值化的值后在表10示出。
表10
确认植物凝胶的保湿相关半胱天冬酶-14蛋白质表达的结果,当进行实施例2的处理时,蛋白质表达浓度依赖性地增加,由此确认具有皮肤保湿功效。
4)对于作为参与皮肤表皮内天然保湿因子合成的酶的博来霉素水解酶(Bleomycin hydrolase,BLMH)表达的评价
向100mm的培养皿接种包含人生长因子(gibco公司)的Epilife(gibco公司)培养基和3.5×10
利用刮刀刮掉细胞后,通过离心分离沉淀颗粒。之后,添加蛋白质提取溶液并培养后,利用Qubit
利用iBlot Dry Blotting系统进行移植后,进行粘连。之后,处理一次抗体(博来霉素水解酶、β-肌动蛋白)及二次抗体(GAM-HRP)。在进行抗体处理后使用west save coldECL溶液进行处理,之后,通过chemi doc LuminoGraphⅡ(ATTO)拍摄带并定量将其数值化的值后在表11示出。
表11
确认植物凝胶的保湿相关博来霉素水解酶蛋白质表达的结果,当进行实施例2、实施例4的处理时,蛋白质表达在多种浓度中增加,由此确认具有皮肤保湿功效。
实验例2:植物凝胶的皮肤屏障强化功效评价
实验例2-1:对于参与植物凝胶的皮肤屏障强化的紧密连接蛋白(Tight junctionprotein)的表达量调查
1)对于紧密连接蛋白中的一种的闭合蛋白(Occludin,OCDN)表达的评价
在本实施例中,为了测定植物凝胶的皮肤屏障强化效果,执行了对屏障功能起到决定作用的紧密连接(TJ)蛋白相关基因闭合蛋白表达实验。向60mm的培养皿(康宁公司)接种4.5×10
表12
闭合蛋白引物(OCDN Primers)
表13
确认植物凝胶的皮肤屏障相关闭合蛋白基因表达的结果,当进行实施例2的处理时,基因表达在多种浓度中增加,由此确认具有皮肤屏障强化功效。
实验例2-2:参与植物凝胶的皮肤保湿屏障强化的神经酰胺合成相关基因表达量调查
1)对于作为参与神经酰胺合成的酶的丝氨酸棕榈酰转移酶(Serine PalmitoylTransferase,SPT)的表达的评价
在本实施例中,为了测量植物凝胶的皮肤屏障强化效果,确认了对于防止皮肤内水分流失的神经酰胺合成路径相关基因的表达。其中,确认作为对于神经酰胺合成起到决定性作用的酶的丝氨酸棕榈酰转移酶的表达。向60mm的培养皿(康宁公司)接种4.5×10
表14
引物
表15
确认植物凝胶的皮肤屏障相关丝氨酸棕榈酰转移酶基因表达的结果,当进行实施例1的处理时,基因表达浓度依赖性地增加,由此确认具有皮肤屏障强化功效。
2)对于作为参与神经酰胺合成的酶的神经酰胺合酶-3(Ceramide synthase-3,CERS3)的表达的评价
向100mm的培养皿接种包含人生长因子(gibco公司)的Epilife(gibco公司)培养基和3.5×10
利用刮刀刮掉细胞后,通过离心分离沉淀颗粒。之后,添加蛋白质提取溶液并培养后,利用Qubit
利用iBlot Dry Blotting系统进行移植后,进行粘连。之后,分别处理一次抗体(神经酰胺合酶-3、β-肌动蛋白)及二次抗体(GAR-HRP,GAM-HRP)。在进行抗体处理后使用west save cold ECL溶液进行处理,之后,通过chemi doc LuminoGraphⅡ(ATTO)拍摄带并定量将其数值化的值后在表16示出。
表16
确认植物凝胶的皮肤屏障相关神经酰胺合酶-3蛋白质表达的结果,当进行实施例1、实施例4的处理时,蛋白质表达在多种浓度中增加,由此确认具有皮肤屏障强化功效。
实验例2-3:对于参与植物凝胶的皮肤屏障强化的紧密连接蛋白的表达量调查
1)对于参与皮肤屏障形成的酶转谷氨酰胺酶-1
(Transglutaminase-1,TGase-1)的基因表达的评价
为了测定植物凝胶的皮肤屏障强化效果,为了确认作为参与皮肤屏障形成的酶中的一种的转谷氨酰胺酶-1的表达,执行本实验。向60mm的培养皿(康宁公司)接种4.5×10
表17
酶转谷氨酰胺酶-1引物
表18
确认植物凝胶的皮肤屏障相关酶转谷氨酰胺酶-1基因表达的结果,当进行实施例2的处理时,基因表达在多种浓度中增加,由此确认具有皮肤屏障强化功效。
2)对于作为参与皮肤屏障形成的酶的转谷氨酰胺酶-1的蛋白质表达的评价
向100mm的培养皿接种包含人生长因子的Epilife(gibco公司)培养基和3.5×10
利用刮刀刮掉细胞后,通过离心分离沉淀颗粒。之后,添加蛋白质提取溶液并培养后,利用Qubit
利用iBlot Dry Blotting系统进行移植后,进行粘连。之后,处理一次抗体(转谷氨酰胺酶-1、β-肌动蛋白)及二次抗体(GAM-HRP)。在进行抗体处理后使用west save coldECL溶液进行处理,之后,通过chemi doc LuminoGraphⅡ(ATTO)拍摄带并定量将其数值化的值后在表21示出。
表19
确认植物凝胶的皮肤屏障相关转谷氨酰胺酶-1蛋白质表达的结果,当进行实施例4的处理时,蛋白质表达在多种浓度中增加,由此确认具有皮肤屏障强化功效。
3)对于构成皮肤屏障的蛋白质中的一种的外皮蛋白(Involucrin,INV)的表达的评价
向100mm的培养皿接种包含人生长因子的Epilife(gibco公司)培养基和3.5×10
利用刮刀刮掉细胞后,通过离心分离沉淀颗粒。之后,添加蛋白质提取溶液并培养后,利用Qubit
利用iBlot Dry Blotting系统进行移植后,进行粘连。之后,处理一次抗体(外皮蛋白、β-肌动蛋白)及二次抗体(GAM-HRP)。在进行抗体处理后使用west save cold ECL溶液进行处理,之后,通过chemi doc LuminoGraphⅡ(ATTO)拍摄带并定量将其数值化的值后在表20示出。
表20
确认植物凝胶的皮肤屏障相关外皮蛋白的蛋白质表达的结果,当进行实施例4的处理时,蛋白质表达在多种浓度中增加,由此确认具有皮肤屏障强化功效。
实验例3:植物凝胶的抗皮肤老化功效评价
实验例3-1:对于植物凝胶的皮肤皱纹相关基因的表达量调查
1)金属蛋白酶-1(MMP-1)、金属蛋白酶-2(MMP-2)、金属蛋白酶-9(MMP-9)表达减少效果
向培养皿接种人正常成纤维细胞,利用包含10%的牛血清的IMD M培养基,在37℃且5%的CO
表21
引物
表22
金属蛋白酶1信使核糖核酸表达量
确认植物凝胶的皮肤老化相关金属蛋白酶-1基因表达的结果,当进行实施例1、实施例2、实施例3、实施例4、实施例5、实施例6、实施例7、实施例8、实施例10的处理时,基因表达在多种浓度中减少,由此确认具有皮肤老化功效。
表23
金属蛋白酶-2信使核糖核酸表达量
表24
金属蛋白酶-9信使核糖核酸表达量
确认植物凝胶的皮肤老化相关金属蛋白酶-9基因表达的结果,当进行实施例1、实施例2的处理时,基因表达在多种浓度中减少,由此确认具有皮肤老化功效。
表25
胶原I型信使核糖核酸表达量
确认植物凝胶的皮肤老化相关胶原I型基因表达的结果,当进行实施例5、实施例10的处理时,基因表达在多种浓度中增加,由此确认具有皮肤老化功效。
2)金属蛋白酶-2、金属蛋白酶9的酶活性抑制效果
向培养皿接种人正常成纤维细胞,利用包含10%的牛血清的IMDM培养基,在37℃且5%的CO
表26
金属蛋白酶-2酶活性测定
确认植物凝胶的皮肤老化相关金属蛋白酶-2蛋白质表达的结果,当进行实施例1的处理时,蛋白质表达在多种浓度中减少,由此确认具有皮肤老化功效。
表27
金属蛋白酶-9酶活性测定
确认植物凝胶的皮肤老化相关金属蛋白酶-9蛋白质表达的结果,当进行实施例1、实施例2的处理时,蛋白质表达在多种浓度中减少,由此确认具有皮肤老化功效。
实验例3-2:对于植物凝胶的皮肤弹性相关基因的表达量调查
1)胶原I型、弹性蛋白(Elastin)表达增加效果
为了测定胶原I型和弹性蛋白基因的表达程度,实施Applied Biosystems7500FAST Real-Time PCR System(Applied Biosystems,加利福尼亚州(CA),美国)。在60mm的培养皿以1×10
表28
引物
互补脱氧核糖核酸合成反应条件如下,即,胶原I型、弹性蛋白及β-肌动蛋白均在95℃的温度下反应5秒钟、在60℃的温度下反应25秒钟,并进行40个循环。用作对照组的维生素C(Vitamin C)用作增加胶原I型、弹性蛋白的表达的物质。在表29、表30示出表达量的结果。
表29
胶原I型信使核糖核酸表达量
确认植物凝胶的皮肤弹性相关胶原I型基因表达的结果,当进行实施例1、实施例4的处理时,胶原I型合成在多种浓度中增加,由此确认具有皮肤弹性功效。
表30
弹性蛋白信使核糖核酸表达量
确认植物凝胶的皮肤弹性相关弹性蛋白基因表达的结果,当进行实施例3、实施例7、实施例8的处理时,弹性蛋白合成在多种浓度中增加,由此确认具有皮肤弹性功效。
实验例3-3:皮肤光保护(Skin photo-protection)评价
向培养皿接种人正常成纤维细胞后,在37℃且5%的CO
在表31示出测定结果。
表31
实验结果,如表31所示,当进行实施例2的处理时,使得UVB照射导致的减少的细胞功能大大增加,从而恢复。
实验例3-4:细胞再生功效调查
向培养皿接种人正常成纤维细胞后,在37℃且5%的CO
实验例3-5:细胞功能活性化测定
向培养皿接种人正常成纤维细胞后,在37℃且5%的CO
表32
实验结果,如表32所示,当进行实施例4的处理时,使得UVB照射导致的减少的细胞功能最大增加11.4%,从而恢复。
实验例4:植物凝胶的皮肤美白功效评价
实验例4-1:黑色素生物合成抑制此熬过测定
为了测定植物凝胶的美白功效,在小鼠的黑素瘤(B16-F1)细胞处理试样来实施实验。向6孔板(well plate),以1×10
表33
黑色素生成量测定
确认植物凝胶的黑色素生成率的结果,当进行实施例7、实施例8、实施例9的处理时,减少通过α-黑素细胞刺激激素增加的黑色素生成率,由此确认具有黑色素生成抑制功效。
实验例4-2:作为生成黑色素的路径的黑素原生成(melanogenesis)相关酪氨酸酶(Tyrosinase)、酷氨酸酶相关蛋白1(TRP-1)、酷氨酸酶相关蛋白2(TRP-2)信使核糖核酸表达量调查
为了测定植物凝胶的黑素原生成相关美白效果,在小鼠的黑素瘤细胞处理试样来实施实验。向6孔板,以3×10
表34
引物
互补脱氧核糖核酸合成反应条件如下,即,酪氨酸酶、酷氨酸酶相关蛋白1及酷氨酸酶相关蛋白2和磷酸甘油醛脱氢酶均在95℃温度下反应5秒钟、60℃的温度下反应25秒钟,并进行40个循环。将处理用作溶解溶剂的1,2-己二醇的用作对照组,将一同处理α-黑素细胞刺激激素和用作溶解溶剂的1,2-己二醇的用作α-黑素细胞刺激激素处理组。将用作阳性对照组的熊果苷用作抑制黑素原生成相关基因表达的物质。在表35、表36、表37示出表达量的结果。
表35
酪氨酸酶信使核糖核酸表达量
表36
酷氨酸酶相关蛋白1信使核糖核酸表达量
确认植物凝胶的黑素原生成相关基因表达的结果,当进行实施例8、实施例9的处理时,由于α-黑素细胞刺激激素增加的酪氨酸酶及酷氨酸酶相关蛋白1基因表达量减少,由此确认,具有通过抑制作为生成黑色素的路径的黑素原生成的美白功效。
实验例4-3:作为传递黑色素小体的路径的黑素传递(melanosome transfer)相关蛋白酶激活受体-2(PAR-2)信使核糖核酸表达量调查为了测定植物凝胶的黑素传递相关美白效果,向60mm的培养皿(康宁公司)以2×10
表37
引物
互补脱氧核糖核酸合成反应条件如下,即,蛋白酶激活受体-2和β-肌动蛋白均在95℃的温度下反应5秒钟、在60℃的温度下反应25秒钟,并进行40个循环。将处理用作溶解溶剂的1,2-己二醇的用作对照组,将一同处理α-黑素细胞刺激激素和用作溶解溶剂的1,2-己二醇的用作α-黑素细胞刺激激素处理组。将用作阳性对照组的表没食子儿茶素没食子酸酯用作抑制蛋白酶激活受体-2基因表达的物质。在表38示出表达量的结果。
表38
蛋白酶激活受体-2信使核糖核酸表达量
确认植物凝胶的黑素传递相关基因表达的结果,当进行实施例7的处理时,由于UVB照射而增加的蛋白酶激活受体-2基因表达量减少,由此可确认,具有通过抑制作为传递黑色素小体的路径的黑素传递的美白功效。
制备例
另一方面,以下记述包含本发明的植物凝胶的化妆品组合物的制备例。但是,下述制备例仅具体说明本发明的使用例,病毒将本发明的发明要求保护范围限定于下述制备例,这对普通技术人员而言是显而易见的。
制备例1:制备营养化妆水(乳液)
如下述表39所记载,通过常规方法制备了包含在实施例1至实施例12中获取的植物凝胶的营养化妆水(乳)。
表39
制备例2:制备柔软化妆水(水)
如下述表40所记载,通过常规方法制备包含在实施例1至实施例12中获取的植物凝胶的柔软化妆水(水)。
表40
制备例3:制备营养霜
如下述表41所记载,通过常规方法制备包含实施例1至实施例12中获取的植物凝胶的营养霜。
表41
制备例4:制备精华素
如下述表42所记载,通过常规方法制备包含实施例1至实施例12中获取的植物凝胶的精华素。
表42
制备例5:制备粉底液
如下述表43所记载,通过常规方法制备包含实施例1至实施例12中获取的植物凝胶的粉底液。
表43
制备例6:制备护发素
如下述表44所记载,通过常规方法制备包含实施例1至实施例12中获取的植物凝胶的护发素。
表44
序列表
<110> 株式会社现代百朗德
<120> 包含植物作为原料的凝胶的用途
<130> 1017-049.20P8
<160> 36
<170> KoPatentIn 3.0
<210> 1
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 正向β-肌动蛋白引物
<400> 1
ggcacccagc acaatgaag 19
<210> 2
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 反向β-肌动蛋白引物
<400> 2
ccgatccaca cggagtactt g 21
<210> 3
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 正向水通道蛋白-3引物
<400> 3
gggaccagtc ggaagggat 19
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 反向水通道蛋白-3引物
<400> 4
cacagatgga caggctgcct 20
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 正向透明质酸合酶-2引物
<400> 5
acaacacctt agttcctcta 20
<210> 6
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> 反向透明质酸合酶-2引物
<400> 6
agcagtgata tgtctcct 18
<210> 7
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 正向CD-44引物
<400> 7
gctattgaaa gccttgcaga g 21
<210> 8
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 反向CD-44引物
<400> 8
cgcagatcga tttgaatata acc 23
<210> 9
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 正向丝聚合蛋白原引物
<400> 9
ctgatggtat tcaagttggc t 21
<210> 10
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 反向丝聚合蛋白原引物
<400> 10
actgtgcttt ctgtgcttgt 20
<210> 11
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 正向闭合蛋白引物
<400> 11
ccacctatca cttcagatca acaaa 25
<210> 12
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 反向闭合蛋白引物
<400> 12
ttcctgtagg ccagtgtcaa aat 23
<210> 13
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 正向丝氨酸棕榈酰转移酶引物
<400> 13
tggtcatttg gcccaggtc 19
<210> 14
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 反向丝氨酸棕榈酰转移酶引物
<400> 14
tcccaaccat tggcttcaca tc 22
<210> 15
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 正向酶转谷氨酰胺酶-1引物
<400> 15
tgaatagtga caaggtgtac tggca 25
<210> 16
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 反向酶转谷氨酰胺酶-1引物
<400> 16
ttgtgacaat gagtgtgccg at 22
<210> 17
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 正向金属蛋白酶1引物
<400> 17
ccacctatca cttcagatca acaaa 25
<210> 18
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 反向金属蛋白酶1引物
<400> 18
ttcctgtagg ccagtgtcaa aat 23
<210> 19
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 正向金属蛋白酶2引物
<400> 19
gatgcggtat acgaggccc 19
<210> 20
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 反向金属蛋白酶2引物
<400> 20
gatccagtat tcattccctg caa 23
<210> 21
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 正向金属蛋白酶9引物
<400> 21
aacatcttcg acgccatcg 19
<210> 22
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 反向金属蛋白酶9引物
<400> 22
aatcgccagt acttcccatc c 21
<210> 23
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 正向胶原I型引物
<400> 23
agcaagaacc ccaaggacaa 20
<210> 24
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 反向胶原I型引物
<400> 24
cgaactggaa tccatcggtc 20
<210> 25
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 正向弹性蛋白引物
<400> 25
ggccattcct ggtggagttc c 21
<210> 26
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 反向弹性蛋白引物
<400> 26
aactggctta agaggtttgc ctcca 25
<210> 27
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> 正向酪氨酸酶引物
<400> 27
tataaactca gtgtttccct ttatcacaa 29
<210> 28
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 反向酪氨酸酶引物
<400> 28
tctatgatga catgaagtgg caaa 24
<210> 29
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 正向酷氨酸酶相关蛋白1引物
<400> 29
gttcaatggc caggtcagga 20
<210> 30
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 反向酷氨酸酶相关蛋白1引物
<400> 30
caacgcagcc actacagca 19
<210> 31
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 正向酷氨酸酶相关蛋白2引物
<400> 31
tggctcactc cttcctgaat g 21
<210> 32
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 反向酷氨酸酶相关蛋白2引物
<400> 32
caaacacagg gtcgttggct 20
<210> 33
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 正向磷酸甘油醛脱氢酶引物
<400> 33
ggcatcttgg gctacactga g 21
<210> 34
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 反向磷酸甘油醛脱氢酶引物
<400> 34
ggaagagtgg gagttgctgt tg 22
<210> 35
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 正向蛋白酶激活受体-2引物
<400> 35
tgctagcagc ctctctctcc 20
<210> 36
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 反向蛋白酶激活受体-2引物
<400> 36
ccagtgagga cagatgcaga 20
- 包含植物作为原料的凝胶的用途
- 有机聚硅氧烷及其作为表面活性剂、粉末处理剂、油基原料的增稠剂或胶凝剂的用途,包含所述有机聚硅氧烷的凝胶组合物和乳液组合物以及外用配制品和化妆品
