一种乳酸肠球菌、预防或治疗肿瘤的药物及应用
文献发布时间:2023-06-19 10:35:20
技术领域
本发明涉及医药生物技术领域,具体而言,涉及一种乳酸肠球菌、预防或治疗肿瘤的药物及应用。
背景技术
在肿瘤治疗领域,肿瘤逃逸是目前肿瘤免疫治疗公认的障碍,患者肿瘤细胞自身的缺陷和免疫系统的功能障碍一起作用促进了肿瘤的疯狂生长。PD-1/PD-L1免疫疗法(immunotherapy)是当前全世界备受瞩目、广为研究的新一类抗癌免疫疗法,旨在充分利用人体自身的免疫系统抵御、抗击癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,实质性改善患者总生存期。
目前,上述的免疫治疗存在一定的副作用及治疗失败等问题,而引入微生物进行辅助传统免疫疗法进行治疗,不失为一种全新的治疗干预手段。
鉴于此,特提出本发明。
发明内容
本发明的目的在于提供一种乳酸肠球菌、预防或治疗肿瘤的药物及应用以解决上述技术问题。
基于现有的技术问题,本发明分离筛选出一株乳酸肠球菌,该乳酸肠球菌可以抑制肿瘤的生长速度,可以用于肿瘤的预防和治疗。此外,该乳酸肠球菌还可以与其他的肿瘤抑制剂联合使用。
本发明是这样实现的:
本发明提供了一种乳酸肠球菌在制备肿瘤抑制剂中的应用;所述肿瘤包括如下实体肿瘤中的至少一种:结肠癌、直肠癌、结肠直肠癌、肝癌、胰腺癌、乳腺癌、肾癌、纤维肉瘤、肺癌和胆管癌。
优选地,乳酸肠球菌在制备结肠直肠癌抑制剂中的应用。
上述的乳酸肠球菌,保藏于广东省微生物菌种保藏中心,保藏名称为乳酸肠球菌(Enterococcus faecium)MNC-168,保藏编号为GDMCC NO:61121。保藏时间为2020年8月5月,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所,分类名称为Enterococcus faecium。
在本发明应用较佳的实施方式中,上述乳酸肠球菌的菌落培养特征为:在细菌培养基上,培养24h后菌落呈白色,圆形,表面湿润,不透明,边缘整齐;在显微镜下,菌体呈椭球状,0.7-1.0μm×0.8-1.3μm,单个或成对排列,革兰氏阳性;
优选地,细菌培养基为MRS培养基。
本发明还提供了一种预防或治疗肿瘤的药物,其包括乳酸肠球菌。
在本发明应用较佳的实施方式中,上述预防或治疗肿瘤的药物还包括药学上可接受的添加剂或辅料,优选地,药物组合物剂型选自片剂、丸剂、粉剂、混悬剂、凝胶、乳液、乳膏、颗粒剂、纳米颗粒、胶囊、栓剂、注射剂、喷雾和针剂。
在其他实施方式中,上述预防或治疗肿瘤的药物的有效成分包括并不限于乳酸肠球菌,还可以包括其他的预防或治疗肿瘤的药物或抗体。
乳酸肠球菌保藏于广东省微生物菌种保藏中心,保藏名称为乳酸肠球菌(Enterococcus faecium)MNC-168,保藏编号为GDMCC NO:61121。
本发明还提供了一种药物组合物,其包括上述的预防或治疗肿瘤的药物。
可选的,上述药物组合物还包括联用药物,联用药物为如下药物中的至少一种:
化疗药物,光敏剂,光热剂,抑制性第二信号分子的抗体、抑制性第二信号分子的抑制剂、PD-L1抑制剂、PD-1/PD-L1单抗药物。
在本发明应用较佳的实施方式中,上述抑制性第二信号分子包括如下信号分子中的至少一种:PD-1和CTLA-4。在其他实施方式中,上述抑制性第二信号分子可以是PD-1;CTLA-4;PD-1和CTLA-4。
上述抑制性第二信号分子是指抑制免疫反应的信号分子。
在本发明应用较佳的实施方式中,上述抑制性第二信号分子的抗体或抑制性第二信号分子的抑制剂包括如下抗体中的至少一种:尼伏单抗(nivolumab)、潘利珠单抗(pembrolizumab)、替雷利珠单抗(Tislelizumab)、纳武利尤单抗注射液(Opdivo)、帕博利珠单抗注射液(Keytruda)、特瑞普利单抗注射液(拓益JS001)和信迪利单抗注射液(达伯舒IBI308)。
在本发明应用较佳的实施方式中,上述PD-L1抑制剂选自度伐单抗(durvalumab)、阿替珠单抗(atezolizumab)或阿维单抗(avelumab)。
在本发明应用较佳的实施方式中,上述PD-1/PD-L1单抗药物选自帕博利珠单抗或纳武利尤单抗。
在其他实施方式中,只要能抑制免疫反应的发生均可以与本发明提供的乳酸肠球菌配合进行联合肿瘤治疗。
本发明具有以下有益效果:
本发明分离筛选出一种新的乳酸肠球菌,该乳酸肠球菌对癌症病人肿瘤免疫治疗的效果具有重要的影响。肠道微生物与免疫细胞之间能相互作用,共同调控人的免疫系统。研究表明,本发明提供的乳酸肠球菌可以诱导iDC(immature DC)细胞分化成熟,成熟DC能有效激活T细胞,从而杀伤肿瘤细胞;此外,本发明提供的乳酸肠球菌可以诱导M0型巨噬细胞向M1或M2型细胞的分化,具体地,使得IL-1β,IL-23,TNFα的分泌量显著的增加。本发明提供的乳酸肠球菌可以用于制备肿瘤抑制剂及相应的药物,从而实现肿瘤预防或治疗。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为MNC-168在平板上的生长状况图;
图2A为巨噬细胞和MNC-168在MOI(细菌:细胞)为10共培养后产生细胞因子IL-1β的变化;
图2B为巨噬细胞和MNC-168在MOI(细菌:细胞)为10共培养后产生细胞因子IL-23的变化;
图2C为巨噬细胞和MNC-168在MOI(细菌:细胞)为10共培养后产生细胞因子TNFα的变化;
图3A为Primary PBMC和MNC-168在MOI(细菌:细胞)为1共培养后产生细胞因子IL-1β的变化;
图3B为Primary PBMC和MNC-168在MOI(细菌:细胞)为1共培养后产生细胞因子CXCL9的变化;
图4A为iDC细胞和MNC-168在MOI(细菌:细胞)为10共培养后产生细胞因子CXCL9的变化;
图4B为iDC细胞和MNC-168在MOI(细菌:细胞)为10共培养后产生细胞因子IL-1β的变化;
图5为MNC-168在模拟胃液中的存活曲线;
图6为MNC-168在模拟肠液中的存活曲线;
图7为MNC-168和PD-1抗体联用对结直肠癌(CT26)的抑制作用结果图;
图8为MNC-168和PD-1抗体联用对结直肠癌(MC38)的预防和治疗作用结果图;
图9为MNC-168逆转PD-1抗体未响应率;
图10为MNC-168增加肿瘤內淋巴細胞浸润;
图11为MNC-168在MRS培养基上划线培养24h后的图片;
图12为MNC-168经过染色后在光学显微镜下的形态图;
图13为MNC-168的电镜图;
图14为MNC-168与相关种的16S rDNA序列系统发育树;
图15为PMA诱导THP1细胞为M0型巨噬细胞流式检测CD14表达图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供了一种乳酸肠球菌,其分离、纯化,菌落鉴定如下所示。
菌株MNC-168的分离、纯化。
(1)在生物安全柜中分装生理盐水于无菌的10ml离心管中;提前24h将厌氧血平板和无菌生理盐水转移入厌氧工作台(H35 Hypoxystation,Whitley)中,并将5~7颗无菌的玻璃珠倒入已经凝固的厌氧血平板中备用。厌氧血平板购自江门凯林贸易有限公司,Bio-Caring。
(2)慕恩(广州)生物科技有限公司某员工(供体号403051)与公司签订粪便收集的知情同意书后,取其鲜粪便样本1g于厌氧操作台中使用漩涡振荡器震荡1min,混匀,吸取1mL样本到9mL生理盐水中,混匀为10
(3)吸取100μL步骤(2)中的10
(4)观察分离到的菌株生长状况,并用灭菌牙签挑取单菌落进行平板划线纯化、培养,对纯菌株进行16S rRNA基因分析,初步确定其分类地位。
分离到的菌株命名为MNC-168,其16s RNA序列见SEQ ID NO.1所示。
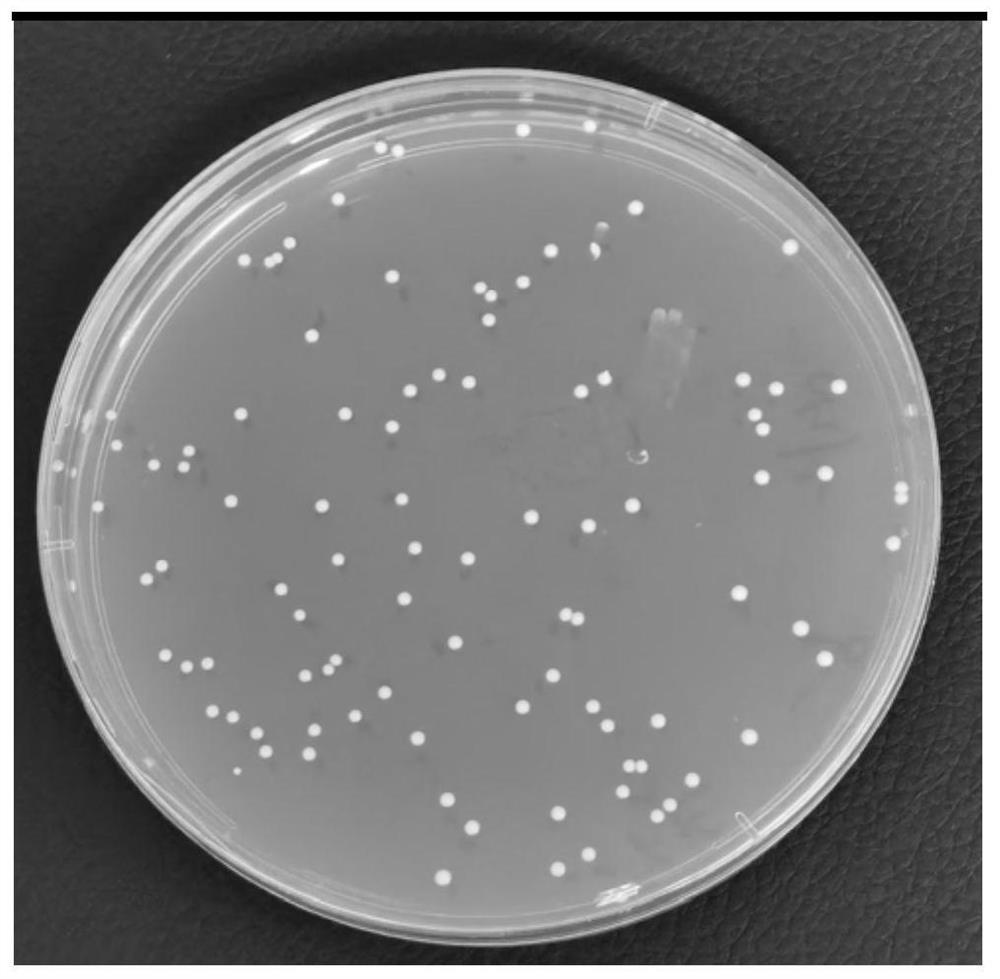
分离到的菌株在MRS培养基上划线培养后的平板图参照图11所示,图11为MNC-168在MRS培养基上以36℃,培养24h后的图片。菌落呈白色,圆形,表面湿润,不透明,边缘整齐。
MNC-168菌株在平板上的生长状况参照图1所示。
MNC-168经过染色后在光学显微镜下的形态参照图12所示,显微镜下,在MRS培养基中36℃培养24h后,菌体呈椭球状,0.7-1.0μm×0.8-1.6μm,单个或成对排列,为革兰氏阳性菌。
MNC-168在电镜下的形态参照图13所示,由图13可知,分离得到的MNC-168呈椭球形,大小为0.7-1.0μm×0.8-1.6μm,单个或成对排列。
MNC-168的生理生化特征参照表1所示,本实施例中采用API 20Strep生化鉴定试剂条进行微生物的生理生化鉴定。
表1 MNC-168的生理生化特征。
符号说明:“+”,阳性;“-”,阴性。
MNC-168的抗生素敏感性测试结果参照表2所示,由表2可知,MNC-168对红霉素和利福平具有一定的耐药性。
表2 MNC-168的抗生素敏感性测试表。
图14为MNC-168与相关种的16S rDNA序列系统发育树,采用MEGA5.0软件,邻位连接法显示“MNC-168RCB”与相关种的16S rDNA序列系统发育树,进行1000次的相似度重复计算,图中发育树节点只显示Bootstrap值大于50%数值,上标的“T”表示模式菌株。
实施例2
本实施例对实施例1分离获得的MNC-168原始菌株进行基因组的制备、测序,组装和分析。
MNC-168原始菌株的基因组通过超声波法进行序列片段化,片段化长度范围~350bp,然后利用标准DNA建库试剂盒(NEB
基因组原始测序数据使用fastp(版本:0.20.0)进行数据过滤,过滤参数:“-q 15-l 50”。过滤后的原始数据使用SPAdes(版本:v3.13.1)进行基因组组装,组装参数“—isolate--cov-cutoff 10”。基因组组装得到基因总长度2.84Mbp,N50长度为79.90kbp,GC含量为38.17%。基因组相似度最高的模式菌株为:Enterococcus lactis(乳酸肠球菌),其中平均核苷酸相似度(ANI)为98.36%,基因覆盖度为86.98%,因此,可以认定为Enterococcus lactis同种的菌株。
基因组基因使用原核分析软件基因组注释流程prokka(版本:1.14.5)进行基因组基因预测分析,参数“—gcode 11--evalue 1e-09--coverage 80”。总共预测得到2769条CDS序列,其中平均CDS序列长度为873bp。
基因组中潜在的抗生素耐药基因使用RGI流程分析(版本:4.2.2),其中抗生素耐药基因数据库为CARD(版本:3.0.0,https://card.mcmaster.ca/analyze/rgi)。详细对比信息参照表3所示。
表3耐药基因信息列表。
对基因组中潜在的毒力因子及相关基因的分析采用的是NCBI blastp(版本为:2.9.0)比对毒力因子数据库VFDB(virulence factor database,http://www.mgc.ac.cn/cgi-bin/VFs/v5/main.cgi,更新日期为2019年9月13日)。详细比对结果见表4。
表4 MNH-5168潜在毒性基因列表。
实验例1
本实验例研究实施例1分离获得的MNC-168对巨噬细胞的影响。
近年来的研究表明,癌症病人肠道微生物对肿瘤免疫治疗的效果有重要的影响,而调节和利用肠道微生物也称为肿瘤免疫治疗的关键组成部分。已经证明:肠道微生物和免疫细胞之间存在直接相互作用的多种机制,而肠道淋巴组织中的树突状细胞和巨噬细胞是免疫调节微生物的关键靶细胞,特别是在小肠中,由于肠道表面积大,黏液层薄而弥散,使得微生物可以与免疫细胞紧密接触。微生物菌群中的不同的特异菌株能够抑制或激活整个身体的免疫反应。
巨噬细胞是天然免疫系统中髓样细胞的异质性群体,参与多种生理和病理过程。在机体发生炎症或发生感染时,血液单核细胞聚集到组织中,分化成巨噬细胞。巨噬细胞具有很高的可塑性,其主要具有两种的极化状态,经典活化的1型(M1)和替代活化的2型(M2)。Mantovani等人将这两种巨噬细胞表型定义为功能状态连续性的极端。M1巨噬细胞是可以产生促炎细胞因子的巨噬细胞,被称为经典型巨噬细胞,常发生在损伤及感染之后。在体外巨噬细胞的经典激活常通过细菌细胞壁(例如LPS)和TNFα或IFNγ。M1巨噬细胞的特征在于分泌促炎因子例TNFα,IL-1β,IL-6和IL-12,IL-8,在炎症早期发挥重要的作用。M2巨噬细胞极化可由不同刺激引起,主要是IL-4和/或IL-13等。被IL-4和IL-13活化的巨噬细胞分泌抗炎细胞因子,如IL-10、CCL18和CCL22,发挥抑制炎症反应及组织修复的作用。
M1巨噬细胞对病原体和肿瘤细胞都具有细胞毒性。它们的抗瘤活性与它们分泌的活性硝基、活性氧和促炎细胞因子的能力有关。M2巨噬细胞通过分泌许多生长因子例如EGF,TGF-β或VEGF等促进肿瘤细胞生长及存活。故通过检测不同菌株诱导巨噬细胞相关促炎因子及抑炎因子表达的检测可以作为判断该菌株是否具有可能的抗肿瘤特征的一个判断指标。
由于巨噬细胞分离过程比较麻烦,常用phorbol 12-myristate 13-acetate(佛波醇12-十四酸酯13-乙酸酯,PMA,Sigma,P8139)诱导THP-1(THP-1是人白血病单核细胞系,由于其与PBMC来源的单核细胞具有相似的反应,故被广泛用于研究单核细胞或单核来源的巨噬细胞免疫反应能力的模型)单核细胞系分化而成的M0巨噬细胞作为研究巨噬细胞功能的体外细胞模型。该巨噬细胞模型,具有以下优点:易于获取,分化及极化,且其经诱导分化的M1及M2巨噬细胞与极化的原始巨噬细胞具有相同的表达类型。
在培养过夜的人单核细胞白血病细胞THP-1(武汉普诺赛生命科技有限公司)中加入PMA至终浓度为5ng/ml,37℃,5%CO
(1)细胞是否贴壁;
(2)流式检测CD14,CD68表达确认是否诱导成功(CD14表达下调)。
收集诱导成功的M0细胞,加入20ng/ml IFNγ+10pg/ml脂多糖,LPS诱导24hr诱导M1类型巨噬细胞形成,加入20ng/ml IL-4+20ng/ml IL-13诱导24hr诱导M2型巨噬细胞形成。
首先,本实验例观察MNC-168诱导M0型巨噬细胞向M1或M2型细胞的分化。实验方案如下:
使用终浓度为5ng/ml的PMA处理THP-1 48hr使其分化为M0巨噬细胞。PMA诱导THP1细胞为M0型巨噬细胞流式检测CD14表达图参照图15所示。
收集PMA诱导THP-1 48hr分化后的M0巨噬细胞,加入20ng/ml IFNγ+10pg/ml脂多糖,LPS诱导24hr诱导M1类型巨噬细胞形成。
其次,本实验例还观察了MNC-168诱导M0型巨噬细胞向M1型细胞的分化。
实验方案如下:
使用终浓度为5ng/ml的PMA处理THP-1(武汉普诺赛生命科技有限公司)48hr使其分化为M0巨噬细胞。
M0巨噬细胞与MNC-168进行共孵育24hr。按照MOI(活菌数:细胞数)=10:1的比例加入MNC-168。同时设置M1巨噬细胞对照组(M0细胞经20ng/ml IFNγ+10pg/ml脂多糖,LPS诱导24hr)和M2巨噬细胞对照组(20ng/ml IL-4+20ng/ml IL-13诱导24hr),厌氧培养1hr后加入下述表5中所列的抗生素组合杀死细菌。
表5:使用抗生素列表。
将MNC-168与巨噬细胞共孵育24hr后,收集上清用ELISA方法检测其分泌的细胞因子浓度(结果参照图2A、图2B和图2C所示)。
结果显示,巨噬细胞和MNC-168共培养后,巨噬细胞明显表现出向M1型巨噬细胞分化的特征。具体地,IL-1β,IL-23,TNFα的分泌都有了非常显著的增加,IL-27分泌也有一定程度的增加,但IL-27的分泌水平的增加幅度小于其他三个细胞因子的分泌水平增加幅度。
实验例2
本实验例探究MNC-168对Primary PBMC的影响。
已有研究表明:肠道微生物的成分对周围的免疫系统有着深远的影响,同时肠道微生物对癌症病人肿瘤免疫治疗的效果也有着重要的影响,是抗肿瘤免疫和治疗效果的关键组成部分。肠道微生物与免疫细胞之间能进行相互作用,共同调控人的免疫系统。肠道菌株能够诱导primary PBMC细胞分化为不同的细胞类型,并分泌不同的炎症因子,故可用于具有免疫调控菌株的筛选。
本实验旨在观察MNC-168诱导Primary PBMC的分化。实验方案如下:
使用购买的商业化Primary PBMC(购买于TPCS,批号A19Z289100),复苏后培养于PRMI1640完全培养基中(10%的热灭活FBS,含有1%L-谷氨酰胺,0.1%ps(青链霉素混合液),10mg/ml DNase,Dnase的作用为避免凝集)。
Primary PBMC与MNC-168进行共孵育24hr。按照MOI(活菌数:细胞数)=1:1的比例加入细菌,同时设置PBS对照组(PBS与Primary PBMC共培养24hr),厌氧培养1hr后加入下述表6中所列抗生素组合杀死细菌。
表6:使用抗生素列表。
菌株与巨噬细胞共孵育24hr后,收集上清用ELISA方法检测其分泌的细胞因子浓度。实验结果参照图3A和图3B所示。
对MNC168菌株与Primary PBMC细胞共同培养24hr后收集上清进行ELISA检测,结果显示MNC168能够诱导炎症因子IL1β,CXCL9的显著增加,而IFNγ,TNFα分泌也有一定程度的增加,但IFNγ,TNFα分泌的增加幅度低于IL1β,CXCL9细胞因子的增加幅度。
实验例3
本实验例探究菌株MNC-168对DC细胞的影响。
肠道微生物与免疫细胞之间能相互作用,共同调控人的免疫系统。肠道菌株能够诱导iDC(immature DC)细胞分化成熟,成熟DC能有效激活T细胞,从而杀伤肿瘤细胞,故iDC的诱导分化可用于具有免疫调控菌株的筛选。
在培养5-6小时的PBMC细胞(购买于TPCS,批号A19Z289100)中加入50ng/ml GM-CSF及20ng/ml的IL-4细胞因子进行iDC的诱导,继续培养5天。
MNC-168对iDC细胞的影响实验。
本实验旨在观察MNC-168诱导iDC细胞向成熟DC细胞的分化。实验方案如下:
使用终浓度为50ng/ml GM-CSF及20ng/ml的IL-4细胞因子处理PBMC 6d使其分化为iDC细胞。
iDC细胞与MNC-168进行共孵育24hr。按照MOI(活菌数:细胞数)=10的比例加入细菌,同时设置空白对照组(PBS)和阳性对照组(LPS),厌氧培养1hr后加入下述表7中所列抗生素组合杀死细菌。
表7:使用抗生素列表。
菌株与iDC细胞共孵育24hr后,收集上清用ELISA方法检测其分泌的细胞因子浓度,实验结果参照图4A和图4B所示。
结果表明,iDC细胞和MNC-168共培养后,iDC细胞明显表现出向成熟DC细胞分化的特征。具体地,iDC细胞IL-1β,CXCL9的分泌都有非常显著的增加,IFNγ和TRAIL分泌也有一定程度的增加,但IFNγ和TRAIL分泌的增加幅度没有其他两个细胞因子增加幅度明显。
实验例4
本实验例提供了MNC-168的制备方法。
用灭菌牙签挑取一个MNC-168单克隆到10ml的AC液体培养基(每升含:蛋白胨,20g;葡萄糖,5g;酵母提取物,3g;牛肉浸粉,3g;维生素C,0.2g;pH7.0)中培养1天,取1ml培养液进行质谱鉴定,鉴定结果正确后,吸取2ml菌悬液转接入80ml AC液体培养基中于厌氧操作台培养。
培养24小时后,吸取30ml菌悬液转接入400ml AC液体培养基中于厌氧操作台培养。培养24小时后,取1ml菌液进行质谱鉴定,鉴定结果正确后,将全部菌液转移到I L离心瓶中,6000rpm,4℃离心30min。取沉淀用AC液体培养基:无菌甘油(4:1)重悬。
将菌液甘油混合液吸取0.1ml菌株冻存液加入0.9ml生理盐水中进行梯度稀释,稀释至10
将制作好的菌株冻存液分装于无菌冻存管中,每管分装0.2ml菌液,每株菌分装10管。冷冻于-80℃冷冻保存。待完全冷冻后(24h),取出一管冻存细菌,融化至室温,并采用稀释涂布法测量其活菌浓度(CFU)。
实验例5
本实验例探究MNC-168的抗逆性。
以活细菌为基础的活体生态药(Live Biotherapeutic Product)的开发在近年来获得了越来越多的关注。细菌在进入消化道后会面临相当恶劣的生存环境,一方面,胃部的低pH的胃酸以及肠道中一定浓度的胆盐对许多细菌有着很大的伤害,另一方面,不同的菌株对这些有害环境的抗性差异也很大。
一个细菌对消化道环境的耐受性关系到其是否有机会被开发成活体生态药,这些指标对以该细菌菌株为基础进行活体生态药开发中的剂型选择也具有重要的意义。因此,测试菌株的耐酸性以及胆盐耐受性是十分有必要的。
体外抗逆性测试所采取的方式是观察细菌在与体内环境相似的模拟液,即模拟胃液(SGF)和模拟肠液(SIF),接入菌株,根据菌株在胃部及小肠的停留时间设定时间点取样,测定菌株的存活曲线。为排除菌株在自然情况下的生长/死亡带来的影响,我们以pH=6.8的缓冲溶液作为对照。空腹模拟胃液(SGF)及以浓盐酸稀释法获得pH在1.0(中国药典)或1.2(美国药典)的溶液加入胃蛋白酶制成。考虑到餐前餐后胃液的变化,参考MargarethR.C.Marques等人所发表的文章,我们以pH=3作为餐后的胃液pH,这个酸度也与小鼠的正常胃液pH相似。而模拟肠液(SIF)则根据USP26用磷酸二氢钾及氢氧化钠按一定比例配置,pH为6.8。
测试的时长参考人体胃肠道的排空时间,对于耐酸性试验,我们选取2小时作为测试时长,对于胆盐耐受性试验,我们选取6小时为测试时长。本实验中,主要考虑了酶、无机盐,以及胆盐。其中,由于不同的来源以及工艺,市面上胃蛋白酶、胰蛋白酶的活度参差不齐,我们参考M.Minekus等人,Leyuan Li等人和发表的文献,确定最终实验所用介质的配置及方案。
由于测试的取点时间相当密集,MRS涂板的方法操作时间长,受影响因素大,难以保证结果的准确性。因而在本实验中采用MTT(噻唑蓝)染色的方法进行活菌的鉴别。MTT作为一种染料常被当作底物通过检测细胞琥珀酸脱氢酶的活性来检测细胞的死活。琥珀酸脱氢酶是连接氧化磷酸化与电子传递的枢纽之一,可为真核细胞线粒体和多种原核细胞需氧和产能的呼吸链提供电子。
琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。在一定细胞数范围内,形成的甲瓒结晶的量与活细胞数成正比,二甲基亚砜(DMSO)能溶解细胞中沉淀的甲瓒,在570nm波长处测定其光吸收值,可间接测量活细胞的数量。该方法可以免去繁琐的浓度稀释和涂板操作,非常适用于快速进行细菌活率的测定。
一、模拟胃液(Simulated Gastric Fluid,SGF)实验,实验方案包括:
1.称取2.0g NaCl和2.67g胃蛋白酶(源叶生物胃蛋白酶,USP级,1:3000);
2.加入7.0mL浓HCl(37%),纯水定容至1000mL,混匀;
3.调pH分别至pH1.2(模拟人空腹肠液pH)和pH3.0(模拟人饭后肠液pH及小鼠空腹肠液pH),过滤除菌;
4.将6.8g磷酸二氢钾及0.9g氢氧化钠溶于1000mL纯水中,调节pH至6.8±0.1,作为实验中使用的缓冲液(缓冲能力18.6mmol/L/pH)。
二、模拟肠液(SIF)-Simulated Intestinal Fluid(SIF)实验,实验方案包括:
1、称取6.8g磷酸二氢钾以及0.9g氢氧化钠到1000mL纯水中;
2、加入0.1g胰蛋白酶(源叶生物胰蛋白酶,1:2500),使溶液达到250U/mL的酶活力;
3、调节pH至6.8±0.1,过滤除菌。
三、MTT(噻唑蓝)染色剂配制方法包括:
称量0.5g MTT(噻唑蓝Shanghai Acmec Biochemical Co.ltd,98%)至100mL无菌PBS(磷酸盐缓冲溶液,pH=7.2)中,完全溶解后过滤除菌,储存于棕色试剂瓶,冷藏于4℃冰箱中。
四、耐酸性测试。
1、将待测菌粉0.7796g至10mL的缓冲液中;
2、分别准备9mL缓冲液(对照组);9mL pH1.2的模拟胃液(实验组1);9mL pH3.0的模拟胃液(实验组2)至离心管中;
3、取步骤1中的样品1mL加入步骤2配制的模拟胃液及缓冲液中,摇匀获得样品A(缓冲液组),B(pH1.2模拟胃液组),和C(pH3.0模拟胃液组)。
4、在取样时间点取样:在0时时间点对样品A取样(以此为0时数据);在0.5h,1h和2h时对样品A,B,C取样。
5、取1mL样品A,B和C加至4mL缓冲液中,混匀后取3mL混悬液加入1mL MTT(5mg/mL)染色液,黑暗环境下反应过夜。取3mL缓冲液加入1mL MTT作为空白对照。
6、过夜后,震荡摇匀,取1mL各反应的样品加入2mL二甲基亚砜(DMSO)用于溶解显色物质甲瓒)。
7、在570nM波长下测量样品的吸光值,并据此推算出活细菌的比例。
五、胆盐耐受性测试(在常温条件,超净工作台中进行)。
1、将待测菌液2mL加至含18mL的缓冲液的离心管中(缓冲液对照组),将待测菌液2mL加至含18mL的模拟肠液的离心管中(模拟肠液组)。
2、取样时间点:0h(加入菌液混匀后马上取样),0.5h,1h,2h,4h,6h。
3、在取样时间点分别取3mL对照组和模拟肠液组加入1mL MTT(5mg/mL)染色液,黑暗环境下反映过夜。
4、过夜后,震荡摇匀,取1mL各反应的样品加入5mL二甲基亚砜(DMSO)用于溶解显色物质甲瓒),再次取1mL上述样品溶液到3mL二甲基亚砜中进行二次稀释。
5、在570nM波长下测量样品的吸光值,并据此推算出活细菌的比例。
六、耐酸性测试结果参照图5所示,图5中示出了MNC-168在模拟胃液中以吸光度值为参照的存活曲线。
以对照组的数值为基准,实验组相对于对照组的活菌存活率见表8,结果表明,2小时pH3.0的模拟胃液处理对MNC-168的存活几乎无影响,但该菌株无法抵抗pH1.2的模拟胃液(处理0.5小时后,几乎所有细菌均死亡)。
表8:MNC-168在模拟胃液中的存活率(%)。
七、胆盐耐受性测试结果。
MNC-168在模拟肠液中以吸光度值为参照的存活曲线见图6所示。
以对照组的数值为基准,实验组相对于对照组的活菌存活率见表9。结果显示,MNC-168在肠液的环境中适应良好,并有所增殖,但随处理时间的增长,MNC-168存活率会有稍微下降。
表9:MNC-168在模拟肠液中的存活率(%)。
实验例6
本实验例探究了口服MNC-168可以用于肿瘤治疗结直肠癌。
为验证MNC-168是否可以用于肿瘤的预防和治疗,我们利用小鼠同源肿瘤模型进行了抑制结直肠癌的生长的实验。本实验通过了慕恩生物动物伦理委员会伦理审查。
C57B/6小鼠购自南京模式动物中心,小鼠结直肠癌细胞CT26购自ATCC,InVivoMAbanti-mouse PD-1(BioXcell,BE0146)。
小鼠被通过p.o.方式被喂食MNC-168细菌,MNC-168解冻后放置于室温至其温度达到室温,后按照每只小鼠2×10
在喂食MNC-168七天后,接种CT26的细胞量为1×10
接种肿瘤后小鼠持续进行喂食MNC-168治疗直至实验结束,喂食方法同样采用p.o.方式。
在接种肿瘤后第7,10,14,17天腹腔注射抗鼠PD-1抗体,注射剂量为每次每只小鼠100μg。
每两天量取肿瘤大小,通过如下的公式计算肿瘤的体积:
肿瘤体积=1/2×肿瘤长径
除实验组(MNC-168+PD-1)外,实验同时设置两组对照,分别为仅使用PD-1治疗组(PD-1)和不进行任何治疗的对照组(Control)。
结果参照图7所示,非治疗组肿瘤快速生长,在D19达到约2300mm
实验例7
为验证MNC-168是否可以用于肿瘤的预防和治疗,我们利用小鼠同源肿瘤模型进行了抑制结直肠癌的生长的实验。本实验通过了慕恩生物动物伦理委员会伦理审查。
C57B/6小鼠购自南京模式动物中心,小鼠结直肠癌细胞MC-38购自ATCC,InVivoMAb anti-mouse PD-1(BioXcell,BE0146)。
小鼠被通过p.o.方式被喂食MNC-168细菌,MNC-168解冻后放置于室温至其温度达到室温,后按照每只小鼠2×10
在喂食MNC-168七天,接种MC38细胞量为1×10
接种肿瘤后的小鼠持续进行喂食MNC-168治疗直至实验结束,喂食方法同样采用p.o.方式。
在接种肿瘤后的第7,10,14,17天腹腔注射抗鼠PD-1抗体,注射剂量为每次每只小鼠100μg。
每两天量取种瘤大小,通过如下的公式计算肿瘤的体积:
肿瘤体积=1/2×肿瘤长径
除实验组(MNC-168+PD-1)外,实验同时设置两组对照,分别为仅使用PD-1治疗组(PD-1)和不进行任何治疗的对照组(Control)。
结果参照图8所示,非治疗组肿瘤快速生长,在D19达到约1800mm
实验例9
本实验例探究了口服MNC-168可以增加anti-PD-1的响应效率。
为验证MNC-168是否可以增加anti-PD-1的响应效率,我们利用小鼠抗生素处理过的同源肿瘤模型进行了抑制结直肠癌的生长的实验,抗生素列表参照表10所示。本实验通过了慕恩生物动物伦理委员会伦理审查。
表10:使用抗生素列表。
C57B/6小鼠购自南京模式动物中心,小鼠结直肠癌细胞CT26购自ATCC,InVivoMAbanti-mouse PD-1(BioXcell,BE0146)。
小鼠被通过p.o.方式被喂食MNC-168细菌,MNC-168解冻后放置于室温至其温度达到室温,后按照每只小鼠2×10
在喂食MNC-168七天后,接种CT26的细胞量为1×10
接种肿瘤后小鼠持续进行喂食MNC-168治疗直至实验结束,喂食方法同样采用p.o.方式。
在接种肿瘤后第7,10,14,17天腹腔注射抗鼠PD-1抗体,注射剂量为每次每只小鼠100μg。
每两天量取肿瘤大小,通过如下的公式计算肿瘤的体积:
肿瘤体积=1/2×肿瘤长径
除实验组(MNC-168+PD-1)外,实验同时设置两组对照,分别为仅使用PD-1治疗组(PD-1)和不进行任何治疗的对照组(Control)。
结果参照图9所示,非治疗组肿瘤快速生长,在D19达到约2300mm
实验例10
本实验例的实验方法包括:
取约0.3g肿瘤组织,用剪刀切成小块,在胶原酶IV消化液中(1mg/ml胶原酶IV,0.1mg/ml DNA酶,10%FBS),37度消化30分钟。组织消化后的混合液通过70um筛网,制成单细胞悬液。取一定量细胞悬液,加入刺激剂(1640培养基中加入100ng/ml PMA,1ug/ml离子霉素和6ug/ml BFA),37度刺激4小时。刺激后,进行表面分子CD4和CD8染色(FITC RatAnti-Mouse CD4,PE anti-mouse CD8a按1:100稀释在1%FBS-PBS溶液),4度避光染色30分钟。用Transcription Factor Buffer Set对细胞进行固定破膜,1X固定液在4度固定过夜,然后进行细胞因子染色(PE-Cy7 anti-mouse IFN-γ按1:100稀释在1x破膜液),室温避光染色1小时。细胞重悬在PBS,上机检测。
图10中显示了MNC-168激活肿瘤组织中的肿瘤浸润免疫细胞CD4IFNγ细胞和CD8IFNγ细胞流式图。
实验材料:
FITC Rat Anti-Mouse CD4(货号553046,BD),PE Rat Anti-Mouse CD8a(货号553032,BD)。
PE-Cy7 anti-mouse IFN-γ(货号557649,BD),PMA(P1585,Sigma),ionomycin(货号407952,Sigma),brefeldin A(货号00-4506-51,Thermofisher),Transcription FactorBuffer Set(货号562574,BD),1640培养基(货号C11875500BT,Thermofisher),FBS(货号10099-141,Gibico)。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 慕恩(广州)生物科技有限公司
<120> 一种乳酸肠球菌、预防或治疗肿瘤的药物及应用
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 1424
<212> DNA
<213> 人工序列
<400> 1
tgcaagtcgt acgcttcttt ttccaccgga gcttgctcca ccggaaaaag aggagtggcg 60
aacgggtgag taacacgtgg gtaacctgcc catcagaagg ggataacact tggaaacagg 120
tgctaatacc gtataacaat cgaaaccgca tggttttgat ttgaaaggcg ctttcgggtg 180
tcgctgatgg atggacccgc ggtgcattag ctagttggtg aggtaacggc tcaccaaggc 240
cacgatgcat agccgacctg agagggtgat cggccacatt gggactgaga cacggcccaa 300
actcctacgg gaggcagcag tagggaatct tcggcaatgg acgaaagtct gaccgagcaa 360
cgccgcgtga gtgaagaagg ttttcggatc gtaaaactct gttgttagag aagaacaagg 420
atgagagtaa ctgttcatcc cttgacggta tctaaccaga aagccacggc taactacgtg 480
ccagcagccg cggtaatacg taggtggcaa gcgttgtccg gatttattgg gcgtaaagcg 540
agcgcaggcg gtttcttaag tctgatgtga aagcccccgg ctcaaccggg gagggtcatt 600
ggaaactggg agacttgagt gcagaagagg agagtggaat tccatgtgta gcggtgaaat 660
gcgtagatat atggaggaac accagtggcg aaggcggctc tctggtctgt aactgacgct 720
gaggctcgaa agcgtgggga gcaaacagga ttagataccc tggtagtcca cgccgtaaac 780
gatgagtgct aagtgttgga gggtttccgc ccttcagtgc tgcagctaac gcattaagca 840
ctccgcctgg ggagtacgac cgcaaggttg aaactcaaag gaattgacgg gggcccgcac 900
aagcggtgga gcatgtggtt taattcgaag caacgcgaag aaccttacca ggtcttgaca 960
tcctttgacc actctagaga tagagcttcc ccttcggggg caaagtgaca ggtggtgcat 1020
ggttgtcgtc agctcgtgtc gtgagatgtt gggttaagtc ccgcaacgag cgcaaccctt 1080
attgttagtt gccatcattc agttgggcac tctagcaaga ctgccggtga caaaccggag 1140
gaaggtgggg atgacgtcaa atcatcatgc cccttatgac ctgggctaca cacgtgctac 1200
aatgggaagt acaacgagtt gcgaagtcgc gaggctaagc taatctctta aagcttctct 1260
cagttcggat tgcaggctgc aactcgcctg catgaagccg gaatcgctag taatcgcgga 1320
tcagcacgcc gcggtgaata cgttcccggg ccttgtacac accgcccgtc acaccacgag 1380
agtttgtaac acccgaagtc ggtgaggtaa cctttttgga gcca 1424
- 一种乳酸肠球菌、预防或治疗肿瘤的药物及应用
- 一种乳酸肠球菌、预防或治疗肿瘤的药物及应用
