泡沫稳定性
文献发布时间:2023-06-19 10:36:57
本发明涉及具有改善的泡沫稳定性的啤酒,以及改善啤酒的泡沫稳定性的方法。
背景技术
啤酒是全世界最受欢迎的酒精饮料。其通过使用将糖转化为乙醇(“酒精”)的酵母发酵衍生自谷粒的含糖水性基质来制备。啤酒的生产方法通常是已知的,并且本领域技术人员能够基于公知常识(参见例如Ted Goldammer(2008,Apex出版商)的The BrewersHandbook(第二版))和本文公开的信息获得啤酒。
啤酒通常由诸如大麦的谷物制成,但也可以使用其它谷物类型,包括但不限于小麦或高粱。啤酒通常由包括以下基本步骤的方法生产:糖化谷粒和水的混合物以产生麦芽浆;将麦芽汁中的麦芽浆与麦糟分离;将麦芽汁煮沸以得到煮沸的麦芽汁;将煮沸的麦芽汁用活酵母(例如巴氏酵母(Saccharomyces pastorianus)或酿酒酵母(Saccharomycescerevisiae))发酵以产生发酵的麦芽汁;使发酵的麦芽汁进行一个或多个进一步的处理步骤(例如后熟和过滤)以产生啤酒;以及将啤酒灌装在密封容器(例如瓶、罐或桶)中。
在生产大麦麦芽啤酒的示例性方法中,对大麦进行麦芽化,这意指使其发芽并且随后干燥(“焙燥”)以生产麦芽。该方法对于味道和颜色化合物的形成和酶的形成是重要的,所述酶对于进一步的风味发展和淀粉降解是重要的。随后,将麦芽研磨并且悬浮在水中(“糖化”)。加热麦芽浆以促进淀粉降解。随后的过滤产生麦芽汁,其是或多或少澄清的可发酵糖的水溶液,其还含有各种风味和香味以及许多其它化合物。在麦芽汁中,存在期望的和不期望的风味化合物。
煮沸麦芽汁以将其灭菌,沉淀蛋白质并且浓缩。任选地添加酒花,以增加苦味和风味。去除沉淀之后,使该混合物进行发酵。发酵导致可发酵糖转化成乙醇和二氧化碳,并且还导致各种新的风味化合物的形成。同时,用于发酵的酵母实现了许多其它的化学转化。发酵之后,可以过滤和/或储存啤酒,以便优化外观和味道。
啤酒的重要方面是啤头(beer head)。啤头是啤酒顶部上的泡沫层。该泡沫通过由发酵和/或发酵后添加而存在于啤酒中的二氧化碳得到,但由于啤酒容器(例如罐或瓶)中的高压,该泡沫基本上溶解在啤酒中。将啤酒从容器中释放到例如玻璃杯中,引起二氧化碳气泡的形成,二氧化碳气泡通过啤酒液体上升至玻璃杯的顶部以形成泡沫。
啤酒泡沫的区别特征是其稳定性。与其它发泡酵母发酵饮料(例如香槟酒)相比,啤酒泡沫是稳定的。这是由啤酒中的(尤其是)蛋白质和异构化的酒花酸引起的,所述蛋白质和异构化的酒花酸在二氧化碳气泡形成并且通过啤酒上升期间定位在气泡和液体的界面处。一旦到达液体顶部,这些组分稳定啤酒泡沫气泡。因此,泡沫层在延长的时间段内保持完整。完整且稳定的泡沫层被认为是令人享受的啤酒的重要方面。
然而,泡沫稳定化具有有限的持续时间。在倾倒之后的几分钟内,泡沫层变得更薄,并且最终根本没有泡沫留下。可能该过程比消费者愿意饮用啤酒发生得更快。这意味着由于消失的泡沫层,啤酒随时间流逝而不令人享受。对于慢饮者,甚至在喝完啤酒之前,泡沫可能就已经消失了。
本发明提供了具有改善的泡沫稳定性的啤酒,以及改善啤酒的泡沫稳定性的方法。
发明内容
本发明涉及具有降低量的AcHFA的啤酒。已经发现具有降低的AcHFA量的啤酒具有改善的泡沫稳定性。本发明提供了具有降低的AcHFA量的啤酒,以及用于在发酵期间或发酵之后从啤酒中去除AcHFA或从麦芽汁中去除AcHFA前体的方法。
附图
图1:在用甲基纤维素酯吸附剂的吸附过程之前和之后的泡沫稳定性的比较。
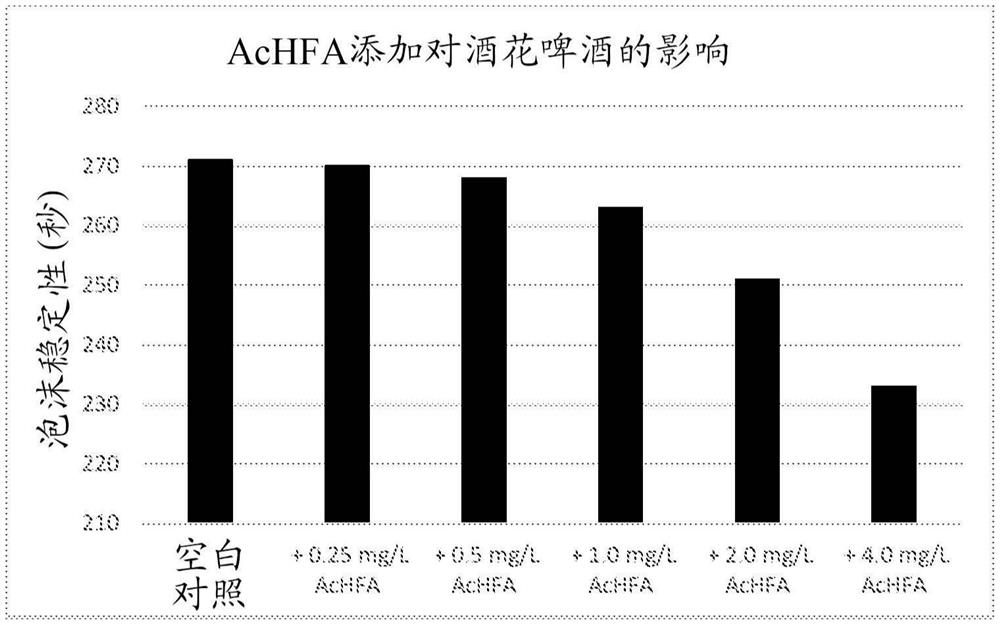
图2:AcHFA添加对酒花啤酒(2a)和无酒花啤酒(2b)的泡沫稳定性的影响。
图3:从酒花啤酒(3a)和无酒花啤酒(3b)中去除AcHFA的影响。
图4:用多种吸附剂从啤酒中去除AcHFA。
图5:两种吸附剂从啤酒中去除AcHFA的活性。
图6:工业规模啤酒酿造工艺中吸附剂过滤器的安装。
图7a:酵母中的ATF-1突变。
图7b:与未修饰的酵母(WT)相比,ATF-1缺陷酵母(菌株a)、ATF-2缺陷酵母(菌株b)以及ATF-1和ATF-2缺陷酵母(菌株c)的乙醇生产。
图8a和图8b:以工厂相关规模从啤酒中去除AcHFA的示例性设置。
图9:使用工厂相关规模生产的啤酒中增加的泡沫稳定性。
具体实施方式
本发明提供了包含少于2mg/l的AcHFA的啤酒,其中AcHFA是C12-C22脂肪酸,其包含羧酸基团和C11-C21直链烃基基团,所述烃基基团可以是部分不饱和的,并且所述烃基基团被至少一个羟基基团和至少一个乙酸酯基团取代。优选地,啤酒包含少于1.5mg/l的AcHFA,优选少于1.0mg/l,更优选少于0.5mg/l,甚至更优选少于0.25mg/l,甚至更优选少于0.1mg/l。因此,本发明涉及包含肯定少于10mg/l,例如少于9mg/l,少于8mg/l,少于7mg/l,少于6mg/l,少于5mg/l,少于4mg/l或少于3mg/l的AcHFA的啤酒。
目前已经发现AcHFA在麦芽汁由酵母常规发酵期间通过乙酰转移酶(ATF)的作用而形成。已经发现AcHFA通常以至少2mg/l,有时至少3mg/l,或甚至至少4mg/l,或至少5mg/l,或至少6mg/l,或至少7mg/l,或至少8mg/l,或至少9mg/l,或至少10mg/l的水平存在于通过发酵获得的啤酒中。因此,AcHFA可以以高于1mg/l,肯定高于0.5mg/l,最肯定高于0.25mg/l的量存在于通过发酵获得的啤酒中。本发明人发现AcHFA是泡沫消极因素:它对泡沫稳定性具有消极影响。通过调整发酵过程以降低最终啤酒中AcHFA的量,泡沫稳定性可以增加至少10%,最高达40%。
AcHFA(“乙酰化羟基脂肪酸”)是C12-C22脂肪酸,其包含羧酸基团和C11-C21直链烃基基团,所述烃基基团可以是部分不饱和的,并且所述烃基基团被至少一个羟基基团和至少一个乙酸酯基团取代。乙酸酯基团(H
AcHFA可以定义为结构
其中n是4-9的整数,并且其中每个
a)
A和B中的一个是H、OH或OAc,并且A和B中的另一个是H;
C和D中的一个是H、OH或OAc,并且C和D中的另一个是H;或者
b)
A和B中的一个是H,而A和B中的另一个不存在(这意指A和B中的另一个为无),并且C和D中的一个是H,而C和D中的另一个不存在(这意指A和B中的另一个为无);
条件是在结构
如通常已知的,双键可以具有顺式或反式构型,但优选地,构型是顺式。此外,如有机酸常见的,酸基团可以呈中性形式(如所描绘的;~CO
优选地,在任选的多个羟基和/或乙酸酯基团中,AcHFA包含位于相邻碳原子上的一个羟基基团和一个乙酸酯基团。进一步优选地,AcHFA是C16-C20脂肪酸(结构
在更优选的实施方案中,AcHFA由结构
其中
n=1、2或3,优选2或3,最优选3;
m=1或2,优选2;
A和B中的一个是OH,并且A和B中的另一个是OAc。
同样对于结构
在更优选的实施方案中,AcHFA由结构
其中A和B中的一个是OH,并且A和B中的另一个是OAc。在这些实施方案中,AcHFA是(顺式或反式;RR、SS、RS或SR)12-乙酰氧基-13-羟基十八碳-9-烯酸(3a),或(顺式或反式;RR、SS、RS或SR)13-乙酰氧基-12-羟基十八碳-9-烯酸(3b):
已经发现AcHFA天然存在于啤酒中,因为它是通过酵母酶乙酰转移酶(ATF)在发酵期间形成。
一个AcHFA前体是二羟基脂肪酸,例如上文定义的结构
此外,已经发现,相对于相同的普通啤酒,具有降低的AcHFA含量的啤酒具有改善的发泡性质。特别地,AcHFA的量的降低增加了啤酒泡沫的稳定性。
在本文中,根据由NIBEM研究所设定的标准测量啤酒泡沫的稳定性,并且以秒([s])表示。因此,啤酒泡沫稳定性表示泡沫层在标准化测试条件下稳定的按秒计的时间量。
NIBEM方法通常是已知的,并且可以被发现为EBC分析方法9.42.1。在大气压下在20℃下进行测试。泡沫稳定性测量为在标准化条件下(包括允许泡沫排出的时间段)制备泡沫直到泡沫层的高度降低3cm所经过的时间。
啤酒可以是指任何类型的啤酒,包括但不限于艾尔啤酒(ale)、波特啤酒(porter)、司陶特啤酒(stout)、拉格啤酒(lager)和博克啤酒(bock beer)。啤酒优选是基于麦芽的啤酒,即从由麦芽制备的麦芽汁的发酵制备的啤酒。优选地,啤酒是拉格啤酒(Lager beer),其是通过在7-15℃下使用底部发酵酵母发酵并且随后在低温下贮藏而获得的啤酒。拉格啤酒包括例如皮尔森啤酒(pilsner)。最优选地,如本文所述的啤酒是皮尔森啤酒。皮尔森啤酒是淡色拉格啤酒。
在本文中,啤酒应以广义的含义来理解,并且包括普通(含酒精的)啤酒和低酒精或零酒精(“NA”)啤酒。因此,本文中的啤酒优选是具有0-15vol.%(“ABV”),优选1-15vol.%的乙醇含量的啤酒。啤酒可以富含酒花(“酒花啤酒”),或者可以没有加酒花(“无酒花啤酒”)。酒花啤酒包括使用改性酒花(例如Rho-hop)制备的啤酒。
在一个优选的实施方案中,啤酒是普通啤酒。在本文中,“普通啤酒”是使用产生大于1vol.%乙醇的发酵过程获得的普通酿造啤酒。因此,如本文所定义的普通啤酒具有大于1vol.%,并且优选小于15vol.%的乙醇含量。普通啤酒的乙醇含量优选是2-15vol.%,更优选2.5-12vol.%,更优选3.5-9vol.%。如上所述,普通啤酒优选是拉格啤酒,最优选是皮尔森啤酒。技术人员能够例如通过在Ted Goldammer的Brewers Handbook(第二版)(2008,Apex出版商)中描述的方法或者通过本文公开的方法获得普通啤酒,例如普通拉格啤酒和皮尔森啤酒。或者,可商购普通啤酒。
在另一个优选的实施方案中,啤酒是零酒精或低酒精啤酒(“NA啤酒”)。在本文中,“零酒精或低酒精啤酒”是具有1.0vol.%(“ABV”)或更少,优选0.5vol.%或更少,更优选0.2vol.%或更少的乙醇含量。因此,NA啤酒是具有0-1.0vol.%,例如优选0-0.5vol.%的乙醇含量的啤酒。
NA啤酒可以例如通过普通啤酒的脱醇来获得(“脱醇啤酒”)或者通过麦芽汁的限制乙醇发酵来获得(“限制发酵啤酒”)。
获得如本文所定义的NA啤酒的一种方法是使普通酿造的啤酒进行脱醇步骤,例如精馏步骤、反渗透步骤、透析步骤或冷冻浓缩步骤,以从发酵啤酒中去除乙醇。这些技术例如描述于Brányik等人,J.Food.Eng.108(2012)493-506或者Mangindaan等人,Trends inFood Science&Technology 71(2018)36-45。
获得NA啤酒的另一种方法是通过限制发酵过程来制造啤酒,其得到限制发酵啤酒。限制发酵啤酒是本文所定义的另一种NA啤酒。
限制发酵啤酒被定义为通过麦芽汁的限制乙醇发酵而获得的发酵啤酒。麦芽汁的限制乙醇发酵是不产生显著的净乙醇形成的发酵,即,如本文所定义的限制发酵产生1vol.%或更少,优选0.5vol.%或更少,更优选0.2vol.%或更少的乙醇。因此,限制发酵啤酒具有1.0vol.%或更少,优选0.5vol.%或更少,更优选0.2vol.%或更少的乙醇含量。
麦芽汁的限制发酵是其中从发酵直接获得的产物具有1.0vol.%或更少,优选0.5vol.%或更少,更优选0.2vol.%或更少的乙醇含量的过程。技术人员知道不会产生显著的净乙醇形成的各种限制发酵技术。实例是麦芽汁的限制乙醇发酵,其特征在于
·低于7℃,优选-1至4℃,例如-0.5至2.5℃的温度,优选持续8-72小时,更优选12-48小时(“冷接触发酵啤酒”);和/或
·短的(例如小于2小时)发酵时间,所述发酵通过温度失活而快速停止,例如通过快速冷却至-0.5至1℃,任选地随后进行后续的巴氏消毒(“停滞发酵啤酒”);和/或
·通过在所应用的发酵条件下产生少量乙醇的酵母菌株发酵,例如在麦芽汁中产生小于0.2g乙醇/克可发酵糖,优选小于0.1g乙醇/克可发酵糖的酵母菌株。合适的菌株(例如克拉布特里(Crabtree)阴性菌株)是本领域已知的,并且在不同的发酵条件下产生的乙醇的量可以通过常规实验(“酵母限制的啤酒”)确定;和/或
·使用第一产乙醇的酵母菌株,在足量的消耗乙醇的第二酵母菌株(例如鲁氏酵母(Saccharomyces rouxii))的存在下进行发酵,以消耗由第一酵母菌株产生的基本上所有的乙醇;和/或
·麦芽汁具有可发酵糖含量使得在其发酵完成之后产生最多1.0vol.%的乙醇。在这种情况下,麦芽汁通常具有小于17.5g/l、优选小于12g/l、更优选小于8g/l的可发酵糖含量(“糖缺乏麦芽汁啤酒”)。
限制发酵啤酒未进行脱醇而获得了1.0vol.%或更少、优选0.5vol.%或更少、更优选0.2vol.%或更少的所述乙醇含量。技术人员已知用于发酵啤酒的脱醇的各种合适的技术(参见上文,参考Brányik等人和Mangindaan等人),并且这些技术中没有一种被应用来获得所述乙醇含量。然而,本文中的限制发酵啤酒可以任选地进行脱醇步骤,以将乙醇含量从由发酵获得的所述1.0vol.%或更少、优选0.5vol.%或更少、更优选0.2vol.%或更少降低至进一步降低的乙醇含量。然而,优选地,如本文所定义的限制发酵啤酒根本不进行脱醇步骤。
本文中的限制发酵啤酒优选是糖缺乏麦芽汁啤酒、酵母限制啤酒、停滞发酵啤酒或冷接触发酵啤酒。本文中的限制发酵啤酒优选是冷接触发酵啤酒。
在更优选的实施方案中,本文中的啤酒是普通啤酒、限制发酵啤酒或两种类型啤酒的混合物,优选普通啤酒、冷接触发酵啤酒或两种类型啤酒的混合物。最优选地,在本文中,啤酒是具有1-15vol.%的乙醇含量的普通啤酒,如上所定义。
为了最佳地受益于增加的泡沫稳定性,本发明的啤酒优选具有低糖含量。定义为葡萄糖、果糖、蔗糖、麦芽糖和麦芽三糖的总和的本发明啤酒的总糖含量是优选0.05-5g/100ml、更优选0.1-1g/100ml、甚至更优选0.15-0.5g/100ml。这是因为已经发现,在具有相对低的总糖含量的啤酒中,降低AcHFA量的泡沫稳定效果更强。
出于类似的原因,本发明的啤酒优选具有相对高水平的游离氨基氮(FAN)。FAN有助于泡沫稳定性,因此本发明的啤酒优选具有50-160mg/l、优选90-140mg/l、更优选110-135mg/l的FAN含量。
异α-酸也对啤酒泡沫稳定性具有积极影响。因此,本发明的啤酒优选具有总计2-55mg/l、优选5-45mg/l、更优选10-30mg/l、更优选13-25mg/l的异α-酸。在本文中,异α-酸定义为在雌性酒花球果中产生的啤酒花苦味素的软树脂部分。α-酸包括例如葎草酮、合葎草酮(cohumulone)和加葎草酮(adhumulone)。
为了获得如本文所定义的具有降低量的AcHFA的啤酒,公开了三种选择:在发酵期间或之后从啤酒中去除AcHFA,通过使用ATF缺陷型酵母用于发酵来避免形成AcHFA,以及从待发酵的混合物中去除AcHFA前体。因此,本发明公开了用于增加啤酒泡沫稳定性的方法,包括发酵麦芽汁以获得所述啤酒的步骤,其中
a)使用乙酰转移酶(ATF)缺陷型酵母实现发酵;和/或
b)在发酵期间或之后将啤酒与能够吸附AcHFA的吸附剂接触;和/或
c)使麦芽汁进行由能够吸附AcHFA前体的吸附剂去除AcHFA前体的步骤。
在一个优选实施方案中,使用乙酰转移酶(ATF)缺陷型酵母(包含ATF的任何直系同源物)实现发酵,所述酵母优选是酿酒酵母(S.cerevisiae)。这种酵母可以通过酵母(优选酿酒酵母)的遗传修饰、例如通过ATF编码基因的替换或破坏(敲除)获得。在本文中,ATF缺陷型酵母意指在存在ATF基因的多个拷贝的酵母类型中,优选该ATF基因的所有拷贝均被敲除。
有两个与乙酰转移酶活性相关的基因:ATF-1和ATF-2(在酿酒酵母中)。ATF-1基因具有基因识别号854559(NCBI数据库),并且ATF-2基因具有基因识别号853088(NCBI数据库)。在其它适于发酵的酵母类型中,可以使用公知常识来定位直系同源ATF基因。如所述,在ATF-1缺陷型酵母中,优选敲除ATF-1基因的所有拷贝。在ATF-2缺陷型酵母中,优选敲除ATF-2基因的所有拷贝。
在一个实施方案中,ATF缺陷型酵母是ATF-1缺陷型酵母。ATF-1缺乏导致AcHFA形成降低约50-90%,优选约65-85%。在另一个实施方案中,ATF缺陷型酵母是ATF-2缺陷型酵母。ATF-2缺乏导致AcHFA形成降低约1-40%,优选约10-30%。在优选实施方案中,ATF缺陷型酵母至少是ATF-1缺陷型,优选ATF-2缺陷型。在更优选的实施方案中,ATF缺陷型酵母是ATF-1且ATF-2缺陷型酵母。使用ATF-1和ATF-2均缺乏的酵母导致完全防止AcHFA在发酵期间的形成。
ATF缺陷型酵母可以通过周知的方法获得,例如通过诱变,优选随机诱变,或者通过基因工程。
如本文使用的“诱变”是指在至少一个酵母细胞或其孢子的DNA中产生至少一个突变使得改变酵母细胞或孢子的遗传信息的方法。因此,诱变可以产生如上所述的ATF缺陷型酵母。
如本文使用,术语“突变”是指酵母细胞或孢子的DNA中的任何变化,并且包括但不限于点突变、一个或多个核苷酸的插入或缺失、一个或多个核苷酸的置换、移码突变和单链或双链DNA断裂(例如染色体断裂或亚端粒断裂),以及其任意组合。优选地,突变位于ATF基因中,从而产生如上所述的ATF缺陷型酵母。
诱变可以使用本领域已知的任何方法进行,包括常规的随机诱变方法(例如放射和化学处理)和重组DNA技术(例如定向诱变或定点诱变)。因此,在一个实施方案中,使至少第一种酵母的至少一个酵母细胞或孢子经历UV照射、X射线照射、γ射线照射或诱变剂的处理或者进行基因工程。
“基因工程”是本领域熟知的并且是指使用生物技术改变酵母细胞或孢子的基因组,从而引入酵母细胞或孢子的DNA的改变。
“随机诱变”是指突变的确切位点是不可预测的并且可以发生在一个或多个酵母细胞或一个或多个孢子的染色体中的任何位置的诱变技术。通常,这些方法包括使用化学试剂或照射来诱导至少一种突变。使用易错PCR可以进一步实现随机诱变,其中PCR在DNA聚合酶的拷贝精度低的条件下进行,导致PCR产物中的突变率相对较高。可以使用寡核苷酸导向诱变以在目标DNA序列中产生位点特异性突变来实现定点诱变。定向诱变是指在体内改变特定或靶向基因导致针对特定位点的基因结构的改变的诱变方法,例如通过可编程RNA引导的核酸酶,例如TALEN、CRISPR-Cas、锌指核酸酶或大核酸酶技术。
在优选实施方案中,在本发明的方法中,通过使至少一个酵母细胞或孢子经历照射(例如UV照射、X射线照射、γ射线照射)或诱变剂(优选化学试剂,例如NTG(N-甲基-N'-硝基-N-亚硝基胍)或EMS(甲磺酸乙酯))的处理来进行诱变。
在另一个优选实施方案中,发酵啤酒与能够吸附AcHFA的吸附剂接触。此外,可以在发酵前通过使麦芽汁与能够吸附AcHFA前体的吸附剂接触来从麦芽汁中去除AcHFA前体。
已经发现,为了从麦芽汁中去除AcHFA前体,以及为了在发酵期间或之后从啤酒中去除AcHFA,可以使用相同的吸附剂。换而言之,AcHFA前体和AcHFA本身吸附到基本上相同的吸附剂上。合适的吸附剂包括活性炭、疏水吸附剂、亲水吸附剂和沸石。优选地,在发酵期间或之后(优选在发酵之后)应用这些吸附剂,以从啤酒中吸附AcHFA。
为了改善无酒花啤酒的泡沫稳定性,啤酒可以与适于吸附AcHFA(或其前体)的任何吸附剂接触。因此,在优选实施方案中,啤酒是未加酒花的。任选地,啤酒可以之后加酒花,以实现进一步的泡沫稳定性增强和进一步的(风味)优点。酒花啤酒包含异α酸,其对啤酒泡沫具有进一步的稳定作用。
为了改善酒花啤酒的泡沫稳定性,啤酒优选与基本上不吸附异-α-酸的吸附剂接触。异-α-酸通过麦芽汁煮沸从酒花中得到,并且已知具有泡沫稳定作用。技术人员认识到,对于酒花啤酒也可以使用任何吸附剂,只要吸附剂对泡沫稳定性具有净改善效果即可。这可以取决于使用的酒花的量和/或发酵期间形成的AcHFA的量。在优选实施方案中,酒花啤酒在AcHFA去除步骤完成之后可以进一步加酒花。
活性炭是本领域公知的,并且可以用作吸附剂以去除AcHFA并且获得根据本发明的AcHFA降低的啤酒。然而,活性炭的缺点在于它在去除AcHFA方面不是非常有效)。此外,活性炭显著吸附异α酸,这是酒花啤酒处理中的缺点。另一个缺点在于活性炭使啤酒脱色,导致过淡的饮品,这对消费者而言没有吸引力。
疏水性吸附剂包括疏水性聚合物吸附剂,优选包含芳香族基团和/或酰基基团的聚合物吸附剂。技术人员可以基于公知常识和本文所述的方法容易地确定哪些吸附剂适于降低啤酒(或麦芽汁)中的AcHFA(或其前体)。疏水聚合物吸附剂的优点是它们在去除AcHFA(或AcHFA前体)方面非常有效。此外,保留了啤酒的颜色,并且这些吸附剂吸附了相对较少或甚至没有异α酸。因此,疏水聚合物吸附剂是优选的,例如特别是聚苯乙烯/二乙烯基苯(PS/DVB),例如由Agilent销售的PLRP-S。
亲水性吸附剂优选是亲水性聚合物吸附剂。非常优选的亲水性吸附剂是混合纤维素酯吸附剂,例如MCE(MF-Millipore
进一步优选的吸附剂是例如Supelclean
在本文中,沸石优选是疏水性沸石。这是含有摩尔比(SiO
应理解,含有SiO
根据优选实施方案,吸附剂是疏水性沸石。用于本发明方法的疏水性沸石优选具有至少40、更优选至少100、甚至更优选至少200、最优选至少250的SiO
疏水性沸石的平均孔径直径优选为0.2-1.2纳米,更优选0.3-1.0纳米,甚至更优选0.4-0.8纳米,并且最优选0.45-0.70纳米。疏水性沸石的孔径可以通过用t-plot-DeBoer方法在77K下分析氮吸附等温线来测定。
疏水性沸石的表面积优选为至少100m
疏水性沸石优选具有1-2000微米,更优选10-800微米,并且最优选100-300微米的质量加权平均粒度。颗粒疏水性分子筛的粒度分布可以使用不同筛孔尺寸的一组筛来测定。
疏水性沸石优选选自ZMS-5沸石、Y型沸石、β-沸石、硅质岩、全二氧化硅镁碱沸石、丝光沸石及其组合。更优选地,疏水性沸石选自ZMS-5沸石、Y型沸石、β-沸石及其组合。最优选地,疏水性沸石是ZMS-5沸石。
如本文公开的使用的吸附剂可以如本领域已知的应用。
为了在发酵期间去除AcHFA,发酵混合物可以与吸附剂接触,例如通过使混合物通过填充有吸附剂的柱,或者通过将吸附剂作为颗粒材料添加至发酵混合物中并且随后通过过滤、旋风分离或其它合适的技术去除吸附剂。
为了在发酵之后去除AcHFA,可以使从发酵获得的啤酒与吸附剂接触,例如通过使啤酒通过填充有吸附剂的柱,或者通过将吸附剂作为颗粒材料添加至啤酒中并且随后通过过滤、旋风分离或其它合适的技术去除吸附剂。在优选实施方案中,将从发酵获得的啤酒引入滞留罐,其中啤酒与吸附剂接触,持续例如20分钟-24小时,优选0.5-5小时的时间,以便吸附AcHFA。随后可以通过过滤去除AcHFA。或者,啤酒可以经装有吸附剂的过滤器连续过滤。
为了去除AcHFA前体,可以在发酵之前使麦芽汁与吸附剂接触,例如通过使麦芽汁通过填充有吸附剂的柱,或者通过将吸附剂作为颗粒材料添加至麦芽汁中并且随后通过过滤、旋风分离或其它合适的技术去除吸附剂。优选地,麦芽汁在调浆之前作为甜麦芽汁接触。
技术人员已知通过吸附从液体混合物中吸附不需要的组分的无数技术,并且可以应用任何技术以获得如本文定义的具有降低量的AcHFA的啤酒。合适的技术例如描述于C.Judson King,Separation Processes(第二版)McGraw-Hill,Inc.1980。
麦芽汁、发酵混合物或啤酒与吸附剂接触足以吸附AcHFA或其前体的时间。这可以由本领域技术人员基于公知常识和本文公开的方法容易地确定。优选地,接触时间为5分钟-48小时,更优选0.5-24小时,更优选1-20小时。
待使用的吸附剂的量也可以由本领域技术人员基于公知常识和本文公开的方法容易地确定。优选地,以0.001-10g/l,更优选0.01-5g/l,更优选0.05-2.5g/l的剂量使用吸附剂。
取决于啤酒的类型和性质、吸附剂的类型和量以及接触时间,AcHFA的量可以显著降低,如本领域技术人员可以容易地确定。AcHFA的量可以降低至少50%,优选至少75%,更优选至少80%。在一些实施方案中,AcHFA的量可以降低高达90%或甚至高达95%或更高。在优选实施方案中,其中通过吸附从啤酒中去除AcHFA,AcHFA的量降低至小于初始量的60%,更优选降低至小于初始量的20%,最优选降低至小于初始量的5%。
AcHFA降低的效果在于泡沫稳定性增加至少10秒,优选至少15秒,更优选至少20秒。泡沫稳定性可以增加多达40秒,或者甚至多达50秒或更高。
在更优选的实施方案中,本发明涉及用于增加啤酒的泡沫稳定性的方法,包括使通过发酵获得的啤酒与能够吸附AcHFA的吸附剂接触。吸附剂和使啤酒与吸附剂接触的方式如上所定义。如上所述,这导致具有增加的泡沫稳定性的啤酒。
出于清楚和简明描述的目的,本文描述的特征作为相同或单独实施方案的一部分,然而,应理解,本发明的范围可以包括具有所有或一些所述特征的组合的实施方案。
现在将通过以下非限制性实施例进一步例示本发明。
方法
AcHFA分析
啤酒中的AcHFA含量可以通过LC-MS分析。LC-MS系统由Waters TQ-S质谱仪和Waters Acquity UPLC系统组成。流动相由以下组成:
A:超纯水+0.1%(v/v)甲酸
B:乙腈+0.1%(v/v)甲酸
分析柱是15cm*2.1mm ID UPLC BEH C18(1.7um)柱。用以下梯度将AcHFA与其它基质成分分离:
T 0分钟:95%A,5%B
T 13分钟:70%A,30%B
T 17分钟:5%A,95%B
T 25分钟:95%A,5%B
流速设定为0.25ml/min,并且柱在50℃恒温。UPLC系统经由以负离子模式操作的电喷雾接口(ESI)连接至MS。对于以下转变记录MRM数据:m/z 355>295。锥孔电压设定在40伏特。碰撞能量设定在15eV。AcHFA检测为由结构3表示的化合物。AcHFA量以任意单位(a.u)表示,其衍生自色谱图的峰面积以提供定量结果。
啤酒中糖含量的测定
用超高效液相色谱(UPLC)测定糖含量。UPLC可以在65℃的温度下合适地进行。洗脱剂的合适选择是乙腈/水的混合物,例如75/25体积比。使用的检测器通常是折射率(RI)检测器。通过将样品的UPLC曲线与具有已知糖浓度的标准样品的校准曲线进行比较来测定样品的糖含量。
UPLC的样品制备如下。通过添加乙腈/水混合物(50/50-等体积份)将啤酒或麦芽汁的样品稀释5倍。如果存在,则在稀释(例如通过摇动或搅拌样品)之前去除CO
游离氨基氮(FAN)的测定
游离氨基氮(例如氨基酸、小分子肽和氨)的量根据氮的邻苯二甲醛测定(NOPA)方法测量。使用光度分析仪(例如GalleryTM Plus光度分析仪)进行NOPA方法。根据NOPA方法,将测试样品用邻-邻苯二甲醛(OPA)和N-乙酰半胱氨酸(NAC)处理。这种处理将导致在形成异吲哚的情况下存在于测试样品中的伯氨基基团的衍生。随后使用光度分析仪在340nm的波长下测定异吲哚的含量。然后可以基于测量的异吲哚的含量计算游离氨基氮(以mg FAN/l表示)。如果需要,首先使啤酒或麦芽汁样品进行离心以澄清样品和/或在分析之前进行CO
啤酒中乙醇的测定
使用光度分析仪(例如GalleryTM Plus光度分析仪)测量乙醇含量。使测试样品进行酶促方法,其中用醇脱氢酶(ADH)将样品中存在的乙醇转化为乙醛。随后使用光度分析仪在340nm的波长下测定乙醛含量。可以基于乙醛含量计算乙醇含量。如果需要,首先使啤酒或麦芽汁样品进行离心以澄清样品和/或在分析之前进行CO
啤酒中异α-酸的测定
使用EBC 9.47 2010定量测定异α酸:通过HPLC测定啤酒中异α-酸和降低的异α-酸(Rho、Tetra、Hexa)。
泡沫稳定性的测定
根据由NIBEM研究所设定的标准EBC 9.42.1测定泡沫稳定性。
脱气和再碳酸化
对已经脱气的普通啤酒进行从啤酒中吸附AcHFA的所有实验。在测量泡沫稳定性之前,将啤酒再碳酸化。
如下获得脱气的啤酒:
将约200ml的瓶装啤酒(4℃)小心地转移(防止起泡)至干净的500ml实验室瓶中。将含有样品的瓶放入20℃水浴中,并且轻轻摇动(40rpm)40分钟。
接着,将摇动强度增加至120rpm,并且继续摇动30分钟,以获得脱气的啤酒。在整个脱气处理期间,用氮气连续冲洗瓶子的顶部空间以防止啤酒氧化。
如下在实验室规模下实现再碳酸化。制备不锈钢Millipore容器(型号Millipore目录号xx6700p05)以允许将其用作普通啤酒桶。在添加啤酒之前,清洁桶并且用CO
使用CO
实施例1
从啤酒中去除AcHFA导致泡沫稳定
将脱气的啤酒与0.1g/l市售甲基纤维素酯吸附剂(MCE,MF-Millipore
结果表明,AcHFA至MCE的吸附以及随后从啤酒中去除AcHFA导致具有增强的泡沫稳定性的啤酒。除了吸附步骤之外,对空白对照啤酒进行相同的程序。处理之后,经处理的啤酒中的AcHFA减少至普通啤酒中的量的6.3%。空白对照啤酒具有253秒的(NIBEM)泡沫稳定性,而经MCE处理的啤酒具有296秒的泡沫稳定性。因此,去除大于90%的AcHFA导致泡沫稳定性增加17%。
已经表明,在酒花啤酒和无酒花啤酒(数据未示出)中,AcHFA去除过程均导致AcHFA的有效去除。此外,已经发现MCE没有显著吸附异α酸,并且啤酒颜色没有降低。这是有益的,因为异α酸的存在对啤酒泡沫具有进一步的稳定作用。因此,MCE是非常优选的吸附剂。
实施例2
AcHFA是泡沫消极因子
如实施例1中所述获得脱气的普通啤酒。在这种情况下,啤酒是无酒花的全麦芽啤酒。将脱气的啤酒在室温下与0.2g/l PLRP-S(Agilent)一起培养16小时以实现AcHFA的完全去除并且获得无AcHFA的无酒花啤酒。
将吸附剂过滤并分离,并且用乙腈洗涤以获得粗品AcHFA。将粗品AcHFA在反相HPLC柱(C18)中使用水至乙腈梯度分馏。将获得的级分通过添加到啤酒中来测试对泡沫稳定性的影响,并且将泡沫消极级分通过LC-MS收集和分析并且通过NMR表征为根据说明书中定义的AcHFA。因此,分离并且表征纯AcHFA。
向通过常规发酵获得的具有常规量的AcHFA的脱气的酒花啤酒和脱气的无酒花啤酒中添加额外量的纯AcHFA。在如实施例1中所述的温和均化和再碳酸化之后,如所述测定泡沫稳定性。添加的AcHFA的量示于表1中,并且表示于图2a和图2b中。
表1
结果表明,随着普通啤酒中AcHFA量的增加,啤酒的泡沫稳定性急剧下降。因此,得出结论,AcHFA是泡沫消极因素,并且具有降低量的AcHFA的啤酒具有增加的泡沫稳定性。
实施例3
具有减少量的AcHFA的啤酒具有更高的泡沫稳定性
在进一步的实验中,通过在室温下与0.2g/l PLRP-S(Agilent)培养16小时以实现AcHFA的完全去除来获得无AcHFA的酒花啤酒和无AcHFA的无酒花啤酒。在添加AcHFA至酒花啤酒之前,通过添加20mg/l异α酸(“IAA”,B-hop,Hopsteiner)来补偿吸附步骤期间异α酸的损失。随后将两种AcHFA啤酒脱气。
向无AcHFA啤酒中添加各种量的AcHFA。在如上所述的温和均化和再碳酸化之后,测定泡沫稳定性。结果示于表2以及图3a和图3b中。
表2
结果表明,将啤酒中AcHFA的量降低至低于普通啤酒中的水平,导致泡沫稳定性以AcHFA浓度依赖性方式增加。没有AcHFA的啤酒具有最高的泡沫稳定性。
实施例4
减少啤酒中的AcHFA
获得具有常规量的AcHFA的普通(无酒花)啤酒。将该啤酒如所述脱气并且以30ml份量(10柱体积)在3ml SPE柱中与相同量的各种Supelclean
表3
结果表明,各种疏水和亲水吸附剂均能减少啤酒中AcHFA的量。优选的吸附剂是LCC18、LC C8和LcPh。在优选的实施方案中,将AcHFA减少至小于初始量的60%,更优选减少至小于初始量的20%,甚至更优选减少至小于初始量的5%。
实施例5
使用PLRP-S和活性炭减少啤酒中的AcHFA
将无酒花的脱气啤酒与PLRP-S(0.1mg/l)和1.0mg/l活性炭(Aktivkohle,art.2186Merck)接触,并且随后再碳酸化。结果显示于图5中。
结果表明,PLRP-S对从啤酒中去除AcHFA更有效。此外,观察到活性炭从啤酒中去除颜色,这被认为是缺点。PLRP-S保持啤酒颜色完整。此外,PLRP-S不显著吸附异α酸。因此,PLRP-S(和MCE,参见实施例1)是相对于活性炭优选的吸附剂。
实施例6
从甜麦芽汁中去除AcHFA前体,以获得相对于常规啤酒具有降低量的AcHFA的啤酒
在常规的中试装置啤酒酿造方法中,通过以下方式用PLRP-S处理甜麦芽汁:在安装在过滤槽与麦芽汁煮锅之间的PVPP过滤器上涂覆750g PLRP-S,并且在进入麦芽汁煮锅之前用所述过滤器处理15hl的甜麦芽汁来(图6)。随后,以常规方式(酒花添加、煮沸、涡流、发酵和后处理和灌瓶)酿造啤酒。
由相同的麦芽汁,使用相同的工艺条件酿造比较啤酒,但不经负载PLRP-S的过滤器过滤甜麦芽汁。
使用如关于AcHFA所述的HPLC条件,对酒花麦芽汁(加酒花的麦芽汁)的样品分析AcHFA前体(二羟基脂肪酸)的量。对最终啤酒测定AcHFA的量。结果显示于表4中。
结果表明,通过吸附去除AcHFA前体,可以防止最终啤酒中AcHFA的形成。这导致获得的啤酒的泡沫稳定性增加。
结果进一步表明,吸附过程可应用于工业相关规模。
实施例7
通过修饰酵母获得具有减少量的AcHFA的啤酒
在该实施例中,使用CRISPR-Cas9技术构建了具有缺失ATF1和ATF2的等位基因的不同组合的巴氏酵母(S.pastorianus)野生型(WT)酵母的缺失文库。巴氏酵母WT含有来自酿酒酵母和真贝酵母(S.eubayanus)基因组的ATF1的5个拷贝和ATF2的4个拷贝。利用在巴氏酵母中起作用的CRISPR-Cas9系统,一个基因的所有拷贝在单个转化中被靶向。最后,仅在两个转化中从四个不同的染色体中缺失9个ATF1/2基因。ATF-1缺陷型酵母称为“菌株a”。ATF-2缺陷型酵母称为“菌株b”。ATF-1和ATF-2均缺失的酵母称为“菌株c”。通过在酿造相关条件下培养菌株来研究各种敲除的影响。在15柏拉图度(°Plato)麦芽汁中的标准酿造发酵期间,菌株显示出类似的生长速率、糖消耗量曲线和乙醇产生。
由野生型酵母获得突变体
按照如“CRISPR-Cas9 mediated gene deletions in lager yeastSaccharomyces pastorianus”,Arthur R.Gorter de Vries等人,Microb Cell Fact(2017)16:222中描述的方法获得突变菌株。突变的展示显示于图7a中。
在酿造条件下表征具有ATF缺失的WT
为了检查发酵性能,将菌株接种在15柏拉图度及含额外锌的高压灭菌且过滤灭菌的麦芽汁中以满足酵母的生长要求。用约5百万个细胞的相同细胞浓度接种每种菌株的3个瓶。在实验开始时和发酵7天后对所有瓶取样,用于HPLC分析。然而,在发酵期间也对每种一式三份中的一个瓶取样,以监测糖消耗和甘油、乙醇和生物质的产生,与用WT发酵进行比较。发酵后,通过HPLC分析来自每个瓶的上清液的糖、甘油和乙醇。观察到突变菌株在发酵中应用于野生型酵母时表现出基本上相同的行为。关于葡萄糖、麦芽糖、麦芽三糖和果糖的随时间的糖消耗曲线表明使用基本上相同的消耗曲线。此外,如发酵期间监测的甘油和乙醇的产生是基本上相同的。此外,细胞生长速率(通过光密度测量)基本上相同。将显示菌株a、菌株b和菌株c的乙醇产生的示例性附图合并为图7b。在所有测试的参数中,突变株显示出基本上相同的特征和基本上相同的时间进程。因此,突变菌株可以应用于现有的生产过程中,以便减少最终啤酒中的AcHFA的量。
因此,获得ATF缺陷型酵母,其可以在与WT酵母相同的条件下应用。ATF-1缺陷型酵母(菌株a)、ATF-2缺陷型酵母(菌株b)和ATF-1且ATF-2缺陷型酵母(菌株c)用于麦芽汁的标准发酵,以评估它们在标准啤酒酿造过程中的活性。将不同的酵母(5mio细胞/ml接种)在250ml输注烧瓶中的150ml全麦芽的酒花15-16P麦芽汁中发酵,在200rpm下摇动,在微需氧条件下在13C下持续7天。将获得的啤酒与用未修饰的WT酵母获得的啤酒进行比较。结果显示于表5中:
表5:
结果表明,使用ATF-1缺陷型酵母,AcHFA减少至使用野生型酵母观察到的AcHFA量的15%。使用ATF-2缺陷型酵母,AcHFA减少至使用野生型酵母观察到的AcHFA量的77%。通过使用ATF-1和ATF-2均缺乏的酵母(优选所有拷贝),可以完全抑制AcHFA的形成。
实施例8
以工业相关规模从普通啤酒中去除AcHFA,以便获得具有降低量的AcHFA的啤酒
在中试装置中使用常规方法和常规酵母酿造啤酒。酿造过程产生拉格啤酒。获得添加了异α酸(“IAA”)的拉格啤酒(20mg/l B-hop,Hopsteiner),以及不添加异α酸的啤酒。
将拉格啤酒过滤并且用PVPP稳定,储存在滞留罐中,在滞留罐中它与0.1g/lPLRP-S(Agilent)接触1或2小时。随后,过滤啤酒以去除PLRP-S和吸附的AcHFA(图8a)。或者,可以将从发酵获得的啤酒经PLRP-S-涂覆的过滤器过滤以去除AcHFA(图8b;获得的啤酒的数据未示出,但与通过图8a所示的方法获得的啤酒的数据相当)。
分析AcHFA量,并且与没有所述过滤步骤的啤酒中的量进行比较。此外,比较获得的啤酒的泡沫稳定性。
结果表明,通过将啤酒进行如用PLRP-S发酵1或2小时所获得的处理,AcHFA量可以显著减少。这对在具有和不具有添加的异α酸的啤酒中的泡沫稳定性均具有显著且积极的影响。因此,诸如PLRP-S的吸附剂可用于去除AcHFA并且增加啤酒的泡沫稳定性。
- 一种泡沫稳定性的评价方法
- 一种降低浮选泡沫稳定性的复合捕收剂及其制备方法和应用
