一种新型细胞外基质生物支架材料及其制备方法
文献发布时间:2023-06-19 10:40:10
技术领域
本发明涉及生物材料技术领域,尤其是涉及一种新型细胞外基质生物支架材料及其制备方法。
背景技术
在现代军事力量条件下发生的战争和渐渐增多的车祸等严重事故会引起颌面部战创伤,进而导致颌面部软硬组织的缺损,造成患者面部畸形和功能障碍,严重影响患者的心理健康和生存质量。目前,关于支架材料的研究受到广泛关注,成功获得理想性能的支架材料对软硬组织的修复具有重要意义。
理想的组织工程支架材料是要能被宿主骨组织逐步吸收替代,最终与自体骨形成牢固的骨性愈合。单纯的无机材料替代物具有易碎、力学性能不匹配、体内降解缓慢及愈合延迟等缺点。单纯的有机物支架材料,其结构和功能与人体骨组织差距很大存在力学强度差、降解产物堆积引起酸性环境不易于组织愈合等缺点。无机材料与有机材料的复合,虽然其结构和组成接近骨组织,但要真正在体外预构天然骨组织的纳米结构,受到目前材料制作工艺水平的限制难以达到临床需要的水平。生物可降解材料在支架方面的使用是具有划时代意义的。生物衍生骨支架材料是利用异种或异体骨,经过机械加工塑形后,用理化法、酶解法等处理掉抗原和细胞,保留其基本结构及部分生物活性的一类材料,具有很好的应用前景。
现有的组织工程支架材料还不能满足临床要求,寻找和开发新型骨支架材料迫在眉睫。
发明内容
本发明的第一目的在于提供一种新型细胞外基质生物支架材料。该生物支架材料结构致密,排列规则,有大量胶原纤维存在,具有良好的组织相容性和生物诱导能力,可以很好地修复兔子的骨软骨复合体缺损。本发明的第二目的在于提供一种新型细胞外基质生物支架材料的制备方法,该方法操作简单,应用方便。
本发明提供的一种新型细胞外基质生物支架材料,制备方法包括以下步骤:
(1)分离培养兔子的骨髓干细胞,在体外成膜诱导培养,获得骨髓干细胞膜片;
(2)将获得的骨髓干细胞膜片在磷酸缓冲盐溶液中漂洗;
(3)用十二烷基硫酸钠脱细胞液进行多次脱细胞处理,然后用磷酸缓冲盐溶液漂洗;
(4)随后加入Triton-X100去除残留的细胞碎片,再次用磷酸缓冲盐溶液漂洗;
(5)再去除残留的DNA和RNA,最后再用磷酸缓冲盐溶液漂洗,获得生物支架材料。
优选地,步骤(1)中分离培养兔子的骨髓干细胞包括以下步骤:
a.用速眠新Ⅱ号与氯胺酮混合后对兔子进行肌肉注射将兔子麻醉,俯卧位放置,进行备皮和消毒,双侧髂嵴表面用盐酸利多卡因局部浸润麻醉;
b.逐层切开双侧髂嵴皮肤皮下组织,切取双侧髂骨、四肢股骨和胫骨,去除表面骨膜及软骨,在超净工作台内用含有肝素、胎牛血清、青霉素和L-谷胺酰胺的DMEM-F12培养基冲洗髓腔,获得骨髓液;
c.将步骤b中获得的骨髓液进行过滤,将过滤后的骨髓液接种到培养皿中,置于37℃、5%CO
d.接种后第47.5-48.5小时进行一次半换液,再过71.5-72.5小时后进行一次全换液,此后每隔两天进行一次全换液,在倒置显微镜下观察细胞生长情况,选用第一代骨髓干细胞诱导成膜片。
其中,半换液即半量换液,弃掉一半旧的培养基,再加一半新的进去,这样一方面可以给细胞适应的缓冲环境;另一方面细胞生长过程中可能会分泌某些生长因子,促进细胞生长。
优选地,所述兔子为健康4周龄雄性新西兰白兔。
更优选地,步骤(1)中分离培养兔子的骨髓干细胞包括以下步骤:
a.取健康4周龄雄性新西兰白兔,用0.2mL/Kg的速眠新Ⅱ号与10mg/Kg的氯胺酮混合后对兔子进行肌肉注射将兔子麻醉,俯卧位放置,进行备皮和消毒,双侧髂嵴表面用2%盐酸利多卡因局部浸润麻醉;
b.逐层切开双侧髂嵴皮肤皮下组织,切取双侧髂骨、四肢股骨和胫骨,去除表面骨膜及软骨,在超净工作台内用含有200U/mL肝素、10%胎牛血清、100U/mL青霉素和0.27g/LL-谷胺酰胺的DMEM-F12培养基冲洗髓腔,获得骨髓液;
c.将步骤(2)获得的骨髓液用100目和200目不锈钢网分别过滤一次,将过滤后的骨髓液接种到2个直径为10cm的培养皿中,置于37℃、5%CO
d.接种后的骨髓液第48小时进行一次半换液,半换液后再间隔72小时进行一次全换液,此后每隔两天进行一次全换液,在倒置显微镜下观察细胞生长情况,选用第一代骨髓干细胞诱导成膜片。
优选地,步骤(1)中体外成膜诱导的培养基采用含58-62μg/ml抗坏血酸和20-22%胎牛血清的高糖培养基,诱导培养时间为2-4周;更优选60μg/ml抗坏血酸和20%胎牛血清的高糖培养基,诱导培养时间为3周,诱导培养2周的时候诱导的膜片比较薄,细胞外基质含量也少,诱导培养4周时间略微有点久,细胞外基质增加量不甚明显,因此3周是个比较合适的时间。
优选地,步骤(3)为:加入0.5%-1.5%的十二烷基硫酸钠脱细胞液进行脱细胞,并在30-60分钟后进行第一次更换新的十二烷基硫酸钠脱细胞液,再过1-2小时进行第二次更换新的十二烷基硫酸钠脱细胞液,再过4-6小时进行第三次更换新的十二烷基硫酸钠脱细胞液,第三次换液后脱细胞处理24-36小时,然后用磷酸缓冲盐溶液漂洗。
更优选地,步骤(3)为:加入浓度为1%的十二烷基硫酸钠脱细胞液进行脱细胞,并在30分钟后进行第一次更换新的十二烷基硫酸钠脱细胞液,再过1小时后进行第二次更换新的十二烷基硫酸钠脱细胞液,再过4小时后进行第三次更换新的十二烷基硫酸钠脱细胞液,第三次换液后脱细胞处理24小时,然后用磷酸缓冲盐溶液漂洗。采用低浓度(1%)的十二烷基硫酸钠脱细胞液能够达到完全脱掉细胞的效果,同时也保存了完整的细胞外基质成分及其功能的作用。采用本发明所述的脱细胞方式处理后,残留的细胞空间结构完好,存留的细胞外基质(ECM)结构致密,排列规则,有大量胶原纤维存在。
优选地,步骤(4)中加入Triton-X100浸泡作用29-31分钟去除残留的细胞碎片,更优选浸泡30分钟,Triton-X100的浓度为0.5%-1%。
优选地,步骤(2)中漂洗次数为三次,步骤(3)中漂洗次数为三次,步骤(4)中漂洗次数为三次,漂洗时间均为4.5-5.5分钟,优选5分钟,漂洗采用恒温振荡器进行,转速为145-155rpm,优选150rpm。
优选地,步骤(5)为:加入含有DNA酶和RNA酶的DMEM浸泡作用23.5-24.5小时去除残留的DNA和RNA,优选浸泡24小时,所述DMEM中DNA酶和RNA酶的含量均为1%,最后再用磷酸缓冲盐溶液漂洗,获得生物支架材料。
优选地,步骤(5)中再用磷酸缓冲盐溶液漂洗为:再用磷酸缓冲盐溶液漂洗三次,每次2.5-3.5分钟,优选3分钟,然后再用磷酸缓冲盐溶液漂洗24-36小时。
本发明所述的一种新型细胞外基质生物支架材料的制备方法,包括以下步骤:
(1)分离培养兔子的骨髓干细胞,在体外成膜诱导培养,获得骨髓干细胞膜片;
(2)将获得的骨髓干细胞膜片在磷酸缓冲盐溶液中漂洗;
(3)用十二烷基硫酸钠脱细胞液进行多次脱细胞处理,然后用磷酸缓冲盐溶液漂洗;
(4)随后加入Triton-X100去除残留的细胞碎片,再次用磷酸缓冲盐溶液漂洗;
(5)再去除残留的DNA和RNA,最后再用磷酸缓冲盐溶液漂洗,获得生物支架材料。
综上所述,本发明具有以下优点:
(1)本发明所述的新型细胞外基质生物支架材料,可以用于组织再生,具有修复骨和软骨缺损的作用。
(2)本发明所述的新型细胞外基质生物支架材料来源于干细胞,可以更好的募集和调控干细胞的生物学功能,并在合适的微环境下分化为目的组织,从而用于缺损组织的修复再生。
(3)本发明所述的新型细胞外基质生物支架材料,具有独特的3D空间结构和含有的生物活性成分可以募集体内的干细胞达到缺损部位,并调控该募集而来的干细胞的生物学行为,从而启动修复再生机制,修复缺损组织,达到组织再生的目的。
(4)本发明所述的新型细胞外基质生物支架材料,来源于干细胞,消除了抗原性,组织相容性、生物降解性能和生物诱导能力。相较于以往研究中所用的软骨组织膜片,采用低浓度的脱细胞液脱细胞处理,从而维持了细胞膜片中原有的生物活性成分和支架结构,进而维持了其三维空间结构,有利于细胞的迁移、增殖和分化等生物学行为。
(5)本发明为细胞外基质支架提供了很好的研究思路,为干细胞在细胞外基质支架中的应用提供了可行的方案和经验,这也为将来制备同种异体甚至是异种的干细胞来源的细胞外基质支架材料用于无细胞移植修复缺损组织提供了依据和研究基础,也为无细胞(Cell-Free)移植概念在组织工程和再生医学中的应用提供了研究思路。
(6)采用本发明制备方法进行脱细胞方式处理后,残留的细胞空间结构完好,存留的细胞外基质(ECM)结构致密,排列规则,由大量纵横排列的胶原纤维组成,当骨髓干细胞膜片中的细胞被脱细胞去除后,残留的细胞空间结构完好。
附图说明:
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意型实施例及其说明用于解释本申请,并不构成对本申请的不当限定。以下,结合附图来详细说明本发明的实施方案,其中:
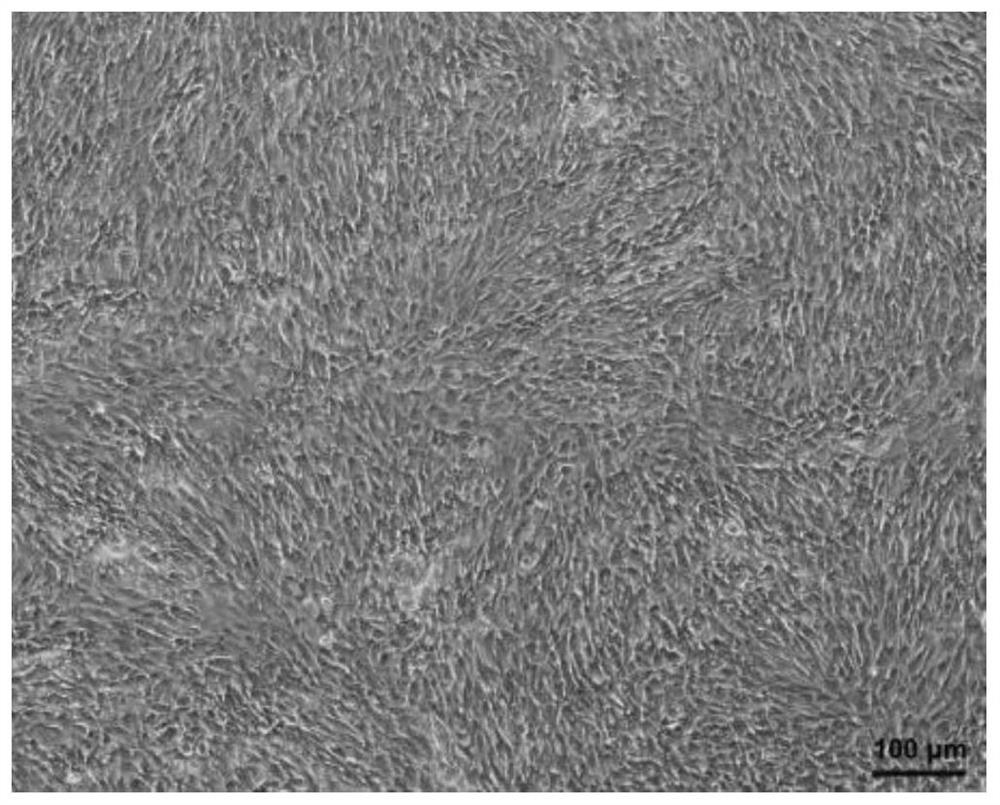
图1为实施例1制备的骨髓干细胞成膜诱导后显微镜下的结构图;
图2为实施例1制备的骨髓干细胞膜片脱细胞后大体观图片;
图3为实施例1制备的生物支架材料的HE染色图;
图4为实施例1制备的生物支架材料的扫描电镜图;
图5为实施例1制备的生物支架材料的透射电镜图;
图6为动物实验中移植后缺损修复效果图;
图7为动物实验中为空白对照组与实施例制备的生物支架材料ECM移植16周治疗后的组织切片的大体观图片;
图8为动物实验中为空白对照组与实施例制备的生物支架材料ECM移植16周治疗后的组织切片番茄红O染色图片;
图9为动物实验中为空白对照组与实施例制备的生物支架材料ECM移植16周治疗后的组织切片马松三色染色图片。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一种新型细胞外基质生物支架材料,制备方法包括以下步骤:
(1)将从新西兰大白兔(四周龄)中分离培养的骨髓干细胞(BMSCs)在体外成膜诱导培养,诱导培养基采用含60μg/ml抗坏血酸和20%胎牛血清的高糖培养基,培养3周后得到BMSCs膜片,其结构如图1所示,(2)将BMSCs膜片用磷酸(PBS)缓冲盐溶液漂洗3次,每次5分钟,漂洗采用恒温振荡器进行,转速为150rpm,然后加入1%的十二烷基硫酸钠(SDS)脱细胞液进行脱细胞,并在30分钟后进行第一次更换新的十二烷基硫酸钠脱细胞液,再过1小时进行第二次更换新的十二烷基硫酸钠脱细胞液,再过4小时进行第三次更换新的十二烷基硫酸钠脱细胞液,第三次换液后脱细胞处理24小时,(3)再次用磷酸缓冲盐溶液漂洗三次,每次5分钟,漂洗结束后加入1%的Triton-X100浸泡作用30分钟去除可能残留的细胞碎片,再次用PBS缓冲盐溶液漂洗三次,每次5分钟,(4)再加入含有DNA酶和RNA酶含量均为1%的DMEM培养基浸泡作用24小时去除残留的DNA和RNA,再用磷酸缓冲盐溶液漂洗三次,每次三分钟,最后再用磷酸缓冲盐溶液漂洗24小时,获得所需的生物支架材料,如图2所示。
其中,步骤(1)中分离培养兔子的骨髓干细胞包括以下步骤:
a.取健康4周龄雄性新西兰白兔,将0.2mL/Kg速眠新Ⅱ号与10mg/Kg氯胺酮混合后对兔子进行肌肉注射将兔麻醉,将兔子俯卧位固定于操作台上,备皮,消毒,双侧髂嵴表面用2%盐酸利多卡因局部浸润麻醉,其中备皮、消毒为本领域的常规操作;
b.逐层切开双侧髂嵴皮肤皮下组织,切取双侧髂骨、四肢股骨和胫骨,去除表面骨膜及软骨,在超净工作台内以含有200U/mL肝素的DMEM-F12培养基(含10%胎牛血清、100U/mL青霉素、0.27g/L的L-谷胺酰胺)10mL冲洗髓腔,获得骨髓液;
c.将获得的骨髓液用100目和200目不锈钢网分别过滤一次,然后接种到2个直径为10cm的培养皿中,置于37℃、5%CO
d.接种后的骨髓液第48h进行一次半换液,半换液后再间隔72h后进行一次全换液,在换液前反复摇晃培养皿使未贴壁细胞悬浮,能够比较彻底地完全清除未贴壁细胞,此后每隔2日给进行一次全换液,逐渐纯化,倒置显微镜下观察细胞生长情况,实验选用第一代骨髓干细胞诱导成膜片。
对本实施例1制备的生物支架材料进行苏木精-伊红(HE)染色,如图3所述,可见骨髓干细胞膜片脱细胞处理后存留的生物支架材料有大量红染的胶原纤维组成,排列较致密。
如图4所示,从扫描电镜图上可以观察到本实施例1制备的骨髓干细胞膜片脱细胞处理后,残留大量原有细胞存在的空间结构,且保存完好,存留的生物支架材料结构致密,排列规则,有大量胶原纤维存在。
如图5所示,从透射电镜图上可以观察到本实施例1制备的生物支架材料是由大量纵横排列的胶原纤维组成,当骨髓干细胞膜片中的细胞被脱细胞去除后,残留的细胞空间结构完好。
实施例2
一种新型细胞外基质生物支架材料,制备方法包括以下步骤:
(1)将从新西兰大白兔中分离培养的骨髓干细胞(BMSCs)在体外成膜诱导培养,诱导培养基采用含58μg/ml抗坏血酸和22%胎牛血清的高糖培养基,培养2周后得到BMSCs膜片,其结构如图1所示,(2)将BMSCs膜片膜片用磷酸(PBS)缓冲盐溶液漂洗3次,每次5分钟,漂洗采用恒温振荡器进行,转速为150rpm,然后加入1.5%的十二烷基硫酸钠(SDS)脱细胞液进行脱细胞,并在40分钟后进行第一次更换新的十二烷基硫酸钠脱细胞液,再过1.5小时进行第二次更换新的十二烷基硫酸钠脱细胞液,再过6小时进行第三次更换新的十二烷基硫酸钠脱细胞液,第三次换液后脱细胞处理36小时,(3)再次用磷酸缓冲盐溶液漂洗三次,每次5分钟,漂洗结束后加入0.5%的Triton-X100浸泡作用30分钟去除可能残留的细胞碎片,再次用PBS缓冲盐溶液漂洗三次,每次5分钟,(4)加入含有DNA酶和RNA酶含量均为1%的DMEM培养基浸泡作用24小时去除残留的DNA和RNA,再用磷酸缓冲盐溶液漂洗三次,每次三分钟,最后再用磷酸缓冲盐溶液漂洗30小时,获得所需的生物支架材料,如图2所示。
其中,步骤(1)中分离培养兔子的骨髓干细胞包括以下步骤:
a.取健康4周龄雄性新西兰白兔,将0.2mL/Kg速眠新Ⅱ号与10mg/Kg氯胺酮混合后对兔子进行肌肉注射将兔麻醉,将兔子俯卧位固定于操作台上,备皮,消毒,双侧髂嵴表面用2%盐酸利多卡因局部浸润麻醉,其中备皮、消毒为本领域的常规操作;
b.逐层切开双侧髂嵴皮肤皮下组织,切取双侧髂骨、四肢股骨和胫骨,去除表面骨膜及软骨,在超净工作台内以含有200U/mL肝素的DMEM-F12培养基(含10%胎牛血清、100U/mL青霉素、0.27g/L的L-谷胺酰胺)10mL冲洗髓腔,获得骨髓液;
c.将获得的骨髓液用100目和200目不锈钢网分别过滤一次,然后接种到2个直径为10cm的培养皿中,置于37℃、5%CO2的孵箱内培养;
d.接种后的骨髓液第48h进行一次半换液,半换液后再间隔72h后进行一次全换液,在换液前反复摇晃培养皿使未贴壁细胞悬浮,能够比较彻底地完全清除未贴壁细胞,此后每隔2日进行一次全换液,逐渐纯化,倒置显微镜下观察细胞生长情况,实验选用第一代骨髓干细胞诱导成膜片。
通过动物实验检测实施例1制备的生物支架材料在动物体内是否具有修复骨和软骨缺损的作用。
选取成年新西兰大白兔用直径为5mm、深为7mm、并标有刻度的口腔种植用的取骨环钻,用取骨环钻在大白兔的股骨关节上面造一直径为5mm、深为4mm的骨软骨复合体缺损模型,然后将上述实施例1中制备的生物支架材料直接移植到缺损部位,待移植16周后取材观察。如图6所示,左边为未植入生物支架材料的空白对照组的图片,右边为实验组生物图片,16周后可以发现实施例1制备的生物支架材料可以很好地修复兔子的骨软骨复合体缺损,说明利用本发明提供的方法制备的生物支架材料可以用于兔子体内的组织再生。
从移植16周后的组织切片(组织切片为动物实验中移植后兔子膝关节骨软骨缺损部位的组织切片,将获得的兔子膝关节骨软骨缺损标本利用本领域常用的现有技术进行脱钙、脱水、包埋等步骤制备而成)也可以看到,如图7、图8和图9所示,移植的细胞外基质在整个缺损修复的过程中,起到诱导干细胞募集和归巢、促进细胞增殖和分化以修复缺损组织,并最终被新生的组织所替代,其中图7为空白对照组与实施例1制备的生物支架材料ECM移植16周治疗后的组织切片的大体观图片,图8为空白对照组与实施例1制备的生物支架材料ECM移植16周治疗后的组织切片的番茄红O染色图片,图9为空白对照组与实施例1制备的生物支架材料ECM移植16周治疗后的组织切片的马松三色染色图片。从上述的组织学切片结果可以看出来,在空白对照组的骨软骨复合体缺损部位,仅有少量散在的骨组织和零散的软骨组织形成,缺损的深面几乎没有修复组织。而相反在细胞外基质(ECM)治疗组的骨软骨复合体缺损部位,从图8和图9中都可以非常清晰地看到兔子膝关节骨软骨缺损修复的效果:在组织切片的表面有一层番红O染色红染的软骨组织层(高倍镜下可见到该新生软骨组织为透明软骨,且与缺损周边的原软骨组织联结良好,无组织缺损出现),在新生软骨层的深面,则是新生的骨小梁结构,与正常骨软骨组织非常接近。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 一种新型细胞外基质生物支架材料及其制备方法
- 一种三维生物支架材料及制备方法
