孕激素在治疗细胞因子释放综合征中的应用
文献发布时间:2023-06-19 10:40:10
技术领域
本发明属于免疫性疾病和感染类疾病治疗领域,具体地,本申请提供了己酸羟孕酮在制备抑制细胞因子风暴,特别是PBMC细胞因子释放的药物中的应用。
背景技术
细胞因子释放综合征(cytokine release syndrome,CRS)是指淋巴细胞在机体受到感染或者应用单克隆抗体、细胞因子等治疗后出现活化、溶解,并释放出大量细胞因子所导致的一组临床综合征。这一现象最早在20世纪90年代初抗移植排斥反应药莫罗莫那-CD3单抗(OKT3)的使用中即已被发现。2006年3月,在单克隆抗体TGN1412的英国I期临床试验中,试验组6名健康男性出现了多器官的衰竭,其中2名出现深度昏迷,后证实与诱发机体CRS有关。这次事件使科学界和药品管理机构对单克隆抗体的临床前研究尤其是CRS重新进行了审视,并提出了相应的临床试验指导原则。CRS早期的临床表现易与输注反应相混淆,典型症状多表现为轻中度,一般症状有发热、疲乏、肌肉关节酸痛,以及皮肤、呼吸、心血管、胃肠道、凝血和神经系统等相关症状如皮疹、呼吸急促、心动过速、低血压、呕吐、腹泻、出血、精神异常、抽搐或惊厥等。部分症状是因肺脏、肝脏和脾脏等器官内的网状内皮系统清除抗原-抗体免疫复合物而引起,少数患者也可能出现严重反应甚至猝死。CRS是器官移植、新冠肺炎、CAR-T和大分子药物治疗后患者的主要致死原因之一,据报道高达93%的CAR-T治疗患者和20%的新冠肺炎患者会产生不同程度的CRS。
CRS的启动机制尚未完全明确,通常认为其是由特定炎性细胞活化引起,尤其是单核细胞、巨噬细胞、T细胞和B细胞。目前已知的CRS可能发生机制包括:1)可溶性抗体通过其抗原特异性决定簇与相应细胞表面的抗原结合,效应细胞发生活化,释放大量细胞因子;2)抗体通过其Fc段与非效应细胞的Fc受体结合,产生类似旁观者效应,激活相应结合细胞释放细胞因子;3)单克隆抗体的鼠源性部分产生的“抗抗体”激活免疫学反应,释放细胞因子。已有的临床观察表明,至少7个细胞因子水平在血清中的增高与患者发生CRS具有明确的相关性,包括:白细胞介素-5(IL-5)、白细胞介素- 6(IL-6)、白细胞介素-10(IL-10)、干扰素-γ(IFN-γ)、粒-巨噬细胞集落刺激因子(GM-CSF)、分形趋化因子(Fractalkine)和人FMS样酪氨酸激酶3配体(Flt- 3L)。此外,人体的免疫系统作为一个非常复杂的体系,还存在着多种机制交叉反应和激活。抗体的亲和力、抗体的表位、抗原的特性、抗体Fc段与Fc受体的结合等,甚至穿膜蛋白胞内部分激活一系列的信号转导均会影响CRS的发生,从而也造成其临床表现的多样化。
目前临床治疗CRS主要是以对症处理为主,常用的治疗措施包括:1)生命支持。维持体温、肠道内外营养和能量供给;2)呼吸支持。一般氧疗,机械通气和表面活性物质等;3)循环支持。调整出入量,维持水电解质酸碱平衡。酌情使用胶体、晶体、血管活性药物和弥漫性血管内凝血时肝素的使用;4)皮质类固醇,对乙酰氨基酚和抗组胺药如苯海拉明等,可以预防性使用,在发病时亦可以重复使用;5)其他,包括血液滤过和持续肾脏替代治疗等。迄今为止,临床上仍然缺乏安全有效的、针对CRS病因进行治疗的药物。比如用于治疗CAR-T引起的CRS的IL-6受体拮抗剂托珠单抗 (Tocilizumab),会加剧神经毒性的发生率以及严重等级。且当托珠单抗对CAR-T患者无效时,只能大量使用具有副作用的糖皮质激素进行治疗。鉴于此,针对CRS病因来治疗该疾病的药物在本领域中仍存在着极大的需求。
现阶段体外诱导CRS最为灵敏的模型是固定化抗体刺激外周血单核细胞(peripheral blood mononuclear cell,PBMC)模型。人的PBMC是由淋巴细胞包括T 细胞、B细胞和NK细胞,以及单核细胞和少量树突状细胞组成,其中淋巴细胞约占 PBMC的70-90%,又以CD3+T细胞所占比例最高,约45-70%。已知淋巴细胞在机体受到刺激后出现活化、溶解,并释放出大量细胞因子是CRS的最主要发病机理。因此,本实施例亦采用人类PBMC刺激模型来筛选抑制细胞因子释放的潜在药物。
发明内容
为抑制细胞因子风暴并治疗相关疾病,以及体外科研用途,我们筛选了大量候选药物,其中处于研发阶段的己酸羟孕酮是一种具有高疗效和低副作用潜力的候选药品。试验结果证明,己酸羟孕酮可以浓度依赖性地抑制多种抗体或刺激物质引起的PBMC细胞因子释放,是一种治疗细胞因子风暴或抑制细胞因子释放的潜力药物或试剂。
一方面,本申请提供了孕激素在制备抑制细胞因子风暴综合征的药物中的应用。
另一方面,本申请提供了抑制细胞因子风暴的方法,其特征在于,包括施用孕激素。
再一方面,一种用于抑制细胞因子风暴综合征的药物组合物,其特征在于,包含孕激素。
进一步地,本申请中所述的孕激素为己酸羟孕酮、醋酸甲羟孕酮和/或黄体酮,优选为己酸羟孕酮。
进一步地,所述方法中的细胞因子风暴为PBMC的细胞因子释放,这种释放可以发生在体内或者体外。
进一步地,PBMC释放的细胞因子选自IL-2,IL-6,IL-10、TNF-α、IFN-γ中的一种或多种。
进一步地,本申请中所述的细胞因子释放综合征为感染,抗体治疗,器官移植或CAR-T治疗引起的细胞因子释放综合征;优选抗体治疗、器官移植或CAR-T治疗引起的细胞因子释放综合征。
进一步地,所述抗体治疗中包括使用抗CD28抗体和/或CD3抗体;或者所述CAR-T治疗中的CAR包含CD28抗体和/或CD3抗体或其活性部分。
进一步地,所述CD28抗体为ANC28.1/5D10,所述CD3抗体为OKT3。
本申请中所述的抗体包含针对某抗原的现有技术已知的各种抗体,包括但不限于单克隆抗体、多克隆抗体、单链抗体、纳米抗体等;这些抗体的活性部分或者片段本领域技术人员可以根据需要截取。
本申请中己酸羟孕酮也被称为17-α己酸羟孕酮、17-HPC、17-己酸羟孕酮、17-羟己孕酮,CAS编号为630-56-8,在实施例和附图部分中简写为HPC。
本申请中的药物可以为临床上任何可接受的剂型形式,本申请的治疗中药物可以以临床上任何可接受的剂型形式施用。具体剂型包括但不限于:片剂、胶囊剂、口服液、针剂、粉针剂等。
本发明所制备的药物中还可以含有其他已知和未知的治疗相关疾病的药物,本发明的治疗方法中也可以使用其他已知和未知的治疗相关疾病的药物,这些药物包括但不限于:用于治疗自身免疫疾病的药物,如免疫抑制剂、过氧化物酶体增殖物激活受体激动剂、鞘氨醇-1-磷酸酯受体激动剂、环氧化酶抑制剂、抗氧化剂、抗肿瘤坏死因子治疗、静脉注射免疫球蛋白以及其他疗法。用于治疗感染的药物,如抗生素、抗真菌药、病毒复制抑制剂、病毒侵入抑制剂,以及治疗相关疾病中发烧、呕吐、皮肤问题等症状的已知和未知药物。
根据制备/施用的剂型,药物中可以选用各种药学可接受的辅料,包括但不限于包衣材料、溶剂、增溶剂、粘合剂、稳定剂、抗氧化剂、pH调节剂、矫味剂,这些辅料成分本领域技术人员可以根据药剂学常识选用。
附图说明
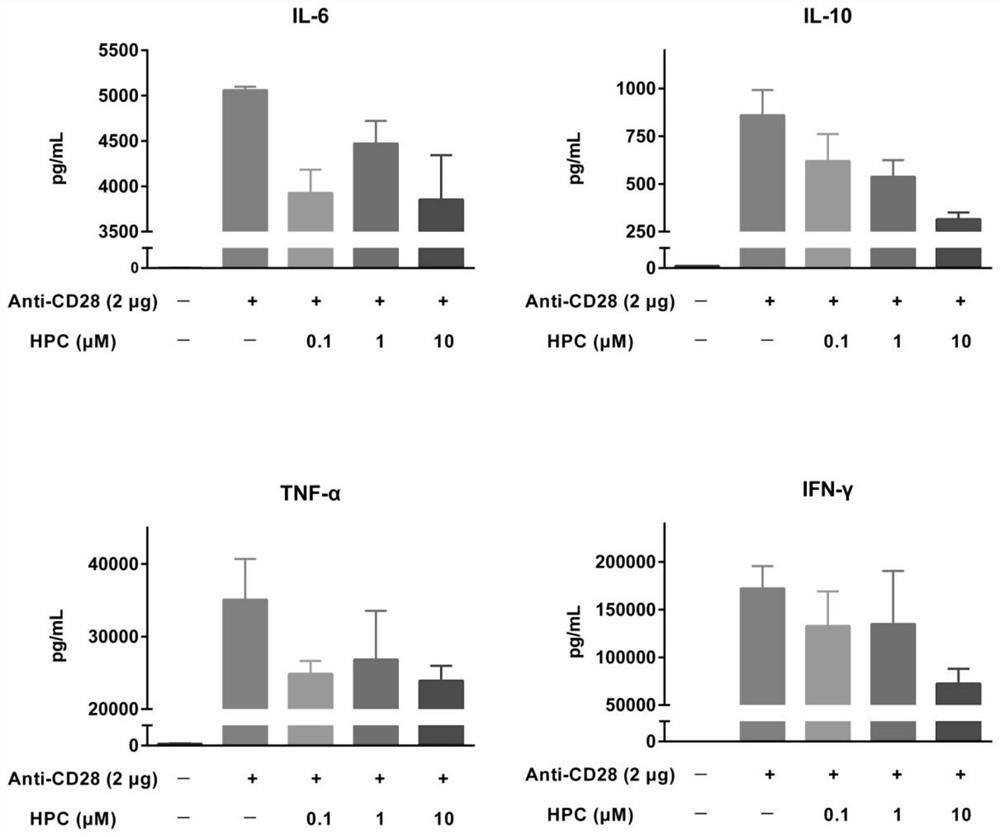
图1HPC抑制抗CD28诱导的人外周血单核细胞中IL-6,IL-10,TNF-α和IFN- γ释放的数据(数据为平均值±标准差,n=3);
图2HPC抑制OKT3诱导的人外周血单核细胞中IL-6,IL-10和IFN-γ释放的数据(数据为平均值±标准差,n=3);
图3为HPC抑制抗PHA诱导的人外周血单核细胞中IL-2,IL-6,IL-10和TNF-α释放的数据(数据为平均值±标准差,n=3)。
具体实施方式
以下实验中采用的人外周血单核细胞(PBMCs)是来源于Eurofins Discovery(StCharles,MO,USA),混合自3个健康人类供试者(Lot#98,99,101)。
实施例1己酸羟孕酮(HPC)抑制人外周血单核细胞(PBMCs)内的细胞因子释放
1)采用抗CD28超激动剂的T细胞炎症抑制实验方法
第一天
将溶于PBS 1x的抗CD28超激动剂(clone ANC28.1/5D10,2μg/孔)接种于高结合力酶标板内,并在生物安全柜内开盖孵育过夜,固定风干。冻存PBMCs滴融化冻,混合并稀释至适当密度,接种入U形底的聚丙烯96孔板(1.2x105 cells每孔),每孔加入 228μL的培养基(RPMI 1640,10%热灭活胎牛血清,1%青霉素/链霉素,2mM L-谷氨酰胺)。细胞在加入HPC之前在37℃,5%CO2孵育1小时。HPC溶于50%的乙醇 &PBS,并进一步用20X的细胞培养基进行稀释。将HPC加入PBMCs中,平行重复三组,每组12μL(1X),37℃,5%CO2孵育16小时。
第二天
孵育16小时后,将200μL(1x105)加入HPC或对照试剂的细胞转移至接种抗 CD28的酶标板内,在37℃,5%CO2孵育48小时。对于阴性对照组,将200μL (1x105)的细胞转移至接种抗CD28或同型IgG1的酶标板内。孵育48小时后,酶标板在200x g下离心10分钟。收集细胞培养上清,并保存于-80℃直至分析。
2)采用抗CD3(OKT3)或PHA的T细胞炎症抑制实验方法
第一天
冻存PBMCs经过滴融化冻,混合并稀释至适当密度,接种入聚丙烯96孔板(2x105cells每孔)并在每孔内加入150μL的培养基(RPMI 1640,10%热灭活胎牛血清,1%青霉素/链霉素,2mM L-谷氨酰胺)。在加入HPC之前,细胞于37℃,5%CO2下孵育1 小时。HPC溶于50%的乙醇&PBS,并进一步用20X的细胞培养基进行稀释。将HPC加入 PBMCs中,平行重复三组,每组10μL(1X),37℃,5%CO2孵育16小时。
第二天
孵育16小时后,根据实验设计向酶标板的孔内加入40μL的抗CD3(OKT3,3μ g/孔or15μg/mL)或PHA(10μg/mL),并在37℃,5%CO2孵育48小时。孵育48 小时后,酶标板在200 xg下离心10分钟。收集细胞培养上清,并保存于-80℃直至分析。
细胞因子的测定
每个样品的细胞因子水平测定是采用Luminex方法,并按照厂商提供的实验操作进行。对细胞培养上清的细胞因子水平测定,是使用由Millipore Sigma(catalogue No.HCYTOMAG-60K)提供的人细胞因子/趋化因子磁珠并按照厂商提供的实验操作进行的,标准范围为3.2,16,80,400,2000,10000pg/mL。
本实验对下列细胞因子进行测定:IFN-γ,IL-2,IL-6,IL-10和TNF-α。
结果表明:
1.抗CD28成功刺激人外周血单核细胞中特定细胞因子的释放,其中IL-6,IL-10,TNF-α和IFN-γ的释放受到HPC的显著抑制,且其对于IL-10和IFN-γ释放的抑制具有浓度依赖性。
2.OKT3成功刺激人外周血单核细胞中特定细胞因子的释放,其中IL-6,IL-10和IFN- γ的释放受到HPC的显著抑制,且其对于IL-6和IL-10释放的抑制具有浓度依赖性。
3.PHA成功刺激人外周血单核细胞中特定细胞因子的释放,其中IL-2,IL-6,IL-10和 TNF-α的释放受到HPC的显著抑制,并显示出浓度依赖性。
- 孕激素在制备治疗细胞因子释放综合征的药物中的应用
- CDK7靶向抑制剂在制备治疗细胞因子释放综合征药物中的应用
