一种制备人工熊胆粉的工程酿酒酵母及方法
文献发布时间:2023-06-19 10:57:17
技术领域
本发明属于生物技术和医药领域,具体涉及采用工程酿酒酵母制备人工熊胆粉的方法。
背景技术
熊胆粉为熊科动物黑熊(Ursus thibetanus)、棕熊(Ursus arctos)等经胆囊手术引流胆汁而得的干燥品,临床作为熊胆药物使用,具有清热解毒、平肝明目、杀虫止血等功效,临床多用于治疗肝胆和眼科疾病。胆汁酸类是熊胆粉中含量最高且研究最多的活性成分,其主要有效成分为牛磺熊去氧胆酸(TUDCA)。
当前,活体引流熊胆汁是获取熊胆粉的主要方式,并形成产业规模。活体引流技术分无管和有管两种。通常需要选择健康的熊,麻醉后,开腹先进行手术埋管或造瘘。有管引流可能会导致插管处频繁出现炎症,从而影响胆汁的产量和质量,严重的还会使胆汁引流中断。无管引流是在手术时选择胆囊合适部位置管进行人工造瘘,待导管排出后,创口基本愈合,即可形成胆囊底瘢痕组织和瘘道。这些方式都会严重危害熊科动物的健康与保护,故争议极大。
天然熊胆粉的特征活性成分为牛磺熊去氧胆酸(TUDCA),也含有牛磺鹅去氧胆酸(TCDCA),且TUDCA:TCDCA在1.0:1.0~1.5:1.0之间。家禽胆汁与熊胆汁在化学成分组成上的差异为:家禽胆汁中牛磺鹅去氧胆酸(TCDCA)为主要成分,且不含有TUDCA。化学结构上,TUDCA是TCDCA在C-7位羟基的差向异构体。研究表明,TUDCA可由TCDCA经由氧化还原化学反应生成。TCDCA依次经过7α-羟基类固醇脱氢酶(7α-HSDH)和7β-羟基类固醇脱氢酶(7β-HSDH)的催化转变成TUDCA。其反应方程式如下图所示:
将生物技术应用于熊去氧胆酸化合物的定向生物合成,由此将低值的家禽胆汁制品转化为高附加值产物,既可以作为熊胆粉的替代资源,可以很大程度上解决药用熊胆粉来源问题,也可以作为新的药用资源,具有强大竞争力和潜力。酿酒酵母被称为绿色安全微生物,广泛应用于食品医药行业。利用工程改造酿酒酵母对家禽胆汁中TCDCA进行定向转化,在人工熊胆粉方面具有较为突出的优势。通过基因工程技术调控关键酶表达量与活性,可以实现TCDCA到TUDCA定向转化,从而实现资源的综合利用,更加有效地解决医药市场需求。
发明内容
本发明旨在提供一种用于生产人工熊胆粉的工程酿酒酵母。
本发明提供了一种用于生产人工熊胆粉的方法。
本发明通过遗传改造的酿酒酵母中表达的外源酶将家禽胆汁制品中的牛磺鹅去氧胆酸(TCDCA)成分转化为一定比例的牛磺熊去氧胆酸(TUDCA)。
本发明要解决的技术问题在于采用绿色安全的工程酿酒酵母,以家禽胆汁制品为底物,通过工程酿酒酵母制备的粗酶,在体外将底物中的牛磺鹅去氧胆酸(TCDCA)部分地原位转化为牛磺熊去氧胆酸(TUDCA)的方法,提供一种绿色、健康、环保的以安全型酿酒酵母为载体,通过表达外源酶催化制备人工熊胆粉的方法。
为了解决上述问题,本发明采用的技术方案如下:
一种工程酿酒酵母,含有7α-HSDH基因的重组载体和7β-HSDH基因的重组载体。
7α-HSDH基因和7β-HSDH基因分别表达7α-羟基类固醇脱氢酶和7β-羟基类固醇脱氢酶。
7α-HSDH分别来源于撒丁岛梭菌(Clostridium sardiniense strain DSM599,GenBank登录号:JN191345.1)和大肠杆菌(Escherichia coli strain TW14359,GenBank登录号:CU928163.2);
7β-HSDH基因分别来源于撒丁岛梭菌(Clostridium sardiniense strainDSM599,GenBank登录号:JN191345.1)和活泼瘤胃球菌(Ruminococcus gnavus strainN53,GenBank登录号:KF052988.1);
分别采用http://www.jcat.de/在线软件以大肠杆菌为宿主菌,根据密码子偏好性,对上述两个7α-HSDH和7β-HSDH全基因序列进行密码子优化,并进行全基因合成,分别记为α
所述的7α-HSDH基因的核苷酸序列如SEQ ID No.1或SEQID No.2所示;所述的7β-HSDH基因的核苷酸序列如SEQ ID No.3或SEQID No.4所示;更优选的,所述7α-HSDH基因的核苷酸序列如SEQID No.2所示,7β-HSDH基因的核苷酸序列如SEQID No.4所示。
所述的载体为pRS424和pRS426质粒;更进一步,7α-HSDH基因连接到pRS424质粒上,7β-HSDH基因连接到pRS426质粒上;
所述的酿酒酵母宿主菌为CEN.PK2-1C或W303a,更优选的,所述的酿酒酵母宿主菌为CEN.PK2-1C。
所述工程酿酒酵母的构建方法如下:
(1)载体构建:将7α-HSDH和7β-HSDH基因分别连接到载体上得到重组载体;
(2)工程酿酒酵母构建:将连接了7α-HSDH和7β-HSDH基因的重组载体分别转导到酿酒酵母菌感受态细胞中,得到工程酿酒酵母。
优选的,步骤(1)中,所述的7α-HSDH基因的核苷酸序列如SEQ ID No.1或SEQIDNo.2所示;所述的7β-HSDH基因的核苷酸序列如SEQ ID No.3或SEQID No.4所示;更优选的,所述7α-HSDH基因的核苷酸序列如SEQID No.2所示,7β-HSDH基因的核苷酸序列如SEQIDNo.4所示。
所述的载体为pRS424和pRS426质粒;更进一步,7α-HSDH基因连接到pRS424质粒上,7β-HSDH基因连接到pRS426质粒上;
步骤(2)所述的酿酒酵母菌为CEN.PK2-1C或W303a,更优选的,所述的酿酒酵母菌为CEN.PK2-1C。
携带重组载体的工程酿酒酵母发酵后收集菌体,破碎取粗酶液。可以用酸洗玻璃珠法或者均质机破碎法制备粗酶液。
具体的,取工程酿酒酵母菌体,洗涤后用细胞破碎缓冲液重悬,采用酸洗玻璃珠涡旋混合-冰浴,重复3-15次,充分裂解细胞;或采用匀质机破碎细胞,所得混合物即为粗酶液。细胞破碎缓冲液组成如下:pH4.5~7.5、含0~15wt%甘油的5~200mM磷酸钠盐缓冲液。优选的,细胞破碎缓冲液中甘油含量为0~5wt%。
粗酶液可以进一步干燥制成粗酶粉;可采用冷冻干燥或者真空冷冻干燥制备粗酶粉。
上述工程酿酒酵母、粗酶粉或者粗酶液可以在体外将底物中的牛磺鹅去氧胆酸(TCDCA)部分地原位转化为牛磺熊去氧胆酸(TUDCA),因此可以用于制备人工熊胆粉。
一种制备人工熊胆粉的方法,步骤包括:
(1)将家禽胆汁制品溶液、NADP
所述的家禽胆汁制品溶液为pH4.5~7.5的5~200mM磷酸钠盐缓冲液和家禽胆汁制品混合物;反应体系中,家禽胆汁制品的含量为3-30g/L,优选为4-25g/L;以NADPNa计,反应体系中NADP
含有7α-HSDH基因的重组载体和7β-HSDH基因的重组载体的工程酿酒酵母经过破碎得到所述的粗酶液或者粗酶粉菌;反应体系中粗酶液或者粗酶粉溶液的体积比为5%-50%,优选为12%-35%;粗酶液与酵母工程菌培养液体积比为1-3:100;
(2)停止反应,过滤或离心,取无沉淀清液;停止反应的方法为沸水浴5~10分钟,冷却;
(3)过大孔树脂用水和乙醇溶液洗脱,浓缩干燥得到人工熊胆粉;具体为:用H
步骤(1)所述的粗酶液通过以下方法制备:含有携带7α-HSDH基因的重组载体和携带7β-HSDH基因的重组载体的工程酿酒酵母菌发酵后,收集菌体,破碎取粗酶液。粗酶液可以进一步干燥制成粗酶粉;可采用冷冻干燥或者真空冷冻干燥制备粗酶粉。
进一步,所述的7α-HSDH基因的核苷酸序列如SEQ ID No.1或SEQID No.2所示;7β-HSDH基因的核苷酸序列如SEQ ID No.3或SEQID No.4所示。优选的,所述7α-HSDH基因的核苷酸序列如SEQID No.2所示,7β-HSDH基因的核苷酸序列如SEQID No.4所示。所述的酿酒酵母菌为CEN.PK2-1C。所述的载体为pRS424和pRS426质粒;更进一步,7α-HSDH基因连接到pRS424质粒上,7β-HSDH基因连接到pRS426质粒上。
所述工程酿酒酵母的发酵方法为:
(1)工程酿酒酵母种子菌制备:工程酿酒酵母在SD-Trp
(2)菌液按照1-10%接种量接种到含有SD-Trp
所述的SD-Trp
所述的SD-Trp
所述的Minimal SD Base成分组成如下:硫酸铵、微量元素、葡萄糖按比例混合而成。
所述的DO Supplement-Trp/-Ura成分组成如下:缺失色氨酸和尿嘧啶的DO添加剂。
与现有技术相比,本发明具有如下有益效果:
1)选用的绿色安全的酿酒酵母菌CEN.PK2-1C和W303a作为工程酿酒酵母宿主菌,易于培养,转化产物安全、健康;粗酶液制备过程操作简便、易于控制,粗酶液酶活性稳定,粗酶粉且复溶于水溶液后酶活性稳定;
2)选用密码子优化的7α-HSDH和7β-HSDH基因作为修饰宿主菌的工程基因,其表达水平高,酶的催化稳定、可控;
3)采用本方法,底物中牛磺鹅去氧胆酸(TCDCA)转化速度快,可在较短时间内得到一定比例的TUDCA,TUDCA与TCDCA比例在1~1.5之间;
4)混合液反应过程操作简便、易于控制,对人工熊胆粉的理论研究及药用价值的广泛利用具有重要贡献。
酿酒酵母被称为绿色安全微生物,广泛应用于食品医药行业。本发明利用工程改造酿酒酵母对家禽胆汁中TCDCA进行定向转化,在人工熊胆粉方面具有较为突出的优势。通过基因工程技术调控关键酶表达量与活性,可以实现TCDCA到TUDCA定向转化,从而实现资源的综合利用,更加有效地解决医药市场需求。
附图说明
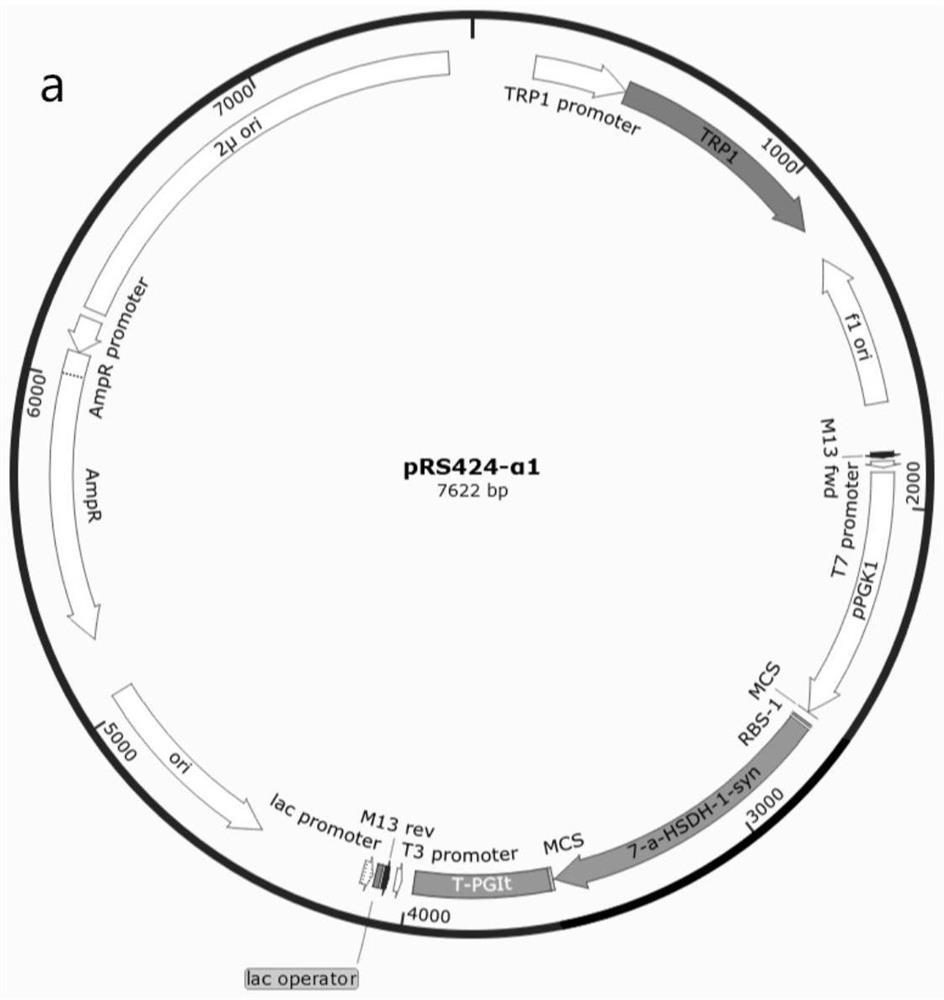
图1为pRS424-α
图2为pRS424-α
图3为pRS426-β
图4为pRS426-β
图5为工程酿酒酵母反应液样品HPLC图谱。
具体实施方式
为了更好的理解本发明的实质,下面将结合附图和实施例来对本发明做进一步的详细说明。应当理解,此处所描述的具体实施方式仅仅用于解释本发明,并不用于限定本发明。
SD-Trp
SD-Trp
破碎缓冲液组成如下:pH4.5~7.5、含5%甘油的5~200mM磷酸钠盐缓冲液。
实施例1工程酿酒酵母构建与菌体收集
(1)载体构建:将两个7α-HSDH和两个7β-HSDH基因(其核苷酸序列分别如SEQ IDNo.1-No.4)采用双酶切、T4连接酶连接法分别连接到pRS424和pRS426质粒载体上,分别命名为pRS424-α
(2)工程酿酒酵母构建:将pRS424-α
(3)工程酿酒酵母培养:用接种环蘸取保种的上述携带重组质粒工程酿酒酵母的甘油菌,在SD-Trp
挑取单菌落,接种到含有SD-Trp
(4)收集菌体:收集10毫升细胞培养液,2200rpm,4℃离心5分钟,弃上清。用500μL无菌水重悬,转移到离心管中,4℃高速离心(13000rpm)30秒,弃去上清,菌体细胞-80℃冻存备用。
实施例2工程酿酒酵母CEN-α
(1)用接种环蘸取保种CEN-α
(2)挑取酿酒酵母单菌落,接种到含有毫升的SD-Trp
(3)将上述第(2)步中得到种子液按照5%接种量,接种到含有15毫升SD-Trp
(4)将上述第(3)步中得到菌液按照5%接种量,接种到1~3个含有2升SD-Trp
实施例3酸洗玻璃珠法制备粗酶液和粗酶粉
(1)按实施例2第(3)步的10毫升工程酿酒酵母培养液,2200rpm,4℃离心5分钟,弃上清。
(2)用500μL无菌水重悬菌体,转移到离心管中,4℃、13000rpm高速离心60秒,弃上清,菌体细胞-80℃冻存备用。
(3)用500μL细胞破碎缓冲液(50mM磷酸钠盐缓冲液,pH6.5,5%甘油)重悬菌体,2200rpm,4℃离心5分钟,弃上清。
(4)用150μL细胞破碎缓冲液重悬菌体,加入相同体积的酸洗玻璃珠(424~600μm),涡旋混合-冰浴(涡旋混合30秒,冰浴30秒,重复10次,总时间10分钟),以充分裂解细胞。
(5)12000rpm离心5~10分钟,将上清液转移到新的离心管中,所得即为粗酶液;或于冷冻干燥机中干燥,即得粗酶粉。所得粗酶液和粗酶粉置于-20℃~-80℃冰箱保存备用。
其他工程酿酒酵母菌用同样的方法制备粗酶液和粗酶粉。
实施例4匀质机破碎法制备粗酶液和粗酶粉
(1)按实施例2第(4)步操作得到的6升工程酿酒酵母培养液,于3500rpm、4℃离心10分钟,弃上清。
(2)用200毫升无菌水重悬菌体,转移到离心管中,12000rpm离心60秒,弃上清,菌体细胞-80℃冻存备用。
(3)用200毫升细胞破碎缓冲液重悬菌体,2600rpm、4℃离心10分钟,弃上清。
(4)用120毫升细胞破碎缓冲液重悬菌体,利用匀质机,600~1000bar破碎细胞。
(5)12000rpm离心5~10分钟,将上清液转移到新的离心管中,所得即为粗酶液,或于冷冻干燥机中干燥,即得粗酶粉。所得粗酶液和粗酶粉置于-20℃~-80℃冰箱保存备用。
实施例5工程酿酒酵母人工熊胆粉制备(方法一)
(1)催化反应:微量离心管中加入6g/L的精制鸡胆粉溶液、NADP
(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,于8000rpm离心20分钟取上层清液,过D101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用H
所得人工熊胆粉复溶于甲醇后进行液相检测,其中TUDCA和TCDCA的比值为1.1:1.0。HPLC检测结果如图5所示。
产物的HPLC检测分析方法如下:取反应液样品或人工熊胆粉复溶于甲醇样品,于12000rpm离心1.5分钟,取上清液按1:5的比例加入用水饱和的正丁醇对其进行萃取,混匀分层后,取出上层清液并用氮气吹干或挥干,加入与上清液等体积的HPLC级甲醇重新溶解,用0.22μm滤膜过滤。
反向色谱柱Agilent Poroshell 120EC-C18 column(2.7μm,4.6mm×150mm),使用CAD检测器对转化产物进行分析,流速为0.6mL/min,进样量为1μL,柱温40℃,采集频率10Hz,雾化温度45℃,流动相为乙腈(A相)和0.3%甲酸的5mmol/L醋酸铵水溶液(B相),进行梯度洗脱。
梯度条件如下:
实施例6工程酿酒酵母人工熊胆粉制备(方法二)
(1)催化反应:微量离心管中加入15g/L的精制鸡胆粉溶液、NADP
(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,于8000rpm离心20分钟取上层清液,过D101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用H
所得人工熊胆粉复溶于甲醇后进行液相检测,其中TUDCA和TCDCA的比值为1.5:1.0。
实施例7工程酿酒酵母人工熊胆粉制备(方法三)
(1)催化反应:微量离心管中加入20g/L的精制鸡胆粉溶液、NADP
(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,于8000rpm离心20分钟取上层清液,过D101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用H
所得人工熊胆粉复溶于甲醇后进行液相检测,其中TUDCA和TCDCA的比值为1.2:1.0。
实施例8工程酿酒酵母人工熊胆粉制备(方法四)
(1)催化反应:微量离心管中加入15g/L的粗制鸡胆粉溶液、NADP
(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,于8000rpm离心20分钟取上层清液,过D101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用H
所得人工熊胆粉复溶于甲醇后进行液相检测,其中TUDCA和TCDCA的比值为1.3:1.0。
实施例9工程酿酒酵母人工熊胆粉制备(方法五)
(1)催化反应:微量离心管中加入15g/L的粗制鸡胆粉溶液、NADP
(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,于8000rpm离心20分钟取上层清液,过D101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用H
所得人工熊胆粉复溶于甲醇后进行液相检测,其中TUDCA和TCDCA的比值为1.3:1.0。
实施例10工程酿酒酵母人工熊胆粉制备(方法六)
(1)催化反应:微量离心管中加入15g/L的粗制鸡胆粉溶液、NADP
(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,用3MM滤纸真空抽滤,取滤过清液,过D101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用H
所得人工熊胆粉复溶于甲醇后进行液相检测,其中TUDCA和TCDCA的比值为1.3:1.0。
对照例
工程酿酒酵母W303a-α
经过HPLC检测,所得人工熊胆粉复溶于甲醇后进行液相检测,其中TUDCA和TCDCA的比值为0.2386。
SEQUENCE LISTING
<110> 上海中医药大学
<120> 一种制备人工熊胆粉的工程酿酒酵母及方法
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 888
<212> DNA
<213> Clostridium sardiniense strain
<400> 1
catatggtga acataatgaa aagattagaa ggaaaagtcg caatagtaac atcatctact 60
agaggaatag gacgtgcatc tgcagaagca ttagcaaaag aaggtgcttt agtatatcta 120
gcagcacgtt cagaggaatt agctaatgaa gttatagcag atataaaaaa gcaaggtgga 180
gtagctaagt ttgtttactt taatgctaga gaagaagaaa cttacacttc aatggtagaa 240
aaagttgctg aagctgaagg caggatagat atattagtta ataactacgg tggaacaaat 300
gttaatttag ataagaactt aactgctgga gatacagatg aattctttag aatattaaaa 360
gataacgttc aaagtgtata cttaccagca aaagctgcta taccacacat ggaaaaagta 420
ggcggtggaa gcatagttaa tatctcaact ataggatcag ttgttccaga tatatcaaga 480
atagcttact gtgtatcaaa atccgctata aactctttaa ctcaaaacat agcattacaa 540
tatgcaagaa agaatatcag atgtaatgca gtattacctg gtttaatagg aactagagca 600
gcactcgaaa atatgactga tgaatttaga gactcattct taggacatgt tcctttaaat 660
agagtaggaa gaccagaaga tatagcaaat gcagttttat actatgcctc tgatgattca 720
ggttatgtaa caggaatgat tcatgaagtt gcaggaggtt ttgcattagg aactcctcaa 780
tattcagaat actgtccaag aggaggagga ggatctggag gaggaggatc tggaggagga 840
ggatctcctc ctcctgcact gcctccgaaa cgtcgtcgtt aactcgag 888
<210> 2
<211> 858
<212> DNA
<213> Escherichia coli
<400> 2
catatggtgt ttaattctga caacctgaga ctcgacggaa aatgcgccat catcacaggt 60
gcgggtgcag gtattggtaa agaaatcgcc attacattcg cgacagctgg cgcatctgtg 120
gtggtcagtg atattaacgc cgacgcagct aaccatgttg tagacgaaat tcaacaactg 180
ggtggtcagg catttgcctg ccgttgtgat attacttccg aacaggaact ctctgcactg 240
gcagactttg ctatcagtaa gctgggtaaa gttgatattc tggttaacaa cgccggtggc 300
ggtggaccta aaccgtttga tatgccaatg gcggattttc gccgtgctta tgaactgaat 360
gtgttttctt ttttccatct gtcacaactt gttgcgccag aaatggaaaa aaatggcggt 420
ggcgttattc tgaccatcac ttctatggcg gcagaaaata aaaatataaa catgacttcc 480
tatgcatcat ctaaagctgc ggccagtcat ctggtcagaa atatggcgtt tgacctgggt 540
gaaaaaaata ttcgggtaaa tggcattgcg ccgggggcaa tattaaccga tgccctgaaa 600
tccgttatta caccagaaat tgaacaaaaa atgttacagc acacgccgat cagacgtctg 660
ggccaaccgc aagatattgc taacgcagcg ctgttccttt gctcgcctgc tgcgagctgg 720
gtaagcggac aaattctcac cgtctccggt ggtggggtac aggagctcaa tggaggagga 780
ggatctggag gaggaggatc tggaggagga ggatctcctc ctcctgcact gcctccgaaa 840
cgtcgtcgtt aactcgag 858
<210> 3
<211> 861
<212> DNA
<213> Clostridium sardiniense
<400> 3
catatgaatt ttagagaaaa atatggacaa tggggaattg ttttaggggc aacagaagga 60
attggtaaag ctagtgcttt tgaattagct aaaagaggga tggatgttat tttagttgga 120
agaagaaaag aagcattaga agagttagct aaggcaatac atgaagaaac aggaaaagaa 180
atcagagtat taccacaaga tttatctgaa tatgatgctg cagaaagatt aatagaagca 240
actaaagatt tagatatggg agtcattgag tatgttgcat gtctacatgc aatgggacaa 300
tataataaag ttgactacgc taaatatgaa caaatgtata gagttaatat aagaacattc 360
tcaaaattat tacatcacta tataggtgaa ttcaaagaaa gagatagagg tgcattcata 420
acaataggat ctttatcagg atggacatca ttaccattct gtgcagaata tgcagcagaa 480
aaagcttata tgatgacagt aacagaagga gttgcttacg aatgtgcaaa tactaatgtt 540
gacgtaatgc ttttatcagc gggttcaaca atcacaccta cttggttaaa aaataaacca 600
tcagatccta aggcggttgc agcagcaatg tatccagaag atgttataaa agatggattt 660
gaacaattag gaaagaaatt tacttattta gctggagagt taaatagaga aaaaatgaag 720
gaaaataatg caatggatag aaatgattta attgcaaaac taggaaaaat gtttgatcac 780
atggcaggag gaggaggatc tggaggagga ggatctggag gaggaggatc tggtgttaaa 840
gaaagcctgg tttaactcga g 861
<210> 4
<211> 867
<212> DNA
<213> Ruminococcus gnavus strain N53
<400> 4
catatgacat tgagagaaaa atatggagaa tggggaatta ttttaggcgc tactgaaggt 60
gtcggaaaag cattttgtga aaggcttgcc aaagaaggta tgaatgtcgt aatggtcgga 120
cgccgtgaag aaaaattaaa agagctcggt gaggaactaa aaaacactta tgagattgat 180
tataaagtcg taaaagcaga cttttcgctg ccagatgcta ctgacaaaat ttttgctgca 240
acagaaaatc tggatatggg atttatggcc tatgtagcct gcttacactc ttttggcaaa 300
atccaggata caccttggga aaagcatgag gcaatgatca acgtaaacgt tgttacattt 360
atgaaatgct tctatcacta tatgaaaatc tttgctgcac aggatcgcgg tgctgtcatc 420
aacgtatctt ctatgactgg aatttccagt tcaccatgga atggccaata tggtgcagga 480
aaggcattca ttttaaaaat gacagaggct gttgcctgtg aaacggaaaa gaccaatgtt 540
gatgtggaag tcatcacttt gggaactact ctgacaccaa gtcttttaag caacctgcct 600
ggcggaccac agggggaagc tgttatgaag actgctcaaa caccggaaga agttgtggac 660
gaagcttttg aaaaattagg aaaagaactg tctgtcattt ccggagagcg taataaagcc 720
agcgtccatg actggaaagc gaatcataca gaagatgact atatccgcta tatgggatct 780
ttctatcaag aaggaggagg aggatctgga ggaggaggat ctggaggagg aggatctggt 840
gttaaagaaa gcctggttta actcgag 867
- 一种制备人工熊胆粉的工程酿酒酵母及方法
- 一种采用工程菌规模化发酵培养制备人工熊胆粉的工艺
