牙髓干细胞在制备治疗糖尿病药物中的应用
文献发布时间:2023-06-19 10:58:46
技术领域
本发明属于生物医药领域,涉及一种牙髓干细胞在制备治疗糖尿病药物中的应用。
背景技术
糖尿病是一种日益严重的全球流行病[1,2]。根据国际糖尿病联合会的数据,2017年全球20岁以上的糖尿病患者人数达到4.249亿,预计到2045年患者总数将达到6.286亿[1]。 2型糖尿病(T2DM)占所有糖尿病病例的90%以上[3]。尽管尚未完全阐明其发病机理,但β细胞功能障碍在其发生和发展中起着关键作用[4-6]。现有的降血糖药物,包括胰岛素,主要用于控制高血糖并延迟并发症的发生,但不能有效逆转胰岛β细胞的逐步减少和衰竭[7,8]。促进胰岛β细胞再生和恢复内源性胰岛素分泌可能是治疗糖尿病的理想方法[9,10]。
先前的研究表明,异基因胰腺或胰岛移植可以有效改善糖尿病患者的胰岛功能。然而,由于捐助者资源有限,免疫排斥的可能性以及维持移植所需的免疫抑制药物的毒性,该方法尚未得到广泛使用[11-13]。对于干细胞再生策略的应用,胚胎干细胞(ESC)和诱导多能干细胞(iPSC)的使用带来了伦理问题,并且具有发生肿瘤的风险,这也限制了其临床应用 [14-17]。在这种背景下,间充质干细胞(MSC)具有巨大的临床潜力,因为它们可能能够恢复胰岛β细胞的功能并具有许多优势,例如易于从可获取的来源获得,与收获相关的创伤有限,并且免疫原性低[18,19]。因此,MSC治疗在糖尿病研究领域引起了极大的关注。
发明内容
一些实施方案中,本发明中提供了间充质干细胞在制备治疗糖尿病患者的药物中的应用,所述糖尿病患者为低血脂糖尿病患者。
一些实施方案中,所述的血脂指标包括总胆固醇指标、甘油三酯指标、或低密度脂蛋白胆固醇指标。
一些实施方案中,所述低血脂糖尿病患者的总胆固醇含量≤5mmol/L。
一些实施方案中,所述低血脂糖尿病患者的甘油三酯含量为≤1.5mmol/L。
一些实施方案中,所述低血脂糖尿病患者的低密度脂蛋白胆固醇含量为≤3.2mmol/L。
一些实施方案中,所述药物选自注射剂、口服制剂或外用制剂。
一些实施方案中,所述药物为注射剂。
一些实施方案中,所述药物选自静脉注射剂、肌肉注射剂、皮下注射剂或鞘内注射剂;或优选地,所述药物还包括药学上可接受的药用载体。
一些实施方案中,所述药用载体包括稀释剂、赋形剂、填充剂、粘合剂、崩解剂、表面活性剂和润滑剂中的一种或几种。
发明人研究过程中首次发现,其给予间充质干细胞治疗后,血脂水平低的糖尿病患者相对于血脂水平高的糖尿病患者而言,治疗效果更加显著。因此,可以在给予糖尿病患者间充质干细胞治疗的同时或者之前对糖尿病患者进行血脂水平的干预,以提高间充质干细胞的治疗糖尿病的效果。
因此,为了提高糖尿病的治疗效果,作为一种实施方案,本发明提供了一种组合物,包含间充质干细胞和降血脂药物或降血脂保健品。
一些实施方案中,所述的组合物也可以是“药品套装”,所述组合物中(包括间充质干细胞或含有间充质干细胞的制剂和降血脂的药物或降血脂的保健品)的各个物质可以混合也可以被分开包装。
一些实施方案中,所述组合物为用于治疗糖尿病的组合物。
一些实施方案中,述组合物还包括药学上可接受的载体。
一些实施方案中,本发明提供了一种所述的组合物在制备治疗糖尿病患者的药物中的应用。
一些实施方案中,所述糖尿病患者为高血脂患者。
一些实施方案中,所述间充质干细胞和降血脂药物被同时给药。
一些实施方案中,所述间充质干细胞和降血脂药物被单独给药。
一些实施方案中,对于降血脂药物和间充质干细胞而言,先给予降血脂药物,后给予间充质干细胞。
一些实施方案中,先给予间充质干细胞或含有间充质干细胞的制剂,后给予降血脂药物。
根据发明人的发现,为了进一步提高间充质干细胞治疗糖尿病的效果,在治疗方案的选择中,可以首先判断糖尿病患者的血脂水平,再针对性地给予间充质干细胞的治疗方案,以此来提高治疗方案的有效性,避免无效给药所造成的时间上的拖延和药物滥用。例如在给药前先测定患者的血脂水平,如果血脂水平低,可直接给予间充质干细胞治疗;如果血脂水平正常或者偏高,则可以在给予间充质之前或者同时给予降血脂药物或者降血脂保健品,以提高糖尿病的治疗效果。血脂水平越低的糖尿病患者越有利于间充质干细胞的治疗效果。判断某个体是否适合于利用间充质干细胞进行治疗,可先检测血脂水平。判断血脂水平高低可以优选但不限于以下方式:
血脂水平高或低是指在糖尿病患者中的血脂水平的高或低,在一些实施方式中,比如前期研究纳入的糖尿病患者甘油三酯含量在0.54-3.80mmol/L,其中以1.5mmol/L为界,高于此则疗效不佳。作为一种可选的实施方案,血脂水平的低指的是糖尿病患者中的血脂水平低。若个体的血脂水平低(即个体的总胆固醇含量≤5mmol/L,或甘油三酯含量为≤1.5mmol/L,或低密度脂蛋白胆固醇含量为≤3.2mmol/L),则属于低血脂水平。
因此,一些实施方案中,本发明提供了一种试剂盒,包含血脂水平的检测试剂和间充质干细胞或含有间充质干细胞的组合物。
一些实施方案中,所述试剂盒为治疗糖尿病的试剂盒。
一些实施方案中,本发明提供了一种糖尿病用药指导系统,用于根据样本的血脂水平,判别糖尿病的治疗方案,并输出判别结果。
一些实施方案中,本发明提供了一种糖尿病用药指导系统,包含以下构件:(1)血脂水平分析构件;用于分析对应样本的血脂水平的与正常血脂水平的偏离;(2)结果判断构件;用于根据血脂水平分析结果判断用于治疗糖尿病的用药方案,所述用药方案为:当血脂水平偏低或正常时,则直接给予间充质干细胞进行用药;当血脂水平偏高时,则进行间充质干细胞与降血脂药物或保健品的联合用药。
一些实施方案中,本发明提供了一种糖尿病用药系统,包含所述的用药指导系统,并且,还包括用药构件,所述的用药构件用于给予间充质干细胞。
一些实施方案中,所述的用药指导系统或用药系统,还包括血脂水平检测构件,用于检测血脂水平。
一些实施方案中,所述血脂水平的检测构件含有血脂水平检测试剂或试剂盒。
一些实施方案中,所述血脂水平的检测构件含有血脂水平检测仪器。
一些实施方案中,所述的结果判断构件含有数据处理机器。
一些实施方案中,所述的数据处理机器包含计算器、计算机中的一种或多种。
一些实施方案中,所述的计算机包含附载有SPSS、SAS、Excel中一种或多种软件的计算机。
一些实施方案中,所述的间充质干细胞来源包括脐带和牙髓,但又限于此。
一些实施方案中,所述的间充质干细胞来源于脱落乳牙。
一些实施方案中,所述糖尿病为包括Ⅰ型糖尿病和Ⅱ型糖尿病。
一些实施方案中,所述糖尿病为Ⅱ型糖尿病。
附图说明
图1为SHED的表征图。A:培养的SHED的形态。B:成骨分化。C:成脂分化。 D:软骨分化。E-L:表面标记的流式细胞仪分析。
图2为图1研究期间葡萄糖代谢指标的变化。A:患者从基线到治疗期结束后一个月的 GSP水平。*P<0.05vs.基线水平。B:研究期间HbA1c水平的变化。*P<0.05vs.基线水平。C和D:分别为研究期间患者的FBG水平和自我监测的空腹CBG值。
图3为steamed bread meal(馒头餐)测试过程中葡萄糖代谢和胰岛功能的变化。A:患者在基线、治疗结束后以及在第三次输注SHED之后的第3、6、9和12个月后的FBG,P1hBG和P2hBG水平。B:研究期间FCP,F1hCP和F2hCP水平的变化。*P<0.05vs.基线水平。C:研究期间患者HOMA-IR的变化。
图4为研究期间患者的血脂变化。A-D:在研究期间,患者的TC,TG,HDL-C和 LDL-C水平分别升高。*P<0.05与基线水平。
图5为SHED移植治疗的疗效分析。A:研究期间24例患者的每日胰岛素剂量变化。B:22例SHED移植治疗的疗效分析。
图6为SHED移植治疗效果的相关分析。A:在研究结束时,干细胞移植前的HbA1c水平会影响每日胰岛素剂量。B和C:研究结束时基线FCP和P2hCP水平会影响FCP水平。 D,E和F:在研究结束时,患者治疗前的TC,TG和LDL-C水平会分别影响每日胰岛素剂量。
图7为研究期间低血糖的发生率。A:所有患者的低血糖发作。B:每位患者的低血糖发生频率。
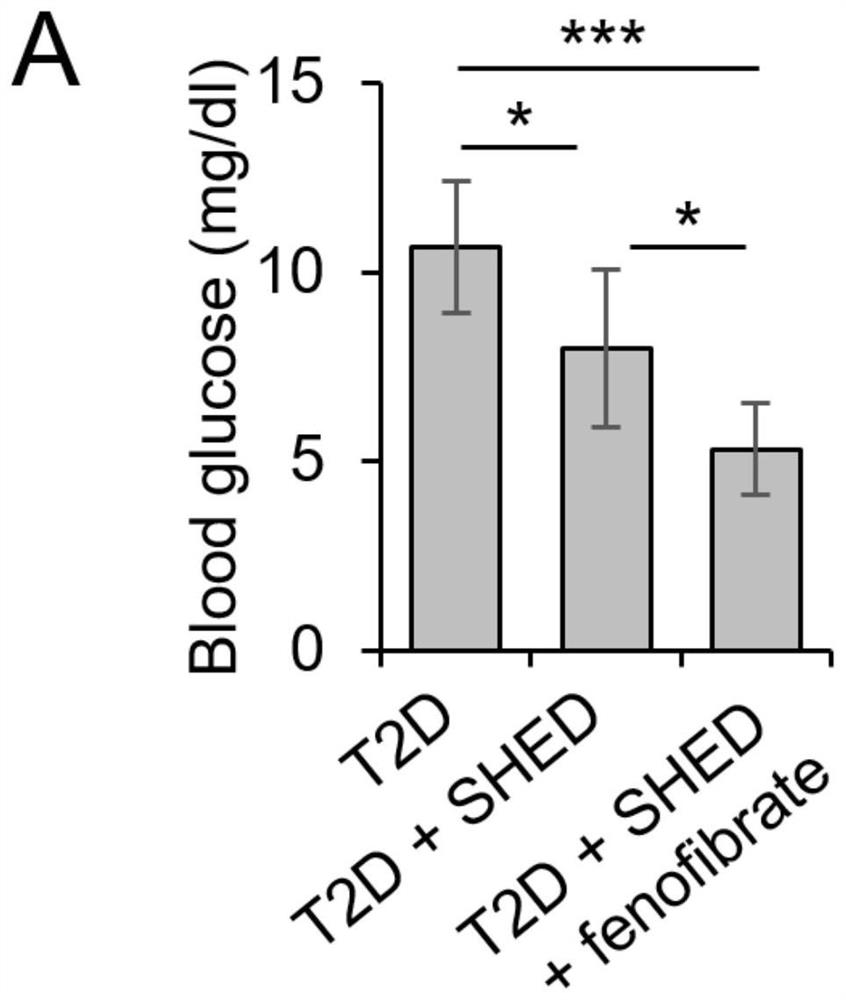
图8A为降血脂药与SHED联合应用降血糖能力显著优于单纯SHED治疗。小鼠禁食12小时后取尾静脉血测量禁食后血糖。图8B为降血脂药与SHED联合应用后小鼠糖耐量显著优于单纯SHED治疗。腹膜内葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT),将动物禁食12小时,然后腹腔注射20%葡萄糖溶液(每公斤体重2克葡萄糖)。注射后0、15、30、60、90和120分钟测量血糖。
具体实施方式
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
在该公开内容中,“包含”、“包括”、“含有”、“具有”可指“囊括”、“涵盖”等,“基本由.... 组成”、“基本组成为”等具有专利法中赋予它们的含义,该术语为开放式的,允许多于所引用的事项的存在,只要所引用的事项的基本或新颖特征不因多于所引用的事项的存在而改变,但排除现有技术的实施方案。
如本文所使用的,术语“治疗”是指减轻或改善紊乱和/或与其相关的症状。应理解,尽管未排除,但治疗紊乱或异常状况不需要所述紊乱、异常状况或与其相关的症状完全消除。“改善”是指减轻、抑制、减小、减弱、遏制或稳定疾病的发展或进展。
药学上可接受的载体包括盐水、含水缓冲溶液、溶剂和/或分散介质。这种载体的使用是本领域公知的。该溶液优选是无菌的并且易于注射程度存在的流体。优选地,该溶液在制造和储存的条件下是稳定的,并且通过例如对羟基苯甲酸酯类、氯丁醇、苯酚、抗坏血酸、硫柳汞等的使用,抵制细菌和真菌的微生物的污染作用而被保存。
“低血脂糖尿病患者”指的是个体的血清甘油三酯水平在1.5mmol/L以下、或总胆固醇水平在5mmol/L以下、或低密度脂蛋白胆固醇水平在3.2mmol/L以下。满足糖尿病纳入标准的患者群体中(空腹血糖7.5-12.0mmol/L,糖化血红蛋白7.0%-10.0%等,详见以下“材料和方法”),血脂变化具有分界数值(并不具备临床疾病诊断学意义,仅作为干细胞治疗预后标准)。
血脂的检测条件、方法:血脂检测为临床常规的空腹血脂三项检测。T2DM指的是2型糖尿病。
SHED指的是人脱落乳牙牙髓干细胞。
GSP:糖基化血清白蛋白。
FBG:空腹血糖。
FCP(fasting C-peptide):空腹C肽水平。
在没有特别指明的情况下,本发明采用的材料及实验方法为常规材料及方法。
材料和方法
1、受试者。2018年5月至2018年8月,上海长海医院内分泌科收治了24例T2DM患者。
纳入标准:(1)年龄在45-65岁之间,体重指数(BMI)在20-30kg/m
排除标准:(1)1型糖尿病,妊娠糖尿病或任何其他特殊类型的糖尿病。(2)糖尿病酮症酸中毒或非酮症高渗综合征等急性并发症在筛查前1个月内发生。(3)在筛选前接受过其他干细胞疗法,或在过去三个月内曾参加或正在参加另一项临床研究计划。(4)筛查时血压控制不良和/或血压≥160/100mmHg。(5)在筛选前3个月内使用噻唑烷二酮,DPP-IV抑制剂或GLP-1类似物。(6)筛选前三个月中,胰岛素使用时间不到一年或每天皮下注射一次。(7)胰腺疾病,包括急性或慢性胰腺炎或胰腺肿瘤病史。(8)其他恶性肿瘤或疑似肿瘤的趋势,或处于各种传染病活跃期(包括乙肝或丙肝活跃期)或艾滋病毒呈阳性的病人。 (9)其他严重的系统疾病(如心血管系统,呼吸系统,消化系统,神经系统,内分泌系统,免疫系统和血液系统等)。(10)肝或肾功能异常,例如血清总胆红素超过正常值上限的1.5倍,丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)超过正常值上限的2.5倍或血清肌酸(SCr)超过正常值上限的1.2倍。(11)当前使用的全身性激素(例如糖皮质激素),免疫抑制剂或细胞毒性药物。(12)过去5年内有不良药物滥用和酒精依赖史的孕妇或哺乳期妇女,吸毒者或患者,以及在治疗本研究中有禁忌症或过敏症的患者。严格按照相关法律法规进行本研究,例如国家卫生和计划生育委员会和国家食品药品监督管理局发布的《干细胞临床研究管理办法(试行)》。该研究得到上海长海医院伦理委员会的批准(伦理批准号:CHEC2017-159;临床试验注册号:NCT03658655),所有入组患者均签署了知情同意书。当患者参加研究时记录患者的基线参数。
2、移植和随访。这项研究分为筛选期,治疗期和随访期。筛选期为1周,符合条件的患者在筛选后1周内入组。患者在42天的治疗期内接受了3次静脉SHED输注。第一次输注计划在患者入组时进行,第二次和第三次输注计划分别在第一次输注后1周和4周进行。 SHED由卡替(上海)生物技术有限公司提供,干细胞的制备符合干细胞制剂质量监督和临床前研究指南的有关规定。在本研究中使用的SHED是在知情同意下捐赠的,并且是从自然脱落的牙齿中收集的,无需侵入性程序。SHED的供体已经过生物安全性测试(表1)。根据我们以前的研究方法,通过形态学,表面标记和多分化功能对SHED进行了表征[20]。此外,本研究中使用的SHED在输注之前还通过了致瘤性测试。每次干细胞输注的剂量计算为 0.1U/kg体重,其中每个单位包含1×10
3、研究方法。进入小组的当天,我们为所有入组患者提供了自我管理培训,包括饮食和运动对糖尿病的重要性以及低血糖症的常见症状的信息。向患者发放了统一的血糖监测仪 (型号:GE333D,由中国平潭市华光生物技术有限公司生产)。在随访期间,检查并增强了患者的自我管理意识和能力。常规血液和尿液样本,血液总胆固醇(TC),甘油三酸酯(TG),高密度脂蛋白胆固醇(HDL-C),低密度脂蛋白胆固醇(LDL-C),AST,ALT, SCr,估计的肾小球滤过率(eGFR),HbA1c和/或糖基化血清白蛋白(GSP),胰岛素释放测试在每次随访中进行。分发了日常生活日记。要求患者详细记录饮食和运动,毛细血管血糖 (CBG)监测值,每日胰岛素剂量和口服药物使用,低血糖和其他不良反应(如果有)。然后在每次随访中收集日记。常用的CBG监测时间点包括禁食,餐前,每天三顿饭中的每一次饭后2小时,就寝时间以及任何不舒服的时间。在这项研究中,以胰岛素的日剂量为主要评估指标[24,25]。当胰岛素的每日剂量与基线相比减少≥50%时,该干预措施被认为是非常有效的。当与基线相比,胰岛素的每日剂量减少≥20%但<50%时,被评估为中等有效;当胰岛素的每日剂量与基线相比减少了<20%时,被认为是无效的。HbA1c,FBG和连续血糖监测结果的变化被用作次要疗效评估指标。胰岛素抵抗指数(HOMA-IR)通过以下公式计算:FBG(mmol/L)×空腹胰岛素(FIN,mmol/L)/22.5。
4、统计分析使用SPSS 23.0统计软件。测量数据表示为平均值±标准偏差,计数数据表示为病例数和百分比(%)。ANOVA和SNK-q检验用于各组之间的比较,显著性水平(α或P)<0.05。
表1源齿供者主要血液学检查项目及结果评估
实施例1代谢指标检测
实验方法见“材料与方法”所示。
在24例T2DM患者中,有2例在第三次随访后退出。患者的基线信息如表2所示。SHED的表征在于评估典型的MSC表型,包括形态,表面标志物和多分化功能(图1)。在治疗期间,患者的GSP水平较基线水平显著降低(P<0.05)。治疗期结束后一个月,GSP也显著低于基线水平(P<0.05)(图2A)。在治疗期间,患者的GSP水平较基线水平显著降低 (P<0.05)(图2A)。与基线水平相比,治疗结束后2周的HbA1c水平显著降低(P <0.05)。HbA1c的这种降低一直维持到第三次随访(第三次SHED输注后12周)。之后,直到随访期结束,HbA1c水平均低于基线,但无统计学差异(图2B)。在治疗期间,FBG水平显著低于基线水平,然后呈现上升趋势,与基线水平相比无统计学差异(图2C)。但是,患者的自我监测的空腹CBG值在随访期间略有波动,但无统计学差异(图2D)。
在开始第一次SHED输注之前(基线),治疗期结束以及第三次SHED输注后的3、6、 9和12个月,进行了馒头餐试验(bread meal test)。在治疗结束时和随访期间,餐后1小时血糖(P1hBG)和餐后2小时血糖(P2hBG)的水平低于基线水平,并在治疗结束后3个月达到最低水平,但差异无统计学意义(图3A)。SHED移植导致FCP水平升高,但差异无统计学意义(图3B)。在治疗结束时,餐后两小时测得的C肽水平(P2hCP)显著高于基线 (P<0.05);此后,它显示出下降趋势,并且在随访期结束时仍高于基线,没有统计学差异(图3B)。在治疗结束时,P2hCP水平显著升高(P<0.05)。此后,它显示出下降趋势,并且在随访期结束时仍高于基线水平,但是没有统计学差异(图3B)。在治疗期末和随访期间,HOMA-IR高于基线水平,但差异无统计学意义(图3C)。
SHED移植后TC和LDL-C的水平逐渐降低,第二次和第三次SHED移植后两周与基线的差异具有统计学意义(P<0.05)。在观察期间,血液TG的水平没有显示出明显的变化 (图4)。ALT,AST,eGFR和SCr的水平均在正常基线范围内,在随访期间未显示出明显变化。
表2基线时24例患者的一般状况
实施例2治疗效果检测
实验方法见“材料与方法”所示。
共有22位患者完成了研究,他们的信息被用来评估患者每天使用的胰岛素量。结果显示,在治疗期间,胰岛素的日剂量显着下降,与治疗前的基线相比,治疗结束时胰岛素的日剂量减少了35.34%。在随访期间,每天的胰岛素剂量进一步减少。与基线水平相比,治疗期结束后3、6和9个月的每日胰岛素剂量分别减少了51.18%,43.39%和39.39%;之后,剂量相对稳定,没有明显减少(图5A)。
每日胰岛素剂量是该研究的主要疗效评估标准。治疗期结束时的总有效率为86.36% (19/22)。在治疗期间,两名患者停止使用胰岛素。治疗结束后六个月的总有效率为 81.82%(18/22)。另一位患者在随访期间停止使用胰岛素。到研究结束时,三名患者停止使用胰岛素的总有效率为68.18%(15/22)(图5B)。在其他4例患者中,与基线相比,胰岛素注射的频率也降低了。
实施例3相关性分析
本研究中,通过数据分布图确定每个指标的阈值后,进行初始和终点两因素相关性分析。结果表明,干细胞移植前的血糖水平与疗效相关,即HbA1c<8.5%的患者入组,治疗后每日胰岛素剂量显着降低(图6A)。治疗前患者的胰岛功能状态与治疗后胰岛功能恢复程度密切相关,如FCP>1.7ng/mL和P2hCP>3ng/mL患者,治疗后胰岛功能恢复较好(图6B, 6C)。
此外,研究中,发明人还发现,干细胞治疗前TC≤5mmol/L或TG≤1.5mmol/L或LDL-C ≤3.2mmol/L的患者显示每日胰岛素剂量显著降低(图6D,6E,6F)。
实施例4副作用分析
低血糖症是研究期间最常见的不良事件。在治疗期间,所有24例患者的低血糖发生率均增加,并达到0.51次/周/患者的峰值。进入随访期后,所有22例患者的低血糖发生率均明显降低。SHED移植后六个月,平均低血糖发生频率约为0.09次/周/患者,与治疗前水平相似 (图7A,7B)。
除低血糖症外,治疗期间其他常见不良反应为短暂性发烧(11.11%),疲劳(4.17%) 和皮疹(1.39%)。所有这些不良反应均在SHED移植后24小时内发生,经过适当的症状常规治疗后可以缓解。在随访期间,一名患者分别被诊断出患有颈椎病,肩周炎和眼底出血。另外两名患者发生了双足破裂,发生率为8.33%(2/24)。这些疾病及其发生率与干细胞疗法无关。
实施例5降血脂药物fenofibrate(非诺贝特)与牙髓干细胞(SHED)联合治疗2型糖尿病小鼠
小鼠实验均采用雄性C57BL/6J小鼠,所有实验均在小鼠6-8周龄时开始的。将18只小鼠分为3组(T2D,T2D+SHED,T2D+SHED+fenofibrate),每组6只,均给予高脂饮食 (HFD,脂肪热量43%)饲养10周诱导2型糖尿病。10周后给予T2D+SHED组小鼠尾静脉注射SHED细胞治疗(0.5×10
在小鼠第一次治疗结束一个月后,小鼠禁食12小时后取尾静脉血测量禁食后血糖,其中使用Accu-chek血糖仪和血糖试纸测量小鼠禁食后血糖。结果如图8A所示,从图8A可知,降血脂药与SHED联合应用降血糖能力显著优于单纯SHED治疗。
进行腹膜内葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT)前,将动物禁食12小时,然后腹腔注射20%葡萄糖溶液(每公斤体重2克葡萄糖)。注射后0、15、 30、60、90和120分钟测量小鼠尾静脉血糖值。结果如图8B所示,可知,降血脂药与 SHED联合应用后小鼠糖耐量显著优于单纯SHED治疗。
参考文献:
1Cho N H,Shaw J E,Karuranga S et al.IDF Diabetes atlas:globalestimates of diabetes prevalence for 2017and projections for 2045.DiabetesRes Clin Pract 2018,138:271-281.
2Ingelfinger JR,Jarcho JA.Ingelfinger JR et al.Increase in theincidence of diabetes and its implications.N Engl J Med 2017;376:1473-1474.
3Magliano DJ,Islam RM,Barr ELM et al.Trends in incidence of total ortype 2diabetes: systematic review.BMJ 2019;11:366:l5003.
4Li L,Krznar P,Erban A et al.Metabolomics identifies a biomarkerrevealing in vivo loss of functionalβcell mass before diabetes onset.Diabetes2019;68:2272-2286.
5Batchuluun B,Al Rijjal D,Prentice KJ et al.Elevated medium-chainacylcarnitines are associated with gestational diabetes mellitus and earlyprogression to type 2diabetes and induce pancreaticβ-celldysfunction.Diabetes 2018;67:885-897.
6Halban PA,Polonsky KS,Bowden DW et al.β-cell failure in type2diabetes:postulated mechanisms and prospects for prevention andtreatment.Diabetes Care 2014;37:1751-1758.
7Freeland B,Farber MS,Freeland B et al.Type 2diabetes drugs:areview.Home Healthc Now 2015;33:304-310;quiz 311-312.
8Hompesch M,Patel DK,LaSalle JR et al.Pharmacokinetic andpharmacodynamic differences of new generation,longer-acting basal insulins:potential implications for clinical practice in type 2diabetes.Postgrad Med2019;131:117-128.
9Banerjee M,Khursheed R,Yadav AK et al.A systematic review onsynthetic drugs and phytopharmaceuticals used to manage diabetes.CurrDiabetes Rev 2020;16:340-356.
10 Wallner K,Pedroza RG,Awotwe I et al.Stem cells and beta cellreplacement therapy:a prospective health technology assessment study.BMCEndocr Disord 2018;18:6.
11 Kawser H M,Abdal D A,Han J et al.Recent advances in diseasemodeling and drug discovery for diabetes mellitus using induced pluripotentstem cells.Int J Mol Sci 2016;17:256.
12 El-Badawy A,El-Badri N.Clinical efficacy of stem cell therapy fordiabetes mellitus:a meta-analysis.PLoS One 2016;11:e151938.
13 Gibly R F,Graham J G,Luo X et al.Advancing islet transplantation:from engraftment to the immune response.Diabetologia 2011;54:2494-2505.
14 Ishikawa T,Banas A,Teratani T et al.Regenerative cells fortransplantation in hepatic failure.Cell Transplant 2012;21:387-399.
15 Tang W.Challenges and advances in stem cell therapy.Biosci Trends2019;13:286.
16 Mousavinejad M,Andrews P W,Shoraki E K.Current biosafetyconsiderations in stem cell therapy.Cell J 2016;18:281-287.
17 Gilbert D M.The future of human embryonic stem cell research:addressing ethical conflict with responsible scientific research.Med SciMonit 2004;10:A99-A103.
18 Ankrum J A,Ong J F,Karp J M.Mesenchymal stem cells:immune evasive,not immune privileged.Nat Biotechnol 2014;32:252-260.
19 Murphy M B,Moncivais K,Caplan A I.Mesenchymal stem cells:environmentally responsive therapeutics for regenerative medicine.Exp Mol Med2013;45:e54.
20 Miura M,Gronthos S,Zhao M et al.SHED:stem cells from humanexfoliated deciduous teeth.Proc Natl Acad Sci U S A 2003;100:5807-5812.
21 Wang D,Li J,Zhang Y et al.Umbilical cord mesenchymal stem celltransplantation in active and refractory systemic lupus erythematosus:amulticenter clinical study.Arthritis Res Ther 2014;16:R79.
22 Wang D,Zhang H,Liang J et al.Allogeneic mesenchymal stem celltransplantation in severe and refractory systemic lupus erythematosus:4 yearsof experience.Cell Transplant 2013;22:2267-2277.
23 Gu F,Wang D,Zhang H et al.Allogeneic mesenchymal stem celltransplantation for lupus nephritis patients refractory to conventionaltherapy.Clin Rheumatol 2014;33:1611-1619.
24 Jiang R,Han Z,Zhuo G et al.Transplantation of placenta-derivedmesenchymal stem cells in type 2 diabetes:a pilot study.Front Med 2011;5:94-100.
25 Bhansali S,Dutta P,Kumar V et al.Efficacy of autologous bonemarrow-derived mesenchymal stem cell and mononuclear cell transplantation intype 2 diabetes mellitus:a randomized,placebo-controlled comparativestudy.Stem Cells Dev 2017;26:471-481。
- 牙髓干细胞在制备治疗糖尿病药物中的应用
- 新甾体皂苷类化合物及其制备方法和在制备治疗2型糖尿病药物中的应用
