腺胃坏死病毒实时荧光定量PCR检测试剂及应用
文献发布时间:2023-06-19 11:13:06
技术领域
本发明涉及生物基因工程技术领域,特别是涉及腺胃坏死病毒实时荧光定量PCR检测试剂及应用。
背景技术
鸡传染性病毒性腺胃炎(Transmissible viral proventriculitis,TVP)是一种由病毒引起的慢性消耗性消化道疾病,其可导致典型腺胃炎症状。该病多发于雏鸡,以发育不良、生长迟缓、粪便过料为主要特征。鸡群一旦发病,发病初期表现为缩头垂尾、羽毛蓬松、精神沉郁、挑食甩料;中后期,病鸡体型消瘦明显、腹泻、所排粪便中掺杂未消化的饲料;发病严重的鸡则会出现全身苍白,最终衰竭而亡。剖检可见腺胃肿大如球形,呈乳白色,触摸坚硬,腺胃壁水肿、增厚,腺胃乳头肿胀、出血、溃疡等病理变化,病理切片可见大量炎性细胞浸润腺胃组织、导管上皮细胞增生变性、抗氧化细胞坏死等病理变化。
近年来研究发现,腺胃坏死病毒(Chicken proventricular necrosis virus,CPNV)属于双链RNA病毒科、Birnacirus病毒属,与传染性病毒性腺胃炎密切相关,并推测CPNV是引起TVP的最主要病原,然而目前对于CPNV的检测尚无标准化、精准化方案。
发明内容
基于此,有必要提供一种特异性高、灵敏度强的腺胃坏死病毒实时荧光定量PCR检测试剂及应用。
用于检测腺胃坏死病毒的引物对,其序列如SEQ ID NO.6和SEQ ID NO.15所示。
一种腺胃坏死病毒检测试剂盒,包括所述的引物对。
在其中一些实施例中,所述腺胃坏死病毒检测试剂盒还包括dNTPs、Mg
在其中一些实施例中,所述双链DNA结合荧光染料选自溴化乙锭、SYBR Green、PicoGreen中的任一种。
在其中一些实施例中,所述腺胃坏死病毒标准品为含腺胃坏死病毒的质粒。
在其中一些实施例中,所述腺胃坏死病毒检测试剂盒还包括反转录酶和反转录引物。
一种腺胃坏死病毒的非诊断目的检测方法,包括以下步骤:
a、以已知浓度的含腺胃坏死病毒的质粒为模板、以双链DNA结合荧光染料以及SEQID NO.6和SEQ ID NO.15为引物对进行实时荧光定量PCR反应,建立标准曲线;
b、在与步骤a相同的条件下对待测样本进行实时荧光定量PCR,并根据所述标准曲线确定所述待测样本中的腺胃坏死病毒的拷贝数。
在其中一些实施例中,所述实时荧光定量PCR反应的退火温度为56℃~60℃,循环数为38~42。
在其中一些实施例中,还包括在38~42个循环之后,按照下述反应条件进行反应以得到熔解曲线的步骤:先升至96℃~95℃,后降到67℃~63℃,再升至96℃~95℃,每0.5℃读板一次。
在其中一些实施例中,所述实时荧光定量PCR的反应体系为:10μL的实时荧光定量PCR的反应体系中,加入SEQ ID NO.6和SEQ ID NO.15所示引物各0.5μL,质粒模板或待测样本0.5μL。
在其中一些实施例中,如SEQ ID NO.6所示引物和如SEQ ID NO.15所示引物的工作浓度分别为100nM。
本发明以引起传染性病毒性腺胃炎的CPNV为研究对象,发现最佳定量检测引物(F1-3:5’-TGTGAGAGCAACCTGAACCC-3’;R2:5’-TCTTCTTGATTGGCGTCGCT-3’),该引物对可以与检测样本中的CPNV靶核酸序列更特异性、更灵敏的结合。并优化获得扩增引物最佳反应终浓度,成功建立腺胃坏死病毒实时荧光定量PCR检测方法,通过敏感性及特异性检验,结果证实该方法可以特异性检测到样品中的CPNV,较传统检测方法既可提高检测敏感性,又可做到定量分析的效果,本发明的方法尤其适用于检测来源于鸡的腺胃坏死病毒。因此该方法的建立将为鸡传染性病毒性腺胃炎爆发风险评估提供理论依据,对养鸡业的发展具有重要意义。本研究所建立的腺胃坏死病毒实时荧光定量PCR检测方法可填补CPNV的检测方面的空白,为鸡传染性病毒性腺胃炎的精准防控提供技术支撑。
附图说明
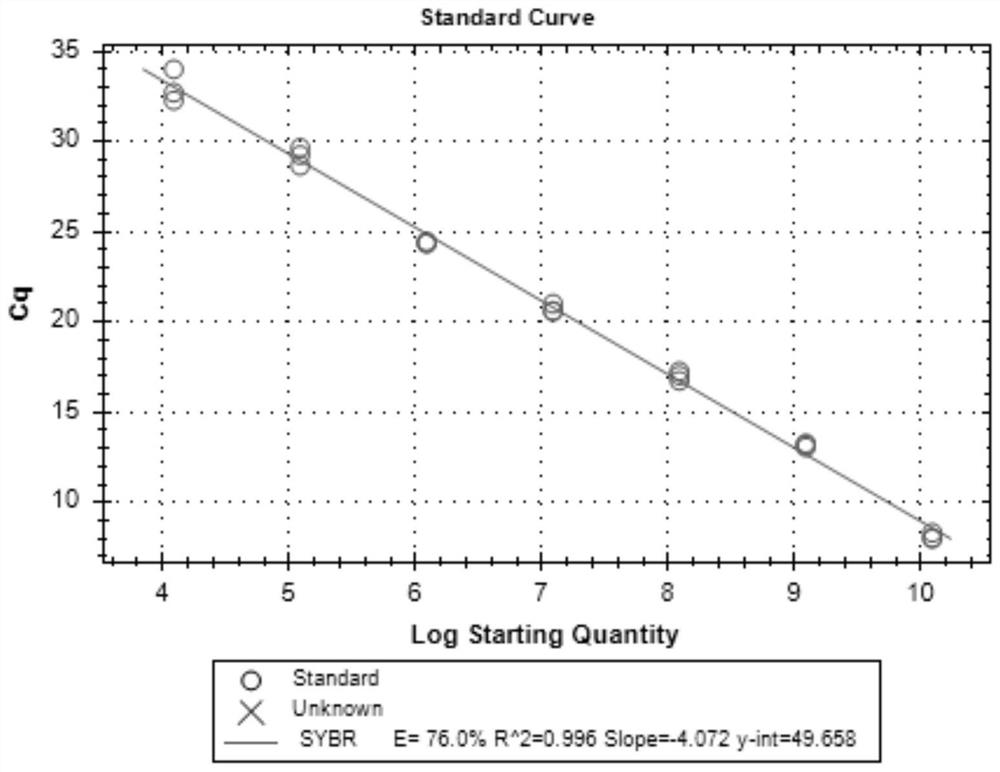
图1为本发明一实施例的P-CPNV-VP1基因SYBR TB Green实时荧光定量PCR标准曲线图;
图2A为本发明一实施例的P-CPNV-VP1基因SYBR TB Green实时荧光定量PCR敏感性检验扩增曲线;
图2B为本发明一实施例的P-CPNV-VP1基因SYBR TB Green实时荧光定量PCR敏感性检验熔解曲线;
图3A为本发明一实施例的P-CPNV-VP1基因SYBR TB Green实时荧光定量PCR特异性检验扩增曲线;
图3B为本发明一实施例的P-CPNV-VP1基因SYBR TB Green实时荧光定量PCR特异性检验熔解曲线;
图4A为本发明实施例的其他引物实时荧光定量PCR扩增曲线;
图4B为本发明实施例的其他引物实时荧光定量PCR熔解曲线;
图5A为本发明实施例的其他引物浓度实时荧光定量PCR扩增曲线;
图5B为本发明实施例的其他引物浓度熔解曲线。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
如本文中所使用的,术语“靶核酸序列”、“靶核酸”和“靶序列”是指待检测的目标核酸序列。在本申请中,术语“靶核酸序列”、“靶核酸”和“靶序列”具有相同的含义,并且可互换使用。如本文中所使用的,术语“靶向序列”和“靶特异性序列”是指,在允许核酸杂交、退火或扩增的条件下,能够与靶核酸序列选择性/特异性杂交或退火的序列,其包含与靶核酸序列互补的序列。在本申请中,术语“靶向序列”和“靶特异性序列”具有相同的含义,并且可互换使用。易于理解的是,靶向序列或靶特异性序列对于靶核酸序列是特异性的。换言之,在允许核酸杂交、退火或扩增的条件下,靶向序列或靶特异性序列仅与特定的靶核酸序列杂交或退火,而不与其他的核酸序列杂交或退火。
如本文中所使用的,术语“上游”用于描述两条核酸序列(或两个核酸分子)的相对位置关系,并且具有本领域技术人员通常理解的含义。例如,表述“一条核酸序列位于另一条核酸序列的上游”意指,当以5'至3'方向排列时,与后者相比,前者位于更靠前的位置(即,更接近5'端的位置)。如本文中所使用的,术语“下游”具有与“上游”相反的含义。
如本文中所使用的,术语“上游引物”是指,包含与靶核酸序列互补的序列的一段寡核苷酸序列,其在允许核酸杂交(或退火)或扩增的条件下,能够与靶核酸序列杂交(或退火),并且,在扩增的情况下,上游引物充当核酸合成的起始点。“下游引物”具有相反的含义。
如本说明书中使用的术语“载体”,也称为表达构建体。术语“载体”是指能够被引入细胞或能够将包含在其中的蛋白和/或核酸引入细胞的蛋白或多核苷酸或其混合物。载体的实例包括但不限于质粒、黏粒、噬菌体、病毒或人工染色体。特别地,使用载体将本发明的启动子和转基因转运到合适的宿主细胞中。载体可以包含有助于载体在宿主细胞中自主复制的“复制子”多核苷酸序列。外源DNA定义为异源DNA,其为宿主细胞中不天然存在的DNA,其例如复制载体分子、编码可选择的或可筛选的标记、或编码转基因。进入宿主细胞后,载体可以独立于宿主染色体DNA进行复制或与宿主染色体DNA同时复制,并且可以产生载体的几个拷贝及其插入的DNA。此外,载体还可含有必需的元件,该必需的元件允许将插入的DNA转录成mRNA分子或以其他方式将插入的DNA复制成多拷贝的RNA。载体还可以包含调节目的基因表达的“表达控制序列”。通常,表达控制序列是多肽或多核苷酸,例如但不限于启动子、增强子、沉默子、绝缘子或抑制子。在包含编码一种或多于一种目的基因产物的多于一种多核苷酸的载体中,表达可以通过一种或多于一种表达控制序列一起控制或分开控制。更具体地,载体上包含的每种多核苷酸可以通过单个表达控制序列控制或者载体上包含的所有多核苷酸可以通过单个表达控制序列进行控制。包含在由单个表达控制序列控制的单个载体上的多核苷酸可以形成开放阅读框。一些表达载体另外含有与插入的DNA相邻的序列元件,该序列元件增加表达的mRNA的半衰期和/或允许mRNA翻译成蛋白分子。因此可以快速合成由插入的DNA编码的许多mRNA和多肽分子。
如本文中所使用的,术语“PCR反应”具有本领域技术人员通常理解的含义,其是指使用核酸聚合酶和引物来扩增靶核酸的反应(聚合酶链式反应)。如本文中所使用的,术语“荧光强度”、“荧光振幅”与“荧光大小”同等含义。
通常,实时聚合酶链反应(qPCR)在PCR期间(即实时)监测靶标DNA分子的扩增。实时PCR可定量和半定量使用。实时PCR中检测PCR产物的两种常见方法是:(1)插入双链DNA的双链DNA结合荧光染料(例如溴化乙锭、SYBR Green、PicoGreen中的任一种),以及(2)由使用荧光报告分子标记的寡核苷酸组成的序列特异性DNA探针,只有在探针与其互补序列杂交后,所述荧光报告分子才允许进行检测(例如TAQMAN)。在本发明的方法中,采用插入双链DNA的双链DNA结合荧光染料的方法进行实时定量PCR反应,具体采用SYBR Green实时定量PCR反应。
SYBR染料通过与PCR过程中形成的DNA结合来检测聚合物链反应(PCR)产物。其工作原理为:当SYBR染料加入到样品中后,它可立即与样品中的所有双链DNA进行结合。在PCR过程中,DNA聚合酶对产生PCR产物的目标序列进行扩增。随后,SYBR染料会与每一个新产生的双链DNA分子进行结合。随着PCR进行,生成更多PCR产物。SYBR染料可与所有的双链DNA结合,因此荧光强度也会随着PCR产物的增加而增加。SYBR PCR无需探针,可降低检测设置和运行成本。
如本文中所使用的,术语“熔解曲线”具有本领域技术人员通常理解的含义,其是指,通过测定双链核酸分子的熔解曲线来分析双链核酸分子存在或其身份(identity)的方法,其通常用于评估双链核酸分子在加热过程中的解离特征。
本发明实施例提供一种用于检测腺胃坏死病毒的引物对,其序列如SEQ ID NO.6和SEQ ID NO.15所示。该引物对可以与检测样本中的CPNV靶核酸序列更特异性、更灵敏的结合。
本发明实施例还提供一种腺胃坏死病毒检测试剂盒,包括所述的引物对。
在一些实施方式中,所述腺胃坏死病毒检测试剂盒,还包括dNTPs、Mg
SYBR Green染料包括SYBR Green II染料和SYBR Green I。SYBR Green II是一种高敏感的核酸染色试剂,可以对RNA或者是单链的DNA进行染色。SYBR Green I是一种结合于所有dsDNA双螺旋小沟区域的具有绿色激发波长的染料。在游离状态下,SYBR Green I发出微弱的荧光,但一旦与双链DNA结合后,荧光大大增强。因此,SYBR Green I的荧光信号强度与双链DNA的数量相关,可以根据荧光信号检测出PCR体系存在的双链DNA数量。在本发明的方法中,SYBR Green染料优选自SYBR Green I。
在一些实施方式中,所述腺胃坏死病毒标准品为含腺胃坏死病毒的质粒。
在一些实施方式中,所述腺胃坏死病毒检测试剂盒,还包括反转录酶,用于现将样本中的RNA反转录为cDNA再进行PCR扩增。还可包括反转录引物。
本发明实施例还提供一种腺胃坏死病毒的非诊断目的检测方法,包括以下步骤:
a、以已知浓度的含腺胃坏死病毒的质粒为模板、以双链DNA结合荧光染料以及SEQID NO.1和SEQ ID NO.2为引物对进行实时荧光定量PCR反应,建立标准曲线;
b、在与步骤a相同的条件下对待测样本进行实时荧光定量PCR,并根据所述标准曲线确定所述待测样本中的腺胃坏死病毒的拷贝数。
在本发明的方法中,样本可以是任何待检测的样品。例如,在某些实施方案中,样品包含或是DNA(例如基因组DNA或cDNA)。在某些实施方案中,样品包含或者是RNA(例如mRNA)。在某些实施方案中,样品包含或者是核酸的混合物(例如DNA的混合物,RNA的混合物,或者DNA和RNA的混合物)。当待检测的样品或靶核酸序列为mRNA时,优选地,在进行本发明的方法之前,进行逆转录反应,以获得与所述mRNA互补的cDNA。
待检测的样本或靶核酸序列还可以是任何形式的核酸序列,例如基因组序列,人工分离或片段化的序列,合成的序列等。
待检测的样本可取自含有腺胃坏死病毒的组分。在本发明的方法中,待检测样本可以取自于血液、尿液、胃液、唾液、粪便等。
在本发明的方法中,待检测样本可以于动物或人类。
在一些实施方式中,所述腺胃坏死病毒来源于鸡。
在一些实施方式中,所述实时荧光定量PCR反应的退火温度为56℃~60℃,循环数为38~42。
在一些具体实施方式中,所述实时荧光定量PCR反应的反应条件为:96℃~95℃预变性1.5min~2.5min;95℃~94℃变性8sec~12sec,60℃~56℃退火25sec~35sec,70℃~74℃延伸30sec~32sec,38~42个循环。
在一些实施方式中,还包括在38~42个循环之后,按照下述反应条件进行反应以得到熔解曲线的步骤:先升至96℃~95℃,后降到67℃~63℃,再升至96℃~95℃,每0.5℃读板一次。
在一些实施方式中,10μL的实时荧光定量PCR的反应体系中,加入SEQ ID NO.6和SEQ ID NO.15所示引物各0.5μL,质粒模板或待测样本0.5μL
在一些具体实施方式中,所述实时荧光定量PCR的反应体系为:非水类SYBR Green实时荧光定量PCR扩增试剂5μL,100nM的上下游引物各0.5μL,质粒模板或待测样本0.5μL,超纯水3.5μL。
以下为具体实施例。
本实施例提供一种鸡腺胃坏死病毒SYBR Green实时荧光定量PCR检测方法,它包括:
步骤一,构建Marker gene-P-CPNV-VP1-T质粒:利用生物信息学分析,确定全长为764bp的部分P-CPNV-VP1基因序列(1730bp-2101bp)为Marker gene,设计扩增引物上游引物:5’-GCAGAAGCGACGCCAATCAAG-3’(SEQ ID NO.2),下游引物:5’-CGCCACTGTTTTGGTGAGCTTG-3’(SEQ ID NO.3)。以前期所构建的CPNV-VP1-T质粒为模板,对P-CPNV-VP1基因进行PCR扩增,同时以ddH
SEQ ID NO.1:
1730bp-CCTACGAAACACCACTCAGTGGAAAACACCGGGGATGCCATCGGGCACCTCACTCACCTTTCTAATTAATGACCTGGTGATGGGGTGTGCGGTCCAGCTGGCCCTGGAGAACGGTGTGAATCTCGCCGACACTAGCTCCACCATTGAGTTCATGGCCAAGTGTGGCATCAGGCTGAAAGTGGAATGTGAGAGCAACCTGAACCCCGGTCTAACCCCCTTCAATGGACTGGGCTCCCCGGGCAGGCTGGACCTGCTGGGCTTCGACCTCATGGGCATGCGAGTATCAGATCAGGAGGCCAGGTTTCTAGTGCTCAATGAGGACAGGTGCTTGGACTCCCTCGTATGGGGCAGAAGCGACGCCAATCAAGAAGAGTTAGACGATCTAATCAGTGCGAAAGGCAAACAGCTATCCATGCTAGTGAGCGCATTGCTGAATGGCCAGGGCACGTACAAGCCCATAGAAGGGCCGATTCGCACGGCTGTGAGGCGACTCCAGGAGGAATTAACCGTCGAAATTGACGAAGCTGCTGTGGCGGGTGGCGTGCAGTCGAGCTGGATCACCAGCAACGGTGGGCCGAGCTGTGCAGTAATAGTCGGCATGAGGCTGGGGGTGGAGCCCGGCTCGGAGGAGGCCTGGTCGCTGATGAGGGAGGCGAGCAGGGCTCCGGCCGCGGGCATCCGCCCCCCTGACCTCGCGCGCTCCCAAGCGGGGCTCCGGCGCCGTGGCCGAGGTCCCGCCGGCCAAGCTCACCAAAACAGTGGCG-2101bp
步骤二,筛选及优化SYBR TB Green实时荧光定量PCR引物:设计SYBR TB Green实时荧光定量PCR引物(F1-1:5’-AATGTGAGAGCAACCTGAACCC-3’;F1-2:5’-TGTGAGAGCAACCTGAACCCCG-3’;F1-3:5’-TGTGAGAGCAACCTGAACCC-3’;F1-4:5’-AATGTGAGAGCAACCTGAACCCCG-3’;F2:5’-CTCCCCGGGCAGGCTGGACCTGC-3’;F3:5’-TGGGCTTCGACCTCATGGGCATGC-3’;F4:5’-GAGTATCAGATCAGGAGGCCAGG-3’;F5:5’-TTTCTAGTGCTCAATGAGGACAGG-3’;F6:5’-TGCTTGGACTCCCTCGTATGGGGC-3’;F7:5’-AGAAGCGACGCCAATCAAGAAGA-3’;R1:5’-CTCTTCTTGATTGGCGTCGCTTC-3’;R2:5’-TCTTCTTGATTGGCGTCGCT-3’;R3:5’-TCTTCTTGATTGGCGTCGCTTCTGC-3’),分别对质粒模板进行荧光定量PCR扩增,反应程序为:95℃预变性2min;94℃变性10sec,58℃退火30sec,72℃延伸31sec,40个循环;反应结束后先升至95℃10sec,后降到65℃,再以0.5℃/min升至95℃,每0.5℃读板一次,由此得到熔解曲线。如图1-3(SEQ ID NO.6和SEQ ID NO.15)和图4A、图4B(除SEQ ID NO.6和SEQ ID NO.15外的其他引物对)所示,根据扩增曲线及熔解曲线结果,筛选获得“F1-3:5’-TGTGAGAGCAACCTGAACCC-3’;R2:5’-TCTTCTTGATTGGCGTCGCT-3’”为最佳检测引物,从图中可以看出,其他引物对都无法扩增得到正确的曲线。随后以此对引物摸索引物浓度,对上下游引物终浓度(500nM、100nM、50nM)进行优化,反应程序为:95℃预变性2min;94℃变性10sec,58℃退火30sec,72℃延伸31sec,40个循环;反应结束后先升至95℃10sec,后降到65℃,再以0.5℃/min升至95℃,每0.5℃读板一次,由此得到熔解曲线。确定最佳引物工作浓度。根据扩增曲线和熔解曲线结果,获得最佳引物终浓度为上下游各100nM。如图1(100nM)和图5A、图5B(其他浓度)所示。
步骤三,建立标准曲线:选取稀释的10
步骤四,敏感性检验:选取10
步骤五,特异性检验:分别以实验室所保存取分别含鸡传染性贫血病毒(Chickeninfectious anemia virus,CIAV)、马立克氏病毒(Marek's disease virus,MDV)、传染性支气管炎病毒(Infectious bronchitis virus,IBV)、传染性法氏囊病毒(Infectiousbursal disease virus,IBDV)、网状内皮增生症病毒(Reticuloendotheliosis virus,REV)的核酸样本进行特异性试验,同时设立阴性对照。按照步骤二荧光定量PCR反应体系及程序分别进行qPCR扩增。如图3A、图3B所示。
其中步骤二中的SYBR TB Green实时荧光定量PCR引物的设计,如表1。
表1 SYBR TB Green实时荧光定量PCR引物
步骤二中的PCR扩增的PCR反应体系如表2。
表2引物筛选PCR反应体系(单位:μl)
经过生物信息学分析,筛选764bp的P-CPNV-VP1基因序列(1730bp -2101bp)作为SYBR TB Green实时荧光定量PCR检测的Marker基因,结果成功构建CPNV-VP1-T质粒,测序正确。
选取质粒浓度为1.22×10
分别对不同浓度的DNA模板(10
分别以利用本方法分别对CAIV、MDV、IBV、IBDV、REV、CPNV和GyV3进行扩增,从扩增曲线看,其他病原均无扩增,只有CPNV能扩增出S型曲线,且引物熔解曲线显示单一的峰,Tm值为87.5℃,表明VP1基因荧光定量PCR扩增中无非特异性产物和引物二聚体生成,说明引物的特异性良好,扩增结果如图3A、图3B,此为特异性检测结果。
本发明以引起鸡传染性病毒性腺胃炎的CPNV为研究对象,发现最佳定量检测引物(F1-3:5’-TGTGAGAGCAACCTGAACCC-3’;R2:5’-TCTTCTTGATTGGCGTCGCT-3’),该引物对可以与检测样本中的CPNV靶核酸序列更特异性、更灵敏的结合。并优化获得扩增引物最佳反应终浓度,成功建立腺胃坏死病毒实时荧光定量PCR检测方法,通过敏感性及特异性检验,结果证实该引物对和对应的方法可以特异性检测到样品中的CPNV,较传统检测方法既可提高检测敏感性,又可做到定量分析的效果,本发明的方法尤其适用于检测来源于鸡的腺胃坏死病毒。因此该方法的建立将为鸡传染性病毒性腺胃炎爆发风险评估提供理论依据,对养鸡业的发展具有重要意义。本研究所建立的腺胃坏死病毒实时荧光定量PCR检测方法可填补CPNV的检测方面的空白,为鸡传染性病毒性腺胃炎的精准防控提供技术支撑。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
序列表
<110> 广东省农业科学院动物卫生研究所
<120> 腺胃坏死病毒实时荧光定量PCR检测试剂及应用
<160> 16
<170> SIPOSequenceListing 1.0
<210> 1
<211> 764
<212> DNA
<213> Artificial Sequence
<400> 1
cctacgaaac accactcagt ggaaaacacc ggggatgcca tcgggcacct cactcacctt 60
tctaattaat gacctggtga tggggtgtgc ggtccagctg gccctggaga acggtgtgaa 120
tctcgccgac actagctcca ccattgagtt catggccaag tgtggcatca ggctgaaagt 180
ggaatgtgag agcaacctga accccggtct aacccccttc aatggactgg gctccccggg 240
caggctggac ctgctgggct tcgacctcat gggcatgcga gtatcagatc aggaggccag 300
gtttctagtg ctcaatgagg acaggtgctt ggactccctc gtatggggca gaagcgacgc 360
caatcaagaa gagttagacg atctaatcag tgcgaaaggc aaacagctat ccatgctagt 420
gagcgcattg ctgaatggcc agggcacgta caagcccata gaagggccga ttcgcacggc 480
tgtgaggcga ctccaggagg aattaaccgt cgaaattgac gaagctgctg tggcgggtgg 540
cgtgcagtcg agctggatca ccagcaacgg tgggccgagc tgtgcagtaa tagtcggcat 600
gaggctgggg gtggagcccg gctcggagga ggcctggtcg ctgatgaggg aggcgagcag 660
ggctccggcc gcgggcatcc gcccccctga cctcgcgcgc tcccaagcgg ggctccggcg 720
ccgtggccga ggtcccgccg gccaagctca ccaaaacagt ggcg 764
<210> 2
<211> 21
<212> DNA
<213> Artificial Sequence
<400> 2
gcagaagcga cgccaatcaa g 21
<210> 3
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 3
cgccactgtt ttggtgagct tg 22
<210> 4
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 4
aatgtgagag caacctgaac cc 22
<210> 5
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 5
tgtgagagca acctgaaccc cg 22
<210> 6
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 6
tgtgagagca acctgaaccc 20
<210> 7
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 7
aatgtgagag caacctgaac cccg 24
<210> 8
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 8
ctccccgggc aggctggacc tgc 23
<210> 9
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 9
tgggcttcga cctcatgggc atgc 24
<210> 10
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 10
gagtatcaga tcaggaggcc agg 23
<210> 11
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 11
tttctagtgc tcaatgagga cagg 24
<210> 12
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 12
tgcttggact ccctcgtatg gggc 24
<210> 13
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 13
agaagcgacg ccaatcaaga aga 23
<210> 14
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 14
ctcttcttga ttggcgtcgc ttc 23
<210> 15
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 15
tcttcttgat tggcgtcgct 20
<210> 16
<211> 25
<212> DNA
<213> Artificial Sequence
<400> 16
tcttcttgat tggcgtcgct tctgc 25
- 腺胃坏死病毒实时荧光定量PCR检测试剂及应用
- 一种GAS5基因的实时荧光定量PCR检测试剂盒及应用
