一种产磷脂酶D的基因工程菌及其构建方法与在sdLDL-C检测试剂盒开发中的应用
文献发布时间:2023-06-19 11:16:08
技术领域
本发明涉及基因工程技术领域,尤其涉及一种产磷脂酶D的基因工程菌及其构建方法与在sdLDL-C检测试剂盒开发中的应用。
背景技术
磷脂酶D(Phospholipase D,简称PLD,EC 3.1.4.4)是作用于磷脂分子中磷酸与有机碱间磷酰氧键(P-O)的一类酶。作为磷酸二酯酶超家族的一员,PLD是催化磷脂水解第一步反应的关键酶之一,参与细胞脂质代谢、信号转导及生物膜形成等。此外,它还可以催化各种羟基化合物与磷脂碱基结合形成新的磷脂,这一重要的特性称为磷脂酶D的碱基交换反应(Base exchange reaction),也称为转磷脂反应(Transphosphatidylation)。利用PLD的这一重要特性可以合成稀有磷脂(如磷脂酰丝氨酸、磷脂酰肌醇、磷脂酰乙醇胺、磷脂酰甘油以及新型甘油醚磷脂等)、新型药物释放系统等。因此,PLD被广泛应用于食品、化妆品和医药等领域。
磷脂酶D广泛分布于病毒、动物、植物和微生物中。由于具有较好的转磷脂活性、较广泛的底物特异性和较强的底物耐受性,微生物来源的磷脂酶D在工业生产中的应用较为广泛。
自20世纪70年代以来,已报道的PLD主要来源于革兰氏阳性菌,包括链霉菌属(Streptomyces)、轮枝链霉菌属(Streptoverticillium)、芽胞杆菌属(Bacillus)和棒状杆菌属(Corynebacterium)等。其中,链霉菌来源的PLD是目前报道最多的,且它们具有较好的水解和转磷脂活性。此外,少数酵母菌和丝状真菌也能生产PLD,包括酵母(Saccharomyces)、假丝酵母属(Candida)、裂殖酵母属(Schizosaccaromyces)和镰刀菌属(Fusarium)等。
目前,国外对微生物PLD的研究已较为成熟,一些酶制剂公司已筛选出高产PLD的链霉菌菌株。但链霉菌较长的生长周期(近7d)给实际生产和应用带来了许多困难,而且商品化PLD的价格非常昂贵,如Sigma-Aldrich公司的Streptomyces sp.PLD酶制剂,每毫克售价约一千元人民币左右。而目前国内由微生物发酵制备PLD的研究才刚刚起步,基本上都停留在实验室水平,还没有相关的PLD产品。对进口酶源的高度依赖严重影响了我国下游产业的发展,包括体外诊断试剂的自主研发。
发明内容
本发明所要解决的技术问题在于提供一种产磷脂酶D的基因工程菌及其构建方法与在sdLDL-C检测试剂盒开发中的应用。
本发明采用以下技术方案解决上述技术问题:
一种产磷脂酶D的基因工程菌,所述基因工程菌包括如SEQ ID NO.2所示的核苷酸序列。
一种产磷脂酶D的基因工程菌的构建方法,包括如下步骤:
(1)磷脂酶D基因密码子的优化
选择基因序列如SEQ ID NO.1所示的链霉菌来源的磷脂酶D基因进行密码子优化,得到适合在毕赤酵母中高效表达的基因序列;
(2)磷脂酶D基因糖基化位点分析
将优化过的磷脂酶D基因利用相关软件分析蛋白的糖基化位点;
(3)糖基化位点定点突变及全基因合成
为了消除潜在的被糖基化修饰位点影响,将潜在的糖基化位点的天冬酰胺变为谷氨酰胺,并将密码子优化及糖基化位点改造后的序列进行全基因合成;最终改造后的基因序列如SEQ ID NO.2所示;
(4)初步工程菌的获得
将步骤(3)完成的序列连接在pPIC9K载体上,且基因上下游分别插入NotI和EcoRI酶切位点,接着转化入DH5a菌株获得初步工程菌;
(5)pPIC9K-PLD质粒的抽提
对步骤(4)得到的初步工程菌进行质粒提取,并采用琼脂糖凝胶电泳检测提取质粒的质量,检测合格的pPIC9K-PLD质粒继续用于后续实验;
(6)毕赤酵母GS115细胞的转化
制备毕赤酵母GS115感受态细胞,并将线性化的pPIC9K-PLD和pPIC9K质粒利用电转方法转入GS115酵母感受态细胞;
(7)pPIC9K-PLD重组阳性转化子的鉴定
挑取不同的pPIC9K-PLD重组转化子单克隆进行PCR鉴定;将鉴定为阳性的菌株克隆扩大培养,即为目标所需的产磷脂酶D的基因工程菌。
作为本发明的优选方式之一,所述步骤(1)中,采用在线密码子优化软件不改变蛋白编码序列,将原始的磷脂酶基因三联体密码子中最后一个碱基改为酵母密码子偏爱的碱基;所述步骤(2)中,利用NetNGlyc 1.0 Server在线软件分析蛋白的糖基化位点。
作为本发明的优选方式之一,所述步骤(6)中,毕赤酵母GS115感受态细胞的制备方法如下:
①将保存在15%甘油中GS115菌株从-80℃冰箱取出,用接种环蘸取菌液,在YPD平板上进行划线,30℃培养2天;
②从YPD平板上挑取单克隆于5mL YPD液体培养基中,30℃、220rpm条件下振荡培养2天;
③按照1%接种量,将培养2天的菌液接种到100mL/250mL YPD液体培养基中,振荡培养至OD
④用10mL无菌离心管收集细胞;离心条件为:4℃,1500×g,离心5min,菌液8mL;
⑤用8mL预冷无菌水重悬并离心收集细胞;离心条件为:4℃,1500×g,离心5min;
⑥用4mL预冷无菌水重悬并离心收集细胞;离心条件为:4℃,1500×g,离心5min;
⑦用4mL 1M预冷无菌山梨醇重悬并离心收集细胞;离心条件为:4℃,1500×g,离心5min;
⑧加入预冷的160μL 1M预冷无菌山梨醇重悬细胞,取80μL细胞分装到1.5mL管中,冻存于-80℃冰箱备用。
作为本发明的优选方式之一,所述步骤(6)中,线性化pPIC9K-PLD和pPIC9K质粒的获取方法为:选择线性化酶切位点为Stu I,并建立如下酶切反应体系:50μL pPIC9K-PLD/pPIC9K,4μL QuickCut
作为本发明的优选方式之一,所述步骤(6)中,毕赤酵母GS115的电转化步骤如下:
①取自制的80μL酵母感受态细胞,放在冰上溶解,将5-10μg线性化质粒DNA加入到感受态细胞中,混匀,转入预冷的0.2cm电转杯中,冰浴5min;
②电转的参数设置成实验所需参数,电击后立刻向电转杯中加入1mL预冷的1M山梨醇;
③混合后,将混合物转到无菌的离心管中,28℃培养箱静置2h;
④4000×g离心30s,去500μL上清,取200μL菌液均匀涂在不含组氨酸的MD平板上,置于28℃培养箱培养2-3天。
作为本发明的优选方式之一,所述步骤(7)中,pPIC9K-PLD重组阳性转化子的具体鉴定方法为:挑取不同的pPIC9K-PLD重组转化子单克隆至10μL无菌水中,涡旋混匀;取1μL混合液作为PCR反应的模板,用pPIC9K的通用引物5'AOX Primer和3'AOX Primer鉴定阳性克隆;
其中,建立的PCR反应体系为:1μL菌液,0.2μM 5'AOX Primer,0.2μM 3'AOXPrimer,10μL 2×Taq Master mix,添加无菌水至20μL;
PCR扩增条件为:94℃变性30sec,55℃退火30sec,72℃延伸3min;20个循环,最后72℃延伸7min,电泳检测。
一种上述产磷脂酶D的基因工程菌在sdLDL-C检测试剂盒开发中的应用,利用所述产磷脂酶D的基因工程菌所产生的磷脂酶D作为催化剂生产sdLDL-C检测试剂盒。
作为本发明的优选方式之一,利用所述基因工程菌获得磷脂酶D的方法为:
(1)重组PLD蛋白的摇瓶发酵
①将pPIC9K-PLD菌株,接种至5mL BMGY试管中,28℃、220-250rpm过夜培养;
②将过夜培养的菌液按1%的接种量转接至含有50mL BMGY的摇瓶中,28℃、220-250rpm培养至OD
③用无菌的离心管,1500-3000×g离心收集细胞;诱导表达时,去除上清,用BMMY培养基重悬细胞至OD
④每24小时,加甲醇至最适终浓度诱导蛋白的表达,同样取出与加入甲醇量相同体积的菌液,用于酵母生物量的测定;
⑤72小时后分别取8mL菌液,离心获取上清液,进行浓缩;SDS-PAGE检测PLD蛋白是否成功表达;
(2)纯化PLD蛋白的获取
①蛋白上清液的制备
将摇瓶发酵6天的菌液分装在离心瓶中,6000×g离心30min收集上清液,把得到的上清液置于4℃冰箱保存,已备后续实验利用;
②PLD蛋白上清液的超滤
将储存在4℃冰箱的上清液,分装于500mL的离心瓶中,配平后于4℃,6000×g离心30min,取上清;将部分上清置于超滤杯中,在4℃冰箱中进行超滤,在超滤之前进行检漏,确保蛋白不会大量损失;
③PLD蛋白上清液的透析
将超滤得到的浓缩液,分装于50mL离心管中,4℃条件下,12000×g离心30min,获得上清液;
取上清装入透析袋中,将透析袋放入40mM、pH 7.4的Tris-HCl缓冲液中每隔3小时更换缓冲液,共透析3次;
将透析液分装于50mL离心管中,4℃条件下,12000×g离心30min,获得上清液,用离心管将透析液浓缩至10-15mL;
④阴离子交换层析
柱高15cm,填充材料的高度为10cm;先用2个柱体积的40mM、pH 7.4的Tris-HCl缓冲液平衡DEAE-Spharose Fast Flow柱子,然后进行上样;用0-1mol/L NaCl溶液进行梯度洗脱,流速为1mL/min,每管收集8mL;SDS-PAGE检测蛋白的纯度;其中,所述0-1mol/L NaCl溶液含40mM、pH 7.4的Tris-HCl;
⑤凝胶过滤层析
先用1个柱体积的40mM、pH 7.4的Tris-HCl溶液平衡Superdex-200柱子,然后将经过离子交换层析的PLD蛋白溶液上样,上样的体积为5mL;以40mM pH 7.4、Tris-HCl的溶液进行洗脱,流速为1mL/min,每管收集1mL;根据峰图进行SDS-PAGE检测蛋白的纯度,并将纯化的磷脂酶D蛋白浓缩后备用;其中,所述40mM、pH 7.4的Tris-HCl溶液含500mM NaCl,所述40mM、pH 7.4的Tris-HCl的溶液含500mM NaCl。
作为本发明的优选方式之一,将纯化获得的磷脂酶D蛋白按照2.7KU/L的浓度添加到sd LDL-C检测试剂盒。
本发明相比现有技术的优点在于:
本发明将Streptomyces racemochromogenes strain10-3来源的PLD基因(Genbank:AB573232)进行密码子优化并改造潜在糖基化位点后进行了全基因合成,将基因序列加入合适的酶切位点后与pPIC9K质粒连接,并转化P.Pastoris GS115菌株,通过培养及诱导条件的优化,制得可以高效表达具有优良酶学特性的PLD蛋白的工程菌株;本发明构建的产磷脂酶D的基因工程菌能够高效表达PLD蛋白,经过简单纯化后其以蛋黄卵磷脂为底物的水解酶活可达115.2U/mL,且实现了其对现有sdLDL-C检测试剂盒中进口PLD的替代,将sdLDL-C检测试剂盒的生产成本降低了将近10%,具有重要的工业应用价值。
附图说明
图1是实施例2中磷脂酶D基因的潜在糖基化位点预测图;
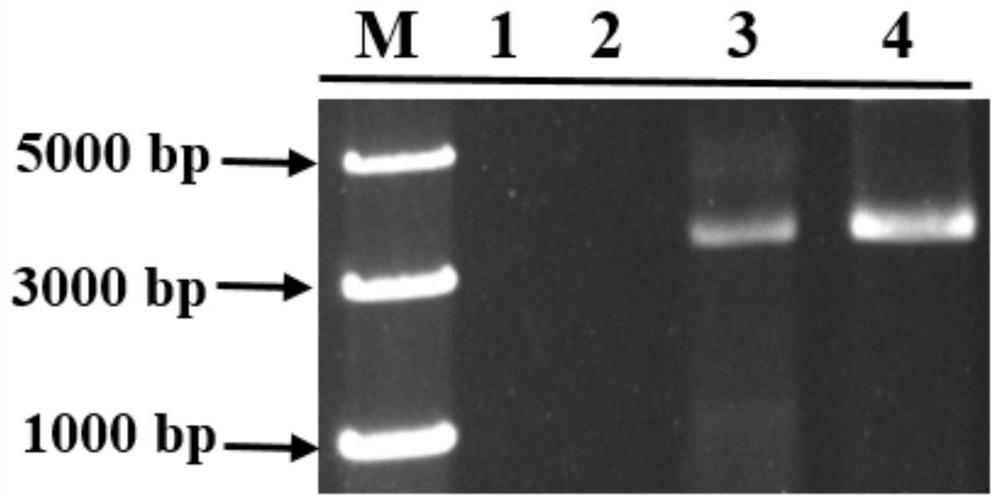
图2是实施例2中pPIC9K-PLD重组阳性转化子验证电泳图(图2中,泳道M:Marker;泳道1:挑取的1号单克隆;泳道2:挑取的2号单克隆;泳道3:挑取的3号单克隆;泳道4:挑取的4号单克隆);
图3是实施例4中PLD蛋白的SDS-PAGE图(图2中,泳道M:蛋白Marker;泳道1-6分别为各管收集的蛋白);
图4是实施例5中氯化胆碱的标准曲线图。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
本实施例用以说明本发明各溶液及培养基的配制:
1、溶液的配制
13.4%YNB(1L):溶解134.0g YNB于1L ddH
500×B(0.02%):溶解20.0mg生物素于100mL ddH
10×D(20%葡萄糖):称量200.0g D-葡萄糖完全溶解于1L ddH
10×M(5%甲醇):取5.0mL甲醇与95.0mL ddH
10×GY(10%甘油):100mL甘油与900mL ddH
1M磷酸钾缓冲液:称量23.0g K
1M山梨醇:称量18.2g山梨醇完全溶解于100mL ddH
2、培养基的配制
YPD:取10.0g酵母提取物,20.0g蛋白胨,溶于900mL ddH
MD:取15g琼脂粉加入800mL ddH
BMGY:取10.0g酵母提取物,20.0g蛋白胨,溶于700mL ddH
BMMY:将BMGY培养基中的10×GY换成10×M即可。
实施例2
本实施例用以说明产磷脂酶D的基因工程菌的构建方法,包括如下步骤:
1、磷脂酶D基因密码子的优化
由于酵母宿主对基因的表达有一定的密码子偏好性,故将Streptomycesracemochromogenes strain10-3来源的PLD基因(序列如SEQ ID NO.1所示)进行密码子优化,优化为适合酵母表达系统的表达的基因序列。采用在线密码子优化软件不改变蛋白编码序列,将原始的磷脂酶基因三联体密码子中最后一个碱基改为酵母密码子偏爱的碱基。
2、磷脂酶D基因糖基化位点分析
酵母表达系统作为真核表达系统的一种,在表达目的基因时,可能会发生一些真核细胞转录后的修饰,例如对目的基因进行糖基化修饰,故将优化过的磷脂酶D基因利用NetNGlyc 1.0 Server在线软件分析蛋白的糖基化位点。网址为(http://www.cbs.dtu.dk/services/NetNGlyc/),结果如图1。
3、糖基化位点定点突变及全基因合成
为了消除潜在的被糖基化修饰位点影响,将潜在的糖基化位点的天冬酰胺变为谷氨酰胺,并将密码子优化及糖基化位点改造后的序列进行全基因合成(基因序列如SEQ IDNO.2所示)。基因合成交由上海生物工程有限公司完成(连接在pPIC9K上,基因上下游分别插入NotI和EcoRI酶切位点,转化入DH5a菌株)。
4、pPIC9K-PLD质粒的抽提
质粒提取方法参照AxyPrep
5、毕赤酵母(Pichia pastoris)GS115细胞的转化
5.1毕赤酵母GS115感受态细胞的制备
①将保存在15%甘油中GS115菌株从-80℃冰箱取出,用接种环蘸取少许菌液,在YPD平板上进行划线,30℃培养2天。
②从YPD平板上挑取单克隆于5mL YPD液体培养基中,振荡培养(30℃,220rpm)2天。
③按照1%接种量,将培养2天的菌液接种到100mL/250mL YPD液体培养基中,振荡培养至OD
④用10mL无菌离心管收集细胞(4℃,1500×g,离心5min,菌液8mL)。
⑤用8mL预冷无菌水重悬细胞(4℃,1500×g,离心5min),收集细胞。
⑥用4mL预冷无菌水重悬细胞(4℃,1500×g,离心5min),收集细胞。
⑦用4mL 1M预冷无菌山梨醇重悬细胞(4℃,1500×g,离心5min),收集细胞。
⑧加入预冷的160μL 1M预冷无菌山梨醇重悬细胞,取80μL细胞分装到1.5mL管中,冻存于-80℃冰箱备用。
5.2pPIC9K-PLD和pPIC9K质粒线性化
参照毕赤酵母表达手册,在电转化前需将pPIC9K-PLD和pPIC9K质粒线性化,选择线性化酶切位点为Stu I,酶切的体系如表1所示。37℃保温1h,琼脂糖凝胶电泳检测是否酶切彻底。
表1质粒线性化反应体系
5.3毕赤酵母GS115的电转化
将线性化的pPIC9K-PLD和pPIC9K质粒进行凝胶回收,利用电转(Pic)方法将回收产物转入GS115酵母感受态细胞,转化步骤如下:
①取自制的80μL酵母感受态细胞,放在冰上溶解,将5-10μg线性化质粒DNA加入到感受态细胞中,混匀,转入预冷的0.2cm电转杯中,冰浴5min。
②电转的参数设置成实验所需的参数,电击后立刻向电转杯中加入1mL预冷的1M山梨醇。
③混合后,将混合物转到无菌的离心管中,28℃培养箱静置2h。
④4000×g离心30s,去500μL上清,取200μL菌液均匀涂在MD(不含组氨酸)平板上,置于28℃培养箱培养2-3天。
6、pPIC9K-PLD重组阳性转化子的鉴定
从MD板上挑取不同的单克隆,至10μL无菌水中,涡旋混匀。取1μL混合液作为PCR反应的模板,用pPIC9K的通用引物5'AOX Primer和3'AOX Primer鉴定阳性克隆。PCR体系参照表2。PCR扩增的条件参考试剂公司的DNA聚合酶说明书,(94℃变性30sec,55℃退火30sec,72℃延伸3min)20个循环,最后72℃延伸7min,电泳检测。
结果如图2所示,其中,3号(泳道3)和4号(泳道4)单克隆扩增出与PLD编码基因大小一致的目的条带,说明3号和4号克隆为阳性,将其扩大培养保菌,用于后续实验。
表2 PCR反应体系
实施例3
本实施例用以说明PLD蛋白在毕赤酵母GS115中表达条件的优化。
影响毕赤酵母中重组蛋白表达的主要因素有:温度、培养基、pH和甲醇诱导的浓度。
这里,我们随机选取一个阳性转化子进行蛋白表达条件的优化,如表3所示,培养温度为28℃,培养基为BMMY,对pH为4,5,6及甲醇诱导浓度为0.5%,1.0%,1.5%,2.0%进行正交实验测定,最终选择的表达条件为培养基pH=5,甲醇诱导浓度为1.0%。
表3优化PLD蛋白表达条件
据此,重组的PLD蛋白的摇瓶发酵的步骤:
①将pPIC9K-PLD菌株,接种至5mL BMGY试管中,28℃,220-250rpm过夜培养。
②将过夜培养的菌液按1%的接种量转接至含有50mL BMGY的摇瓶中,28℃,220-250rpm培养至OD
③用无菌的离心管,1500-3000×g离心收集细胞。诱导表达时,去除上清,用BMMY培养基重悬细胞至OD
④每24小时,加甲醇至最适终浓度诱导蛋白的表达,同样取出与加入甲醇量相同体积的菌液,用于酵母生物量的测定。
⑤72小时后分别取8mL菌液,离心获取上清液,进行浓缩;SDS-PAGE检测PLD蛋白是否成功表达。
实施例4
本实施例用以说明纯化PLD蛋白的获取。
1、PLD蛋白上清液的制备
将摇瓶发酵6天左右的菌液分装在离心瓶中,6000×g离心30min收集上清液,把得到的上清液置于4℃冰箱保存,已备后续实验利用。
2、PLD蛋白上清液的超滤
将储存在4℃冰箱的上清液,分装于500mL的离心瓶中,配平后于4℃,6000×g离心30min,取上清。将部分上清置于超滤杯中,在4℃冰箱中进行超滤,在超滤之前进行检漏,确保蛋白不会大量损失。
3、PLD蛋白上清液的透析
(1)将超滤得到的浓缩液,分装于50mL离心管中,4℃条件下,12000×g离心30min,获得上清液。
(2)取上清装入透析袋中,将透析袋放入40mM Tris-HCl(pH 7.4)缓冲液中每隔3小时更换缓冲液,共透析3次。
(3)将透析液分装于50mL离心管中,4℃条件下,12000×g离心30min,获得上清液,用离心管将透析液浓缩至10-15mL。
4、阴离子交换层析(DEAE-Spharose Fast Flow(pharmacia))
柱高15cm,填充材料的高度为10cm。先用2个柱体积的40mM Tris-HCl(pH 7.4)缓冲液平衡DEAE-Spharose Fast Flow柱子,然后进行上样。用0-1mol/L NaCl(含40mM pH7.4 Tris-HCl)溶液进行梯度洗脱,流速为1mL/min,每管收集8mL。SDS-PAGE检测蛋白的纯度。
5、凝胶过滤层析(Superdex-200)
先用1个柱体积的40mM pH 7.4 Tris-HCl(含500mM NaCl)的溶液平衡Superdex-200柱子,然后将经过离子交换层析的PLD蛋白溶液上样,上样的体积为5mL,以40mM pH 7.4Tris-HCl(含500mM NaCl)溶液进行洗脱,流速为1mL/min,每管收集1mL,得到目标所需的PLD蛋白。根据峰图进行SDS-PAGE检测蛋白的纯度,结果如图3所示。
实施例5
本实施例用以说明PLD酶活的测定。
本实验PLD水解酶活测定采用酶连比色法。100μL反应液包括:0.5%
(w/v)蛋黄卵磷脂,0.1%(w/v)曲拉通X-100,40m M Tris-HCl(pH 7.4),100μL酶液(50×),37℃反应10min。向其中加50μL反应终液,包括:50M EDTA,200M Tris-HCl(pH7.4),震荡混匀,95℃加热10min。冷却至室温后,向反应体系中再加入500μL反应液,包括:20mM磷酸钾缓冲液(pH 7.4),21mM苯酚,0.60mM 4-AAT,5μL 10U/mL胆碱氧化酶,3μL 10U/mL过氧化物酶,混匀,37℃反应2h,505nm下检测吸光值。
实验中通过检测胆碱含量来定量测定PLD水解酶活。称取100mg氯化胆碱溶于100mL蒸馏水中作为母液,分别取不同体积的该母液补加蒸馏水至200μL配制成0-1g/L的标准液,通过加入氯化胆碱的标准溶液代替PLD酶液来绘制标准曲线。酶每分钟催化水解卵磷脂释放1μmol胆碱所需酶量定义为一个酶活单位。
其中,绘制的胆碱标准曲线如图4所示,本发明获得的PLD蛋白的酶活达到115.2U/mL。
实施例6
本实施例用以说明上述实施例制得的PLD在sd LDL-C检测试剂盒中的应用。
将纯化获得的磷脂酶D按照2.7KU/L的浓度添加到sd LDL-C检测试剂盒(代替的试剂盒是现有sd LDL-C检测试剂盒中的进口PLD)中,并对试剂盒的性能进行评测,包括,空白吸光度、准确度、灵敏度、精密度及线性等。
本实施例中,将PLD蛋白代替本公司sd LDL-C检测试剂盒(已申报专利,专利申请号为202010532055.2)中的进口PLD。测定结果表明,采用自制PLD的sd LDL-C检测试剂盒在完全符合产品技术要求的同时,其产品成本降低了将近10%,具有非常好的工业化应用前景。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 安徽大千生物工程有限公司
<120> 一种产磷脂酶D的基因工程菌及其构建方法与在sdLDL-C检测试剂盒开发中的
应用
<130> 2021
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 2772
<212> DNA
<213> 链霉菌属(Streptomyces)
<400> 1
atgggatccg gtcagcggcg cggaggtgtg gtcgtacgag gacaacccgc cgcagaactt 60
cttcagcccg tacatgtcca gcgcgcagcg cctgccgaac gggaacacct tcgtggcgga 120
gggctccttc ggccggctct tcgaggtgac cccggagggc gacgtggtct gggagttcgt 180
ggtcccggag ttcggctcgt tcagccgggg cacgggcctg gagtcctcgc gcggcgccca 240
gaactcggtg ttccgcgcct accgctacgg cgcggacgag atcgcctggc tctgacggcg 300
ggcggcccag gcgccccggc accccggacc ggttccgggg cgccggggcg cgggggggcc 360
gggcatccgg tcgtggtccg gcccggggac ggcggcccgg ggacggcggc ccaccgatcg 420
gacgcctcga ttccgcggac tggtttcggc cacgcggccg gatggggtgg ccggacaacg 480
gccggtgggg cccgaccgac ggttccgcag ggtggccgga aggcgaccat gcccggatga 540
acaggggctt acgggctggt aacttgcgcg agttgatcaa ggccggggcc cggaacgacc 600
atgccgcccg gccggagcca ccccccagta ccaaggaacc acattggcac gcaccgtccg 660
cacgacggcc ctctcgctca ccctctcctt cgcgctgctc cccgccgcgc cggccttcgc 720
cgcctcgccg accccgcacc tggactcggt cgagcagacc ctgcgccagg tctcccccgg 780
cctcgagggc tcggtctggg agcgcaccgc cggcaacagc ctcggcgcct cggcccccgg 840
cggctccgac tggctgctcc agacccccgg atgctggggc gacccgtcct gcaccgaccg 900
tccgggctcg cgccggctgc tggacaagac ccggcaggac atcgcccagg cccggcagag 960
cgtggacata tccaccctgg ccccgttccc caacggcggc ttccaggacg cggtcgtggc 1020
cggcctcaag gaggccgtgg cgaagggcaa ccggctccag gtccgcatcc tggtgggcgc 1080
cgcgccgatc taccacgcca acgtgatccc gtcctcgtac cgcgacgaga tggtggccag 1140
gctcggcccg gcggccgcga acgtcaccct caacgtggcc tcgatgacca cctccaagac 1200
cggcttctcc tggaaccact ccaagctcgt ggtggtggac ggcggttcgg tgatcaccgg 1260
cggcatcaac agctggaagg acgactacct cgacaccgcc cacccggtga acgacgtcga 1320
cctcgcgctg tccggtccgg cggcgggctc ggccggccgc tacctcgaca ccctgtggga 1380
ctggacctgc cgcaacaagt ccagctggag cagcgtctgg ttcgcctcct cgaacaacgc 1440
cggctgcatg cccaccctgc cccgtccggc cgcgccggcc ggcggcggtg acgtccccgc 1500
cctcgcggtc ggcggcctcg gcgtcggcat ccgccagagc gacccggcgt cggcgttcaa 1560
gccggtcctg ccgacggccc ccgacaccaa gtgcggcatc ggcgtgcacg acaacaccaa 1620
cgccgaccgg gactacgaca cggtcaaccc ggaggagagc gccctgcgtg cgctggtcgc 1680
cagtgcgaac agccacgtcg agatctccca gcaggacctg aacgcgacct gcccgccgct 1740
gccccgctac gacatccggc tctacgacac gctcgccgcg aagctcgcgg ccggcgtgaa 1800
ggtccgcatc gtggtcagcg acccggcgaa ccgcggcgcg gtcggcagcg acggctactc 1860
gcagatcaag tccctgaacg aggtgagcga cgcgctgcgc ggccgcctca cggccctcac 1920
cggcgacgag cgcacctcga aggccgcgat gtgccagaac ctccagctgg cgaccttccg 1980
cgcctcggac aaggcgacgt gggcggacgg gaagccgtac gcccagcacc acaagctggt 2040
ctcggtggac gactcggcct tctacatcgg ctcgaagaac ctgtacccgt cctggctcca 2100
ggacttcggc tacgtcgtcg agagcccggc cgccgcgaac cagctgaagg actccctgct 2160
ggctccgcag tggaagtact cgcaggcgac cgcgacgtac gactacgcgc gcggcctctg 2220
ccaggcctga cggctccggg tccgggtccg gctccgggtc cgggtccggg tccgggtcag 2280
cgcctgcgct ggcccgggcc ggccgccagc agcagcgcct cggagacgag ccgggcgccc 2340
cgggagaggc ggccgagctg ctccagctcg atggcgtaca tcctgatcgt gttctcgatg 2400
accgactcgg cgacgcccat cgtcggcagc tcggcccggc tggtgtgcag ggccacgcgg 2460
accgcgcgca tctcgtgctg gagctggagc tgcacgtgcc gggccagcag ggcgtggtga 2520
cgggtcagcg tcaggtagct cccgtagcgg gccgggagga ggtcccgcag ccagcgggtg 2580
gcgctgcgtt cccagtcgtg cgtgccgggc gccttgacct gcaggggcca gtccgggctg 2640
cgcgtgaggg tggccgtctg gggcatctcg tcacttccga ggggtgtgga actctgatcg 2700
agagactgcg tgggggggcg gcctcggtcc aggggttgac cgaggccgcc aggggcgccc 2760
ctccggggga tc 2772
<210> 2
<211> 2772
<212> DNA
<213> 人工序列
<400> 2
atgggttctg gtcaacgtcg tggtggtgtt gttgttcgtg gtcaacctgc tgctgaatta 60
ttacaacctg ttcatgttca acgtgctgct cctgctgaac gtgaacattt acgtggtggt 120
ggtttattac gtcctgcttt acgtggtgat cctggtggtc gtcgtggttt aggtgttcgt 180
ggtcctggtg ttcgtttagt tcaacctggt catggtcctg gtgttttagc tcgtcgtcct 240
gaattaggtg ttcctcgttt acctttacgt cgtggtcgtg atcgtttagc tttaactgct 300
ggtggtcctg gtgctcctgc tcctcgtact ggttctggtg ctcctggtcg tggtggtgct 360
ggtcatcctg ttgttgttcg tcctggtgat ggtggtcctg gtactgctgc tcatcgttct 420
gatgcttcta ttcctcgtac tggttttggt catgctgctg gttggggtgg tcgtactact 480
gctggtggtg ctcgtcctac tgttcctcaa ggtggtcgta aagctactat gcctggttaa 540
actggtgctt atggtttagt tacttgtgct tcttaatctc gtcctggtcc tggtactact 600
atgcctcctg gtcgttctca tcctcctgtt cctcgtaatc atattggtac tcatcgtcct 660
catgatggtc ctttagctca tcctttatta cgtgctgctc ctcgtcgtgc tggtttacgt 720
cgtttagctg atcctgctcc tggtttaggt cgtgctgatc ctgctcctgg tttacctcgt 780
cctcgtggtt taggtttagg tgctcatcgt cgtcaacaac ctcgtcgttt aggtcctcgt 840
cgtttacgtt tagctgctcc tgatcctcgt atgttaggtc gtcctgtttt acatcgtcct 900
tctggtttag ctcctgctgc tggtcaagat cctgctggtc atcgtcctgg tcctgctgaa 960
cgtggtcata ttcatcctgg tcctgttcct caacgtcgtt tacctggtcg tggtcgtggt 1020
cgtcctcaag gtggtcgtgg tgaaggtcaa cctgctcctg gtcctcatcc tggtggtcgt 1080
cgtgctgatt tacctcgtca acgtgatcct gttttagttc ctcgtcgtga tggtggtcaa 1140
gctcgtcctg gtggtcgtga acgtcatcct caacgtggtt tagatgatca tttacaagat 1200
cgtttattat tagaaccttt acaagctcgt ggtggtggtc gtcgttttgg tgatcatcgt 1260
cgtcatcaac aattagaagg tcgtttacct cgtcatcgtc ctcctggtga acgtcgtcgt 1320
cctcgtgctg ttcgttctgg tggtggttta ggtcgtcctt tacctcgtca tcctgttggt 1380
ttagatttac ctcaacaagt tcaattagaa caacgtttag ttcgtttatt agaacaacgt 1440
cgtttacatg ctcatcctgc tccttctggt cgtgctggtc gtcgtcgtta acgtcctcgt 1500
cctcgtggtc gtcgtcctcg tcgtcgtcat cctcctgaac gtcctggtgt tggtgttcaa 1560
gctggtcctg ctgatggtcc tcgtcatcaa gttcgtcatc gtcgtgctcg tcaacatcaa 1620
cgtcgtcctg gtttacgtca tggtcaacct ggtggtgaac gtcctgcttg tgctggtcgt 1680
caatgtgaac aacctcgtcg tgatttacct gctggtcctg aacgtgattt acctgctgct 1740
gctcctttac gtcatcctgc tttacgtcat gctcgtcgtg aagctcgtgg tcgtcgtgaa 1800
ggtcctcatc gtggtcaacg tcctggtgaa cctcgtcgtg gtcgtcaacg tcgtttatta 1860
gctgatcaag ttcctgaacg tggtgaacgt cgtgctgctc gtcctcctca tggtcctcat 1920
cgtcgtcgtg ctcatttaga aggtcgtgat gttcctgaac ctcctgctgg tgatttacct 1980
cgtttaggtc aaggtgatgt tggtggtcgt gaagctgttc gtcctgctcc tcaagctggt 2040
ttaggtggtc gtttaggttt attacatcgt ttagaagaac ctgttcctgt tttagctcct 2100
ggtttacgtt tacgtcgtcg tgaacctggt cgtcgtgaac ctgctgaagg tttacctgct 2160
ggttctgctg ttgaagtttt agctggtgat cgtgatgttc gtttacgtgc tcgtccttta 2220
cctggtttaa ctgctcctgg tcctggtcct gctcctggtc ctggtcctgg tcctggtcaa 2280
cgtttacgtt ggcctggtcc tgctgcttct tcttctgctt ctgaaacttc tcgtgctcct 2340
cgtgaacgtc gtccttcttg ttcttcttct atggcttata ttttaattgt tttttctatg 2400
actgattctg ctactcctat tgttggttct tctgctcgtt tagtttgtcg tgctactcgt 2460
actgctcgta tttcttgttg gtcttggtct tgtacttgtc gtgcttctcg tgcttggtaa 2520
cgtgtttctg ttcgttaatt accttaacgt gctggtcgtc gttctcgttc tcaacgtgtt 2580
gctttacgtt ctcaatcttg tgttcctggt gctttaactt gtcgtggtca atctggttta 2640
cgtgttcgtg ttgctgtttg gggtatttct tctttacctc gtggtgttga attataatct 2700
cgtgattgtg ttggtggtcg tcctcgttct cgtggttaac ctcgtcctcc tggtgctcct 2760
ttacgtggta tt 2772
- 一种产磷脂酶D的基因工程菌及其构建方法与在sdLDL-C检测试剂盒开发中的应用
- 一种产磷脂酶D的基因工程菌及其构建方法与在sdLDL-C检测试剂盒开发中的应用
