新型拮抗性抗TNFR2抗体分子
文献发布时间:2023-06-19 11:21:00
技术领域
本发明涉及新型拮抗性抗体分子,所述新型拮抗性抗体分子与靶细胞上的肿瘤坏死因子受体2(TNFR2)特异性结合并且由此阻断配体TNF-α与TNFR2结合并且还阻断TNFR2信号传导,所述抗体分子还通过其Fc区与Fc受体结合。本发明还涉及其在医学中,如在治疗癌症或由细胞内病原体引起的感染中的用途。
背景技术
肿瘤坏死因子(TNF)受体2(TNFR2、TNFR-2或TNFRII),也被称为肿瘤坏死因子受体超家族成员1B(TNFRSF1B)和CD120b,是结合肿瘤坏死因子-α(TNF-α或TNFα)的膜受体。其发现于即T细胞、单核细胞和巨噬细胞的表面并且可以通过核因子κB(NF-κB)激活TNFR2受体表达细胞的增殖。值得注意的是,TNFR2在癌症中并且具体地在肿瘤浸润免疫细胞,例如调节性T细胞(Treg)、CD8
据讨论,TNFR2已成为癌症免疫疗法的有希望的靶标并且已被描述为是在具体地肿瘤内Treg和许多人类肿瘤细胞的表面上高度表达的(Williams GS等人,《肿瘤靶标(Oncotarge)》2016;7(42):68278–68291;Vanamee ES等人,《分子医学趋势(Trends inMolecular Medicine)》,2017,第23卷,第11期,1037-1046;《免疫学前沿(Frontiers inImmunology)》,2017年11月|第8卷|第1482条;《科学信号(Sci Signal.)》2018年1月2日;11(511)。
调节性T细胞(其可以被称为Treg细胞、Treg或T
还与以下结合对TNFR2进行了讨论:自身免疫疾病(Faustman DL等人,《免疫学前沿(Front Immunol)》2013;4:478;《临床与转化免疫学(Clin Transl Immunology)》2016年1月8日;5(1);《神经科学杂志(J Neurosci.)》2016年5月4日;36(18):5128-43)和炎性疾病(Ait-Ali D等人,《内分泌学(Endocrinology)》2008年6月;149(6):2840-52;《科学报告(Sci Rep.)》2016年9月7日;6:32834)。
先前也已经描述了不同类型并且具有各种特性的抗TNFR2抗体。例如,Williams等人(《肿瘤靶标》2016年10月18日;7(42):68278-68291)描述了配体阻断激动性抗体和配体非阻断激动性抗体两者。
WO 2014/124134公开了TNFR2激动剂的用途,如激动性抗TNFR2抗体和/或用于体外产生富含CD4+CD25
WO 2016/187068公开了能够拮抗肿瘤坏死因子受体超家族成员,如TNFR2的抗体。据说所述抗体可用于调节Treg,如可用于以治疗增生性病症和感染性疾病的免疫疗法。具体地,其公开了与人TNFR2的特异性表位结合的拮抗性TNFR2抗体,并且其呈现了此类抗体的许多特异性CDR序列。据说WO 2016/187068中的数据证明了拮抗性TNFR2抗体的Fab区与TNFR2的特异性结合可能负责调节Treg细胞生长,而不是这些抗体的Fc区的非特异性结合。
WO 2017/040312公开了抗TNFR2抗体以及具体地能够促进TNFR2信号传导并且对Treg的扩增或增殖具有影响的激动性抗TNFR2抗体。WO 2017/040312公开了与包括序列KCSPG的表位特异性结合但不与包括序列KCRPG的表位特异性结合,因此排除了以上描述的US 9 821 010的抗体或者可替代地不与另一TNFR超家族成员结合的抗体。据说所述激动性抗体可用于治疗免疫性疾病。WO 2017/040312进一步阐述了人TNFR2的完整序列。
WO 2017/083525讨论了包括抗TNFR2抗体的药理组合物以及其在治疗与TNF-α和/或TNFR2相关联的病症,如癌症中的用途。WO 2017/083525进一步讨论了包括对于与Fcγ受体的结合以及对Treg的扩增的抑制无效的人IgG1 Fc结构域的抗体。
WO 2017/197331公开了包括具有特定序列的互补决定区-重链3的拮抗性TNFR2抗体并且讨论了减少或抑制Treg的增殖和/或对T效应细胞的增殖的抑制。
Fc受体是发现于免疫效应细胞的细胞表面上的膜蛋白,所述免疫效应细胞包含单核细胞、巨噬细胞、树突状细胞、嗜中性粒细胞、肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞和自然杀伤细胞以及B淋巴细胞。名称衍生自其对抗体的Fc区的结合特异性。Fc受体发现于细胞膜上–所述细胞膜另外被称为质膜或细胞质膜。Fc受体可以被细分为活化FcγR和抑制性FcγR,所述活化FcγR和抑制性FcγR已知通过聚集的免疫球蛋白G Fc's的结合来协调地调节细胞活化,以及通过细胞内ITAM或ITIM基序将活化或抑制性信号传输到细胞中。聚集的免疫球蛋白或免疫复合物的FcR结合可以介导抗体进入细胞的内化并且可能导致抗体介导的吞噬、抗体依赖性细胞介导的细胞毒性或抗原呈递或交叉呈递。已知FcR还介导或增强抗体结合的细胞表面受体的交联。已知此交联是激活靶向的细胞的信号传导的一些(Li等人,2011“抑制性Fcγ受体连接驱动激动性CD40抗体的佐剂和抗肿瘤活性(InhibitoryFcgamma receptor engagement drives adjuvant and anti-tumor activities ofagonistic CD40 antibodies)”,《科学(Science)》,333:1030-4;White等人,2011“与FcγRIIB的相互作用对于抗CD40单克隆抗体的激动活性至关重要(Interaction withFcgammaRIIB is critical for the agonistic activity of anti-CD40 monoclonalantibody)”,《免疫学杂志(J Immunol)》,187:1754-63),但不是所有(Richman等人,2014,“抗人CD40单克隆抗体疗法在不进行FcR交联的情况下是有效的(Anti-human CD40monoclonal antibody therapy is potent without FcR crosslinking)”,《肿瘤免疫学(Oncoimmunology)》,3:e28610)抗体能力所需要的,并且可能是也可能不是达到治疗效果所需要的。
Fc受体的亚组是对IgG抗体具有特异性的Fcγ受体(Fcγ受体、FcγR(FcgammaR)或FcγR)。存在两种类型的Fcγ受体:活化Fcγ受体(也表示为活化性Fcγ受体)和抑制性Fcγ受体。活化和抑制性受体分别通过基于免疫受体酪氨酸的活化基序(ITAM)或基于免疫受体酪氨酸的抑制性基序(ITIM)传输其信号。在人类中,FcγRIIb(CD32b)是抑制性Fcγ受体,而FcγRI(CD64)、FcγRIIa(CD32a)、FcγRIIc(CD32c)和FcγRIIIa(CD16a)是活化Fcγ受体。FcγgRIIIb是在中性粒细胞上表达的GPI连接的受体,所述GPI连接的受体缺乏ITAM基序但通过其交联脂质筏并与其它受体连接的能力而也被视为是活化性的。在小鼠中,活化受体是FcγRI、FcγRIII和FcγRIV。
众所周知,抗体可以通过与Fcγ受体的相互作用来调节免疫细胞活性。具体地,抗体免疫复合物如何调节免疫细胞活化是通过其活化和抑制性Fcγ受体的相对连接来确定的。不同抗体同种型以不同亲和力与活化和抑制性Fcγ受体结合,从而产生不同的A:I比率(活化:抑制比率)(Nimmerjahn等人;《科学》2005年12月2日;310(5753):1510-2)。
通过与抑制性Fcγ受体结合,抗体可以抑制、阻断和/或下调效应细胞功能。通过与抑制性FcγR结合,抗体可以通过在靶细胞上聚集抗体靶向的信号传导受体来进一步刺激细胞活化(Li等人,2011,“抑制性Fcγ受体连接驱动激动性CD40抗体的佐剂和抗肿瘤活性”,《科学》,333:1030-4;White等人,2011“与FcγRIIB的相互作用对于抗CD40单克隆抗体的激动活性至关重要”,《免疫学杂志》,187:1754-63;White等人2014“激动性CD40抗体在淋巴瘤疗法中的Fcγ受体依赖性可以通过抗体多聚化来克服(Fcgamma receptordependency of agonistic CD40 antibody in lymphoma therapy can be overcomethrough antibody multimerization)”,《免疫学杂志》,193:1828-35)。
通过与活化Fcγ受体结合,抗体可以激活效应细胞功能并且由此触发以下机制,如抗体依赖性细胞毒性(ADCC)、抗体依赖性细胞吞噬(ADCP)、细胞因子释放和/或抗体依赖性内吞以及在中性粒细胞的情况下的NETosis(即NET中性粒细胞细胞外陷阱的活化和释放)。抗体与活化Fcγ受体的结合还可能导致某些活化标志物,如CD40、MHCII、CD38、CD80和/或CD86的增加。
具体地本发明人发表的最新数据表明,分别与活化和抑制性FcγR的结合的CD8 T细胞激动剂和Treg耗竭型抗4-1BB抗体在治疗功效方面的关键性和差异性依赖性(Buchan等人,“共刺激性受体4-1BB的抗体通过T调节性细胞耗竭以及对CD8 T细胞效应功能的促进来增强抗肿瘤免疫力(Antibodies to Costimulatory Receptor 4-1BB Enhance Anti-tumor Immunity via T Regulatory Cell Depletion and Promotion of CD8 T CellEffector Function)”,《免疫学(Immunity)》2018 49(5):958-970)。此外并且至关重要的是,同时施用分别在与活化和抑制性FcγR结合方面优化的CD8 T细胞激动剂和Treg耗竭型抗4-1BB抗体损害了治疗活性。这些数据表明了开发适当地且定制地连接活化和抑制性FcγR,以最大化具有独特作用机制的抗体的治疗活性的抗体的关键重要性。同时,其表明了活化和抑制性FcγR的次优连接可能会严重降低治疗功效。
这些数据令人惊讶,因为其与对其它TNFSR成员的抗体,值得注意地是免疫刺激性抗CD40抗体的发现相反,所述其它抗体显示出对抑制性而非活化FcγR的连接的专性需要(Li等人,2011,“抑制性Fcγ受体连接驱动激动性CD40抗体的佐剂和抗肿瘤活性”,《科学》,333:1030-4;White等人,2011“与FcγRIIB的相互作用对于抗CD40单克隆抗体的激动活性至关重要”,《免疫学杂志》,187:1754-63)。综上所述,这些结果表明FcγR依赖性在同一受体超家族的不同靶标的抗体之间以及甚至在相同靶标的不同类型的抗体之间,可能会以不容易预测的方式发生变化,但是对于在开发用于治疗用途的抗体时进行理解和利用可能是至关重要的。
发明内容
在导致本发明以及并行发明的工作中,标识了两种主要不同组的具有强大治疗作用以及不同特性和作用机制的抗TNFR2抗体。
发明人首先识别出阻断TNF-α与TNFR2受体的结合的拮抗性抗TNFR2抗体的强大治疗活性。对于体内治疗活性,此类抗体的活性被示出为取决于FcγR相互作用,以及具体地与活化性FcγR的结合。发现此组或类别的强大抗TNFR2治疗药剂的特征在于1)明显阻断并抑制TNF-α(配体)诱导的TNFR2信号传导,以及2)依赖于FcγR连接,从而最大得益于对抑制性FcγR进行活化的连接的活性。
发明人然后标识了在体内具有同样强大的治疗活性的不同组的抗TNFR2抗体,但是其特性在许多方面与构成第一组和本发明的拮抗性阻断类型的TNFR2抗体的特性相反。此第二组的抗TNFR2抗体不依赖于TNFR2信号传导对治疗活性的TNF-α阻断或抑制,而是其特征在于对TNFR2信号传导的强烈激活。与第一组的阻断抗体进一步相反,第二组的激动性抗体未示出对抗体:FcγR连接的专性依赖性,即使利用FcγR:连接抗体变体提高了其活性也是如此。与第一组拮抗性且阻断抗体进一步相反的是,第二组激动性抗体在抗体变体中示出最大活性,与活化FcγR相比对抑制剂的结合增强。
本发明涉及第一组抗TNFR2抗体,即涉及通过与TNFR2特异性结合而阻断TNF-α与TNFR2的结合并且还阻断TNFR2的信号传导的拮抗性抗体分子。这些抗体分子还具有与Fc受体结合的Fc区,所述Fc区可用于赋予TNFR2阳性细胞的FcγR依赖性消除或功能性调节,如Treg耗竭或肿瘤相关巨噬细胞的调节。
在下面的实例中使用了属于第二组的拮抗性抗体,以用于与本发明的激动性阻断TNFR2抗体分子进行比较。在实例中,还使用了具有某些特性的与第一组或第二组或两者的抗体相似的其它抗体以进行比较,如以下进一步解释的。
因此,本发明涉及拮抗性抗体分子,所述拮抗性抗体分子与靶细胞上的TNFR2特异性结合并且由此阻断TNF-α与TNFR2结合并且还阻断TNFR2信号传导,并且其中所述抗体分子还通过其Fc区与Fcγ受体结合。
本发明还涉及此类新型拮抗性且阻断抗TNFR2抗体分子的具体实例。
本发明还涉及编码以上抗体分子中的至少一种抗体分子的分离的核苷酸序列。
本发明还涉及包括以上核苷酸序列中的至少一种核苷酸序列的质粒。
本发明还涉及包括以上核苷酸序列或质粒中的至少一种的病毒。
本发明还涉及包括以上核苷酸序列之一,或以上质粒之一,或以上病毒之一的细胞。
本发明还涉及用于医学的以上抗体分子、核苷酸序列、质粒、病毒和/或细胞。
本发明还涉及用于治疗癌症或由细胞内病原体引起的感染的以上抗体分子、核苷酸序列、质粒、病毒和/或细胞。
本发明还涉及用于治疗癌症或由细胞内病原体引起的感染的以上抗体分子、核苷酸序列、质粒、病毒和/或细胞。
本发明还涉及药物组合物,所述药物组合物包括以下或由以下组成:以上抗体分子、核苷酸序列、质粒、病毒和/或细胞中的至少一种以及任选地药学上可接受的稀释剂、载体、媒剂和/或赋形剂。此类药物组合物可以用于治疗癌症或由细胞内病原体引起的感染。
本发明还涉及用于治疗患者的癌症或由细胞内病原体引起的感染的方法,所述方法包括向所述患者施用治疗有效量的所述以上抗体分子、核苷酸序列、质粒、病毒和/或细胞中的至少一种。
本发明还涉及抗体分子、供使用的抗体分子、分离的核苷酸序列、供使用的分离的核苷酸序列、质粒、供使用的质粒、病毒、供使用的病毒、细胞、供使用的细胞、用途、药物组合物和治疗的方法,如本文参考所附说明书、实例和/或附图所描述的。
具体实施方式
因此,本发明涉及拮抗性抗体分子,所述拮抗性抗体分子与靶细胞上的TNFR2特异性结合并且由此阻断TNF-α与TNFR2结合并且还阻断TNFR2信号传导,并且其中所述抗体分子还通过其Fc区与Fcγ受体结合。
本文公开的拮抗性抗体分子阻断TNF-α与TNFR2的结合以及TNFR2信号传导两者。拮抗性抗体分子阻断TNF-α与TNFR2的结合在本文中意指与受体TNFR2结合的抗体分子由此阻止配体TNF-α与同一受体结合。在实例3中对此进行了更详细的说明。本文公开的拮抗性抗体分子阻断TNFR2信号传导意指其阻断TNFR2介导的细胞活化。已经清楚地表明,通过TNFR2进行的TNF-α介导的信号传导开始信号传导级联,所述信号传导级联终止于核转录因子NFκB的活化(Thommesen等人“NFκB的TNF受体1介导的活化与TNF受体2介导的活化之间的明显差异(Distinct differences between TNF receptor 1-and TNF receptor 2-mediated activation of NFkappaB)”,《生物化学与分子生物学杂志(J Biochem MolBiol.)》2005年5月31日;38(3):281-9;Yang等人“TNF-TNF受体2信号在调节性T细胞中的作用以及其治疗意义(Role of TNF-TNF Receptor 2Signal in Regulatory T Cells andIts Therapeutic Implications)”《免疫学前沿》2018年4月19日;9:784)。这进而导致细胞的活化和几种促炎因子的合成,几种促炎因子之一是NK细胞中的IFN-γ(Liu等人“炎症中的NF-κB信号传导(NF-κB signaling in inflammation)”《信号转导与靶向治疗(SignalTransduct Target Ther.)》2017;2.pii:17023;Tato等人“NF-κB家族成员在调节NK细胞增殖和IFN-γ的产生中的相反作用(Opposing roles of NF-kappaB family members inthe regulation of NK cell proliferation and production of IFN-gamma)”《国际免疫学(Int Immunol.)》2006年4月;18(4):505-13)。在本文中术语TNFR2信号传导和TNFR2活化可互换使用。
抗体分子与TNFR2特异性结合。众所周知的是,抗体与限定的靶分子或抗原特异性结合或相互作用,并且这意味着抗体优先地且选择性地结合其靶标而不是非靶标的分子。“特异性结合TNFR2的抗体分子”或“TNFR2特异性抗体分子”意指以剂量依赖性方式结合TNFR2蛋白但不与无关蛋白结合的抗体。另外,相同的抗体结合内源性地表达TNFR2的细胞,并且此结合可以通过将相同细胞与市售的多克隆TNFR2抗体试剂一起预培育来阻断,这示出了当TNFR2被多克隆试剂掩盖时可能无法检测到非特异性结合。这在实例2中示出。
特异性结合TNFR2的抗体分子(或抗TNFR2抗体分子)是指与TNFR2的细胞外结构域中的至少一个表位特异性结合的抗体分子。细胞表面抗原和表位是免疫学或细胞生物学的技术人员容易理解的术语。
评估蛋白质结合的方法是生物化学和免疫学的技术人员已知的。技术人员将理解,那些方法可以用于评估抗体与靶标的结合和/或抗体的Fc区与Fc受体的结合;以及相对强度或特异性,或那些相互作用中的抑制或预防或降低。可以用于评估蛋白质结合的方法的实例是,例如,免疫测定、BIAcore、蛋白质印迹(western blot)、放射免疫测定(RIA)和酶联免疫吸附测定(ELISA)以及流式细胞术(FACS)。(对于关于抗体特异性的讨论,参见《基础免疫学(Fundamental Immunology)》第二版,雷文出版社(Raven Press),纽约(New York)第332-336页(1989))。
表达根据本发明的阻断抗体所结合的TNFR2的靶细胞包含免疫细胞和/或肿瘤细胞,如以上和以下讨论的。根据本发明的拮抗性抗体分子与TNFR2结合的作用可以是患病组织中的细胞组成发生变化。组成的此变化可以通过患病组织中的TNFR2表达细胞的数量和/或频率的改变而发生。例如,对癌症的影响包含肿瘤内T细胞数量增加,CD8
患病组织在此上下文中意指肿瘤组织(即肿瘤微环境中的所有细胞,包含肿瘤细胞、免疫细胞、内皮细胞和基质细胞)或受细胞内病原体影响的组织。
为了决定抗体分子是阻断还是不阻断配体与TNFR2的结合,可能的是使用ELISA测定确定在TNFR2特异性抗体存在下,与固定化的TNFR2受体结合的TNF-α配体的量。阻断抗体将阻止配体TNF-α与固定化的受体TNFR2结合。在以下实例3中对此进行了更详细的说明和解释。
根据本发明的阻断抗体分子是另外能够拮抗TNFR2信号传导的完全阻断剂。
完全阻断剂在本文中被定义为与在仅同种型对照抗体分子存在下的TNF-α结合相比,将TNF-α与TNFR2的结合降低多于多98%,即至多100%的抗体分子。同种型对照抗体是针对在研究下在测定中不以任何形式存在的蛋白质或其它结构提出的抗体。同种型对照理想地具有与比较抗体相同的框架,但至少相同的Fc部分。这对本领域的技术人员而言是众所周知的。在本文所述的实例中,同种型对照具有相同的构架、相同的Fc部分,并且对荧光素异硫氰酸(FITC)具有特异性。在一些实施例中,完全阻断剂将的TNF-α结合降低了多于99.5%。
其它类型的阻断剂是部分阻断剂和弱阻断剂。如本文所用,部分阻断剂是与在仅同种型对照抗体分子的存在下的TNF-α结合相比,将TNF-α与TNFR2的结合降低60-98%(例如,降低60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%或98%以及其间的所有十进制数)的抗体分子,并且弱阻断剂是与在仅同种型对照抗体分子存在下的TNF-α结合相比,将TNF-α与TNFR2的结合降低少于60%,如50-59.9%(或50%、51%、52%、53%、54%、55%、56%、57%、58%、59或59.9%以及其间的所有十进制数)的抗体分子。
相反,非阻断TNFR2抗体分子是与在仅同种型对照抗体分子存在下的TNF-α结合相比,将TNF-α与TNFR2的结合降低少于50%的抗体分子。在一些实施例中,这在高剂量单点ELISA或剂量滴定ELISA中得到确定,如实例3以及图6和7中示出的。
在实例中使用了部分阻断、弱阻断和非阻断抗体,以用于与本发明的拮抗性阻断抗体分子进行比较。
几种性质和特征可以奠定和(共同)确定抗体的生物活性。除了阻断配体与受体结合的能力之外,重要的此类性质包含调节受体信号传导,即激动或拮抗受体信号传导的抗体能力,以及对用于赋予治疗活性的FcγR相互作用的抗体依赖性。
首先表征了完全阻断、部分阻断和非阻断抗体调节TNFR2信号传导的能力。标识了两个极端。
在第一个极端中,标识了完全阻断配体与TNFR2的结合,阻断TNF-α诱导的TNFR2信号传导,并且在与细胞内源性表达的TNFR2结合时本身并不诱导信号传导的抗体。此组配体阻断拮抗性抗体形成本发明的基础。
在另一极端中,标识了不阻断配体与TNFR2的结合,但在与TNFR2结合时内源性表达的细胞激动受体的抗体。此第二组抗体构成了单独发明并且包含在此以用于比较。
由部分阻断激动性、部分阻断非激动性和完全阻断非拮抗性定义的抗体和类别被另外标识为展示出抗TNFR2抗体的复杂生物学和巨大异质性,这清楚地展示了本发明的抗体形成独特的组。
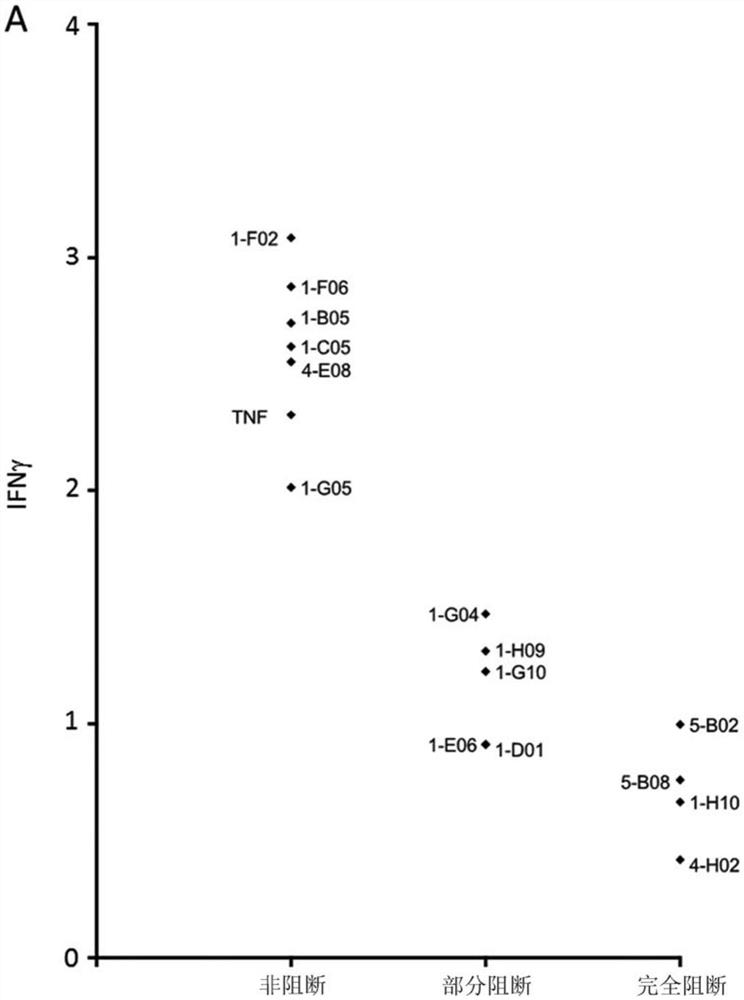
为了确定抗体是否具有激动剂活性或拮抗活性,可能的是使用如实例4中所述的自然杀伤(NK)细胞测定。简而言之,已经描述了NK细胞利用分泌IFN-γ对IL-2和IL-12刺激作出反应。可溶性TNF-α是内源性地产生的并且以鲁棒但次优的浓度(约20-100pg/ml)存在,用于TNFR2信号传导,这意味着IFN-γ可以通过调节TNFR2信号传导来增加和减少。因此,外源性地添加TNFR2信号传导最优浓度的TNF-α增强了此测定中的IFN-γ浓度,与激动剂抗TNFR2抗体一起进行的培育也是如此(图8C)。相反,与抗TNF-α抗体或本文所述的配体阻断拮抗剂抗体共同培育降低了此测定中的IFN-γ释放。因此,此测定可以用于标识抗TNFR2抗体的激动剂或拮抗剂活性或抗TNFR2抗体的缺乏。(TNFα通过TNFR2增强了细胞因子诱导的NK细胞IFNγ产生。Almishri W.等人,《先天免疫杂志(J Innate Immun.)》2016;8:617-629)。因此,在此实验设置中,拮抗性抗体防止TNFR2表达细胞中的TNF-α诱导的信号传导并且在与TNFR2受体结合时自身并不刺激所述TNFR2受体。具体地,在此测定中,拮抗性抗体在与以上提及的NK细胞结合后不增加IFN-γ释放而是抑制IFN-γ释放。如图8中示出的,本发明所述的完全阻断抗体未诱导TNFR2信号传导,而是降低了此含TNF-α的NK细胞测定中的TNFR2信号传导,导致释放的IFN-γ的量降低。如图8实例4中指示的,本发明的抗体因此可以被分类为配体阻断拮抗性抗TNFR2抗体。使用此测定,将拮抗性抗体定义为导致IFN-γ释放降低>30%(例如35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%)的抗体,条件是此培养物中的基础TNF-α水平为至少20pg/ml。由于此测定使用来自PBMC供体的原代细胞,因此需要包含至少4个供体,并且均值应根据所有供体计算。来自在计算均值时要包含的每个供体的细胞必须对与利用同种型对照进行的处理相比IFN-γ水平增加>100%(>2倍)的阳性对照(可溶性TNF-α)处理作出反应。
拮抗剂活性也可以使用IL-2介导的记忆性T细胞的活化来证明。活化在此通过上调T细胞活化标志物CD25来测量。使用此测定,添加非阻断激动性TNFR2抗体进一步地上调CD25表达,而根据本发明的阻断拮抗性TNFR2抗体则导致与同种型对照相比较低的CD25表达。对于本发明的人抗体以及鼠替代抗体而言确实如此,并示出在实例4中。
除了与TNFR2结合并且由此阻断TNF-α结合和信号传导以外,根据本发明的抗体分子还与Fcγ受体结合。在小鼠癌症实验模型中使用有效地连接或不有效地连接FcγR结合的抗体变体证明了对属于本发明的用于得到治疗功效的TNF-α阻断拮抗性组的抗体的抗TNFR2抗体的FcγR相互作用的专性依赖性。此配体阻断拮抗性抗体对体内治疗活性的专性依赖性,以及其为了最大治疗性体内活性而相对于抑制性FcγR优先结合/连接活化性FcγR示出在实例5中。在此实例中包含了证明激动剂非阻断抗TNFR2抗体的FcγR无关的体内活性,以及其为了最大治疗性活性而相对于活化FcγR差异性地优先连接抑制性FcγR的数据,以用于仅比较和对比目的。总的来说,数据证明了可以产生几种类型的抗TNFR2抗体。此外,数据证明,哪些抗体变体将是治疗最有效的,是否其依赖于阻断、激动剂或拮抗剂(外部或固有)性质以及其是依赖于还是不依赖于FcγR连接或在相关于与活化或抑制性Fcγ受体优先/强结合的抗体格式中最有效并不是不重要的并且可能无法预测。
小鼠与人FcγR系统之间的相对高的同源性解释了物种之间保守的FcγR介导的机制的许多一般方面。然而,小鼠和人IgG亚类在其对其同源FcγR的亲和力方面有所不同,使其在将小鼠系统中的FcγR介导的观察转化为基于人IgG的治疗剂以选择示出与人活化与抑制性FcγR的适当结合的抗体、抗体亚类和/或经工程化的亚类变体时非常重要。人抗体分子对单独人Fcγ受体的亲和力和/或亲合力可以使用表面等离子体共振(SPR)来确定。在一些实施例中,阻断TNFR2抗体分子对活化Fcγ受体结合的亲和力比对抑制性Fcγ受体结合的亲和力更高。对活化Fcγ受体的亲和力比对抑制性Fcγ受体的亲和力更高,包含了与对抑制性Fcγ受体的亲和力相比,变体对活化Fcγ受体,例如FcγRIIA、FcγRIIIA和/或FcγRI结合的亲和力更高的含义。
在一些实施例中,抗体分子是可以通过抗体分子的Fc区与Fcγ受体之间的正常相互作用而与Fcγ受体结合的IgG。
在一些实施例中,拮抗性阻断TNFR2抗体分子是人IgG1。众所周知,人IgG1以对活化人FcγRI的高亲和力结合,并且以对人活化性Fcγ受体FcγRIIA、FcγRIIIA以及对人抑制性FcγRIIB的更低且相似的亲和力结合。这已经使用例如表面等离振子共振(SPR)证明。
在一些实施例中,拮抗性阻断TNFR2抗体分子是示出改善了与一种或几种活化性Fc受体的结合和/或被工程化为用于改善与一种或几种活化性Fcγ受体的结合和/或被工程化为用于改善相对于抑制性Fcγ受体与活化性Fcγ受体相对结合的IgG抗体分子。在一些实施例中,抗TNFR2抗体是经Fc工程化的人IgG1抗体。此类经工程化的抗体变体的实例包含抗体与FcγRIIIA的结合选择性地改善的岩藻糖基化抗体,以及通过定向、突变或其它方式、导致与抑制性FcγRIIB相比,改善与一种或几种活化Fcγ受体的结合的氨基酸取代进行工程化的抗体(Richards等人,2008“抗体与FcγRIIa的结合的优化增强了肿瘤细胞的巨噬细胞吞噬(Optimization of antibody binding to FcgammaRIIa enhancesmacrophage phagocytosis of tumor cells)”,《分子癌症疗法(Mol Cancer Ther)》7:2517-27;Lazar等人,2006“具有增强的效应功能的经工程化的抗体Fc变体(Engineeredantibody Fc variants with enhanced effector function)”,《美国国家科学院院刊》,103:4005-10)。
在一些实施例中,被工程化用于改善与活化Fcγ受体的结合的人IgG抗体可以是在其Fc部分中具有两个突变S239D和I332E或三个突变S239D、I332E和A330L和/或G236A突变的人IgG抗体。在一些实施例中,被工程化用于改善与活化Fcγ受体的结合的人IgG抗体可以是岩藻糖基化的人IgG抗体。
本发明的拮抗性阻断抗体分子的Fc区所结合的Fcγ受体可以是如上所述的表达免疫效应细胞的Fcγ受体。
TNFR2特异性抗体分子与靶细胞上的TNFR2表面受体的结合以及FcγR在同一细胞或免疫效应细胞上的紧密共连接可能导致抗体分子所结合的TNFR2阳性靶细胞的耗竭或功能调节。细胞的耗竭在本文中是指通过细胞的物理清除来耗竭、缺失或消除细胞。
细胞的耗竭可以通过ADCC,即抗体依赖性细胞介导的细胞毒性或抗体依赖性细胞毒性,和/或ADCP,即抗体依赖性细胞吞噬来实现。这意味着当向患者,如人施用如本文所述的抗体分子时,其与在如Treg等细胞的表面上表达的TNFR2特异性结合,并且此结合导致细胞耗竭。通常,与低表达细胞相比,高表达细胞更有效地缺失。如实例5、图14中示出的,Treg是肿瘤设置中的最高表达细胞。
ADCC是具有Fc受体的效应细胞通过其可以识别并杀死,即耗竭在其表面上表达肿瘤来源的抗原,即在当前情况下,TNFR2的抗体涂覆的靶细胞的免疫机制。ADCP是类似的机制,但是其会导致靶细胞通过吞噬而非细胞毒性被杀死–即,耗竭。
另外,抗体分子的Fc区与Fcγ受体的结合的改善也可以改善借助于ADCC或ADCP通过Fc受体依赖性死亡耗竭靶细胞。这对于与活化Fcγ受体的结合改善的抗体分子尤其相关。
抗体分子对TNFR2阳性细胞具有耗竭作用意指在施用于如人等患者后,此抗体分子与在TNFR2阳性细胞的表面上表达的TNFR2特异性结合,并且此结合导致此类靶细胞的耗竭。
耗竭的细胞可以是许多不同细胞,如以上结合靶细胞是什么的讨论所解释的。通常是,具有最高TNFR2表达的细胞将耗竭。也表达TNFR2但不那么高的其它细胞也可能耗竭,但与具有最高TNFR2表达的细胞相比,程度却很小。
如以上所提及的,TNFR2在发现于各种癌症患者的肿瘤中的Treg上高度表达,并且在此类患者中,本发明的抗体分子将与Treg优先结合,并且由此导致Treg耗竭。Treg对其它免疫细胞(如CD8阳性(CD8
CD8
TNFR2特异性抗体分子的结合和TNF-α信号传导的阻断还可能导致细胞表型的功能性调节,例如将促肿瘤骨髓细胞调节为具有杀肿瘤性质的骨髓细胞。
在一些实施例中,TNFR2阳性细胞,即靶细胞是CD4阳性(CD4
在一些实施例中,TNFR2阳性细胞是CD4
在一些情况下,TNFR2优先在肿瘤微环境中的免疫细胞(肿瘤浸润细胞,TILS)上表达。
在一些实施例中,Treg将是肿瘤微环境中具有最高TNFR2表达,从而导致与TNFR2特异性结合的抗体分子(或抗TNFR2抗体分子)具有Treg耗竭作用的细胞。这在以下,例如在实例5中并且结合图13和15进行了更详细的讨论。
在一些实施例中,TNFR2阳性细胞将是实体瘤中的Treg。此类Treg将具有非常高的TNFR2表达,并且因此施用与TNFR2特异性结合的抗体分子将优先导致此类Treg的耗竭。
为了确定抗体分子是否是如本文所提及的,对TNFR2阳性细胞具有耗竭作用的抗体分子,可以使用PBMC-NOG/SCID中的体内测试。体内测试是基于PBMC小鼠和NOG/SCID小鼠的组合用途,这在本文中被称为PBMC-NOG/SCID模型。NOG小鼠和SCID小鼠是技术人员已知的(Ito M等人,(2002)NOD/SCID/γc
1)将人PBMC(外周血单核细胞)分离、洗涤并重悬于无菌PBS中。在一些实施例中,以75×10
2)向NOG小鼠i.v.(静脉内)注射适当量(如200μl)的来自步骤1)的细胞悬浮液。如果注射200μl,则这对应于15×10
3)在注射之后的合适时间,如2周,分离来自NOG小鼠的脾脏并且使其成为单细胞悬浮液。任选地,提取来自单细胞悬浮液的小样品,以通过FACS确定TNFR2在人T细胞上的表达,以便确认TNFR2表达。
4)将来自步骤3)的细胞悬浮液重悬于无菌PBS中。在一些实施例中,以50×10
5)向SCID小鼠i.p.(腹膜内)注射适当的量(如200μl)的来自步骤4的悬浮液。如果注射200μl,则这对应于10×10
6)在步骤5)中的注射之后的合适时间,如1小时,用适当量(如10mg/kg)的待测试的抗体分子、阳性对照抗体(例如,已知耗竭Treg的抗CD25抗体)或同种型对照单克隆抗体对SCID小鼠进行治疗。
7)在步骤6)中的处理之后的合适时间,如24小时,收集经治疗的SCID小鼠的腹膜液。
8)使用以下标志物通过FACS标识人T细胞亚群并对其进行量化:CD45、CD4、CD8、CD25和/或CD127。公认的是,人Treg在人PBMC群中可以被区分为CD4
9)将来自对来自用测试的抗体分子治疗的小鼠的T细胞亚群的标识和量化的结果与来自对来自用阳性对照抗体治疗的小鼠的T细胞亚群的标识和量化的结果以及来自对来自用同种型对照单克隆抗体治疗的小鼠的T细胞亚群的标识和量化的结果进行比较。来自用待测试的抗体分子治疗的小鼠的腹膜液中的Treg的数量比来自用同种型对照治疗的小鼠的腹膜液中的Treg的数量低证明了抗体分子对TNFR2阳性Treg具有耗竭作用。
此测定在以下实例5中结合图15进行了更详细的展示。
如以上所提及的,其它细胞也可以表达TNFR2,如癌细胞。在一些实施例中,抗体分子与在癌细胞上表达的TNFR2优先结合,并且所述结合然后直接导致癌细胞的耗竭。
抗体是免疫学和分子生物学领域的技术人员众所周知的。通常,抗体包括两条重(H)链和两条轻(L)链。在此,有时将此完整抗体分子称为全尺寸(full-size)或全长(full-length)抗体。抗体的重链包括一个可变结构域(VH)和三个恒定结构域(CH1、CH2和CH3),并且抗体的分子轻链包括一个可变结构域(VL)和一个恒定结构域(CL)。可变结构域(有时统称为F
抗体的另一部分是Fc区(另外被称为片段可结晶结构域),其包括所述抗体的重链中的每条重链的恒定结构域中的两个恒定结构域。如上所提及的,Fc区负责抗体与Fc受体之间的相互作用。
如本文所使用的术语抗体分子涵盖全长或全尺寸抗体以及全长抗体的功能片段和此类抗体分子的衍生物。
全尺寸抗体的功能片段具有与对应全尺寸抗体相同的抗原结合特性并且包含与对应全尺寸抗体相同的可变结构域(即,VH和VL序列)和/或相同的CDR序列。功能片段不总是含有对应全长抗体的所有六个CDR。应当理解的是,含有三个或更少个CDR区(在一些情况下,甚至仅单个CDR或其一部分)的分子能够保留一个或多个CDR所衍生的抗体的抗原结合活性。例如,在Gao等人,1994,《生物化学杂志》,269:32389-93中,描述了整个VL链(包含所有三个CDR)对其底物具有高亲和力。
含有两个CDR区的分子描述于例如,Vaughan和Sollazzo 2001,《组合化学与高通量筛选(Combinatorial Chemistry&High Throughput Screening)》,4:417-430中。在第418页(右栏—3“设计策略(Our Strategy for Design)”)中,描述了仅包含散布在框架区内的H1和H2CDR高变区的微抗体。所述微抗体被描述为能够与靶标结合。Vaughan和Sollazzo引用了以下Pessi等人,1993,《自然》,362:367-9和Bianchi等人,1994,《分子生物学杂志(J.Mol.Biol.)》,236:649-59,并且所述文献更详细地描述了H1和H2微抗体和其性质。在Qiu等人,2007,《自然生物技术(Nature Biotechnology)》,25:921-9中,证明了由两个连接的CDR组成的分子能够结合抗原。Quiocho 1993,《自然》,362:293-4提供了“微抗体”技术的总结。Ladner 2007,《自然生物技术》,25:875-7指出,含有两个CDR的分子能够保留抗原结合活性。
含有单个CDR区的抗体分子描述于例如,Laune等人,1997,《生物化学杂志》,272:30937-44中,其中证明了衍生自CDR的一系列六肽显示出抗原结合活性,并且注意到完整的单个CDR的合成肽显示出强结合活性。在Monnet等人,1999,《生物化学杂志》,274:3789-96中,示出了一系列12聚体肽和相关框架区具有抗原结合活性,并且指出CDR3样肽单独能够结合抗原。在Heap等人,2005,《普通病毒学杂志(J.Gen.Virol.)》,86:1791-1800中,报道了“微抗体”(含有单个CDR的分子)能够结合抗原,并且示出来自抗HIV抗体的环状肽具有抗原结合活性和功能。在Nicaise等人,2004,《蛋白质科学(Protein Science)》,13:1882-91中,示出了单个CDR可以赋予抗原结合活性和对其溶菌酶抗原的亲和力。
因此,具有五个、四个、三个或更少的CDR的抗体分子能够保留其所衍生的全长抗体的抗原结合性质。
抗体分子也可以是全长抗体的衍生物或此抗体的片段,条件是片段的此衍生物保留了Fcγ受体结合能力。当使用衍生物时,所述衍生物应当具有与对应全长抗体相同的抗原结合特性,在某种意义上所述衍生物与靶标上的和全长抗体相同的表位结合。
因此,如本文所使用的术语“抗体分子”包含所有类型的抗体分子以及其功能片段和其衍生物,包含:单克隆抗体、多克隆抗体、合成抗体、重组产生的抗体、多特异性抗体、双特异性抗体、人抗体、人来源抗体、人源化抗体、嵌合抗体、单链抗体、抗体重链、抗体重链的同二聚体、抗体重链的异二聚体以及抗体轻链的异二聚体。
进一步地,如本文所使用的术语“抗体分子”包含所有类别的抗体分子和功能片段,包含:IgG、IgG1、IgG2、IgG3、IgG4、IgA、IgM、IgD和IgE,除非另有说明。
在一些实施例中,抗体分子是人抗体分子、人源化抗体分子或人来源的抗体分子。在一些此类实施例中,抗体分子是IgG抗体。在一些实施例中,抗体分子具有以最优方式连接活化Fc受体的同种型。在一些实施例中,抗体分子是IgG1抗体。
技术人员应当理解,小鼠IgG2a和人IgG1与活化性Fcγ受体连接,并且分享通过由例如ADCP和ADCC对具有活化性Fcγ受体的免疫细胞进行的活化来激活靶细胞的缺失的能力。在一些实施例中,抗TNFR2抗体是鼠或人源化鼠IgG2a抗体。
在一些实施例中,特异性结合TNFR2的抗体分子是人IgG2抗体分子。
在一些实施例中,抗TNFR2抗体是与人TNFR2具有交叉反应性的鼠抗体。
如上所概述的,本发明涵盖不同类型和形式的抗体分子,并且所述不同类型和形式的抗体分子将是免疫学领域的技术人员已知的。众所周知的是,用于治疗目的的抗体通常被修饰抗体分子的性质的另外的组分修饰。
因此,包含了本文所述的抗体分子,或如本文所述的使用抗体分子(例如,单克隆抗体分子和/或多克隆抗体分子和/或双特异性抗体分子)包括可检测部分和/或细胞毒性部分。
“可检测部分”包含来自包括以下的组的一种或多种:酶;放射性原子;荧光部分;化学发光部分;生物发光部分。可检测部分允许抗体分子在体外和/或体内和/或离体可视化。
“细胞毒性部分”包含放射性部分和/或酶,例如其中酶是胱天蛋白酶和/或毒素,例如其中毒素是细菌毒素或毒液;其中细胞毒性部分能够诱导细胞裂解。
进一步包含了抗体分子可以呈分离的形式和/或经纯化的形式,和/或可以是聚乙二醇化的。聚乙二醇化是向分子,如抗体分子或衍生物,添加聚乙二醇聚合物以修饰其行为,例如以通过增加其水动力学尺寸来延长其半衰期,从而防止肾清除的方法。
如上所讨论的,抗体的CDR与抗体靶标结合。向本文所描述的每个CDR分配氨基酸符合根据以下的定义:Kabat EA等人,1991,“免疫学上所关注的蛋白质的序列(Sequencesof Proteins of Immunological Interest)”第五版,NIH出版号:91-3242,第xv-xvii页。
如技术人员将了解的,还存在用于向每个CDR分配氨基酸的其它方法。例如,国际免疫遗传学信息系统(International ImMunoGeneTics information system)(IMGT(R))(http://www.imgt.org/,以及Lefranc和Lefranc“免疫球蛋白概况(The ImmunoglobulinFactsBook)”,由学术出版社(Academic Press)出版,2001)。
在一些实施例中,特异性结合TNFR2的抗体分子是人抗体。
在一些实施例中,特异性结合TNFR2的抗体分子是人来源的抗体,即已经如本文所描述的进行修饰的最初人抗体。
在一些实施例中,特异性结合TNFR2的抗体分子是人源化抗体,即已经被修饰以增加其与人抗体的相似性的最初非人抗体。人源化抗体可以具有例如鼠抗体或lama抗体。
在一些实施例中,抗TNFR2抗体是单克隆抗体。
在一些实施例中,抗TNFR2抗体是多克隆抗体。
在一些实施例中,特异性结合TNFR2的抗体分子包括以下表1中列出的VH-CDR1序列之一。
在一些实施例中,特异性结合TNFR2的抗体分子包括以下表1中列出的VH-CDR2序列之一。
在一些实施例中,特异性结合TNFR2的抗体分子包括以下表1中列出的VH-CDR3序列之一。
在一些实施例中,特异性结合TNFR2的抗体分子包括以下表1中列出的VL-CDR1序列之一。
在一些实施例中,特异性结合TNFR2的抗体分子包括以下表1中列出的VL-CDR2序列之一。
在一些实施例中,特异性结合TNFR2的抗体分子包括以下表1中列出的VL-CDR3序列之一。
在一些实施例中,抗TNFR2抗体分子是:包括具有以下的6个CDR的抗体分子:SEQ.ID.NO:1、2、3、4、5和6;或包括具有以下的6个CDR的抗体分子:SEQ.ID.NO:9、10、11、12、13和14;或包括具有以下的6个CDR的抗体分子:SEQ.ID.NO:17、18、19、20、21和22。
在一些实施例中,抗TNFR2抗体分子是:包括具有以下的6个CDR的抗体分子:SEQ.ID.NO:1、2、3、4、5和6。
在一些实施例中,抗TNFR2抗体分子是选自由包括VH的抗体分子组成的组的抗体分子,所述VH选自由以下组成的组:SEQ.ID.NO:7、15和23。
在一些实施例中,抗TNFR2抗体分子是选自由包括VL的抗体分子组成的组的抗体分子,所述VL选自由以下组成的组:SEQ.ID.NO:8、16和24。
在一些实施例中,抗TNFR2抗体分子是包括具有SEQ.ID.NO:7的VH的抗体分子。
在一些实施例中,抗TNFR2抗体分子是包括具有SEQ.ID.NO:8的VL的抗体分子。
在一些实施例中,抗TNFR2抗体分子包括具有SEQ.ID.NO:7的VH和具有SEQ.ID.NO:8的VH。
在一些实施例中,抗TNFR2抗体分子包括具有SEQ.ID.NO:217的CH。
在一些实施例中,抗TNFR2抗体分子包括具有SEQ.ID.NO:218的CL。
在一些实施例中,抗TNFR2抗体分子包括具有SEQ.ID.NO:7的VH、具有SEQ.ID.NO:8的VH、具有SEQ.ID.NO:217的CH和具有SEQ.ID.NO:218的CL。
表1:根据本发明的拮抗性TNFR2阻断抗体分子的特定序列(在VH和VL序列中,CDR序列以粗体标记)
表2:非拮抗性的并且在本文中用于比较的TNFR2阻断抗体分子的特定序列(在VH和VL序列中,CDR序列以粗体标记)
为了确定或证明本发明的抗体分子的特征,将其与不阻断TNF-α配体与TNFR2结合的抗体分子进行了比较。此类抗体示出在表3中。
表3:本文提及的作为参考抗体的非阻断TNFR2抗体分子的特定序列(在VH和VL序列中,CDR序列以粗体标记)
以上表1、2和3中的序列均为人类起源的并且衍生自
在一些实施例中,特异性结合本文所述的TNFR2的抗体分子还可以包括以下表4中列出的恒定区(CH和/或CL)中的一个或两个。
表4:
以上表4中的第一CH(SEQ.ID.NO:217)和第一CL(SEQ.ID.NO:218)序列为人类起源。表4中的第二CH(SEQ.ID.NO:219)和第三CH(SEQ.ID.NO:220)均来自鼠IgG2a,其区别在于第三CH序列(SEQ.ID.NO:220)含有N297A突变。第二CL序列(SEQ.ID.NO:221)来自鼠λ轻链恒定区。这些鼠序列在实例中用于替代抗体。
在一些实施例中,抗体分子结合人TNFR2(hTNFR2)。
在一些实施例中,有利的是,抗体分子与hTNFR2和食蟹猴TNFR2(cmTNFR2或cynoTNFR2)结合。与在恒河猴,也被称为食蟹猕猴或长尾猕猴体内的细胞上表达的TNFR2的交叉反应可能是有利的,因为这使得能够在不使用替代抗体的情况下,在特别关注耐受性的情况下进行抗体分子的动物测试。
在一些实施例中,需要的是使用替代抗体测试小鼠体内的相关体内模型中的抗体分子的功能活性。为了确保人体内的抗体分子的作用与小鼠体内的替代抗体的体内结果之间的可比性,必要的是选择具有与人抗体分子相同的体外特性的功能等效的替代抗体。
在一些实施例中,抗体分子不与包括序列KCSPG或由序列KCSPG组成的TNFR2的表位特异性结合。
在一些实施例中,本发明或根据本发明使用的抗体分子是能够与本文提供的特异性抗体竞争,例如能够与包括以下的抗体分子竞争以用于与TNFR2结合的抗体分子:选自由SEQ.ID.NO:7、15和23组成的组的VH;和/或选自由SEQ.ID.NO:8、16和24组成的组的VL。
“能够竞争”意指竞争性抗体能够至少部分地抑制或另外干扰如本文定义的抗体分子与特异性靶标TNFR2的结合。
例如,此竞争性抗体分子能够将本文所述的拮抗性阻断抗体分子的结合抑制至少约10%;例如至少约20%、或至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少100%和/或将本文所述的抗体防止或减少TNFR2与特定靶配体TNF-α的结合的能力抑制至少约10%;例如至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%或约100%。
竞争性结合可以通过本领域的技术人员众所周知的方法来确定,如酶联免疫吸附测定(ELISA)。
可以使用ELISA测定来评价表位修饰或阻断抗体。适用于标识竞争性抗体的另外的方法公开于《抗体:实验室手册(Antibodies:A Laboratory Manual)》,Harlow和Lane中,所述文献通过引用并入本文(例如,参见第567页到第569页、第574页到第576页、第583页以及第590到第612页,1988,冷泉港实验室(CSHL),纽约(NY),ISBN 0-87969-314-2)。
在一些实施例中,所关注的是不使用抗体分子自身,而是使用编码此抗体分子的核苷酸序列。因此,本发明涵盖编码以上拮抗性阻断TNFR-2抗体分子的核苷酸序列。
以上所述的拮抗性阻断抗体分子和核苷酸序列可以用于医学中,并且然后此类抗体分子和/或核苷酸序列可以包含在药物组合物中,如以下进一步讨论的。
以上所述的拮抗性阻断抗体分子、核苷酸序列和/或药物组合物可以用于治疗癌症,如下文进一步讨论的。
以上所述的拮抗性阻断抗体分子、核苷酸序列和/或药物组合物可以用于治疗由细胞内病原体引起的感染,如下文进一步讨论的。
以上所述的拮抗性阻断抗体分子和/或核苷酸序列可以用于制造用于治疗癌症的药物组合物。
以上所述的拮抗性阻断抗体分子和/或核苷酸序列可以用于制造用于治疗由细胞内病原体引起的感染的药物组合物。
以上所述的拮抗性阻断抗体分子和/或药物组合物可以在用于治疗患者的癌症的方法中使用,在所述方法中向所述患者施用治疗有效量的抗体分子或药物组合物。
以上所述的拮抗性阻断抗体分子和/或药物组合物可以在用于治疗患者的由细胞内病原体引起的感染的方法中使用,在所述方法中向所述患者施用治疗有效量的抗体分子或药物组合物。
在涉及治疗癌症的一些实施例中,所述癌症是实体癌或白血病癌。实体瘤是通常不含有囊肿或液体区域的异常组织块。实体瘤可以是良性的(不是癌症)或恶性的(癌症)。恶性实体瘤在本文中被称为实体癌。不同类型的实体瘤针对形成其的细胞的类型而命名。实体瘤或癌症的实例是肉瘤、癌和淋巴瘤。
实体癌的更具体实例是肺癌、乳腺癌、结肠直肠癌、前列腺癌、膀胱癌、卵巢癌、子宫内膜癌、肾癌、肝癌、胰腺癌、甲状腺癌、脑癌、中枢神经系统癌、黑素瘤、神经母细胞瘤、威尔姆斯瘤(Wilms tumor)、横纹肌肉瘤、视网膜母细胞瘤、头颈癌、胃癌、淋巴瘤和骨癌。
白血病癌症的更具体的实例是急性淋巴细胞性白血病、慢性骨髓增殖性疾病、急性非淋巴细胞性白血病、B细胞急性淋巴细胞性白血病、慢性淋巴细胞性白血病、T细胞急性淋巴细胞性白血病、非霍奇金淋巴瘤(non-Hodgkin lymphoma)和慢性淋巴细胞增殖性疾病。
在涉及治疗由细胞内病原体,如病毒或细菌引起的感染的一些实施例中,细胞内病原体的具体实例是嗜肺军团菌(Legionella pneumophila)、立克次氏菌(R.rickettsia)、结核分枝杆菌(Mycobacterium tuberculosis)、单核细胞增多性李斯特氏菌(Listeria monocyotogenes)、沙门氏菌(Salmonella spp)、侵袭性大肠杆菌(invasive Escherichia coli)、奈瑟菌属(Neisseria spp)、布鲁氏菌属(Brucella spp)、志贺氏菌属(Shigella spp)、流感病毒、疱疹病毒、肝炎病毒、柯萨基病毒(Coxsackievirus)、艾普斯登-巴尔病毒(Epstein-Barr virus)或鼻病毒。
在涉及治疗癌症的一些实施例中,上述拮抗性阻断抗体分子可以和与检查点抑制剂特异性结合的抗体分子组合使用。可替代地,以上讨论的编码阻断TNFR2抗体分子的核苷酸序列可以和与检查点抑制剂或共刺激性激动性抗体特异性结合的抗体分子组合使用。检查点抑制剂的抗体包含靶向CTLA4、PD1、PD-L1、VISTA、TIGIT、CD200、CD200R、BTLA、LAG3、TIM3、B7-H3、B7-H4、B7-H7的抗体。共刺激性激动性抗体的实例是靶向OX40、41BB、OX40L、41BBL、GITR、ICOS、DR3、DR4、DR5、CD40、CD27、RANK、HVEM、LIGHT和B7-H6的抗体。可替代地,以上讨论的拮抗性阻断TNFR2抗体分子可以和编码与检查点抑制剂或共刺激性激动剂特异性结合的抗体分子的核苷酸序列组合使用。可替代地,以上讨论的编码阻断TNFR2抗体分子的核苷酸序列可以和编码与检查点抑制剂或共刺激性激动剂特异性结合的抗体分子的核苷酸序列组合使用。在一些实施例中,与检查点抑制剂特异性结合的抗体分子是抗PD-1抗体。PD-1(或PD1)抗体被视为阻断主要CD8
另外,以上讨论的拮抗性阻断TNFR2抗体分子可以与其它抗癌治疗组合使用,如化学疗法(例如但不限于多柔比星(doxorubicin)、卡铂、环磷酰胺、太平洋紫杉醇、吉西他滨(gemcitabine)、5-氟尿嘧啶、多西他赛(docetaxel)、长春新碱(vincristine)、米托蒽醌(Mitoxantrone)、密吐霉素(mutamycin)、表柔比星(epirubicin)和甲氨蝶呤(methotrexate))、小分子酪氨酸激酶或丝氨酸/苏氨酸激酶抑制剂(例如但不限于依鲁替尼(ibrutinib)、伊马替尼(imatinib)、舒尼替尼(suntinib)、瑞格拉非尼(regorafenib)、索拉非尼(sorafenib)、达沙替尼(dasatinib)、厄洛替尼(erlotinib)、凡德他尼(vandetanib)、米哚妥林(midostaurin)、维莫非尼(vemurafenib)、达拉菲尼(dabrafenib)、帕博西尼(palbociclib)、瑞博西尼(ribociclib)、曲美替尼(Trametinib)或艾乐替尼(alectinib))、靶向生长因子受体的抑制剂(例如但不限于靶向EGFR/HER1/ErbB1、EGFR2/HER2/ErbB2、EGFR3/HER3/ErbB3、VEGFR、PDGFR HGFR、RET、胰岛素样生长因子受体IGFR、FGFR的药物)、抗血管生成剂(例如但不限于贝伐单抗(Bevacizumab)、依维莫司(Everolimus)、来那度胺(Lenalidomide)、沙利度胺(Thalidomide)、齐夫-阿非西普(Ziv-aflibercept))或辐射。典型地,以上提及的抗癌药物均引起癌细胞死亡,这将导致新抗原暴露和发炎。在新抗原暴露并且肿瘤中存在炎性细胞涌入时,可能发生抗癌药物的协同作用,并且添加可以耗竭Treg并且由此可以增强免疫系统的拮抗性配体阻断TNFR2抗体甚至更进一步。
医学领域的技术人员将理解,药物可以用不同添加剂来修饰,例如以改变身体吸收药物的速率;并且药物可以以不同形式修饰,例如以允许到身体的特定施用途径。
因此,包含了本文所述的拮抗性阻断抗体分子、核苷酸序列、质粒、病毒和/或细胞可以与药学上可接受的赋形剂、载体、稀释剂、媒剂和/或佐剂一起组合成药物组合物。在此上下文中,术语药物组合物与术语药物制剂、药物调配物、治疗组合物、治疗制剂、治疗调配物和治疗实体可互换使用。
本文所述的药物组合物可以包括以下,或在一些实施例中可以由以下组成:抗体分子、核苷酸序列、质粒、病毒或细胞。
在一些实施例中,本文所述的药物组合物可以由质粒组成或包括质粒,所述质粒包括编码上述抗体分子或包括上述核苷酸序列的核苷酸序列。
在一些实施例中,药物组合物可以包括编码整合在细胞或病毒基因组中或病毒体中的本文所述的抗体分子的部分或完整抗体分子的核苷酸序列。然后,药物组合物可以包括作为本发明的抗体的递送媒剂的细胞或病毒(或编码本发明的抗体的核苷酸序列的递送媒剂)。例如,在实施例中,病毒可以呈治疗性溶瘤病毒的形式,所述治疗性溶瘤病毒包括编码本文所述的抗体分子中的至少一个抗体分子的核苷酸序列。在一些实施例中,此溶瘤病毒包括编码全长人IgG抗体的核苷酸序列。
在一些实施例中,本发明涉及包括本发明的核苷酸序列或本发明的质粒的病毒。优选地,病毒是溶瘤病毒,如治疗性溶瘤病毒。此类病毒是医学和病毒学领域的技术人员已知的。
在一些实施例中,此溶瘤病毒包括编氨基酸序列的与以上表1中列示的序列具有至少80%同一性的核苷酸序列。在一些实施例中,此溶瘤病毒包括与以上表1中列示的序列具有至少85%同一性的氨基酸序列。在一些实施例中,此溶瘤病毒包括与以上表1中列示的序列具有至少90%同一性的氨基酸序列。在一些实施例中,此溶瘤病毒包括与以上表1中列示的序列具有至少95%同一性的氨基酸序列。
例如,编码抗体001-H10的核苷酸序列可以如表5中呈现的。
表5:编码抗体001-H10的核苷酸序列的实例–表中带下划线的序列的一部分分别编码001-H10的VH和VL序列
一些溶瘤病毒具有容纳足够大的DNA插入以适应全长人抗体序列整合的能力。减弱型痘苗病毒和单纯疱疹病毒是其基因组大到足以允许整合全长IgG抗体序列的治疗性溶瘤病毒的实例(Chan等人,2014,“溶瘤痘病毒(Oncolytic Poxviruses)”,《病毒学年度评论(Annu Rev Virol)》1:119-41;Bommareddy等人,2018,“在组合癌症免疫疗法中整合溶瘤病毒(Integrating oncolytic viruses in combination cancer immunotherapy)”,《自然综述免疫学(Nat Rev Immunol)》18:498-513)。已经将全长IgG抗体成功整合成溶瘤牛痘病毒,这引起在病毒易感性宿主细胞,例如癌细胞感染时表达和细胞外释放(产生)全长IgG抗体(Kleinpeter等人,2016,“在抗体、Fab和scFv的溶瘤牛痘病毒中针对程序性细胞死亡-1(PD-1)的载体化允许其肿瘤内递送以及改善肿瘤生长抑制(Vectorization in anoncolytic vaccinia virus of an antibody,a Fab and a scFv against programmedcell death-1(PD-1)allows their intratumoral delivery and an improved tumor-growth inhibition)”《肿瘤免疫学(Oncoimmunology)》5:e1220467)。腺病毒也可以被工程为编码在细胞感染时功能性地产生并且分泌的全长IgG抗体(MarinoN.等人,2017“用于治疗性转基因的局部肿瘤内表达的多功能溶瘤病毒平台的开发(Development ofaversatile oncolytic virus platform for local intra-tumoural expression oftherapeutic transgenes)”《公共科学图书馆·综合》12:e0177810)。
本发明还涵盖包括病毒,如上文所讨论的溶瘤病毒以及药学上可接受的稀释剂、媒剂和/或佐剂的药物组合物。
本发明还包括其它治疗方式或“形状”的药物,如抗体药物缀合物、输注蛋白质等,以及包括此类治疗方式的药物组合物。
本文所述的抗体分子、核苷酸序列、质粒、病毒、细胞和/或药物组合物可以适合于肠胃外施用,其包含水性和/或非水性无菌注射溶液,所述水性和/或非水性无菌注射溶液可以含有抗氧化剂和/或缓冲剂和/或抑菌剂和/或使调配物与预期接受者的血液等渗的溶质;和/或水性和/或非水性无菌悬浮液,所述水性和/或非水性无菌悬浮液可以包含悬浮剂和/或增稠剂。本文所述的抗体分子、核苷酸序列、质粒、细胞和/或药物组合物可以在单位剂量或多剂量容器(例如密封安瓿和小瓶)中呈现并且可以在冷冻干燥(即冻干)条件下储存,仅需要在立即使用之前添加无菌液体载体,例如注射用水。
可以由前述种类的无菌粉末和/或颗粒和/或片剂制备临时注射溶液和悬浮液。
对于人类患者的肠胃外施用,抗TNFR2抗体分子的日常剂量水平通常将为1mg/kg患者体重到20mg/kg,或者在一些情况下以单个剂量或分开的剂量施用甚至高达100mg/kg。在特殊情况下,例如在结合长期施用的情况下,可以使用较低剂量。在任何情况下,医生将确定最适合于任何个体患者的实际剂量,并且所述实际剂量将随着特定患者的年龄、体重和反应而变化。上述剂量是一般情况的示例。当然,可以存在个别情况,其中更高或更低的剂量范围是理所当然的,并且此剂量处于本发明的范围内。
典型地,本文所述的包括抗体分子的药物组合物(或药物)将含有浓度介于大约2mg/ml与150mg/ml之间或介于大约2mg/ml与200mg/ml之间的抗TNFR2抗体分子。
通常,在人类中,本文所述的抗体分子、核苷酸序列、质粒、病毒、细胞和/或药物组合物的口服或肠胃外施用是优选途径,是最方便的。对于兽医用途,本文所述的抗体分子、核苷酸序列、质粒、病毒、细胞和/或药物组合物根据正常兽医实践,以适当可接受的调配物形式施用,并且兽医将确定最适合于特定动物的给药方案和施用途径。因此,本发明提供了包括一定量的对于治疗各种病状有效的本发明的抗体分子、核苷酸序列、质粒、病毒和/或细胞的药物调配物(如上文和下文进一步描述的)。优选地,本文所述的抗体分子、核苷酸序列、质粒、病毒、细胞和/或药物组合物适用于通过选自包括以下的组的途径递送:静脉内(IV或i.v.);肌肉内(IM或i.m.);皮下(SC或s.c.)或肿瘤内。
本发明还包含包括本发明的靶结合分子或部分的药学上可接受的酸或碱加成盐的本文所述的抗体分子、核苷酸序列、质粒、病毒、细胞和/或药物组合物。用于制备可用于本发明的上述碱化合物的药学上可接受的酸加成盐的酸是形成无毒酸加成盐的酸,即含有药理学上可接受的阴离子的盐,如盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸性磷酸盐、乙酸盐、乳酸盐、柠檬酸盐、酸性柠檬酸盐、酒石酸盐、酒石酸氢盐、琥珀酸盐、马来酸盐、富马酸盐、葡萄糖酸盐、蔗糖酸盐、苯甲酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐[即,1,1'-亚甲基-双-(2-羟基-3萘甲酸酯)]盐等。也可以使用药学上可接受的碱加成盐来产生药学上可接受的盐形式的根据本发明的药剂。可以用作试剂以制备在性质上为酸性的本发明药剂的药学上可接受的碱盐的化学碱是与此类化合物形成无毒碱盐的那些。此类无毒碱盐包含但不限于:衍生自此类药理学上可接受的阳离子的碱盐,如碱金属阳离子(例如,钾和钠)和碱土金属阳离子(例如,钙和镁)的那些;铵或水溶性胺加成盐,如N-甲基葡糖胺-(葡甲胺);以及低级链烷醇铵和药学上可接受的有机胺的其它碱盐等。本文所述的抗体分子、核苷酸序列、质粒、病毒和/或细胞可以冻干以用于在使用前储存并在合适的载体中重组。可以采用任何合适的冻干方法(例如,喷雾干燥、滤饼干燥(cake drying))和/或重组技术。本领域的技术人员将理解,冻干和重组可能导致不同程度的抗体活性损失(例如,利用常规免疫球蛋白,IgM抗体的活性损失往往比IgG抗体更大),并且可能必须向上调整使用水平以进行补偿。在一个实施例中,当再水化时,冻干的(冷冻干燥的)多肽结合部分损失的活性(在冻干之前)不超过约20%、或不超过约25%、或不超过约30%、或不超过约35%、或不超过约40%、或不超过约45%、或不超过约50%。
本文所述的抗TNFR2抗体分子、核苷酸序列和药物组合物可以用于治疗受试者或患者的癌症。在本文中,术语受试者和患者可互换使用。
如本文所用的术语“患者”(或受试者)是指已经被诊断为患有具体疾病的动物,包含人。
在一些实施例中,患者(或受试者)是已被诊断为患有癌症和/或表现出癌症的症状的动物,包含人。
在一些实施例中,患者(或受试者)是已被诊断为患有由细胞内病原体引起的感染和/或表现出由细胞内病原体引起的感染的症状的动物,包含人。
在一些实施例中,患者(或受试者)是患病组织中具有高TNFR2表达的患者。在此上下文中,高表达意指与对应健康组织相比更高水平的TNFR2表达。通常,用于此比较的健康组织是从一个或几个健康个体的健康组织中收集的参考组织(或标准参考)。表达的水平可以通过标准技术测量,如免疫组织化学(IHC)、荧光激活细胞分选(FACS)或mRNA表达测量。
包含了患者可以是哺乳动物或非哺乳动物。优选地,哺乳动物患者是人、马、牛、羊、猪、骆驼、狗或猫。最优选地,哺乳动物患者是人。
“表现出”癌症的症状包含了,患者展现出癌症症状和/或癌症诊断标志物和/或所述癌症症状和/或癌症诊断标志物可以被测量和/或评估和/或量化。
对于医学技术人员容易理解的是,癌症症状和癌症诊断标志物将是什么以及如何测量和/或评估和/或量化癌症症状的严重度是否降低或增加、或癌症诊断标志物是否减少或增加;以及如何可以使用那些癌症症状和/或癌症诊断标志物来形成癌症的预后。
癌症治疗通常以一系列治疗的治疗形式施用,也就是说,治疗剂在一段时间内施用。一系列治疗的时间的长度将取决于许多因素,所述许多因素可以包含所施用的治疗剂的类型、所治疗的癌症的类型、所治疗的癌症的严重度以及患者的年龄和健康状况等其它原因。
“治疗期间”包含了,患者当前正在接受一系列治程和/或正在接受治疗剂、和/或正在接受一系列治疗剂。
在一些实施例中,根据本发明的待治疗的癌症是实体瘤。
上述癌症中的每一种癌症都是众所周知的,并且如用于治疗那些癌症的治疗剂一样对症状和癌症诊断标志物进行了很好的描述。因此,症状、癌症诊断标志物和用于治疗以上提及的癌症类型的治疗剂将是医学技术人员已知的。
对大量癌症的诊断、预后和进展的临床定义依赖于被称为分期的某些分类。那些分期系统用于核对许多不同癌症诊断标志物和癌症症状,以提供对癌症的诊断和/或预后和/或进展的概述。肿瘤学的技术人员将理解如何使用分期系统评估癌症的诊断和/或预后和/或进展,以及应该使用哪些癌症诊断标志物和癌症症状来进行评估。
“癌症分期”包含:Rai分期,所述Rai分期包含0期、I期、II期、III期和IV期;和/或Binet分期,所述Binet分期包含A期、B期和C期;和/或安娜堡分期(Ann Arbour staging),所述安娜堡分期包含I期、II期、III期和IV期。
已知的是,癌症可以引起细胞形态的异常。这些异常通常可再现地发生在某些癌症中,这意味着在癌症的诊断或预后中可以使用检查形态的这些变化(另外被称为组织学检查)。用于使样品可视化以检查细胞形态并且用于制备用于可视化的样品的技术是本领域众所周知的;例如,光学显微镜或共聚焦显微镜。
“组织学检查”包含:存在小型成熟淋巴细胞;和/或存在具有狭窄细胞质边界的小型成熟淋巴细胞;存在具有缺乏可辨别的核仁的致密核的小型成熟淋巴细胞;和/或存在具有狭窄细胞质边界并且具有缺乏可辨别的核仁的致密核的小型成熟淋巴细胞;和/或存在非典型细胞和/或裂解的细胞和/或幼淋巴细胞。
众所周知,癌症是细胞DNA突变的结果,所述突变可能导致细胞避免细胞死亡或不可控制地增殖。因此,检查这些突变(也被称为细胞遗传学检查)可能是用于评估癌症的诊断和/或预后的有用工具。这一点的实例是染色体位置13q14.1的缺失,这是慢性淋巴细胞性白血病的特性。用于检查细胞的突变的技术是本领域中众所周知的;例如,荧光原位杂交(FISH)。
“细胞遗传学检查”包含检查细胞以及具体地染色体中的DNA。细胞遗传学检查可以用于标识DNA的变化,所述变化可能与难治性癌症和/或复发性癌症的存在相关联。此类变化可以包含:染色体13的长臂中的缺失;和/或染色体位置13q14.1的缺失;和/或染色体12的三体性;和/或染色体12的长臂中的缺失;和/或染色体11的长臂中的缺失;和/或11q的缺失;和/或染色体6的长臂中的缺失;和/或6q的缺失;和/或染色体17的短臂中的缺失;和/或17p缺失;和/或t(11:14)易位;和/或(q13:q32)易位;和/或抗原基因受体重排;和/或BCL2重排;和/或BCL6重排;和/或t(14:18)易位;和/或t(11:14)易位;和/或(q13:q32)易位;和/或(3:v)易位;和/或(8:14)易位;和/或(8:v)易位;和/或t(11:14)和(q13:q32)易位。
已知的是,患有癌症的患者表现出某些身体症状,所述身体症状通常是由于癌症对身体的负担引起的。那些症状通常再发生在同一癌症中,并且因此可以作为疾病的诊断和/或预后和/或进展的特性。医学领域的技术人员将理解哪些身体症状与哪些癌症相关联,以及评估那些身体系统如何与疾病的诊断和/或预后和/或进展相关。“身体症状”包含肝肿大和/或脾肿大。
附图说明
在下文的实例中,参考以下附图:
图1展示了本发明抗体结合TNFR2。图1A-D:通过ELISA示出了人抗体以产生不同的EC50值的剂量依赖性方式与人TNFR2蛋白结合。图1E:鼠抗体3-F10和5-A05以类似亲和力与mTNFR2结合。
图2示出了TNFR2特异性
尽管人TNFR2抗体以不同亲和力与体外活化的CD4结合(EC50值范围为0.59到53nM),但小鼠TNFR2抗体以类似亲和力结合(EC50值范围为0.072到0.11nM)。
图3示出了TNFR2
所有抗体均可以通过多克隆TNFR2抗体阻断,因此其示出了TNFR2
图4示出了人TNFR2特异性
大多数TNFR2抗体示出了与食蟹猴细胞的交叉反应性结合。
图5示出了所有本文所述的TNFR2特异性
MR2-1抗体不干扰TNFR2特异性
图6示出了抗人TNFR2抗体的配体阻断活性。用对hTNFR2具有特异性的
图7示出了抗小鼠TNFR2抗体的配体阻断活性。用对mTNFR2具有特异性的
图8根据其激动/拮抗TNFR2信号传导的能力和阻断TNF-α与TNFR2结合的能力对TNFR2特异性
图9示出了非阻断激动性而非阻断拮抗性TNFR2特异性
图10A示出了配体阻断拮抗性抗体作为mIgG2a(优先连接活化性Fc受体的同种型),具有最显著的抗肿瘤作用。对Balb/c小鼠皮下注射1×10
图11示出了配体阻断拮抗性抗体作为抗肿瘤治疗与抗PD1的组合是有效的。对C57/BL6小鼠皮下注射1×10
图12示出了阻断拮抗性抗体作为抗肿瘤治疗与抗PD-L1的组合是有效的。对C57/BL6小鼠皮下注射1×10
图13:对C57/BL6小鼠皮下注射1×10
图14示出了配体阻断拮抗性替代抗体3F10改变了肿瘤中的免疫细胞组成。如所描述的,用CT26肿瘤细胞对小鼠进行接种,并且在肿瘤的大小达到大约7×7mm时,如所指示的对其注射抗体。3次注射后,在治疗开始后第8天,使小鼠牺牲并收获肿瘤。通过FACS分析肿瘤单细胞悬液的免疫细胞含量。图14A:配体阻断拮抗性替代抗体3F10引起Treg耗竭,并且图14B:CD8
图15示出了人肿瘤中的T细胞表达的TNFR2水平类似于从PBMC重组的NOG小鼠中检索到的T细胞。简而言之,对NOG小鼠i.v.注射15-20×10
图16示出了配体阻断拮抗性抗体1-H10以FcγR依赖性方式在体内耗竭Treg。对NOG小鼠i.v.注射15-20×10
图17示出了拮抗性配体非阻断TNFR2抗体不诱导体外细胞因子释放。在三种不同的体外系统中测量了由各种TNFR2特异性抗体诱导的IFN-γ释放。作为阳性和抗CD3抗体=OKT3,使用了抗CD52抗体=阿仑珠单抗(Alemtuzumab)和抗CD28抗体。使用同种型对照作为阴性对照。每个点表示来自一个人类供体的PBMC。图17A示出了来自高密度细胞培养物的结果,其中PBMC以1×10
图18示出了拮抗性配体非阻断TNFR2抗体不诱导体内细胞因子释放。对NOG小鼠i.v.注射25-×10
图19示出了与缺乏单个结构域的TNFR2变体的结合。以流式细胞术方法对与在HEK细胞上表达的TNFR2变体结合的抗体进行了测试。结构域1和2的缺乏不会显著影响结合(图19A和B),而3和部分4则完全消除了抗体与TNFR2之间的相互作用(图19C和D)。类似地,结构域1+3的缺乏完全阻止了所有抗体(1F06除外)的结合(图19E),而结构域2+4的缺乏完全消除了激动性抗体(1F02、1F06、4E08)的结合并且还显著降低了拮抗剂(1H10、4H02、5B08)的结合(图19F)。深灰色表示阳性对照,并且白色表示阴性对照抗体。
图20示出了TNFR2的人(H-D3)和小鼠(M-D3)结构域3的氨基酸序列的比较。相似的氨基酸用白色标记,而差异用灰色标记。下面的五个序列代表测试抗体所针对的5种不同构建体。人与小鼠序列的交换是加下划线的,而未标记的序列是完全人的。结构域1、2和4是人的并且不含有任何取代或突变。
图21示出了与野生型人和小鼠TNFR2的结合(左图)。使用了突变的hTNFR2构建体(m1、m2、m3和m4)来缩小不同抗hTNFR2抗体的结合位点。流式细胞术分析显示,aa 119-132中的突变不影响抗体结合,而aa 151-160中的突变则完全消除了所有抗体的结合。134-144中的突变仅破坏阻断抗体和拮抗性抗体的结合,但不会显著影响激动性抗体。深灰色条表示阳性对照,并且白色为阴性对照抗体。虚线是阴性对照抗体的水平。
现在将描述体现本发明的某些方面的具体非限制性实例。
在许多实例中,具体地体内实例中,已经使用了抗体3-F10。这是小鼠抗体,是本文公开的人抗体的替代抗体。已经基于其与鼠TNFR2结合的能力,其对鼠TNF-α配体与TNFR2的结合的阻断,并且基于其在鼠T细胞活化测定中的拮抗活性选择小鼠抗体,如实例4中所述。在一些实例中,测试了3-F10抗体并且以与相比于抑制性Fcγ受体(mIgG2a)与活化性Fcγ受体的强且优先的结合,与小鼠抑制性FcγR(mIgG1)的强且优先的结合或与小鼠FcγR(mIgG2a N297A)的缺陷型结合相关联的不同抗体格式对其进行了比较。
在一些实例中,已经使用的抗体5-A05。其是出于参考和出于比较原因包含在本文中的人抗TNFR2非阻断激动性抗体的小鼠替代抗体。基于其与鼠TNFR2结合的能力、对鼠TNF-α配体与TNFR2的结合的阻断作用的缺乏以及其在鼠T细胞活化测定中的激动活性选择5-A05作为替代物,如实例4中描述的。在一些实例中,测试了5-A05抗体并且以与相比于抑制性Fcγ受体(mIgG2a)与活化Fcγ受体的强且优先的结合,相比于活化性FcγR(mIgG1)与小鼠抑制性FcγR的强且优先的结合或与小鼠Fcγ(N297A)的缺陷型结合相关联的不同抗体格式对其进行了比较。
在一些实例和附图中,使用了抗体克隆的略微不同的命名,例如,克隆001-H10有时会缩短为1-H10或1H10,005-B08有时会缩短为5-B08或5B08等。
(另请参见图1和此图的以上描述)。
scFv抗体片段的分离
使用了
在针对重组人或小鼠蛋白的三个连续淘选中使用了噬菌体库。在噬菌体培育后,洗涤细胞以去除未结合的噬菌体。用胰蛋白酶洗脱结合噬菌体并在大肠杆菌(E.coli)中扩增结合噬菌体。将所得噬菌体原种转化为scFv格式。用scFv携带质粒转换大肠杆菌,并且表达单独scFv克隆。
独特TNFR2结合scFv的标识
使用均质FMAT分析(美国加利福尼亚州卡尔斯巴德的应用生物系统公司(AppliedBiosystems,Carlsbad,CA,USA))测定来自第三次淘选的经转化的scFv,以用于与被转染成表达人或小鼠TNFR2或非相关蛋白的293FT细胞结合。
简而言之,将经转染的细胞与来自表达板的含scFv的上清液(按1:7稀释)、小鼠抗His Tag抗体(0.4μg/ml;R&D系统公司(R&D Systems))和APC缀合的山羊抗小鼠抗体(0.2μg/ml;目录号:115-136-146,杰克逊免疫研究实验室有限公司(Jackson Immunoresearch))一起添加到清澈底板。在读数前,将FMAT板在室温下温育9小时。经细菌克隆结合TNFR2转染的细胞而不是用非相关蛋白转染的细胞被归类为活性物,并将其最佳挑选到96孔板中。
ELISA中与TNFR2的IgG结合
在4℃下,用重组人或小鼠TNFR2-Fc蛋白(义翘神州生物技术公司(SinoBiological))以1pmol/孔涂覆96孔板(葛莱娜公司(Greiner)的Lumitrac 600LIA板)过夜。洗涤后,允许滴定剂量的20μg/ml到0.1ng/ml(133nM到1pM)的抗TNFR2 mAb结合1小时。然后再次洗涤板,并且用以50ng/ml稀释的抗人F(ab)-HRP二级抗体(杰克逊免疫研究实验室有限公司)检测结合的抗体。使用Super Signal ELISA Pico(赛默科技公司(ThermoScientific))作为底物,并且使用Tecan Ultra Microplate读数器分析板。
表6和图1A-D中示出的数据示出人抗TNFR2抗体均与人TNFR2蛋白结合。EC50值的范围从1-C08的0.082nM到1-A09的4.4nM。
另外,小鼠抗体替代克隆3-F10和5-A05也与mTNFR2蛋白结合。这两个克隆以非常相似的亲和力结合(表6和图1E)。
表6与TNFR2蛋白(克隆3F10和5A05除外的人类蛋白)结合的抗体的EC50值
(另请参见图2-5和这些图的以上描述)。
CD4
使用Ficoll-Paque PLUS(GE医疗公司(GE Healthcar))梯度分离出来自人血沉棕黄层和食蟹猕猴(食蟹)全血的PBMC。通过磁性细胞分选使用均来自美天旎公司(Miltenyi)的CD4
TNFR2特异性
使用体外活化的CD4
TNFR2
在FACS阻断实验中利用商用多克隆TNFR2抗体(R&D系统公司)获得了TNFR2抗体对TNFR2的特异性。用40μg/ml多克隆TNFR2抗体(R&D系统公司)将用50ng/ml rhIL-2(R&D系统公司)(人)/135U/ml rm IL-2(R&D系统公司)(小鼠)和
TNFR2特异性
TNFR2抗体克隆MR2-1(英杰公司(Invitrogen))结合TNFR2蛋白的特定结构域。通过FACS阻断实验测试了TNFR2特异性
用50ng/ml rhIL-2(R&D系统公司)和
TNFR2
为了验证TNFR2抗体对食蟹猴的交叉反应性,用50ng/ml PMA(西格玛公司(Sigma))和100ng/ml离子霉素(西格玛公司)将食蟹猴CD4
总之,实例2中的数据示出了人抗体与在人类免疫细胞上内源性地表达的TNFR2特异性地结合。此外,数据示出,此结合可以通过添加TNFR2的显示出对TNFR2的非常高的特异性的多克隆可商购抗体来阻断。对于关于表达鼠TNFR2的鼠细胞的替代克隆3F10和5A05也是如此。同样,人克隆的结合不受显示出与MR2-1不同的表位特异性的MR2-1抗体的影响。
表7.按照体外活化的CD4
(另请参见图6-7和这些图的以上描述)。
ELISA方法
在ELISA包被缓冲液(0.1M碳酸钠pH 9.5)中,用hTNFR2(Sinobioologicals目录号10414-H08H)或mTNFR2(Sinobioologicals目录号50128M08H)以2.5pmol/孔涂覆96孔板,并且在4℃下培育过夜。在ELISA洗涤缓冲液(含0.05%Tween20的PBS)中洗涤后,将板与
数据呈现在以下表8和9中以及图6和7中。
阻断定义
·完全阻断剂被定义为将TNF-α结合降低多于98%。
·部分阻断剂被定义为将TNF-α结合降低60-98%。
·弱阻断剂被定义为将TNF-α结合降低少于60%。
·非阻断抗体被定义为在高剂量单点ELISA中未达到不多于50%阻断,如图6A和7A中示出的。
此实例中示出的数据示出,已经产生了各种抗体,其范围从完全抑制配体TNF-α结合的抗体到根本不抑制配体阻断的抗体。对于人抗体和鼠替代物两者都是如此。
(另请参见图8-9和这些图的以上描述)。
TNFR2抗体调节细胞因子刺激的NK细胞IFN-γ产生的能力
使用Almishri等人描述的NK细胞测定评价了TNFR2特异性抗体的激动性/拮抗性特性。(“TNFα通过TNFR2增强细胞因子诱导的NK细胞IFNγ产生(TNFαAugments Cytokine-Induced NK Cell IFNγProduction through TNFR2)”Almishri W.等人,《先天免疫杂志(J Innate Immun.)》2016;8:617-629)。
简而言之,使用“NK分离试剂盒”(美天旎公司)通过MACS从人PBMC中分离出人NK细胞。将100μl NK细胞(1×10
作为对照,包含了中和TNF-α的抗TNF-α抗体(目录号AF-210-NA,R&D系统公司)。如图8D中所见,1μg/ml的剂量完全中和了可溶性TNF-α,并且此剂量也降低了IFN-γ释放。
人非阻断TNFR2抗体显著增强了IL-2和IL-12刺激的NK细胞IFN-γ产生(与同种型对照相比多2-3倍的IFN-γ),而拮抗性抗体(此处示出为完全阻断剂)示出了对NK细胞的拮抗性作用以及减少的IFN-γ产生(图8A)。
由于鼠培养物中缺乏内源性地产生的TNF-α以及抑制性FcγR在鼠NK细胞上的表达,同时仅活化FcγR在人对应物上的表达,所以此测试被视为对用小鼠替代抗体执行是非代表性。相反,使用了以下所述的记忆性T细胞活化测定(CD25的诱导)来解决小鼠替代抗体的激动剂或拮抗性质。
TNFR2抗体对CD25表达记忆性CD4
为了进一步理解TNFR2抗体的激动性/拮抗性特性,对其增强CD25表达记忆性CD4
简而言之,使用来自美天旎公司的“CD4
类似地,使用“CD4
增强了CD25表达细胞在人和小鼠两者中的用非阻断TNFR2刺激的记忆性细胞培养物中的百分比。然而,用阻断抗体进行的刺激不会增加这些培养物中的CD25表达而是减少其表达。
总之,实例4中的数据示出,配体阻断抗体是拮抗性的,如通过几种体外方法测量的:对NK细胞介导的IFN-γ释放的抑制以及对CD4
(另请参见图10-16和这些图的以上描述)。
不同肿瘤模型的治疗作用
为了评估配体阻断拮抗性抗TNFR2 mAb的体内抗肿瘤作用,在不同肿瘤模型中,使用不同同种型格式,并且单独或与如下所述的抗PD-1组合体内研究了被称为3F10的小鼠替代物。
根据内政部(home office)的指导方针,在本地设施中饲养并维持小鼠。由泰康利(Taconic)(丹麦博姆霍尔特(Bomholt,Denmark))供应六到八周大的雌性BalbC和C57/BL6小鼠并且将其维持在本地动物设施中。使CT26、MC38和B16.F10细胞(ATCC)在补充有10%FCS的谷氨酰胺(glutamax)缓冲的RPMI中生长。当细胞半汇合时将其与胰蛋白酶分离并且以10×10
配体阻断蚂蚁激动性抗小鼠TNFR2 mAb 3-F10在三种不同肿瘤模型中示出了治疗性抗肿瘤作用(图10-13),在更具治疗敏感性的CT26(图10)中具有治愈作用并且在更具治疗耐性的MC38和B16中具有肿瘤生长抑制作用(图11-13)。
配体阻断拮抗性抗小鼠TNFR2 mAb的抗肿瘤作用是Fc:FcγR依赖性的
为了评估Fc-FcγR相互作用对配体阻断拮抗性抗TNFR2小鼠替代mAb的体内抗肿瘤作用的重要性,在CT26肿瘤模型中体内研究了此抗体的不同Fc格式,如下所述。
如上所述饲养和维持小鼠。使CT26细胞(ATCC)生长并注射,如上所述。当肿瘤达到3×3mm时,每周两次用10mg/kg抗体i.p.(同种型对照、3-F10 IgG1、3-F10 IgG2a或3-F10-N297A(Fc缺陷型))治疗小鼠。两次/周测量肿瘤,直到其直径达到15mm,然后将小鼠处死。
Fc缺陷型3-F10-N297A示出了与同种型对照相比很小的治疗活性或无治疗活性,这表明Fc连接对此配体阻断拮抗性抗小鼠TNFR2 mAb的治疗功效是关键的(图10A和B)。IgG1和IgG2a格式均示出显著的治疗功效。然而,与活化Fcγ受体优先结合的IgG2a格式示出了优越的治疗效果,这表明Treg的耗竭/吞噬是此配体阻断拮抗性抗小鼠TNFR2 mAb的一个重要作用机制(图10A-B)。这与在Fc缺陷型格式中示出某种活性并且在鼠IgG1格式中示出最佳活性,已知与抑制性FcγR优先结合的非阻断激动性替代抗体5A05相反。配体阻断拮抗性抗体(3F10)与本发明一致,并且包含配体非阻断激动性抗体(5A05)以用于进行参考。
抗PD-1mAb的组合作用
为了评估配体阻断拮抗性抗TNFR2 mAb(小鼠替代物(3-F10))与抗PD-1的组合体内抗肿瘤作用,在MC38肿瘤模型中体内研究了治疗组合,如以下所述。
如上所述饲养和维持小鼠。使MC38细胞(ATCC)生长并注射,如上所述。注射八天后,每周两次用10mg/kg抗体i.p.(同种型对照、抗小鼠PD-1、3-F10或抗小鼠P-D-1和3-F10的组合)并且如图11A-E中所指示的治疗小鼠。两次/周测量肿瘤,直到其直径达到15mm,然后将小鼠处死。
抗小鼠PD-1和配体阻断拮抗性抗小鼠TNFR2 mAb 3-F10两者均在MC38模型中示出肿瘤生长抑制治疗作用(图11A-E)。当抗PD1和拮抗性抗小鼠TNFR2 mAb 3-F10组合时,治愈了具有治疗耐性的MC38的肿瘤(图11D-E)。
抗PD-L1 mAb的组合作用
为了评估配体阻断拮抗性抗TNFR2 mAb的组合体内抗肿瘤作用,将小鼠替代物(3F10)与抗PD-L1进一步组合,以用于MC38肿瘤模型中的治疗,如下所述。
如上所述饲养和维持小鼠。如上所述使MC38细胞(从南安普敦大学(SouthamptonUniversity)的M.Cragg博士获得)生长并且注射。注射六天后,两次用同种型对照抗体或3F10治疗小鼠(第1天和第4天),或用抗PD-L1(Bioxcell公司的克隆10F.9G2)治疗连续四天,然后两天后进行第五次注射(在第1天、第2天、第3天、第4天和第7天总计五次注射)或两者的组合。以10mg/kg i.p.施用所有抗体。用卡尺每周两次测量肿瘤,直到其直径达到2000mm3的体积,然后将小鼠处死。
抗小鼠PD-L1和配体阻断拮抗性抗小鼠TNFR2 mAb 3-F10两者均在MC38模型中示出肿瘤生长抑制治疗作用(图12)。当抗PD-L1和拮抗性抗小鼠TNFR2 mAb 3-F10组合时,抗肿瘤作用甚至进一步增强(图12)。
体内免疫细胞调节
为了研究免疫细胞在肿瘤中的体内作用,如上所述用CT26细胞接种BalbC小鼠。在肿瘤达到大约7×7mm之后,如图中指示的用i.p.施用的10mg/kg抗体治疗小鼠。在第1天、第4天和第7天治疗小鼠,并在第8天处死小鼠。将肿瘤切开,机械地分成小块,并且在37℃下使用胶原酶100μg/ml释放酶和100μg/ml脱氧核糖核酸酶的混合物消解2×5分钟,之间放置Vortex。在通过70μm过滤液过滤后,用含有10%FBS的PBS洗涤细胞悬浮液(400g,持续10分钟)。之后,将细胞重悬于MACS缓冲液中并且用染色CD45、CD3、CD8、CD4和CD25的抗体组或染色MHCII、F4/80、Ly6C、CD11b和Ly6G的抗体组进行染色。染色前,使用100μg/ml IVIG(经过纯化的静脉内免疫球蛋白)阻断细胞的非特异性结合。在FACS Verse中分析细胞。将小鼠Treg量化为CD45
如图14中所见,用配体阻断/拮抗性TNFR2抗体进行治疗导致肿瘤中的Treg耗竭。还看到朝CD8
PBMC-NOG/SCID模型
为了证实关于配体阻断拮抗性抗小鼠TNFR2替代mAb的耗竭活性的体内发现,分析了配体阻断拮抗性抗人TNFR2 mAb 1-H10在PBMC-NOG/SCID模型中在体内的耗竭能力,如以下所述。
根据内政部的指导方针,在本地设施中饲养并维持小鼠。由泰康利(丹麦博姆霍尔特)供应八周大的雌性SCID和NOG小鼠并且将其维持在本地动物设施中。对于PBMC-NOG/SCID(原代人异种移植)模型,使用Ficoll Paque PLUS分离出人PBMC,并且在洗涤后以75×10
1-H10的Treg耗竭活性优于Yervoy和1-H10N297Q(图16),证实了配体阻断拮抗性抗TNFR2 mAb 1-H10使Treg耗竭并且Fc相互作用涉及此耗竭(图16D)。
总之,实例5示出:
1.拮抗性配体阻断抗体可以具有跨几种肿瘤模型的强大抗肿瘤作用。
2.此作用可以通过与抗PD1抗体组合而增加。
3.作用取决于活化FcγR的连接。
4.用拮抗性配体阻断替代抗体进行治疗显著改变了肿瘤中的T细胞组成,其中CD8
5.在人类肿瘤中,最高的TNFR2表达细胞是Treg。
6.在其中在T细胞上模仿肿瘤TNFR2表达的人异种移植模型中,人Treg缺失并且CD8
7.如果抗体可以连接活化FcγR,则此Treg缺失最显著。
(另请参见图17-18和这些图的以上描述)。
大量促炎细胞因子的释放是用于治疗患者的免疫调节性抗体的一种可能的副作用。因此,在此使用两种不同方法测量了通过拮抗性配体阻断抗体诱导的细胞因子释放。第一种方法基于体外培养物中的抗体刺激,并且第二种方法基于将人类免疫细胞异种移植到免疫缺陷型小鼠。对于体外而言,培养物的设置已经示出很大程度上影响细胞因子的释放(Vessillier等人,《免疫方法杂志(J Immunol Methods)》2015年9月;424:43-52)。为了解决方法的差异,根据最近的出版物,使用了三种不同体外培养物装置。
对于高密度细胞培养(HDC)细胞因子释放测定(CRA),以1×10
通过用1μg/ml抗体涂覆96孔板的孔1小时来执行PBMC固相(SP)CRA。用PBS洗涤板后,每孔添加含1×10
还在用5μg/ml的抗体刺激200μl的全血48小时后,测量了细胞因子释放。
培育阶段结束时,将板离心,并且提取培养上清液并在-20℃下储存。根据制造商的说明(美国Meso Scale Discovery),使用定制的MSD板测量了IFN-γ、IL-2、IL-4、IL-6、IL-10、IL-8和TNF-α的浓度。
总之,在任何体外设置中,阻断拮抗性抗体均未诱导任何显著的细胞因子释放。阳性对照抗体阿仑珠单抗和OKT3确实诱导细胞因子,其中最明显的是IFN-γ,但是如图17中所见,除了同种型对照抗体以外,1H10抗体未诱导IFN-γ。1H10没有其它细胞因子升高(数据未示出)。
PBMC-NOG耐受性模型
为了研究配体阻断拮抗性抗人TNFR2 mAb 1-H10的耐受性,如下所述分析了PBMC-NOG模型中的体内细胞因子释放。
根据内政部的指导方针,在本地设施中饲养并维持小鼠。由泰康利(丹麦博姆霍尔特)供应八周大的雌性NOG小鼠并且将其维持在本地动物设施中。对于PBMC-NOG(原代人异种移植)模型,使用Ficoll Paque PLUS分离出人PBMC,并且在洗涤后以125×10
总而言之,实例6示出了在此用被称为1-H10的抗体例示的TNFR2配体阻断抗体不会诱导显著水平的细胞因子释放,如通过几种先前公开的方法测量的。由于细胞因子释放是几种免疫调节抗体临床开发的限制因素,因此这表明了在此方面的可接受的安全概况。
结构域构建体敲除
在第一组实验中,使用了编码TNFR2的不同变体的、丢失表10中所述的4个细胞外结构域中的一个或多个的DNA构建体。在第二组实验中,使用了编码TNFR2的变体的,其中如表11中所述的将结构域3的不同部分与对应鼠部分交换的DNA构建体。后者是可能的,因为没有一种抗体与鼠TNFR是交叉反应的。在两种情况下,从GeneArt公司(赛默飞世尔公司)购买构建体。将构建体克隆到含有CMV启动子和质粒复制的OriP起源(OriP origin)的表达载体中,并在悬浮液适应的HEK293-EBNA细胞中瞬时表达。
表11.已经针对对应鼠序列交换了用于结构域3的转染各个部分的TNFR2构建体。
基于流式细胞术的结合分析
使用Lipofectamin 2000用TNFR2变体的相应cDNA质粒转染了HEK-293-E细胞。转染后48小时,收获细胞并用指定的抗体将细胞染色30分钟。在利用PBS的2个洗涤步骤后,用偶联到APC的第二抗IgG对表面结合的抗体染色。在BD-Verse流式细胞仪上进行流式细胞术分析之前,洗涤细胞并对细胞染色以用于检测活/死。
经转染的HEK 293细胞的基于流式细胞术的结合实验清楚地示出,结构域1和结构域2不会影响抗体中的任何抗体与这些细胞结合(结构域1)或者仅略微影响抗体中的任何抗体与这些细胞结合(结构域2)。使用了多克隆抗人TNFR2抗体作为阳性对照。阳性对照抗体示出了与所有测试的构建体的高结合,而阴性抗体未示出结合(图19)。所有测试的抗体均示出完全丧失了与缺乏结构域3的TNFR2的结合。类似地,如果结构域4丢失,则大多数抗体可能不会与TNFR2结合。相比于与TNFR2Δ1和TNFR2Δ2结合,所有拮抗性抗体(1H10、4H02和5B08)均示出与TNFR2Δ4的结合大大降低了多于50%。类似地,从TNFR2中去除两个结构域清楚地示出,结构域3或4的缺乏严重消除了所有测试的抗体与TNFR2的结合,可能激动性抗体1F06除外,而结构域4的缺乏则消除了激动性抗体的结合并且显著降低了拮抗性抗体的结合。(图19E和F)。
与小鼠人嵌合TNFR2的结合
为了进一步缩小结合位点并定义表位,用对应小鼠序列替代了人TNFR2结构域3的一部分。由于所有抗体均示出对小鼠TNFR2的交叉反应性非常低,因此与某些构建体的结合的丧失将允许细化结合表位。图20显示了不同的小鼠-人嵌合TNFR2构建体。进行了四种不同替代,将来自人序列的14(m1)、12(m2)、10(m3)或16(m4)氨基酸与对应小鼠序列交换。其它三个结构域(1、2、4)排他地含有人类序列。
然后将这些构建体(在3中具有突变的TNFR2结构域1-4)转染成HEK293细胞,并且使用流式细胞术方法测试抗体的结合。作为阳性对照,使用了小鼠TNFR2以及人TNFR2的多克隆抗体。如所期望的,由于序列相似性,两种多克隆对照抗体均示出显著的交叉反应性并且识别人和小鼠TNFR2两者。显然,在将抗体与其预期靶标匹配时,获得了最佳信号。
单克隆抗体示出了与人TNFR2的强结合,但与小鼠TNFR2不结合或结合很少(图21左图)。对于所有克隆,观察到与在aa 119-132中具有突变的hTNFR2 m1构建体的结合相似,几乎没有减少,这表明没有抗体与所述区内的表位结合。然而,aa 134-144(hTNFR2 m2构建体)中的突变完全消除了测试的抗体的对应于拮抗性阻断抗体1-H10、4-H02和5-B08的一半的结合,这表明所述抗体至少部分地在此区中结合。1-G10是也受到此替代的强烈影响的部分阻断剂。值得注意的是,使用构建体2,激动性抗体(1-F02、1-F06和4-E08)保持了结合,这强烈表明与拮抗性抗体不同的表位。有趣的是,所有抗体都丧失了与在aa 151-160中具有突变的hTNFR2 m3构建体的结合。这表明,所有抗体(激动剂和拮抗剂两者)在所述序列内均具有至少部分表位。测试在aa 130-144中具有突变的稍大构建体hTNFR2 m4示出了与构建体hTNFR2 m2相似的结合。
结论结合表位
将抗体分组为其功能作用,激动性抗体(1-F02、1-F06和4-E08)似乎结合了结构域3的涵盖aa 151-160的非常远侧的C端部分并且可能延伸到结构域4的更大部分,然而拮抗剂(1-H10、5-B08和4-H02)的表位更多地朝结构域3的涵盖aa 134-160的中心移位并且可能覆盖结构域4的较小部分。然而,尽管如此,其表位似乎在一定程度上重叠。
没有抗体与域3的aa 119-134的N端部分结合。与结构域4的结合位点很有可能针对所有抗体但尚未完全标识出来。
- 新型拮抗性抗TNFR2抗体分子
- 用于治疗脊髓损伤和疼痛的抗反义导向分子A(RGMA)拮抗性抗体
