用于诊断受试者体内恶性异常增生的方法和试剂盒
文献发布时间:2023-06-19 11:22:42
技术领域
本发明涉及诊断领域,具体地涉及用于诊断受试者体内恶性异常增生的方法和试剂盒。
背景技术
生物机体内在各种因子的刺激下使细胞分裂活跃,细胞数量增多,产生各种疾病,称之为异常增生或异常增殖,包括良性的肿瘤和恶化后的癌症或恶性异常增生或增殖。因此恶性异常增生的早期诊断对于疾病的尽早及时干预至关重要。例如,卵巢癌(OC)属于一种恶性异常增生,是第二大最常见的妇科癌症,其死亡人数比其他任何妇科恶性肿瘤都要多。由于缺乏有效的早期诊断方法,超过70%的病例被诊断为晚期。尽管进行了最佳的细胞减灭术和标准的铂类化学疗法,大多数患者仍无法治愈,70%以上的患者会在2-3年内复发。这些因素加在一起,导致5年生存率低于30%。早期诊断的困难和容易转移是死亡的主要原因。探索用于OC诊断和复发监测的生物标志物对于提高OC患者的存活率具有重要意义。
循环肿瘤细胞(CTC)被认为是血源性转移的种子,它是一种新型的肿瘤生物标记物,代表了主要的液体活检方法,具有无创、实时的优势。CTC已获得美国食品和药物管理局的批准,并已在许多类型的实体恶性肿瘤中显示出诊断、预后和预测价值。在OC中,由于传统上将腹腔内植入转移视为OC转移的主要途径,并且尚未考虑血源性转移,因此对CTC的研究有限。
尽管最近的研究表明,血行转移也是OC转移的重要模式,包括常见的腹膜网膜转移(Pradeep S,Kim SW,Wu SY,et al.Hematogenous metastasis of ovarian cancer:rethinking mode of spread.Cancer Cell 2014;26:77-91)。有人认为OC中可能存在两种主要的转移机制:被动扩散和血源性转移(Tsz-Lun Yeung,Cecilia S.Leung,Kay-PongYip,et al.Cellular and molecular processes in OC metastasis.A review in thetheme:Cell and Molecular Processes in Cancer Metastasis.Am J Physiol CellPhysiol 2015;309:C444-C456)。OC中CTC的发现也已成为OC血源性转移的重要证据(VanBerckelaer C,Brouwers AJ,Peeters DJ,et al.Current and future role ofcirculating tumor cells in patients with epithelial ovarian cancer.Eur J SurgOncol 2016;42:1772-1779)。大量研究证实,CTC在OC的诊断、疗效评估和预后评估中具有潜在的临床应用价值。
背景技术中的信息仅仅在于说明本发明的总体背景,不应视为承认或以任何形式暗示这些信息构成本领域一般技术人员所公知的现有技术。
发明内容
鉴于现有技术中的现状,本发明在深入研究后发现通过在从外周血中去除红细胞和白细胞得到的富集液相中鉴定特定类型的细胞作为标志细胞可以有效地诊断体内恶性异常增生类疾病。至少部分地基于此完成了本发明。具体地,本发明包括以下内容。
本发明的第一方面,提供一种用于诊断受试者体内恶性异常增生的方法,其包括利用试剂从外周血中去除红细胞和白细胞得到的富集液相中鉴定标志细胞的步骤,其中,所述标志细胞为DAPI
在某些实施方案中,根据本发明所述的用于诊断受试者体内恶性异常增生的方法,其中,通过CEP8(8号染色体着丝粒探针)来检测细胞是否存在异倍体。
在某些实施方案中,根据本发明所述的用于诊断受试者体内恶性异常增生的方法,其中,所述异倍体为三倍体和四倍体。
在某些实施方案中,根据本发明所述的用于诊断受试者体内恶性异常增生的方法,其中,所述试剂包括DAPI、抗PTPRC抗体和抗PECAM1抗体。
在某些实施方案中,根据本发明所述的用于诊断受试者体内恶性异常增生的方法,其中,所述细胞异常增殖为恶性异常增殖。
在某些实施方案中,根据本发明所述的用于诊断受试者体内恶性异常增生的方法,其中,包括通过同步实施免疫荧光染色与染色体荧光原位杂交鉴定标志细胞。
在某些实施方案中,根据本发明所述的用于诊断受试者体内恶性异常增生的方法,其中,包括以下步骤:
(1)向所述富集液相中加入抗原修复缓冲液和染色混合液进行结合反应,离心后去上清得到细胞液,所述染色混合液包含DAPI、抗PTPRC抗体和抗PECAM1抗体,且各抗体分别偶联不同的荧光基团;
(2)向所述细胞液加入固定液混匀后,涂布于载玻片,干燥后加入包含CEP8探针的显色试剂进行杂交,得到检测标本;
(3)在荧光显微镜下通过颜色选择DAPI
在某些实施方案中,根据本发明所述的用于诊断受试者体内恶性异常增生的方法,其中,所述富集液相通过包括下述步骤的方法得到:取从受试者采集的外周血进行离心,弃上清后,加入清洗液混匀后,经密度梯度分离得到三层液体,取最上层和中间层液体混合,然后加入与磁珠结合的白细胞抗体,经磁分离后得到富集液相。
在某些实施方案中,根据本发明所述的用于诊断受试者体内恶性异常增生的方法,其中,当每5-7ml外周血中存在2个以上的标志细胞时,将受试者诊断为患有恶性细胞异常增殖或受试者体内存在细胞异常增殖的风险高,当每5-7ml外周血中存在小于2个标志细胞时,将受试者诊断为未患有恶性细胞异常增殖或受试者体内存在细胞异常增殖的风险低。
本发明的第二方面,提供一种用于诊断机体内细胞异常增殖的试剂盒,其包含用于显示细胞表面或细胞内含有PTPRC和PECAM1的试剂、DAPI和用于显示细胞染色体异常的试剂。优选地,进一步包含用于显示肿瘤标志物的试剂。
本发明的方法能够有效地诊断恶性增殖疾病。与传统的基于瘤标的方法相比,本发明的方法诊断价值更高。
附图说明
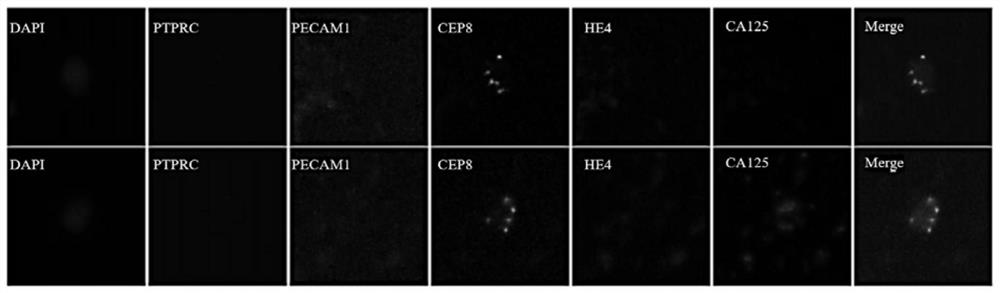
图1为从卵巢癌外周血鉴定的候选细胞的图像。
图2为候选细胞在良性和恶性卵巢癌组间的差异分布。
图3为候选细胞不同倍体亚类的差异分布。
图4为细胞系CAOV-3和SKOV-3的不同倍体的差异分布。
图5为候选细胞的细胞大小亚类的差异分布。
图6为不同大小的候选细胞的非整倍性分析。
图7为不同倍体亚类的ROC曲线。
图8为根据倍体数和细胞大小分类的各亚组的ROC曲线。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。除非另有说明,否则“%”为基于数量的百分数。
在前期研究中鉴定出的CTC细胞中存在较多的杂质细胞。这些杂质细胞的存在致使疾病的诊断结果中存在较多的假阳性,进而使准确性大大降低。发明人发现通过选择特定的抗原作为指标可以有效排除杂质细胞的干扰。另外,已知CTC细胞的大小并不均一,而是存在差异,传统的从外周血分离CTC细胞的方法不可避免地排除了部分小直径细胞,而这些小直径细胞对于诊断同样具有重要价值。这对于细胞数量本身极少的CTC细胞的检测而言是极为不利的。
本发明的“细胞异常增殖”是指体内细胞过度分裂产生的一类疾病的总称,一般而言,细胞异常增殖包括肿瘤和恶化后的癌症。本发明中,优选的细胞异常增殖为恶性异常增殖,如癌症。癌症的实例不特别限定,包括但不限于卵巢癌、子宫内膜癌、宫颈癌、乳腺癌、肺癌、前列腺癌、膀胱癌、结直肠癌、胃癌、食管癌、肝癌、胰腺癌、鼻咽癌、皮肤癌等。本发明优选妇科癌症,特别是卵巢癌。
本发明的“标志细胞”是指可用作疾病诊断或判断依据或指标的细胞。本发明的标志细胞属于一类特定的CTC细胞,其特别是指源自外周血的DAPI
本发明的“富集液相”是指从外周血中去除占血液大部分的红细胞和白细胞后得到的候选细胞富集的混合液。由于是从外周血中仅去除作为杂质的红细胞和白细胞,而对于目标细胞并无损失。因此本发明的富集液相,也称作差相富集液相。富集液相的制备可通过已知方式进行。下文示例性说明了其制备过程。
本发明中,表示细胞数量或个数的数值一般为自然数,例如1、2、3、4、5等。在数量统计的情况下,例如多次计数或测量并统计平均值时,细胞数量可以用小数表示,例如1.5个,1.8个等。
本发明的第一方面,提供用于诊断机体内细胞异常增殖的方法,有时简称为“本发明的诊断方法”,其包括利用试剂从外周血中去除红细胞和白细胞得到的富集液相中鉴定标志细胞的步骤。
本发明中,只要是能够显示标志细胞存在或其状态,则对于试剂不特别限定。试剂可以是一种试剂,也可以是多种试剂的组合。一般而言,本发明的试剂包括能够显示选自PECAM1和PTPRC组成的组的指示剂、DAPI和能够显示细胞染色体是否异常的试剂。优选地,指示剂可包括能够显示颜色的部分和能够特异性与标志细胞内或标志细胞表面的特定成分结合的部分。优选地,两种部分之间通过例如共价健方式结合。能够显示颜色的部分可以是已知的着色剂、颜料、染料或荧光剂等。能够特异性与标志细胞内或标志细胞表面的特定成分结合的部分包括能够与核酸结合的物质,例如DNA探针或核酸的其他互补片段,还包括抗体、受体或配体,或者它们的修饰物或衍生物。
本发明的抗体包括多抗、单抗、嵌合抗体、纳米抗体、人源化抗体或者完全人类抗体。本发明的抗体还可以是单链抗体。本发明中,抗体的修饰物包括化学修饰物以及抗体和其他材料的偶联物。其中,化学修饰物的实例包括但不限于抗体的乙酰化、酰化、ADP-核糖基化、酰胺化、交联环化、二硫键化、脱甲基化、共价交联、半胱氨酸化、焦谷氨酸化、甲酰化、γ-羧化、糖基化、GPI锚定、羟基化、碘化、甲基化、豆蔻酰化、氧化、蛋白水解和磷酸化等。其中,偶联物的实例包括但不限于与纳米高分子材料、磁珠等的偶联物。
在某些实施方案中,本发明的试剂包括抗体和与之偶联的可检测基团,例如荧光基团。本发明中,多种试剂的情况下,优选地,每种试剂的可检测基团不同。
在某些实施方案中,本发明的试剂还进一步包括用于显示肿瘤标记物的试剂。此类试剂可使用本领域已知的试剂,例如各种瘤标抗体,其实例包括但不限于针对CA125、HE4、PDL-1、methothelin、Kallikrein、osteopontin、claudin、TP53、c-myc、Bcl2、Bcl6、IgH、HER-2、MUC1、Folate Receptor、E-cadherin、N-cadherin、EpCAM、cytokeratin、vimentin、CD44、CD133、CD24、CD117的抗体等。本发明可以使用上述瘤标抗体中的一种或多种的组合。
本发明中,鉴定标志细胞的方法不特别限定,优选包括实施免疫荧光染色的步骤和染色体荧光原位杂交的步骤。在示例性实施方案中,本发明的鉴定包括以下步骤:
(1)向所述富集液相中加入抗原修复缓冲液和染色混合液进行结合反应,离心后去上清得到细胞液,所述染色混合液包含DAPI、抗PTPRC抗体和抗PECAM1抗体,且各抗体分别偶联不同的荧光基团;
(2)向所述细胞液加入固定液混匀后,涂布于载玻片,干燥后加入包含CEP8探针的显色试剂进行杂交,得到检测标本;
(3)在荧光显微镜下通过颜色选择PECAM1
可选地,本发明进一步包括(4)从外周血得到富集液相的步骤。
本发明中优选通过差相富集来进行富集。差相富集完全不依赖于肿瘤细胞表面标志物(如EpCAM)的表达,应用偶联抗人白细胞表面抗原的特殊单克隆抗体组合群的免疫磁微粒及用于分离血源性细胞的特殊离心介质快速高效去除肿瘤病人血液中的红细胞、白细胞及血浆蛋白,从而有效富集血液等体液标本中的稀有细胞,包括来源于所有不同组织实体瘤的循环肿瘤细胞、循环血管内皮细胞、干细胞等。获取的肿瘤细胞既没有被磁珠所包裹,亦没有与任何抗肿瘤细胞表面标志物的抗体相结合,从而避免了激活细胞内的信号传导通路。与其它常规方法相比,差相富集方法中红细胞的去除避免了低渗裂解法的使用,从而对富集的肿瘤细胞的损伤降至最低,使得获取的靶细胞维持良好的自然状态及细胞形态。另外,采用差相富集方法还可避免基于细胞大小,例如微流控技术进行细胞筛选时遗漏大量小细胞的不足,特别是能够避免例如直径小于5μm以下的有效细胞的损失。
在示例性实施方案中,本发明的富集液相制备包括以下步骤:取从受试者采集的外周血进行离心,弃上清后,加入清洗液混匀后,经密度梯度分离得到三层液体,取最上层和中间层液体混合,然后加入与磁珠结合的白细胞抗体,经磁分离后得到富集液相。
本发明的诊断方法中,只要包括鉴定本发明所述的标志细胞的步骤,即在本发明的范围内。在优选的实施方案中,除了上述鉴定步骤之外,本发明的诊断方法还进一步包括判断步骤。
本发明中,判断步骤一般包括基于预先设定的阀值来对鉴定步骤的结果进行分类,并由此确认诊断结果。本发明的阀值可以是标志细胞的数量。由于本申请的标志细胞为特定的CTC细胞,在外周血中其含量极少。因此一般而言以5-7ml外周血,特别是6ml外周血内所检测到的标志细胞的数量作为标准。在示例性实施方案中,本发明的阀值一般为2个/6ml外周血以上,优选3个/6ml外周血以上。需要说明的是,本发明的标志细胞还可以进一步细化为不同亚类或亚组。在以标志细胞的亚类作为指标时,本发明的阀值的选择通常会不同。例如,当仅基于4倍体标志细胞进行判断时,此时的阀值为1个/6ml外周血左右。
本发明的第二方面,提供用于诊断机体内细胞异常增殖的试剂盒,其一般包含用于显示细胞表面或细胞内含有选自PTPRC和PECAM1的试剂、DAPI和用于显示细胞染色体异常的试剂。可选地,本发明的试剂盒进一步包含用于显示肿瘤标志物的试剂。
实施例
一、患者及样本
招募的对象为2018年5月至2020年8月在北京大学人民医院收治的56名妇女。术前从高度怀疑为恶性肿瘤或明确诊断但未接受治疗的患者中收集外周血。术后病理证实了20例新诊断的原发性OC和36例卵巢良性肿瘤。根据赫尔辛基宣言,从所有患者获得书面知情同意书。该研究得到北京大学人民医院伦理委员会的批准,并根据赫尔辛基宣言的原则进行。
二、候选细胞的差相富集
将6ml外周血收集到装有ACD抗凝剂的试管中(Becton Dickinson,FranklinLakes,NJ,美国),然后在室温下离心(200×g)15分钟以分离血浆。弃去棕红色沉淀物上方的上清液,将血细胞沉淀物用6ml CRC缓冲液稀释,然后在50mL离心管中轻轻加入3mL样品密度分离液中,然后以450×g离心7分钟。将含有WBC和高于RBC的肿瘤细胞的溶液收集到50ml试管中,然后,将300μL涂有抗白细胞单克隆抗体(抗PTPRC等)的磁珠添加到样品中,并在室温下摇动30分钟。使用50ml大小的磁选机(Cytelligen)去除与WBC结合的免疫珠,然后洗涤非血液来源的细胞(包括肿瘤细胞和内皮细胞)并富集剩余的100μL CRC液体。样品适用于后续分析。
三、免疫染色和荧光原位杂交(iFISH)
向100μL富集的细胞溶液中加入2μL抗原修复缓冲液,轻轻混合并摇匀,然后在室温下静置10分钟。随后通过与淋巴细胞的荧光标记单克隆抗体(抗PTPRC-Alexa594)、内皮细胞的荧光标记单克隆抗体(抗PECAM1-Cy5)和OC肿瘤标志物(TM)的荧光标记单克隆抗体(抗CA125-Cy7、抗HE4-Alexa488)在室温下以1:200稀释孵育20分钟。将染色的细胞样品用CRC洗涤液洗涤并离心(500×g)5分钟,然后弃去上清液,剩下100μL。等体积的组织固定剂被用于固定这些细胞过夜。将样品包被在载玻片上,并用CEP 8探针进行原位杂交(美国Abbott Molecular,美国)。杂交条件是在76℃变性10min,在37℃杂交3h。借助于缓冲液,将盖玻片缓慢除去。清洁的载玻片用吹风机干燥。洗涤后,将样品用含有DAPI的固定介质(蓝色)固定。使用荧光显微镜收集鉴定出的肿瘤细胞的图像。
本发明标志细胞的判断标准:DAPI
四、数据处理
所有统计分析均使用SPSS版本24.0(版本24.0;美国纽约IBM公司)和GraphPadPrism 7(GraphPad Software,美国加利福尼亚州拉荷亚)。使用单向方差分析(ANOVA)和未配对的学生t检验对两组之间的差异进行统计学分析,与三组独立数据之间的差异相同。使用Fisher精确检验检查了CTC阳性与临床病理特征的相关性。通过非参数受试者工作特性曲线(ROC)分析确定了CTC和CTEC的阈值,并使用最大的尤登指数(灵敏度+特异性-1)来确定临界值。分类数据以百分位数表示。使用人相关性分析来确定相关性。P值<0.05被认为具有统计学意义。
五、结果
CA125和HE4作为肿瘤标志物(TM)都已被证明在OC的临床诊断中具有重要价值。无论CA125阳性还是HE4阳性或双重阳性都被认为是TM阳性。本发明中选择以下标准的CTC作为候选细胞,即,被表征为具有TM阳性和/或非整倍性,但没有PTPRC和PECAM1表达的有核细胞。更具体地说,CTC定义为:DAPI+/PTPRC-/PECAM1-/TMs+和/或DAPI+/PTPRC-/PECAM1-/CEP8≠2(图1)。为了方便说明的目的,下文和附图中有时也简称为CTC,但需特别说明的是,下文和附图中的CTC属于本领域一般理解的CTC范围内的一类特定细胞。
1、在OC和对照组中CTC计数的分布
比较20例OC患者与36例诊断为卵巢良性肿瘤的CTC的计数。图2显示在19/20(95.0%)的OC患者中检出210个CTC(平均10.5/6ml)。在34/36(94.4%)卵巢良性肿瘤患者中也可检测到CTC,总数为221(平均6.14/6ml)。
2、CTC的CA125和HE4表达特征及Chr8异倍性
通过免疫荧光染色鉴定CA125和HE4在CTC的细胞膜和细胞质上的表达。通过荧光原位杂交检测CTC中Chr8的倍性。结果显示在表1中。在4例OC患者中检测到CA125阳性CTC(4/20,20.0%),仅占总CTC的相对较小的比例(10/210,4.8%)。在5例OC患者中检测到HE4阳性CTC(5/20,25.0%),仅占总CTC的4.3%(9/210)。
表1 20例卵巢癌患者中CTC的CA125和HE4表达特征及Chr8异倍性
无论OC患者的阳性检出率如何,CA125+或HE4+CTC的总计数比例均较低。但是,在19/20(95.0%)的OC患者中发现具有Chr8非整倍性的CTC。此外,在210个异质CTC中,只有一个是二倍体CA125阳性细胞,其他209个CTC(99.5%)都是chr8的非整倍性。综上,TMs阳性CTC的数量均不足,我们的研究中CTC的主要特征是chr8非整倍性。
三、CTC的非整倍性亚型分析
在我们的研究中,大多数CTC表现出不同的Chr8非整倍性亚型,即单倍体、三倍体、四倍体和五倍体以上。图3A显示了示例性CTC的图像。
由于在我们的研究中几乎未检测到单倍体CTC,因此未分析数据。图3B显示,与CTC计数相比,两组中三倍体和四倍体CTC的差异分布更为显著(分别为P=0.0068和0.0003)。五倍体以上CTC的分布没有统计学差异(P=0.7578)。有趣的是,尽管在良性或癌症组中主要检测到五倍体以上的CTC,但与其他亚型相比,OC组中三倍体和四倍体CTC的差异更明显。
为了解释良性组中存在大量五倍体以上CTC的原因,我们研究了卵巢癌细胞系CAOV-3和SKOV-3中的Chr 8多倍性。图4A显示了通过FISH检测的Chr 8倍性的细胞的状态。在图4B中显示了在两个细胞系中具有多倍体Chr 8的细胞的百分比。有趣的是,在细胞系样本中,发现具有非整倍体Chr 8的细胞主要是三倍体或四倍体,它们在OC的CTC中也很常见。然而具有Chr 8五倍体以上的细胞很少,而这些细胞在OC或良性组中的CTC中占大多数。
四、不同大小CTC的分布
CTC中小细胞(≤5μm)和大细胞(>5μm)的分布如图5A所示。图5B显示了OC组和良性组中小细胞和大细胞CTC的分布,只有小细胞CTC的分布具有统计学显着性差异(P=0.0013)。图5C显示,OC患者中小细胞和大细胞CTC的比例分别为38.57%(81/210)和61.43%(129/210)。至于良性组,小细胞和大细胞CTC分别为17.65%(39/221)和82.35%(182/221)。在癌和良性组中大细胞占主导,而OC组中小细胞CTC的比例高于良性组。
五、不同大小CTC的非整倍性分析
为了进一步了解CTC的各种亚型的重要性,将细胞大小、Chr8倍性和疾病都考虑在内,图6A-C显示了CTC的12个亚类在良性或OC组中的分布。图6A表明,在良性组和癌症组之间,小细胞CTC中只有三倍体和四倍体细胞显著不同(分别为P=0.0003和0.0002)。小细胞CTC中五倍体以上的无法区分癌症患者和良性患者。对于大细胞CTC,只有四倍体细胞在两组之间显示出统计学上显著的分布差异(图6B)。
图6C显示了在良性或癌症组中不同大小的非整倍体细胞的比例。无论是良性患者还是癌症患者,三倍体细胞均是小细胞CTC中的最高亚组,而五倍体以上细胞则是大细胞CTC中的最高亚组。
六、CTC计数的临床价值
为了将OC患者与非恶性肿瘤区分开,根据本发明检测的CTC总数或其非整倍体或细胞大小亚型的数量绘制了ROC曲线,确定检测的灵敏度和特异性。
根据约登指数选择最佳的临界值,CTC总数诊断卵巢癌的临界值为4.5/6ml,敏感性为75.00%,特异性为58.3%。
为了寻求更好的指标,接下来,用同样的方法确定了CTC亚类的阀值和灵敏度和特异性。结果如下表2所示。亚类的ROC曲线如图7所示。
表2各倍性亚类的阀值及灵敏度和特异性
如表2和图7所示,具有三倍体或四倍体的非整倍性CTC对ROC的AUC的诊断价值较好,分别为0.792(临界值2.5/6ml,敏感性50.00%,特异性94.44%)和0.821(临界值0.5/6ml,敏感性为75.00%,特异性为80.51%)。基于该结果,我们尝试将三倍体CTC和四倍体CTC组合作为指标,以便能够得到更好的临床价值。经分析,组合后的AUC为0.853(临界值为2.5/6ml,敏感性为70.00%,特异性为91.67%),高于单独的三倍体或四倍体。
表3和图8显示了按非整倍性和细胞大小分类的亚组的诊断价值。这些指标在良性组和癌症组之间的分布差异具有统计学意义。如表3和图8所示,所有CTC亚组均具有良好的临床价值,AUC超过0.7,其中三倍体和四倍体小细胞CTC组表现出最佳的临床诊断价值(临界值1.5/6ml,敏感性70.00%,特异性83.3%,AUC 0.809)。
表3各倍性、细胞大小亚类的阀值及灵敏度和特异性
尽管本发明已经参考示例性实施方案进行了描述,但应理解本发明不限于公开的示例性实施方案。在不背离本发明的范围或精神的情况下,可对本发明说明书的示例性实施方案做多种调整或变化。权利要求的范围应基于最宽的解释以涵盖所有修改和等同结构与功能。
- 用于诊断受试者体内恶性异常增生的方法和试剂盒
- 用于诊断体内恶性实体肿瘤的方法和试剂盒
