一种个体化肿瘤新生抗原肽的筛选方法及其疫苗制剂
文献发布时间:2023-06-19 11:32:36
技术领域
本发明涉及医药领域,特别是一种个体化肿瘤新生抗原肽的筛选方法及其疫苗制剂。
背景技术
肿瘤疫苗作为免疫疗法的一种,旨在帮助免疫系统识别肿瘤细胞,进而消除肿瘤细胞。 肿瘤疫苗可分为预防型肿瘤疫苗和治疗型肿瘤疫苗。预防型肿瘤疫苗在临床应用中不仅能够 帮助机体在没有肿瘤侵染的状态下预先训练免疫系统,还能够预防手术后肿瘤的复发;治疗 型肿瘤疫苗针对已经存在的肿瘤细胞,激活免疫反应消除病灶。肿瘤疫苗可依据其抗原的来 源分为非个体化疫苗和个体化疫苗。非个体化疫苗利用肿瘤相关抗原(tumor-associated antigen; TAA)作为免疫靶点,激活免疫反应。肿瘤相关抗原为肿瘤细胞和其他人体正常细胞所共有, 其又可分为1)过表达自抗原(例如Her-2/neu和TERT等抗原);2)组织分化抗原(例如PSA, Mammaglobin-A和Tryosinase等抗原);3)生殖腺自抗原(例如MAGE,BAGE和NY-ESO-1 等抗原)和4)癌胚抗原(如CEA,MUC-1和TPBG等抗原)。多项针对传统非个体化肿瘤 疫苗(基于肿瘤相关性抗原开发的疫苗)的临床试验结果表明,这类抗肿瘤疫苗难以实现长 期的治疗效果。肿瘤新生抗原(neoantigens)通常由肿瘤细胞基因组突变产生,仅存在于肿 瘤细胞,是肿瘤特异性抗原(tumor specific antigen,TSA)中的一类。相较于肿瘤相关抗原, 新生抗原除了具有高度肿瘤特异性,通常还有更强的免疫原性和更好的主要组织相容性复合 体(MHC蛋白)亲和性,并且不受中央免疫耐受性的影响,因此在肿瘤临床治疗应用上具有 极大的潜力。2017年《自然》杂志发表了两项基于新生抗原的肿瘤疫苗的研究成果。美国波 士顿Dana-Farber癌症中心的Catherine Wu教授团队和德国美因茨大学Ugur Sahin团队分别 展示了基于肿瘤新生抗原的个体化多肽疫苗和个体化RNA疫苗治疗黑色素瘤中晚期复发高 危患者的优异疗效。这些结果为个体化肿瘤新生抗原疫苗的安全性、免疫原性、有效性提供 了有力证据。
肿瘤疫苗按照形式可分为树突状细胞(DC)疫苗,核酸(DNA或RNA)疫苗,蛋白质 疫苗和多肽疫苗。其中,多肽疫苗具有易于合成与纯化,且应用安全、无潜在致癌性等优点,国内外已有多种多肽疫苗上市。目前也已有数个肿瘤新生抗原多肽疫苗相关临床试验正在进 行。肿瘤新生抗原多肽疫苗疗法成功的关键在于:1)从肿瘤患者的样本测序数据中分析出能 够特异性刺激免疫细胞的新生抗原;2)将这些新生抗原包含的可递呈表位序列设计成易于合 成的疫苗多肽序列;3)将多肽疫苗合理运输、贮存,最后输入患者体内使其生效。多肽是 由氨基酸以肽键连接在一起而形成的化合物。多肽链中氨基酸残基的排列顺序(sequence)是多 肽最基本的结构,其决定了多肽的二、三级结构与各种理化性质。对于肿瘤新生抗原多肽来 说,由于其个体化定制的特殊属性,每条多肽的基本结构——包含新生抗原表位序列的氨基 酸序列均不相同,这就决定了设计制备得到的肿瘤新生抗原多肽往往具有不同的理化特性, 如等电点、亲水疏水性、溶解性、氧化还原性、pH值、肽链稳定性等。而这些都对肿瘤新生 抗原多肽疫苗的制备、储存、运输及临床使用带来了极大的困难。为了确保个体化的肿瘤新 生抗原多肽疫苗能具有合格的质量、足够长的保质期,实现储存稳定、保障疫苗功效,同时 避免为不同性质抗原肽开发不同工艺的麻烦,我们需要研发出一套通用的可行的制剂工艺来 制备肿瘤新生抗原多肽疫苗制剂;多肽肿瘤疫苗的给药途径包括皮下注射、静脉注射、肌肉 注射等。其中,皮下注射是目前肿瘤疫苗给药的首选途径。所以我们还需要对肿瘤新生抗原 多肽疫苗进行通用可行的制剂工艺研发;本发明解决这样的问题。
发明内容
为解决现有技术的不足,本发明的目的在于提供一种个体化肿瘤新生抗原肽的筛选方法 及其疫苗制剂,本发明将设计得到的个体化肿瘤新生抗原肽进行筛选后制备成制剂,具有优 秀的抑瘤效果。
为了实现上述目标,本发明采用如下的技术方案:
一种个体化肿瘤新生抗原肽的筛选方法,包括:如下步骤:
步骤一,针对产生疫苗包含的新生抗原的突变及抗原肽本身,收集整理变量信息;
变量信息包括:产生新生抗原的突变在基因组水平的突变频率Ag,产生新生抗原的突变 在转录组水平的突变频率Ar,产生新生抗原的突变所在基因的表达量E,突变导致的氨基酸 改变数目H,MHC蛋白I型和MHC蛋白II型表位序列的质量指标M
步骤二,根据公式计算,得到每一条设计的抗原肽的综合评分iNeo_Score;
iNeo_Score综合评分的计算公式为:
iNeo_Score=f
其中,Ag为产生新生抗原的突变在基因组水平的突变频率,Ar为转录组水平突变频率, E为产生新生抗原的突变所在基因的表达量,H为突变导致的氨基酸改变情况,M
去除iNeo_Score为0的抗原肽,剩余的抗原肽全部作为备选抗原肽,准备进行抗原肽筛 选;
步骤三,将抗原肽按照iNeo_Score进行降序排列,然后从上至下依次进行抗原肽选取; 在选取一条抗原肽后,根据肽段信息检查毒性、活性肽、同源性这三项指标;
若抗原肽的以上三个指标有任一项不合格,则该条抗原肽直接丢弃;
若全部合格,则将该抗原肽作为选定抗原肽保留,并删除同一突变产生的其他抗原肽序 列;
步骤四,继续按照顺序向下选取下一条抗原肽,并重复以上过程,直到获取足够的候选 抗原肽或所有备选抗原肽都选取完毕为止,得到筛选后的抗原肽;
步骤五,合成多肽,采用纯化体系分段收集纯度>阈值纯度的部分,待收集足够量后,浓 缩及冷冻干燥,干燥后放置冻干品,进行纯度检测,若此肽纯度仍高于阈值纯度,则入选进 入制剂分组,若此肽纯度低于阈值纯度,则判定为不稳定肽,不进入制剂分组;
步骤六,对筛选后能进入制剂分组的抗原肽进行制剂分组;
分组要求包括:
1,对一份n条多肽进行分组,根据条数制定分组组数;
2,根据每条肽对应的HPLC保留时间,将每组分到的肽按照对应的HPLC保留时间从小 到大排序排好,每组相邻两个多肽保留时间的差值要大于单个多肽峰的最大峰宽对应的时间 差值;
3,将带半胱氨酸的多肽均匀分到每一组;
4,每条肽都有对应的凝胶色谱聚合物保留时间,要求每组分到的所有原料肽对应聚合物 凝胶色谱保留时间与所有原料肽本身凝胶色谱保留时间不重叠。
前述的一种个体化肿瘤新生抗原肽的筛选方法,变量的信息来源包括:
产生新生抗原的突变在基因组水平的突变频率Ag的信息来源为外显子组测序,
产生新生抗原的突变在转录组水平的突变频率Ar的信息来源是转录组测序,
产生新生抗原的突变所在基因的表达量E的信息来源是转录组测序,
突变导致的氨基酸改变数目H的信息来源是突变信息注释,
MHC蛋白I型和MHC蛋白II型表位序列的质量指标M
抗原肽包含活性肽的情况ACTIVE的信息来源是抗原肽信息注释,
抗原肽包含药物肽的情况DRUG的信息来源是抗原肽信息注释,
抗原肽的与人正常蛋白的同源性情况HOM的信息来源是抗原肽信息注释,
抗原肽的毒性预测结果TOXIC的信息来源是抗原肽的毒性预测分析。
前述的一种个体化肿瘤新生抗原肽的筛选方法,步骤三中,毒性、活性肽、同源性三项 指标分别是:
活性肽指标:抗原肽的氨基酸序列内包含活性肽氨基酸序列或药物肽氨基酸序列,且活 性肽氨基酸序列或药物肽氨基酸序列包含突变的氨基酸位点;
毒性指标:抗原肽毒性预测结果为有毒;
同源性指标:抗原肽与突变所在基因以外的人源蛋白质的同源性超过80%。
前述的一种个体化肿瘤新生抗原肽的筛选方法,步骤六中对一份n条多肽进行分组,根 据条数制定的分组组数的具体规则为:
设抗原肽的条数为n,
若抗原肽的条数为n>20,分组组数为n除以5的值再向上取整;
若抗原肽的条数为16<=n<=20,分组组数为4;
若抗原肽的条数为11<=n<=15,分组组数为3;
若抗原肽的条数为5<=n<=10,分组组数为2。
前述的一种个体化肿瘤新生抗原肽的筛选方法,步骤六中对筛选后的抗原肽进行制剂分 组的具体规则为:
第一步,
已知抗原肽的条数为p条,根据分组组数的分组规则,确定分组组数为g,每组条数用a
第二步,检验带半胱氨酸的多肽是否平均的分布到每组,若不满足,继续分组,若满足;
第三步,检验每条肽对应的凝胶色谱聚合物的保留时间与主肽保留时间是否重叠,不重 叠即满足要求;
若重叠,则继续分组,直到获得成功的分组;
第四步;按疫苗制剂的配方进行满足第三步制剂组溶解度复核,若可溶解,即分组成功, 若不可溶解,按第二次满足第三步制剂组分组的方法,直到溶解度复核结果为可溶解,即获 得成功分组。
前述的一种个体化肿瘤新生抗原肽的疫苗制剂,按照质量份数包括:1-3份筛选后抗原 肽,0-20份无机盐,10-100份赋形剂。
前述的一种个体化肿瘤新生抗原肽的疫苗制剂,赋形剂包括:助溶剂,填充剂,渗透压 调节剂。
前述的一种个体化肿瘤新生抗原肽的疫苗制剂,助溶剂包括:糖类或多元醇辅料。
前述的一种个体化肿瘤新生抗原肽的疫苗制剂,助溶剂为甘露醇。
前述的一种个体化肿瘤新生抗原肽的疫苗制剂,疫苗制剂为小容量注射剂;每种抗原肽 的浓度为0.1-0.5mg/ml,助溶剂浓度为0.5%-5%(w/v)。
前述的一种个体化肿瘤新生抗原肽的疫苗制剂,疫苗制剂为冻干粉针剂;冻干方法包括 如下步骤:
a,将分装有疫苗药液的瓶子摆入冻干干燥机内;
b,开启冷冻干燥机,将冷冻干燥机导热油温度调低;
c,开始抽真空;
d,当真空度达到指定要求,隔板继续升温;
e,继续调节导热油温度升温;
f,当真空度达到指定要求,隔板继续升温;
g,关闭冷冻干燥机,充入氮气,压塞,出料。
本发明的有益之处在于:
本发明将设计得到的个体化肿瘤新生抗原肽进行筛选后制备成制剂,具有优秀的抑瘤效 果;
本发明通过改进制剂的配方,针对个体化肿瘤疫苗的通用的无菌制剂制备方法,包括小 容量注射剂和冻干粉;
本发明发现甘露醇不光可作为冻干制剂的填充剂,还作为难溶性多肽的助溶剂,大大提 高了疏水性肽在水性溶剂中的溶解度。
附图说明
图1是本发明实验中C57-B16F10黑色素瘤模型治疗结果(A:黑色素瘤治疗模型肿瘤生 长曲线;B:黑色素瘤治疗模型总生存周期);
图2是本发明实验中Balb/c-CT26.wt结肠癌模型治疗结果(A:结肠癌治疗模型肿瘤生长 曲线;B:结肠癌治疗模型总生存周期);
图3是本发明实验中治疗模型中IFN-γ+细胞的各自占比;
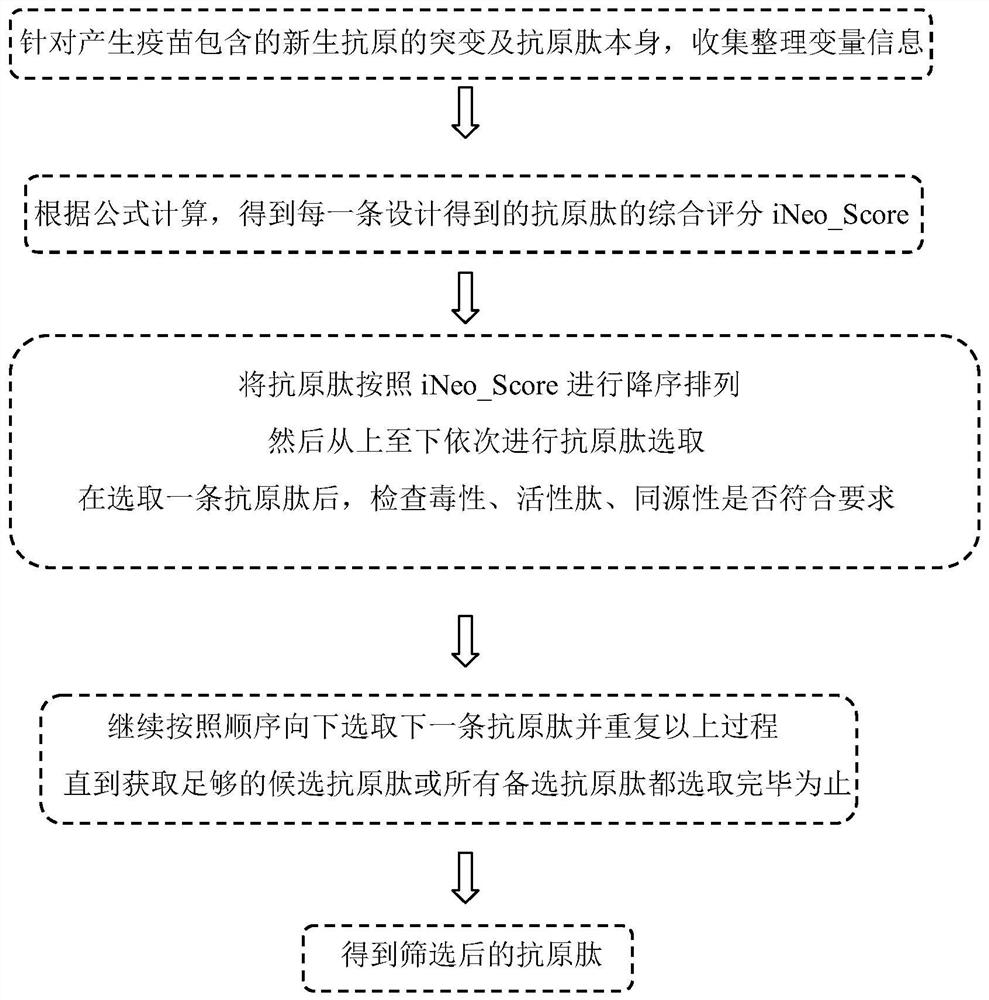
图4是本发明筛选方法的一种实施例的流程图。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
如图4所示,一种个体化肿瘤新生抗原肽的筛选方法,包括:如下步骤:
步骤一,针对产生疫苗包含的新生抗原的突变及抗原肽本身,收集整理变量信息;
表1抗原肽评分所需变量一览表
备注:呈递是表位序列和MHC蛋白形成pMHC蛋白复合物后作为一个整体呈递给免疫 细胞识别,所以需要预测表位序列和MHC蛋白的亲和力。
步骤二,根据公式计算,得到每一条设计的抗原肽的综合评分iNeo_Score。去除iNeo_Score为0的抗原肽,剩余的抗原肽全部作为备选抗原肽,准备进行抗原肽筛选;
iNeo_Score综合评分的计算公式为:
iNeo_Score=f
其中,Ag为产生新生抗原的突变在基因组水平的突变频率,Ar为转录组水平突变频率, E为产生新生抗原的突变所在基因的表达量,H为突变导致的氨基酸改变情况,M
步骤三,将抗原肽按照iNeo_Score进行降序排列,然后从上至下依次进行抗原肽选取; 在选取一条抗原肽后,根据肽段信息检查毒性、活性肽、同源性这三项指标:
活性肽指标:抗原肽的氨基酸序列内包含活性肽氨基酸序列或药物肽氨基酸序列,且活 性肽氨基酸序列或药物肽氨基酸序列包含突变的氨基酸位点;
毒性指标:抗原肽毒性预测结果为有毒;
同源性指标:抗原肽与突变所在基因以外的人源蛋白质的同源性超过80%。需要说明的 是:抗原肽是EGFR基因突变后形成的,因为突变一般是点突变,只有一个氨基酸改变.所以 这个新生抗原肽跟EGFR的野生型相似度非常高,所以抗原肽需要跟EGFR基因以外的人基 因蛋白序列同源性不能太高。
若抗原肽的以上三个指标有任一符合,则任一项不合格,则该条抗原肽直接丢弃;
若全部不符合,则合格,则将该抗原肽作为选定抗原肽保留,并删除同一突变产生的其 他抗原肽序列(可依据突变编号进行排除);
以下实际展示新生抗原抗原肽筛选过程。
如下表2中有10条备选的新生抗原肽,同时表中含有进行抗原肽筛选必须的突变及抗原 肽相关信息。
首先将该10条抗原肽按照iNeo_Score降序排列,然后从上到下依次进行选取。
表2
分数最高的肽P0001017毒性预测结果为无毒(no_toxic),且该抗原肽内无药物肽、活性 肽成分,但是该抗原肽与人正常蛋白序列的同源性最高超过80%,因此判定该抗原肽不可用, 继续向下后续抗原肽。其后的P0001016与P0001017情况一致,继续向下选取。
P0000578同时满足毒性预测无毒、抗原肽内无药物肽或活性肽成分、与人正常蛋白序列 的同源性不超过80%,因此选定P0000578后继续向下选取。
P0000771-P0000774同源性不符合要求,均跳过。
P0000526满足毒性预测无毒、抗原肽内无药物肽或活性肽成分、与人正常蛋白序列的同 源性不超过80%三项要求,因此选定P0000526,同时由于P0000526-P0000528均来自相同的 变异,因此将P0000527及P0000528剔除。
经上述筛选后,最终从10条抗原肽中筛选出下抗原肽,如下表3所示:
表3
步骤四,继续按照顺序向下选取下一条抗原肽,并重复以上过程,直到获取足够的候选 抗原肽或所有备选抗原肽都选取完毕为止,得到筛选后的抗原肽;
步骤五,合成多肽,采用纯化体系分段收集纯度>阈值纯度的部分,待收集足够量后,浓 缩及冷冻干燥,干燥后冻干品4摄氏度放置一段时间约7-14天后,进行纯度检测,若此肽纯 度仍高于阈值纯度,则入选进入制剂分组,若此肽纯度低于阈值纯度,则判定为不稳定肽, 不进入制剂分组。
作为一种优选,合成多肽采用固相合成技术生产高纯度多肽;纯化体系采用三氟乙酸纯 化体系,阈值纯度为95;分段收集纯度>95%的部分,待收集足够量后进行浓缩并冷冻干燥, 干燥后冻干品4℃放置1-2周后进行检测,若此肽纯度高于95%,则入选进入制剂分组,若 此肽纯度降低低于95%,则判定为不稳定肽,不进入制剂分组。需要说明的是:多肽的合成 方法、纯化体系的选择都不受限制,本发明采用的方法只是一种优选,只要是通过本发明的 方法筛选抗原肽的都在本发明的保护范围内。
步骤六,个体化肿瘤新生抗原多肽的分组程序设计;
对筛选后的抗原肽进行制剂分组的具体规则为:
第一步,已知抗原肽的条数为p条,根据分组组数的分组规则,确定分组组数为g,每 组条数用a
第二步,检验带半胱氨酸的多肽是否平均的分布到每组,若不满足,继续分组,若满足;
第三步,检验每条肽对应的凝胶色谱聚合物的保留时间与主肽保留时间是否重叠, 若不重叠即满足要求;
若重叠,则继续分组,直到获得成功的分组;
第四步;按疫苗制剂的配方进行满足第三步制剂组溶解度复核,若可溶解,即分组成功,若不可溶解,按第二次满足第三步制剂组分组的方法,直到溶解度复核结果为可 溶解,即获得成功分组。
举例说明:比如通过运算注册批含20条肽,分成4个组,制剂组最大可分开相邻两个多 肽保留时间为2min。假设注册批A组数据有A1,A2,A3,A4;注册批B组数据有B1,B2,B3,B4; 注册批C组数据有C1,C2,C3,C4;注册批D组数据有D1,D2,D3,D4;
成功分组后的条件,要满足保留时间差值的条件,就必须满足,A2-A1>2min,A3-A2> 2min,A4-A3>2min,B2-B1>2min,B3-B2>2min,B4-B3>2min,C2-C1>2min,C3-C2> 2min,C4-C3>2min,D2-D1>2min,D3-D2>2min,D4-D3>2min,满足带半胱氨基酸的多肽 平均的分布到每组,A、B、C、D组都含有1-2条含半胱氨酸的多肽,满足每组分到的肽的 所有聚合物保留时间与所有肽的本身保留时间不重叠,A、B、C、D组每组的聚合物保留时 间与多肽主峰不重叠,按疫苗制剂的配方进行溶解度复核,若可溶解,即分组成功,若不能 溶解,按上述方法第二次分组,直到溶解度复核结果为可溶解即已经成功分组。
目的:每一人份设计20条多肽,因多肽合成成功率的差别和工艺的要求,用于制备多肽 制剂的多肽实际条数有所不同,其分组组数和每组内的多肽数量也随之变化,分组规则随之 变化。为规范多肽制剂分组,制定多肽制剂分组规则。
分组程序设计的分组要求包括:
1、对一份n条多肽进行分组,根据条数制定分组组数,具体规则如下表4所示。
表4
2、由于每条肽都有对应的保留时间,将每组分到的肽按照对应的HPLC保留时间从小到大排序排好,每组相邻两个多肽保留时间的差值要大于单个多肽峰的最大峰宽对应的时间差值。
比如相邻两个多肽单个多肽峰的最大峰宽对应的时间差值要大于2min。假设A组数 据有A1,A2,A3,A4。
那么要满足保留时间差值的条件,就必须满足,A2-A1>2min,A3-A2>2min, A4-A3>2min,
3、带半胱氨酸的多肽均匀分到每一组。
比如有5条带半胱氨酸的多肽要分3组,那么这5条肽的分布情况只能是,1-2-2,不允许出现每组超过2条,或者有组没有分到带半胱氨酸的情况出现。
4、每条肽都有对应的凝胶色谱聚合物保留时间,要求每组分到的所有原料肽对应聚 合物凝胶色谱保留时间与所有原料肽本身凝胶色谱保留时间不重叠。
以下用实施例来举例:
具体实现我们采用了排列组合的方式来获取结果(比如15条肽分4组,那么采用C
人工复核的方法为:
将分组完成的制剂瓶组按相应的原料肽组合及辅料进行溶解度复核,若可溶解,即分组 成功,若不能溶解,按上述分组步骤进行第二次分组,直到溶解度复核结果为可溶解。
一种个体化肿瘤新生抗原肽的疫苗制剂,按照质量份数包括:1-3份筛选后抗原肽,0-20 份无机盐,10-100份赋形剂。
赋形剂包括:助溶剂,填充剂,渗透压调节剂。作为一种实施例,助溶剂包括:甘露醇, 山梨醇,蔗糖,海藻糖,木糖醇,右旋糖苷等糖类与多元醇辅料;作为一种优选,助溶剂为 甘露醇。作为一种实施例,填充剂包括:蔗糖,乳糖;渗透压调节剂为氯化钠。需要说明的是,本发明中包括的含义为其中一个或多个的混合。
作为一种实施例,疫苗制剂为小容量注射剂;每种抗原肽的浓度为0.1-0.5mg/ml,助溶 剂浓度为0.5%-5%(w/v)。更优选地,每种抗原肽的浓度为0.2-0.4mg/ml,助溶剂浓度为1%-3% (w/v)。
作为一种实施例,疫苗制剂为冻干粉针剂;冻干方法包括如下步骤:
a,将分装多肽组药液的瓶子摆入冻干干燥机内;
b,开启冷冻干燥机,将冷冻干燥机导热油温度调低;
c,开始抽真空;
d,当真空度达到指定要求,隔板继续升温;
e,继续调节导热油温度升温;
f,当真空度达到指定要求,隔板继续升温;
g,关闭冷冻干燥机,充入氮气,压塞,出料。
冻干粉剂中,可用灭菌注射用水、0.9%氯化钠溶液或5%葡萄糖溶液、林格氏液、乳酸 林格氏液等配制后再施用于患者。
实施例1:分组后的多肽肿瘤疫苗的制备工艺(小容量注射剂)
用注射用水配制含1%(W/V)甘露醇及0.12mmol氯化钠的溶液,称取处方量的一组(5 条)个体化抗原肽,加入后搅拌溶解,经0.22μm的PVDF滤膜无菌过滤,弃去适量初滤液,收集续滤液。按照1.0ml/瓶分装于中硼硅玻璃管制瓶中,加塞,轧盖,目检,贴签,包装。 冻干品于-20℃±5℃条件下保存。个体化设计的其他几组抗原肽以同样方法进行制备。
实施例2:分组后的多肽肿瘤疫苗的制备工艺(冻干粉针剂)
用注射用水配制含2%(W/V)甘露醇及5%蔗糖(W/V)的溶液,称取处方量的一组(4条)个体化抗原肽,加入后搅拌溶解,经0.22μm的PVDF滤膜无菌过滤,弃去适量初滤液, 收集续滤液。按照1.0ml/瓶分装于中硼硅玻璃管制瓶中,半加塞,置已预冷至约10度的冻干箱中,启动冷冻干燥。
冷冻干燥:1)预冻:板层在1小时内降至-45℃;-45℃维持5小时。2)一次干燥:控制真空度为0.2mbar以下,用6小时升温至-30℃,-30℃维持4小时;控制真空度为0.1mbar以下,用6-14小时升温至-20℃,-20℃维持2小时;用5小时升温至0℃,0℃维持1小时。 3)二次干燥:控制真空度为0.05mbar以下,用4小时升温至30℃;30℃维持6小时。冻干 结束,充入氮气,压塞,轧盖,目检,贴签,包装。冻干品于5℃±3℃条件下保存。
个体化设计的其他几组抗原肽以同样方法进行制备。
实验一:多肽肿瘤疫苗(粉针)的初步稳定性;
将10种原料肽按照分组原则分成两个制剂组(各含5条肽),如实施例2制备得到两批 冻干品,所制得的冻干品外形均饱满疏松。将两批冻干制剂分别置于-20℃、2-8℃冰箱及25℃ /RH60%长期稳定性考察箱中30天,看各肽纯度%(面积归一化法)、总杂变化情况及用灭菌 注射用水复溶后溶液情况。具体如下表5、6所示。
表5
表6
上述初步稳定性结果显示,在不同储存条件下放置30天,两组多肽制剂组的总杂无明显 增加,复溶后溶液仍澄清,说明多肽冻干制剂的稳定性较好。
实验二:经过筛选后的多肽肿瘤疫苗(冻干粉针剂)具有优秀的抑瘤效果的验证实验:
1、C57-B16F10黑色素瘤模型验证:
1)鼠源肿瘤模型构建——C57-B16F10黑色素瘤模型;
选择C57BL/6小鼠,由上海斯莱克采购,雌性,6~8周。接种B16-F10鼠源黑色素瘤肿 瘤细胞。肿瘤细胞接种前计数,保证细胞活率95%以上。将收获的B16-F10黑色素瘤细胞按 细胞量为5×10
2)抑瘤效果评估
a.肿瘤模型分组;
小鼠成瘤后的2天,选取50-60只肿瘤体积相近且平均肿瘤直径约为0.3厘米的小鼠入组, 随机分为四组,每组至少10只,分别是阴性对照生理盐水组、空白对照辅料组、佐剂组、 iNeo-P01组
b.肿瘤模型给药;
iNeo-P01组给药:
临用前将iNeo-P01制剂瓶4瓶分别用加入300uL注射用水溶解,含量为1mg/ml,
当C57BL/6小鼠肿瘤瘤体长至50mm
将肿瘤疫苗制剂瓶分别皮下注射于小鼠的四肢四个部位,每次多肽注射与佐剂GM-CSF 混合注射,GM-CSF注射量为2μg/注射点,共4个注射点,共8ug。每个部位接种100μl疫 苗。
阴性对照生理盐水组,空白对照辅料组、佐剂组给药:
方法与iNeo-P01给药方法大体一致,将分别将生理盐水、辅料组(1%甘露醇)、佐剂组 (2μg/注射点GM-CSF)分别皮下注射于小鼠的四肢四个部位,每个部位接种100μl体积。
c.取样检测及指标评估:
末次给药后2周收获小鼠脾脏细胞、引流淋巴结细胞以及肿瘤细胞用于检测机体各项免 疫指标。
记录并对比实验组和对照组中以及对比不同肿瘤模型组别中所有小鼠的生存周期,具体 需要对比的参数包括但不仅限于:总生存期(OS)、肿瘤抑制率、CD4+IFN-λ+细胞占比、 CD8+IFN-λ+细胞占比等。
结果如图1:C57-B16F10黑色素瘤模型治疗结果,图3:治疗模型中IFN-γ+细胞的各 自占比。
结果分析:通过对比阴性对照生理盐水组,空白对照辅料组、佐剂组、iNeo-P01组的各 项结果,证明iNeo-P01组有良好抑瘤效果。
2、Balb/c-CT26结肠癌模型验证:
1)鼠源肿瘤模型构建——Balb/c-CT26结肠癌模型;
选择Balb/c小鼠,由上海斯莱克采购,雌性,6~8周。接种CT26鼠源结肠癌肿瘤细胞。 肿瘤细胞接种前计数,保证细胞活率95%以上。将收获的细胞按细胞量为5×10
2)抑瘤效果评估
a.肿瘤模型分组;
小鼠成瘤后的2天,选取50-60只肿瘤体积相近且平均肿瘤直径约为0.3厘米的小鼠入组, 随机分为四组,每组至少10只,分别是阴性对照生理盐水组、空白对照辅料组、佐剂组、 iNeo-P01组
b.肿瘤模型给药;
iNeo-P01组给药:
临用前将iNeo-P01制剂瓶4瓶分别用加入300ul注射用水溶解,含量为1mg/ml,
当Balb/c小鼠肿瘤瘤体长至50mm
将肿瘤疫苗制剂瓶分别皮下注射于小鼠的四肢四个部位,每次多肽注射与佐剂GM-CSF 混合注射,GM-CSF注射量为2μg/注射点,共4个注射点,共8ug。每个部位接种100μl疫 苗。
阴性对照生理盐水组,空白对照辅料组、佐剂组给药:
方法与iNeo-P01给药方法大体一致,将分别将生理盐水、辅料组(1%甘露醇)、佐剂组 (2μg/注射点GM-CSF)分别皮下注射于小鼠的四肢四个部位,每个部位接种100μl体积。
c.取样检测及指标评估:
末次给药后1周收获小鼠脾脏细胞、引流淋巴结细胞以及肿瘤细胞用于检测机体各项免 疫指标。
记录并对比实验组和对照组中以及对比不同肿瘤模型组别中所有小鼠的生存周期,具体 需要对比的参数包括但不仅限于:总生存期(OS)、肿瘤抑制率、CD4+IFN-λ+细胞占比、 CD8+IFN-λ+细胞占比等。
结果如图2:Balb/c-CT26.wt结肠癌模型治疗结果(A:结肠癌治疗模型肿瘤生长曲线;B: 结肠癌治疗模型总生存周期),图3::治疗模型中IFN-γ+细胞的各自占比所示。
结果分析:通过对比阴性对照生理盐水组,空白对照辅料组、佐剂组、iNeo-P01组的各 项结果,证明iNeo-P01组有良好抑瘤效果。
实验三,甘露醇对个体化肿瘤新生抗原肽的助溶作用;
甘露醇是一种常用的冷冻干燥制剂辅料(骨架形成剂),作为载体用于形成硬质的均匀骨 架,以改善玻璃瓶中冷冻干燥制剂的外观;且甘露醇不与多肽中残留氨基呈Maillard反应, 是惰性的辅料,可用于皮下注射途径。甘露醇分子中的羟基可与肽键中的羰基形成氢键,这 种氢键并不能直接促进多肽的溶解,但可以促进胶束的形成;所以甘露醇的助溶作用,主要 还是形成胶束后的增溶作用。
同一多肽在水中及在不同浓度甘露醇溶液中的溶解度对比试验结果如下表7:
表7
可见,通过个体化设计得到的肿瘤新生抗原肽(不同氨基酸序列),在甘露醇溶液中的溶 解度比注射用水中提高了3倍以上;特别对于在水中不溶(溶解度低于0.1mg/mL)的多肽, 用1%-2%甘露醇溶液来配制,可使其溶解度提高10倍多,完全满足制剂生产的原料肽溶解 度要求,并通过简单稳定的制剂工艺,使包含这些肿瘤新生抗原肽的疫苗制剂应用于临床变 成可能。
综上以上实验可知:本发明将设计得到的个体化肿瘤新生抗原肽进行筛选后制备成制剂, 具有优秀的抑瘤效果;本发明发现甘露醇不光可作为冻干制剂的填充剂,还作为难溶性多肽 的助溶剂,大大提高了疏水性肽在水性溶剂中的溶解度。
以上显示和描述了本发明的基本原理、主要特征和优点。本行业的技术人员应该了解, 上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案, 均落在本发明的保护范围内。
- 一种个体化肿瘤新生抗原肽的筛选方法及其疫苗制剂
- 一种肿瘤个体化疫苗的有效新抗原肽的快速筛选方法
