胰岛素产生细胞的制造方法和组合物
文献发布时间:2023-06-19 11:35:49
技术领域
(关连申请的相互参照)
此申请是主张于2018年11月14日向日本专利厅申请的日本申请编号第2018-213449号的优先权的申请。该日本申请,其全部申请文件(说明书、权利要求的范围、附图、摘要)以明示的形式,作为本说明书全部的目的参照而引用于本说明书。
本发明属于再生医疗的技术领域。本发明涉及:在该技术领域中,通过低分子化合物从体细胞直接制造胰岛素产生细胞的方法,以及涉及的制造方法所制造的低分子化合物诱导性胰岛素产生细胞(ciIPCs:chemical compound-induced Insulin-producingcells)。本发明进一步涉及可用于制造该胰岛素产生细胞的方法的诱导用培养基组合物。
背景技术
近年,对于不进行基因导入,而通过低分子化合物将成纤维细胞这样的体细胞直接转换为其他的细胞的方法(直接重编程:Direct Reprogramming)进行的研究正广泛地展开。例如,在专利文献1中,将ALK5抑制剂、ALK6抑制剂等几种低分子化合物组合,并在其存在下培养体细胞,特别是人类成纤维细胞,其后将该细胞直接诱导为褐色脂肪细胞、成骨细胞、软骨细胞、神经系统细胞或心肌细胞。如专利文献1的发明,如果能将常见的成纤维细胞,通过容易获得的低分子化合物直接诱导为褐色脂肪细胞等的细胞,这是非常有益的。例如,由于能从自身的成纤维细胞简便地制作自身的其他细胞,因此其在再生医疗方面的应用能够扩大。另外,也能够容易地制作作为用于新医药品开发的实验材料的细胞。
关于分泌胰岛素的胰脏β细胞,除了从iPS细胞或ES细胞分化诱导为人类胰腺β细胞的报道之外,也有从胰腺α细胞、胰腺腺泡细胞、胰腺导管腺细胞、小肠隐窝细胞、肝细胞、胆管细胞之类的内胚叶类细胞,使用胰腺β细胞特异性转录因子Pdx1、Ngn3以及MafA,直接诱导为胰腺β细胞的报道(非专利文献1)。另外,还有从小鼠胚胎成纤维细胞(MEFs)或人类皮肤成纤维细胞,使用山中4因子等,直接诱导为胰腺β细胞的报道(非专利文献2、3)。甚至还有从小鼠胚胎成纤维细胞(MEFs),通过低分子化合物,制作内胚叶祖细胞,再从该细胞分化为胰脏内分泌细胞的报告(非专利文献4)。
如上所述的从体细胞向胰腺β细胞等的分化诱导,必定是通过在含有其他各种各样的化合物或营养素等的培养基中培养而进行。作为该培养基,例如,可以举出一般的培养基MEM(最小必需培养基)、DMEM(Dulbecco's Mod ified Eagle Medium)、DMEM/F12或对它们进行了调整的培养基,这些都有市售。并且,通常这些培养基,在考虑要诱导的细胞后,适当地添加适宜的成分(血清、蛋白质、氨基酸、糖类、维生素类、脂肪酸类、抗生物质等)而进行细胞的分化诱导。
现有技术文献
专利文献
[专利文献1]国际公开第2018/062269号
非专利文献
[非专利文献1]Current Pathobiology Reports,2016年,3卷,57-65页
[非专利文献2]Cell Stem Cell,2014年,14卷,228-236页
[非专利文献3]Nature Communications,2016年,7卷,10080页
[非专利文献4]Journal of Biological Chemistry,2017年,292卷,19122-19132页
发明内容
本发明所要解决的技术问题
细胞的分化诱导中的问题之一是,即使可顺利地分化诱导为期望的细胞,要达成可堪实用程度的充分的量的分化诱导非常困难。此问题在诱导胰岛素产生细胞时也是同样。
本发明以提供一种能够不进行人为的基因导入,而通过低分子化合物高效地进行从体细胞向胰岛素产生细胞的直接转换或诱导的、新的制造方法为主要课题。
解决技术问题的技术手段
本发明者们经过锐意探讨的结果,发现,在从体细胞向胰岛素产生细胞的直接诱导中,通常,通过除去培养基中添加的牛胚胎血清(FBS)进行培养,或通过添加比通常更多的胰岛素进行培养来解决所述课题,以此完成了本发明。
作为本发明,例如,可以举出下述项:
[1]一种胰岛素产生细胞的制造方法,其是通过从体细胞直接分化诱导而制造胰岛素产生细胞的方法,其中,所述方法包含:
以无血清的分化诱导用培养基培养体细胞的工序。
[2]一种胰岛素产生细胞的制造方法,其是通过从体细胞直接分化诱导而制造胰岛素产生细胞的方法,其中,所述方法包含:
使分化诱导用培养基中含有5μg/mL以上的胰岛素而培养体细胞的工序。
[3]一种胰岛素产生细胞的制造方法,其是通过从体细胞直接分化诱导而制造胰岛素产生细胞的方法,其中,所述方法包含:
使用无血清的分化诱导用培养基,且使分化诱导用培养基中含有5μg/mL以上的胰岛素而培养体细胞的工序。
[4]、项[1]~[3]中任一项所述的胰岛素产生细胞的制造方法,其中,
所述工序是在RSK抑制剂的存在下培养体细胞的工序。
[5]、项[4]所述的胰岛素产生细胞的制造方法,其中,
所述工序是,进一步在GSK3抑制剂和/或cAMP诱导体的存在下培养体细胞的工序。
[6]、项[4]或[5]所述的胰岛素产生细胞的制造方法,其中,
RSK抑制剂为BRD7389或BI-D1870。
[7]、项[5]或[6]所述的胰岛素产生细胞的制造方法,其中,
GSK3抑制剂为CHIR99021或者cAMP诱导剂为毛喉素。
[8]、项[1]~[7]中任一项所述的胰岛素产生细胞的制造方法,其中,
所述体细胞为成纤维细胞或间叶系干细胞。
[9]一种胰岛素产生细胞,其由项[1]~[8]中任一项所述的胰岛素产生细胞的制造方法所制造。
[10]、一种分化诱导用组合物,其是用于通过从体细胞直接分化诱导而制造胰岛素产生细胞的组合物,其中,所述组合物是无血清的。
[11]、一种分化诱导用组合物,其是用于通过从体细胞直接分化诱导而制造胰岛素产生细胞的组合物,其中,所述组合物含有5μg/mL以上的胰岛素。
[12]、一种分化诱导用组合物,其是用于通过从体细胞直接分化诱导而制造胰岛素产生细胞的组合物,其中,所述组合物是无血清的,且含有5μg/mL以上的胰岛素。
[13]、项[10]~[12]中任一项所述的分化诱导用组合物,其含有RSK抑制剂。
[14]、项[13]所述的分化诱导用组合物,其进一步含有GSK3抑制剂和/或cAMP诱导体。
[15]、项[13]或[14]所述的分化诱导用组合物,其中,
RSK抑制剂为BRD7389或BI-D1870。
[16]、项[14]或[15]所述的分化诱导用组合物,其中,
GSK3抑制剂为CHIR99021或者cAMP诱导剂为毛喉素。
[17]、项[10]~[16]中任一项所述的分化诱导用组合物,其中,
所述体细胞为成纤维细胞或间叶系干细胞。
发明的效果
根据本发明,能够不进行人为的基因导入,而高效地进行从体细胞向胰岛素分泌能力高的胰岛素产生细胞的直接转换或诱导。通过本发明得到的胰岛素产生细胞,在再生医疗等中是有用的。
附图说明
[图1]表示在含有或除去牛胚胎血清(FBS)的条件下,从人类成纤维细胞直接分化诱导而得的胰岛素产生细胞分泌的胰岛素量。纵轴表示细胞的总蛋白质每1mg的胰岛素分泌量(μU/mg)。各实验结果中,左柱表示含有牛胚胎血清(FBS)时的结果,右柱表示不含有牛胚胎血清(FBS)时的结果。
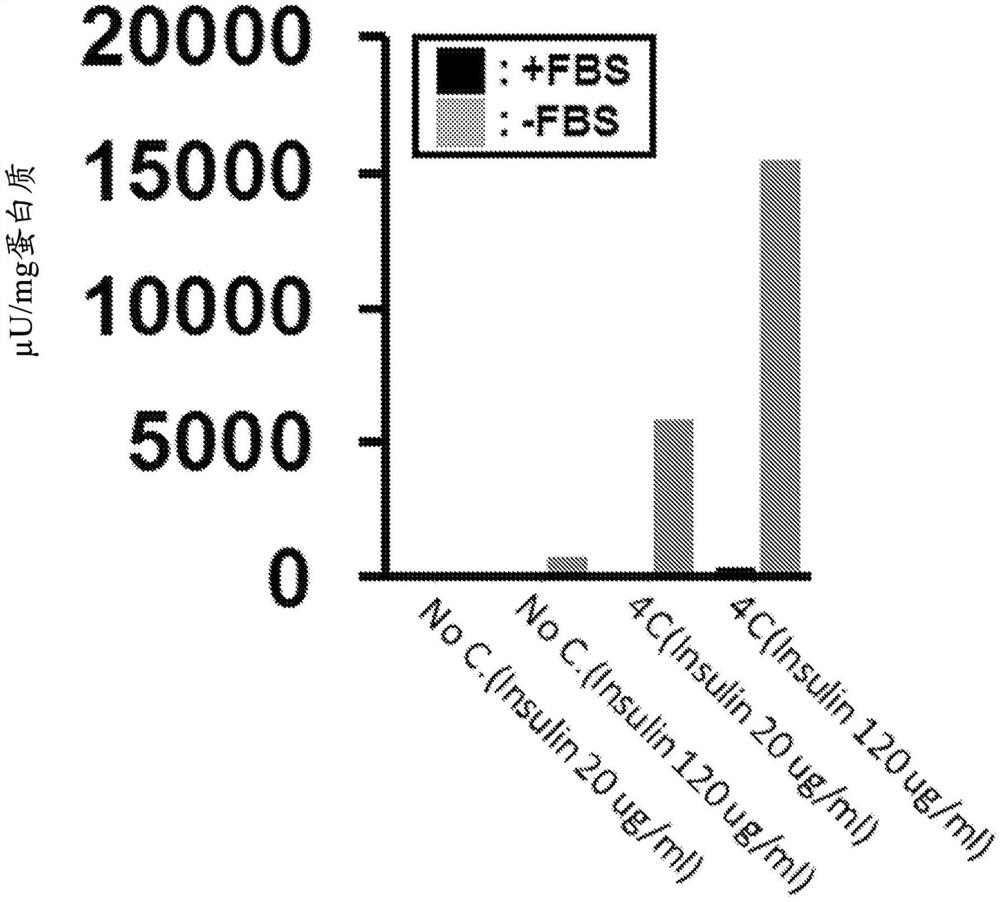
[图2]表示在含有胰岛素20μg/mL或120μg/mL的条件下,从人类成纤维细胞直接分化诱导而得的胰岛素产生细胞分泌的胰岛素量。纵轴表示细胞的总蛋白质每1mg的胰岛素分泌量(μU/mg)。各实验结果中,左柱表示含有胰岛素20μg/mL时的结果,右柱表示含有胰岛素120μg/mL时的结果。
[图3]表示从人类成纤维细胞直接分化诱导而得的胰岛素产生细胞分泌的胰岛素量。纵轴表示细胞的总蛋白质每1mg的胰岛素分泌量(μU/mg)。
[图4]表示从人类成纤维细胞直接分化诱导而得的胰岛素产生细胞分泌的胰岛素量。纵轴表示细胞的总蛋白质每1mg的胰岛素分泌量(μU/mg)。
[图5]表示从人类脂肪组织来源的间叶系干细胞(AdMSC)直接分化诱导而得的胰岛素产生细胞分泌的胰岛素量。纵轴表示细胞的总蛋白质每1mg的胰岛素分泌量(μU/mg)。
本发明的具体实施方式
以下,对本发明进行详细说明。
1胰岛素产生细胞的制造方法
本发明涉及的胰岛素产生细胞的制造方法(以下,称为“本发明的制造法。”),是通过从体细胞直接分化诱导而制造胰岛素产生细胞的方法,其特征在于包含以无血清的分化诱导用培养基培养体细胞的工序。或是通过从体细胞直接分化诱导而制造胰岛素产生细胞的方法,其特征在于包含使分化诱导用培养基中含有5μg/mL以上的胰岛素而培养体细胞的工序。
如上所述,本发明的要旨之一是,在实质上不含牛胚胎血清(FBS)这样的血清的无血清的分化诱导用培养基中培养体细胞,从而制造胰岛素产生细胞。另外,作为本发明的要旨,可以举出:使分化诱导用培养基含有5μg/mL以上的较多的胰岛素,进而制造胰岛素产生细胞。
这里的“无血清”是指,实质上不含有无调整或未纯化的血清,在本发明中,即使分化诱导用培养基中混入了经过纯化的血液来源的成分、动物组织来源的成分,只要实质上不含有无调整或未纯化的血清,就可以称为无血清的分化诱导用培养基。
在所述中,优选包含下述工序的本发明制造法:使用无血清的分化诱导用培养基并且含有5μg/mL以上的胰岛素而培养体细胞的工序。
另外,所述工序优选是在RSK抑制剂的存在下培养体细胞的工序。更优选所述工序是除RSK抑制剂之外,进一步在GSK3抑制剂和/或cAMP诱导体的存在下培养体细胞的工序。特别是,所述工序优选是在RSK抑制剂以及GSK3抑制剂的存在下或在RSK抑制剂、GSK3抑制剂以及cAMP诱导体的存在下培养体细胞的工序。所述工序可以是根据需要,进一步在PI3K抑制剂等任意其他抑制剂、诱导剂等的存在下培养体细胞的工序。
所述抑制剂、诱导剂可以使用1种或组合使用两种以上。
具体而言,在所述抑制剂等中,有些有可能具有2种以上的抑制作用等,此时,可以将这1种的存在视为多种抑制剂等的存在。
1.1关于体细胞
生物细胞可以分类为体细胞和生殖细胞。在本发明的制造法中,作为其出发材料,可以使用任意的体细胞。体细胞没有特别限制,可以是从活体中采集的初代细胞或细胞株化的细胞。在本发明的制造法中,可以使用处于分化的各种阶段的体细胞,例如,最终分化的体细胞(例如,成纤维细胞、脐带静脉内皮细胞(HUVEC)、肝细胞(Hepatocytes),胆管细胞(Biliary cells)、胰腺α细胞(Pancreaticαcells)、胰腺腺泡细胞(Acinar cells)、胰腺导管腺细胞(Ductal cells)、小肠隐窝细胞(Intestinal crypt cells)等),处于向最终分化过程中的体细胞(例如,间叶系干细胞、神经干细胞、内胚叶祖细胞等)或被初始化而获得了多能性的体细胞。作为本发明的制造法可以使用体细胞,可以举出任意的体细胞,例如,造血类的细胞(各种淋巴球、巨噬细胞、树状细胞、骨髓细胞等)、脏器来源的细胞(肝细胞、脾细胞、胰腺细胞、肾细胞、肺细胞等)、肌肉组织类的细胞(骨格肌肉细胞、平滑肌肉细胞、肌肉芽细胞、心肌细胞等)、成纤维细胞、神经细胞、成骨细胞、软骨细胞、内皮细胞、间质细胞、脂肪细胞(白色脂肪细胞等)、胚性干细胞(ES细胞)等。另外,这些细胞的祖细胞、癌细胞也能适用于本发明的制造法。可以优选使用成纤维细胞或间叶系干细胞。
作为本发明可以使用的成纤维细胞,没有特别限制,例如,可以举出皮肤成纤维细胞(Dermal Fibroblasts)、大动脉外膜成纤维细胞(Adventitial Fibroblasts)、心脏成纤维细胞(Cardiac Fibroblasts)、肺成纤维细胞(Pulmonary Fibroblasts)、子宫成纤维细胞(Uterine Fibroblasts)、绒毛间叶系成纤维细胞(Villous Mesenchymal Fibroblasts)等的作为在各种组织或器官中构成结缔组织的主要细胞成分并且进行胶原纤维生产的细胞。
作为本发明可以使用的间叶系干细胞,没有特别限制,例如,可以举出脂肪组织来源的间叶系干细胞(Adipose tissue-derived mesenchymal stem cells)、骨髓来源的间叶系干细胞(Bone marrow-derived mesenchymal stem cells)、脐带来源的间叶系干细胞(Umbilical cord-derived mesenchymal stem cells)、脐带血来源的间叶系干细胞(Umbilical cord blood-derived mesenchymal stemcells)、齿髓组织来源的间叶系干细胞(Dental pulp-derived mesenchymal stem cells)、胎盘来源的间叶系干细胞(Placenta-derived mesenchymal stem cells)、羊膜来源的间叶系干细胞(Amnioticmembrane-derived mesenchymal stemcells)、子宫内膜来源的间叶系干细胞(Endometrium-derived mesenchymal stem cells)、滑膜来源的间叶系干细胞(Synovium-derived mesenchymal stem cells)、真皮组织来源的间叶系干细胞、齿周韧带来源的间叶系干细胞。
作为所述的体细胞的供给源,可以举出人类、人类以外的哺乳动物以及哺乳动物以外的动物(鸟类、爬虫类、两栖类、鱼类等),但不限于此。作为体细胞的供给源,优选人类以及人类以外的哺乳动物,特别优选人类。以向人类给药为目的而通过本发明的制造法制造胰岛素产生细胞时,可以优选使用从和接受者的组织适合性抗原的类型一致或类似的捐献者处采集的体细胞。也可以将从接受者自身处采集的体细胞用于胰岛素产生细胞的制造。
1.2体细胞的培养
本发明的制造法中的体细胞的培养,除了分化诱导用培养基中不含有牛胚胎血清(FBS)这样的血清而进行,和/或含有5μg/mL以上的胰岛素而进行之外,可以通过常规方法进行。并且,可以根据使用的体细胞的种类而选择培养基、温度、其他的条件,在所述的各种抑制剂(在某些情况下是诱导剂或活化剂)的存在下实施。
在本发明的制造法中,通过在包含所述的各种抑制剂等的分化诱导用培养基中培养体细胞,能够以一个阶段的培养从体细胞制造胰岛素产生细胞。
另外,作为使用的体细胞,通过选择容易培养的细胞,可以将一开始就增加了细胞数的、几乎达到汇合状态的体细胞转换为胰岛素产生细胞。因此,也能够容易进行大规模的胰岛素产生细胞的制造。
实施本发明时作为基础的分化诱导用培养基或用于体细胞的传代培养的培养基,可以从公知的培养基或市售的培养基中选择。例如,可以向作为一般的培养基的MEM(最小必需培养基)、DMEM(Dulbecco’s Modified Eagle Medium)、DMEM/F12或对它们进行了调整的培养基中,添加适宜的成分(血清、蛋白质、氨基酸、糖类、维生素类、脂肪酸类、抗生物质等)而进行使用。
本发明的制造法的一种实施方式中,使分化诱导用培养基中含有的5μg/mL以上的胰岛素,但优选为20μg/mL以上或25μg/mL以上,更优选为80~120μg/mL的范围内。
作为基础的公知或市售的诱导用培养基中预先含有一定的胰岛素时,可以添加胰岛素以将胰岛素的含量调整到所述的量。
作为培养条件,可以选择一般的细胞培养的条件。例如37℃、5%CO
体细胞的培养,可以使用培养板、培养皿、细胞培养用烧瓶、细胞培养用袋等的细胞培养容器。需要说明的是,作为细胞培养用袋,优选具有透气性。需要大量的细胞时,可以使用大型培养槽。培养可以以开放型培养或封闭型培养实施,以将得到的胰岛素产生细胞向人类给药等为目的时,优选封闭型培养。
1.3关于可用于本发明的抑制剂等
1.3.1RSK抑制剂
核糖体S6蛋白激酶(Ribosomal S6 Protein Kinase,RSK)在细胞内广泛地表达,是应答各种各样的生长因子的丝氨酸/苏氨酸激酶之一。分为分子量为70kDa和90kDa的亚家族,特别是90kDa的RSK亚家族,通过被属于MAP K信号传达通路的ERK磷酸化而活化,在哺乳类中存在4个基因。活化了的90kDa的RSK,对包括核糖体蛋白S6(Ribosomal protein S6)的下游的各种蛋白质进行磷酸化,对细胞的生存、细胞增殖、分化等进行多样的控制。
“RSK抑制剂的存在下”是指在能够抑制RSK的培养条件下,其手段没有特别限定,可以利用抑制RSK活性的物质,例如,可以利用抗RSK抗体或RSK抑制剂这样的RSK信号抑制手段。另外,由于RSK在自身的特定部位被磷酸化时活化,因此抑制所述的磷酸化的手段也可以用于RSK信号的抑制。
作为RSK抑制剂,在本发明中没有特别限制,例如,可以使用以下的化合物。可以优选使用BRD7389或BI-D1870。
BRD7389(CAS No.:376382-11-5)
[化学式1]
SL 0101-1(CAS No.:77307-50-7)
BI-D1870(CAS No.:501437-28-1)
LJH685(CAS No.:1627710-50-2)
LJI308(CAS No.:1627709-94-7)
FMK(CAS No.:821794-92-7)
RMM46(CAS No.:1307896-46-3)
CMK(CAS No.:821794-90-5)
Carnosol(CAS No.:5957-80-2)
Bix 02565(CAS No.:1311367-27-7)
RSK抑制剂的浓度根据使用的体细胞等而不同,没有特别限制,适宜决定即可,例如可以在0.05μmol/L~50μmol/L,优选在0.1μmol/L~20μmol/L的范围内使用。
1.3.2 GSK3抑制剂
GSK3(glycogen synthase kinase-3,糖原合成酶激酶3)作为将糖原合成酶磷酸化使之失活的蛋白激酶而被发现。在哺乳类中,GSK3被分类为51kDa的α(GSK3α)和47kDa的β(GSK3β)二个同源异构体。GSK3具有将各种蛋白质磷酸化的活性,不仅参与糖原代谢,也参与细胞分裂、细胞增殖等的生理现象。
“GSK3抑制剂的存在下”是指在能够抑制GSK3的培养条件下,其手段没有特别限定,可以利用抑制GSK3的活性的物质,例如,抗GSK3抗体或GS K3抑制剂这样的GSK3信号抑制手段。另外,由于GSK3在自身的特定部位被磷酸化时失去活性,因此促进所述的磷酸化的手段,也可用于GSK3信号的抑制。
在本发明中没有特别限制,但作为GSK3抑制剂,例如,可以使用以下的化合物。优选可以使用CHIR99021。
CHIR99021(CAS No.:252917-06-9)
[化学式2]
BIO((2’Z,3’E)-6-溴靛玉红-3’-肟)(CAS No.:667463-62-9)
Kenpaullone(CAS No.:142273-20-9)
A1070722(CAS No.:1384424-80-9)
SB216763(CAS No.:280744-09-4)
CHIR98014(CAS No.:556813-39-9)
TWS119(CAS No.:601514-19-6)
Tideglusib(CAS No.:865854-05-3)
SB415286(CAS No.:264218-23-7)
Bikinin(CAS No.:188011-69-0)
IM-12(CAS No.:1129669-05-1)
1-Azakenpaullone(CAS No.:676596-65-9)
LY2090314(CAS No.:603288-22-8)
AZD1080(CAS No.:612487-72-6)
AZD2858(CAS No.:486424-20-8)
AR-A014418(CAS No.:487021-52-3)
TDZD-8(CAS No.:327036-89-5)
靛玉红(CAS No.:479-41-4)
GSK3抑制剂的浓度,根据使用的体细胞等而不同,没有特别限制,适宜决定即可,例如可以在0.05μmol/L~20μmol/L,优选在0.1μmol/L~10μmol/L的范围内使用。
1.3.3 cAMP诱导剂
cAMP(环状单磷酸腺苷)是作为第二信使,参与各种细胞内信号传达的物质。cAMP在细胞内通过腺苷酸环化酶(adenylate cyclase)环化三磷酸腺苷(ATP)而生成。
“cAMP诱导剂的存在下”是指,在能够诱导cAMP的培养条件下,其手段没有特别限定,例如,可以利用能够增加细胞内cAMP浓度的任意手段。能够直接作用于作为参与cAMP的生成的酶的腺苷酸环化酶进行诱导的物质,能够促进腺苷酸环化酶的表达的物质,其他还有抑制作为分解cAMP的酶的磷酸二酯酶的物质等,都可以作为增加细胞内cAMP浓度手段使用。也可以使用在细胞内与cAMP具有相同的作用,作为cAMP的结构类似物的二丁酰cAMP(dibutyryl cAMP)。
在本发明中虽然没有特别限制,但作为cAMP诱导剂(腺苷酸环化酶活化剂),例如,可以举出毛喉素(forskolin:CAS No.:66575-29-9)以及毛喉素衍生物(例如日本特开2002-348243号公报)或以下的化合物等。优选可以使用毛喉素。
毛喉素(CAS No.:66428-89-5)
[化学式3]
异丙肾上腺素(CAS No.:7683-59-2)
NKH477(CAS No.:138605-00-2)
PACAP1-27(CAS No.:127317-03-7)
PACAP1-38(CAS No.:137061-48-4)
cAMP诱导剂的浓度,根据使用的体细胞等而不同,没有特别限制,适宜决定即可,例如可以在0.2μmol/L~50μmol/L,优选在1μmol/L~30μmol/L的范围内使用。
1.3.4PI3K抑制剂
磷酸肌醇3-激酶(Phosphoinositide 3-kinase,PI3K)是对肌醇磷脂进行磷酸化的酶,产生的磷酸肌醇使PDK1活化。PDK1进一步使AKT磷酸化,而使得PDK1/AKT信号通路活化。LY294002是PI3K选择性的抑制剂,通过抑制磷酸肌醇的产生而抑制PDK1/AKT信号通路的活化。
“PI3K抑制剂的存在下”是指在能够抑制PI3K的培养条件下,其手段没有特别限定,可以利用能够抑制PI3K的任意手段。本发明中可以利用直接作用于PI3K而抑制其功能的物质(例如,抗PI3K抗体、其他的药剂)、抑制PI3K自身的产生的药剂等。另外,通过在PI3K参与的信号传达的上游进行抑制也能够抑制PI3K。
在本发明中虽然没有特别限制,但作为PI3K抑制剂,例如,可以使用以下的化合物。优选可以使用LY294002。
LY294002(CAS No.:154447-36-6)
[化学式4]
Buparlisib(CAS No.:944396-07-0)
TGR-1202(CAS No.:1532533-67-7)
PI-103(CAS No.:371935-74-9)
IC-87114(CAS No.:371242-69-2)
渥曼青霉素(CAS No.:19545-26-7)
ZSTK474(CAS No.:475110-96-4)
AS-605240(CAS No.:648450-29-7)
PIK-90(CAS No.:677338-12-4)
AZD6482(CAS No.:1173900-33-8)
Duvelisib(CAS No.:1201438-56-3)
TG100-115(CAS No.:677297-51-7)
CH5132799(CAS No.:1007207-67-1)
CAY10505(CAS No.:1218777-13-9)
PIK-293(CAS No.:900185-01-5)
CZC24832(CAS No.:1159824-67-5)
Pilaralisib(CAS No.:934526-89-3)
AZD8835(CAS No.:1620576-64-8)
PI3K抑制剂的浓度,根据使用的体细胞等而不同,没有特别限制,适宜决定即可,例如可以在0.1μmol/L~20μmol/L,优选在0.5μmol/L~10μmol/L的范围内使用。
1.4胰岛素产生细胞
通过所述的本发明的制造法,能够得到含有胰岛素产生细胞的细胞集团。通过本发明的制造法制造的胰岛素产生细胞也在本发明的范围内。以本发明的制造法制造的胰岛素产生细胞,除了最终分化的细胞之外,也可以是注定分化为胰岛素产生细胞的祖细胞。
通过本发明的制造法制造的胰岛素产生细胞,是通过低分子化合物从体细胞直接分化诱导的,也就是所谓的低分子化合物诱导性胰岛素产生细胞(ciIPCs),与通过基因导入分化诱导的细胞有所区别。
以本发明的制造法制造的胰岛素产生细胞,举例而言,可以利用细胞形态的变化、胰岛素产生细胞的特征性质或特异性标记物(例如,抗胰岛素抗体),进行检测、确认以及分离。另外,也可以通过以三明治ELISA定量其分泌的胰岛素的量,来评价制造的胰岛素产生细胞的分泌能力。
特异性标记物的检测可以利用检疫的方法(通过抗体进行的检测),对于蛋白质分子,也可以通过定量其mRNA量来进行检测。识别胰岛素产生细胞特异性标记物的抗体,对于通过本发明的制造法得到的胰岛素产生细胞的分离以及纯化是有用的。
以本发明的制造法制造的胰岛素产生细胞,例如,可用于组织修复或血中胰岛素浓度的改善等。通过移植以本发明的制造法制造的胰岛素产生细胞,能够制造用于组织修复等的医药用组合物。对于先天几乎不能分泌胰岛素的1型糖尿病的患者,为轻减其症状以及根治,胰脏移植或胰岛的移植是根本性的治疗法。另外,据预测,2型糖尿病的患者在国内外今后会进一步增加,而成为医疗费高涨的原因,分泌胰岛素的胰腺β细胞的移植可能是有效的治疗方法,作为这样的糖尿病等的胰脏疾患的治疗手段,胰岛素产生细胞的制造方法以及胰岛素产生细胞的移植方法的开发正在进行。例如,期望通过将胰岛素产生细胞移植至肾皮膜下或介由门静脉向肝脏移植,而用于重度的胰脏疾患(糖尿病等)的治疗。
使用以本发明的制造法制造的胰岛素产生细胞制备医药用组合物时,通过常规方法,将胰岛素产生细胞与医药上容许的载体混合等,制备成适于向个体给药的形态的制剂即可。作为载体,例如,可以举出生理盐水、加入了葡萄糖或其他辅助药(例如,D-山梨糖醇、D-甘露醇、氯化钠等)而等渗的注射用蒸馏水。也可以进一步混合缓冲剂(例如,磷酸盐缓冲液、醋酸钠缓冲液)、无痛化剂(例如,苯扎氯铵、盐酸普鲁卡因等)、稳定剂(例如,人类血清白蛋白、聚乙二醇等)、保存剂、抗氧化剂等。
以本发明的制造法制造的胰岛素产生细胞,可以进一步制备为与对胰岛素产生细胞的功能的发挥或附着性的提高有效的其他细胞或成分组合的组合物。
进一步,以本发明的制造法制造的胰岛素产生细胞,可以用于作用于胰岛素产生细胞的医药候补化合物的筛选或医药候补化合物的安全性评价。胰岛素产生细胞是评价医药候补化合物的毒性时的重要工具。根据本发明的制造法,由于可以通过一次操作获得大量的胰岛素产生细胞,因此能够不受细胞的批次差异的影响,获得具有再现性的研究结果。
2组合物
本发明涉及的诱导用组合物(以下,称为“本发明的组合物”。),其是用于通过从体细胞直接分化诱导而制造胰岛素产生细胞的组合物,其是无血清的。或其是用于通过从体细胞直接分化诱导而制造胰岛素产生细胞的组合物,其含有5μg/mL以上的胰岛素。
如上所述,本发明的要旨之一是,在用于从体细胞直接分化诱导而制造胰岛素产生细胞的组合物中,实质上不含有牛胚胎血清(FBS)这样的血清。另外,作为本发明的要旨,可以举出:在用于从体细胞直接分化诱导而制造胰岛素产生细胞的组合物中,含有5μg/mL以上的较多的胰岛素。
所述中,优选无血清且含有5μg/mL以上的胰岛素的本发明的组合物。
另外,优选含有RSK抑制剂的本发明的组合物。更优选,除了RSK抑制剂,还进一步含有GSK3抑制剂和/或cAMP诱导体的本发明的组合物。特别是,优选含有RSK抑制剂以及GSK3抑制剂,或RSK抑制剂、GSK3抑制剂以及cAMP诱导体的本发明的组合物。也可以是根据需要进一步含有PI3K抑制剂等的其他抑制剂、诱导剂等的本发明的组合物。
所述抑制剂、诱导剂等可以使用1种或组合使用两种以上。
具体的所述抑制剂等中,有些有可能具有2种以上的抑制作用等,此时,可以将含有这一种视为含有多种抑制剂等。
所述的抑制剂、诱导剂等的具体例或优选例等,与所述同义。
本发明的组合物,可以作为用于从体细胞制造胰岛素产生细胞的培养基而使用。
作为本发明的组合物,举例而言,可以是在混合了细胞培养所必要的成分而制造的基础培养基中,不含有牛胚胎血清(FBS)这样的血清,和/或含有5μg/mL以上的胰岛素的培养基。举例而言,可以是进一步在该培养基中,作为有效成分而含有RSK抑制剂,再进一步根据需要含有GSK3抑制剂和/或cAMP诱导体、PI3K抑制剂的培养基。所述的有效成分,以对胰岛素产生细胞的制造有效的浓度含有即可,浓度可由本行业人员适宜决定。基础培养基,可以从公知的培养基或市售的培养基中选择。例如,可以将一般的培养基MEM(最小必需培养基)、DMEM(Dulbecco’s Modified Eagle Medium)、DMEM/F12、RPMI1640或对它们进行了调整的培养基作为基础培养基使用。
在本发明的组合物的一种实施方式中,含有5μg/mL以上的胰岛素,但优选含有20μg/mL以上或25μg/mL以上,更优选在80~120μg/mL的范围内含有。
作为基础的公知或市售的分化诱导用培养基中预先含有一定的胰岛素时,可以添加胰岛素以将胰岛素的含量调整到所述的量,以制作本发明的组合物。
本发明的组合物涉及的培养基,可以进一步添加本说明书中所述的公知的培养基成分,例如,可以添加血清、蛋白质(白蛋白、转铁蛋白、生长因子等)、氨基酸、糖类、维生素类、脂肪酸类、抗生物质等。
本发明的组合物涉及的培养基,可以进一步添加本说明书中所述的对向胰岛素产生细胞的分化诱导有效的物质。
实施例
以下,将通过实施例对本发明进行具体的说明,但本发明不限于实施例的范围。
实施例1 胰岛素产生细胞的制造
~从人类成纤维细胞向胰岛素产生细胞的直接诱导~
(1)人类成纤维细胞
作为材料的人类成纤维细胞是从DS Pharma Biomedical株式会社购入的。是38岁的人类皮肤来源的成纤维细胞。
(2)从人类成纤维细胞向胰岛素产生细胞的直接诱导
将人类成纤维细胞,向以明胶(Cat#:190-15805,和光纯药工业公司制)涂覆了的35mm培养皿中以5×10
将所述的人类成纤维细胞的培养皿的培养基与下述的分化诱导用培养基进行了交换。
·分化诱导用培养基:添加或不添加10%牛胚胎血清(FBS,Hyclone公司制),并添加了ITS-X(Cat#:51500056,Gibco公司制)、非必需氨基酸(NEAA:Non-essential aminoacids;Cat#:11140050,Gibco公司制)、谷氨酰胺(Gibco公司制;终浓度2mmol/L)、烟酰胺(Cat#:72340-100G,Sigma-Aldrich公司制;终浓度10mmol/L)、Exendin-4(Cat#:av120214,Abcam公司制;终浓度100ng/mL)、100U/mL青霉素、100μg/mL链霉素、胰岛素以及下述的低分子化合物的改良DMEM/F-12(Cat#:12634010;Gibco公司制)。
然后,每3天以同组成的培养基进行培养基交换,同时在37℃、5%CO
需要说明的是,对于分化诱导用培养基,根据需要添加人重组胰岛素(Cat#:093-06351;Wako)进行调整,以达到含有胰岛素20~120μg/mL。
<低分子化合物>
3μM CHIR99021(Cat#:13122,Cayman Chemical)
7.5μM毛喉素(Cat#:063-02193,Wako)
1.5μM BRD7389(Cat#:ab146161,Abcam)
5μM LY294002(Cat#:70920,Cayman Chemical)
(3)结果
如所述(2)而培养了14天的结果如图1~4所示。
图中,“4C”是指所述4种低分子化合物,“3C”是指所述4种低分子化合物中的CHIR99021、BRD7389以及毛喉素3种。“+FBS”表示培养基中存在FBS,“-FBS”表示培养基中不存在FBS。另外,“NoC”或“No Compound”表示所述4种低分子化合物(4C)或3C在培养基中不存在。因此,例如“No C.-FBS”是表示不存在4C且不存在FBS时的实验结果,“4C-FBS”是表示存在4C而不存在FBS时的实验结果。
图4中,“B”是指BRD7389,“3C-B”是表示3C中不存在BRD7389的情况,即在CH和F的2因子条件下的实验结果。“3C-B+BI-D1870”是表示,3C中不存在BRD7389,作为其代替,RSK抑制剂BI-D1870(Cat#:15264,Cayman Chemical)以终浓度5μM或10μM而存在时的实验结果。
如图1所示,通过使分化诱导用培养基中不含有牛胚胎血清(FBS)而进行诱导,从人类成纤维细胞直接高效地诱导获得了胰岛素分泌量增加约20~50倍的分泌能力更高的胰岛素产生细胞。
如图2所示,通过使分化诱导用培养基中含有高浓度的胰岛素(120μg/mL)而进行诱导,从人类成纤维细胞直接高效地诱导获得了胰岛素分泌量增加约3倍的分泌能力更高的胰岛素产生细胞。
从所述来看,可以认为胰岛素分泌增加中FBS和高浓度胰岛素的效果是分别独立的。
如图3所示,从人类成纤维细胞直接得到了,分化诱导用培养基中的胰岛素的浓度直到100μg/mL之前,浓度越高胰岛素分泌量越多的、浓度依赖性的分泌能力高的胰岛素产生细胞。
从图4的结果来看,在除去LY294002,从RSK抑制剂(BRD7389)、GSK抑制剂(CHIR99021)以及cAMP诱导剂(毛喉素)的3因子中进一步除去RSK抑制剂(BRD7389)的2因子条件下,胰岛素的分泌量减少,这表明在向胰岛素产生细胞的诱导中RSK抑制剂的存在是很重要的。另一方面,在取代BRD7389,而使别的RSK抑制剂BI-D1870存在的3因子条件下,也得到了分泌能力高的胰岛素产生细胞。
实施例2 胰岛素产生细胞的制造
~从人类间叶系干细胞向胰岛素产生细胞的直接诱导~
(1)人类间叶系干细胞
从脂肪组织中分离的人类间叶系干细胞是从Takara Bio株式会社处购入的。
(2)从人类间叶系干细胞的向胰岛素产生细胞的直接诱导
将人类间叶系干细胞,向以明胶(Cat#:190-15805,和光纯药工业公司制)涂覆的35mm培养皿中以5×10
将所述的人类间叶系干细胞的培养皿的培养基与下述的分化诱导用培养基进行了交换。
·分化诱导用培养基:添加或不添加10%牛胚胎血清(FBS,Hyclone公司制),并添加了ITS-X(Cat#:51500056,Gibco公司制),非必需氨基酸(NEAA:Non-essential aminoacids;Cat#:11140050,Gibco公司制),谷氨酰胺(Gibco公司制;终浓度2mmol/L),烟酰胺(Cat#:72340-100G,Sigma-Aldrich公司制;终浓度5mmol/L),Exendin-4(Cat#:av120214,Abcam公司制;终浓度50ng/mL),100U/mL青霉素,100μg/mL链霉素以及下述的低分子化合物的改良DMEM/F12(Cat#:12634010;Gibco公司制)。
然后,每3天以同组成的培养基进行培养基交换,同时在37℃、5%CO
需要说明的是,在诱导用培养基中含有120μg/mL的胰岛素的实验中,添加了人重组胰岛素(Cat#:093-06351;Wako)进行调整,以达到含有120μg/mL胰岛素。
<低分子化合物>
0.5μM CHIR99021(Cat#:13122,Cayman Chemical)
3.75μM毛喉素(Cat#:063-02193,Wako)
0.2μM BRD7389(Cat#:ab146161,Abcam)
2.5μM LY294002(Cat#:70920,Cayman Chemical)
(3)结果
如所述(2)而培养了14天的结果如图5所示。
图中,“4C”是指所述4种低分子化合物。“+FBS”表示培养基中存在FBS,“-FBS”表示培养基中不存在FBS。另外,“No compound”表示所述4种低分子化合物在培养基中不存在。因此,例如”No Compound-FBS”表示在不存在4C且也不存在FBS时的实验结果,“4C-FBS”表示存在4C而不存在FBS时的实验结果。
如图5所示,在从人类脂肪组织来源的间叶系干细胞(AdMSC)的直接分化诱导中也是同样,即使分化诱导用培养基中不含有牛胚胎血清(FBS),也充分确认到了胰岛素的分泌。另外,使分化诱导用培养基中含有高浓度(120μg/mL)的胰岛素而进行诱导时,从人类间叶系干细胞直接高效地诱导获得了胰岛素分泌量显著增加,分泌能力更高的胰岛素产生细胞。
- 从间充质干细胞制造胰岛素产生细胞的方法、胰岛素产生细胞、细胞构建体及医药组合物
- 组合物、细胞保存组合物、细胞培养组合物、细胞制剂、包含微小气泡的对象物的制造方法、细胞的保存方法、细胞的培养方法和细胞制剂的制造方法
