用于对接心脏瓣膜的装置和系统
文献发布时间:2023-06-19 11:39:06
本申请是分案申请,原申请的申请日为2017年2月3日,申请号为201780009758.3,发明名称为“用于对接心脏瓣膜的装置和系统”。
技术领域
本发明涉及心脏瓣膜,并具体地涉及用于植入心脏瓣膜例如经导管心脏瓣膜(“THV”)的对接站(docking stations)/支架、递送系统、和方法。
背景技术
假体心脏瓣膜可用于治疗心脏瓣膜疾病。天然心脏瓣膜(主动脉瓣、肺动脉瓣、三尖瓣和二尖瓣)在确保充足的血液供应向前流动通过心血管系统中起到关键作用。先天性、炎性、或传染性疾病可致使这些心脏瓣膜不够有效。这种疾病可最终导致严重的心血管危害或死亡。多年来对于这种疾病的决定性治疗是手术修复或在心脏直视手术期间的瓣膜置换。
经导管技术还可用于以比心脏直视手术创伤小的方式利用挠性导管引入并植入假体心脏瓣膜。在此技术中,可将假体瓣膜以折绉状态安装在挠性导管的末端部分上并推进通过患者的血管,直到瓣膜到达植入位点。然后可在有缺陷的天然瓣膜位点处将导管尖端处的瓣膜扩张至其功能尺寸,如通过使上面安装了瓣膜的球囊膨胀。可选地,瓣膜可具有弹性、自扩张支架或框架,在将瓣膜从导管远端处的递送鞘推进时使瓣膜扩张至其功能尺寸。
经导管心脏瓣膜(THVs)可被适当地设定尺寸以被置于大多数天然主动脉瓣内。然而,对于较大的天然瓣膜、血管、和移植物,主动脉经导管瓣膜可能太小而不能固定至较大的植入位点或部署位点中。在此情况下,经导管瓣膜可能不足够大以在天然瓣膜或其它植入位点或部署位点内充分扩张以固定在适当位置。
置换肺动脉瓣——其有时被称为肺动脉瓣膜——展现出极大的挑战。肺动脉的几何机构可从患者到患者变化很大。一般地,矫正手术后的肺动脉流出道对于假体心脏瓣膜的有效放置来说是太宽的。
发明内容
此概述有意提供实例并且不意图以任何方式限制本发明的范围。例如,权利要求不要求本概述的实例中包括的任何特征,除非权利要求明确限定该特征。该描述公开了用于可扩张瓣膜的可扩张对接站、用于可扩张对接站的导管、和用于导管的手柄的示例性实施方式。可以以各种方式构建对接站、导管、和手柄。
在一个实施方式中,例如,对接站可包括瓣膜座(valve seat)、一个或多个密封部分、和一个或多个保持部分(retaining portions)。在一个实施方式中,瓣膜座可基本上不可扩张超出部署尺寸,即,瓣膜座的直径最大只能增加0–4mm。一个或多个密封部分可被连接至瓣膜座并径向向瓣膜座之外延伸。可构建一个或多个密封部分以向瓣膜座之外扩张并延伸,并在尺寸范围内(例如,在扩张尺寸范围内和/或在循环系统或脉管系统内的尺寸范围内,例如,当在各种形状和尺寸的不同血管或位置中扩张时其能够提供密封)提供密封。一个或多个保持部分可被连接至一个或多个密封部分。一个或多个保持部分可被配置以将对接站保持在部署位置。可扩张对接站能够扩张并在27mm至38mm范围内提供密封。可扩张对接站可沿其长度L径向向外扩张至不同程度。瓣膜座和一个或多个密封部分可充当隔离器,减少或防止瓣膜座中可扩张瓣膜的径向向外的力被转移至一个或多个密封部分或一个或多个保持部分。对接站可被配置使得血压通过保持部分增强保持。一个或多个保持部分可被配置使得由一个或多个保持部分中的至少一个在部署位置处施加的力与作用在对接站上的血压成比例。一个或多个保持部分可被配置使得由一个或多个保持部分中的至少一个施加的力在心脏处于舒张期时比在心脏处于收缩期时更大。瓣膜座可由缝线、环、条带(band)、结构布置、材料、泡沫、和以其它方式形成。密封部分可包括覆盖有织物、聚合物、和/或其它材料的金属框架的部分。密封部分可包含开孔泡沫。对接站的部分可以能渗透血液并且对接站的部分可以不能渗透血液。对接站的不能渗透血液的部分可从至少瓣膜座延伸至至少密封部分。对接站的长度可以是可调节的。对接站可包括第一半部,对接站的第二半部能够可调节地延伸至第一半部中以调节长度。一个或多个保持部分可在对接站处于无约束状态时径向向一个或多个密封部分之外延伸。也可包括本公开中别处描述的其它特征。
在一个示例性实施方式中,系统可包括可扩张对接站和可扩张瓣膜。可扩张对接站可包括瓣膜座、一个或多个密封部分、和一个或多个保持部分。瓣膜座可扩张至部署尺寸。一个或多个密封部分可被连接至瓣膜座并可被构建以径向向瓣膜座之外扩张并延伸,并在扩张尺寸范围内提供密封。一个或多个保持部分可被连接至一个或多个密封部分。一个或多个保持部分可被配置以将对接站保持在部署位置。可扩张瓣膜可包括可扩张框架和瓣膜元件。可扩张框架可被扩张以接合对接站的瓣膜座。瓣膜元件可被连接至可扩张框架。可扩张对接站和可扩张瓣膜可被配置使得在植入循环系统的部分中时,由密封部分向循环系统的部分施加的径向向外的力,在密封部分处于尺寸范围内时,小于由可扩张框架向瓣膜座施加的径向向外的力的1/2(并且可以小于1/3、小于1/4、小于1/8、或小于1/10)。可扩张对接站可被配置使得在植入循环系统的部分中时,瓣膜座的直径通过由可扩张框架向瓣膜座施加的径向向外的力增加不超过3mm(或不超过1mm、2mm、或4mm)。密封部分的尺寸范围可为27mm至38mm。可扩张对接站可被配置以在植入循环系统的部分中时沿其长度L径向向外扩张至不同程度。
可扩张对接站可被配置使得在植入循环系统的部分中时,可扩张对接站上的血压通过保持部分增强保持。可扩张对接站可被配置使得由保持部分施加的力在植入循环系统的部分中时与作用在组件上的血压成比例。可扩张对接站可被配置使得由保持部分施加的力在植入循环系统的部分中时,在心脏处于舒张期时比心脏处于收缩期时更大。瓣膜座可由缝线、环、条带、结构布置、材料、泡沫、和以其它方式形成。密封部分可包括覆盖有织物的金属框架的部分。密封部分可包含开孔泡沫。对接站的部分可以能渗透血液并且对接站的部分可以不能渗透血液。对接站的不能渗透血液的部分能够从至少瓣膜座延伸至至少密封部分。对接站可具有可调节的总长度。对接站可包括第一半部(即,部分),对接站的第二半部(即,部分)能够可调节地延伸至第一半部(即,部分)中以调节总长度。换言之,可通过相对于第一半部/部分移动第二半部/部分来调节对接站的长度,并且可将第一半部/部分与第二半部/部分独立地移动(例如,一个半部/部分可保持在适当位置而另一半部/部分移动)。如果第一或第二半部/部分中的一个在另一半部/部分内延伸并重叠以调节长度,那么可调节第一半部/部分和第二半部/部分以改变两者之间重叠的量/长度。一个或多个保持部分可在对接站处于无约束状态时向一个或多个密封部分之外径向延伸。也可包括本公开中别处描述的其它特征。
在一个示例性实施方式中,方法可包括扩张对接站和扩张对接站中的瓣膜。可将对接站扩张使得对接站的瓣膜座扩张至瓣膜座部署尺寸并且密封部分扩张至处于密封尺寸范围内的密封尺寸。可将可扩张瓣膜的框架扩张以接合对接站的瓣膜座。由密封尺寸范围内的密封部分施加的径向向外的力可小于在扩张框架后由可扩张框架向瓣膜座施加的径向向外的力的1/2(并可小于1/3、小于1/4、小于1/8、或小于1/10)。对接站的瓣膜座可被配置使得瓣膜座的直径通过由可扩张框架向瓣膜座施加的径向向外的力增加不超过2mm(或不超过1mm、3mm、或4mm)。对接站的密封尺寸的范围可为27mm至38mm。瓣膜座可由缝线、环、条带、结构布置、材料、泡沫、和以其它方式形成。也可包括本公开中别处描述的其它特征/步骤。
在一个示例性实施方式中,系统可包括可扩张对接站和可扩张瓣膜。可扩张对接站可包括瓣膜座、一个或多个密封部分、和一个或多个保持部分。瓣膜座可扩张至部署尺寸。一个或多个密封部分可被连接至瓣膜座并可向瓣膜座之外径向延伸。一个或多个密封部分可被构建以向瓣膜座之外扩张并在尺寸范围内提供密封。一个或多个保持部分可被连接至一个或多个密封部分。一个或多个保持部分可被配置以保持对接站在部署位置。可扩张瓣膜可包括可扩张框架和瓣膜元件。可扩张框架可扩张以接合对接站的瓣膜座。瓣膜元件可被连接至可扩张框架。作用在瓣膜和对接站上的血压可在部署位置处通过保持部分增强保持。
瓣膜座可被配置使得可扩张瓣膜的径向向外的力基本上不径向向外扩张瓣膜座。密封部分的尺寸范围可为27mm至38mm。对接站可被配置以沿其长度L径向向外扩张至不同程度。由保持部分施加的力可与作用在组件上的血压成比例。由保持部分施加的力可在心脏处于舒张期时比心脏处于收缩期时更大。瓣膜座可由缝线、环、条带、结构布置、材料、泡沫、和以其它方式形成。密封部分可包括覆盖有织物的金属框架的部分。密封部分可包含开孔泡沫或其它材料。对接站的部分可以能渗透血液并且对接站的部分可以不能渗透血液。对接站的不能渗透血液的部分可从至少瓣膜座延伸至至少密封部分。对接站的长度是可调节的。对接站可包括第一半部(即,部分),对接站的第二半部(即,部分)能够可调节地延伸至第一半部(即,部分)中以调节总长度。换言之,可通过相对于第一半部/部分移动第二半部/部分来调节对接站的长度,并且第一半部/部分与第二半部/部分可独立地移动(例如,一个半部/部分可保持在适当位置而另一半部/部分移动)。如果第一或第二半部/部分中的一个在另一半部/部分内延伸并重叠以调节长度,那么可调节第一半部/部分和第二半部/部分以改变两者之间重叠的量/长度。一个或多个保持部分可在对接站处于无约束状态时向一个或多个密封部分之外径向延伸。也可包括本公开中别处描述的其它特征。
在一个示例性实施方式中,方法可包括扩张对接站和扩张对接站中的瓣膜。可将对接站扩张使得对接站的瓣膜座扩张至瓣膜座部署尺寸并且密封部分扩张至处于密封尺寸范围内的密封尺寸。可将可扩张瓣膜的框架扩张以接合对接站的瓣膜座。作用在瓣膜和对接站上的血压可在部署位置处通过保持部分增强保持。对接站的瓣膜座可被配置使得瓣膜座的直径通过由可扩张框架向瓣膜座施加的径向向外的力增加不超过2mm(或不超过1mm、3mm、或4mm)。对接站的密封尺寸的范围可为27mm至38mm。瓣膜座可由缝线、环、条带、结构布置、材料、泡沫、和以其它方式形成。也可包括本公开中别处描述的其它特征/步骤。
在一个实施方式中,例如,对接站可包括瓣膜座,以及一个或多个密封部分。瓣膜座可被扩张至部署尺寸。一个或多个密封部分可被连接至瓣膜座并向瓣膜座之外径向延伸。一个或多个密封部分可被构建以向瓣膜座之外扩张并在尺寸范围内提供密封。对接站的长度可以是可调节的。对接站可包括第一半部(即,部分),对接站的第二半部(即,部分)能够可调节地延伸至第一半部(即,部分)中以调节总长度。换言之,对接站的长度可通过相对于第一半部/部分移动第二半部/部分来调节,并且第一半部/部分可与第二半部/部分独立地移动(例如,一个半部/部分可保持在适当位置而另一半部/部分移动)。如果第一或第二半部/部分中的一个在另一半部/部分内延伸并重叠以调节长度,那么可调节第一半部/部分和第二半部/部分以改变两者之间重叠的量/长度。
瓣膜座可被构建使得可扩张瓣膜的径向向外的力基本上不可径向向外扩张瓣膜座。密封部分的尺寸范围可为27mm至38mm。对接站可被配置以沿其长度L径向向外扩张至不同程度。瓣膜座和一个或多个密封部分可充当隔离器,基本上防止可扩张瓣膜的径向向外的力转移至一个或多个密封部分。瓣膜座可由缝线、环、条带、结构布置、材料、泡沫、和以其它方式形成。密封部分可包括覆盖有织物的金属框架的部分。密封部分可包含开孔泡沫。对接站的部分可以能渗透血液并且对接站的部分可以不能渗透血液。也可包括本公开中别处描述的其它特征。
在一个示例性实施方式中,系统可包括可扩张对接站和可扩张瓣膜。可扩张对接站可包括瓣膜座,以及一个或多个密封部分。瓣膜座可扩张至部署尺寸。一个或多个密封部分可被连接至瓣膜座并可向瓣膜座之外径向延伸。一个或多个密封部分可被构建以向瓣膜座之外扩张并在尺寸范围内提供密封。对接站的长度可以是可调节的,例如,以与本文别处所讨论的方式相同或类似的方式是可调节的。可扩张瓣膜可包括可扩张框架和瓣膜元件。可扩张框架可扩张以接合对接站的瓣膜座。瓣膜元件可被连接至可扩张框架。对接站的第二半部可延伸至对接站的第一半部中以使对接站的长度是可调节的。瓣膜座可被配置使得可扩张瓣膜的径向向外的力基本上不径向向外扩张瓣膜座。对接站可被配置以沿其长度L径向向外扩张至不同程度。瓣膜座可由缝线、环、条带、结构布置、材料、泡沫、和以其它方式形成。密封部分可包括覆盖有织物的金属框架的部分。密封部分可包含开孔泡沫。对接站的部分可以能渗透血液并且对接站的部分可以不能渗透血液。也可包括本公开中别处描述的其它特征。
在一个示例性实施方式中,方法可包括扩张多件式(multiple piece)对接站和扩张对接站中的瓣膜。第一对接站半部或部分可被扩张。第二对接站半部或部分的部分/区段可定位在第一对接站半部中,例如,使得期望的长度重叠。第二对接站半部可在第一对接站半部中被扩张以设定对接站的长度。对接站可具有瓣膜座和密封部分。可扩张瓣膜的框架可被扩张以接合对接站的瓣膜座。瓣膜座可被配置使得可扩张瓣膜的径向向外的力基本上不径向向外扩张瓣膜座。对接站的密封部分的预定尺寸可为27mm至38mm。瓣膜座可由缝线、环、条带、结构布置、材料、泡沫、和以其它方式形成。也可包括本公开中别处描述的其它特征/步骤。
在一个示例性实施方式中,递送导管可包括外管和内管。外管可具有远侧开口。内管可被设置在外管内使得内管和外管之间形成间隙。内管可具有近端处的开口并可具有一个或多个侧开口。递送导管可被配置使得注射冲洗液至内管的近端中使冲洗液冲洗通过内管,其中冲洗液中的至少一些通过一个或多个侧开口离开内管以填充间隙并使空气从外管的远侧开口冲出。内管可具有远侧开口并且递送导管可被配置使得在近端处用冲洗液对内管的填充使空气从内管的远侧开口冲出。可在内管近端的导丝用开口处用冲洗液填充内管。递送导管可被配置使得内管中的空气可通过内管的远侧开口并通过可被连接至内管的鼻锥体(nosecone)中的开口被冲出。也可包括本公开中别处描述的其它特征。
在一个示例性实施方式中,方法可将空气从递送导管冲出。递送导管可包括具有远侧开口的外管、具有在内管的近端处的近侧开口以及一个或多个侧开口的内管、和内管与外管之间形成的间隙。可将冲洗液注射至内管的近端中,使得冲洗液流动通过内管并且冲洗液中的至少一些通过一个或多个侧开口离开内管以填充间隙并使空气从外管的远侧开口冲出。内管可通过近侧开口用冲洗液填充,并且近侧开口还可用于使导丝通过递送导管。还可在空气已被冲出后将递送导管插入血管中。也可包括本公开中别处描述的其它特征/步骤。
在一个示例性实施方式中,导管和对接站系统包括套筒、对接站保持器、和对接站。对接站保持器可设置在套筒中。对接站保持器可包括一个或多个保持器凹槽。对接站可设置在套筒中。对接站可包括可释放地附接至对接站保持器的一个或多个延伸部。一个或多个延伸部中的每一个延伸部都可包括设置在一个或多个保持器凹槽中的至少一个中的头部。一个或多个对接延伸部中的每一个延伸部都可被配置以仅以两个点接触对接站保持器。头部可为三角形并且可包括两个头部。在对接站保持器中一个或多个保持器凹槽可为矩形凹槽。头部的侧面可以以60度和120度之间的角度彼此远离延伸。在套筒被定位在一个或多个延伸部之上时,套筒可接合一个或多个延伸部以使一个或多个头部保持在保持器凹槽中。一个或多个延伸部可在不受套筒约束时相对于对接站保持器径向向外弹开(spring)以从对接站保持器释放一个或多个延伸部。一个或多个延伸部可在一个或多个凹槽中被倾斜。也可包括本公开中别处描述的其它特征。
在一个示例性实施方式中,使用对接站的方法可包括将对接站延伸部的头部置于对接站保持器的凹槽中使得对接站延伸部仅以两个点接触对接站保持器。可将对接站和对接站保持器置于套筒中。套筒可接合对接站延伸部以使对接站延伸部的头部保持在凹槽中。头部可为三角形。在对接站保持器中凹槽可为矩形凹槽。头部的侧面可以以60度和120度之间的角度彼此远离延伸。可将保持器和对接站从套筒移除使得对接站延伸部的头部相对于对接站保持器径向向外弹开以将对接站延伸部从对接站保持器释放。延伸部可在凹槽中被倾斜。也可包括本公开中别处描述的其它特征/步骤。
在一个示例性实施方式中,用于部署对接站的组件包括手柄和导管。手柄可包括壳体、驱动部件、和从动部件。驱动部件可被可旋转地联接至壳体。从动部件可被联接至驱动部件和壳体,使得驱动部件的旋转使从动部件在壳体中线性地移动。导管可包括外套筒和内套筒。外套筒可被固定地连接至从动部件。内套筒可设置在外套筒中并可被固定地连接至壳体。驱动部件的旋转可使外套筒相对于内套筒移动。驱动部件可包括具有齿轮部分的轮。驱动部件可包括内螺纹部件。从动部件可包括齿条。从动部件可包括外螺纹部件。棘轮机构能够从接合位置移动至分离位置,使得在棘轮处于接合位置时驱动部件能够仅以一个方向旋转。鲁尔接口(lure port)可被固定至内套筒。鲁尔接口和内套筒可被配置以接受延伸通过内轴的导丝。也可包括本公开中别处描述的其它特征。
在一个示例性实施方式中,部署对接站的方法可包括使驱动部件相对于壳体旋转以使从动部件在壳体中线性地移动。内套筒可被固定至壳体并且外套筒可被固定至从动部件。驱动部件的旋转使外套筒相对于内套筒移动。驱动部件可通过轮齿的接合使从动部件线性地移动。驱动部件可通过螺纹的接合使从动部件线性地移动。驱动部件可被配置以仅以一个方向旋转。可将第一和第二套筒在导丝之上移动。
本公开中别处描述的各种特征可被包括在此处概括的实例中,并且可利用使用实例和特征的各种方法和步骤,包括本文别处所描述的。
所公开的发明的本质和优势的进一步理解可通过以下描述和权利要求获得,特别是在与其中相同部分具有相同参照编号的所附附图一起考虑时。
附图说明
为进一步阐明本公开实施方式的各种方面,将通过参照所附附图的各种方面作出某些实施方式的更具体的描述。应当理解这些附图仅描绘了本公开的一般的实施方式并因此不被认为是限制本公开的范围。而且,尽管针对一些实施方式按比例绘制了图,但是不必要针对所有实施方式按比例绘制图。本公开的实施方式将通过利用所附附图以另外的特性和细节来描述和说明。
图1A为处于舒张期的人心脏的剖面图;
图1B为处于收缩期的人心脏的剖面图;
图2A-2E为示例了肺动脉可具有各种不同形状和尺寸的肺动脉截面图;
图3A-3D为示例了肺动脉可具有各种不同形状和尺寸的肺动脉透视图;
图4A为被定位在循环系统中的压缩的对接站的示意图;
图4B为被扩张以将对接站的位置设定在循环系统中的图4A的对接站的示意图;
图4C为被定位在图4B示例的对接站中的可扩张经导管心脏瓣膜的示意图;
图4D为被扩张以将心脏瓣膜的位置设定在对接站中的图4C的经导管心脏瓣膜的示意图;
图4E示例了部署在循环系统的不规则形状部分中的对接站和经导管心脏瓣膜;
图4F示例了部署在肺动脉中的对接站和经导管心脏瓣膜;
图5A为被定位在循环系统中的压缩的对接站的示意图;
图5B为被扩张以将对接站的位置设定在循环系统中的图5A的对接站的示意图;
图5C为被定位在图5B示例的对接站中的可扩张经导管心脏瓣膜的示意图;
图5D为被扩张以将心脏瓣膜的位置设定在对接站中的图5C的经导管心脏瓣膜的示意图;
图5E示例了部署在循环系统的不规则形状部分中的对接站和经导管心脏瓣膜;
图5F示例了部署在肺动脉中的对接站和经导管心脏瓣膜;
图6A为具有对接站并且部署在肺动脉中的处于收缩期的人心脏的剖面图;
图6B为对接站和经导管心脏瓣膜部署在肺动脉中的处于收缩期的人心脏的剖面图;
图7A为在心脏处于收缩期时图6B的对接站和经导管心脏瓣膜的放大示意图;
图7B为以图7A中的线7B-7B指示的方向截取的视图;
图7C为显示了对接站直径与由对接站施加的径向向外的力之间的关系的图;
图8为对接站和经导管心脏瓣膜部署在肺动脉中的处于舒张期的人心脏的剖面图;
图9A为在心脏处于舒张期时图8的对接站和经导管心脏瓣膜的放大示意图;
图9B为以图9A中的线9B-9B指示的方向截取的视图;
图10A示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图10B示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图10C示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图10D示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图11A示例了伸缩式对接站的示例性实施方式;
图11B示例了伸缩式对接站的示例性实施方式;
图11C示例了伸缩式对接站的示例性实施方式;
图11D示例了伸缩式对接站的示例性实施方式;
图12A示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图12B示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图12C示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图12D示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图13A示例了伸缩式对接站的示例性实施方式;
图13B示例了伸缩式对接站的示例性实施方式;
图13C示例了伸缩式对接站的示例性实施方式;
图13D示例了伸缩式对接站的示例性实施方式;
图14A示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图14B示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图14C示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图14D示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图14E示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图14F示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图14G示例了经导管心脏瓣膜被设置在对接站内的对接站的示例性实施方式;
图15A为对接站的框架的示例性实施方式的侧视图;
图15B示例了图15A示例的框架的侧面轮廓;
图16示例了处于压缩状态的图15A的对接站框架;
图17A为图15A的对接站框架的透视图;
图17B为图15A的对接站框架的透视图;
图18为具有多个覆盖室和多个开放室的对接站的示例性实施方式的透视图;
图19为部分被切除以示例被扩张至对接站中的位置的经导管心脏瓣膜的图18示例的对接站的透视图;
图20示例了在植入循环系统的血管中时图18示例的对接站的侧面轮廓;
图21示例了在植入循环系统的血管中时图18示例的对接站的透视图;
图22示例了在植入循环系统的血管中时图19示例的对接站和瓣膜的透视图;
图23A和23B示例了在植入循环系统的不同尺寸的血管中时图18示例的对接站的侧面轮廓;
图24和25示例了在植入循环系统的不同尺寸的血管时图18示例的对接站的侧面轮廓,其中具有相同尺寸的示意性示例的经导管心脏瓣膜被安装或被部署在每一个对接站中;
图26A为示例了置于肺动脉中的对接站的示例性实施方式的侧面轮廓的截面图;
图26B为示例了置于肺动脉中的对接站和置于对接站中的示意性示例的瓣膜的示例性实施方式的侧面轮廓的截面图;
图26C为示例了置于肺动脉中的对接站和置于对接站中的瓣膜的示例性实施方式的截面图;
图27为对接站的示例性实施方式的侧视图;
图28为伸缩式对接站的示例性实施方式的侧视图;
图29为其中对接站的两个部分已被套叠在一起的图28的对接站的侧视图;
图30为示例了置于肺动脉中的对接站的截面图;
图31A为示例了置于肺动脉中的对接站的示例性实施方式的侧面轮廓的截面图;
图31B为示例了置于肺动脉中的对接站和置于对接站中的瓣膜的示例性实施方式的侧面轮廓的截面图;
图32A为具有对接站并且被部署在肺动脉中的处于收缩期的人心脏的剖面图;
图32B为对接站和经导管心脏瓣膜被部署在肺动脉中的处于收缩期的人心脏的剖面图;
图33A为在心脏处于收缩期时图32B的对接站和经导管心脏瓣膜的放大示意图;
图33B为以图33A中的线33B-33B指示的方向截取的视图;
图34为在心脏处于舒张期时图32B示例的人心脏、被部署在肺动脉中的对接站和经导管心脏瓣膜的剖面图;
图35A为在心脏处于舒张期时图34的对接站和经导管心脏瓣膜的放大示意图;
图35B为以图35A中的线35B-35B指示的方向截取的视图;
图36A为对接站正被部署在肺动脉中的处于收缩期的人心脏的剖面图;
图36B为对接站被部署在肺动脉中的处于收缩期的人心脏的剖面图;
图36C为对接站和经导管心脏瓣膜被部署在肺动脉中的处于收缩期的人心脏的剖面图;
图37A为在心脏处于收缩期时图36C的对接站和经导管心脏瓣膜的放大示意图;
图37B为以图37A中的线37B-37B指示的方向截取的视图;
图38为在心脏处于舒张期时图36C示例的人心脏、被部署在肺动脉中的对接站和经导管心脏瓣膜的剖面图;
图39A为在心脏处于舒张期时图38的对接站和经导管心脏瓣膜的放大示意图;
图39B为以图39A中的线39B-39B指示的方向截取的视图;
图40A为对接站正被部署在肺动脉中的处于收缩期的人心脏的剖面图;
图40B为对接站被部署在肺动脉中的处于收缩期的人心脏的剖面图;
图40C为对接站和经导管心脏瓣膜被部署在肺动脉中的处于收缩期的人心脏的剖面图;
图41A为在心脏处于收缩期时图40C的对接站和经导管心脏瓣膜的放大示意图;
图41B为以图41A中的线41B-41B指示的方向截取的视图;
图42为在心脏处于舒张期时图40C示例的人心脏、被部署在肺动脉中的对接站和经导管心脏瓣膜的剖面图;
图43A为在心脏处于舒张期时图42的对接站和经导管心脏瓣膜的放大示意图;
图43B为以图43A中的线43B-43B指示的方向截取的视图;
图44-47、和48A-48C示例了可被部署在对接站(例如,本文描述或描绘的对接站中的一个)中的瓣膜类型的实例;
图49A为导管的示例性实施方式的截面图;
图49B为对接站被折绉并被装载在导管中的导管的示例性实施方式的截面图;
图50A-50D示例了从导管的对接站的部署;
图51为导管的鼻锥体的示例性实施方式的侧视图;
图52为按图51中的线52-52指示所截取的视图;
图53为导管的远侧部分的示例性实施方式的截面图;
图54为导管的鼻锥体的示例性实施方式的侧视图;
图55为导管的远侧部分的示例性实施方式的截面图;
图56为用于将对接站保持在导管中的夹持器(holder)的透视图;
图57为用于将对接站保持在导管中的夹持器的透视图;
图57A和57B示例了设置在夹持器中的对接站的延伸部的侧视图;
图58为对接站导管的手柄的示例性实施方式的截面图;
图59为图58的手柄的部分的分解透视图;
图60为图58的手柄的部分的分解截面图;
图61为图58的手柄的部分的分解透视截面图;
图62为侧盖被移除的对接站导管的手柄的示例性实施方式的视图;
图63为示例了导管的冲洗系统的图62的放大部分;
图64A和64B为相对侧盖被移除以示例对接站导管的外套筒的延伸和缩回的图62示例的手柄的视图;
图65为图62的手柄的分解图;
图66为相对侧盖被移除的图62示例的手柄的透视图;
图67为图62示例的手柄的侧视图;
图68为处于棘轮状态(ratcheting state)的图62示例的手柄的分度轮(indexingwheel)的侧视图;
图69为处于棘轮状态的图68的分度轮的透视图;
图70为图69的放大部分;
图71为设置在手柄壳体中的图68示例的分度轮的部分截面图;
图72为处于分离状态的与图71相似的视图;以及
图73为处于分离状态的图62示例的手柄的分度轮的侧视图。
具体实施方式
以下描述参照示例了本发明的特定实施方式的所附附图。具有不同结构和操作的其它实施方式不偏离本发明的范围。本公开的示例性实施方式涉及用于向经导管心脏瓣膜(“THV”)——例如,THV 29——提供对接站或着陆区(landing zone)的装置和方法。在一些示例性实施方式中,THV的对接站被示例用于肺动脉内,虽然对接站(例如,对接站10)可用于解剖结构、心脏、或脉管系统的其它区域诸如上腔静脉或下腔静脉。本文所述对接站可被配置以补偿比这样的空间(例如,解剖结构/脉管系统/等)小的被部署的THV:所述空间中将放置所述THV。
应当注意,本文公开了用于递送和植入的对接站和系统的各种实施方式,并且可作出这些选项的任意组合,除非特定排除。例如,公开的任意对接站装置,可与任意类型的瓣膜、和/或任意递送系统一起使用,即使未明确描述具体的组合。同样地,可混合并匹配对接站和瓣膜的不同结构,如通过组合任意对接站类型/特征、瓣膜类型/特征、组织覆盖(cover)等,即使未明确公开。简言之,可组合所公开系统的各个构件,除非相互排斥或以其它方式在物理上无可能。
出于一致的目的,在本申请的这些图和其它中描绘对接站使得肺分叉末端(pulmonary bifurcation end)在上,而心室末端在下。这些方向也被称为“远侧”,作为上或肺分叉末端的同义词,和被称为“近侧”,作为下或心室末端的同义词,其是相对于医师视角的术语。
图1A和1B分别为处于舒张期和收缩期的人心脏H的剖面图。右心室RV和左心室LV分别通过三尖瓣TV和二尖瓣MV;即,房室瓣与右心房RA和左心房LA分离。另外,主动脉瓣AV将左心室LV与升主动脉(未指出)分离并且肺动脉瓣PV将右心室与肺动脉PA分离。这些瓣膜中的每一个都具有向内延伸横跨各自孔口的挠性小叶,其在流动流(flowstream)中汇集在一起或“闭合”以形成单向流体-阻塞平面。本申请的对接站和瓣膜主要关于肺动脉瓣进行描述。因此,将更详细地说明右心房RA和右心室RV的解剖结构。应当理解本文所述装置还可用于其它区域,例如,在下腔静脉和/或上腔静脉中用作治疗回流或以其它方式的有缺陷的三尖瓣、在主动脉(例如,扩大的主动脉)中用作治疗有缺陷的主动脉瓣、用于心脏或脉管系统的其它区域中、用于移植物中等。
右心房RA通过上腔静脉SVC和下腔静脉IVC接收来自静脉系统的脱氧血,前者从上方进入右心房,和后者从下方进入右心房。冠状窦CS为合并在一起的静脉的聚集以形成从心脏肌肉(心肌)聚集脱氧血并将其递送至右心房RA的大血管。在舒张期或心脏舒张期间,图1A中所见,在右心房RA中聚集的静脉血液通过右心室RV的扩张进入三尖瓣TV。在收缩期或心脏收缩期间,图1B中所见,右心室RV收缩以迫使静脉血液通过肺动脉瓣PV和肺动脉进入肺中。在一个示例性实施方式中,由本申请描述的装置用于置换或补充有缺陷的肺动脉瓣的功能。在心脏收缩期间,三尖瓣TV的小叶关闭以防止静脉血液回流至右心房RA中。
参照图2A-2E和3A-3D,所示非穷尽实例示例了肺动脉可具有广泛各种不同的形状和尺寸。例如,如图2A-2E的截面图和图3A-3D的透视图中所示,长度L、直径D、和曲率或轮廓(contour)在不同患者的肺动脉之间可变化很大。此外,直径D沿个体的肺动脉的长度L可显著变化。这些差异在遭受某些疾病和/或已受到先前手术的损伤的肺动脉中可甚至更显著。例如,法鲁四联症(TOF)或大动脉错位(TGA)的治疗时常导致较大的且更不规则形状的肺动脉。
法鲁四联症(TOF)是心脏异常,其指代通常一起发生的四种相关心脏缺陷的组合。四种缺陷为室间隔缺损(VSD)、主动脉骑跨(主动脉瓣被扩大并表现出从左心室和右心室两者上升而非如正常心脏中从左心室上升)、肺动脉瓣狭窄(肺动脉瓣和流出道或产生血流从右心室至肺动脉的阻碍的瓣膜下方区域的变窄)、和右心室肥大(右心室的肌肉壁的增厚,其发生是因为右心室以高压泵送)。
大动脉错位(TGA)指代主动脉和肺动脉从其正常的位置被“转置”(transposed)致使主动脉从右心室上升并且肺动脉从左心室上升的异常。
一些疾病的手术治疗涉及沿肺动脉、高至和沿肺动脉分支(pulmonary branches)中的一个的纵向切口。该切口可消除或显著损害肺动脉瓣的功能。经瓣环补片(trans-annular patch)用于手术后覆盖切口。经瓣环补片减小与其它手术有关的肺动脉PA的狭窄或被约束的疾病。然而,肺动脉瓣PV的损伤或消除可产生显著的回流,并且在本发明前,时常需要后期心脏直视手术以置换肺动脉瓣。经瓣环补片技术可导致肺动脉具有宽泛程度的尺寸和形状变化(参见图3A-3D)
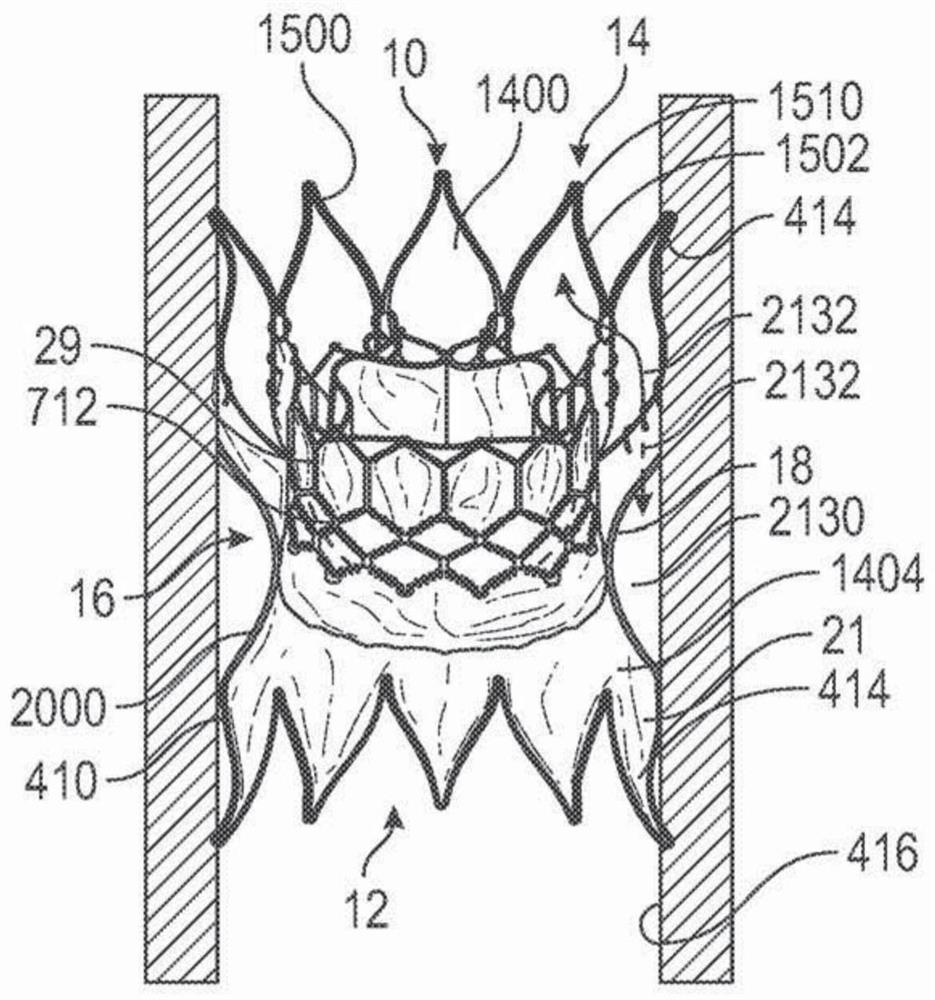
参照图4A-4F,在一个示例性实施方式中,可扩张对接站10包括一个或多个密封部分410、瓣膜座18、和一个或多个保持部分414。一个或多个密封部分410在对接站10和循环系统的内表面416之间提供密封。瓣膜座18在对接站10被植入循环系统中后提供用于将瓣膜29植入或部署在对接站10中的支撑表面。保持部分414协助将对接站10和瓣膜29保持在循环系统中的植入位置或部署位点。本文各种实施方式中描述的可扩张对接站10和瓣膜29还表示可能已知的或可能开发的各种对接站和/或瓣膜,例如,各种不同类型的瓣膜可替换和/或用作各种对接站中的瓣膜29。
图4A-4D示意地示例了循环系统中对接站10和瓣膜29的示例性部署。参照图4A,对接站10处于压缩形式/构型并被引入循环系统中的部署位点。例如,可通过导管(例如,图50A–50D中所示的导管3600)将对接站10定位在肺动脉中的部署位点。参照图4B,使对接站10在循环系统中扩张,使得一个或多个密封部分410和保持部分414接合循环系统的部分的内表面416。参照图4C,在部署对接站10后,瓣膜29处于压缩形式并被引入对接站10的瓣膜座18。参照图4D,使瓣膜29在对接站中扩张,使得瓣膜29接合瓣膜座18。在本文所述实例中,对接站10比瓣膜长。然而,在其它实施方式中,对接站10的长度可与瓣膜29的长度相同或比瓣膜29的长度短。类似地,瓣膜座18的长度可比瓣膜29的长度长、短、或与其相同。
参照图4D,瓣膜29已扩张使得对接站的座18支撑瓣膜。瓣膜29只需扩张抵靠狭窄的座18,而不抵靠对接站10占据的循环系统的部分内的更宽空间。对接站10允许瓣膜29在其被设计所针对的扩张直径范围内操作。
图4E示例了循环系统的内表面416,如血管或心脏的解剖结构的内表面在沿其长度的横截面尺寸和/或形状上可有变化。在示例性实施方式中,对接站10被配置以沿其长度L径向向外扩张至不同程度以顺应内表面416的形状。在一个示例性实施方式中,对接站10被配置使得一个或多个密封部分410和/或一个或多个保持部分接合内表面416,虽然血管或心脏的解剖结构的形状沿对接站的长度L显著变化。对接站可由非常弹性或柔顺的材料制成以容纳解剖结构中的大变化。例如,对接站可由高挠性金属、金属合金、聚合物、或开孔泡沫制成。可使用的金属和金属合金的实例包括,但不限于,镍钛诺、埃尔吉洛伊非磁性合金(elgiloy)、和不锈钢,但可以使用其它金属和高弹性或柔顺的非金属材料。例如,对接站10可具有由这些材料——例如,由形状记忆材料,如镍钛诺——制成的框架或框架的部分(例如,自扩张框架、一个或多个保持部分、一个或多个密封部分、瓣膜座等)。这些材料允许框架被压缩至小尺寸,然后在压缩力释放时,框架将自扩张回至其压缩前直径。
可用于形成对接站或对接站的部分的开孔泡沫的实例为生物相容性泡沫,如聚氨酯泡沫(例如,可从Biomerix,Rockville,MD获得)。本文所述对接站可自扩张和/或可用可膨胀装置扩张以导致对接站接合具有可变形状的内表面416。
图4F示例了植入在肺动脉PA中的对接站10和瓣膜29。如有关图2A-2E和3A-3D提及的,肺动脉的形状沿其长度可显著变化。在一个示例性实施方式中,对接站10以与有关图4E所述的相同的方式被配置以顺应肺动脉PA的变化形状。
参照图5A-5F,在一个示例性实施方式中,可扩张对接站10由可扩张泡沫材料诸如开孔生物相容性泡沫制成。泡沫材料的外表面510可充当密封部分410。在此实例中,可将瓣膜座18提供在如示例的泡沫材料的内表面512上,或者内表面512可充当瓣膜座。在图5A-5F示例的实例中,虽然可使用保持部分,但省略了保持部分414。在一个实施方式中,泡沫材料可与(例如,金属的、形状记忆材料等的)可扩张框架一起使用。泡沫材料可覆盖或延伸框架的全部长度或仅覆盖或延伸框架长度的部分。
图5A-5D示意地示例了将泡沫对接站10和瓣膜29部署在循环系统中。参照图5A,对接站10处于压缩形式并被引入循环系统中的部署位点。例如,可通过导管(例如,图50A–50D中所示导管3600)将对接站10定位在肺动脉中的部署位点。参照图5B,使对接站10在循环系统中扩张,使得密封部分410接合循环系统的内表面416。参照图5C,在部署对接站10后,瓣膜29处于压缩形式并被引入瓣膜座18或对接站10的内表面512。参照图5D,使瓣膜29在对接站中扩张,使得瓣膜29接合瓣膜座18或内表面512(例如,在内表面512充当瓣膜座的情况下)。
图5E示例了循环系统的内表面416,如血管或心脏的解剖结构的内表面在沿其长度的横截面上可变化。在示例性实施方式中,泡沫对接站10被配置以沿其长度L径向向外扩张至不同程度以顺应内表面416的形状。
图5F示例了植入肺动脉PA中的泡沫对接站10和瓣膜29。如有关图2A-2E和3A-3D提及的,肺动脉的形状沿其长度可显著变化。在一个示例性实施方式中,对接站10以与有关图4E所述的相同或相似的方式被配置以顺应肺动脉PA的变化形状。
参照图6A,对接站,例如,有关图4A-4D所述的对接站,被部署在心脏H的肺动脉PA中。图6B示例了部署在图6A示例的对接站10中的瓣膜29。在图6A和6B中,心脏处于收缩期。图7A为图6B的肺动脉29中的对接站10和瓣膜29的放大表示。在心脏处于收缩期时,瓣膜29打开。血液从右心室RV流动并如箭头602指示通过肺动脉PA、对接站10、和瓣膜29。图7B示例了空间608,其表示瓣膜29在心脏处于收缩期时是开放的。图7B未显示对接站10与肺动脉之间的界面以简化附图。图7B中的交叉影线示例了通过开放瓣膜的血流。在示例性实施方式中,一个或多个密封部分410防止血液在肺动脉PA和对接站10之间流动,并且瓣膜29在对接站10的座18中的就座(seating)防止血液在对接站10和瓣膜29之间流动。在此实例中,血液在心脏处于收缩期时基本上只流动或只能流动通过瓣膜29。
图8示例了在心脏处于舒张期时图6B示例的瓣膜29、对接站10和心脏H。参照图9A和9B,在心脏处于舒张期时,瓣膜29关闭。图9A为图8的肺动脉29中的对接站10和瓣膜29的放大表示。(即肺动脉分支760中的)瓣膜29上方的肺动脉PA中的血流被处于关闭并阻塞如箭头900指示的血流的瓣膜29阻塞。图9B中的实心区域(solid area)912表示在心脏处于舒张期时瓣膜29处于关闭。
在一个示例性实施方式中,对接站10充当防止或基本上防止瓣膜29的径向向外的力被转移至循环系统的内表面416的隔离器。在一个实施方式中,对接站10包括瓣膜座18(其不被THV或瓣膜29的径向向外的力径向向外扩张或基本上不被THV或瓣膜29的径向向外的力径向向外扩张,即,瓣膜座的直径不被THV的力增加或被THV的力增加小于4mm)、和锚定/保持部分414以及密封部分410,(相比于瓣膜29对瓣膜座18施加的径向向外的力)其在循环系统的内表面416上仅赋予相对小的径向向外的力720、722。
在不使用对接站时,THV的支架和框架通过直接作用在循环系统内表面416上的THV支架或框架712的相对高的径向向外的力710保持在循环系统中的适当位置。如果使用对接站,如在图7A示例的实例中,瓣膜29的支架或框架712径向向外扩张或被径向向外扩张以在对接站10的瓣膜座18上赋予高的力710。此高的径向向外的力710将瓣膜29固定至对接站10的瓣膜座18。然而,由于瓣膜座18不被力710扩张或基本上不被力710扩张,力710与循环系统隔离,而非用于使对接站固定在循环系统中。
在示例性实施方式中,密封部分410对内表面416的径向向外的力722基本上小于瓣膜29对瓣膜座18施加的径向向外的力710。例如,径向向外的密封力722可小于瓣膜施加的径向向外的力710的1/2、小于瓣膜施加的径向向外的力710的1/3、小于瓣膜施加的径向向外的力710的1/4、小于瓣膜施加的径向向外的力710的1/8、或甚至小于瓣膜施加的径向向外的力710的1/10。在一个示例性实施方式中,选择密封部分410的径向向外的力722以在内表面416和密封部分410之间提供密封,但不足以通过其自身保持瓣膜29和对接站10在循环系统中的位置。
在示例性实施方式中,锚定/保持部分414对内表面416的径向向外的力720基本上小于瓣膜29对瓣膜座18施加的径向向外的力710。例如,径向向外的密封力720可小于瓣膜施加的径向向外的力710的1/2、小于瓣膜施加的径向向外的力710的1/3、小于瓣膜施加的径向向外的力710的1/4、小于瓣膜施加的径向向外的力710的1/8、或甚至小于瓣膜施加的径向向外的力710的1/10。
在一个示例性实施方式中,保持部分414的径向向外的力720不足以通过其自身保持瓣膜29和对接站10在循环系统中的位置。相反,血液608的压力用于增强保持部分414保持至内表面416。再次参照图6A,在心脏处于收缩期时,瓣膜29是开放的并且血液如通过箭头602指示流动通过瓣膜。由于瓣膜29是开放的并且血液流动通过瓣膜29,血液对对接站10和瓣膜29施加的压力P如图7A中的小P和箭头指示是低的。虽然小,但是压力P总体上以箭头F指示的方向迫使对接站及其上保持部分414抵靠表面416。此血流协助的由保持部分F向表面416施加的力F防止对接站10和瓣膜29在心脏H的收缩期中以血流方向602移动。
参照图9A,在心脏处于舒张期时,瓣膜29被关闭并且如箭头900指示血流被阻塞。由于瓣膜29被关闭并且瓣膜29和对接站10阻塞血液流动,由血液向对接站10和瓣膜29施加的压力P如图9A中大箭头P指示是高的。此大压力P迫使下保持部分414总体上以由大箭头F指示的方向抵靠表面416。此血流协助的由保持部分F向表面416施加的力F防止对接站10和瓣膜29以箭头900指示的方向移动。
由于由上和下保持部分414施加的力取决于由血液向瓣膜29和对接站10施加的压力的量,因此向表面416施加的力自动成比例。即,上保持部分在心脏处于收缩期时压靠表面416的力比下保持部分在心脏处于舒张期时压靠表面416的力小。这是因为抵靠处于收缩期的开放的瓣膜29和对接站10的压力小于抵靠处于舒张期的关闭的瓣膜和对接站的压力。
瓣膜座18和密封部分410可采取广泛多种不同的形式。例如,瓣膜座18可为不被THV的径向向外的力径向向外扩张或基本上不被THV的径向向外的力径向向外扩张的任意结构(即,处于部署位置/构型的瓣膜座的直径可不扩张或可扩张小于4mm,例如,直径可在瓣膜部署在瓣膜座中时仅扩张1–4mm大)。例如,瓣膜座18可包括对抗或限制扩张的缝线或金属环。然而,在一个实施方式中,瓣膜座18(或本文所述的任意瓣膜座)可在更大的范围内扩张,例如,直径可在瓣膜部署在瓣膜座中时扩张5mm与30mm之间大。在一个实施方式中,直径可从5mm或6mm的直径扩张至20mm–29mm、24mm、26mm、29mm等的直径,或从该范围内的不同直径扩张并扩张至该范围内的不同直径。即使可更加扩张,但是瓣膜座的扩张可仍被限制,例如,被限制以避免瓣膜座扩张超过将被置于瓣膜座的瓣膜的扩张的直径或避免扩张超过将通过在其之间产生的力固定地使瓣膜保持在瓣膜座中的直径。瓣膜座18可为对接站10的主体的部分或限定对接站10的主体的部分,或瓣膜座18可为附接至对接站的主体的单独构件。瓣膜座18可以比瓣膜更长、更短、或与其相同长度。在瓣膜座18由缝线或金属环限定时瓣膜座18可显著短于瓣膜29。由缝线或金属环形成的瓣膜座18可在瓣膜29和对接站之间形成狭窄的周向密封线。
各种实施方式的一个或多个密封部分410可采取广泛多种不同的形式。例如,一个或多个密封部分410可为在对接站10和循环系统的表面416之间提供一个或多个密封的任意结构。例如,一个或多个密封部分410可包括织物、泡沫、生物相容性组织、这些的组合等。一个或多个密封部分410可为对接站10的主体的部分或限定对接站10的主体的部分,和/或一个或多个密封部分410可为附接至对接站的主体的单独构件。对接站10可包括单个密封部分410或两个或多于两个的密封部分。
如上所述,在一个示例性实施方式中,一个或多个密封部分410被配置以向表面416施加低的径向向外的力。低的径向向外的力可以以广泛多种不同的方式提供。例如,密封部分可由非常可压缩的或非常柔顺的材料制成。参照图7C,在一个示例性实施方式中,对接站10主体由弹性或超弹性金属制成。一种这样的金属为镍钛诺。在对接站10的主体由金属支柱的网格制成时,主体可具有弹簧特性。参照图7C,像弹簧一样,在对接站的主体不受约束并被允许松弛至其最大直径时,对接站的主体几乎不施加或不施加径向向外的力。随着对接站10的主体被压缩,像弹簧一样,由对接站施加的径向向外的力增加。如图7C示例的,在一个示例性实施方式中,对接站主体的径向向外的力与对接站的扩张的直径的关系是非线性的,虽然在一个示例性实施方式中,该关系也可以为线性的。在图7C示例的实例中,曲线750示例了由对接站10施加的径向向外的力与对接站的被压缩的直径之间的关系。在区域752中,曲线750具有低斜率。在此区域752中,径向向外的力是低的并且仅小量地变化。在一个示例性实施方式中,区域752与25mm和40mm之间,如27mm和38mm之间的直径对应。区域752中径向向外的力小,但不为零。在区域754中,曲线750具有较高斜率。此区域754中径向向外的力随着对接站的压缩而显著增加。在一个示例性实施方式中,支架的主体被构建在低斜率区域752中。这允许密封部分710在直径的宽泛范围内向循环系统的内表面416仅施加小的径向向外的力。
保持部分414可采取广泛多种不同的形式。例如,一个或多个保持部分414可为将对接站10的位置设定在循环系统中的任意结构。例如,一个或多个保持部分414可压靠内表面416或压入内表面416或在循环系统的解剖结构周围延伸以设定对接站10的位置。一个或多个保持部分414可为对接站10的主体的部分或限定对接站10的主体的部分或者一个或多个保持部分414可为附接至对接站的主体的单独构件。对接站10可包括单个保持部分414或两个或多于两个的保持部分。
图10A-10C示例了对接站10可具有一种或多于一种不同类型的瓣膜座18和密封部分410的任意组合。在图10A示例的实例中,瓣膜座18为附接至对接站10的主体的单独构件,并且密封部分与对接站的主体一体地形成。在图10B示例的实例中,瓣膜座18为附接至对接站10的主体的单独构件,并且密封部分410为附接至对接站的主体的单独构件。在图10C示例的实例中,瓣膜座18与对接站10的主体一体地形成,并且密封部分与对接站的主体一体地形成。在图10D示例的实例中,瓣膜座18与对接站10的主体一体地形成,并且密封部分为附接至对接站10的主体的单独构件。
如上所述,肺动脉PA和循环系统的其它解剖结构的长度可从患者到患者变化很大。参照图11A-11D,在一个示例性实施方式中,如箭头1100指示对接站的长度10是可调节的。此可调节性1100指代对接站的植入的/扩张的长度被调节的能力,而不是在支架从压缩状态扩张至扩张状态时发生的长度的固有变化。可以以广泛多种不同的方式调节长度。在图11A-11D示例的实例中,对接站10包括第一半部1102和第二半部1104。本文有关两个部分的对接站使用的词语“半部”的用法与“部分”同义并且不要求第一和第二半部或第一和第二部分的尺寸相等,即,第一半部可比第二半部大/长,并且反之亦然。在一个实施方式中,可将第二半部1104插入或“套叠”至第一半部1102中。插入或“套叠”的量设定对接站10的长度。本专利申请中所示和所述的任意对接站10的长度可通过由套叠在一起或以其它方式可相对于彼此调节的两个部分制作对接站来调节。在一个实施方式中,单件式对接站的长度是可皱缩和可扩张的。在一个实施方式中,对接站可由可改变形状以调节长度的材料形成。在一个实施方式中,多于两个的部分(例如,3、4、或更多个部分)可以以类似方式组合并包括一个或多个与第一半部1102和第二半部1104类似的特征。
在一个示例性实施方式中,可通过首先在肺动脉中部署对接站10的第一半部1102在肺动脉PA中来调节对接站的长度。例如,可将第一半部1102如所期望的进行定位和扩张,例如,使得第一半部的远端1106与肺动脉的分支对齐或稍微延伸经过肺动脉的分支。在使第一半部1102在肺动脉中扩张后,可以以远端1110设置在第一半部1102的近端1108将压缩的第二半部1104定位。在一个实施方式中,选择第二半部1104的位置使得密封部分410和保持部分414将与肺动脉进行接触并将对接站10的位置设定在肺动脉中。一旦被适当定位,第二半部1104被扩张。在一个实施方式中,第二半部1104的远端1110以摩擦接合第一半部的近端1108以将两个半部1102、1104固定在一起。在一个实施方式中,一个或多个闭锁、闭锁机构、一条或多条缝线、交织、一条或多条链和/或其它附接装置/机构可用于协助将多个半部/部分固定在一起。
在图11A-11D示例的实例中,座18和密封部分410被包括在对接站10的第二半部1104上。然而,在其它实施方式中,座18和/或密封部分410可被包括在第一半部1102上。图11A-11C示例了对接站10的半部1102、1104可具有不同类型的瓣膜座18和密封部分410的任意组合。在图11A示例的实例中,瓣膜座18为附接至对接站半部1104的主体的单独构件,并且密封部分与对接站半部1104的主体一体地形成。在图11B示例的实例中,瓣膜座18为附接至对接站半部1104的主体的单独构件,并且密封部分410为附接至对接站半部1104的主体的单独构件。在图11C示例的实例中,瓣膜座18与对接站半部1104的主体一体地形成,并且密封部分与对接站半部1104的主体一体地形成。在图11D示例的实例中,瓣膜座18与对接站半部1104的主体一体地形成,并且密封部分410为附接至对接站半部1104的主体的单独构件。
图12A-12D示例了具有两个密封部分410的对接站10的示例性实施方式。对接站10可具有一种或多于一种不同类型的瓣膜座18和密封部分410的任意组合。在图12A示例的实例中,瓣膜座18为附接至对接站10的主体的单独构件,并且密封部分410与对接站的主体一体地形成。在图12B示例的实例中,瓣膜座18为附接至对接站10的主体的单独构件,并且密封部分410为附接至对接站的主体的单独构件。在图12C示例的实例中,瓣膜座18与对接站10的主体一体地形成,并且密封部分与对接站的主体一体地形成。在图12D示例的实例中,瓣膜座18与对接站10的主体一体地形成,并且密封部分为附接至对接站10的主体的单独构件。
图13A-13D示例了图12A-12D示例的对接站可为两件式(two-piece)伸缩式对接站。对接站10的件1102、1104可具有在两个件之一上或在两个件两者上的一种或多于一种不同类型的瓣膜座18和密封部分410的任意组合。在图13A示例的实例中,第一半部1102包括一体式密封部分410。第二半部1104包括瓣膜座18,其为附接至对接站10的主体的单独构件,并且密封部分410与对接站的主体一体地形成。在图13B示例的实例中,第一半部1102包括与第一半部102的主体分离的密封部分410。瓣膜座18为附接至对接站10的主体的单独构件,并且密封部分410为附接至对接站的主体的单独构件。在图13C示例的实例中,第一半部1102包括一体式密封部分410。瓣膜座18与对接站10的第二半部1104的主体一体地形成,并且密封部分410与第二半部1104的主体一体地形成。在图12D示例的实例中,第一半部1102包括与第一半部102的主体分离的密封部分410。瓣膜座18与对接站10的第二半部1104的主体一体地形成,并且密封部分410为附接至第二半部1104的主体的单独构件。
参照图14A-14G,在一个示例性实施方式中,对接站10可包括血液可如箭头1402指示流动通过的能渗透部分1400和血液不能流动通过的不能渗透部分1404。在一个示例性实施方式中,不能渗透部分1404从至少密封部分410延伸至瓣膜座18以防止血液在瓣膜29周围流动。在一个示例性实施方式中,能渗透部分1400允许血液自由流动通过其,使得不密封抵靠循环系统的内表面416或不密封抵靠瓣膜29的对接站的部分不阻塞血液流动。例如,对接站10可延伸至肺动脉的分支中,并且延伸至肺动脉中的对接站10的部分1400自由地允许血液流动通过对接站10。在一个示例性实施方式中,能渗透部分1400允许血液自由地流动通过其,使得对接站和循环系统之间的区域1420随心脏跳动用血液冲洗,从而防止血液在区域1420中停滞。
不能渗透部分1404可采取广泛多种不同形式。不能渗透部分1404可为防止血液流动通过不能渗透部分1404的任意结构或材料。例如,对接站10的主体可由丝或网格诸如镍钛诺丝或网格形成,并且主体的室由不能渗透材料覆盖(参见图18)。广泛多种不同材料可用作不能渗透材料。例如,不能渗透材料可为血液不能渗透的织布,如PET织布或生物相容性覆盖材料诸如用不能渗透血液的涂层处理的织物、聚酯、或加工的生物材料诸如心包。
图14A-14G示例了广泛多种对接站构型可提供有能渗透部分1402。密封部分410可如图14B、14D、和14F示例与对接站的主体一体地形成,或如图14C、14E和14G示例是分离的。在图14F和14G中,对接站10包括部分1410。这些部分1410类似于密封部分410,但不与循环系统的内表面416一起形成密封,因为部分1410是能渗透部分1402的部分。瓣膜座18可如图14A-14C示例与对接站的主体单独地形成,或如图14D-14G示例与对接站10的主体一体地形成。
图15A、15B、16、17A、和17B示例了框架1500或对接站10的主体的示例性实施方式。框架1500或主体可采取广泛多种不同的形式,并且图15A、15B、16、17A、和17B只示例了多种可能构型中的一种。在图15A、15B、16、17A、17B、和18示例的实例中,对接站10具有相对较宽的近侧流入端12和远侧流出端14,以及在末端12、14之间形成座18的相对较窄的部分16。在图15A、15B、17A、和17B示例的实例中,对接站10的框架1500优选地为由形成室1504的多个金属支柱1502构成的宽支架。在图15A、15B、17A、和17B的实例中,框架1500具有总体上为沙漏的形状,其具有狭窄部分16,狭窄部分16在被不能渗透材料在近端12和远端14之间覆盖时形成瓣膜座18。如下所述,瓣膜18在形成瓣膜座18的狭窄部分16中延伸。
图15A、15B、17A、和17B示例了处于其无约束、扩张情况下的框架1500。在此示例性实施方式中,保持部分414包括近端12和远端14处的金属支柱1502的末端1510。密封部分410处于保持部分414和腰部16之间。在无约束情况下,保持部分414总体上径向向外延伸并且径向向密封部分410之外。图16示例了处于压缩状态用于通过导管递送和扩张的框架16。对接站可由非常弹性或非常柔顺的材料制成以适应解剖结构中的大变化。例如,对接站可由高挠性金属、金属合金、聚合物、或开孔泡沫制成。高弹性金属的实例为镍钛诺,但可以使用其它金属和高弹性或高柔顺的非金属材料。对接站10可自扩张、可手动扩张(例如,可通过球囊扩张)、或可机械扩张。自扩张对接站10可由形状记忆材料诸如——例如,镍钛诺——制成。
图18示例了框架1500,不能渗透材料21附接至框架1500以形成对接站10。参照图18,在一个示例性实施方式中,条带20围绕腰部或狭窄部分16延伸,或是与腰部成一体以形成不可扩张或基本上不可扩张的瓣膜座18。条带20使腰部变硬,并且一旦部署并扩张对接站,使腰部/瓣膜座在其部署构型中相对不可扩张。在图19示例的实例中,瓣膜29通过其可皱缩框架扩张至对接站10的形成瓣膜座18的狭窄部分16中而被固定。如上说明的,不可扩张或基本上不可扩张的瓣膜座18防止瓣膜29的径向向外的力被转移至循环系统的内表面416。然而在另一示例性实施方式中,部署的对接站的腰部/瓣膜座可在瓣膜抵靠其部署时任选地以弹性样式(fashion)稍微扩张。腰部18的此任选的弹性扩张可在瓣膜29上施加压力以协助将瓣膜29保持在对接站内的适当位置。
条带可采取广泛多种不同的形式并可由广泛多种不同材料制成。条带20可由以下制成:PET、一条或多条缝线、织物、金属、聚合物、生物相容性带(tape)、或本领域已知的足以维持瓣膜座18的形状并保持瓣膜29在适当位置的其它相对不可扩张的材料。条带可围绕支架的外部延伸,或可为其的一体式部分,如在将织物或另一材料相互编织至支架的室中或相互编织通过支架的室时。条带20可以狭窄,如图18中的缝线条带,或可以更宽。条带可为各种宽度、长度、和厚度。在一个非限制性实例中,瓣膜座18的宽在27-28mm之间,虽然瓣膜座的直径应在将被固定在瓣膜座18内的特定瓣膜29的操作范围内,并且可不同于前述实例。在对接在对接站内时,瓣膜29可任选地在瓣膜座的任一侧周围稍微扩张。此方面,有时被称为“犬骨”(dogbone)(例如,由于其在瓣膜座或条带周围形成的形状),还可协助保持瓣膜在适当位置。
图20和21示例了植入循环系统中——如肺动脉中——的图18的对接站10。密封部分410在对接站10和循环系统的内表面416之间提供了密封。在图20和21的实例中,通过在框架1500或其部分之上提供不能渗透材料21(参见图21)形成密封部分410,具体地,密封部分410可包括框架1500的下方的、圆的、径向向外延伸的部分2000。在示例性实施方式中,不能渗透材料21从框架1500的至少部分2000延伸至瓣膜座18。这使对接站从密封部分410至瓣膜座18是不能渗透的。因此,以流入方向12向流出方向14流动的所有血液被导向至瓣膜座18(和一旦安装或部署在瓣膜座中的瓣膜29)。
在对接站10的优选实施方式中,流入部分具有不能渗透血液的壁,但流出部分壁是相对开放的。在一种方法中,流入端部分12、中间区段16、和流出端部分14的部分覆盖有不能渗透血液的织物21,其可缝在支架上或通过本领域已知方法另外附接。支架的流入部分的不能渗透性协助血液以灌入漏斗的方式(funnel)进入对接站10中并最终流动通过将被扩张并被固定在对接站10内的瓣膜。
从另一角度看,设计对接站的该实施方式以在近侧流入区段2000密封以产生导管用于血液流动。然而,远侧流出区段总体上保留开放的,从而允许对接站10置于肺动脉中的较高位置而不限制血液流动。例如,能渗透部分1400可延伸至肺动脉的分支中并且不阻碍或不显著阻碍血液流动经过分支。在一个实施方式中,血液不能渗透的织布,诸如例如PET织布,或其它材料覆盖近侧流入区段,但该覆盖物不覆盖任何远侧流出区段14或远侧流出区段14的至少部分。作为一个非限制性实例,在将对接站10置于为大血管的肺动脉中时,流动通过动脉的显著体积的血液通过织布覆盖物21以灌入漏斗的方式进入瓣膜29。织布21是流体不能渗透的,使得血液不能穿过。再次,可利用各种其它的生物相容性覆盖材料,诸如,例如用不能渗透血液的涂层处理的泡沫或织物、聚酯、或加工的生物材料诸如心包。
在图21示例的实例中,对接站框架1500的更多提供有不能渗透材料21,形成相对大的不能渗透部分1404。在图21示例的实例中,不能渗透部分1404从流入端12延伸并在流出端之前的一排室1504停止。因此,最远侧的那排室1504形成能渗透部分1400。然而,更多排室1504可不被不能渗透材料覆盖以形成更大的能渗透部分。能渗透部分1400允许血液如箭头2132指示流至区域2130中并从区域2130中流出。有关流入端12,应当注意由于室1504总体上是菱形的,因此血液能够在对接站10和表面416之间流动,直至到达密封部分410。即,在一个示例性实施方式中,血液可流至区域2100中并从区域2100中流出。
瓣膜座18可提供支撑表面用于将瓣膜29植入或部署在对接站10中。保持部分414可使对接站10保持在循环系统中的植入位置或部署位点。示例的保持部分具有向外弯曲的张开部分(flare),其协助使对接站10固定在动脉内。本文使用的“向外”意为远离对接站的中心纵轴延伸。如图20中可见,在对接站10被内表面416压缩时,保持部分414以可在30度与60度之间如约45度的角度α(与表面的垂直线至保持部分414的表面中点的切线)接合表面416,而非如未压缩情况下(参见图15B)基本上径向向外延伸(即α为0度至20度或约10度)。如箭头2020指示的保持部分414的该向内弯曲起到使对接站10保持在循环系统中的作用。保持部分14处在较宽的流入端部分12和流出端部分14并压靠内表面416。张开的保持部分414接合至循环系统中的周围解剖结构中,如肺动脉(pulmonic)空间中。在一个示例性实施方式中,张开部分充当止动件,其将装置锁定在适当位置。在向对接站10施加轴向力时,张开的保持部分414被力推至周围组织中以抵抗支架的移动,如下文更详细地描述。在特定实施方式中,对接站总体上具有沙漏形状,具有较宽的远端部分和近端部分,远端部分和近端部分具有张开的保持部分,以及在末端之间的狭窄、绑扎的腰部,瓣膜被扩张至其中。
图22示例了部署在循环系统中的对接站10和部署在对接站10中的瓣膜29。在将对接站10部署后,瓣膜29处于压缩形式并被引入对接站10的瓣膜座18中。在对接站中使瓣膜29扩张,使得瓣膜29接合瓣膜座18。在图22示例的实例中,对接站10比瓣膜长。然而,在一个实施方式中,对接站10可以是与瓣膜10的长度相同的长度或比瓣膜10的长度短。
可通过常规手段将瓣膜29递送至对接站的位点,如通过球囊扩张或机械扩张或者通过自扩张。在将瓣膜29扩张时,其嵌套在对接站10的瓣膜座中。在一个实施方式中,绑扎的腰部稍微具有弹性并对瓣膜29施加弹力,以协助将THV保持在适当位置。
图23A和23B示例了对接站10可用于适应各种不同尺寸的循环系统解剖结构以植入具有一致尺寸的瓣膜29。在图23A和23B的实例中,相同尺寸的对接站10部署在两个不同尺寸的血管2300、2302中,如两个不同尺寸的肺动脉PA。在实例中,图23A示例的血管2300具有比图23B示例的血管2302大的有效直径。(注意本专利申请中循环系统的解剖结构的尺寸通过术语“直径”或“有效直径”来指代。循环系统的解剖结构通常不是圆形的。术语“直径”和“有效直径”在本文指代可被变形以适配在非圆形解剖结构内的圆形物或圆盘的直径。)在图23A和23B示例的实例中,密封部分410和保持部分414顺应接触每一个血管2300、2302。然而,瓣膜座18保持相同尺寸,虽然密封部分410和保持部分414被压缩。以此方式,对接站10适应广泛多种不同解剖尺寸以植入标准的或单一尺寸的瓣膜。例如,对接站可顺应25mm和40mm如27mm和38mm的血管直径,并提供24mm至30mm如27mm至28mm的恒定或基本上恒定直径的瓣膜座。然而,瓣膜座10可适于血管直径大于或小于25mm至40mm的情况下的应用并提供大于或小于24mm至30mm的瓣膜座。
参照图23A和23B,条带20维持瓣膜座18的直径恒定或基本上恒定,即使在对接站的近端和远端扩张至与内表面416接合所需的各自直径时。肺动脉PA的直径可从患者到患者极大地变化,但处于部署构型的瓣膜座18始终具有处在瓣膜29的可接受范围内的直径。
图24和25示例了在植入循环系统的不同尺寸的血管2300、2302中时图18示例的对接站10的侧面轮廓,示意性示例的经导管心脏瓣膜29具有安装或部署在每一个对接站10中的相同尺寸。在此实例中,对接站10都容纳具有各种不同尺寸的血管2300、2302,并充当防止或基本上防止瓣膜29的径向向外的力被转移至血管的隔离器。瓣膜座18不被瓣膜29的径向向外的力径向向外扩张或基本上不被瓣膜29的径向向外的力径向向外扩张,并且锚定/保持部分414和密封部分410在血管2300、2302上仅赋予相对小的径向向外的力(相比于瓣膜29向瓣膜座18施加的径向向外的力),甚至在将对接站部署在具有更小直径的血管2302中时。
在图24和25示例的实例中,瓣膜29的支架或框架712径向向外扩张或被径向向外扩张以在对接站10的瓣膜座18上输入高的力710。此高的径向向外的力710将瓣膜29固定至对接站10的瓣膜座18。然而,由于瓣膜座18不被力710扩张或基本上不被力710扩张,因此力710被从循环系统中隔离,而非被用于使对接站固定在循环系统中。
在示例性实施方式中,密封部分410对较大血管2300和较小血管两者的径向向外的力722基本上小于瓣膜29向瓣膜座18施加的径向向外的力710。例如,对于用于瓣膜植入的对接站10将适应的最小血管,径向向外的密封力722可小于瓣膜施加的径向向外的力710的1/2、小于瓣膜施加的径向向外的力710的1/3、小于瓣膜施加的径向向外的力710的1/4、小于瓣膜施加的径向向外的力710的1/8或甚至小于1/10。在一个示例性实施方式中,选择密封部分410的径向向外的力722以在内表面416和密封部分410之间提供密封,但不足以通过其自身保持瓣膜29和对接站10在循环系统中的位置。在一个实施方式中,径向向外的力722足以保持瓣膜29和对接站10在循环系统中的位置。
在示例性实施方式中,图18示例的对接站10还包括锚定/保持部分414,其施加的径向向外的力720基本上小于瓣膜29向瓣膜座18施加的径向向外的力710。例如,对于用于瓣膜植入的对接站10将适应的最小血管,径向向外的密封力720可小于瓣膜施加的径向向外的力710的1/2、小于瓣膜施加的径向向外的力710的1/3、小于瓣膜施加的径向向外的力710的1/4、小于瓣膜施加的径向向外的力710的1/8或甚至小于瓣膜施加的径向向外的力710的1/10。在一个实施方式中,锚定/保持部分414的径向向外的力720不足以通过其自身保持瓣膜29和对接站10在循环系统中的位置。在一个实施方式中,径向向外的力720足以保持瓣膜29和对接站10在循环系统中的位置。
在一个示例性实施方式中,对接站10的框架1500由弹性或超弹性材料或金属制成。一种这样的金属为镍钛诺。在对接站10的框架1500由金属支柱的网格制成时,主体可具有弹簧特性。参照图7C,像弹簧一样,在图24和25示例的对接站10的框架1500不受约束并被允许松弛至其最大直径时,对接站的框架几乎不施加或不施加径向向外的力。随着对接站10的框架1500被压缩,像弹簧一样,由对接站施加的径向向外的力增加。如图7C示例的,在一个示例性实施方式中,对接站框架1500的径向向外的力与对接站的扩张的直径的关系是非线性的,虽然其也可以是线性的。在图7C示例的实例中,曲线750示例了由对接站10施加的径向向外的力与对接站的压缩的直径之间的关系。在区域752中,曲线750具有低斜率。在该区域752中,径向向外的力低并仅小量变化。在一个示例性实施方式中,区域752与在25mm和40mm之间——如在27mm和38mm之间——的直径对应。区域752中径向向外的力小,但不为零。在区域754中,曲线750具有较高斜率。在此区域754中,径向向外的力随着对接站被压缩而显著增加。在一个示例性实施方式中,针对被对接站10适应的最大血管2300(图24)和最小血管2302(图25)两者,将支架的主体构建在低斜率区域752中。这允许密封部分710在直径的宽泛范围内向循环系统的内表面416仅施加小的径向向外的力。
图26A-26C示例了植入肺动脉中的图18的对接站10。图26A示例了植入肺动脉PA中的对接站10的轮廓。图26B示例了植入肺动脉PA中的对接站10的轮廓,其中示意性示例的瓣膜29安装或部署在对接站10中。图26C示例了植入肺动脉PA中的图22所描绘的对接站10和瓣膜29。如有关图2A-2E和3A-3D提及的,肺动脉的形状可沿其长度显著变化。在一个示例性实施方式中,对接站10被配置以顺应肺动脉PA的变化形状。对接站10被示例为定位在肺动脉分叉或分支的下方。然而,通常将使对接站10定位使得末端14延伸至肺动脉分叉210中。在考虑对接站10将延伸至肺动脉分叉中时,对接站10可具有血液能渗透部分1400(例如,如图21中所示)。
图27示例了对接站10的另一示例性实施方式。对接站10包括框架2700和外部密封部分410。框架2700或主体可采取广泛多种不同的形式,并且图27仅示例了多种可能构型中的一种。在图27示例的实例中,对接站10具有相对较宽的近侧流入端12和远侧流出端14,以及细长的相对较窄的部分2716。可在沿细长的相对狭窄的部分2716的长度的任意位置提供座18和密封部分410。在图27示例的实例中,对接站10的框架2700优选地为由形成室1504的多个金属支柱1502构成的支架。框架2700或框架的一个或多个部分可任选地由不能渗透材料21覆盖(例如,如图18中所示)。
图27示例了处于其无约束、扩张的情况/构型或部署构型的框架2700和密封部分410。在此示例性实施方式中,保持部分414包括近端12和远端14处的金属支柱1502的末端1510。密封部分410可为在保持部分414之间的框架2700周围设置的单独构件。在无约束的情况下,保持部分414总体上径向向外延伸并可径向在密封部分410之外。
图27示例的对接站10可由非常弹性或非常柔顺的材料制成以适应解剖结构中的大变化。例如,对接站可由高挠性金属(例如,图27实例中的框架)和织布和/或开孔泡沫(例如,图27实例中的密封部分)制成。高弹性金属的实例为镍钛诺,但可以使用其它金属和高弹性或高柔顺非金属材料。可使用的开孔泡沫的实例为生物相容性泡沫,如聚氨酯泡沫(例如,如可从Biomerix,Rockville,MD获得)。在一个实施方式中,形成密封部分的泡沫还可在其内表面上形成瓣膜座。
仍参照图27,框架2700和/或单独的密封部分410可包括任选的条带20以形成不可扩张或基本上不可扩张的瓣膜座18。在另一示例性实施方式中,框架2700可被配置以在瓣膜座18的区域中在不使用条带20的情况下基本上不可扩张。任选的条带20使框架2700和/或密封部分变硬并使瓣膜座相对不可扩张。
任选的条带20可采取广泛多种不同的形式、可由广泛多种不同的材料制成、以及可与本公开中别处讨论的条带相同或类似。条带20可由以下制成:PET、一条或多条缝线、织物、金属、聚合物、生物相容性带、或本领域已知的足以维持瓣膜座18的形状并使瓣膜29保持在适当位置的其它相对不可扩张的材料。条带可围绕支架的外部延伸,或可成为其的一体部分,如在将织物或另一材料相互编织至支架的室中或相互编织通过支架的室时。条带20可以是狭窄的,如图18中的缝线条带,或可如图27中的虚线所示更宽。在一个非限制性实例中,瓣膜座18的直径在27-28mm之间,虽然瓣膜座的直径应在将被固定在瓣膜座18内的特定瓣膜29的操作范围内并可不同于前述实例。
图28和29示例了长度上可扩张的图27示例的对接站10的改进版本。如上所述,肺动脉PA和循环系统的其它解剖结构的长度可从患者到患者变化很大。参照图29,在一个示例性实施方式中,对接站10的长度如箭头1100指示是可调节的。可以以广泛多种不同的方式调整长度,例如,可以以本公开中别处所述的任意方式对其调节。在图28和29示例的实例中,对接站10包括第一半部1102和第二半部1104。第二半部1104可插入或“套叠”至第一半部1102中。插入或“套叠”的量设定对接站10的长度。
在一个示例性实施方式中,通过首先在肺动脉中部署对接站10的第一半部1102来在肺动脉PA中调节对接站10的长度。例如,可将第一半部1102定位并扩张使得第一半部的远端1106与肺动脉的分支对齐或稍微延伸经过肺动脉的分支。在使第一半部1102在肺动脉中扩张后,以远端1110设置在第一半部1102的近端1108将压缩的第二半部1104定位。选择第二半部1104的位置使得密封部分410和保持部分414将与肺动脉进行接触并将设定对接站10在肺动脉中的位置。一旦被适当定位,第二半部1104被扩张。第二半部1104的远端1110以摩擦接合第一半部的近端1108以将两个半部1102、1104固定在一起。在一个实施方式中,一个或多个闭锁、闭锁机构、一条或多条缝线、交织、一条或多条链和/或其它附接装置/机构(也或可选地)可用于使两个半部固定在一起。
在图28和29示例的实例中,座18和密封部分410被包括在对接站10的第一半部1102上。然而,在其它实施方式中,座18和/或一个或多个密封部分410可被包括在第二半部1104上或在第一半部和/或第二半部上的不同位置中。
图30和31A示例了植入循环系统中——如肺动脉PA中——的图27和图28和29的对接站10。密封部分410在对接站10和肺动脉PA的内表面416之间提供密封。在图30和31A的实例中,密封部分410为扩张材料,如在框架2700之上的可扩张开孔泡沫。在示例性实施方式中,密封部分410与瓣膜座18重合或至少重叠。在密封部分410不与瓣膜座18重叠时,可将不能渗透材料21提供在框架的部分之上(例如,从密封部分410至瓣膜座18以制作从密封部分410至瓣膜座18不能渗透的对接站)。不管密封部分410与瓣膜座10重叠还是从密封部分410至瓣膜座18提供不能渗透材料,以流入方向12向流出方向14流动的所有血液都被导向至瓣膜座18(和一旦安装或部署在瓣膜座中的瓣膜29)。
在对接站10的一个示例性实施方式中,框架2700的至少流出部分14是相对开放的。参照图31A,这允许对接站10置于肺动脉中的较高位置而不限制血液流动。例如,开放室1504可延伸至肺动脉的分支或分叉并且不阻碍或不显著阻碍血液流动经过分支。开放室1504允许血液如图31A中箭头3132指示流动通过框架1500。
在图30和31A示例的实例中,通过使一个或多个保持部分414径向向外扩张至其中内表面416也向外延伸的肺动脉PA的区域210、212中将对接站10保持在肺动脉PA中。例如,保持部分414可被配置以径向向外延伸至肺动脉分叉210和/或通往右心室RV的肺动脉的开口212中。在一个示例性实施方式中,对接站10可为可调节的对接站。例如,对接站10可为如图28示例的伸缩式对接站,并且将第一部分1102部署使得保持部分414径向向外延伸至肺动脉分叉210中)。然后可将第二部分1104定位在第一部分1102中使得其保持部分414与肺动脉的开口或肺动脉的另一向外延伸的区域重合。一旦处于适当位置,可将第二部分1104扩张以将第二区段1104固定至第一区段1102并在开口212或其它向外延伸的区域处将第二区段固定至肺动脉。
参照图31B,瓣膜座18提供了支撑表面以将瓣膜29安装或部署在对接站10中。可利用在此或本公开中别处公开的步骤将瓣膜安装或部署在瓣膜座中。锚定/保持部分414使对接站10保持在循环系统中的植入或部署位点/位置。在将对接站10部署后,瓣膜29处于压缩形式并可被引入对接站10的瓣膜座18中。可在对接站中扩张瓣膜29,使得瓣膜29接合瓣膜座18。可通过常规手段,如通过球囊扩张或机械扩张或者通过自扩张来将瓣膜29递送至对接站的位点。在将瓣膜29扩张时,其嵌套在对接站10的瓣膜座中。
参照图32A,图18示例的对接站部署在心脏H的肺动脉PA中。图32B示例了部署在图32A示例的对接站10中的一般性示例的瓣膜29。在图32A和32B中,心脏处于收缩期。图33A为图32B的肺动脉29中的对接站10和瓣膜29的放大表示。在心脏处于收缩期时,瓣膜29打开。血液如箭头3202指示从右心室RV流动并通过肺动脉PA、对接站10、和瓣膜29。图33B示例了在心脏处于收缩期时表示瓣膜29开放的空间3208。图33B未显示对接站10和肺动脉之间的界面以简化附图。图33B中的交叉影线示例了通过开放的瓣膜的血流。在示例性实施方式中,通过密封410防止血液在肺动脉PA和对接站10之间流动并通过瓣膜29在对接站10的座18中的就座防止血液在对接站10和瓣膜29之间流动。在此实例中,血液在心脏处于收缩期时基本上只流动或只能流动通过瓣膜29。
图34示例了在心脏处于舒张期时图32B示例的瓣膜29、对接站10和心脏H。参照图34,在心脏处于舒张期时,瓣膜29关闭。图35A为图34的肺动脉29中的对接站10和瓣膜29的放大表示。瓣膜29上方的肺动脉PA中(即肺动脉分支210中)的血流被处于关闭并阻塞如箭头3400指示的血流的瓣膜29阻塞。图35B中的实心区域3512表示在心脏处于舒张期时瓣膜29处于关闭。
参照图33A,锚定/保持部分414对内表面416的径向向外的力720基本上小于瓣膜29向瓣膜座18施加的径向向外的力710。例如,径向向外的密封力720可小于瓣膜施加的径向向外的力710的1/2、小于瓣膜施加的径向向外的力710的1/3、小于瓣膜施加的径向向外的力710的1/4、小于瓣膜施加的径向向外的力710的1/8或甚至小于瓣膜施加的径向向外的力710的1/10。
参照图33A和35A,在一个示例性实施方式中,保持部分414的径向向外的力720不足以通过其自身保持瓣膜29和对接站10在循环系统中的位置。相反,血液3208的压力用于增强保持部分414至内表面416的保持。再次参照图33A,在心脏处于收缩期时,瓣膜29开放并且血液如箭头3202指示流动通过瓣膜。由于瓣膜29开放并且血液流动通过瓣膜29,血液对对接站10和瓣膜29施加的压力P如图33A中的小P和箭头指示是低的。虽然小,但是压力P总体上以箭头F(小F表示相对低的力)指示的方向迫使对接站及其上保持部分414抵靠表面416。此血流协助的由保持部分F向表面416施加的力F防止对接站10和瓣膜29在心脏H的收缩期中以血流方向3302移动。
参照图35A,在心脏处于舒张期时,瓣膜29被关闭并且如箭头3400指示血流被阻塞。由于瓣膜29被关闭并且瓣膜29和对接站10阻塞血液流动,由血液向对接站10和瓣膜29施加的压力P如图35A中大箭头P指示是高的。此大压力P迫使下保持部分414总体上以由大箭头F(大F表示相对更大的力)指示的方向抵靠表面416。此血流协助的由保持部分F向表面416施加的力F防止对接站10和瓣膜29以箭头3400指示的方向移动。
参照图33A和35A,由于由上和下保持部分414施加的力取决于由血液向瓣膜29和对接站10施加的压力的量,因此向表面416施加的力自动成比例。即,上保持部分在心脏处于收缩期时压靠表面416的力比下保持部分在心脏处于舒张期时压靠表面416的力小。这是因为在收缩期中抵靠开放的瓣膜29和对接站10的压力小于在舒张期时抵靠关闭的瓣膜和对接站的压力。
治疗患者的方法(例如,治疗心脏瓣膜功能障碍/回流/等等的方法)可包括各种步骤,包括与将对接站引入和部署在所期望的位置/治疗区域中以及将瓣膜引入和部署在对接站中相关的步骤。例如,图36A示例了通过导管3600部署的图18示例的对接站。可以以广泛多种不同的方式定位和部署对接站10。进入(access)可通过股静脉获得或者进入可以是经皮的。总体上,可以使用导向至肺动脉的任何血管路径。在一个示例性实施方式中,通过股静脉、下腔静脉、三尖瓣和右心室RV的方式将导丝及随其后的导管3600推进至肺动脉PA。可将对接站10置于右心室流出道/肺动脉PA中以产生用于瓣膜29(例如,经导管心脏瓣膜)的人造导管和着陆区。
参照图36B,图18示例的对接站部署在心脏H的肺动脉(PA)中。图36C示例了部署在图32A示例的对接站10中的瓣膜29。在图36C、37A、38、39A、和39B示例的实例中,瓣膜29被描绘为Edwards Lifesciences提供的SAPIEN 3THV;然而,也可使用各种其它瓣膜。在图36A-36C中,心脏处于收缩期。图37A为图36C的肺动脉29中的对接站10和瓣膜29的放大表示。在心脏处于收缩期时,瓣膜(例如,Sapien 3瓣膜)是开放的。血液从右心室RV流动并如箭头3202指示通过肺动脉PA、对接站10、和瓣膜。图37B示例了在心脏处于收缩期时表示瓣膜开放的空间3208。图37B未显示对接站10与肺动脉之间的界面以简化附图。图37B中的交叉影线示例了通过瓣膜的血流。在示例性实施方式中,密封410防止血液在肺动脉PA和对接站10之间流动,并且瓣膜在对接站10的座18中的就座防止血液在对接站10和瓣膜之间流动。在此实例中,血液在心脏处于收缩期时基本上只流动或只能流动通过瓣膜。
图38示例了在心脏处于舒张期时图36C示例的瓣膜29、对接站10和心脏H。参照图38,在心脏处于舒张期时,瓣膜29关闭。图39A为图38的肺动脉29中的对接站10和瓣膜(例如,Sapien 3瓣膜)的放大表示。瓣膜29上方的肺动脉PA中(即肺动脉分支210中)的血流被处于关闭并阻塞如箭头3400指示的血流的瓣膜29阻塞。图39B中的实心区域3512表示在心脏处于舒张期时瓣膜29处于关闭。
参照图39A,锚定/保持部分414对内表面416的径向向外的力720基本上小于瓣膜(例如,Sapien 3瓣膜)向瓣膜座18施加的径向向外的力710。例如,径向向外的密封力720可小于瓣膜施加的径向向外的力710的1/2、小于瓣膜施加的径向向外的力710的1/3、小于瓣膜施加的径向向外的力710的1/4、小于瓣膜施加的径向向外的力710的1/8或甚至小于瓣膜施加的径向向外的力710的1/10。29mm尺寸的Sapien 3瓣膜一般施加约42牛顿的径向向外的力710。在一个实施方式中,本文所述部署的对接站或部署的对接站的一个或多个部分的径向向外的力可为约4至16牛顿之间,虽然其它力也是可能的。
图40A示例了通过导管3600部署的图27或28示例的对接站。参照图40B,图27或28示例的对接站部署在心脏H的肺动脉PA中。图40C示例了部署在图40A示例的对接站10中的瓣膜29。在图36C、37A、38、39A、和39B示例的实例中,瓣膜29为Edwards Lifesciences提供的SAPIEN 3THV,虽然可以使用各种不同的瓣膜。在图40A-40C中,心脏处于收缩期。图41A为图40C的肺动脉29中的对接站10和瓣膜29的放大表示。在心脏处于收缩期时,血液从右心室RV流动并如箭头3202指示通过肺动脉PA、对接站10、和瓣膜29。图41B示例了在心脏处于收缩期时表示瓣膜29开放的空间3208。图41B未显示对接站10与肺动脉之间的界面以简化附图。图41B中的交叉影线示例了通过瓣膜29的血流。在示例性实施方式中,密封410防止血液在肺动脉PA和对接站10之间流动,并且瓣膜在对接站10的座18中的就座防止血液在对接站10和瓣膜29之间流动。在此实例中,血液在心脏处于收缩期时基本上只流动或只能流动通过瓣膜。
图42示例了在心脏处于舒张期时图40C示例的瓣膜29、对接站10和心脏H。参照图42,在心脏处于舒张期时,瓣膜29关闭。图43A为图42的肺动脉29中的对接站10和瓣膜29的放大表示。瓣膜29上方的肺动脉PA中(即肺动脉分支210中)的血流被处于关闭并阻塞如箭头3400指示的血流的瓣膜29阻塞。图43B中的实心区域3512表示在心脏处于舒张期时瓣膜29关闭。
参照图43A,通过使一个或多个保留/锚定部分414径向向外扩张至其中内表面416也向外延伸的肺动脉PA的区域210、212中,将对接站10保持在肺动脉PA中。例如,保持部分414可被配置以径向向外延伸至肺动脉分叉210和/或通往右心室RV的肺动脉的开口212中。在一个示例性实施方式中,对接站10可为可调节的和/或多构件的对接站。例如,对接站10可为如图28示例的伸缩式对接站,并且可将第一部分1102部署使得保持部分414径向向外延伸至肺动脉分叉210中,并可将第二部分1104定位在第一部分1102中使得其保持部分414与肺动脉的开口212重合。保持部分414至区域210、212中的延伸使对接站10的位置设定在肺动脉PA中并协助防止图43A中所示压力P移动对接站。
与对接站10一起使用的瓣膜29可采取广泛多种不同的形式。在一个示例性实施方式中,瓣膜29被配置以通过导管植入心脏H中。例如,瓣膜29可以是可扩张且可皱缩的以促进心脏内的经导管施用。然而,在其它实施方式中,瓣膜29可被配置用于手术施用。类似地,可利用经导管施用/放置或手术施用/放置来放置本文所述的对接站。
图44-48示例了可使用的多种瓣膜或瓣膜构型中的几个实例。可使用任意瓣膜类型并且传统上以手术方式施用的一些瓣膜可被改进用于经导管植入。图44示例了美国专利号8,002,825(其通过引用以其全部内容并入本文)中所示和所述的用于经导管植入的可扩张瓣膜29。公开的专利合作条约申请号WO 2000/42950(其通过引用以其全部内容并入本文)中显示和描述了三小叶瓣膜的实例。美国专利号5,928,281(其通过引用以其全部内容并入本文)中显示和描述了三小叶瓣膜的另一实例。美国专利号6,558,418(其通过引用以其全部内容并入本文)中显示和描述了三小叶瓣膜的另一实例。图45-47示例了可扩张三小叶瓣膜29的示例性实施方式,如Edwards SAPIEN经导管心脏瓣膜。参照图45,在一个示例性实施方式中,瓣膜29包括包含压缩在框架712内的三小叶瓣膜4500(参见图46)的框架712。图46示例了扩张的框架712和处于开放情况下的瓣膜29。图47示例了扩张的框架712和处于关闭情况下的瓣膜29。图48A、48B、和48C示例了美国专利号6,540,782(其通过引用以其全部内容并入本文)中所示和所述的可扩张瓣膜29的实例。美国专利号3,365,728(其通过引用以其全部内容并入本文)中显示和描述了瓣膜的实例。美国专利号3,824,629(其通过引用以其全部内容并入本文)中显示和描述了瓣膜的另一实例。美国专利号5,814,099(其通过引用以其全部内容并入本文)中显示和描述了瓣膜的另一实例。任意这些或其它的瓣膜可用作本文公开的各种实施方式中的瓣膜29。
图49A、49B和50A-50D示例了用于递送和部署对接站10的导管3600的示例性实施方式的远侧部分。导管3600可采取广泛多种不同的形式。在示例的实例中,导管3600包括外管/外套筒4910、内管/内套筒4912、连接至内管4912的对接站连接器4914、以及通过连接管4916连接至对接站连接器4914的细长鼻锥体28。
可将对接站10设置在外管/外套筒4910内(参见图49B)。细长腿5000可将对接站10连接至对接站连接器4914(参见图49B)。细长腿5000可为比保持部分414的其余部分长的保持部分。导管3600可在导丝5002之上通行(route)以将对接站10定位在递送位点。
参照图50A-50D,外管4910关于内管4912、对接站连接器4914、和细长鼻锥体28被渐进缩回以部署对接站10。在图50A中,对接站10开始从外管4910扩张。在图50B中,对接站10的远端14从外管4910扩张。在图50C中,对接站10被扩张至外管之外,除了细长腿5000仍由对接站连接器4914保持在外管4910中。在图50D中,对接站连接器4914从外管4910延伸以释放腿5000,从而充分部署对接站。在将对接站部署在循环系统期间,可利用类似步骤并且可以类似方式部署对接站。
图51和54示例了鼻锥体28的示例性实施方式。在一个示例性实施方式中,鼻锥体28为用于协助将导管3600给入心脏的导管上的细长挠性尖端或远端5110。在示例实例中,鼻锥体28为长的、逐渐变细的锥体,具有相对挠性的锥体的狭窄的远端。在一个非限制性实施方式中,鼻锥体具有1.5英寸的长度,鼻锥体28的内腔5200具有0.04英寸内径以容纳导丝5002。在一个实施方式中,随着鼻锥体100的直径从狭窄的远端至较宽的近端增加,锥体逐渐变得更刚性。这可能是由于厚度的增加和/或鼻锥体可由具有不同硬度(durometers)的不同材料构建。任选地,鼻锥体在其与外管4910连接的点处的刚度可大致与外管4910的刚度相同,以便防止刚度的突然变化。在图51和54示例的实例中,鼻锥体28的细长远端5110是相同的。在一个实施方式中,鼻锥体28的锥形物从末端至末端地延伸鼻锥体28的整个长度或仅延伸鼻锥体28的部分长度。为了形成锥形物,鼻锥体28的外径可以以远侧至近侧的方向增加。锥形物可采取各种形状并且锥形物的外表面可关于鼻锥体28的纵轴成各种角度。
在一个示例性实施方式中,鼻锥体28的较长远端5110有助于在患者的脉管系统中的弯曲部或弯曲处周围导航。由于鼻锥体28增加的长度,尖端更多围绕弯曲部,并以鼻锥体的其余部分产生“追随前导(follow-the-leader)”效果。
在图51示例的实例中,鼻锥体28的基底或近端5112具有毗邻搁板(shelf)5310的近侧成角部分5308。在取回递送导管时,近侧成角部分不在已植入心脏中的对接站10上抓卡(catch)。因此,近侧基底部分5112允许更容易地移除递送系统。参照图53,随着将基底部分5112的成角部分5308(或“斜面”)缩回至外管4910中,斜面5308首先进入递送导管,然后是搁板5310。在鼻锥体28与外套筒/外管4910接合时,外套筒的内径骑跨斜面5308,然后停留在搁板5310(其可以是平坦的或基本上是平坦的,例如,关于鼻锥体28的纵轴呈180°或180°±5°)上。外套筒/外管4910的内径可稍微小于搁板5310的直径,以确保滑动配合(snugfit)。
在一个非限制性实例中,鼻锥体28的搁板5310滑动配合至在一个非限制性实例中可具有大约0.2英寸或在0.1英寸与0.4英寸之间直径的导管组件3600的腔或外腔中。在一个实施方式中,鼻锥体28的最大部分的外径可为0.27英寸或在0.2英寸与0.4英寸之间,其中鼻锥体的远侧尖端处的直径为0.069英寸或在0.03英寸与0.1英寸之间。再次,这些尺寸只是用于示例目的。例如,鼻锥体28的外径或最大外径可比外管4910的外径大(例如,如示例的稍微大);鼻锥体28的外径可与外管4910的外径相同;或者鼻锥体28的外径可比外管4910的外径小(例如,稍微小)。
在图54示例的实例中,鼻锥体28的整个基底或近端/部分5112成角度。在取回递送导管时,连续成角的近端5112不在已植入心脏中的对接站10上抓卡。因此,基底部分5112允许更容易地移除递送系统。参照图55,外管4910可包括斜切面(chamfer)5500以接受并与连续成角的近端5112配合。
在一个非限制性实例中,鼻锥体28的连续成角的近端5112滑动配合至导管组件3600的外管/外套筒4910(其可任选地被斜切)中。鼻锥体28的外径或最大外径可比外管4910的外径大(例如,稍微大);鼻锥体28的外径可如示例与外管4910的外径相同;或者鼻锥体28的外径可比外管4910的外径小(例如,稍微小)。
对接站10可以以广泛多种不同的方式联接至导管组件、或导管组件的对接站连接器4914。例如,对接站10可用一个或多个闭锁、闭锁机构、一条或多条缝线(例如,可释放地附接、捆系(tie)、或编织通过对接站的一个或多个部分的一条或多条缝线)、一个或多个联锁装置、这些的组合、或其它附接机构与导管组件联接。这些联接或附接机构中的一些可被配置以允许对接站缩回至导管组件中而不引起对接站在导管组件的边缘上抓卡,例如,通过使对接站的近端约束至较小的轮廓或皱缩构型,以允许对接站的调节、移除、置换等。图56、57、57A、和57B示例了如何可将对接站10联接至对接站连接器4914的一个非限制性实例。如图50A-50D示例的,在将对接站10推出外管时,其在一个示例性实施方式中自扩张。控制对接站10扩张的一种方法是将支架的至少一个末端,如近端12,锚定至对接站连接器4914。此方法允许支架的远端14首先扩张,而近端不扩张(参见图50B)。然后在关于外管4910使支架相对向前移动时,近端12从对接站连接器4914脱离,并且允许对接站的近端12扩张(参见图50D)。
实现此方法的一种方式是在支架12的至少近端上包括一个或多个延伸部5000。在示例的实例中,包括两个延伸部。然而,可包括任意数目诸如两个、三个、四个等的延伸部5000。延伸部5000可采取广泛多种不同的形式。延伸部5000可在外管4910内与对接站连接器4914接合。在一个示例性实施方式中,对接站连接器4914可接合延伸部5000的内表面5600。在一个示例性实施方式中,除了延伸部5000的内表面5600(参见图57A)与对接站连接器4914的可能的接合,在导管组件和/或对接站的远侧部分处于直或基本上直的构型时,延伸部5000和对接站连接器4914被配置以将其之间的保持接合限制至两个点,但这些可类似地被配置以将保持接合限制至另一数目的点,例如,三至六个点。在一个示例性实施方式中,延伸部5000的内表面5600在导管组件和/或对接站的远侧部分处于直或基本上直的构型时由于被压缩延伸部的径向向外的偏置力而不与对接站连接器4914接触。在此实施方式中,延伸部5000的内表面5600由于导管组件3600和/或对接站的弯曲可接触对接站连接器4914。延伸部5000可包括头部5636,其具有以诸如30度与60度之间的角度β(参见图57A)延伸远离直部分5638的侧面5640。这种头部5636如示例可为大体三角形的,或成角延伸的侧面5640可通过另一形状诸如圆形、矩形、角锥形、或其它形状连接在一起。即,头部5636在非三角形的情况下可以以与示例的三角形头部相同的方式起作用。
递送导管3600随着其移动通过患者身体的脉管系统而不断地弯曲和成曲形(curve)。从延伸部5000的直部分5638直接转变成T形、弯曲T形、圆形或球形的头部5636总体上将具有与其夹持器保持接触的多于两个的点(除了延伸部5000的内表面5600(参见图17A)与对接站连接器4914可能的接合)。参照图57A和57B,具有以角度β彼此延伸远离的侧面5640的头部5636,如三角形头部,导致头部5636只在两个点5702、5704处接触对接站连接器4914。在图57A示例的实例中,两个点是由T形凹槽5710形成的拐角。如图57B中所示,延伸部5000可在递送期间随着导管3600和对接站10移动通过主体而倾斜。在一个示例性实施方式中,此倾斜也可导致如图57B示例的延伸部5000与对接站连接器4914之间只有两个点接触(除了延伸部5000的内表面5600(参见图17A)与对接站连接器4914可能的接合)。因此,延伸部5000可在递送期间倾斜,增加导管3600在对接站10的区域中的挠性,而两个点的接触防止延伸部5000与连接器4914之间结合。
参照图56、57、57A、和57B,在远端在主体内自扩张时头部5636适配至夹持器中的T形凹槽5710中以夹持对接站的近端12。对接站连接器4914仍在递送导管中直到相对移动到导管外(即,通过使外管/外套筒4910缩回或通过使连接器4914推进,参见图50D)。参照图56,导管3600的外管/外套筒4910可紧密地设置在连接器4914之上,使得头部5636被捕获在凹槽5710中,在外管/外套筒4910与连接器4914的主体之间。凹槽5710中的该捕获随着对接站扩张而夹持对接站10的末端。以此方式,控制对接站10的递送。
返回参考图50D,在对接站10的扩张结束时–在支架的远端已经扩张时-连接器4914相对移动到外套筒外。然后头部5636自由径向向外移动并与各自的凹槽5710脱离(参见图56)。
在一个实施方式中,所有延伸部5000的长度都相同。随着连接器相对移动到外管/外套筒4910外,凹槽5710同时相对移动到外套筒4910外。由于延伸部5000的长度都相同,具有头部5636的凹槽5710都将从递送外套筒4910同时露出。因此,对接站的头部5636将径向向外移动并立即释放全部。
在可选的实施方式中,对接站10被提供有带有头部5636的延伸部5000,但延伸部5000中的至少一些比其它的长。那样的话,随着连接器4914逐渐相对移动到外套筒4910外,最短的延伸部5000首先从其各自的一个或多个凹槽5710中释放。然后,随着连接器4914进一步相对移动到外套筒4910外,较长的延伸部5000从各自的一个或多个凹槽5710释放。如上所述,在一个示例性实施方式中,可将对接站10与导管/导管组件3600一起部署。将导管/导管组件3600在循环系统中推进到递送位点或治疗区域。一旦处于递送位点,通过相对于内套筒或内管4912和附接的连接器4914以及对接站10(参见图50A-50D)移动外套筒或外管4910来部署对接站10。外套筒4910可以以广泛多种不同的方式相对于内套筒4912移动。图58-61和62-73示例了工具或手柄5800、6200的实例,工具或手柄5800、6200可用于在循环系统中移动导管3600并相对于导管3600的内套筒4912相对移动外套筒4910例如以部署/放置对接站。
在图58-61示例的实例中,手柄5800包括壳体5810、驱动部件5812、和从动轴5814。在示例的实例中,驱动部件5812相对于壳体5810如箭头5816指示的旋转使从动轴5814如箭头5818指示线性地移动。参照图60,内套筒4912如箭头6000指示固定连接至壳体5810并且外套筒4910如箭头6002指示固定连接至从动轴5814。因此,以第一方向旋转驱动部件5812相对于内套筒4912缩回外套筒4910并且以相反方向旋转驱动部件5812相对于内套筒4912推进外套筒4910。
在图58-61示例的实例中,壳体5810包括环形凹槽5820。驱动部件5812包括环形突起5822。环形突起5822适配在环形凹槽内以可旋转地将驱动部件5812联接至壳体5810。驱动部件5812包括接合部分5830,其从壳体延伸以允许用户相对于壳体5810旋转驱动部件5812。
在图58-61示例的实例中,壳体5810包括线性凹槽5840或槽(参见图59)。从动轴5814包括线性突起5842。线性突起5842适配在线性凹槽5840内以可滑动地将从动轴5814联接至壳体5810。
在图58-61示例的实例中,驱动部件5812包括内螺纹5850。从动轴5814包括外螺纹部分5852。外螺纹部分5852与内螺纹5850配合以操作地将驱动部件5812联接至从动轴5814。即,在驱动部件5812如箭头5816指示相对于壳体5810旋转时,由于适配在线性凹槽5840内的线性突起5842而防止从动轴5814旋转。因此,由于外螺纹部分5852与内螺纹5850配合的接合,壳体5810中驱动部件5812的旋转引起从动轴5814沿线性凹槽5840线性滑动5818。由于外轴/外管4910连接至从动轴5814并且内轴/内管4912连接至壳体5810,通过驱动部件5812的旋转外轴/外管4910相对于内轴/内管4912被推进和被缩回。
在图58-61示例的实例中,外轴/外管4910固定地连接在从动轴5814中的凹槽5850中,并且任选的密封5852提供在外轴/外管4910与内轴/内管4912之间和/或提供在外轴/外管4910与从动轴5814之间。鲁尔接口5862固定连接至壳体5810,例如,如示壳体5810的近端。内轴/内管4912固定地连接在鲁尔接口5862中的凹槽5860中。鲁尔接口5862被配置以接受延伸通过内轴/内管4912的导丝5002(参见图49)。
在图62-67示例的实例中,手柄6200包括壳体6210、驱动轮6212、和从动部件6214。在示例的实例中,驱动轮6212相对于壳体6210如箭头6216指示的旋转使从动部件6214如箭头6218指示线性地移动(相比图64A和64B中的从动部件6214的位置)。参照图62,内套筒/内管4912固定连接至壳体6210并且外套筒/外管4910固定连接至从动部件6214。因此,以第一方向旋转驱动轮6212相对于内套筒4910缩回外套筒4910并且以相反方向旋转驱动轮6212相对于内套筒/内管4912推进外套筒/外管4910。虽然,在图58-73所示各种实施方式中,显示和描述了内套筒/内管4912相对于手柄或手柄的近端被不可移动地连接而外套筒/外管4910相对于手柄或手柄的近端是可移动的,但在一个利用类似构思的实施方式中,内套筒/内管4912相对于手柄或手柄的近端是可移动的而外套筒/外管4910相对于手柄和手柄的近端被不可移动地连接,或者内套筒/内管4912与外套筒/外管4910两者都可被配置以相对于彼此和相对于手柄或手柄的近端是可移动的。
在图62-67示例的实例中,壳体可旋转地接受驱动轮6212的轮轴6822以可旋转地将驱动轮联接至壳体6210。驱动轮6212包括接合部分6230,其从壳体6210延伸以允许用户相对于壳体6210旋转驱动轮6212。
在图62-67示例的实例中,壳体6210包括线性突起6240(参见图66)。从动部件6214包括突起6240适配在内的线性槽6242(参见图62、66)以可滑动地将从动部件6214联接至壳体6210。
在图62-67示例的实例中,驱动部件6212包括小齿轮6250。从动部件6214包括齿条部分6252。小齿轮6250与齿条部分6252啮合以使驱动轮6212操作地联接至从动部件6214。即,在驱动轮6212如箭头6216指示相对于壳体6210旋转时,由于适配在线性凹槽6242内的线性突起6240,从动部件6214相对于壳体6210滑动。因此,驱动部件6212相对于壳体6210的旋转引起小齿轮6250驱动齿条部分6252以引起从动部件6214相对于壳体6210线性地滑动6218。由于外轴/外管4910连接至从动部件6214并且内轴/内管4912连接至壳体5810,外轴/外管4910通过驱动轮6212的旋转相对于内轴/内管4912被推进和被缩回。
在图62-67示例的实例中,外轴/外管4910固定地连接在从从动部件6214的齿条部分6252延伸的支撑部分6250中,并且任选的密封(未显示)提供在外轴/外管4910与内轴/内管4912之间和/或提供在外轴/外管4910与从动部件6214之间。鲁尔接口5862固定连接至壳体6210,例如,在壳体6210的近端处。内轴/内管4912固定地连接在鲁尔接口5862中的凹槽5860中。鲁尔接口5862被配置以接受延伸通过内轴/内管4912的导丝5002(参见图49)。
参照图63,在一个示例性实施方式中,可通过向内管4912——如通过鲁尔接口5862向内管——施用流体来冲洗导管3600。如上所述,递送导管3600包括外管/外套筒4910内形成的外腔和内管/内套筒4912内形成的内腔,并且内腔和内管4912纵向地与外腔和外管4910共轴。内管4912和外管4910之间的环形腔/间隙/空间6348可以起因于例如为折绉的支架提供空间以行进通过导管3600的需要。此间隙/空间6348最初可填充有空气,随后可用液体例如盐水溶液将其驱除并替换。可用图58-73中所示的各种手柄实施方式进行以这种方式的冲洗。
在一个示例性实施方式中,流体诸如盐水或另一合适的流体,从鲁尔接口5862流动并如箭头6360指示通过内管4912的内腔。在此实施方式中,内管4912提供有一个或多个冲洗孔6354。流体流动通过内管4912的内部,如箭头6370指示从孔6354流出并流进间隙/空间6348中。
随着间隙/空间6348填充有流体,空气从递送导管中被推出通过外管4910的远端。在一个示例性实施方式中,使鼻锥体28从外管4910的远端脱离以允许空气从外管流出并从导管3600流出。流体还流动通过内管4912的内腔以将空气从内腔推出。在一个示例性实施方式中,空气被迫使通过鼻锥体28末端中的开口6390从内腔离开(参见图49A和49B)。在将递送导管3600引入身体中之前进行此冲洗程序。此途径的装置和方法相比于例如在外管4910上提供侧孔用于将冲洗流体引入递送导管组件或间隙/空间6348中节省了空间。
参照图68-73,在一个示例性实施方式中,图62-67示例的手柄6200可提供有棘轮机构6800。棘轮机构6800可采取广泛多种不同的形式并可以以各种不同的方式与手柄6200一起使用。在一个示例性实施方式中,在对接站10的“再捕获”以将其拉回至递送导管3600中期间使用棘轮机构6800。再捕获对接站所需的力可以是显著的。因此,棘轮机构6800可被配置使得,在棘轮机构被接合时(图68-71),可只以将对接站10拉回至外管/外套筒4910中的方向旋转驱动轮6212。即,通过棘轮机构6800防止对接站10的弹簧弹力将对接站拉回到外管之外。例如,如果操作者松开驱动轮6212,操作者可继续再捕获对接站10,而不使对接站向后滑动。
参照图68-71,一个示例性棘轮系统利用突起6810,突起的一侧上具有止动表面6812并且突起的另一侧上具有斜面表面6814。图68-71示例了接合的情况,其中棘轮臂6892被定位以与突起6810接合以允许驱动轮6212以一个方向旋转,并防止驱动轮以相反方向转向。例如,棘轮臂6892可被配置以骑跨斜面表面6814以允许驱动轮6212以缩回方向6850移动。例如,棘轮臂6892可弯曲以骑跨倾斜的斜面表面6814。止动表面6812被配置以接合棘轮臂6892并防止驱动轮以推进方向6852旋转。例如,止动表面6812可基本上与驱动轮6212的侧表面6870正交以防止棘轮臂在突起6810之上移动。
图72和73示例了棘轮机构6800,其中棘轮臂6892从与突起6810的接合移出。这允许驱动轮6212以任一方向转向。例如,随着对接站10正在被部署,可将棘轮机构6800置于脱离的情况下以允许驱动轮6212以任一方向转向。
在棘轮系统中,通常将棘轮齿置于轮的外周边上。通过将齿放在轮的表面上,可减小轮的径向直径,节省空间。还允许轮的外周边用作拇指的夹具(grip),而非例如具有处于与第一轮接合的用于夹紧的第二轮。还允许轮自身更细薄。轮可由任意材料如聚碳酸酯制成。
参照图71,在一个实施方式中,棘轮臂6892可弯曲使得臂的部分可停留在从壳体壁延伸或以其它方式位于壳体内的稳定杆194上,以防止臂6892在向臂施加来自轮的运动的力时扭转。
前文主要描述了自扩张对接站的实施方式。但是可在本公开的范围内将本文所示和所述对接站和/或递送装置改进用于递送球囊可扩张和/或机械可扩张对接装置。也就是说,可利用本公开的改进版本的递送装置经皮地执行将球囊可扩张和/或机械可扩张对接站递送至植入位置。一般来讲,其包括提供可包括如上所述的递送鞘和/或另外的鞘的经导管组件。在球囊可扩张对接站的情况下,装置总体上进一步包括递送导管、球囊导管、和/或导丝。用于球囊可扩张类型的递送装置中的递送导管可限定接收球囊导管的腔。球囊导管,反过来,限定了可滑动设置导丝在其内的腔。此外,球囊导管包括流体地连接至膨胀源的球囊。在对接站安装在球囊上的情况下,通过递送装置将经导管组件递送通过患者中的经皮开口。一旦将对接站适当定位,操作球囊导管以使球囊膨胀,因此使对接站转变为扩张的布置。
鉴于所公开发明的原则可应用的多种可能的实施方式,应当意识到示例的实施方式只是本发明的优选实例并且不应当用来限制本发明的范围。前述示例性实施方式的特征的所有组合和子组合都被本申请所考虑。本发明的范围由所附权利要求限定。我们因此要求保护处在这些权利要求范围和精神内的所有作为我们的发明。
- 用于部署用于置换心脏瓣膜的对接装置的系统和机构
- 用于对接心脏瓣膜的装置和系统
