一种中药质量一致性测定方法、系统、介质及应用
文献发布时间:2023-06-19 11:44:10
技术领域
本发明属于质量评价技术领域,尤其涉及一种中药质量一致性测定方法、系统、介质及应用。
背景技术
目前:传统的中药质量控制往往照搬西药的做法采用单一或几个指标成分定量的模型,但是实践证明这种模型不符合中医药的特点,不能从整体上评价和控制中药的质量。中药指纹图谱由于体现了中医药的整体、宏观、复杂等特点,很快成为国内外广泛接受的中药质量评价模型。近年来中药指纹图谱的研究进展很快,特别是国家药品监督管理局颁发的《中药注射剂指纹图谱研究的技术要求(暂行)》对中药指纹图谱研究的规范化起到了重要作用,中药指纹图谱研究取得了许多阶段性的成果,奠定了其在现代中药质量标准体系中的核心地位。
然而,现有的中药指纹图谱仅仅是关注多种组分,却没有对主要组分以及组分的配合进行测定,同时仅仅是采用指纹图谱定性评价,而忽略了总和定量评价。
通过上述分析,现有技术存在的问题及缺陷为:现有的中药指纹图谱没有对主要组分总量以及组分的配合进行测定,尤其忽略了总和定量评价,这导致中药质量无法真正监控,劣药假药盛行。这也导致中药标准主要以定性为主,无法真正控制好中药质量,从而导致劣质中药和假中药畅通无阻,无法消除。
解决以上问题及缺陷的难度为:中药标准主组分模式能确立重要药效成分,采取抓主要矛盾方法而不求全,对主要结构明确的含量高的活性成为作为重点控制;目前缺乏控制模型和软件方法和系统,本发明解决了此问题。
解决以上问题及缺陷的意义为:建立中药标准主组分模式和中药参比主组分模型等于建立了中药质量的标准模式,可作为质量控制模板和药效对照模板,是中药质量与药效的双重标准模式。原有指标成分的定量是以片面的点来代替整体面的以偏盖全的方法,本发明则全面纠正和避免了此缺陷。
发明内容
针对现有技术存在的问题,本发明提供了一种中药质量一致性测定方法、系统、介质及应用。
本发明是这样实现的,一种中药质量一致性测定方法,所述中药质量一致性测定方法包括:
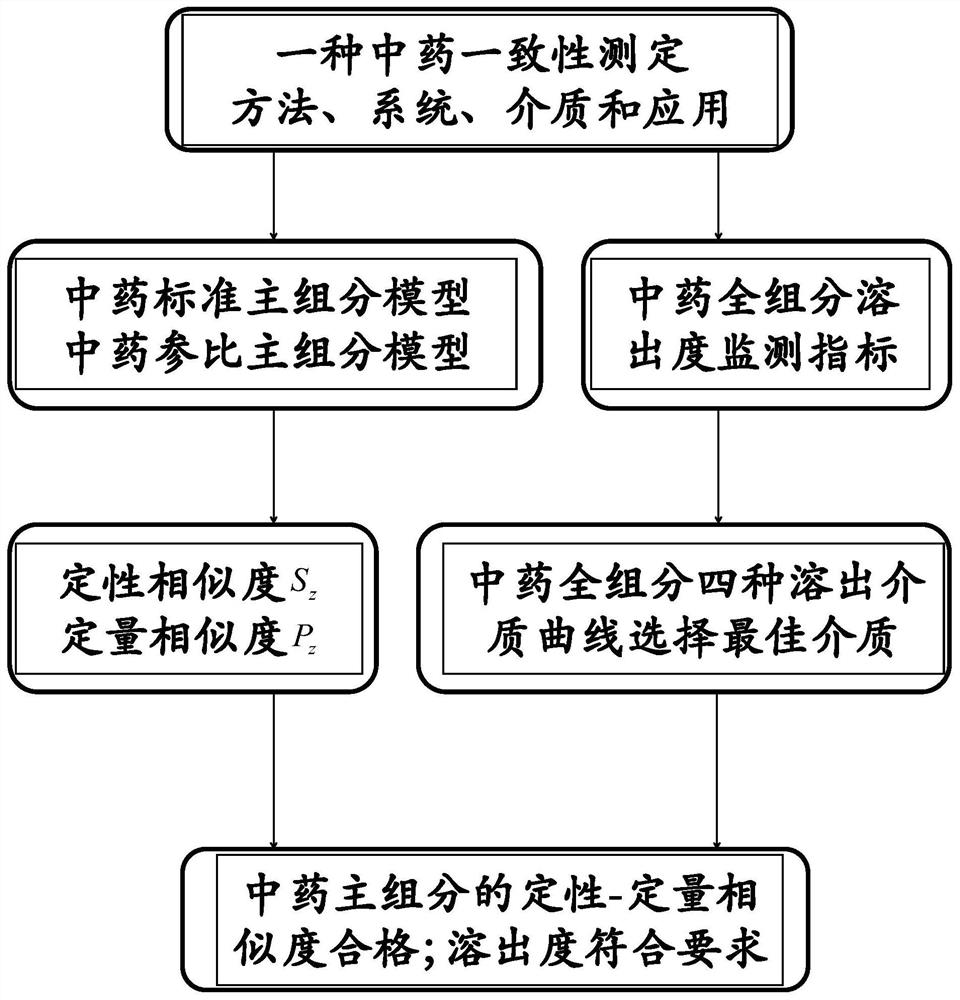
步骤一,选择中药质量评价的主组分定性和定量模型;同时选取固体制剂溶出度的定性和定量指标;这是评价模型和评价指标选取阶段,是确定质控基础的最重要阶段。
步骤二,测定待评价中药主组分的定性定量相似度须满足必要条件(如定性相似度不低于0.9,定量相似度在80%到120%,但前者包括0.1至1;后者包括10%至200%的范围),并基于选取的固体制剂溶出度指标对测定的固体制剂溶出度进行一致性控制和评价。这是以模型为标准后,检验待评价的中药应具备的基本指标属性,它规定了合格中药应具备的基础必要条件。
进一步,所述中药质量评价的定性模型包括:
中药标准主组分评价模型和中药参比主组分评价模型;
所述中药标准主组分评价模型,即由能代表同一中药品种或中药原料药物的基本质量的多数中药企业提供的符合国家中药质量标准的中药制剂或中药原料的共有主组分的色谱标准主组分图谱,或者中药标准制剂经测试得到的中药标准主组分图谱;
所述中药参比主组分评价模型,即对已标准化且中药行业广泛认可的中药制剂在获批为国家认证的中药参比制剂后,其成为中药参比主组分评价模型。
进一步,所述主组分图谱包括:
各类型色谱、各类型光谱,以及其他可提供连续信号或间接性分立信号的色谱或光谱;
所述各类型色谱包括:HPLC,GC,HPCE,LC-MS总离子流谱;
所述各类型光谱包括:紫外光谱UV、中红外光谱IR和近红外光谱NIR、太赫兹光谱THZ、拉曼光谱、X-射线衍射光谱、以及核磁共振谱NMR。
进一步,所述中药质量评价的定量模型包括:
采用定量指纹模型作为中药标准主组分模型和中药参比主组分评价模型用于具体评价时的定量计算评价的数学模型;
所述定量指纹模型包括以下三个指标:第一,存在确定的主组分指纹数;第二,有中药标准主组分或中药参比主组分的图谱模型和制备图谱时样品的质量或浓度;第三,有单参照物或双参照物的度量校正系统。
进一步,步骤二中,所述测定待评价中药的固体溶出度包括:
采用耐腐蚀耐高压的硬质材料的空心管(内径0.1mm至0.5mm,长度1米至20米)作为色谱柱并利用HPLC法测定固体制剂的溶出度,利用二级管阵列检测器(DAD)在线柱后检测190nm-950nm中药固体制剂或中药原料药物的供试溶液,以获得的190nm-950nm连续紫外可见光谱或其中一段连续光谱、以及其中任何单一波长或几个波长检测信号信息的组合作为监测药物全组分溶出的物理信号,并分别按弃液法和补液法计算得到中药全组分的溶出度。
进一步,所述测定待评价中药的固体溶出度还包括:
进行相对溶出度测定:在同一溶出杯内,基于光谱以60min,90min或120min及其他时间点作为紫外标准图谱对溶出曲线各点的溶出度进行计算,通过全溶出溶液测定紫外标准图谱点的绝对溶出量;所述紫外标准图谱点的绝对溶出度拟定以100%计;
进行全溶出溶液制备和测定紫外标准指纹的真实溶出度:取10片或20片固体制剂置于37℃的溶出介质250~900毫升中,于37℃超声10min~30min制备得到全溶出溶液,测试时取供试液正常进样量的十分之一或二十分之一进样检测;测定得到计算相对溶出度时的紫外标准指纹的真实溶出量(绝对溶出度)。
进一步,步骤二中,所述基于选取的固体制剂溶出度指标对测定的固体制剂溶出度进行一致性控制和评价包括:
1)整体定量主组分:对多组分同时定性计算S
2)进行标准主组分系统度量校正以及被测主组分系统的度量校正;
所述整体定量主组分包括:
用S
用P
其中,y
所述进行标准主组分系统度量校正以及被测主组分系统度量校正包括:
所述标准主组分系统度量校正包括:
利用已知浓度双参照C
所述被测主组分系统度量校正包括:
用已知浓度双参照C
本发明的另一目的在于提供一种计算机可读存储介质,存储有计算机程序,所述计算机程序被处理器执行时,使得所述处理器执行如下步骤:
选择中药质量评价的主组分定性和定量模型;同时选取固体制剂溶出度的定性和定量指标;
测定待评价中药主组分的定性定量相似度须满足必要条件(如定性相似度不低于0.9,定量相似度在80%到120%,但前者包括0.1至1;后者包括10%至200%的范围),并基于选取的固体制剂溶出度指标对测定的固体制剂溶出度进行一致性控制和评价。
本发明的另一目的在于提供一种实施所述中药质量一致性测定方法的中药质量一致性测定系统,所述中药质量一致性测定系统包括:
模型选择模块,用于选择中药质量评价的主组分定性和定量模型;
指标选取模块,用于选取固体制剂溶出度的定性和定量指标;
测定模块,用于待评价中药主组分的总量的定性定量相似度的测定和对待评价中药的固体溶出度进行测定;
评价模块,用于基于选取的固体制剂主组分定性定量相似度须满足必要条件,并基于固体制剂溶出度指标对测定的固体制剂溶出度进行一致性控制和评价。
本发明的另一目的在于提供一种所述中药质量一致性测定方法在烟草、食品以及化妆品检测中的用途。
结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明提供了一种基于色谱和光谱的中药主组分一致性评价模型和评价系统,将中药标准主组分模型或中药参比主组分评价模型的主组分图谱作为评价质量的定性和定量模型,把中药固体制剂的色谱指纹或紫外整体(部分)指纹作为监控固体制剂溶出度的指标,对固体制剂溶出度进行一致性控制和评价。本发明首先保证了药效物质总量按照中药标准主组分模型或中药参比主组分评价模型来制备,其充分保证了药效物质基础的一致性,此外控制溶出度指标的一致性是保证药效一致性的必要基础,二者在药效基础物质恒定性和发挥药效一致性的必要条件方面都进行了十分必要的规定。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对本申请实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
图1是本发明实施例提供的中药质量一致性测定方法流程图。
图2是本发明实施例提供的中药质量一致性测定系统结构示意图;
图中:1、模型选择模块;2、指标选取模块;3、测定模块;4、评价模块。
图3是本发明实施例提供的中药质量一致性测定方法的实现流程图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
针对现有技术存在的问题,本发明提供了一种中药质量一致性测定方法、系统、介质及应用,下面结合附图对本发明作详细的描述。
如图1所示,本发明实施例提供的中药质量一致性测定方法包括:
S101,选择中药质量评价的主组分定性和定量模型;同时选取固体制剂溶出度的定性和定量指标;
S102,测定待评价中药主组分的定性定量相似度须满足必要条件(如定性相似度不低于0.9,定量相似度在80%到120%,但前者包括0.1至1;后者包括10%至200%的范围),并基于选取的固体制剂溶出度指标对测定的固体制剂溶出度进行一致性控制和评价。
本发明提供的中药质量一致性测定方法业内的普通技术人员还可以采用其他的步骤实施,图1的本发明提供的中药质量一致性测定方法仅仅是一个具体实施例而已。
本发明实施例提供的中药质量评价的定性模型包括:
中药标准主组分评价模型和中药参比主组分评价模型;
所述中药标准主组分评价模型,即由能代表同一中药品种或中药原料药物的基本质量的多数中药企业提供的符合国家中药质量标准的中药制剂或中药原料的共有主组分的色谱标准主组分图谱,或者中药标准制剂经测试得到的中药标准主组分图谱;
所述中药参比主组分评价模型,即对已标准化且中药行业广泛认可的中药制剂在获批为国家认证的中药参比制剂后,其成为中药参比主组分评价模型。
本发明实施例提供的主组分图谱包括:
各类型色谱、各类型光谱,以及其他可提供连续信号或间接性分立信号的色谱或光谱;
所述各类型色谱包括:HPLC,GC,HPCE,LC-MS总离子流谱;
所述各类型光谱包括:紫外光谱UV、中红外光谱IR和近红外光谱NIR,太赫兹光谱THZ,以及X-射线衍射光谱,核磁共振谱。
本发明实施例提供的中药质量评价的定量模型包括:
采用定量指纹模型作为中药标准主组分模型和中药参比主组分评价模型的定量模型;
所述定量指纹模型包括以下三个指标:第一,存在确定的主组分指纹数;第二,有中药标准主组分或中药参比主组分的图谱模型和图谱质量或浓度;第三,有单参照或双参照的度量校正系统。
步骤S102中,本发明实施例提供的测定待评价中药的固体溶出度包括:
采用耐腐蚀耐高压的硬质材料的空心管(内径0.1mm至0.5mm,长度1米至20米)作为色谱柱并利用HPLC法测定固体制剂的溶出度,利用二级管阵列检测器(DAD)在线柱后检测190nm-950nm中药固体制剂或中药原料药物的供试溶液,以获得的190nm-950nm连续紫外光谱或其中一段连续光谱,以及其中任何单一波长或几个波长检测信号信息的组合作为监测药物组分溶出的物理信号,并分别按弃液法和补液法计算得到中药药物的溶出度。
本发明实施例提供的测定待评价中药的固体溶出度还包括:
进行相对溶出度测定:在同一溶出杯内,以60min,90min或120min及其他时间点作为紫外标准图谱对溶出曲线各点的溶出度进行计算,通过全溶出溶液测定紫外标准图谱点的绝对溶出量;所述紫外标准图谱点的绝对溶出度拟定以100%计;
进行全溶出溶液制备和测定紫外标准指纹的真实溶出度:取10片或20片固体制剂置于37℃的溶出介质900毫升中,于37℃超声10min~30min制备得到全溶出溶液,测试时取供试液正常进样量的十分之一或二十分之一进样检测;测定得到相对溶出度的紫外标准指纹的真实溶出量。
步骤S102中,本发明实施例提供的基于选取的固体制剂溶出度指标对测定的固体制剂溶出度进行一致性控制和评价包括:
1)整体定量主组分:对多组分同时定性计算S
2)进行标准主组分系统度量校正以及被测主组分系统度量校正。
本发明实施例提供的整体定量主组分包括:
用S
用P
其中,yi表示标准主组分的峰面积即中药标准主组分或中药参比主组分;m
本发明实施例提供的进行标准主组分系统度量校正以及被测主组分系统度量校正包括:
所述标准主组分系统度量校正包括:
利用已知浓度双参照C
所述被测主组分系统度量校正包括:
用已知浓度双参照C
如图2所示,本发明实施例提供的中药质量一致性测定系统包括:
模型选择模块1,用于选择中药质量评价的主组分定性和定量模型;
指标选取模块2,用于选取固体制剂溶出度的定性和定量指标;
测定模块3,用于对待评价中药的固体溶出度进行测定;
评价模块4,用于基于选取的固体制剂溶出度指标对测定的固体制剂溶出度进行一致性控制和评价。
下面结合具体实施例对本发明的技术方案作进一步说明。
实施例1:
本发明将中药标准主组分模型或中药参比主组分评价模型的主组分图谱作为评价质量的定性和定量模型,把中药固体制剂的色谱指纹或紫外整体(部分)指纹作为监控固体制剂溶出度的指标,对固体制剂溶出度进行一致性控制和评价。即发明一种基于色谱和光谱的中药主组分一致性评价模型和评价系统。
技术方案:
1.中药标准主组分模型由能代表同一中药品种或中药原料药物的基本质量的多数中药企业提供的符合国家中药质量标准的中药制剂或中药原料的共有主组分的色谱标准主组分图谱称为中药标准主组分模型(平均值法),或由中药标准制剂经测试得到的中药标准主组分图谱模型。把中药标准主组分模型作为中药质量一致性测定的第一种模型。
2.中药参比主组分评价模型对已标准化且中药行业认可的中药制剂在获批为国家认证的中药参比制剂后,以其获得中药参比制剂主组分模型,以该中药参比主组分评价模型作为中药质量一致性测定的第二种可行模型。其可代替第一种模型。
3.中药标准主组分模型和中药参比主组分评价模型用定量指纹模型来表达:有①确定的主组分指纹数,②有中药标准主组分或中药参比主组分的图谱模型和图谱质量或浓度,③有单参照或双参照的度量校正系统。
4整体定量主组分能对多组分同时定性计算S
5.定量校正①标准主组分系统度量校正R用已知浓度双参照C
6.指标选取对检测结果的判定指标必须依据定性指标S
7.主组分图谱保护范围主要包括各类型色谱(HPLC,GC,HPCE,LC-MS总离子流谱)、各类型光谱(紫外光谱UV、中红外光谱IR和近红外光谱NIR,太赫兹光谱THZ、拉曼光谱、X-射线衍射光谱、以及核磁共振谱NMR),但不止于以上各类型色谱和各类型光谱,只要能提供连续信号或间接性分立信号都在主组分图谱保护范围内。
8.固体溶出度的测定法
8.1.溶出方法的装置采用耐腐蚀耐高压的硬质材料的空心管(内径0.1mm至0.5mm,长度1米至20米)作为色谱柱并用于HPLC法测定固体制剂的溶出度,用二级管阵列检测器(DAD检测器)在线柱后检测190nm-950nm中药固体制剂或中药原料药物的供试溶液光谱。以获得的190nm-950nm连续紫外光谱或其中一段连续光谱、以及其中任何单一波长或几个波长检测信号信息的组合作为监测药物全组分溶出的物理信号,据此分别按①弃液法和②补液法计算药物的溶出度。
8.2.相对溶出度测定在同一溶出杯内,以60min,90min或120min等点作为紫外标准图谱对溶出曲线各点的溶出度进行计算,人为拟定的紫外标准图谱点的溶出度按100%计。紫外标准图谱点的绝对溶出量需通过全溶出溶液来测定。
8.3.全溶出溶液制备和测定紫外标准指纹的真实溶出度取10片或20片固体制剂置于37℃的溶出介质900毫升中,于37℃超声10min~30min来制备获得全溶出溶液,测试时取供试液正常进样量的十(或二十)分之一进样检测。依此测定相对溶出度的紫外标准指纹的真实溶出量(绝对溶出度)。
应当注意,本发明的实施方式可以通过硬件、软件或者软件和硬件的结合来实现。硬件部分可以利用专用逻辑来实现;软件部分可以存储在存储器中,由适当的指令执行系统,例如微处理器或者专用设计硬件来执行。本领域的普通技术人员可以理解上述的设备和方法可以使用计算机可执行指令和/或包含在处理器控制代码中来实现,例如在诸如磁盘、CD或DVD-ROM的载体介质、诸如只读存储器(固件)的可编程的存储器或者诸如光学或电子信号载体的数据载体上提供了这样的代码。本发明的设备及其模块可以由诸如超大规模集成电路或门阵列、诸如逻辑芯片、晶体管等的半导体、或者诸如现场可编程门阵列、可编程逻辑设备等的可编程硬件设备的硬件电路实现,也可以用由各种类型的处理器执行的软件实现,也可以由上述硬件电路和软件的结合例如固件来实现。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
- 一种中药质量一致性测定方法、系统、介质及应用
- 一种保障应用一致性的数据保护方法、装置、介质及系统
