一种人羊膜间充质干细胞悬液的制备与应用
文献发布时间:2023-06-19 11:47:31
技术领域
本发明涉及生物医药技术领域,具体而言,涉及人羊膜间充质干细胞在心脏移植受体中的应用。
背景技术
心脏移植(hearttransplantation,HTx)是终末期心脏疾病的最佳治疗手段,但移植心脏在术后面临着诸多考验。在接入受者的循环系统后,移植心脏将不可避免的出现缺血再灌注损伤与排斥反应,限制着心脏移植的治疗效果。目前,心脏移植的排斥反应随着免疫抑制剂的发展得到了显著改善,但随之而来的终生服药、药物并发症与尚未拥有有效治疗方法的慢性排斥反应等问题的出现提示,当前的器官移植领域还需要更好的免疫抑制治疗方法。
近些年来,间充质干细胞的相关研究不断涌现。作为一种来源广泛,具备自我更新与多向分化能力的干细胞,间充质干细胞最初被应用于再生医学领域,希望可通过向受损部位归巢并分化的方式达到治疗效果。而随着研究的不断深入,越来越多的研究认为间充质干细胞的治疗效果主要源自于其抗炎、营养周边组织、促进血管生成等特性。此外,研究发现间充质干细胞不仅本身的免疫原性较低,适合异体移植,其还具备强大的免疫调节特性。研究表明,间充质干细胞的输注不仅可以抑制器官移植受体的排斥反应,延长移植器官的存活时长,还具备诱导特异性免疫耐受的潜能,在心脏移植领域拥有巨大的发展前景。
移植心脏的缺血再灌注损伤与排斥反应损伤之间可以相互促进,对心脏移植受体的短期存活率产生较大影响。而目前的研究结果显示,间充质干细胞对这两种损伤形式都有着不错的治疗效果。大量研究证实了间充质干细胞对缺血再灌注损伤的治疗作用。研究表明,间充质干细胞可通过归巢分化修复受损组织,旁分泌释放具有抗炎、抗凋亡、促进血管生成作用的相关因子与外泌体的方式减轻移植心脏的缺血再灌注损伤。排斥反应方面,间充质干细胞可通过旁分泌作用(释放多种细胞因子如:IDO/iNOs、TGF-β、PGE2、HGF、IL-10、TSH-6等)与细胞间直接接触的方式调节受体的免疫状态,具体可表现为抑制T、B与NK细胞的增殖与功能,诱导促炎性T细胞凋亡,抑制抗原呈递细胞的成熟,诱导巨噬细胞极化为M2型,诱导调节性T细胞的扩增等。有效的利用间充质干细胞的相关特性可为心脏移植等器官移植领域提供一种具备综合治疗效果的新型治疗手段。
间充质干细胞来源广泛,而人羊膜与其他来源的间充质干细胞(如骨髓间充质干细胞)相比具有特定优势。就来源而言,人羊膜属于医疗废弃物且资源丰富,无需有创性取材,且该组织中间充质干细胞丰度更高;就分离所得细胞而言,主流的骨髓间充质干细胞的治疗效果会受到供体年龄的影响,而人羊膜间充质干细胞则更为稳定。此外,人羊膜间充质干细胞还具备一些胚胎干细胞的表型特征(如表达SSEA-3,SSEA-4,TRA-1-81,TRA-1-60,SOX-2,FGF-4、Rex-1等),提示其具有更高的分化潜能与更低的免疫原性。在未来的细胞制剂发展应用过程中,人羊膜间充质干细胞将成为重要的细胞制剂原材料。
如今,间充质干细胞公认的给药途径主要为原位注射与外周静脉注射。而考虑到未来临床应用中原位注射的难以实现,目前间充质干细胞的实验多采取外周静脉注射的方式给药。虽然间充质干细胞具有向损伤或炎症部位归巢的作用,但研究表明外周静脉注射的间充质干细胞绝大多数会被滞留于肺中,且存在有肺栓塞的风险,真正到达患处的干细胞少之又少。而又因为间充质干细胞的微环境可对其抗炎与免疫调节作用产生较大影响,处于错误微环境中的间充质干细胞甚至可以发挥免疫增强作用。因此目前主流的静脉给药途径并不能发挥间充质干细胞应有的治疗效果,造成了实验结果的不稳定性,阻碍了间充质干细胞制剂临床应用的进程。对间充质干细胞在心脏移植受体上的应用而言,还需要更完善的给药方式以充分发挥间充质干细胞的综合治疗效果。
腹腔注射给药也是间充质干细胞制剂的给药方式之一,但由于与循环系统相比,腹腔是一个相对密闭的空间,故腹腔注射在非腹腔内脏器损伤的治疗应用中并不被看好。但本发明的初期研究结果中显示,腹腔注射的人羊膜间充质干细胞向移植心脏归巢的效果良好,有潜力成为间充质干细胞在心脏移植受体应用的更完善的给药途径。
目前关于间充质干细胞在心脏移植中应用的研究较少,且来源多局限在骨髓与脂肪间充质干细胞,给药途径多局限于静脉给药,尚未见到人羊膜间充质干细胞在心脏移植受体中应用的相关报道。
发明内容
鉴于当前心脏移植领域存在的问题,本发明的目的在于提供一种人羊膜间充质干细胞悬液的制备与其在心脏移植受体中的应用方法,该悬液可有效减轻移植心脏的缺血再灌注与排斥反应损伤,延长小鼠异位移植心脏的存活时长。
为了实现上述目标,本发明采用如下技术方案:
本申请实施例提供了一种人羊膜间充质干细胞悬液的制备,其主要制备过程为:回收人羊膜,经过冲洗、剪碎、消化分离、接种、传代培养、消化重悬,获得人羊膜间充质干细胞悬液。
在本发明中,前述的人羊膜间充质干细胞消化分离过程为:将人羊膜组织用含有0.02%EDTA的0.05%胰蛋白酶消化2次,每次40min,弃去消化液后再加入含有0.075mg/mLDNaseI的0.75mg/mLII型胶原酶消化液,置于37℃,200r/min旋转消化40min,用300目钢网过滤,收集细胞滤液,终止消化,1500r/min离心10min,弃上清,得到原代人羊膜间充质干细胞。
本发明中,前述的人羊膜间充质干细胞接种、传代培养、消化重悬过程为:将原代人羊膜间充质干细胞接种于25cm
优选地,前述的人羊膜是由正常足月剖腹产胎儿的胎盘脐带面钝性分离而来,需要注意统一胎儿与细胞悬液应用对象的性别。
优选地,培养前述人羊膜间充质干细胞的培养液为含有5~10%人脐带血血清的LG-DMEM培养基,接种的细胞密度为5×10
优选地,前述的人羊膜间充质干细胞悬液选取第3~5代人羊膜间充质干细胞。
采用上述人羊膜间充质干细胞悬液在心脏移植受体中的应用方法为:采用腹腔注射的方式给药,就小鼠异位心脏移植模型而言,在移植术后的第1、4天腹腔注射0.2~0.3ml细胞悬液。
相对于现有技术,本发明的优点如下:
(1)选择应用人羊膜来源间充质干细胞,具有取材简单,废弃物再利用,治疗效果相对稳定,胚性更加原始等优势。
(2)本发明选择采取腹腔注射的方式给药,与原位注射相比降低了注射时重要脏器损伤的风险,更加安全可行。与外周静脉给药相比减少了间充质干细胞的肺部滞留问题,避免了可能出现的微血栓形成问题,扩大了给药的可用剂量范围,增加了移植心脏处的细胞数量,可发挥较好的治疗效果。
(3)本发明对移植物的排斥反应损伤与缺血再灌注损伤均有不错的治疗效果,是一种具有多方面治疗作用的制剂,十分适合应用于器官移植早期并发症的治疗。
附图说明
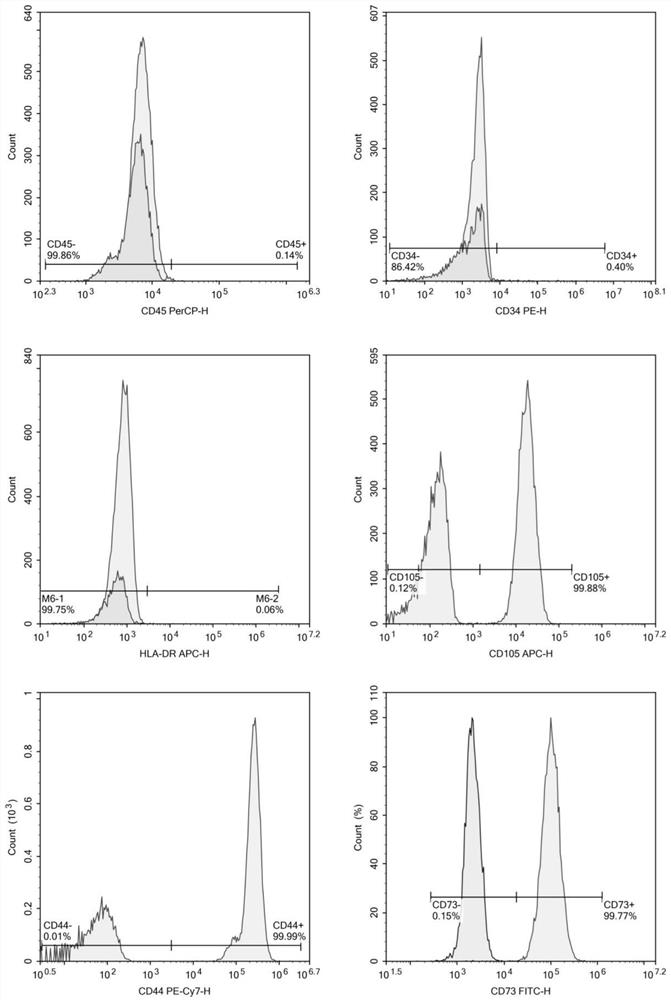
图1是流式细胞术检测第3代hAD-MSCs的免疫表型图;
图2是第3代hAD-MSCs波形蛋白的免疫荧光检测图;
图3是显示hAD-MSCs在模型中分布的小动物活体成像图;
图4是移植心脏组织的H&E染色;
图5是小鼠移植心脏的生存曲线;
图6是尾静脉注射的hAD-MSCs在模型中分布的小动物活体成像图。
具体实施方式
下面将对结合附图,本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
参照图1-6
1、hAD-MSCs的分离与培养:
经产妇知情同意,实验经过医院伦理委员会批准。采集脐带血用50mL离心管4℃保存约6h,3000r/min离心10min,吸出血清,过滤分装,-20℃保存待用。在无菌条件下,于正常足月剖腹产男婴的胎盘脐带面用机械法将羊膜从胎盘组织上剥离,使用含1%双抗(青霉素100IU/mL,链霉素100IU/mL)的D-Hank’s液反复冲洗,去除残留血迹与粘液后,将其剪成碎片。向其中加入含有0.02%EDTA的0.05%胰蛋白酶,于37℃下消化2次,每次40min,经300目不锈钢滤网过滤后弃滤液,用PBS液冲洗羊膜组织碎片后,向其中加入含有0.075mg/mLDNaseI的0.75mg/mLII型胶原酶消化液,37℃,200r/min旋转消化约40min至组织基本消化完全成絮状,经300目不锈钢网过滤,收集细胞滤液,1500r/min离心10min,弃上清,得到原代hAD-MSCs。用含5~10%人脐带血血清的LG-DMEM培养基重悬细胞,以5×10
2、hAD-MSCs的纯度鉴定:
取80%融合的第3代hAD-MSCs,用0.125%胰蛋白酶消化,PBS洗涤两遍,1500r/min离心5min,弃上清。用50ulPBS重悬细胞,一管加入抗体CD34PE、CD73FITC、CD105APC,另一管加入抗体CD44PE-CY·7、HLA-DRAPC、CD45PerCP各5μL,轻微混匀后,室温避光孵育20min,每管加入2mL含0.1%牛血清白蛋白的PBS,震荡混匀,1000r/min离心5分钟,弃上清,加入1%多聚甲醛200μL,震荡混匀,2~8℃避光保存,在24h内用流式细胞仪检测分析。
取第3代hAD-MSCs制备细胞爬片,用PBS洗涤3次,每次5min。4%多聚甲醛室温固定10分钟,PBS洗涤3次,每次5分钟。0.3%Triton-X100,37℃下透膜10min,PBS漂洗3次,每次5min。山羊血清封闭液37℃下孵育30min。滴加鼠抗人CK-19和波形蛋白一抗(空白对照用PBS代替一抗),放入湿盒,4℃孵育过夜。孵育后用PBS冲洗3次,每次5min。滴加羊抗鼠二抗,37℃避光孵育30min,PBS漂洗3次,每次5min。DAPI复染细胞核10min,PBS漂洗3次,每次5min。DAB显色3~5min,自来水充分冲洗。光镜下DAB显色,苏木素复染,干燥脱水封片,倒置荧光显微镜拍照。细胞核为蓝色荧光,包浆中波形蛋白表达阳性显红色荧光。
3、小鼠异位心脏移植模型制备:
SPF级C57BL/6与BALB/c小鼠(23±3g)各20只,自由饮水进食,适应性饲养1周后用于实验,实验前12h禁食。随机分为hAD-MSCs治疗组(10只)与模型组(10只)。
受体准备:使用0.5%的戊巴比妥钠麻醉受体BALB/C小鼠后,将小鼠腹部朝上固定,并对其右侧颈部进行备皮与消毒。使用剪刀剪开小鼠右侧颈部皮肤约1cm左右,暴露右侧颈外静脉,游离并去除小分支,在该静脉第一个属支处结扎并使用静脉夹夹闭,剪断结扎处近心侧。将准备好的颈外静脉翻套于自制套管(22号留置针裁剪制成)上,并用9-0丝线固定翻套的血管。静脉端准备工作完成。切除小鼠下颌腺体及部分胸锁乳突肌后,在气管旁找到右颈总动脉,在其颈内外动脉分支处结扎该动脉,动脉夹夹闭近心端后剪断结扎处近心侧。将准备好的右颈总动脉翻套于自制套管(26号留置针裁剪制成)上,并用9-0丝线固定翻套的血管。套管法颈部心脏移植的受体准备工作完成。
供心回收:使用0.5%的戊巴比妥钠麻醉供体C57BL/6小鼠后,将小鼠腹部朝上固定于手术台上,并进行备皮与消毒。使用剪刀沿腹中线打开腹腔,棉签拨开肠管暴露下腔静脉,向下腔静脉缓慢注射0.5ml50IU/ml的肝素。注射完成后棉签压迫止血,并等待1min完成小鼠的全身肝素化。剪破腹主动脉并快速打开胸腔,使用提前备好的4℃冰盐水滴于心脏上为心脏降温。5-0丝线结扎上腔静脉防止血液回流,并向下腔静脉注射4℃50U/ml肝素直至心脏血液冲净,随后经下腔静脉注射4℃3ml停搏液以保护心脏。将主动脉与肺动脉分离干净后从远心端剪断,并用5-0丝线将所有剩余血管一并结扎。剪断所有的结扎血管并将心脏小心取下,尽快进行下一步。
接入移植心脏:供心的主动脉套于翻有右颈总动脉的套管上,并用9-0丝线固定主动脉;将供心的肺动脉套于翻有右颈外静脉的套管上,并用9-0丝线固定主动脉。移除静脉动脉夹,观察心脏的灌注恢复情况并调整好心脏的位置,5-0缝合线关闭右侧颈部皮肤。套管法颈部心脏移植模型完成。
4、hAD-MSCs注射:
选第3~5代hAD-MSCs,用0.125%胰蛋白酶消化,PBS洗涤2遍,经300目不锈钢过滤网过滤,用PBS制成浓度为5×10
5、标本采集:
在异位心脏移植术后第7天,使用小动物活体成像系统观察hAD-MSCs在心脏移植受体中的分布情况。每组选择3只小鼠5%戊巴比妥钠过量麻醉处死,打开缝合的右侧颈部皮肤,回收移植心脏,用10%甲醛固定,石蜡包埋后制成切片并进行H&E染色观察小鼠移植心脏的病理变化。剩余小鼠通过每日定时触诊4次记录移植心脏的存活状态。
6、实验结果:
(1)hAD-MSCs鉴定:流式细胞术检测结果,第3代hAD-MSCs的CD44(99.99%)、CD73(99.77%)、CD105(99.88%)呈阳性表达,CD45(0.14%)、CD34(0.40%)、HLA-DR(0.06%)呈阴性表达(如图1所示)。免疫荧光检测第3代hAD-MSCs胞浆中波形蛋白表达情况,结果显示第3代hAD-MSCs胞浆内波形蛋白呈阳性表达(如图2所示)。
(2)小动物活体成像:在移植术后第7天试用小动物活体成像系统观察hAD-MSCs的体内分布情况,如图3所示,术后第1、4天腹腔注射的hAD-MSCs有着向移植心脏处归巢的趋势,活体成像显示颈部移植心脏处的荧光信号较高。
(3)hAD-MSCs治疗对移植心脏的保护作用:于移植后第7天回收移植心脏制作石蜡切片并进行H&E染色。染色结果显示,与模型组相比,hAD-MSCs治疗组移植心脏的炎性细胞浸润与心肌损伤更轻(如图4所示),提示hAD-MSCs可减轻移植心脏的排斥反应损伤。通过触诊检测移植心脏的存活时长,结果显示hAD-MSCs治疗可有效延长移植心脏的存活时长(如图5所示)。提示本发明可对移植心脏发挥保护作用。
7.尾静脉注射hAD-MSCs在小鼠异位心脏移植受体中的细胞分布:
为比较外周静脉与腹腔注射hAD-MSCs悬液的体内细胞分布差异,对小鼠异位心脏移植受体进行了hAD-MSCs悬液的尾静脉注射,小动物活体成像如图6所示,与腹腔注射相比,尾静脉注射小鼠的荧光信号并不单纯集中于颈部。提示腹腔注射hAD-MSCs具有更好的移植心脏处归巢效果。
本发明选择采取腹腔注射的方式给药,与原位注射相比降低了注射时重要脏器损伤的风险,更加安全可行。与外周静脉给药相比减少了间充质干细胞的肺部滞留问题,避免了可能出现的微血栓形成问题,扩大了给药的可用剂量范围,增加了移植心脏处的细胞数量,可发挥较好的治疗效果。
以上仅为本发明的具体应用实例,但本发明的保护范围并不局限于此,凡采用等同替换改变的技术方案均落在本发明所要求的保护范围之内。
- 一种人羊膜间充质干细胞悬液的制备与应用
- 一种芽孢杆菌目的菌株感受态细胞冻存悬液及感受态细胞和冻存悬液的制备方法
