抑制新血管形成的C-19类固醇
文献发布时间:2023-06-19 11:54:11
本申请是申请号为201580071870.0、申请日为2015年12月21日、发明名称为“抑制新血管形成的C-19类固醇”的专利申请的分案申请。
技术领域
本发明涉及医学领域,特别涉及C-19类固醇化合物的新用途,更特别涉及具有特定结构构型(特别是在4位和/或17位上)的雄烯-3-酮结构的C-19类固醇用于抑制新血管形成、血管发生的新用途和另外的用途。本发明特别涉及在治疗牵涉例如与肿瘤相关或炎性病症相关的病理性新血管形成和/或过度再生过程的疾病中抑制内皮细胞和/或平滑肌细胞的增殖和/或迁移的选择的C-19类固醇。此外,本发明涉及增殖、癌症和/或炎症相关的生长因子或生长因子受体的合成或表达(尤其在炎症和/或癌症和相关组织的相关病症的治疗情形下)的减少,所述生长因子或生长因子受体选自由血管内皮生长因子(VEGF)、血管内皮生长因子受体(VEGFR)和功能相关的生长因子,特别是成纤维细胞生长因子受体13(FGFR13)、血小板衍生生长因子受体(PDGFR)a和/或β、肥大/干细胞生长因子受体(SCFR;也称为c-Kit或酪氨酸蛋白激酶Kit或CD117)组成的组。
背景技术
血管发生是组织血管形成的生理过程,涉及新血管生长到无论是否需要它们的组织中。例如,在缺氧的情况下,因为这种情况可能类似于伤口形成后的情况,认为细胞释放血管发生因子,从而诱导新的血管生长。例如,血管内皮生长因子被认为是诱导内皮细胞(即,形成血管,导致血管形成的细胞)增殖的最重要的因素。
然而,在几种病理状况下这种生理过程可能失调,导致新血管的过度和不必要甚或有害的形成(它也被称为新血管形成)。一方面,这种新血管形成的情况自身可能引起疾病或病理状况,例如,在过度的瘢痕形成或新生血管性青光眼的情况下。另一方面,新血管形成促进某些疾病的进展,因为这例如由几种实体瘤,例如乳腺癌、前列腺癌或淋巴瘤,如霍奇金淋巴瘤或非霍奇金淋巴瘤,或非实体瘤,如多发性骨髓瘤触发。
由于血管发生或新血管形成是肿瘤的标志,因此抑制新血管的形成从而使肿瘤“饿死”是抗癌治疗中的一个概念。已经开发了几种新的化合物,旨在阻断内皮细胞的增殖和迁移。例如,抗VEGF的单克隆抗体-贝伐珠单抗(Avastin)-成功应用于具有不同肿瘤的患者以预防转移和使肿瘤萎缩。
除了阻断VEGF及其受体VEGFR的抗体外,小分子被广泛用作酪氨酸激酶抑制剂(TKIs,如舒尼替尼和第二代药物多韦替尼(Dovitinib)=TKi 258),概述在Mukherji等人或Heidegger等人针对前列腺癌的综述中(Mukherji D,Temraz S,Wehbe D,ShamseddineA:Angiogenesis and anti-angiogenic therapy in prostate cancer.CriticalReviews in Oncology/Hematology 87(2013)122-131;Heidegger I,Massoner P,EderIE,Pircher A,Pichler R,Aigner F,Bektic J,Horninger W,Klocker H:Noveltherapeutic approaches for the treatment of castration-resistant prostatecancer.Journal of Steroid Biochemistry&Molecular Biology 138(2013)248-256)。
然而,贝伐珠单抗移或小分子抑制剂的摄入可能伴随着几种严重和/或严重性较低的副作用;此外,在治疗过程中在临床环境中定期观察到耐药性的发生。因此,需要用于抗血管发生疗法(该疗法伴随的副作用较少)的新型靶分子。
近来,争议性地评估了类固醇激素对血管发生的影响。例如,Frank-Lissbrant及同事描述了重复皮下施用睾酮后阉割大鼠的大鼠腹部前列腺叶中的快速新血管形成。(Franck-Lissbrant I,
另外,Liao等人描述了睾酮促进培养的人脐带内皮细胞(HUVECs)的血管内皮细胞迁移的作用(Liao W,Huang W,Guo Y,Xin M,Fu X:Testosterone promotes vascularendothelial cell migration via upregulation of ROCK-2/moesin cascade.Mol BiolRep(2013)40:6729-6735)。
在Traish和Galoosian的综述中进一步启示了睾酮在勃起生理功能背景下内皮祖细胞发育和成熟中在调节内皮功能和发挥作用中的作用(Traish AM,Galoosian A:Androgens modulate endothelial function and endothelial progenitor cells inerectile physiology.Korean J Urol 2013;54:721-731)。
Eisermann等人报道,雄激素类似物R1881在前列腺癌细胞系中诱导VEGF表达,由此可能导致VEGF诱导的血管发生(Eisermann K,Broderick CJ,Bazarov A,Moazam MM,Fraizer GC:Androgen up-regulates vascular endothelial growth factorexpression in prostate cancer cells via an Sp1 binding site.Molecular Cancer2013,12:7)。
与之相反,Chao等人描述了与ERα和ERβ受体具有结合特性的合成类固醇SR16388的抗血管发生作用(Chao WR,Amin K,Shi Y,Hobbs P,Tanabe M,Tanga M,Jong L,CollinsN,Peters R,Laderoute K,Dinh D,Yean D,Hou C,Sato B,Alt C,Sambucetti L.:SR16388:a steroidal antiangiogenic agent with potent inhibitory effect ontumor growth in vivo.Angiogenesis.2011Mar;14(1):1-16)。
使用其它众所周知的雄激素也观察到了对于血管发生的不可预测的影响,这些雄激素同时在市场中均被禁用或由于它们的副作用被撤回。Thomas等人描述,达那唑(17α-乙炔基-17β-羟基雄-4-烯并[2,3-d]异
诺龙,即17β-羟基雌-4-烯-3-酮,也是众所周知的合成代谢药物,其对HUVEC细胞具有某些抗增殖性质(D'Ascenzo S,Millimaggi D,Di Massimo C,Saccani-Jotti G,BotrèF,Carta G,Tozzi-Ciancarelli MG,Pavan A,Dolo V.:Detrimental effects ofanabolic steroids on human endothelial cells.Toxicol Lett.2007Mar 8;169(2):129-36.)然而,并不知晓这是否转化成抑制血管发生,因为在肌萎缩性侧索硬化的动物模型中观察到诺龙增加TGF-β的形成,已知其可刺激最有效的血管发生因子之一即VEGF的表达(Galbiati M,Onesto E,Zito A,Crippa V,Rusmini P,Mariotti R,Bentivoglio M,Bendotti C,Poletti A.The anabolic/androgenic steroid nandrolone exacerbatesgene expression modifications induced by mutant SOD1 in muscles of mousemodels of amyotrophic lateral sclerosis.Pharmacol Res.2012Feb;65(2):221-30)。相反,诺龙降低了运动大鼠肌肉中的VEGF水平(Paschoal M,de Cássia Marqueti R,PerezS,Selistre-de-Araujo HS.Nandrolone inhibits VEGF mRNA in rat muscle.Int JSports Med.2009Nov;30(11):775-8)。
司坦唑醇(17α-甲基-5α-雄甾烷并[3,2-c]吡唑-17β-醇)增加TGFβ1的表达,已知其增加最有效的血管发生因子VEGF的产生(Cao Y,Townsend CM,Ko T:Transforminggrowth factor-beta(TGF-beta)induces vascular endothelial growth factor(VEGF)and plasminogen activator inhibitor-1(PAI-1)gene expression through Smad3transcription factor.ACS,2005Volume 201,Issue 3,增刊17-18)。
此外,Thorpe等人证实肝素己二酰肼(HAH-)连接的皮质醇可能代表用于治疗癌症和其它血管发生疾病的新型血管发生抑制剂(Thorpe PE,Derbyshire EJ,Andrade SP,Press N,Knowles PP,King S,Watson GJ,Yang YC,Rao-BettéM.:Heparin-steroidconjugates:new angiogenesis inhibitors with antitumor activity in mice.CancerRes.1993年7月1日;53(13):3000-7.)
根据类固醇激素的各种潜在靶分子,例如类固醇激素受体或酶,变得明显的是,特定的细胞或组织与特定的类固醇相互作用的结果因性别与性别、组织与组织以及可利用和有活性的类固醇受体的特定模式的不同而不同。对类固醇激素的特异性生物学反应受以下因素影响:(i)例如类固醇激素受体的表达模式的差别;(ii)酶的表达以及(iii)调节受体应答的受体辅因子(共激活剂或共阻抑剂)的表达的差异以及(iv)细胞培养物、器官或组织中类固醇的存在。对天然类固醇或合成类似物的生物学反应的预测看起来是困难的;基于可利用的文献,本领域技术人员甚至可以预测睾酮样化合物可诱导血管发生。
因此,需要且本发明的目的在于提供有效的血管发生抑制剂,其能够抑制内皮细胞和/或平滑肌细胞增殖和/或迁移和/或减少VEGF和/或VEGFR的合成或表达,从而在牵涉过度再生过程的疾病(即在各种疾病中发生的过程)中抑制新血管形成。
从以下对本发明的描述中将变得明显的这些目的以及其它目的通过独立权利要求的主题来获得。本发明的一些优选实施方案由从属权利要求的主题来定义。
发明内容
在以下项目中分别以单独或组合方式概括本发明的各个方面、有利特征和优选实施方案,它们促成解决本发明的目的。
1.由式1定义的化合物,及其盐,
其中
a、b和c彼此独立地分别表示单键或双键,条件是a、b和c中的至少一个表示双键,且条件是如果a是单键且b是双键,则R
R
R
R
R
它们作为血管发生抑制剂用于医学治疗中。
2.由式1定义的化合物,及其盐,
其中
a、b和c彼此独立地分别表示单键或双键,条件是a、b和c中的至少一个表示双键,且条件是如果a是单键且b是双键,则R
R
R
R
R
它们通过单独或以组合方式抑制如下各项的增殖或合成用于炎症和/或癌症的疗法中:内皮细胞增殖、平滑肌细胞增殖、内皮细胞迁移、平滑肌肉细胞增殖、血管内皮生长因子(VEGF)、血管内皮生长因子受体(VEGFR)、成纤维细胞生长因子受体13(FGFR 13)、血小板衍生生长因子受体(PDGFR)α和/或β以及肥大/干细胞生长因子受体(SCFR;也称为c-Kit或酪氨酸蛋白激酶Kit或CD117)。
3.根据第1或2项应用的化合物,其中该化合物被定义为a和c为单键,b为双键,且R
4.根据第1项至第3项中任意一项应用的化合物,其中该化合物为4-羟基睾酮(4-OHT)或其盐或酯类。
5.根据上述项目中任意一项应用的化合物,它用作牵涉再生过程的病理状态中的新血管形成的抑制剂。
6.根据上述项目中任意一项应用的化合物,它用于预防或抑制炎性病症中的血管形成。
7.根据第6项应用的化合物,其中所述炎性病症选自关节炎、炎性肠病、湿疹、神经性皮炎。
8.根据第1项至第5项中任意一项应用的化合物,它用于预防或抑制由肿瘤触发的新血管形成。
9.根据第8项应用的化合物,其中新血管形成由乳腺组织的肿瘤(优选乳腺癌)或前列腺组织的肿瘤(优选前列腺癌)触发。
10.根据上述第1项至第5项中任意一项应用的化合物,它用于预防或治疗实体瘤,以及它们的转移。
11.根据第10项应用的化合物,其中所述实体瘤选自肾癌,例如肾细胞癌,结肠直肠癌,肺癌,脑癌且特别是胶质母细胞瘤,卵巢癌,胰腺癌和淋巴瘤,以及它们的转移。
12.根据上述第1项至第5项中任意一项应用的化合物,它用于预防或治疗非实体瘤及其转移。
13.根据第9项应用的化合物,其中所述非实体瘤是多发性骨髓瘤及其转移。
14.根据上述第1项至第5项中任意一项应用的化合物,它用于预防或治疗血管或血管增生性肿瘤,优选内皮细胞肿瘤,其选自血管瘤。
15.用于上述第1项至第7项中任意一项应用的化合物,它用于预防或治疗眼相关性疾病。
16.根据上述第1项至第5项中任意一项应用的化合物,它用于预防或治疗眼相关性疾病,其选自糖尿病视网膜病变,黄斑变性,眼部炎症,特别是角膜炎,角膜血管形成,玻璃体中充满血管,眼晶状体的血管形成。
17.根据上述第1项至第5项中任意一项应用的化合物,它用于预防或抑制伤口修复中包括将规则功能组织转化为软组织的新血管形成。
18.根据第17项应用的化合物,它用于减少在急性或慢性损伤后器官例如肝脏或心脏中或在皮肤上的过度瘢痕形成。
19.根据上述第1项至第5项中任意一项应用的化合物,它用于预防或抑制血管畸形,特别是皮肤或实体器官(肝、脑、心脏)中的血管瘤。
20.根据上述第1项至第5项中任意一项应用的化合物,它用于预防或抑制心血管疾病,特别是高血压、血管狭窄或再狭窄和动脉硬化。
21.根据上述第1项至第5项中任意一项应用的化合物,它用于针对肥胖的治疗。
22.根据上述第1项至第5项中任意一项应用的化合物,它用于针对子宫内膜异位症的治疗。
23.药物组合物,它包含上述项目任意一项中所定义的通式的化合物和药学上可接受的载体和/或赋形剂,用于根据上述项目任意一项的医学治疗中。
24.根据第23项的药物组合物,其中该药物组合物被制备用于皮肤、粘膜或粘膜下、透皮、肌内、皮下、静脉内、口服或栓剂施用或滴入腔。
25.根据第23或24项的药物组合物,其中该药物组合物被制备用于经口应用、皮下、皮肤、肌内静脉内、眼内、鼻腔或透皮施用。
26.组合,它包含:
(i)活性物质,其选自针对VEGF、VEGFR或可溶性VEGFR/VEGFR杂合体的抗体和酪氨酸激酶抑制剂,以及
(ii)由式1定义的化合物,及其盐,
其中
a、b和c彼此独立地分别表示单键或双键,条件是a、b和c中的至少一个表示双键,且条件是如果a是单键且b是双键,则R
R
R
R
R
27.药物组合物,它包含根据第26项的组合。
28.第1项至第27项任意一项中所定义的化合物或药物组合物作为抗血管发生剂在医学治疗中的用途。
29.根据第26项或第27项的组合作为抗血管发生剂在医学治疗中的用途。
附图说明
图1A和B:使用WST-1试验单独或以组合方式分别将HUVEC细胞暴露于4-OHT和TKI258时的增殖测定;
图2A:transwell迁移试验的原理;
图2B:HUVEC细胞暴露于4-OHT时的transwell迁移试验的分析;
图3:HUVEC细胞暴露于4-OHT时的伤口愈合试验;
图4:使用基质胶的HUVEC细胞暴露于4-OHT时的试管迁移试验。
具体实施方式
现在通过优选实施方案和实施例更详细地描述本发明,然而这些优选实施方案和实施例仅为示例性目的而提供,不应当被理解为以任何方式限制本发明的范围。
本发明提供上文所定义的通式1的化合物,令人惊奇地发现所述化合物有效抑制血管发生,且特别是(i)至(vi)的任何一项或组合:
(i)抑制内皮细胞增殖;
(ii)抑制平滑肌细胞增殖;
(iii)抑制内皮细胞迁移;
(iv)抑制平滑肌细胞迁移;
(v)减少VEGF蛋白表达或合成;
(vi)减少VEGFR蛋白表达或合成;
(vii)减少功能相关生长因子的蛋白质表达或合成,包括成纤维细胞生长因子受体13(FGFR 13)、血小板衍生生长因子受体(PDGFR)α和/或β的和肥大/干细胞生长因子受体(SCFR;也称为c-Kit或酪氨酸蛋白激酶Kit或CD117)的蛋白质表达或合成。
因此,它特别适合于治疗组织中牵涉包括新血管形成的过度再生过程的疾病。此外,在受这种异常增殖的患者中,和/或发生这种异常增殖的患者中的特定组织和器官靶标中,上述抗癌/抗增殖和/或抗炎治疗(i)至(vii)的任何一项将是特异性和选择性地有效的。令人惊奇地发现上文具体说明的式1的化合物及其优选实施方案(即,1的化合物,且优选其中a和c为单键,b为双键,R
重要的是,上文提及的组织可以特别地是人体中的组织或器官,其中(新)血管形成可能发生并且可以由特定肿瘤触发,例如癌性或非癌性乳腺组织,前列腺组织,任何肠组织,肺组织,肾组织,脑,眼,卵巢组织或在血管异常的情况下血管组织本身,例如血管或血管增生性肿瘤,例如血管瘤或血管畸形,例如慢流性血管畸形,毛细血管畸形,静脉畸形,淋巴管畸形,快流血管畸形,动脉畸形,动静脉畸形,动静脉瘘或组合性血管畸形(上述各项的各种组合)。
因此,式1的化合物对于引发(新)血管形成的病理状况或情况非常有用,例如在肿瘤或任何炎性病症的相应情况中。式1的化合物对于预防或治疗其它癌症和/或其转移非常有用,其中抗血管发生或血管形成/新血管形成或上文提及的抑制或减少(i)至(vii)的情况是相关的,例如用于预防或治疗肾癌,例如肾细胞癌,结肠直肠癌,肺癌,脑癌,特别是胶质母细胞瘤卵巢癌,多发性骨髓瘤,淋巴瘤,炎性疾病,例如类风湿关节炎,伤口修复以减少瘢痕形成(特别是在急性或慢性损伤后在器官例如肝脏或心脏中或皮肤上),血管畸形,血管或血管增生性肿瘤,内皮细胞肿瘤,例如血管瘤(特别是肝脏、脑和/或心脏中),眼相关疾病,例如(糖尿病性)视网膜病变,黄斑变性,眼部炎症,心血管疾病,特别是高血压,血管狭窄或再狭窄,例如由动脉硬化引起的,特别是动脉粥样硬化,例如在损伤后和/或在血管成形术或支架植入的情况下。
此外,本发明的血管发生抑制剂可以用作减肥药,因为已知脂肪组织中的血管从来不会完全成熟,因此被血管发生抑制剂破坏(D.Bruemmer,Targeting Angiogenesis asTreatment for Obesity;Arteriosclerosis,Thrombosis,and Vascular Biology 32(2),161-162,2012)。
此外,由于抗血管发生与对子宫内膜异位症的积极作用之间的联系,本发明的血管发生抑制剂可以用作治疗子宫内膜异位症的活性物质。
此外,式1的化合物在治疗肿瘤例如肾细胞癌中是非常有用的,所述肿瘤通常对初始抗癌治疗产生抗性,因此需要使用例如mTOR抑制剂或第二代TKIs的第二线疗法。因此,本发明的化合物提供在抗性形成后经典抗癌疗法的替代方案。
此外,本发明提供组合,它包含上文具体说明的式1化合物或其优选结构形式以及选自针对VEGF、VEGFR或可溶性VEGFR/VEGFR杂合体的抗体和酪氨酸激酶抑制剂(TKIs)的活性物质。“组合”意指在常规组合物或常规剂型内的固定组合,或单独的但相关联的组合,例如,以同时或依次施用的分别包含式1的化合物和所具体说明的抗体或TKI的组合物的方式。所述抗体的优选实例包括针对VEGF的单克隆抗体贝伐珠单抗(Avastin),并且TKI的优选实例包括舒尼替尼、多韦替尼(TKI258)、伊马替尼、索拉非尼和上文引用的Mukherji等人(2013)和Heidegger等人(2013)进一步报道的那些TKI。
此外,式1的化合物对于治疗由肿瘤,特别是癌症或其转移,例如乳腺癌或前列腺癌或其转移引发的血管发生是非常有用的。
令人惊奇地且不同于相关化合物对激素相关的肿瘤细胞生长和转移形成的抑制作用的现有研究,尤其与乳腺癌或前列腺癌有关(WO2007/131736,WO 2007/131737),本发明人发现如上所定义的通式1的化合物抑制人内皮细胞和/或平滑肌细胞的增殖和/或迁移。此外,令人惊奇地发现,如上所定义的通式1的化合物减少发炎和/或癌症环境中VEGF和VEGFR的表达。例如在抗癌治疗的情况下,并且再次独立地且不同于牵涉抑制激素相关的肿瘤细胞生长和转移形成的治疗,例如与乳腺癌或前列腺癌相关的情况就是如此(WO 2007/131736,WO2007/131737),本发明的发现允许在相应的新临床环境中利用抗血管发生治疗。例如,与癌性靶细胞和组织的直接破坏不同,根据本发明的血管发生的抑制允许通过抗血管发生和/或通过上文具体说明的抑制或减少作用(i)至(vii)有效地进一步抑制肿瘤生长和肿瘤血管形成。以这种方式,肿瘤可以滋养自身且因此可以中断转移的方式,最终导致肿瘤饥饿且由此导致间接抗肿瘤活性。例如,通过抑制由这类肿瘤触发的血管发生可以实现这类激素相关的癌症和转移例如乳腺癌或前列腺癌的治疗。
此外,与仅一般性合成代谢作用如胶原蛋白和任选其它支持性蛋白质的稳定化且由此考虑支持性组织的稳定化以及相关治疗如心肌梗塞和脑梗塞,动脉硬化,尿失禁等(WO2009/062683)不同,本发明的发现另外允许在相应的新临床环境中利用抗血管发生治疗。
关于治疗应用一般来说,新的临床环境的特征在于例如患者群、时机(例如何时和何地开始治疗的决定)、剂量和与其它治疗组合方面的差异。
不受任何理论束缚,假定这归因于例如在上文提及的发炎和/或癌组织的细胞中,例如形成上文提及的器官和/或上文提及的肿瘤任何上皮细胞中或在基质细胞中的例如VEGF和/或VEGFR和/或其它增殖相关、癌相关和/或炎症相关的生长因子或生长因子受体的下调,因此间接对血管细胞具有抗血管发生作用,或归因于内皮细胞和/或平滑肌细胞自身中VEGF和/或VEGFR和/或其它增殖相关、癌相关和/或炎症相关的生长因子或生长因子受体的下调。因此,本发明提供用于治疗牵涉内皮细胞和/或平滑肌细胞的不期望的增殖和/或迁移的疾病的化合物,例如用于上文提及的疾病的化合物。
基于本发明的这些令人惊奇的发现,式I化合物可靠地可用于其中牵涉功能相关生长因子的治疗性临床环境中,所述的功能相关生长因子特别是成纤维细胞生长因子受体13(FGFR 13),血小板衍生生长因子受体(PDGFR)a和/或β,以及肥大/干细胞生长因子受体(SCFR;也称为c-Kit或酪氨酸蛋白激酶Kit或CD117)。
这种抑制作用可以在不同方面得到利用:
1.可以有效抑制肿瘤引发的新血管形成;
2.可以抑制新血管形成为发炎组织;
3.可以抑制内皮细胞和/或平滑肌细胞自身的异常增殖,因为这可能是内皮细胞肿瘤或血管畸形中的病理改变。
在使用中,可以以适合于抑制内皮细胞和/或平滑肌细胞的增殖和/或迁移的量向患者施用上文提及的化合物。此外,该应用可以通过适当的应用条件来确定,例如患者的类型,或靶部位或器官的类型或能够将上文提及的活性在体内运送到患者体内的指定最终靶部位或器官的药物组合物或制剂。
此外,上文提及的化合物可以局部施用和/或施用于粘膜,例如,以软膏剂,乳膏剂,洗剂,凝胶剂,喷雾剂,粉剂,油剂或透皮膏剂的形式,还包含贮库使用形式(包括小丸);其可以通过肠胃外施用,例如,通过肌内或通过静脉内或皮下注射或输注,或鼻内,滴入腔(例如膀胱,腹部,肠)和/或口服,例如以片剂,胶囊,糖衣或薄膜包衣片剂,液体溶液或混悬剂的形式,或通过直肠施用,例如以栓剂的形式,或通过眼内施用,例如,以注射剂的形式和作为滴眼剂。
用于抑制内皮细胞和/或平滑肌细胞的增殖和/或迁移的施用量可以例如根据使用者的年龄,体重,状况和施用形式进行适当选择;例如,适合于口服施用于成人的剂量可以为每次施用约1至约150-1000毫克,每天1至5次。
因此,所述的化合物可以包含在进一步包含药学上可接受的载体和/或赋形剂和/或稀释剂的药物组合物中。
对于局部使用,可以通过包括如下成分配制组合物:例如,植物油和脂肪,例如杏仁油、花生油、橄榄油、桃仁油、蓖麻油;植物提取物;醚类油;另外植物蜡和合成油和动物油;脂肪和蜡,例如硬脂酸和硬脂酸酯、月桂酸和月桂酸酯、山梨坦酯、鲸蜡硬脂醇;卵磷脂、羊毛脂醇、胡萝卜素、香料、一元醇或多元醇、脲、表面活性剂,例如泊洛沙姆、吐温等;防腐剂和着色剂等。优选作为水包油或油包水型乳剂的制剂。
固体口服形式可以例如包含(与活性化合物一起)稀释剂,例如,乳糖,葡萄糖,蔗糖,纤维素,玉米淀粉或马铃薯淀粉;润滑剂,例如二氧化硅,滑石粉,硬脂酸,硬脂酸镁或硬脂酸钙,和/或聚乙二醇,泊洛沙姆,生育酚聚乙二醇琥珀酸酯(TPGS);粘合剂,例如淀粉,阿拉伯树胶,明胶,甲基纤维素,羧甲基纤维素或聚乙烯吡咯烷酮;崩解剂,例如淀粉,海藻酸,藻酸盐(酯)或淀粉羟乙酸钠;泡腾混合物;染料,甜味剂;润湿剂,例如卵磷脂,聚山梨酯,月桂基硫酸盐;以及通常用于药物制剂中的无毒和药理学上无活性的物质。这些制剂可以以已知的方式制备,例如通过混合,制粒,压片,包糖衣或包薄膜衣的方法。用于口服的液体分散液可以是例如,糖浆剂,乳剂和混悬剂。
糖浆剂可以包含作为载体的例如蔗糖或蔗糖与甘油和/或甘露糖醇和/或山梨醇。
混悬剂和乳剂可以包含作为载体的例如天然树胶,琼脂,藻酸钠,果胶,甲基纤维素,羧甲基纤维素或聚乙烯醇,泊洛沙姆或TPGS。
用于肌内注射的混悬剂或溶液可以包含(与活性化合物一起)药学上可接受的载体,例如,无菌水,橄榄油,油酸乙酯,二醇类,例如丙二醇,以及如果期望,适量的盐酸利多卡因。
用于静脉内或皮下注射或输注的溶液可以包含作为载体的例如无菌水,或者优选它们可以是无菌、含水、等渗盐溶液的形式。
栓剂可以包含(与活性化合物一起)药学上可接受的载体,例如,可可脂,聚乙二醇,聚氧乙烯山梨醇酐脂肪酸酯表面活性剂或卵磷脂。
适合的组合物的活性化合物含量可以为至少0.0001重量%,例如0.0001至20重量%,优选0.6重量%直到10重量%,进一步优选1至5重量%的根据本发明所用的化合物。
如果将物质混合以促进皮肤渗透,则当使用透明质酸酶时,它们的含量可以为例如0.01至1重量%,优选0.05至0.2重量%,当使用1至25重量%的二甲基异山梨醇酯或DMSO时,它们的含量可以优选5和10重量%,泊洛沙姆0.5-30%,TPGS 0.5-30%。
通过以下实施例的描述进一步举例说明本发明,但是这些实施例仅仅为示例性目的,不应以任何限制性方式理解它们。
以下章节中描述的所有实验至少一式三份进行,主要使用2个不同的细胞数和不同的培养时间。所有实验均额外进行多次重复(一种HUVEC不同的传代以及不同的制备物)。
简言之,通过本领域中已知的方法将人脐静脉内皮细胞(下文的HUVEC)从人脐带中新鲜分离出来,并用于从p4代直到p10代的实验中,以防止源自细胞的体外变化的任何人为产物。
在所有实验中,将C-19类固醇化合物4-OHT以所示的浓度添加到EGM-2培养基(Lonza)中的细胞中,以便避免源自培养基中所含的外源因子的任何人为产物。所有实验进行至少三次,并且显示出相同的反应模式。
通过使用用抗冯维勒布兰德因子(vWF)抗体的免疫细胞化学染色来评估所培养的HUVEC细胞的基因表达的同一性、分化和长期稳定性。vWF的表达对于内皮细胞是高度特异性的。vWF表达的稳定性在第1代与第10代之间进行了量化。在此时间方案中,在培养期内和所用的不同批次之间仅发生微小变化。
作为测定哺乳动物内皮细胞的细胞增殖的一种方法,增殖试验根据如下所述进行。
为了测定增殖率,进行WST-1试验。基本上,将1000个HUVEC细胞/孔接种在96孔板中并暴露于所示浓度的4-OHT(也用实验室编号CR1447表示)5天。通过测量经细胞线粒体脱氢酶将四唑鎓盐WST-1酶裂解成甲
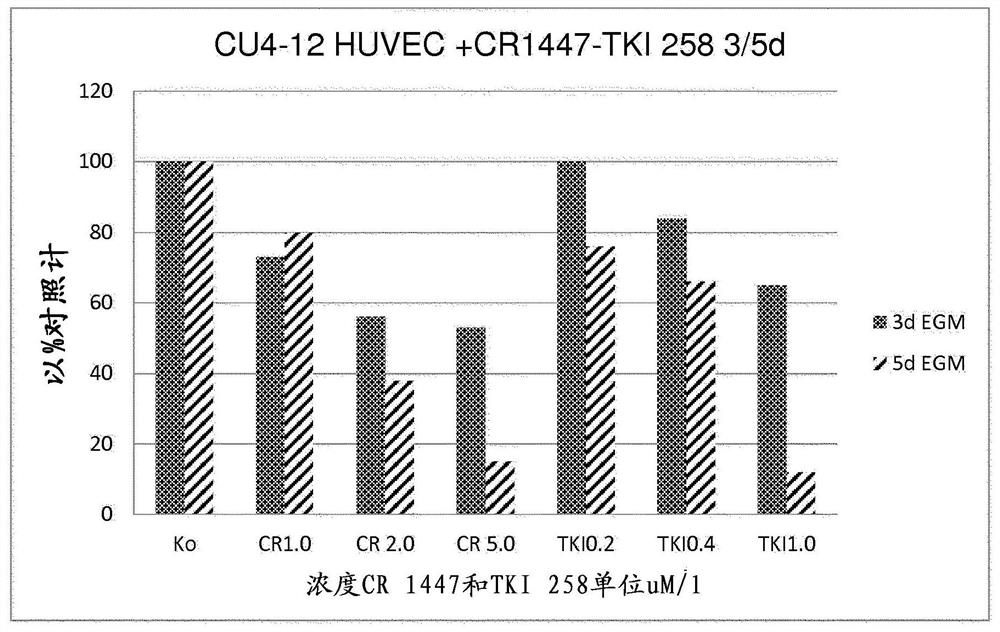
如图1A中所示,在所有3种HUVEC细胞培养物中,所有1、2和5μM浓度的4-羟基睾酮的生长抑制显示为非常显著(p<0.001)(t检验),与已知的VEGF抑制剂TKI258(多韦替尼)(0.2、0.4和1.0μM)相当。使细胞分别在内皮细胞生长培养基(EGM)中生长并传代培养3和5天。如图1B中进一步所示,CR1447与TKI 258组合的生长抑制(与单独的每种化合物相比)在所有3种HUVEC细胞培养物中也是非常显著的(p<0.001)(t检验)。
血管发生的先决条件是内皮细胞迁移到组织中的能力。在伤口愈合以及肿瘤生长的过程中观察到这一过程。内皮细胞沿着因子例如VEGF的梯度迁移到组织中。使用transwell系统,例如从图2A中显见的,可以在体外迁移模型中研究这种行为。具体地,图2A显示了用于监测细胞迁移的transwell试验的典型设置。
为了使用具有3μm孔径的PET膜的transwell系统(24孔w/o纤连蛋白涂敷)研究HUVEC细胞迁移,将不同细胞数的HUVEC细胞置于上部隔室中,而将引诱剂放在下部隔室中。将膜的引诱剂部位上的细胞数与在对照系统(缓冲剂对照)中可见的细胞数目和4-OHT存在下的引诱剂(VEGF)进行比较。
图2B显示了3次独立实验的典型图像,具体地通过使用Fl板块膜的transwell试验和迁移的HUVEC的碘化丙啶染色来进行。如所述接种细胞,并下部腔室中使用VEGF作为引诱剂进行迁移48小时。所述附图代表了来自3次独立实验的实例。与对照(Co)相比。可以看出,4-OHT显著抑制细胞迁移到膜中,这表明经受4.OHT(代码“CR”)处理的样品中迁移细胞的数量显著减少。
研究细胞迁移的另一种方法是伤口愈合(划痕)试验。该试验模拟在急性伤口愈合过程中发生的事件。通过从伤口区域释放因子,内皮细胞迁移到划痕区域,其模拟通过血管化和随后的瘢痕形成的伤口愈合和闭合的过程。概括地,将HUVEC细胞接种在12孔板中并允许其生长直至达到汇合。随后,设置划痕,由此取出划痕区域内的细胞。将细胞暴露于10μM的4-OHT,并且根据个体实验设计,使用2小时直到48小时的方案用显微镜监测内皮细胞向划痕区域内的迁移。
图3中显示了来自3次独立实验中的典型图像,其代表了使用不同浓度和时间方案的10次独立实验的典型结果。如所示,4-OHT有效地抑制了内皮细胞迁移,伤口愈合试验(划痕试验)中证实了这一点。24小时后,在4-OHT(CR1447)的影响下,与未处理的对照细胞相比,HUVEC细胞向划痕区域中的迁移明显减少。
迁移到划痕的组织中后,HUVEC细胞改变它们的生长特征并形成微管。这种效应可以用显微镜方法进行评估。
将HUVEC细胞接种在基质胶(7mg/ml)上。在接种时加入细胞悬浮液和包含10μM/L4-OHT的凝胶,使得在粘附到模拟基底膜特征的该表面上的过程中形成分支点。12小时和48小时后用显微镜方法分析管形成。
图4中显示了来自3次独立实验的典型图像。因此,通过施用4-OHT(下行中“CR”-说明的样品)显著地抑制了人体内皮细胞(HUVEC)的管形成。当将人内皮细胞置于基质胶质垫上时,与未处理的对照(红色箭头)相比,4-OHT抑制了作为管形成的一个标志物的分支点。因此,4-OHT显著地抑制了细胞的分支,并大量地破坏了凝胶上的线性细胞-细胞连接,这表明显著的(新)血管形成抑制。
- 抑制新血管形成的C-19类固醇
- 抑制新血管形成的C‑19类固醇
