石墨烯系多模态传感器
文献发布时间:2023-06-19 12:00:51
本申请是申请日为2016年10月7日、申请号为2016800718103、发明名称为“石墨烯系多模态传感器”的中国专利申请的分案申请。
相关申请的交叉引用
本申请要求2015年10月7日提交的题为“Graphene-based Multi-Modal Sensors(石墨烯系多模态传感器)”的美国临时专利申请No.62/238,489;和2015年10月7日提交的题为“Graphene-based Multi-Modal Sensors(石墨烯系多模态传感器)”的美国临时专利申请No.62/238,495的优先权日的权益。这些临时申请的全部内容通过引用并入本文。
技术领域
本发明涉及传感器。
背景技术
石墨烯有数个吸引人的特性。它与金属膜相比是柔软的且是可拉伸的,它是导电的、透明的,可经受大面积生长并转移至许多基材上,并且其晶粒可以延伸至达到1cm的尺寸。
发明内容
该公开的多模态传感器可以对机械刺激(拉伸、压缩应变)产生电响应,以及用作表面增强拉曼散射(SERS)基底,从而通过拉曼光谱评价局部化学环境。
本文公开的传感器和方法涉及具有空前的高灵敏度(在1%应变下的仪表灵敏系数(gauge factor)~700),可用的范围为0.001%应变至高于10%应变,和良好的循环性的应变传感器。
该公开的传感器和方法还包括沉积在光纤的前端的负载石墨烯的SERS基底,其使得可以远程操作拉曼传感应用。
本文公开的系统和方法提供使用机械应变传感器测量心肌细胞收缩的第一示范。通过在传感器基底上培养心肌细胞,可以使用本文公开的传感器和方法记录和分析自发的和受刺激的心肌细胞收缩。本文公开的应变传感器也可以用于结构健康监测(土木工程、航空学)、生物计量学获取(心率、运动检测)、地下水污染测试、体内生物化学分析(光纤导管插入术)、和药物发现(新型药物筛查、心脏毒性研究)。
在一个方面中,一种复合膜结构体的制作方法,所述方法包括,确定用于复合膜结构体的金属层的期望的形态;基于所述确定选择第一金属基材;将石墨烯层转移至第一金属基材上;将金属层沉积在石墨烯层上以实现所述期望的形态;和从石墨烯和沉积的金属层移除第一金属基材从而形成复合膜结构体。第一金属基材和沉积的金属层之间的表面能差导致金属层的期望的形态。
该实施方式可包括一个或多个以下特征。所述期望的形态可包括纳米岛。金属层中的纳米岛的边缘之间的距离可为分子尺寸的级别。沉积金属层可包括蒸发的金属原子流的沉积。蒸发的金属原子流可自组装而产生所述期望的形态。蒸发的金属原子流可通过电子束蒸发、热蒸发或溅射而产生。将石墨烯层转移至第一金属基材上可包括,将第二金属基材上生长的石墨烯层剥落并且将石墨烯层置于第一金属基材上。石墨烯层可包括单层石墨烯。可以使用化学气相沉积法在第二金属基材上生长石墨烯层。第一金属基材可包括过渡金属。过渡金属可包括金、银或镍。
该实施方式可包括一个或多个以下特征。一种用于表面增强拉曼散射的基底的形成方法,所述方法可包括:将石墨烯层沉积在第一金属基材上;将多个金属纳米岛沉积在石墨烯层上;从石墨烯层和沉积的多个金属纳米岛移除第一金属基材从而形成用于表面增强拉曼散射的基底。一种进行分析物的表面增强拉曼散射的方法,所述方法可包括:形成用于表面增强拉曼散射的基底;将基底转移到光纤上;将分析物涂覆在基底上;和记录来自分析物的表面增强拉曼散射信号。多个金属纳米岛可包括等离子体激元活性金属。等离子体激元活性金属可包括铜、银、钯、金或铂纳米岛。
在其他方面中,一种薄膜应变传感器的制作方法,所述方法包括,将石墨烯层沉积在第一金属基材上;将金属层沉积在石墨烯层上;将聚合物施涂在石墨烯层和金属层上;蚀刻第一金属基材以形成能够检测跨越四个数量级的应变的应变传感器。
该实施方式可包括一个或多个以下特征。金属层可包括钯,第一金属基材包括铜,和聚合物包括聚二甲基硅氧烷。
在其他方面中,一种检测样品中的机械运动的方法,所述方法包括:使样品与复合膜结构体接触,并且使用该复合膜结构体测量通过机械运动引起的电信号。复合膜结构体包括配置在石墨烯层上的金属层、和在石墨烯层和金属层上的聚合物层。
该实施方式可包括一个或多个以下特征。样品可包括飞机部件,并且机械运动可包括飞机部件的挠曲。检测机械运动可包括检测结构体中的裂纹。样品可包括生物样品,并且复合膜结构体在身体外部使用。生物样品可包括器官,所述器官具有与环境空气的界面。机械运动可以传递生理信息。生理信息可包括心率、脉压、肌肉运动和呼吸中的一种或多种。身体是人体的一部分,人体的该部分具有与环境空气的界面。机械运动可以传递生理信息。生理信息可包括心率、脉压、肌肉运动和呼吸中的一种或多种。复合膜结构体可以是附着到皮肤或衣服上的可穿戴传感器的一部分。可穿戴传感器可用于触觉应用中。可穿戴传感器可用于器械假体中。
复合膜结构体可用于在人体外部的应用中。复合膜结构体可用于医疗保健应用中。
石墨烯层可以在将金属层沉积在石墨烯层上之前沉积在第一金属基材上,并且可将聚合物施涂在石墨烯层和金属层上。
所述方法可进一步包括在使样品与复合膜结构体接触之前蚀刻第一金属基材。
使样品与复合膜结构体接触可包括通过将复合膜结构体转移至样品上而用复合膜结构体覆盖样品。
样品包括生物细胞。生物细胞包括心肌细胞、神经元、肌肉细胞和表皮细胞中的一种或多种。金属层包括金纳米岛,并且聚合物包括聚甲基丙烯酸甲酯。
在其他方面中,一种基底,所述基底包括石墨烯层,在石墨烯层上的多个金属纳米岛,多个纳米岛中的纳米岛边缘之间的距离为分子尺寸的级别。该基底可构造为用于表面增强拉曼散射。
该实施方式可包括一个或多个以下特征。石墨烯层包括单层石墨烯,并且多个金属纳米岛包括金纳米岛。
在其他方面中,一种应变传感器,所述应变传感器包括石墨烯层;在石墨烯层上的金属层;以及在石墨烯层和金属层上的聚合物。应变传感器的压电电阻可允许检测跨越四个数量级的应变。
该实施方式可包括一个或多个以下特征。金属层可包括钯,第一金属基材可包括铜,聚合物可包括聚二甲基硅氧烷。石墨烯层可构造为抑制通过金属层的裂纹扩展。应变传感器的在1%应变下的仪表灵敏系数可以为至少1300。
在其他方面中,一种检测生物样品中的机械运动的方法,所述方法包括,通过将复合膜结构体转移到生物样品上而用复合膜结构体覆盖生物样品。所述方法包括使用复合膜结构体来测量通过机械运动引起的电信号。复合膜结构体包括沉积在石墨烯层上的金属层、以及在石墨烯层和金属层上的聚合物层,并且生物样品包括改造的(engineered)、培养的、或采集(harvested)的细胞或组织,和/或内脏器官。
该实施方式可包括一个或多个以下特征。生物样品包括培养的细胞,并且培养的细胞包括心肌细胞、神经元、肌肉细胞和表皮细胞中的一种或多种。生物样品包括培养的组织。培养的组织包括肌肉细胞。生物样品包括内脏器官。内脏器官包括心脏。在将金属层沉积在石墨烯层上之前,将石墨烯层沉积在第一金属基材上。将聚合物施涂在石墨烯层和金属层上。所述方法包括在用复合膜结构体覆盖生物样品之前蚀刻第一金属基材。第一金属基材包括过渡金属。金属层包括金纳米岛,并且聚合物包括聚甲基丙烯酸甲酯。
在其他方面中,一种测量生物样品中的机械运动的系统,所述系统包括:室;其上配置有生物样品的复合膜结构体,所述复合膜结构体具有与石墨烯层接触的金属层,和与金属层或石墨烯层接触的聚合物层。所述系统包括用于电接入复合膜结构体的电连接。所述系统包括在室内的中心开口,所述中心开口构造为接收配置在复合膜结构体上的生物样品。生物样品包括培养的细胞或组织。金属层包括多个金属纳米岛。
该实施方式可包括一个或多个以下特征。聚合物层与金属层接触,并且生物样品直接在石墨烯层上生长。聚合物层与石墨烯层接触,并且生物样品直接在金属层上生长。聚合物层包括透明聚合物。透明聚合物包括聚二甲基硅氧烷(PDMS)、聚甲基丙烯酸甲酯(PMMA)和聚对二甲苯(parylene)中的一种或多种。石墨烯层包括单层石墨烯,并且培养的细胞包括在基底上培养的心肌细胞。多个金属纳米岛包括等离子体激元活性金属。等离子体激元活性金属包括金纳米岛,并且电连接包括电极。复合膜结构体构造为基于因培养的细胞的收缩性活动而引起的应变生成电信号。所述系统包括构造成夹持承载培养的细胞的复合膜结构体的第二对基底。复合膜结构体构造为生成信噪比大于40的信号。复合膜结构体呈现亚毫秒(sub-millisecond)响应时间。所述系统构造为提供培养细胞的机械运动的幅度和时间分布(temporal profile)。所述系统构造为提供与培养细胞的活动相关的电阻抗分布。所述系统包括多个电极,其中第一电极位于培养的细胞的一侧上,第二电极位于培养的细胞的相反侧上。所述系统进一步包括能够以时间分辨的方式记录快速电流-电压信号的放大器。所述系统构造为提供由于培养细胞的活动引起的细胞膜电位分布。所述系统构造为通过光学观察在多个金属纳米岛中的金属纳米岛之间距离的变化来提供细胞收缩性的分布。金属纳米岛之间距离的变化构造为改变用于光学观察的光学光的波长。所述系统构造为提供暗场显微镜数据。所述系统构造为提供来自培养的细胞的拉曼散射数据。
本发明的一个或多个实施方案的细节在附图和以下说明中阐明。本发明的其他特征、目的和优点从说明书和附图中以及从权利要求书中将是显而易见的。
附图说明
图1|用于生成纳米岛(NI)(上部)的方法的示意图和通过将蒸发物(y-轴)电子束蒸镀在石墨烯/金属基材(x-轴)(底部)上而得到的在各种基材上的金属纳米岛的扫描电子显微照片。将10nm金(第一排)和10nm银(第二排)蒸镀在(从左到右):铜箔上的石墨烯(生长的)、镍上MAE-转移的石墨烯、金上MAE-转移的石墨烯、银上MAE-转移的石墨烯上。将各蒸发物在相同室内同时地沉积在基材上。比例尺:200nm。插图中的比例尺:50nm。
图2|如通过分子动态模拟预测的纳米岛的微结构演变。a:1.5nm金模拟蒸镀在铜上的石墨烯上。b:在500K下在20ns真空退火期间金纳米岛的总表面积的变化图。纳米岛的合并之前是结晶排列和颈缩(necking)(表面积增加)。c:1nm金蒸镀在铜上的石墨烯上的扫描电子显微照片。比例尺:50nm。
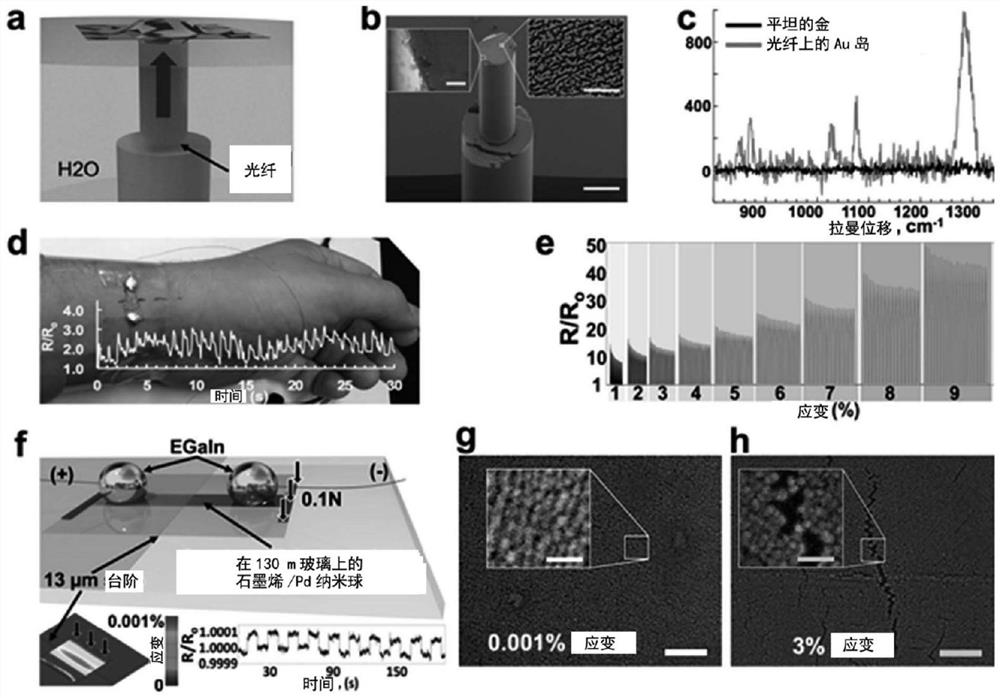
图3|纳米岛的应用。a:自由漂浮的金纳米岛/石墨烯SERS基底沉积在光纤的前端的示意图。b:在光纤的前端上的石墨烯/AuNI SERS基底的扫描电子显微照片(金是伪着色的(false-colored))。比例尺:150μm,左插图中是2μm,右插图中是500nm。c:来自石墨烯/AuNI-涂覆的光纤(灰色)和非结构化的100nm-厚金膜(黑色)的1-丁烷硫醇盐的拉曼光谱。d:用于脉搏的检测(图中叠加的)的置于桡动脉上部的PDMS/石墨烯/PdNI应变传感器的照片。e:循环地拉伸(对于各应变20次循环)至1、2、3、…9%应变的PDMS/石墨烯/PdNI应变传感器的标准化电阻图。f:用于对130μm-厚玻璃盖玻片(用作偏移的幅度等于13μm的悬臂)的表面感应0.001%拉伸应变的石墨烯/PdNI应变传感器的示意图。左插图是在悬臂表面上的应变的有限元分析(FEA)模式。右插图是在0.001%的循环拉伸应变下石墨烯/PdNI应变传感器的标准化电阻图。g:在~0.001%的拉伸应变下玻璃/石墨烯/PdNI应变传感器的扫描电子显微照片。比例尺:100nm。插图中的比例尺:25nm。h:在~3%的拉伸应变下PDMS/石墨烯/PdNI应变传感器的扫描电子显微照片。比例尺:100nm。插图中的比例尺:25nm。
图4|作为用于细胞电生理学的基底的石墨烯上的纳米岛。a和b:在PMMA/AuNI/石墨烯基底上固定的细胞培养物(细胞是伪着色的绿色,金是伪着色的黄色)的扫描显微图像。比例尺:分别是5μm和200nm。c:用于登记心肌细胞收缩的电生理室的示意图。d:在细胞的自发性收缩期间从在PMMA/AuNI/石墨烯上细胞培养物得到的信号调制。左插图是信号上升阶段的分布。右插图是信号衰减阶段的分布。
图5|单层石墨烯。湿法转移到具有90nm热氧化物的硅晶片的单层CVD石墨烯的光学照片(上部)。比例尺:100μm。湿法转移到具有90nm热氧化物的硅晶片的单层CVD石墨烯的拉曼光谱(底部)。突出的石墨烯峰的比例表明高质量的、主要的单层石墨烯(D/G比:0.019。2D/G比:3.1)。
图6|是在不同基底晶粒(grain)取向上的NI。在铜上的石墨烯上的AgNI(10nm沉积)的扫描电子显微照片。比例尺:1μm。注意到:对角地穿过图像(从左下到右上)的铜晶粒间界和在各个铜晶粒上的AgNI形态的差异(渗滤(percolation)、各向异性水平)。
图7|在多层石墨烯上的NI。在转移到Parylene-C(在沉积1μm-厚的Parylene C膜之后蚀刻铜)上的石墨烯上的AuNI(10nm沉积到铜上的石墨烯上)的扫描电子显微照片(石墨烯在该图像中的上部,并且覆盖金岛)。注意到:沉积在铜上的1层、2层和3层石墨烯上的金岛中的渗滤量的变化。比例尺:2μm。
图8|在高蒸发速度下沉积的NI。在
图9|在升高的温度下沉积的NI。在
图10|AuNI的热退火。在600K下真空退火1h之后在铜箔上的石墨烯上的AuNI(10nm沉积)的扫描电子显微照片。与未退火的样品(图2,左上)相比,注意到岛的合并和扩展。比例尺:200nm。插图中的比例尺:50nm。
图11|湿法转移变换(transforms)AuNI。在铜箔上的石墨烯上合成且转移到载玻片上的AuNI(10nm沉积)的扫描电子显微照片。比例尺:200nm。插图中的比例尺:50nm。与未转移的样品(图1,左下)相比,注意到岛合并成完全渗滤的网络和晶体面的平滑。变形(metamorphosis)可能由于在湿法转移过程期间将铜基材(表面能1650mJ/m
图12|薄膜生长模型。蒸发物/基材表面能失配(surface energy mismatch)(竖轴)对蒸发物/基材(石墨烯)晶格失配(横轴)的图。薄膜生长的三个主要模式的稳定性区域在该图中表明:逐层(阴影线)、层/岛(灰色)、岛(浅灰色)。注意到:由于石墨烯的润湿透明性,基材的表面能作为基材金属的表面能小2%而算出(因此,注意到同一蒸发物/同一金属基材(在Au/Gr上的Au和在Ag/Gr上的Ag)的在-0.02处的竖直位置)。基材晶格常数取为石墨烯的晶格常数
图13|监测石墨烯/金界面事项。在铜上的石墨烯上的金纳米岛的热退火(500°K)的LAMMPS模拟。表示的是在退火期间的5ns时间内的金的底层(与石墨烯接触)的重建。注意到:对合并的岛之间的晶粒间界的重建和点缺陷迁移。
图14|监测在沉积期间的AuNI高度分布。在2个单层金的沉积期间AuNI(石墨烯和金)的高度的模拟分布。
图15|在小应变下的玻璃的FEA。在向悬臂的边缘施加0.1N力之后,在承载石墨烯/PdNI应变传感器的玻璃悬臂上的相等应变的有限元分析模拟。悬臂的上面经历0.001%的最大拉伸应变。
图16|石墨烯/PdNI传感器的三个感应模式。石墨烯/PdNI应变传感器的仪表灵敏系数对应变%的图表明三个主要感应模式:粒子间隧道电阻调制(<<1%应变)、PdNI膜龟裂(<6%应变)、和石墨烯龟裂(>6%应变)。注意到:0.001%应变的最低值通过使承载石墨烯/PdNI膜的130μm-厚载玻片(图22a)挠曲得到,而余下的各值通过用转移到PDMS条的传感器得到(图22b)。
图17|作为应变传感器的石墨烯。循环地拉伸(对于各应变20次循环)至1、2、3、…9%应变的PDMS上的石墨烯的标准化电阻图。注意到:在一组20次应变循环内的基线是稳定的直到达到6%应变(石墨烯龟裂开始)。在不同循环的组之间的阶式基线(step-wisebaseline)偏移是由于PDMS基材的粘弹性响应。
图18|在5%应变下的石墨烯/PdNI传感器。在~5%(h)的拉伸应变下PDMS/石墨烯/PdNI应变传感器的扫描电子显微照片。比例尺:200nm。
图19|固体Pd薄膜传感器对石墨烯/PdNI传感器。在0.003%的循环拉伸应变下在玻璃盖玻片上的固体(100nm)Pd膜应变传感器(a),和在0.003%的循环拉伸应变下在玻璃盖玻片上的石墨烯/PdNI应变传感器(b)的标准化电阻图。注意到:在0.003%下相似的仪表灵敏系数(~17)时,PdNI传感器显示稳定的行为(在1秒应变循环期间保持电阻值),而固体Pd膜传感器记录施加的应变,但是不保持电阻值并且使其回复到基线(在1秒未加应变的循环期间,在使传感器回到未加应变的位置时,电阻值下降,然后回复到基线)。该观察启示了在非常小的应变(<<1%)下,固体Pd膜中的颗粒边界重建,从而使颗粒之间的分离最小化,这使得不可能用这种传感器记录静态应变。相反,PdNI传感器证明用于静态应变测量的良好的稳定性。
图20|自由漂浮的石墨烯/NI膜。铜蚀刻和转移到DI水浴中之后的自由漂浮的石墨烯/PdNI/PMMA膜的照片。
图21|石墨烯/NI转移。将自由漂浮的石墨烯/NI/聚合物支撑体(或没有聚合物)沉积到最终接收基材上的渲染示意图。
图22|硬质的、挠性的和可拉伸的基底的石墨烯/PdNI传感器。转移到玻璃盖玻片上的并且用EGaIN和铜线电连接(address)的石墨烯/PdNI膜(a)、在拉伸应变循环负载下转移到PDMS的条上的石墨烯/PdNI膜(b)、未加应变的PET/PdNI/石墨烯应变传感器(c)、和在~1%拉伸应变下的围绕牙签的弯曲(d)的光学照片。
图23|随着金纳米岛沉积配位数(coordination number)概率分布的演变。
图24|传感器基线稳定性。对于在PDMS上的PdNI传感器(黑色三角)和在PDMS上的石墨烯(方形)在1%应变增量(每一次增量20次循环)下的基线偏移(标准化电阻)的图。注意到:PdNI传感器的稳定性(基线标准化点阻下降0.11直到达到3-4%应变,可能是由于Pd颗粒重装(repacking);之后,其在9%应变循环之后最低上升至1.18)。石墨烯对照的基线稳固地上升直到达到5-6%(石墨烯龟裂开始),之后,在9%应变循环之后基线指数地上升并且达到6.80。这表明PdNI膜中的裂纹可以有效地再闭合,因而确保传感器在高应变下的稳定性。
图25|模拟箱。示意性地示出石墨烯/铜基材的几何形状。
各个附图中的类似附图标记表明类似要素。
具体实施方式
金属薄膜的物理气相沉积法(PVD)可以用于制造和研究。其可理解为物理自组装的方法。即,在PVD中的沉积室内产生的蒸发的金属原子流可以变成沉积在基材上的薄膜,并且与沉积的压力、温度和速度一起,薄膜的结构成为金属和基材的复杂函数。在典型的基材如玻璃,聚合物膜,诸如硅、氮化硼和碳化硅等的单晶基材等上的低标称厚度(例如,<50nm)时,最经常产生的形态是不连续的岛。通常,岛是膜中的分离的区域。该形态学通常认为是与薄膜电子学不兼容的。然而,有许多可以利用这些岛的各种特性的应用,条件是这些岛可以再现性地在支撑体上生成,这将允许容易转移到任何其他表面。
石墨烯的润湿透明性(即,其下方基材的表面能被石墨烯采用)允许通过蒸发沉积在石墨烯上的金属薄膜(例如,≤20nm、≤10nm)的形态基于支撑石墨烯的基材的同一性(identity)而改变。例如,该形态可强烈依赖于支撑石墨烯的基材。
以该方式,石墨烯允许控制一系列几何形状的形成:紧密堆积的纳米球,良好成面的(well faceted)纳米晶体,和具有降至3nm的、或如在~
这些石墨烯支撑的结构体可以转移到任何表面上并且起到用于表面增强拉曼散射(SERS)的基底(例如,包括在光纤的前端上)和具有广阔可用范围(例如,应变的至少四个数量级)的超灵敏的机械信号转换器的作用用于结构健康监测、电子皮肤和诸如心肌细胞等细胞的收缩的测量中的应用。金属和石墨烯的这些复合膜结构体由此可以处理为多模态传感用的平台技术(platform technology)。
结构健康监测可包括应变测量和监测经由桥梁、建筑基础、机翼和涡轮叶片等的裂纹进展。电子皮肤是指可穿戴在肌肤上的并且具有类似于肌肤机械性能的机械性能的表皮传感器)。例如,这些传感器可以感应触感、温度和接近度。
此外,它们是低高度的(low profile),例如厚度在20nm或低于20nm,机械坚固、半透明,并且具有在广大区域中可再现的制造的潜力。作为半透明的凸轮(cam),这些传感器也置于窗玻璃、喷气式战斗机平视显示器(HUD)上。半透明性也允许在显微镜下细胞(或其他样品)透过传感器的成像。
石墨烯当被引入功能性纳米复合薄膜结构体时具有数个吸引人的特性。它是挠性的(和可拉伸—与金属膜相比—至5-6%的应变)、导电的、透明的、可经受大面积生长并转移至许多基材,并且其晶粒可以延伸至达到1cm的尺寸。
石墨烯是最薄的可得的2D材料,其可以产生润湿透明性。润湿透明性之前主要是相对于液体探索过,其中诸如接触角等的量可强烈依赖于支撑石墨烯的层或基材的表面能。
本文公开的系统和方法证明了该概念扩展至蒸发的原子流。金属/石墨烯双层或金属/石墨烯复合膜结构体可以用作通过电子束(e-束)蒸镀的多种的和可控形态的纳米颗粒—纳米球、纳米晶体和渗滤网络的自组装用模板。图1示出该概念和当仅蒸发的金属(金和银)和基材改变(铜、镍、金和银),而保持所有其他参数恒定时可得的形态的范围。这些石墨烯/纳米岛(NI)膜显示充分的坚固性,从而转移至几乎任何的表面。这些膜的特征也在于接近分子尺寸的尖端和间隙(即,在纳米岛的边缘之间的距离),使得它们可经受化学、光学和机械刺激的传感。
如图5中所示,纳米岛可以通过化学气相沉积法(CVD)自组装在合成在铜箔上的单层石墨烯上。为将石墨烯从铜转移到其他金属(金、银和镍)上,可以使用金属辅助的剥落(MAE)。
在薄的(例如,10nm)金属膜(例如,金、银或钯)单一同时沉积在各种基材(例如,铜、镍、金和银)上的石墨烯上时,所得纳米岛的表观结晶度(apparent crystallinity)、形状和尺寸分布,渗滤的程度,以及岛之间的间隙的尺寸对于各基材而言可以是不同的。渗滤的程度是岛之间的连通性的量。
例如,如图6中所示,所得形态可以直接依赖于基材材质的本性如其表面能和结晶取向。所得形态也可以依赖于蒸发的金属的特性,如其表面能和与石墨烯的晶格失配(如图1的底部中所示),石墨烯层的数量(如图S3中所示),以及加工参数如沉积的速度(如图S4中所示)和量,基材的温度(如图S5中所示),沉积后的热退火(如图S6中所示)和转移至最终接收基材的转移(如图S7中所示)。
岛的最终形态对支撑石墨烯的金属的同一性的强依赖性启示了可以遵从类似于外延生长而发展的那些的规则的生长。通常,在二元素(例如,蒸发物和金属基材)体系下可以存在膜生长的三种主要模式:逐层(Frank-Van der Merve)、层/岛(Stranski-Krastanov)和岛固有(island proper)(Volmer-Weber)。
三种模式很大程度上通过晶格尺寸的失配和蒸发物与基材之间的表面能的失配来确定。较大的晶格失配有利于岛生长,而正的表面能差,(γ
扩散势垒(Diffusion barrier)(E
可以进行金原子沉积在石墨烯涂覆的铜(111)表面上并退火的大规模的平行的原子模拟,以阐明纳米岛形成的机理。精确的原子间相互作用势可供铜/石墨烯/金使用,并且这样的构造的试验制作可以以最少的步骤数完成。
研究在150ns的过程中在400K下金的五个单层(~30,000原子)沉积在3×3铜/石墨烯Moiré超晶胞(~240,000原子)上。模拟的沉积速度为比试验速度(每一个单层30s)快大约九个数量级,在动力学控制的模拟沉积中产生初始形态,如图2a中所示。
进行在铜上的石墨烯上的金纳米岛(沉积金的三个单层)在500K下热退火20ns的模拟以生成用于与试验比较的热力学控制的形态。图2b示出在退火期间的金的总表面积的减少。岛的合并在初始15ns期间发生,如由金的净表面积的减少注意到的,之后,岛形态的变化的速度减慢。该观察启示了模拟的沉积过程确实生成在短的(ns)时间量程中聚集的动力学受限的簇群(kinetically trapped clusters)。通过图2a和2b中的模拟预测的形态试验地验证图2c中的1nm金的沉积。考虑到在模拟之后进行试验和用于模拟中的参数不调整以配合试验,模拟的和试验的形态之间的相似性是显著的。
预测形态的能力和石墨烯支撑的纳米岛的可操作性可以能够应用于化学和机械传感中。
例如,贵金属的膜广泛用作用于表面增强拉曼散射(SERS)的基底。在具有与等离子体激元共振频率(plasmon frequency)ω
将SERS-活性基底置于光纤上可以允许遥感。遥感可以涉及感应从分析设备物理地除去的化学环境。例如,使用100ft.光纤以实时感应由于地下100ft.深的水力压裂引起的水污染而不需要提取样品以用于分析。
在一些实施方案中,在石墨烯/AuNI膜中由AuNI形成的表面结构上沉积1-丁烷硫醇盐(BT)的单层之前,石墨烯/AuNI膜可以转移到光纤的前端(如图3a和3b中所示)。观察到来自改变的光纤上沉积的BT的单层的大的拉曼信号。相反,沉积在通过硅层支撑的非结构化的金膜上的BT不产生信号(如图3c中所示)。通过硬质的、挠性的或可拉伸的基材支撑的石墨烯上的复合金属纳米岛的压电电阻非常适合于用作应变传感器。硬质基材的实例包括玻璃,挠性基材的实例包括聚合物聚(甲基丙烯酸甲酯)(PMMA),可拉伸的聚合物的实例包括聚二甲基硅氧烷(PDMS)。
在一些实施方案中,能够表皮地测量人的心率的高灵敏度的应变传感器可以通过将金属(例如,钯)的薄层(例如,8-10nm)沉积在金属基材(例如,铜基材)上的石墨烯上并且将复合膜结构体通过旋涂聚合物而转移到薄的(例如,约8μm)聚合物(例如,聚二甲基硅氧烷(PDMS))上来制作。然后可以蚀刻铜基材以得到高灵敏度的应变传感器(如图3d中所示)。例如,在1%应变下的仪表灵敏系数可以为至少1335。仪表灵敏系数
小到0.001%的应变可以用沉积在130μm厚的玻璃盖玻片上的石墨烯/PdNI传感器来测量。这样的小应变可以通过将传感器置于硬质基材上而被精确和反复地诱导。如图3f中所示,硬质基材可以承载具有特定厚度(例如,13μm厚)的粘合带(例如,聚酰亚胺带),该带支撑盖玻片的一半(另一半形成悬臂)。通过将小的力(例如,~0.1N)施加至悬臂并且使远端与基材接触,可以获得玻璃表面上的0.001%拉伸应变(如图15中所示)并且玻璃表面上的0.001%拉伸应变用传感器反复测量。
石墨烯/PdNI应变传感器可以检测跨越至少四个数量级的应变。传感器可以显示如图16中所示的,具有至少两个拐折点的电阻对应变的非线性变化率(即,仪表灵敏系数),这可以表明不同检测模式的存在。
如图3g中所示,在最低应变状态(~0.001%-~0.1%)下的压阻效应最可能是由于当PdNI在分离时经历小的变化时的隧道电流的变化。例如,在该状态下仪表灵敏系数为10类似于在应变<<1%下的隧道电阻的变化的文献值(在0.02%至0.27%之间)。本文公开的石墨烯/PdNI膜被支撑(例如,在硬质基材上),因而与通过界面自组装制备的未支撑的传感器相比,可以是更机械坚固的。
在较低的个位数应变下,裂纹可以出现在PdNI膜中(如图3h中所示)。PdNI是球状的并且形成膜的纳米岛,所述膜包括离散的球状纳米粒子的连续单层。
响应于循环负载的这些裂纹的打开和闭合可以说明在例如,0.1%至5%之间的应变的最灵敏状态下观察到的压电电阻。循环负载是力对传感器的反复施加,导致其反复变形。
不受任何特定理论的束缚,通过PdNI膜的裂纹进展可以通过下方的石墨烯的刚性来抑制,这可以在仪表灵敏系数从735至316(分别在1%和5%应变下)的降低中证明。在5-6%左右的应变下,灵敏度可以再次增加,这可以通过下方石墨烯的龟裂开始来解释(如图17、18、24中所示),因而通过PdNI膜的裂纹进展增加。
石墨烯/金属纳米岛复合膜结构体可以用于监测种类繁多的样品。例如,监测飞机组件如机翼的挠曲、结构体如桥梁的龟裂。
石墨烯/金属纳米岛复合膜结构体也可以在生物装置中利用。例如,石墨烯/AuNI传感器在生物装置中的性能通过在用复合的聚甲基丙烯酸甲酯(PMMA)/AuNI/石墨烯膜结构体覆盖的盖玻片上培养新生大鼠的心肌细胞(CM)来测试。
如图4a和4b中所示,光学扫描电子显微镜法显示优异的基底与活CM的生物相容性,而不需要额外的粘合促进剂。使用图4c中示出的和以下详细说明的专用室,可以检测与心肌细胞的自发性活动相关的传感器信号的可逆变化,如图4d中所示。
抑制肌球蛋白循环且使细胞收缩停止、但是不是电活性的激发-收缩的解偶联剂如布比斯他汀(blebbistatin)可以用于区分通过应变传感器检测的信号是涉及细胞的收缩还是电活性。在细胞周围的溶液中10μM布比斯他汀(blebbistatin)的存在下没有发现显著调制的信号,支持了传感器响应于细胞中的收缩而不是电活性的假设。
应变传感器呈现亚毫秒(ms)响应时间(ton=0.8±0.2ms,n=173)和非常高的信噪比(对于不同强度的CM收缩而言在42和100之间),如图4d的左上部分中所示。对于所有收缩,指数衰减分布类似,并且以单指数函数拟合(toff=68.6±1.5ms,n=173),如图4d的右上部分中所示。如通过应变传感器检测的CM收缩的幅度和时间分布可以允许CM响应的详细表征并且能够测试各种药物学的化合物以用于药物发现的应用。
沉积在石墨烯的表面上的金属纳米岛—其形态可以通过支撑石墨烯的基材的同一性控制并且通过计算而预测—提供用于多模态传感的有前途的平台系统。与通过其他过程形成的金属纳米颗粒的膜相反,石墨烯支撑的纳米岛具有操作和容器转移至几乎任何表面的能力。例如,操作石墨烯支撑的纳米岛包括转移,还有拾取、浮选、对准、图案化和放置。该品质可允许将结构体直接安装在光纤的前端上以用于通过SERS的遥感和将光纤插入诸如地下水或血流等的这些系统。
这些结构沉积在相对硬质(玻璃)、挠性(PMMA)或可拉伸的(PDMS)基材上允许人体和结构的健康监测的应用,其中证明的灵敏度可跨越至少四个数量级并且可具有已经报道的任何薄膜应变传感器的最高的仪表灵敏系数。这些结构的灵敏度和生物相容性允许非侵入性地测量心肌细胞的收缩,并且可以是用于干细胞衍生的心肌细胞的功能表征的无价的工具以及用于心脏毒性的新型药物候选者的多模态筛查和心血管药物发现。
石墨烯在具有10cm×11cm尺寸的25μm厚的铜箔(Alpha Aesar,13382,99.8%)上合成(合成大到18cm×20cm的石墨烯片并经由下述的金属辅助的剥落(MAE)而转移)。在石墨烯生长之前,铜箔通过浸泡在浅的丙酮浴中并且用Kimwipe纸巾(同时在丙酮中)擦拭它们来清洁。之后,将该箔用丙酮冲洗并且转移到填充有异丙醇(IPA)的类似的浴中,在该溶剂中重复机械清洁。相比于经由在丙酮和IPA中的超声处理清洁该箔,机械清洁可以导致更干净的石墨烯。该方法也可以节省相当大量的两种溶剂(考虑到用于对大面积的铜箔进行超声处理的大体积)。在于IPA中机械清洁之后,将该箔在IPA中冲洗并且在压缩空气流中干燥。
铜箔的电解抛光。在石墨烯合成之前电解抛光铜箔可以有助于主要地生成单层石墨烯。将清洁、干燥的铜箔随着烧杯侧壁的轮廓置于250mL烧杯中,并且用作阳极。将铜管(d=2.54cm,l=15cm)沿圆柱形的轴插入烧杯中并且用作阴极。阴极的圆柱状形状和阳极的曲面在电解抛光期间产生均匀的电场。将浓磷酸(H
石墨烯的合成。大气压CVD石墨烯合成在具有以下管尺寸的石英管炉(MTI OTF-1200X-HVC-UL)中进行:d=7.6cm,l=100cm。将CVD室和反应器气体供给管线空气吹扫5min,接着使所有合成气体(氢气、甲烷和氩气)的混合物以它们的最大流量流动,同时用隔膜真空泵对室抽真空。5min之后,停止气体流动并且将该室用涡轮分子真空泵排空至约10
金属辅助的剥落(MAE)。金属辅助的剥落(MAE)用于将石墨烯从铜转移至其他金属(金、银和镍)。简而言之,石墨烯在铜基材上生长,然后层压在另一金属片(例如,金、银和/或镍)的上部。因为石墨烯比铜更好地粘贴至金,所以整个石墨烯单层可以容易地移除并且在大的区域中保留完整。在MAE期间在高真空环境中共形的石墨烯/接收金属界面的形成可以帮助界面保持没有氧化物和其他污染物。共形可以包括与100%的石墨烯表面原子接触的蒸发的金属。例如,铜上的石墨烯可具有明显的表面粗糙度,所以一致性对于转移可以是重要的。
于是在随后的纳米岛沉积之后所得的形态可以仅是涉及的材料(例如,蒸发物和金属基材)和加工参数的函数。
金属的沉积和NI的自组装。为了比较从下方基材的选择中所得的NI形态,将Temescal BJD-1800e-束蒸镀机用于将10nm蒸发物(金或银)沉积在由铜、镍、金和银支撑的石墨烯上。将承载石墨烯的基材固定至样品台并且位于在蒸发物源的正下方(40cm的距离)。金属蒸发速度保持为低的(
在由铜支撑的石墨烯上10nm金的控制蒸发在
使用XL30 FEI SFEG UHR扫描电子显微镜(SEM)分析所有样品。SEM成像显示NI上的形态依赖于下方基材的结晶取向。图6证明由10nm银沉积在具有不同取向的两个相邻的铜晶粒的铜基材上的石墨烯上(在SDC下)而导致的AgNI的形态差异。将在SDC下的10nm金以较大的增加层的密度沉积在承载石墨烯的铜基材上,从而确定基材与蒸发物之间的石墨烯层的数量是否影响NI自组装。此外,铜/石墨烯/AuNI使用PDS 2010Parylene涂布机用1μm的Parylene C涂布。在蚀刻下方铜时,Parylene/AuNI/石墨烯使用SEM成像(使AuNI隔着下方石墨烯成像)。图S3中,看见AuNI上的渗滤量在逐步承载更多层的石墨烯上降低。这与薄膜生长的模型相关性良好,这是由于额外的石墨烯层连续降低铜的表面能。
石墨烯/NI膜的转移。对于许多应用,NI可以从它们生成的基材上转移至最终接收基材(光纤、载玻片、PDMS、PET、人体皮肤等)上。转移至玻璃盖玻片、硅晶片和PDMS的条使用转移石墨烯的标准方法学来进行。首先,将PMMA的支撑层(例如,100nm厚)旋涂在铜/石墨烯/NI上,接着在1M氯化铁(III)(FeCl
突出地,转移到硅晶片的石墨烯/AuNI的形态与图1中所示的转移之前的是大为不同的。AuNI形成完全渗滤的网络并且失去尖锐的晶体棱角,有利于圆形化特征。该效果可以是由于用低表面能的水(72mJ/m
在第二种情况下,将基材插入漂浮的石墨烯/NI/聚合物膜中并且进一步进入水中(图21)。用于心肌细胞培养和收缩试验以及心率监测的基底可以以该方式覆盖。如果传感器在转移期间由PMMA支撑,则该支撑的聚合物膜可以容易地用丙酮除去。明显地,对于用石墨烯/AuNI膜覆盖光纤的前端不使用支撑聚合物,因为前端的面积(~0.03mm
除了上述转移方法之外,聚合物膜也可以层叠在铜/石墨烯/NI膜的上部上(例如,用商业的层压机),因而在铜蚀刻时用作支撑和最终接收基材。
原子物理气相沉积模拟。使用作为在San Diego Supercomputer Center中的Comet超级计算机可得的开源模拟包LAMMPS(12/09/2014)
石墨烯/铜(111)表面的初始构造遵从Süle等人的程序生成和平衡。具体地,具有厚的铜支撑体(30层)的3×3Moiré超晶胞用作其最底层,以有效地制成块状(bulk)铜的表面的模型。4nm的高度的真空层插在表面上方,从而沉积金原子并且提供用于岛生长的空间。在横向上具有周期边界的情况下沿纵向强加反射边界条件。初始模拟细胞的示意图提供在图25中。
模拟金沉积。为了模拟沉积过程,以每纳秒200个颗粒的速度在真空区域的插入平面内在随机的位置处引入金原子,其中速度指向表面。由于计算限制,选择该沉积速度。尽管其为比试验速度大的数量级,但是所选的速度允许用当前的计算资源在合理的时间内进行模拟,并且是整个文献中的标准实践。颗粒速度从在与试验蒸发温度相当的温度下的Maxwell-Boltzmann分布取样。在时间常数0.01ps的NVT系综中使用Nosé-Hoover样式的恒温器,整个系统的温度贯穿沉积过程维持在400K下。运动方程为使用1飞秒的时间步长用时间可逆的、保持测量的Verlet算法进行积分而得的,这发现了得到数值稳定的模拟。
热退火的模拟。沉积过程之后,试验真空退火过程通过将温度升高至500K并且使金岛扩散和聚集直到形态变得稳定(~15ns)来模拟。退火期间,金簇群的表面积在探针球径
由于系统的混合本性,每个成对的相互作用用适当的原子间相互作用势独立地处理。金属-金属相互作用全部使用嵌入原子法计算,这在整个金属系统的文献中已经广泛使用和验证。碳-碳相互作用使用AIREBO势
岛生长的统计分析。从物理气相沉积模拟输出的轨迹文件提供了可以用来定量地表征纳米岛的形态演变和生长的丰富的信息。这些度量为比较不同系统提供了基础,并且可以深入了解仅从实验无法实现的在岛生长下的物理机制。可以很容易监测的一个量是单个金原子的配位数。对轨迹文件的快照进行解析,并且使用键长作为距离截止值计算每个金粒子的所有最近邻元素。图23显示随着岛生长金粒子配位数的概率分布的演变。这些结果显示了,在沉积0.5nm Au之后,大部分金原子的配位数为6,这对应于簇群的表面。在沉积1nm之后,大部分金原子的配位数为12,这对应于簇群的堆积(bulk)。
可用于表征金岛生长的另一个定量度量是金颗粒的高度分布。这些通过将从轨迹快照的金颗粒相对于它们的垂直高度加在一起读出(binning)并对分布进行标准化来计算。图14显示在沉积过程期间的该概率分布的演变。在仅沉积0.5nm Au的情况下,最大的岛高度为6层
光纤拉曼传感器。将未支撑的石墨烯/AuNI转移至新劈开的300μm厚的光纤(芯:半径50μm,50μm厚的包层,50μm厚的护套)的前端从而研究使用石墨烯/NI复合膜结构体作为用于无标记感应的SERS基底的可行性。将7.5nm的金蒸镀到铜上的石墨烯上,从而获得它们之间具有最小间隙(例如,在3-20nm之间)的非渗滤的AuNI(图3b,右插图)。建立7.5-8nm的Au沉积作为AuNI的渗滤阈值。在使膜转移和在环境空气中将纤维干燥过夜之后,将它们与1cm
24小时之后,将测试基底在DI水和异丙醇(IPA)中彻底清洗并且在环境空气中干燥。
拉曼光谱分析。为了从测试基底得到拉曼光谱,使用具有倒置台和785nm激发源的拉曼显微镜(Renishaw inVia)。对于测试样品和对照物二者,激光束聚焦于2μm射束点,并且曝光设定为在0.5mW功率下60秒。不同的BT信号即使在低到1秒曝光时也从覆盖的光纤前端获得(尽管有低的信噪比),而即使通过将射束功率提升至5、然后是50mW在60s曝光时BT信号也是不可得的。这表明石墨烯/AuNI是适合的SERS基底,并且远远优于非结构化的金膜。该实施方案证明了复合石墨烯/NI膜结构体的可操作性。它们可以转移到像光纤的前端等的微小物体上,允许遥感中的非常有前途的应用。
作为应变传感器的石墨烯/PdNI膜。在SDC下将~10nm Pd沉积在铜上的石墨烯上导致球状颗粒(直径4-5nm)的均匀单层的形成。这些球状颗粒,即使是非常不同的形状,仍然是材料选择的函数并且可以以与本文公开的其他纳米岛相同的方式制作。然后这些石墨烯/PdNI转移到硬质(玻璃)、挠性(PET)和可拉伸的(PDMS)基材上(图22),以测试它们在大的应变范围内的压电电阻性质。
在硬质基材上的PdNI传感器。为了评价PdNI作为应变传感器在非常低的应变<<1%下的性能,将3-5×25mm石墨烯/PdNI/PMMA条转移到130μm厚的1”×1”玻璃盖玻片上。为了除去PMMA,将玻片用丙酮冲洗。为了使传感器电连接,将铜线(36号(36gauge))粘附至PdNI并且具有承载导电性粘合剂和EGaIn的点滴的铜带的玻璃盖玻片置于松散的线端,以确保稳定的电接触(图22a)。在所有情况下,在连接电极之后PdNI传感器的纵横比可以是在3和10之间,并且未应变的电阻在644和2015Ω之间。
为了用PdNI传感器诱导和记录非常小的应变(0.001%-0.003%),将13μm厚的聚酰亚胺(PI)带(对于0.001%为1层和对于0.003%应变为3层)置于2”×3”载玻片上。PI带用作可控高度的台阶,以通过将一半的PdNI-涂覆的盖玻片静止和固定在带上而创建悬臂同时在另一半盖玻片下在盖玻片和载玻片之间创建间隙(图3f)。通过将小的力(~0.1N)施加至悬臂的自由端并且使其与载玻片接触,使载玻片弯曲,诱导在其PdNI-涂覆的表面上的拉伸应变并且用Keithley 2400源/表(source/meter)使用自定义生成的LabVIEW代码记录电阻变化(图3f,右插图)。以类似的方式分析固体Pd膜对照样品(图19)。
在可拉伸的基材上的PdNI传感器。为了测量PdNI传感器在较高应变(>1%)下的压电电阻率,将PdNI传感器转移到PDMS的条(3mm×10mm×100mm)上,将它们与铜线和EGaIn(共晶镓铟)连接,并且使用高精度线性致动器以使PDMS拉伸(图22b)。石墨烯(没有PdNI)对照样品以类似的方式分析。传感器在0%和9%应变之间以1%间隔(每一个1%间隔20次循环)循环(图3e)。传感器显示非常高的仪表灵敏系数和循环性,同时保持稳定的基线(图24)。
心率测量。为获得生物计量的信号,在铜/石墨烯/PdNI上旋涂8μm厚的PDMS膜,并且将PDMS在100℃下的热板上固化10分钟。在1M氯化铁(III)中蚀刻铜1小时。使自由漂浮的石墨烯/PdNI/PDMS膜转移到DI水中(3次),并且通过将手腕插入具有DI水和传感器的容器中将传感器放置在手腕的皮肤上(在桡动脉的上部)(图3d)。
作为疏水性的,PDMS表面与皮肤形成良好的界面。在放置传感器之前,将一条胶带围绕手腕粘附,同时在桡动脉上方留下一部分皮肤无胶带。胶带有两个目的:它通过使胶带覆盖的皮肤不可拉伸而帮助附着并保持在电接触导线的位置并且将应变局限在皮肤的无胶带部分上。一个传感器能够测量心率,同时另两个传感器在转移过程期间生成PDMS的皱纹并不够敏感(尽管所有三个传感器都能以高保真度记录手腕和个人数字运动(individual digit motion))。
PdNI传感器上的原位SEM。为了记录PdNI传感器在0.001%、3%和5%应变下的膜形态,用XL30 FEI SFEG UHR扫描电子显微镜使传感器成像。为了使传感器在硬质基材上在小应变下成像,使用了PI带步骤方法学。这里,没有对悬臂施加间歇的力,而是将悬臂的自由端用导电性铜带永久地粘贴至载玻片。该带也用作电接地电极,以使样品放电至SEM台。
为了获得在3%和5%应变下的传感器膜的图像,通过使用粘着的铜带将由1mm厚的PDMS条支撑的传感器粘附到分别具有15mm和10mm的曲率半径的3D打印的半圆柱体的弯曲表面(将PDMS条弯曲至产生3和5%的表面拉伸应变的特定半径),该铜带也用于使样品电接地至SEM台。
电生理学。新生大鼠心室的心肌细胞使用新生大鼠心肌细胞分离试剂盒(Worthington)分离并在37℃下用5%CO
扫描电子显微镜学。首先,细胞用0.1M磷酸盐缓冲液(pH 7.4)洗涤,然后用4%甲醛溶液在室温下固定2小时,并用相同的缓冲液洗涤3次,每次5分钟。接着是用分级系列的乙醇脱水(30%乙醇–10min,50%乙醇-10min,70%乙醇-10min,80%乙醇-10min,95%乙醇–10min内2次变化,100%乙醇–15min内3次变化),所有样品在真空室中冷冻干燥,并用溅射铱涂覆。在XL30 FEI SFEG UHR上以5mm的工作距离同时使用10kV能量束来获取扫描电子显微镜图像。
电生理测量。定制的电生理学室通过3D打印其中固化了PDMS(Sylgard184)的模具来建立。完成的室具有中心开口(用于细胞培养物和培养基)和侧面开口(用于共晶电极放置),并且以AuNI基底的中心部分位于中心开口中且AuNI基底的边缘使用EGaIn通过侧面开口可达到电连接(electrical addressing)的方式,被放置在承载PMMA/AuNI/石墨烯和CM培养物的玻璃盖玻片上方(图4a)。然后将该组件夹持在两个1”×3”的载玻片之间并用长尾夹夹紧以确保良好的密封。在上部的载玻片上预钻5mm孔以允许将培养基和布比他汀(blebbistatin)添加到室的中心开口。弧形开口之间的PDMS壁用于将EGaIn电极与细胞培养基分开(以mM为单位,NaCl,135;KCl,2.5;CaCl
表S1.用于该研究的原子间相互作用势的概要。
本文公开的方法和系统也可以提供细胞(例如,培养的细胞)的活动的电阻抗分布。阻抗的一般方程为Z=R+jX,其中R是“普通(common)”电阻,并且虚部jX涉及电路的电抗的相移。阻抗可以与交流电流测量有关。对于直流电流测量,阻抗等于电路的电阻。使用电阻记录之上的阻抗可以允许经由与电极的相移电容放电-再充电相关的细胞行为的额外分量来收集额外的信息。
通常,阻抗将变化的电压的频域比率与变化的电流相加。测量收缩细胞的阻抗分布的方式(例如,使培养的细胞收缩)可包括细胞层相对侧上的两个电极。该系统可包括具有多个电极的记录电路,其中至少一个电极位于细胞层的每一侧。
例如,阻抗测量可以用类似电生理学的放大器(electrophysiology-likeamplifier)收集,该放大器能够以时间分辨的方式记录快速电流-电压信号。
当细胞(例如,培养的细胞)覆盖电极时,电极和溶液之间的电阻抗会增加。随着它们收缩(即,面积缩小),露出的电极面积增加并且阻抗下降,从而记录节拍(beat)(及其幅度)。
本文公开的系统和方法可以测量多个参数,包括电压分布相对于细胞膜电容量的一阶导数。细胞膜电位是细胞膜的内(细胞内)小叶和外(细胞外)部分之间的电压差。当电极接触细胞膜时,细胞(例如,培养的细胞)的活动(例如,收缩活动)可以经由监测细胞膜电位分布来跟踪。例如,本文公开的系统和方法可以测量由于细胞活动引起的电压动态变化的几个分量。
本文的系统和方法可通过例如,使用暗场显微镜,光学观察纳米岛之间的颗粒间距离变化来提供细胞收缩性的分布。暗场显微镜可包括增强图像对比度的照射技术。照射光可以非常强烈,并且在照射样品之后,直接照射光束被阻止进入用于观察样品的物镜。结果,进入物镜的唯一光线将是来自样品的散射光。该显微镜技术对于黑暗的背景产生几乎黑色的背景与明亮闪耀的图像。
纳米岛的尺寸可以小于光学显微镜的衍射极限。然而,利用更大尺寸的岛(例如,大得多)和由于局部表面等离子体激元共振引起的效应,可以检测到暗场图像。
这样的系统的优点将是跟踪和分析金属纳米岛的容易性。诸如培养的心肌细胞等细胞可以将收缩力施加至纳米岛并且使它们在周围偏移。偏移的量和其他参数(颜色变化/光波长变化)可以用于检测。
本文公开的方法和系统可以构造为通过光学观察钙离子浓度来提供细胞收缩性的分布。心肌细胞内的钙离子浓度变化的动力学可用于检测心肌细胞活动。例如,通过使用专门配制的荧光钙指示剂染料。各染料分子可以在键合钙离子时改变其荧光性。该染料应当在例如,通过传统的荧光显微镜学记录之前装入培养的细胞(例如,心肌细胞或任何其他细胞种类)内部。细胞内部的钙浓度的升高可引发肌动蛋白/肌球蛋白偶联,这导致细胞收缩。因而,细胞内钙浓度(与在金属纳米岛附近的离子相反)的动态变化可以是细胞收缩活动的充分的“替代措施”。记录的信号可以是快速的和明亮的,具有良好的动态范围。
本文公开的方法和系统构造为提供来自培养的细胞的拉曼散射数据。来自细胞的拉曼光谱数据是对主要传感器形式的补充。在细胞表面上来自生物化学活性结构的拉曼信号可以能反映在收缩活动期间的膜化学组成的变化。
由于细胞可与等离子体激元活性的纳米岛(例如,金岛)直接接触,所以后者可增强来自表达的膜蛋白、细胞分析物、细胞因子等,以及进入细胞体的几十纳米的化学物质的拉曼信号。由于本文公开的方法和系统是比其中检测到线粒体运动的非结构化金膜更具有等离子体激元活性的数量级,因此所公开的系统的分辨率和信噪比可以更大。数据分析可包括从细胞生物化学获得的复杂信号的反卷积。
本文公开的系统和方法可以构造为电力地刺激细胞活动。电力地刺激细胞的方式可包括在细胞层的两侧使用两个单独的电极并且将电压施加在这两个电极之间。本文公开的方法和系统可以用作收集电极,一个电极在细胞的上方和一个在细胞的下方。
本文公开的方法和系统可以光学地刺激细胞活动。例如,金纳米岛可以是等离子体激元活性的,并且可以使用一个光带来刺激细胞收缩,同时允许通过另一个光带获得光学细胞活动读出。例如,当光照耀在纳米岛(例如,金岛)上生长的细胞上时,它们可以更快速地收缩。在明显的照射的情况下,它们进入强直收缩(tetanus)(连续收缩的状态)。光可以激活金岛中的等离子体激元模式并且改变表面上和间隙中的电场。这会导致细胞膜去极化和细胞活动。
本文公开的方法和系统可包括附到皮肤或衣服的可穿戴传感器。用于这样的系统的应用可包括医疗保健、健康、触觉技术、仪器化假体和在身体外部使用纳米岛传感器的其他应用。
已描述了本发明的许多实施方案。但是,应了解到可以进行各种改变而不偏离本发明的精神和范围。因此,其他实施方案也在所附权利要求的范围内。
- 石墨烯系多模态传感器
- 石墨烯系多模态传感器
