一种干细胞分化而成的胰岛细胞、方法、复合物及应用
文献发布时间:2023-06-19 12:00:51
技术领域
本发明属于生物医学技术领域,尤其涉及一种干细胞分化而成的胰岛细胞、方法、复合物及应用。
背景技术
随着人民生活水平的不断提高,全球糖尿病发病率逐年提高。糖尿病主要表现为胰岛素的相对或绝对缺乏,同时伴随持续性高血糖为主要特征的慢性代谢性疾病,此外,还可能引发一系列的并发症,如糖尿病肾病、糖尿病大血管病变等,在严重影响人民生活质量的同时也给国民经济带来了巨大压力。目前糖尿病的治疗方法主要是依靠胰岛素、口服降糖药物,或者异体胰岛移植,无论哪种方式,都存在一定程度上的隐患以及不便,胰岛移植对于患者来说更可能存在经济、供体以及免疫排斥等诸多方面的问题。因此,亟需寻找一种可以缓解糖尿病人群血糖水平,同时又安全有效的治疗方法。
近年来随着各种类型的干细胞被相继发现,脂肪间充质干细胞(ADSCs)作为一种脂肪来源的干细胞,具有易获取、极强的自我更新能力、多分化潜能以及能够分泌多种细胞因子等的特性,同时还有免疫豁免的功能。
将未分化的脂肪间充质干细胞移植进入体内可能会增加致瘤风险,而目前将诱导的胰岛素分泌细胞效率较低,导致治疗糖尿病的效果仍需进一步提升。
发明内容
本发明实施例的目的在于提供一种干细胞分化而成的胰岛细胞、方法、复合物及应用,旨在解决背景技术中指出的现有技术存在的问题。
本发明实施例是这样实现的,一种干细胞分化成胰岛细胞的方法,包括以下步骤:
提取分离得到具有分化能力、高纯度的脂肪间充质干细胞;
采用腺病毒感染方法将PDX-1基因转入脂肪间充质干细胞;
利用诱导剂使脂肪间充质干细胞定向分化为胰岛细胞。
作为本发明实施例的另一种优选方案,所述诱导剂包括诱导剂Ⅰ、诱导剂Ⅱ和诱导剂Ⅲ;
诱导剂Ⅰ包括细胞培养添加剂、纤维细胞生长因子和表皮细胞生长因子;
诱导剂Ⅱ包括白蛋白、胰岛素-转铁蛋白-亚硒酸盐、肝细胞生长因子、酸和激活素;
诱导剂Ⅲ包括促胰岛素分泌肽、酸和激活素。
作为本发明实施例的另一种优选方案,所述的采用腺病毒感染方法将PDX-1基因转入脂肪间充质干细胞,具体步骤为:
取脂肪间充质干细胞培养,待细胞汇合度为85~95%时,加入含有Adv-PDX-1过表达腺病毒的培养基,感染细胞5~7h后更换培养基,并继续培养6~8d。
作为本发明实施例的另一种优选方案,所述的利用诱导剂使脂肪间充质干细胞定向分化为胰岛细胞,具体步骤为:
脂肪间充质干细胞加入蛋白酶消化后,加入含诱导剂Ⅰ的诱导培养液I并继续培养4~6d,期间每40~48h更换一次诱导培养液I;
弃去诱导培养液I,加入含诱导剂II的诱导培养液II并继续培养6~8d,期间每40~48h更换一次诱导培养液II;
弃去诱导培养液II,加入含诱导剂III的诱导培养液III并继续培养6~8d,期间每40~48h更换一次诱导培养液III,6~8d后得到目标细胞簇。
本发明实施例的另一目的在于提供一种所述的方法得到的胰岛细胞。
本发明实施例的另一目的在于提供一种复合物,包括所述的胰岛细胞和细胞支架。
作为本发明实施例的另一种优选方案,所述的细胞支架为PDA-PLGA-Hydrogel细胞支架;所述的PDA-PLGA-Hydrogel细胞支架的采用水凝胶作为支架填充物填充在PDA-PLGA细胞支架中。
本发明实施例的另一目的在于提供一种所述的复合物在制备治疗糖尿病药物中的应用。
作为本发明实施例的另一种优选方案,将细胞支架搭载胰岛细胞复合物移植到骨骼肌部位。
本发明通过腺病毒感染方法联合诱导剂使脂肪间充质干细胞定向分化为胰岛细胞,得到的胰岛细胞簇内高表达胰岛素(INS)重组蛋白,且诱导结束后大部分细胞仍然高表达PDX-1蛋白,说明诱导的细胞具有分泌胰岛素(INS)重组蛋白的能力,且效率高;得到的胰岛细胞于30mM葡萄糖刺激下与3.0mM葡萄糖刺激下相比,胰岛素的分泌量有显著性差异;将胰岛细胞搭载细胞支架复合物移植到骨骼肌部位,可较好的治疗糖尿病。
附图说明
图1为体外大鼠脂肪间充质干细胞(ADSCs)感染Ad-PDX-1-GFP 7d后的蛋白表达情况;
图2为体外脂肪间充质干细胞(ADSCs)诱导过程中的形态变化图;
图3为体外诱导结束后细胞簇经双硫腙染色法鉴定后的结果图;
图4为体外诱导结束后细胞簇经INS及PDX-1双标后的免疫荧光染色结果图;
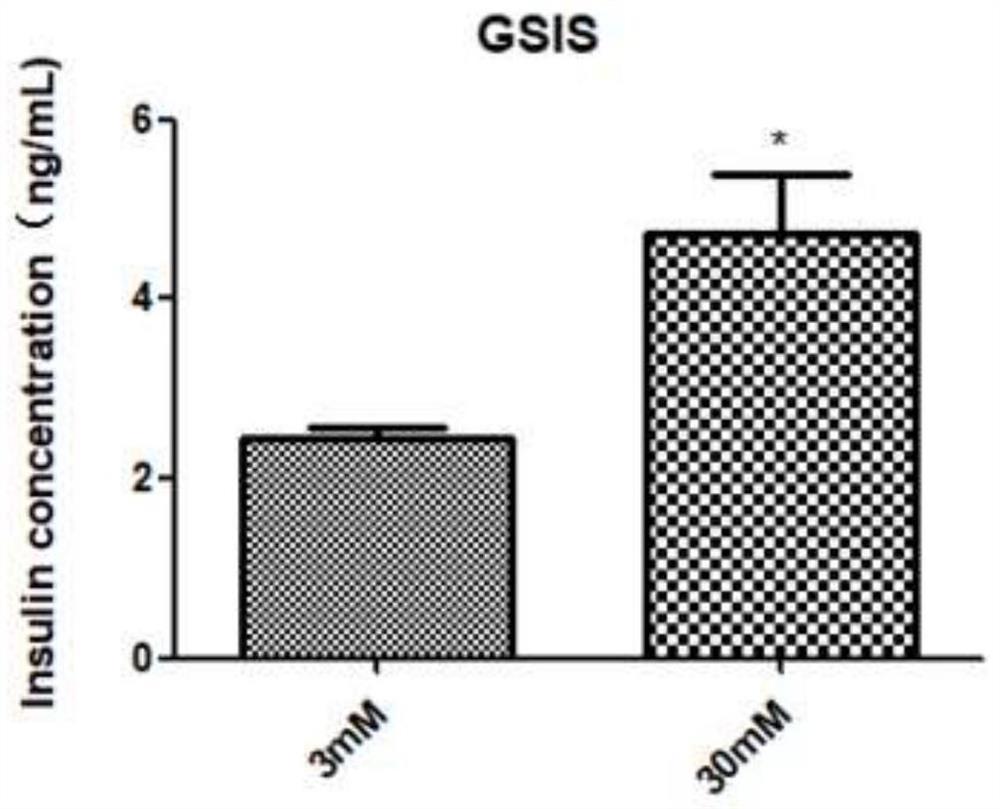
图5为体外诱导结束后细胞簇的胰岛素分泌结果示意图。
图6为干细胞诱导的胰岛细胞与细胞支架复合物移植后大鼠空腹血糖;
图7为胰岛细胞与细胞支架复合物的病理检测结果;
图8为胰岛细胞与细胞支架复合物的胰岛素免疫荧光结果;
图9为胰岛细胞与细胞支架复合物的CD31免疫荧光结果;
图10为pHBAD-EF1-MCS-3flag-CMV-EGFP-Δloxp载体图谱;
图11为合成质粒酶切的验证结果;
图12为正向测序结果;
图13为反向测序结果。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
以下结合具体实施例对本发明的具体实现进行详细描述。
实施例1
该实施例提供了一种干细胞分化成胰岛细胞的方法,包括以下步骤:
(1)提取分离得到具有分化能力、高纯度的脂肪间充质干细胞;
(2)取脂肪间充质干细胞(ADSCs),以4×105个/孔的细胞数于六孔板中铺板培养,待细胞汇合度为90%左右时,弃去培养基I,加入含有Adv-PDX-1过表达腺病毒的培养基感染细胞6h后更换新鲜培养基I,并置于培养箱中继续培养7d,培养基I包括:培养液(L-DMEM)+10%北美胎牛血清(Gibco FBS),Adv-PDX-1为插入了大鼠PDX-1基因的CDS区的重组腺病毒,CDS区序列如序列表1所示。7d后,如图1所示,脂肪间充质干细胞(ADSCs)在经过感染量MOI=100的Adv-PDX-1-GFP的腺病毒感染后,绿色荧光蛋白表达量在90%以上,说明腺病毒对该细胞感染效率高,细胞内成功翻译PDX-1蛋白;
(3)弃去培养基I,用PBS清洗两次,再加入含0.53mM EDTA的0.25%胰蛋白酶(Trypsin)消化后,加入诱导培养液I并继续培养5d,期间每44h更换一次诱导培养液I,诱导培养液I包括:DMEM/F12培养基、20ng/ml的碱性成纤维细胞生长因子、100ng/ml的表皮细胞生长因子、2%的B27细胞培养添加剂(B27Supplement);
(4)弃去诱导培养液I,加入诱导培养液II并继续培养7d,期间每45h更换一次诱导培养液II,诱导培养液II包括:DMEM/F12培养基、1%的fatty acid free-BSA(无脂肪酸牛血清白蛋白)、1%的胰岛素-转铁蛋白-亚硒酸钠(ITS)、2nM的重组人激活素A、5mM的牛磺酸、100pM的肝细胞生长因子;
(5)弃去诱导培养液II,加入诱导培养液III并继续培养7d,期间每43h更换一次诱导培养液III,7d后得到目标细胞簇并收集存储,诱导培养液III包括:DMEM/F12培养基、10nM的促胰岛素分泌肽(exendin-4)、0.1mM的牛磺酸、2nM的重组人激活素A;
上述培养条件均为:在37℃,95%湿度的CO
图2为脂肪间充质干细胞(ADSCs)在诱导过程中细胞形态变化过程,可以看出,细胞开始由原先的间充质干细胞典型的成纤维样变为相邻细胞互相接触,聚拢形成一个个细胞簇样的结构,散在的单个细胞也失去原先的成纤维样细胞形态,而是转变为类似体外分离后的胰岛细胞类似的圆形形态。
实施例2
与实施例1不同的是:
步骤(2)中,待细胞汇合度为85%左右时,弃去培养基I,加入含有Adv-PDX-1过表达腺病毒的培养基感染细胞5h后更换新鲜培养基I,并置于培养箱中继续培养8d;
步骤(3)中,加入诱导培养液I并继续培养4d,期间每48h更换一次诱导培养液I;
步骤(4)中,加入诱导培养液II并继续培养6d,期间每40h更换一次诱导培养液II;
步骤(5)中,加入诱导培养液III并继续培养6d,期间每40h更换一次诱导培养液III,6d后得到目标细胞簇并收集存储;
培养条件均为:在35℃,96%湿度的CO
实施例3
与实施例1不同的是:
步骤(2)中,待细胞汇合度为95%左右时,弃去培养基I,加入含有Adv-PDX-1过表达腺病毒的培养基感染细胞7h后更换新鲜培养基I,并置于培养箱中继续培养6d;
步骤(3)中,加入诱导培养液I并继续培养6d,期间每40h更换一次诱导培养液I;
步骤(4)中,加入诱导培养液II并继续培养8d,期间每48h更换一次诱导培养液II;
步骤(5)中,加入诱导培养液III并继续培养8d,期间每48h更换一次诱导培养液III,8d后得到目标细胞簇并收集存储;
培养条件均为:在36℃,93%湿度的CO
实施例4
该实施例提供了一种复合物,包括所述的胰岛细胞和细胞支架;细胞支架可采用PDA-PLGA-Hydrogel细胞支架;
所述的PDA-PLGA-Hydrogel细胞支架的制备方法,采用CaCl2与海藻酸钠进行交联制备了海藻酸钠水凝胶并将其作为支架填充物填充在PDA-PLGA细胞支架中;
其中,PDA-PLGA细胞支架制备方法:
(1)首先将作为静电纺丝主体的高分子聚合物PLGA固体颗粒称取1.0g溶解在CHCL3和C3H6O(v/v=3:1)的混合溶液中,在25℃下搅拌1h至完全溶解,制得质量分数10~15%的静电纺丝原液。将上述制得的静电纺丝原液加入5mL注射器中,前端通过17G平头金属喷丝头与静电纺丝机器连接,并将该注射器固定在注射泵上,金属喷丝头内径1.12mm。调节金属接收板和喷丝头之间的距离,确定接收距离为15cm。控制纺丝过程中金属喷丝头与接收板间的静电高压为15kv,用注射泵控制静电纺丝原液的流速为1.5mL/h,纺制3小时,将制得的材料取下放在通风橱中干燥过夜即得到PLGA纤维支架;
(2)配制pH=8.5的10mM Tris-HCl缓冲溶液,取20mg多巴胺盐酸盐溶解于10mLTris-HCl缓冲溶液中,制备成2mg/mL多巴胺弱碱性溶液;取PLGA纤维支架浸没在多巴胺弱碱性溶液中,保持有氧条件下,充分振摇使多巴胺在材料表面自聚合成聚多巴胺(PDA)涂层,在PDA的自聚合期间,观察到溶液颜色从浅棕色变为黑色,24小时后将支架取出,用蒸馏水冲洗3次,以去除未黏附的聚多巴胺分子,将制得的材料放在通风橱中干燥过夜即得到PDA-PLGA细胞支架;
其中,海藻酸钠是一种能通过二价离子交联形成水凝胶的生物材料。海藻酸钠水凝胶的具体制备步骤为:用电子天平称取一定质量的海藻酸钠透明粉末溶解于超纯水中,搅拌均匀,配置浓度为1-8%的海藻酸钠水溶液。称取一定质量的无水氯化钙,同样溶解于超纯水中,搅拌均匀,配制成100mM的氯化钙溶液。然后,将海藻酸盐溶液放入注射器中,同时在另一个注射器中注入氯化钙溶液。然后使用流体分配连接器混合两个注射器中的内容物,最后制备获得海藻酸钠水凝胶。
本发明采用PDA-PLGA生物支架包裹水凝胶材料制备PDA-PLGA-Hydrogel细胞支架,既具有天然高分子材料的生物相容性,又具备合成高分子材料的强机械性,具有作为细胞移植载体的潜力。
将PDA-PLGA-Hydrogel细胞支架搭载胰岛细胞复合物移植到骨骼肌部位,可用于治疗糖尿病。
实验例1 脂肪间充质干细胞(ADSCs)分化后的类胰岛细胞簇的体外鉴定及功能实验
1.1双硫腙染色实验
取30mg双硫腙溶于3ml二甲基亚砜,过滤分装于-20℃避光保存,临用与PBS按1:100稀释后,与目标细胞簇在37℃孵育10min后在倒置显微镜下观察并拍照。双硫腙可以与铅、铜、锌等螯合,而人和动物(豚鼠除外)的胰岛β细胞中富含锌,双硫腙与其反应后可呈猩红色,而其他细胞不被着色,因此双硫腙可以将胰岛细胞进行特异性着色。
如图3所示,经双硫腙染色后,该诱导后的细胞簇能被特异性地染成猩红色,且周围散在的单个圆形细胞也被着色。
1.2免疫荧光染色实验
诱导结束后,取出培养板中的细胞簇,1×PBS清洗3次,4%多聚甲醛固定15min后,PBS清洗3次/3min后,TritonX-100通透8min,PBS清洗3次/5min,封闭液室温封闭1h后滴加insulin一抗过夜孵育,第二天吸弃一抗后PBST清洗3次/5min,吸弃残余液体后加入携带PE荧光基团的二抗室温孵育1h后,PBST清洗3次/5min,加入含抗荧光淬灭和DAPI的封片剂封片后于正置荧光显微镜下观察。
如图4所示,细胞簇内高表达胰岛素(INS)重组蛋白,且诱导结束后大部分细胞仍然高表达PDX-1蛋白。说明诱导的细胞具有分泌胰岛素(INS)重组蛋白的能力,且效率高。
1.3葡萄糖刺激胰岛素分泌实验
分化至最后一天的细胞簇,小心吸弃上清,加入1×PBS清洗三次后,在KRB缓冲液(含120mM NaCl,2.5mM CaCl2,1.1mM MgCl2,25mM NaHCO3,0.1%BSA)中于37℃孵育1h后,在含3mM或者30mM葡萄糖的KRB缓冲液中继续孵育1h,之后收集上清,使用商品化Rat-insulin Elisa试剂盒(Proteintech)检测胰岛素分泌水平。
结果如图5所示,诱导组细胞经过诱导后,于30mM葡萄糖刺激下与3.0mM葡萄糖刺激相比,胰岛素的分泌量有显著性差异。
实验例2 PDA-PLGA-Hydrogel细胞支架在糖尿病胰岛细胞骨骼肌移植治疗的应用研究
鉴于骨骼肌作为葡萄糖摄取关键靶器官,能够为具备糖刺激胰岛素释放的胰岛细胞移植提供适宜的微环境。进行PDA-PLGA-Hydrogel细胞支架搭载脂肪间充质干细胞诱导分化胰岛细胞骨骼肌移植治疗糖尿病的应用研究。将脂肪间充质干细胞(ADSCs)诱导成胰岛细胞并接种在PDA-PLGA-Hydrogel细胞支架上,在糖尿病大鼠的骨骼肌部位进行移植,检测大鼠的空腹血糖变化,之后对移植部位进行HE,masson染色观察移植部位的病理情况,最后对移植部位进行荧光染色,探究其治疗作用。
实验方法:
一、I型糖尿病大鼠模型的建立;
二、病理学检测
(1)组织切片制备
取大鼠移植部位,PBS漂洗后,固定于4%甲醛溶液,脱水,透明,透蜡后包埋并切片,厚度为6μm。
(2)HE染色
干燥的石蜡切片,置烘箱内65℃烤片30min,二甲苯中脱蜡10min×3次,100%乙醇5min×2次,95%乙醇5min×2次,流水2min,Harris苏木素染色5min,自来水稍洗,1%盐酸酒精溶液分化5~10秒(切片由蓝变红),自来水洗返蓝25分钟,0.5%伊红(水溶性)染色2min,95%乙醇脱水5min×2次,100%乙醇5min×2次,二甲苯中透明5min×2次,用吸水纸吸干液体,使用中性树胶封片,显微镜下观察并拍照。
(3)Masson染色
石蜡切片脱蜡,二甲苯中脱蜡10min×3次,100%乙醇5min×2次,95%乙醇5min×2次,流水2min。用Regaud苏木精染液或Weigert苏木精液染核5-10min,充分水洗,如过染可盐酸酒精分化,蒸馏水洗,用Masson丽春红酸性复红液5-10min,以2%冰醋酸水溶液浸洗片刻,1%磷钼酸水溶液分化3-5min,不经水洗,直接用苯胺蓝或光绿液染5min,以0.2%冰醋酸水溶液浸洗片刻,95%酒精、无水酒精、二甲苯透明、中性树胶封固。
三、免疫荧光染色。
实验结果:
2.1 PDA-PLGA-Hydrogel支架搭载干细胞诱导的胰岛细胞对I型糖尿病大鼠的治疗作用
大鼠适应性喂养1周后随机分为正常对照组、糖尿病模型组、胰岛细胞移植治疗组,糖尿病模型组、胰岛细胞移植治疗组进行STZ造模处理成模后,在胰岛细胞移植治疗组大鼠后肢骨骼肌部位进行胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物的移植,约移植5000IEQ胰岛细胞,卷成棒状移植在大鼠骨骼肌部位,正常对照组、糖尿病模型组不进行材料移植。术后对动物进行常规的喂养,每隔一周检测一次空腹血糖,结果如图6所示。
图6为干细胞诱导的胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物移植后大鼠空腹血糖;其中,Con:正常对照组,DM:糖尿病模型组,Insulin secreting cell+PDA-PLGA+Hydrogel:胰岛细胞移植治疗组;与正常对照组相比,糖尿病模型组、胰岛细胞移植治疗组大鼠STZ造模后空腹血糖显著升高(p<0.001),空腹血糖≥11.1mmoL视为造模成功。胰岛细胞移植治疗组大鼠进行胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物的移植1周后,与糖尿病模型组大鼠相比血糖有明显下降(p<0.001),证明移植的胰岛细胞发挥作用,分泌胰岛素,降低了大鼠的血糖。
2.2 移植部位的HE和Masson染色
经过HE和Masson染色,在光学显微镜下观察组织因材料移植引起的病理改变及纤维化情况。图7为胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物病理检测结果;其中,图A为HE染色结果(左图为4X,右图为10X),图B为Masson染色结果(左图为4X,右图为10X)箭头指向支架中的胰岛结构。
HE染色结果:材料移植后移植部位能观察到明显的细胞浸润,且能观察到由材料卷曲而形成的方向性,炎性细胞主要附着在材料表层。同时材料中心的海藻酸钠水凝胶发生很大程度的降解,导致胰岛细胞发生丢失,仅有少量胰岛存在。
Masson染色结果:细胞浸润的趋势类似于HE染色,生成的胶原纤维主要集中在材料表面,且随着时间逐渐增加,同时也能看到中心的水凝胶发生降解。
综上,PDA-PLGA-Hydrogel细胞支架搭载胰岛细胞进行骨骼肌部位的细胞移植对I型糖尿病有一定的治疗作用,但天然材料海藻酸钠水凝胶降解速度过快,导致细胞丢失,并且随后的纤维化发生导致胰岛细胞缺氧而死。
2.3 胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物移植后胰岛素免疫荧光检测
为了验证胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物对于I型糖尿病大鼠的治疗作用,取大鼠肌肉及移植物固定切片进行了胰岛素免疫荧光检测,观察胰岛细胞存活及胰岛素分泌情况。胰岛素免疫荧光结果如图8所示。
图8为胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物胰岛素免疫荧光结果;图为移植35天时的胰岛素免疫荧光染色结果;胰岛细胞移植治疗组在35天时胰岛素红色荧光较弱,胰岛细胞基本死亡。
综上,PDA-PLGA细胞支架搭载胰岛细胞进行骨骼肌部位的细胞移植对I型糖尿病有一定的治疗作用,但35天时治疗作用消失,因此对移植部位做了进一步实验探究其作用消失的原因。
2.4 胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物移植后胰岛素免疫荧光检测
为了进一步探究第五周胰岛细胞消失,治疗作用减弱的原因,取大鼠肌肉及移植物固定切片进行了CD31免疫荧光检测,观察移植部位的血管生成状况。CD31主要用于证明内皮细胞组织的存在,用于评估新生血管的生成。CD31免疫荧光结果如图9所示。
图9为胰岛细胞与PDA-PLGA-Hydrogel细胞支架复合物的CD31免疫荧光结果;图为移植35天时的CD31免疫荧光染色结果。胰岛细胞移植治疗组在35天时CD31绿色荧光较弱,血管生成较少。这可能和骨骼肌部位本身就是一个血管较少的移植部位有关,但血管是胰岛移植成功的重要评价因素,良好的血管生成可以为移植部位的胰岛输送氧气,因此,新生血管不足可能是胰岛细胞丢失的原因。
实验例3 PDX-1过表达腺病毒载体构建流程及鉴定报告
一、实验材料
实验试剂
载体及目的基因信息:
1、pHBAD-EF1-MCS-3flag-CMV-EGFP-Δloxp载体图谱如图10所示。
目的片断PDX-1插入MCS区,由EF1启动子调控表达,该载体中含有CMV启动子调控的EGFP基因表达。该载体上在目的基因C端自带3flag蛋白标签。
2、目的片断PDX-1序列信息(序列表1):
ATGAATAGTGAGGAGCAGTACTACGCGGCCACACAGCTCTACAAGGACCCGTGCGCATTCCAGAGGGGTCCGGTGCCAGAGTTCAGTGCTAATCCCCCTGCGTGCCTGTACATGGGCCGCCAGCCCCCACCTCCGCCGACACCCCAGTTTGCAGGCTCGCTGGGAACGCTGGAACAGGGAAGTCCCCCGGACATCTCCCCATACGAAGTGCCCCCGCTCGCCGATGACCCGGCTGGCGCGCACCTCCACCACCACCTCCCAGCTCAGCTCGGGCTCGCCCATCCACCTCCCGGACCTTTCCCGAATGGAACCGAGACTGGGGGCCTGGAAGAGCCCAGCCGCGTTCATCTCCCTTTCCCGTGGATGAAATCCACCAAAGCTCACGCGTGGAAAAGCCAGTGGGCAGGAGGTGCATACGCAGCAGAACCGGAGGAGAATAAGAGGACCCGTACAGCCTACACTCGGGCCCAGCTGCTGGAGCTGGAGAAGGAATTCTTATTTAACAAATACATCTCCCGGCCTCGCCGGGTGGAGCTGGCAGTGATGCTCAACTTGACTGAGAGACACATCAAAATCTGGTTCCAAAACCGTCGCATGAAGTGGAAGAAAGAGGAAGATAAGAAACGTAGTAGCGGGACAACGAGCGGGGGCGGTGGGGGCGAAGAGCCGGAGCAGGATTGTGCCGTAACCTCGGGCGAGGAGCTGCTGGCATTGCCAAAGCCACCACCTCCCGGAGGTGTTGTGCCCTCAGGCGTCCCTGCTGCTGCCCGGGAGGGCCGACTGCCTTCCGGCCTTAGTGCGTCCCCACAGCCCTCCAGCATCGCGCCACTGCGACCGCAGGAACCCCGGTGA
该序列直接合成至pHBAD-EF1-MCS-3flag-CMV-EGFP-Δloxp载体上,由合成公司完成。
二、合成质粒酶切验证结果
上述CDS区序列合成完毕后,最终需要将DNA片段移接到腺病毒载体中,DNA插入区域为BamHI-KpnI两种限制性酶中间。进行酶切并将酶切产物进行测序验证产物的序列是否正确。图11所示,采用BamHI-KpnI双酶切之后,首带为未酶切载体质粒,中间带为酶切后的载体质粒条带,可见在500~1000bp之间有一条带(目的条带PDX-1,约在800bp位置),5000~6000bp之间有一条带(环状质粒酶切开环后的条带,约在5300bp位置),KB ladder和DL3000均为不同分子量大小的DNA Marker凝胶。
三、实验结果
正向测序结果见图12所示;
反向测序结果见图13所示;
质粒测序结果(序列表2):
GGATCCGCCACCATGAATAGTGAGGAGCAGTACTACGCGGCCACACAGCTCTACAAGGACCCGTGCGCATTCCAGAGGGGTCCGGTGCCAGAGTTCAGTGCTAATCCCCCTGCGTGCCTGTACATGGGCCGCCAGCCCCCACCTCCGCCGACACCCCAGTTTGCAGGCTCGCTGGGAACGCTGGAACAGGGAAGTCCCCCGGACATCTCCCCATACGAAGTGCCCCCGCTCGCCGATGACCCGGCTGGCGCGCACCTCCACCACCACCTCCCAGCTCAGCTCGGGCTCGCCCATCCACCTCCCGGACCTTTCCCGAATGGAACCGAGACTGGGGGCCTGGAAGAGCCCAGCCGCGTTCATCTCCCTTTCCCGTGGATGAAATCCACCAAAGCTCACGCGTGGAAAAGCCAGTGGGCAGGAGGTGCATACGCAGCAGAACCGGAGGAGAATAAGAGGACCCGTACAGCCTACACTCGGGCCCAGCTGCTGGAGCTGGAGAAGGAATTCTTATTTAACAAATACATCTCCCGGCCTCGCCGGGTGGAGCTGGCAGTGATGCTCAACTTGACTGAGAGACACATCAAAATCTGGTTCCAAAACCGTCGCATGAAGTGGAAGAAAGAGGAAGATAAGAAACGTAGTAGCGGGACAACGAGCGGGGGCGGTGGGGGCGAAGAGCCGGAGCAGGATTGTGCCGTAACCTCGGGCGAGGAGCTGCTGGCATTGCCAAAGCCACCACCTCCCGGAGGTGTTGTGCCCTCAGGCGTCCCTGCTGCTGCCCGGGAGGGCCGACTGCCTTCCGGCCTTAGTGCGTCCCCACAGCCCTCCAGCATCGCGCCACTGCGACCGCAGGAACCCCGGGGTACC
实验结束后,切下800bp左右的位置用进行DNA测序,得到测序结果,并与CDS区域的序列比对,可以看出质粒测序结果中含有目的片断PDX-1序列。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110> 吉林大学
<120> 一种干细胞分化而成的胰岛细胞、方法、复合物及应用
<160> 2
<170> SIPOSequenceListing 1.0
<210> 2
<211> 852
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
atgaatagtg aggagcagta ctacgcggcc acacagctct acaaggaccc gtgcgcattc 60
cagaggggtc cggtgccaga gttcagtgct aatccccctg cgtgcctgta catgggccgc 120
cagcccccac ctccgccgac accccagttt gcaggctcgc tgggaacgct ggaacaggga 180
agtcccccgg acatctcccc atacgaagtg cccccgctcg ccgatgaccc ggctggcgcg 240
cacctccacc accacctccc agctcagctc gggctcgccc atccacctcc cggacctttc 300
ccgaatggaa ccgagactgg gggcctggaa gagcccagcc gcgttcatct ccctttcccg 360
tggatgaaat ccaccaaagc tcacgcgtgg aaaagccagt gggcaggagg tgcatacgca 420
gcagaaccgg aggagaataa gaggacccgt acagcctaca ctcgggccca gctgctggag 480
ctggagaagg aattcttatt taacaaatac atctcccggc ctcgccgggt ggagctggca 540
gtgatgctca acttgactga gagacacatc aaaatctggt tccaaaaccg tcgcatgaag 600
tggaagaaag aggaagataa gaaacgtagt agcgggacaa cgagcggggg cggtgggggc 660
gaagagccgg agcaggattg tgccgtaacc tcgggcgagg agctgctggc attgccaaag 720
ccaccacctc ccggaggtgt tgtgccctca ggcgtccctg ctgctgcccg ggagggccga 780
ctgccttccg gccttagtgc gtccccacag ccctccagca tcgcgccact gcgaccgcag 840
gaaccccggt ga 852
<210> 3
<211> 867
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ggatccgcca ccatgaatag tgaggagcag tactacgcgg ccacacagct ctacaaggac 60
ccgtgcgcat tccagagggg tccggtgcca gagttcagtg ctaatccccc tgcgtgcctg 120
tacatgggcc gccagccccc acctccgccg acaccccagt ttgcaggctc gctgggaacg 180
ctggaacagg gaagtccccc ggacatctcc ccatacgaag tgcccccgct cgccgatgac 240
ccggctggcg cgcacctcca ccaccacctc ccagctcagc tcgggctcgc ccatccacct 300
cccggacctt tcccgaatgg aaccgagact gggggcctgg aagagcccag ccgcgttcat 360
ctccctttcc cgtggatgaa atccaccaaa gctcacgcgt ggaaaagcca gtgggcagga 420
ggtgcatacg cagcagaacc ggaggagaat aagaggaccc gtacagccta cactcgggcc 480
cagctgctgg agctggagaa ggaattctta tttaacaaat acatctcccg gcctcgccgg 540
gtggagctgg cagtgatgct caacttgact gagagacaca tcaaaatctg gttccaaaac 600
cgtcgcatga agtggaagaa agaggaagat aagaaacgta gtagcgggac aacgagcggg 660
ggcggtgggg gcgaagagcc ggagcaggat tgtgccgtaa cctcgggcga ggagctgctg 720
gcattgccaa agccaccacc tcccggaggt gttgtgccct caggcgtccc tgctgctgcc 780
cgggagggcc gactgccttc cggccttagt gcgtccccac agccctccag catcgcgcca 840
ctgcgaccgc aggaaccccg gggtacc 867
- 一种干细胞分化而成的胰岛细胞、方法、复合物及应用
- 一种细胞支架、其搭载胰岛细胞复合物、制备方法、应用
