原位基因编辑
文献发布时间:2023-06-19 12:19:35
相关应用
本申请要求2018年8月18日提交的美国临时申请号62/719,628的权益。以上申请的全部教导内容以引用方式并入本文。
政府支持
本发明是根据由美国国立卫生研究院(National Institutes of Health)授予的授权号F32AG050395、R01 HL135287、DP1 AG048917和R01 AR070825在政府支持下完成的。政府享有本发明的某些权利。
背景技术
身体组织和器官的有效功能发挥取决于适当细胞数目的维持(体内稳态)和损伤后受损细胞的更换(修复),这两个过程都需要组织干细胞的调控作用。跨越数十年的许多研究试图定义干细胞功能的关键分子调节剂。但是,研究人员能够询问和确定此类介体的速度因产生基因工程化小鼠和通常用于此类研究的干细胞移植模型的技术限制而受约束。特别地,转基因和基于基因敲除的方法需要产生和繁育多个不同的基因工程化缺失和/或夹杂等位基因(floxed allele),以便以普遍或组织特异性方式破坏目标基因,当干扰若干基因的组合效应引人关注时,这一挑战就会加剧。同样,对干细胞的离体基因组操纵也需要对这些细胞进行分离和移植,这扰乱了内源性干细胞生态位中存在的关键调控相互作用,并会深刻地改变正常干细胞的特性(Wagers,2012)。因此,可编程的体内平台可操纵内源性干细胞中的基因表达而无需对这些细胞进行分离或产生复杂的多等位基因转基因动物,本领域将从中大大受益。
当前提出的许多基于CRISPR/cas9的基因修饰治疗方式包括离体方法,其中在修饰之前从患者移除靶细胞群。然而,实体组织不一定能从患者移除,进而限制了这些方法的适用性。此外,移除诸如造血细胞的组织会带来巨大的移植失败和感染风险,并且需要昂贵的GMP设施来处理离体细胞。由于细胞天然生态位和调控相互作用的丧失,组织移除还会破坏组织中的细胞功能发挥。因此,仍然需要原位基因修饰方法,特别是对于不能轻易从受试者体内移除的细胞。
发明内容
公开了一种强大的新平台,所述新平台可在细胞的生理生态位内遗传改变细胞,同时保留其天然干细胞特性和调控相互作用。特别地,所述系统允许原位操纵干细胞基因组,而无需进行细胞分离、培养或后续移植,从而保留了天然的调控相互作用和现有的干细胞特性。这种系统还减轻了与离体干细胞修饰和后续移植相关的挑战和毒性,例如体外条件无法维持稳健的干细胞功能,必需使用去髓性预处理,以及移植失败风险不可避免(Morgan等人,2017)。因此,利用DNA修饰酶直接转导内源性组织干细胞的机会与当前正在进行的旨在于干细胞中进行治疗性基因编辑的学术和商业努力有着直接和特定的联系,至此,所有这些都已被考虑在内,有必要纯化干细胞以进行离体修饰和再输注(Morgan等人,2017)。
本文所述的基于AAV的体内系统还克服了与当前用于询问干细胞功能的实验系统相关的关键技术和实践限制。特别地,常用的基于转基因和基因敲除的模型经常需要复杂的繁育方案来引入多个等位基因,这需要大量的时间和资源投入,且当评定老年动物中、非标准遗传背景下或组合方式的基因靶向效果时,变得更成问题。相比之下,如本文所公开,AAV介导的可编程的DNA修饰酶递送可应用于一系列动物年龄和品系以及各种单独的和多重的基因座。因此,这项技术可能在加速体内和组织祖细胞中基因功能和相互作用可被询问的速度方面有重要的应用。最终,这种系统可能适用于使得能够对可能特异性地影响干细胞表型的候选和未知基因靶标进行快速的且直接的体内筛查。
本公开的一些方面涉及用于在体内修饰受试者中的细胞群的基因组的方法,所述方法包括使所述受试者与病毒接触,其中所述病毒将编码靶向序列的核酸酶的核酸序列转导至所述细胞群中;以及用所述靶向序列的核酸酶修饰所述细胞群的基因组(例如,所述细胞群内的细胞的基因组),其中所述细胞群不是造血干细胞或造血祖细胞。在一些实施方案中,所述方法对于细胞群是选择性的,或选择性地排除一个或多个其他细胞群(可排除本文公开或本领域已知的任何细胞群)。在一些实施方案中,所述病毒是腺相关病毒(AAV)。在一些实施方案中,所述AAV是AAV血清型1、2、6、8、9、10或Anc80L65。在一些实施方案中,局部或全身地施用所述病毒。在一些实施方案中,静脉内施用所述病毒。在一些实施方案中,局部注射所述病毒(例如,将病毒注射到包含细胞群(即,靶细胞群)的组织中。
在一些实施方案中,所述靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、Cre重组酶或RNA指导的核酸酶(例如,Cas9核酸酶)。在一些实施方案中,所述靶向序列的核酸酶是Cas9核酸酶。在一些实施方案中,所述病毒在细胞群中进一步转导编码一个或多个gRNA的核酸序列。
在一些实施方案中,所述方法还包括使所述受试者与第二病毒接触,所述第二病毒在细胞群中转导编码一个或多个gRNA的核酸序列。在一些实施方案中,所述第二病毒是AAV。在一些实施方案中,所述AAV是AAV血清型1、2、6、8、9、10或Anc80L65。
在一些实施方案中,所述细胞群是干细胞或祖细胞。在一些实施方案中,所述细胞群是组织干细胞(例如,实体组织干细胞)。在一些实施方案中,所述细胞群是功能性肌肉干细胞。在一些实施方案中,所述细胞群是骨骼肌中的Sca-1
在一些实施方案中,所述修饰包括引入或校正突变。在一些实施方案中,所述修饰包括通过同源定向修复校正突变。
在一些实施方案中,所述受试者是人类或小鼠。
在一些实施方案中,所述细胞群的至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%或更多由所述病毒(例如,第一病毒或第二病毒,或第一病毒和第二病毒两者)转导。在一些实施方案中,所述细胞群的至少40%由所述病毒(例如,第一病毒或第二病毒,或第一病毒和第二病毒两者)转导。
本公开的一些方面涉及一种用于在体内修饰受试者中的肌肉干细胞群的基因组的方法,所述方法包括使所述受试者与病毒接触,其中所述病毒将编码靶向序列的核酸酶的核酸序列转导至所述肌肉干细胞群中;以及用所述靶向序列的核酸酶修饰所述肌肉干细胞群的基因组,其中通过静脉内注射将所述病毒施用给所述受试者,并且其中所修饰的肌肉干细胞保留生肌能力。在一些实施方案中,所述病毒在细胞群中进一步转导编码一个或多个gRNA的核酸序列。
在一些实施方案中,所述病毒是AAV8或Anc80L65。在一些实施方案中,所述肌肉干细胞群的至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或更多由所述病毒转导。在一些实施方案中,所述肌肉干细胞群的至少50%由所述病毒转导。
在一些实施方案中,所述靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、Cre重组酶或RNA指导的核酸酶(例如,Cas9核酸酶)。在一些实施方案中,所述靶向序列的核酸酶是saCas9核酸酶。
在一些实施方案中,所述方法还包括使所述受试者与第二病毒接触,所述第二病毒在细胞群中转导编码一个或多个gRNA的核酸序列。
在一些实施方案中,所述修饰包括引入或校正突变。在一些实施方案中,所述修饰包括通过同源定向修复校正突变。
在一些实施方案中,所述受试者是人类。在一些实施方案中,所述受试者是小鼠。
本公开的一些方面涉及一种用于在体内修饰受试者中的间充质祖细胞群的基因组的方法,所述方法包括使所述受试者与病毒接触,其中所述病毒将编码靶向序列的核酸酶的核酸序列转导至所述间充质祖细胞群中;以及用所述靶向序列的核酸酶修饰所述间充质祖细胞群的基因组。在一些实施方案中,所述病毒在细胞群中进一步转导编码一个或多个gRNA的核酸序列。
在一些实施方案中,所述间充质祖细胞是Sca-1
在一些实施方案中,所述病毒是AAV8、AAV9或Anc80L65。在一些实施方案中,所述间充质祖细胞群的至少11%由所述病毒转导。在一些实施方案中,所述间充质祖细胞群的至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更多由所述病毒转导。在一些实施方案中,所述间充质祖细胞群的至少20%由所述病毒转导。
在一些实施方案中,所述靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、Cre重组酶或RNA指导的核酸酶(例如,Cas9核酸酶)。在一些实施方案中,所述靶向序列的核酸酶是saCas9核酸酶。
在一些实施方案中,所述方法还包括使所述受试者与第二病毒接触,所述第二病毒在细胞群中转导编码一个或多个gRNA的核酸序列。在一些实施方案中,所述修饰包括引入或校正突变。在一些实施方案中,所述修饰包括通过同源定向修复校正突变。
在一些实施方案中,通过局部注射或静脉内注射将所述病毒施用给所述受试者。在一些实施方案中,所述受试者是人类。在一些实施方案中,所述受试者是小鼠。
本公开的一些方面涉及一种用于在体内修饰受试者中的真皮间充质细胞群的基因组的方法,所述方法包括使所述受试者与病毒接触,其中所述病毒将编码靶向序列的核酸酶的核酸序列转导至所述真皮间充质细胞群中;以及用所述靶向序列的核酸酶修饰所述真皮间充质细胞群的基因组。在一些实施方案中,所述病毒在细胞群中进一步转导编码一个或多个gRNA的核酸序列。
在一些实施方案中,所述病毒是AAV8。在一些实施方案中,所述靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、Cre重组酶或RNA指导的核酸酶(例如,Cas9核酸酶)。在一些实施方案中,所述靶向序列的核酸酶是saCas9核酸酶。
在一些实施方案中,所述方法还包括使所述受试者与第二病毒接触,所述第二病毒在细胞群中转导编码一个或多个gRNA的核酸序列。在一些实施方案中,所述修饰包括引入或校正突变。在一些实施方案中,所述修饰包括通过同源定向修复校正突变。在一些实施方案中,所述受试者是人类。在一些实施方案中,所述受试者是小鼠。
附图说明
该专利或申请文件含有至少一张彩图。本专利或专利申请公布的带有彩图的拷贝,在提出请求并支付必要的费用之后,由专利办公室提供。
图1A至图1C示出了全身AAV-Cre施用可转导肌肉卫星细胞。(图1A)实验设计。将编码Cre重组酶的AAV注射到mdx;Ai9小鼠中,所述小鼠携带Rosa26-LSL-tdTomato报告子。i.v.:静脉内。LSL:lox-stop-lox。(图1B)从静脉内注射封装在低(约5.5-8x10
图2A至图2C示出了AAV转导的肌肉卫星细胞保留了分化和植入潜能。(图2A)肌球蛋白重链(MHC)染色的肌管的代表性免疫荧光图像,所述肌管是自从注射低剂量或高剂量的不同AAV血清型的小鼠分离的肌肉卫星细胞分化而来。绿色,MHC。红色,tdTomato。蓝色,Hoechst。比例尺,100μm。Anc80L65缩写为Anc80。(图2B)代表性免疫荧光图像,其分析了来自未移植(上排,对照)或移植了50,000个来自注射高剂量AAV-Cre的Ai9小鼠的经FACS纯化的tdTomato
图3A至图3J示出了全身注射AAV-Cre可转导功能性造血干细胞。(图3A)实验设计。将编码Cre重组酶的AAV注射到mdx;Ai9小鼠中,所述小鼠携带Rosa26-LSL-tdTomato报告子。i.v.:静脉内。LSL:lox-stop-lox。(图3B)HSC门控策略,骨髓(BM)中的(Lin
图4A至图4G示出了AAV转导的造血干细胞在二次移植后展现长期重构潜能。(图4A)在移植后每月间隔时次级接受者的活外周血细胞之间的供体嵌合性百分比。数据是平均值±SD。每组N=6-9个次级接受者。(图4B)在移植后16周在指定外周血谱系内有tdTomato
图5A至图5G示出了全身注射AAV-Cre可转导骨骼肌卫星细胞和间充质祖细胞。(图5A)从未注射的Ai9fl/fl小鼠(上)或在注射高剂量AAV8-Cre后2周从年龄相匹配的Ai9fl/fl小鼠(下)收集的胫骨前肌(TA)的代表性免疫荧光图像。分析了N=4只注射的小鼠。比例尺,20μm。(图5B)未注射小鼠或注射高剂量AAV8-Cre的Ai9
图6A至图6D示出了局部注射AAV-Cre能够递送至骨骼肌卫星细胞。(图6A)Lin
图7A至图7H示出了全身注射AAV-Cre可转导造血祖细胞。(图7A)以下红细胞前体细胞的FACS门控策略:EryA(Ter119
图8A至图8F示出了局部注射AAV-Cre能够递送至造血干细胞。(图8A)股骨内施用AAV-Cre后6周HSC内tdTomato表达的代表性流式细胞术分析。(图8B)注射腿(蓝色)或对侧腿(红色)内表达tdTomato的Lin
图9A至9H显示全身注射AAV-Cre能够转导皮肤驻留的造血细胞、成纤维细胞和间充质前体。(图9A)流式细胞术门控策略,用以基于皮肤真皮内的CD24和Sca-1表达来鉴定造血细胞(CD45
图10A至图10B显示全身AAV施用未诱导明显的肝组织病理学。(图10A)来自注射媒介物或注射AAV8-Cre的mdx;Ai9动物的肝切片的代表性苏木精和曙红(H&E)图像。以静脉内方式进行注射。(图10B)注射AAV8-Cre和注射媒介物的mdx;Ai9小鼠的子组与未注射C57BL/6J(野生型)对照的的肝组织病理学评分。组织中含有一些在正常小鼠中常见的微脓肿和在正常小鼠中偶发的小坏死灶。比例尺,200μm。vg:病毒基因组。
图11A至图11F示出了以AAV-saCas9-gDnmt3a对Dnmt3a的体内编辑。图11A示出了含有Dnmta3 gRNA靶向位点的扩增Dnmt3序列中含有插入缺失的序列读段的百分比。图11B示出了含有Dnmta3gRNA靶向位点的扩增Dnmt3序列中对应于野生型序列的序列读段的百分比。图11C示出了骨髓细胞中Dnmta3 gRNA靶向位点周围的插入缺失的直方图。图11D示出了HSC中Dnmta3 gRNA靶向位点周围的插入缺失的直方图。图11E示出了MPP中Dnmta3 gRNA靶向位点周围的插入缺失的直方图。图11E示出了肝细胞中Dnmta3 gRNA靶向位点周围的插入缺失的直方图。
具体实施方式
公开了用于体内(即,原位)修饰细胞(例如,组织干细胞)内的DNA序列的策略(即,方法)。此策略利用病毒(例如,AAV介导的)递送将靶向序列的核酸酶原位送入细胞中。可将AAV直接注射到组织中以进行修饰或全身递送。使用AAV介导的递送将Cre重组酶送入荧光报告小鼠(Ai9报告子,在切除loxP Cre识别位点侧接的序列后展现红色荧光),该系统的概念验证已在许多不同的细胞类型中得到了证明。已经显示了对体内多达65%的干细胞和祖细胞的编辑以及已证实的修饰细胞的功能性。此外,本文显示注射到受试者中的转导saCAS9和gRNA的AAV可特异性地修饰肝、骨髓、HSC和MPP。
在一些方面,本发明涉及一种用于在受试者(例如,人类、小鼠)中原位修饰细胞群(例如,靶细胞群)的基因组的方法,所述方法包括使所述受试者与病毒(例如,腺相关病毒(AAV))接触,其中所述病毒将编码靶向序列的核酸酶的核酸序列转导至所述细胞群中;以及用所述靶向序列的核酸酶修饰所述细胞群的基因组。在一些实施方案中,细胞群是干细胞群、组织干细胞群、肌肉干细胞群(例如,功能性肌肉干细胞群)、间充质祖细胞群、Sca-1
在一些实施方案中,细胞或其亚群(例如,具有一个特定细胞表面标记物或一组标记物的细胞)的至少约0.1%、0.5%、1%、2%、3%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、90%或更多被修饰。在一些实施方案中,细胞或其亚群的基因组的至少约0.1%、0.5%、1%、2%、3%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、90%或更多经由同源重组(例如,替换或插入基因组序列)被修饰。在一些实施方案中,细胞或其亚群的基因组的至少约0.1%、0.5%、1%、2%、3%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、90%或更多经由非同源末端连接(NHEJ)(例如,缺失基因组序列)被修饰。在一些实施方案中,修饰包括对至少一个等位基因的修饰。在一些实施方案中,修饰包括对两个等位基因的修饰。
在一些实施方案中,与非靶向细胞群(例如,同样与病毒接触的不同细胞群,诸如包含靶向细胞群的组织中的另一种细胞类型)相比,至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.5倍、3倍、3.5倍、4倍、5倍、10倍、20倍、50倍、100倍或更多的细胞群被修饰。
如本文所用,“受试者”意指人类或动物(例如,灵长类动物)。通常,动物是脊椎动物诸如灵长类动物、啮齿动物、家养动物或狩猎动物。灵长类动物包括黑猩猩、食蟹猴、蜘蛛猴和猕猴例如恒河猴。啮齿动物包括小鼠、大鼠、土拨鼠、雪貂、兔和仓鼠。家养动物和狩猎动物包括奶牛、马、猪、鹿、野牛、水牛、猫科动物(例如家猫)、犬科动物(例如狗)、狐狸、狼、禽类动物(例如鸡)、鸸鹋、鸵鸟,以及鱼类(例如鳟鱼、鲶鱼和鲑鱼)。患者或受试者包括上述物种的任何亚群,例如所有上述物种但排除一个或多个组或物种例如人类、灵长类动物或啮齿动物。在某些实施方案中,受试者是哺乳动物,例如灵长类动物,例如人。术语“患者”、“个体”和“受试者”在本文中可互换使用。优选地,受试者是哺乳动物。哺乳动物可以是人类、非人类灵长类动物、小鼠、大鼠、狗、猫、马或奶牛,但不限于这些实例。受试者可以是男性或女性。在各种实施方案中,“受试者”可以是任何脊椎动物生物体。受试者可以是例如出于实验、诊断和/或治疗目的而对其施用药剂的个体,或者是从其获得样品或对其进行手术的个体。在一些实施方案中,人类受试者为新生儿至6个月大。在一些实施方案中,人类受试者为6至24个月大。在一些实施方案中,人类受试者为2至6岁、6至12岁或12至18岁。在一些实施方案中,人类受试者为18至30岁、30至50岁、50至80岁或大于80岁。在一些实施方案中,受试者为至少约5、10、20、30、40、50、60、65、70、75、80、85或90岁。在一些实施方案中,受试者小于约5、10、20、30、40、50、60、65、70、75、80、85或90岁。在一些实施方案中,受试者是成人。出于此目的,至少18岁的人被视为成年人。在一些实施方案中,所述受试者是青少年(例如,对于人类受试者而言,小于约18、12或6岁)。在一些实施方案中,所述受试者不是青少年(例如,对于人类受试者而言,小于约18、12或6岁)。在一些实施方案中,受试者是胚胎。在一些实施方案中,受试者是胎儿。在某些实施方案中,将剂施用给怀孕女性以治疗子宫内胚胎或胎儿或引起对子宫内胚胎或胎儿的生物学效应。
如本文所用,使细胞与一种或多种病毒“接触”可包括将病毒全身地(例如,静脉内)或局部地(例如,局部注射到皮肤组织、肌肉组织或其他靶向组织或器官中)施用给受试者。或者,可选择其他施用途径(例如,口服、吸入、鼻内、气管内、动脉内、眼内、静脉内、肌内和其他母体途径)。接触方法不受限制,并且可以是本领域中可用的任何适合方法。
如本文所用,术语“核酸”或“核酸序列”是指结合了核糖核酸、脱氧核糖核酸或其类似物的单元的任何分子,优选地是聚合物分子。核酸可以是单链或双链的。单链核酸可以是变性双链DNA的单链核酸。或者,它可以是不衍生自任何双链DNA的单链核酸。在一方面,模板核酸是DNA。在另一方面,模板是RNA。适合核酸分子是DNA,包括基因组DNA或cDNA。其他适合核酸分子是RNA,包括mRNA。核酸分子可以是天然存在的,例如在基因组DNA中,或者可以是合成的,即基于人类行为而制备的,或者可以是这两者的组合。核酸分子也可具有某些修饰,诸如如美国专利申请20070213292中所述的2’-脱氧、2’-脱氧-2’氟、2’-0-甲基、2’-0-甲氧基乙基(2’-0-MOE)、2’-0-氨基丙基(2’-0-AP)、2’-0-二甲基氨基乙基(2’-0-DMAOE)、2’-0-二甲基氨基丙基(2’-0-DMAP)、2’-0-二甲基氨基乙氧基乙基(2’-0-DMAEOE)或2’-0--N-甲基乙酰氨基(2’-0-NMA)、胆固醇加成和硫代磷酸酯骨架;如美国专利号6,268,490中所述的通过亚甲基单元连接在2’-氧与4’-碳原子之间的某些核糖核苷,其中这两个专利和专利申请均以引用方式整体并入本文。
在一些实施方案中,病毒组合物可以剂量单位配制以含有在约1.0x10
在整个说明书中公开的方法中使用的适合病毒包括例如腺病毒、腺相关病毒、逆转录病毒(例如,慢病毒)、牛痘病毒和其他痘病毒、疱疹病毒(例如,单纯疱疹病毒)等。病毒在引入到宿主细胞中时可能包含或可能不包含用于产生感染性病毒的充足病毒遗传信息,即病毒载体可能具有复制能力或者是复制缺陷型的。
在一些实施方案中,病毒是腺相关病毒。腺相关病毒(AAV)是一种小的(20nm)复制缺陷型无包膜病毒。AAV基因组是长约4.7千碱基的单链DNA(ssDNA)。基因组在DNA链的两端包括反向末端重复序列(ITR),以及两个开放阅读框(ORF):rep和cap。AAV基因组最常整合到19号染色体上的特定位点中。随机结合到基因组的频率可忽略不计。可通过从载体去除至少部分rep ORF而消除整合能力,从而产生保持附加型并且至少在非分裂细胞中提供持续表达的载体。为了使用AAV作为基因转移载体,将包含可操作地连接至启动子的编码所需蛋白质或RNA(例如,编码抑制ATPIF1的多肽或RNA)的核酸序列的核酸插入AAV基因组的反向末端重复序列(ITR)之间。腺相关病毒(AAV)及其作为载体的用途(例如用于基因疗法)在Snyder,RO和Moullier,P.,Adeno-Associated Virus Methods and Protocols,Methodsin Molecular Biology,第807卷.Humana Press,2011中也有所论述。
在一些实施方案中,病毒是AAV血清型1、2、6、8、9、10或Anc80(即,Anc80L65)(在WO2015054653中公开,其以引用方式并入本文)。可适当地使用任何AAV血清型或修饰的AAV血清型,但不限于此。
另一种适合AAV可以是例如rhlO[WO 2003/042397]。其他AAV来源可包括例如AAV9[US 7,906,111;US 2011-0236353-A1]和/或hu37[参见,例如,US 7,906,111;US 2011-0236353-A1]、AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV6.2、AAV7、AAV8、[美国专利7790449;美国专利7282199]等。参见,例如,WO 2003/042397;和WO 2005/033321;WO 2006/110689;美国专利7790449;美国专利7282199;US 7588772B2的这些和其他适合AAV的序列,以及用于生成AAV载体的方法。可选择其他AAV,任选地考虑所选AAV衣壳的组织偏好。重组AAV载体(AAV病毒颗粒)可包含封装在AAV衣壳内的核酸分子,所述核酸分子包含5’AAV ITR、本文所述的表达盒和3’AAV ITR。如本文所述,表达盒可包含用于每个表达盒内的一个或多个开放阅读框的调控元件,并且核酸分子可任选地包含额外的调控元件。
在一些实施方案中,所述AAV血清型对靶向细胞群具有趋向性或者优先转导靶向细胞群。在一些实施方案中,与非靶向细胞群(例如,同样与病毒接触的不同细胞群,诸如包含靶向细胞群的组织中的另一种细胞类型)相比,AAV血清型对至少约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.5倍、3倍、3.5倍、4倍、5倍、10倍、20倍、50倍、100倍或更多的靶向细胞群具有趋向性或者进行优先转导。在一些实施方案中,AAV血清型基本上或仅转导靶向细胞群。
AAV载体可包含全长AAV 5’反向末端重复序列(ITR)和全长3’ITR。已经描述了称为AITR的5’ITR的缩短型式,其中缺失了D序列和末端解析位点(trs)。缩写“sc”是指自身互补的。“自身互补AAV”是指其中由重组AAV核酸序列携带的编码区已被设计用于形成分子内双链DNA模板的构建体。感染后,scAAV的两个互补半部分将缔合而形成一个准备立即复制和转录的双链DNA(dsDNA)单元,而不是等待细胞介导的第二链的合成。参见,例如,D MMcCarty等人,"Self-complementary recombinant adeno-associated virus(scAAV)vectors promote efficient transduction independently of DNA synthesis",GeneTherapy,(August 2001),第8卷,第16期,第1248-1254页。自身互补AAV描述于例如美国专利号6,596,535;7,125,717和7,456,683中,所述专利各自以引用方式整体并入本文。
在要产生假型AAV的情况下,ITR选自与衣壳的AAV来源不同的来源。例如,可选择AAV2 ITR与AAV衣壳一起使用,所述衣壳对于所选的细胞受体、靶组织或病毒靶标具有特定的效率。在一个实施方案中,为方便起见使用来自AAV2的ITR序列或其缺失型式(AITR)并且用于加速监管批准。然而,可选择来自其他AAV来源的ITR。如果ITR的来源是来自AAV2,而AAV衣壳来自另一个AAV来源,则可将所得载体称为假型。然而,可利用AAV ITR的其他来源。
可使用单链AAV病毒载体。用于产生和分离适合于递送至受试者的AAV病毒载体的方法在本领域中是已知的。参见,例如,美国专利7790449;美国专利7282199;WO 2003/042397;WO 2005/033321;WO 2006/110689;和US 7588772 B2。在一个系统中,用编码ITR侧接的转基因的构建体和编码rep和cap的构建体瞬时转染生产细胞系。在第二系统中,用编码ITR侧接的转基因的构建体转染(瞬时地或稳定地)稳定地供应rep和cap的封装细胞系。在这些系统中的每一系统中,响应于辅助腺病毒或疱疹病毒感染而产生AAV病毒体,由此需要将rAAV与污染性病毒分开。最近,已经开发出不需要辅助病毒感染即可恢复AAV的系统-所需的辅助功能(例如,腺病毒El、E2a、VA和E4或疱疹病毒UL5、UL8、UL52和UL29,以及疱疹病毒聚合酶)也由所述系统反式提供。在这些较新的系统中,可通过用编码所需辅助功能的构建体瞬时转染细胞来提供辅助功能,或者可对细胞进行工程化以使其稳定地包含编码辅助功能的基因,所述基因的表达可控制在转录水平或转录后水平下。在另一个系统中,通过用基于杆状病毒的载体感染,而将ITR和rep/cap基因侧接的转基因引入昆虫细胞中。有关这些生产系统的综述,大体上参见例如Zhang等人,2009,"Adenovirus-adeno-associatedvirus hybrid for large-scale recombinant adeno-associated virus production,"Human Gene Therapy 20:922-929,其各自的内容以引用方式整体并入本文。制备和使用这些和其他AAV生产系统的方法还描述于以下美国专利中,所述专利的内容以引用方式整体并入本文:5,139,941;5,741,683;6,057,152;6,204,059;6,268,213;6,491,907;6,660,514;6,951,753;7,094,604;7,172,893;7,201,898;7,229,823;和7,439,065。
在另一个实施方案中,可使用其他病毒载体,包括整合病毒,例如疱疹病毒或慢病毒,但是可选择其他病毒。适当地,在产生这些其他载体中一者的情况下,载体将被产生为复制缺陷型病毒载体。“复制缺陷型病毒”或“病毒载体”是指合成或人工病毒颗粒,其中含有目标基因的表达盒被封装在病毒衣壳或包膜中,其中同样封装在病毒衣壳或包膜内的任何病毒基因组序列是复制缺陷型;即,它们不能产生子代病毒体,但保留了感染靶细胞的能力。在一个实施方案中,病毒载体的基因组不包括编码复制所需的酶的基因(基因组可被工程化为“无肠”-仅含有扩增和封装人工基因组所需的信号所侧接的目标转基因),但这些基因可能在生产过程中供应。
一种或多种病毒可含有能够指导哺乳动物细胞中的表达(例如,靶向序列的核酸酶、供体模板和/或一种或多种gRNA的表达)的启动子,诸如例如来自巨细胞病毒(CMV)、逆转录病毒、猿猴病毒(例如SV40)、乳头瘤病毒、疱疹病毒或其他感染哺乳动物细胞的病毒的适合病毒启动子,或来自例如诸如EF1α、泛素(例如泛素B或C)、球蛋白、肌动蛋白、磷酸甘油酸激酶(PGK)等的基因的哺乳动物启动子,或复合启动子诸如CAG启动子(CMV早期增强子元件和鸡β-肌动蛋白启动子的组合)。在一些实施方案中,可使用人类启动子。在一些实施方案中,启动子选自CMV启动子、U6启动子、H1启动子、组成型启动子和遍在启动子。在一些实施方案中,启动子指导在特定细胞类型(例如,靶向细胞群)中的表达。例如,肌肉干细胞特异性启动子、间充质祖细胞特异性启动子或真皮间质细胞(CD140a+)特异性启动子。在一些实施方案中,启动子选择性地指导在本文所述的任何细胞群中的表达。
可在本文所公开的方法中使用的靶向序列的核酸酶不受限制,并且可以是本文所公开的任何靶向序列的核酸酶。在一些实施方案中,靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、RNA指导的核酸酶(例如,Cas核酸酶(例如Cas9核酸酶))或其功能片段或功能变体。
当前使用四种主要类型的靶向序列的核酸酶(即,可靶向核酸酶、位点特异性核酸酶):锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)和RNA指导的核酸酶(RGN)(诸如CRISPR/Cas II型系统的Cas蛋白),以及工程化的大范围核酸酶。ZFN和TALEN包含限制性酶FokI(或其工程化变体)的核酸酶结构域,所述核酸酶结构域融合至位点特异性DNA结合结构域(DBD),所述位点特异性DNA结合结构域被适当地设计用于将蛋白质靶向所选的DNA序列。就ZFN而言,DNA结合结构域(DBD)包含锌指DBD。就TALEN而言,位点特异性DBD是基于转录激活因子样效应物(TALE)采用的DNA识别代码设计的,TALE是在植物致病性细菌(诸如黄单胞菌属)中发现的位点特异性DNA结合蛋白家族。
成簇规律间隔短回文重复序列(CRISPR)II型系统是一种细菌适应性免疫系统,其已经修饰以用作用于基因组工程化的RNA指导的核酸内切酶技术。细菌系统包含两个称为crRNA和tracrRNA的内源性细菌RNA和一个CRISPR相关(Cas)核酸酶,例如Cas9。tracrRNA与crRNA具有部分互补性,并与之形成复合物。Cas蛋白通过crRNA/tracrRNA复合物被导向至靶序列,所述复合物在crRNA序列与靶标中的互补序列之间形成RNA/DNA杂交体。为了在基因组修饰中使用,通常将crRNA和tracrRNA组分组合成单一嵌合指导RNA(sgRNA或gRNA),其中crRNA的靶向特异性和tracrRNA的特性被组合到单一转录物中,所述转录物将Cas蛋白定位至靶序列,使得Cas蛋白可切割DNA。sgRNA通常包含与所需靶序列互补或同源的大约20个核苷酸的指导序列,随后是约80nt的杂交crRNA/tracrRNA。本领域普通技术人员应理解,指导RNA不必与靶序列完全互补或同源。例如,在一些实施方案中,它可具有一个或两个错配。gRNA杂交的基因组序列通常在一侧接有原间隔区相邻基序(PAM)序列,但本领域普通技术人员应理解某些Cas蛋白对PAM序列的要求可能较宽松。PAM序列存在于基因组DNA中,但不存在于sgRNA序列中。Cas蛋白将被引导至具有正确靶序列和PAM序列的任何DNA序列。PAM序列根据衍生Cas蛋白的细菌种类而有所改变。Cas蛋白的具体实例包括Cas1、Cas2、Cas3、Cas4、Cas5、Cas6、Cas7、Cas8、Cas9和Cas10。在一些实施方案中,位点特异性核酸酶包含Cas9蛋白。例如,可使用来自化脓性链球菌(Streptococcus pyogenes)、脑膜炎奈瑟氏菌(Neisseria meningitides)、金黄色葡萄球菌(Staphylococcus aureus)、嗜热链球菌(Streptococcus thermophiles)或齿垢密螺旋体(Treponema denticola)的Cas9。这些Cas9蛋白的PAM序列分别为NGG、NNNNGATT、NNAGAA、NAAAAC。在一些实施方案中,Cas9来自金黄色葡萄球菌(saCas9)。
已经开发了许多位点特异性核酸酶的工程化变体,这些工程化变体可在某些实施方案中使用。例如,Cas9和Fok1的工程化变体在本领域中是已知的。此外,应当理解,可使用生物活性片段或变体。其他变化包括使用杂交位点特异性核酸酶。例如,在CRISPR RNA指导的FokI核酸酶(RFN)中,FokI核酸酶结构域与无催化活性的Cas9蛋白(dCas9)蛋白的氨基末端融合。RFN充当二聚体并利用两个指导RNA(Tsai,QS等人,Nat Biotechnol.2014;32(6):569–576)。产生单链DNA断裂的位点特异性核酸酶也用于基因组编辑。可通过在包含两个核酸酶结构域的位点特异性核酸酶(诸如ZFN、TALEN和Cas蛋白)的两个核酸酶结构域之一中的关键催化残基处引入突变(例如,丙氨酸取代)来生成此类核酸酶(有时称为“切口酶”)。此类突变的实例包括SpCas9中或其他Cas9蛋白中同源位置处的D10A、N863A和H840A。在一些细胞类型中,切口可能会以低效率刺激HDR。靶向彼此靠近且在相反链上的一对序列的两个切口酶可在每条链上产生单链断裂(“双切刻”),从而有效产生DSB,DSB可任选地使用供体DNA模板通过HDR进行修复(Ran,F.A.等人Cell 154,1380-1389(2013)。在一些实施方案中,Cas蛋白是SpCas9变体。在一些实施方案中,SpCas9变体是R661A/Q695A/Q926A三重变体或N497A/R661A/Q695A/Q926A四重变体。参见Kleinstiver等人,“High-fidelity CRISPR–Cas9 nucleases with no detectable genome-wide off-target effects,”Nature,第529卷,第490-495期(和补充材料)(2016);其以引用方式整体并入本文。在一些实施方案中,Cas蛋白是C2c1、2类V-B型CRISPR-Cas蛋白。参见Yang等人,“PAM-Dependent TargetDNA Recognition and Cleavage by C2c1 CRISPR-Cas Endonuclease,”Cell,第167卷,第1814–1828页(2016);其以引用方式整体并入本文。在一些实施方案中,Cas蛋白是US20160319260“Engineered CRISPR-Cas9 nucleases with Altered PAM Specificity”中描述的一种,其以引用方式并入本文。
编码靶向序列的核酸酶的核酸应足够短以包含在病毒(例如,AAV)中。在一些实施方案中,靶向序列的核酸酶是来自金黄色葡萄球菌的Cas9(saCas9)。
在一些实施方案中,靶向序列的核酸酶与天然存在的靶向序列的核酸酶具有至少约80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%多肽序列同一性。
在一些实施方案中,靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)或RNA指导的核酸酶(例如,Cas9核酸酶)。
在一些实施方案中,所述病毒在细胞群中进一步转导编码一个或多个gRNA的核酸序列。gRNA不受限制,并且可以是本文所述的任何gRNA(例如,结合至目标遗传区域的gRNA,侧接目标遗传区域的2个gRNA)。在一些实施方案中,病毒转导单个gRNA。在一些实施方案中,病毒转导两个gRNA。
在一些实施方案中,所述方法还包括使受试者与第二病毒(例如,AAV)接触,所述第二病毒在细胞群中转导编码一个或多个gRNA的核酸序列。在一些实施方案中,第一病毒与第二病毒的比率为约1:3至约1:100,包括居间比率。例如,第一病毒与第二病毒的比率可为约1:5至约1:50,或约1:10,或约1:20。尽管不是优选的,但是比率可以是1:1或可存在更多的第二病毒。
在一些实施方案中,第二病毒编码侧接目标遗传区域的两个gRNA,或结合至目标遗传区域的一个gRNA。在一些实施方案中,本发明的方法还包括向受试者施用同源供体模板以使得能够在细胞群中进行治疗性基因替换。同源重组(HR)介导的修复(也称为同源定向修复(HDR))使用同源供体DNA作为模板来修复断裂。如果供体DNA的序列与基因组序列不同,则该过程导致将序列改变引入基因组中。
在另一个实施方案中,所述方法包括用于递送gRNA的单个AAV和第二种不同的Cas9递送系统。例如,Cas9(或Cpfl)递送可通过非病毒构建体例如“裸DNA”、“裸质粒DNA”、RNA和mRNA介导;结合各种递送组合物和纳米颗粒,包括例如胶束、脂质体、阳离子脂质-核酸组合物、多聚聚糖组合物和其他聚合物、基于脂质和/或胆固醇的核酸缀合物,以及如本文所述的其他构建体。参见,例如,X.Su等人,Mol.Pharmaceutics,201 1,8(3),第774-787页;网络发布于2011年3月21日;WO2013/182683、WO 2010/053572和WO 2012/170930,其均以引用方式并入本文。
在一些实施方案中,待修饰的细胞群是干细胞群。在一些实施方案中,待修饰的细胞群是组织干细胞群、功能性肌肉干细胞群、间充质祖细胞群、Sca-1
在一些实施方案中,本文所公开的方法还包括评定具有通过本文所公开的方法修饰的基因组的细胞的命运或功能。在一些实施方案中,评定了修饰细胞的细胞植入、自我更新和/或分化功能。在一些实施方案中,评定了修饰细胞的生肌、造血、成纤维、成脂和/或成骨能力。在一些实施方案中,细胞的形态、生长速率、生存力、代谢和/或转移潜能。
在一些实施方案中,本文所公开的方法和组合物治疗疾病或疾患或者降低疾病或疾患的可能性。本文所公开的方法设想治疗和/或预防与靶多核苷酸序列的表达相关的多种病症(即,疾病和疾患)。应当理解,本文所述的方法和组合物可用于治疗或预防与细胞中靶多核苷酸序列的表达增加、靶多核苷酸序列的表达减少或靶多核苷酸序列的表达缺失相关的病症。靶多核苷酸序列的表达增加和减少包括靶多核苷酸序列的表达水平分别增加或减少的情况,以及靶多核苷酸序列的表达产物的功能和/或活性水平与正常表达和/或活性水平相比有所增加或减少的情况。本领域技术人员将理解,可通过在使相关细胞与本文所述的组合物接触后,确定所述细胞中靶多核苷酸序列(或其表达产物)的水平和/或活性是否降低来评定对与靶多核苷酸序列表达增加相关的病症的治疗或预防。本领域技术人员还将理解,可通过在使相关细胞与本文所述的组合物接触后,确定所述细胞中靶多核苷酸序列(或其表达产物)的水平和/或活性是否增加来评定对与靶多核苷酸序列表达减少相关的病症的治疗或预防(例如,降低其可能性)。
在一些实施方案中,所述病症是遗传性病症。在一些实施方案中,所述病症是单基因病症。在一些实施方案中,所述病症是多基因病症。在一些实施方案中,所述病症是与一种或多种SNP相关的病症。与一种或多种SNP相关的示例性病症包括美国专利号7,627,436中所述的复杂疾病,PCT国际申请公布号WO/2009/112882中所述的阿尔兹海默病,美国专利申请公布号2011/0039918中所述的炎性疾病,如美国专利申请公布号2012/0309642中所述的多囊卵巢综合征,如美国专利申请号7,732,139中所述的心血管疾病,如美国专利申请公布号2012/0136039中所述的亨廷顿氏病,如欧洲专利申请公布号EP2535424中所述的血栓栓塞性疾病,如PCT国际申请公布号WO/2012/001613中所述的神经血管疾病,如美国专利申请公布号2010/0292211中所述的精神病,如美国专利申请公布号2011/0319288中所述的多发性硬化症,如PCT国际申请公布号WO/2006/023719A2中所述的精神分裂症、情感分裂性精神障碍和双相性精神障碍,如美国专利申请公布号U.S.2011/0104674中所述的双相性精神障碍和其他病痛,如PCT国际申请公布号WO/2006/104370A1中所述的结肠直肠癌,如美国专利申请公布号U.S.2006/0204969中所述的与AKT1基因座相邻的SNP相关的病症,如PCT国际申请公布号WO/2003/012143A1中所述的进食障碍,如美国专利申请公布号U.S.2007/0269827中所述的自身免疫性疾病,如美国专利号7,790,370中所述的克罗恩病患者中的纤维狭窄性疾病,和如美国专利号8,187,811中所述的帕金森氏病,所述申请各自以引用方式整体并入本文。根据本发明的方法可治疗或预防的与一种或多种SNP相关的其他病症对于本领域技术人员将是显而易见的。
在一些实施方案中,所述疾病或疾患涉及干细胞或组织干细胞。在一些实施方案中,可用修饰的功能性肌肉干细胞治疗所述疾病或疾患。修饰的功能性肌肉干细胞可用于治疗需要这种治疗的哺乳动物的肌肉疾病或病症,诸如肌营养不良。肌营养不良包括杜兴氏肌营养不良(DMD)、贝克尔肌营养不良(BMD)、强直性肌营养不良(也称为斯太纳特病(Steinert's disease))、肢带型肌营养不良、面肩肱型肌营养不良(FSH)、先天性肌营养不良、眼咽型肌营养不良(OPMD)、远端肌营养不良和埃-德二氏肌营养不良。
在一些实施方案中,本文所述的方法和组合物可用于治疗或预防缺血性疾病(例如,心肌梗塞、肢体缺血、中风、短暂性缺血、再灌注损伤)、神经病变(例如,糖尿病性周围神经病变、毒性神经病变)、肝衰竭、肾衰竭、糖尿病、骨骼和关节疾病或任何需要干细胞疗法的退行性疾病。
在一些实施方案中,本文所述的方法和组合物可用于治疗神经病变,包括原位修饰有需要的受试者的具有分化成内皮细胞的潜能的细胞(例如,多能干细胞、内皮祖细胞、间充质干细胞、单核细胞或其祖细胞或子代)的基因组,其中所述细胞增强目标神经组织中的血管生成。在一些实施方案中,本文所述的方法和组合物可用于治疗神经病变,包括原位修饰有需要的受试者的具有分化成内皮细胞的潜能的细胞(例如,多能干细胞、内皮祖细胞、间充质干细胞、单核细胞或其祖细胞或子代)的基因组,其中所述细胞位于目标神经组织的微脉管系统中,并增加血管生成、血管供应或神经组织的生物学功能。在另一个实施方案中,所述方法在有需要的受试者中提供具有原位修饰的基因组的具有分化成内皮细胞的潜能的细胞(例如,多能干细胞、内皮祖细胞、间充质干细胞、单核细胞或其祖细胞或子代),其中所述细胞增强神经组织中的体液应答,足以发挥治疗效应(例如,旁分泌因子、神经营养因子、血管生成因子的增加或血管生成的增加)。
在另一个实施方案中,本发明提供了治疗肝衰竭、肾衰竭或糖尿病的方法,所述方法包括原位修饰有需要的受试者的具有转分化成肝细胞、肾细胞或产胰岛素细胞(例如,胰岛细胞)的潜能的细胞的基因组,其中所述细胞修复或再生组织。
在一些实施方案中,可用骨骼肌中的修饰的间充质祖细胞治疗所述疾病或疾患。在一些实施方案中,可用皮肤组织中的修饰的真皮间充质细胞(CD140a+)治疗所述疾病或疾患。在一些实施方案中,所述疾病或疾患是脂肪营养不良(例如,先天性全身性脂肪营养不良(贝-赛二氏综合征(Beradinelli-Seip syndrome))、家族性局部脂肪营养不良、马凡尼-前列腺素-脂质营养不良综合征、CANDLE综合征、获得性局部脂肪营养不良(Barraquer-Simons综合征)、远心性腹部脂肪营养不良(婴儿腹部远心性脂肪营养不良)、环状脂肪萎缩(Ferreira-Marques脂肪萎缩)或与HIV相关的脂肪营养不良)。在一些实施方案中,基因组经原位修饰的细胞用于组织美容、组织修复或用于治疗脂肪相关病症。
如本文所用,“治疗”或“改善”在用于提及疾病、病症或医学疾患时,是指对疾患的治疗性治疗,其中目的是逆转、减轻、改善、抑制、减慢或停止症状或病状的进展或严重程度。术语“治疗”包括减轻或改善疾患的至少一种不利影响或症状。如果减轻一种或多种症状或临床标志,治疗通常是“有效的”。或者,如果疾患的进展减少或终止,则治疗是“有效的”。即,“治疗”不仅包括症状或标志的改善,还包括在没有治疗的情况下将预期的症状的进展或恶化的停止或至少减慢。有益的或期望的临床结果包括但不限于与没有治疗的情况下预期的相比,一种或多种症状的改善,缺陷程度的减轻,状态稳定(即,不恶化)。
给定病症或疾病治疗的功效可由熟练的临床医师确定。然而,如本文所使用的术语,如果在用本文所述的剂或组合物治疗后,病症的任何一种或全部体征或症状以有益的方式改变,其他临床可接受的症状改善或减轻了例如至少10%,则治疗被认为是“有效治疗”。功效也可以通过住院或需要医疗干预评定个体不再恶化(即,疾病进展停止)来测量。测量这些指标的方法是本领域技术人员已知的和/或在本文描述。
本公开的一些方面涉及一种用于在体内修饰受试者中的肌肉干细胞群的基因组的方法,所述方法包括使所述受试者与病毒接触,其中所述病毒将编码靶向序列的核酸酶的核酸序列转导至所述肌肉干细胞群中;以及用所述靶向序列的核酸酶修饰所述肌肉干细胞群的基因组,其中通过静脉内注射将所述病毒施用给所述受试者,并且其中所修饰的肌肉干细胞保留生肌能力。
AAV不受限制,并且可以是本文所述的任何AAV。在一些实施方案中,所述病毒是AAV8或Anc80L65。在一些实施方案中,所述肌肉干细胞群的至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或更多由所述病毒转导。在一些实施方案中,所述肌肉干细胞群的至少50%由所述病毒转导。
靶向序列的核酸酶不受限制,并且可以是本文所述的任何靶向序列的核酸酶。在一些实施方案中,靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、Cre重组酶或RNA指导的核酸酶。在一些实施方案中,靶向序列的核酸酶是Cas9核酸酶(例如,saCas9)。
在一些实施方案中,所述病毒在细胞群中进一步转导编码一个或多个gRNA的核酸序列。gRNA不受限制,并且可以是本文所述的任何gRNA。
在一些实施方案中,所述方法还包括使所述受试者与第二病毒接触,所述第二病毒在细胞群中转导编码一个或多个gRNA的核酸序列。第二病毒不受限制,并且可以是本文所述的任何病毒。
在一些实施方案中,所述修饰包括引入或校正突变。在一些实施方案中,所述修饰包括通过同源定向修复校正突变。在一些实施方案中,修饰治疗、改善或预防疾病(例如,本文所述的疾病)。
受试者不受限制,并且可以是本文所述的任何受试者。在一些实施方案中,所述受试者是人类。在一些实施方案中,所述受试者是小鼠。
本公开的一些方面涉及一种用于在体内修饰受试者中的间充质祖细胞群的基因组的方法,所述方法包括使所述受试者与病毒接触,其中所述病毒将编码靶向序列的核酸酶的核酸序列转导至所述间充质祖细胞群中;以及用所述靶向序列的核酸酶修饰所述间充质祖细胞群的基因组。
在一些实施方案中,所述间充质祖细胞是Sca-1
病毒不受限制,并且可以是本文所述的任何病毒。在一些实施方案中,所述病毒是AAV8、AAV9或Anc80L65。在一些实施方案中,所述间充质祖细胞群的至少11%由所述病毒转导。在一些实施方案中,所述间充质祖细胞群的至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更多由所述病毒转导。在一些实施方案中,所述间充质祖细胞群的至少20%由所述病毒转导。
靶向序列的核酸酶不受限制,并且可以是本文所述的任何核酸酶。在一些实施方案中,靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、Cre重组酶或RNA指导的核酸酶(Cas9核酸酶)。在一些实施方案中,靶向序列的核酸酶是Cas9核酸酶(saCas9)。
在一些实施方案中,所述方法还包括使所述受试者与第二病毒接触,所述第二病毒在细胞群中转导编码一个或多个gRNA的核酸序列。第二病毒不受限制,并且可以是本文所述的任何病毒。在一些实施方案中,所述修饰包括引入或校正突变。在一些实施方案中,所述修饰包括通过同源定向修复校正突变。在一些实施方案中,修饰治疗、改善或预防疾病(例如,本文所述的疾病)。
在一些实施方案中,通过局部注射或静脉内注射将所述病毒施用给所述受试者。在一些实施方案中,所述受试者是人类。受试者不受限制,并且可以是本文所述的任何受试者。在一些实施方案中,所述受试者是小鼠。
本公开的一些方面涉及一种用于在体内修饰受试者中的真皮间充质细胞群的基因组的方法,所述方法包括使所述受试者与病毒接触,其中所述病毒将编码靶向序列的核酸酶的核酸序列转导至所述真皮间充质细胞群中;以及用所述靶向序列的核酸酶修饰所述真皮间充质细胞群的基因组。
病毒不受限制,并且可以是本文所述的任何病毒。在一些实施方案中,所述病毒是AAV8。在一些实施方案中,所述靶向序列的核酸酶是锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、Cre重组酶或RNA指导的核酸酶(例如,Cas9核酸酶)。在一些实施方案中,靶向序列的核酸酶是saCas9核酸酶。
在一些实施方案中,所述方法还包括使所述受试者与第二病毒接触,所述第二病毒在细胞群中转导编码一个或多个gRNA的核酸序列。第二病毒不受限制,并且可以是本文所述的任何病毒。在一些实施方案中,所述修饰包括引入或校正突变。在一些实施方案中,所述修饰包括通过同源定向修复校正突变。在一些实施方案中,修饰治疗、改善或预防疾病(例如,本文所述的疾病)。受试者不受限制,并且可以是本文所述的任何受试者。在一些实施方案中,所述受试者是人类。在一些实施方案中,所述受试者是小鼠。
术语“降低”、“减少”、“减轻”“减小”和“抑制”在本文中通常全部用来意指相对于参照的统计学上显著的量的降低。然而,为了避免疑问,“减少”、“减小”或“降低”或“抑制”通常意指与参照水平相比至少10%的降低,并且可包括例如与参考水平相比至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%的降低,直至且包括例如给定实体或参数的完全不存在,或与不存在给定治疗的情况下相比10%至99%的任何降低。
术语“增加”、“增大”或“增强”或“激活”在本文中通常全部用来意指统计学上显著的量的增加;为了避免任何疑问,术语“增加”、“增大”或“增强”或“激活”意指与参考水平相比至少10%的增加,例如与参照水平相比至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%的增加,或高达并包括100%的增加或10%-100%之间的任何增加,或与参照水平相比至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍或至少约10倍的增加,或2倍与10倍之间的任何增加或更多增加。
如本文所用,术语“包含”或“包括”用于指代对方法或组合物必要的组合物、方法及其各自的组成部分,并且无论是否必要都仍然对未指定的要素保持开放。
术语“由……组成”是指如本文所述的组合物、方法及其各自的组成部分,不包括在实施方案的描述中未列举的任何要素。
如本文所用,术语“基本上由……组成”是指给定实施方案所需的那些要素。该术语允许存在实质上不影响该实施方案的基础和新颖或功能特征的要素。
术语“统计学上显著的”或“显著地”是指统计学显著性,并且通常意指大于0.05(由相关统计检验计算)的“p”值。本领域技术人员将容易意识到,任何特定实验的相关统计检验取决于所分析数据的类型。以下各段的文字中提供了其他定义。
细胞生物学和分子生物学中常用术语的定义可见于“The Merck Manual ofDiagnosis and Therapy”,第19版,Merck Research Laboratories出版,2006(ISBN 0-911910-19-0);RobertS.Porter等人(编),The Encyclopedia of Molecular Biology,Blackwell Science Ltd.出版,1994(ISBN 0-632-02182-9);The ELISA guidebook(Methods in molecular biology 149),Crowther J.R.(2000);Immunology,WernerLuttmann,Elsevier出版,2006。分子生物学中常用术语的定义也可见于Benjamin Lewin,Genes X,Jones&Bartlett Publishing出版,2009(ISBN-10:0763766321);Kendrew等人(编),Molecular Biology and Biotechnology:a Comprehensive Desk Reference,VCHPublishers,Inc.出版,1995(ISBN 1-56081-569-8)以及Cun-ent Protocols in ProteinSciences 2009,Wiley Intersciences,Coligan等人编。
除非另外说明,否则本发明是使用标准程序进行的,如例如Sambrook,MolecularCloning:A Laboratory Manual(第3版),Cold Spring Harbor Laboratory Press,ColdSpring Harbor,N.Y.,USA(2001)以及Davis等人,Basic Methods in Molecular Biology,Elsevier Science Publishing,Inc.,New York,USA(1995)所述,两者均以引用方式整体并入本文。
如本文所用,术语“蛋白质”和“多肽”可互换使用以表示通过相邻残基的α-氨基和羧基之间的肽键彼此相连的一系列氨基酸残基。术语“蛋白质”和“多肽”是指蛋白质氨基酸的聚合物,所述氨基酸包括修饰的氨基酸(例如,磷酸化的、糖化的、糖基化的等)和氨基酸类似物,无论其大小或功能如何。“蛋白质”和“多肽”通常用于指代相对较大的多肽,而术语“肽”通常用于指代较小的多肽,但是这些术语在本领域中的使用是重叠的。当提炼成基因产物及其片段时,术语“蛋白质”和“多肽”在本文中可互换使用。
因此,示例性多肽或蛋白质包括基因产物、天然存在的蛋白质、同系物、直系同源物、旁系同源物、片段以及前述各物的其他等效物、变体、片段和类似物。
***
对本公开的实施方案的描述并非旨在穷举或将本公开限于所公开的精确形式。尽管本文出于例示性目的描述了本公开的特定实施方案和实例,但是如相关领域的技术人员将认识到的,在本公开的范围内可进行各种等效修改。例如,虽然以给定顺序呈现方法步骤或功能,但是替代实施方案可以不同的顺序执行功能,或者可基本上并行地执行功能。本文所提供的本公开的教导内容可适当地应用于其他程序或方法。本文所述的各种实施方案可组合以提供其他实施方案。如果需要,可修改本公开的各方面以采用上述参考文献和申请的组成、功能和概念来提供本公开的另外的实施方案。可根据详细描述对本公开进行这些和其他改变。
前述任何实施方案的具体要素可组合或替代其他实施方案中的要素。此外,尽管已经在这些实施方案的上下文中描述了与本公开的某些实施方案相关联的优点,但是其他实施方案也可展现这样的优点,并且并非所有实施方案都需要展现这样的优点才能落入本公开的范围内。
出于描述和公开例如在所有已确定的专利和其他出版物中描述的可能与本发明结合使用的方法,将这些出版物以引用方式明确并入本文。这些出版物只提供其在本申请提交日期之前的公开内容。这方面的任何内容均不应解释为承认发明人由于先前发明或先前出版物或任何其他原因而无权先于所述公开内容。关于这些文件的日期或内容的所有陈述均基于申请人可获得的信息,并不构成对这些文件的日期或内容的正确性的承认。
本领域技术人员很容易意识到,本发明非常适合于实现这些目标并获得所提及的目的和优点以及其中固有的目的和优点。本文的说明和实例的细节代表某些实施方案,是示例性的,并且不意在限制本发明的范围。本领域技术人员将想到其中的修改和其他用途。这些修改涵盖在本发明的精神内。对于本领域技术人员而言显而易见的是,在不脱离本发明的范围和精神的情况下,可对本文所公开的发明进行各种取代和修改。
除非另外相反地指明,否则在说明书和权利要求书中使用的冠词“一个”和“一种”应理解为包括复数指示物。除非相反地指明或者从上下文中显而易见,否则如果在给定的产物或过程中存在、采用或以其他方式涉及组成员中的一个、超过一个或全部,则包括“或”在一个或多个组成员之间的主张或描述得到满足。本发明包括其中给定产物或过程中存在、采用或与其他方式涉及组中的确切一个成员的实施方案。本发明还包括其中给定产物或过程中存在、采用或与其他方式涉及组成员中的超过一个或全部的实施方案。此外,应当理解,本发明提供了所有变型、组合和排列,其中将来自所列权利要求中的一个或多个的一个或多个限制、要素、子句、描述性术语等引入从属于同一基础权利要求的另一权利要求(或相关的任何其他权利要求)中,除非另外指明或除非本领域普通技术人员明白会出现矛盾或不一致。预期在适当的情况下,本文所述的所有实施方案可应用于本发明的所有不同方面。还预期在适当的情况下,任一所述实施方案或方面可与一个或多个其他此类实施方案或方面自由地组合。在以列表形式例如以马库什(Markush)组或类似格式呈现要素的情况下,应当理解还公开了所述要素的每个子组,并且可从该组中除去任何一个或多个要素。应当理解,一般来讲,当本发明或本发明的方面被称为包括特定要素、特征等时,本发明或本发明的方面的某些实施方案由此类要素、特征等组成或基本上由此类要素、特征等组成。为了简单起见,在本文中没有在每种情况下都用这么多的词语具体阐述那些实施方案。还应当理解,本发明的任何实施方案或方面都可被明确地排除在权利要求书之外,无论说明书中是否叙述了所述具体排除。例如,可排除任何一种或多种活性剂、添加剂、成分、任选剂、生物体类型、病症、受试者或它们的组合。
在权利要求书或说明书涉及物质组合物的情况下,应当理解根据本文所公开的任何方法制造或使用所述物质组合物的方法以及出于本文所公开的任何目的使用所述物质组合物的方法是本发明的方面,除非另外指明或除非本领域普通技术人员明白会出现矛盾或不一致。在权利要求书或说明书涉及方法的情况下,例如应当理解制造可用于执行所述方法的组合物的方法以及根据所述方法生产的产物是本发明的方面,除非另外指明或除非本领域普通技术人员明白会出现矛盾或不一致。
在本文中给出范围的情况下,本发明包括其中包括端点的实施方案,其中两个端点均被排除的实施方案以及其中一个端点被包括而另一端点被排除的实施方案。除非另外指明,否则应假定包括两个端点。此外,应当理解,除非另外指明或从上下文和本领域普通技术人员的理解中显而易见,否则在本发明的不同实施方案中,表示为范围的值可假定为所述范围内的任何具体值或子范围,精确到该范围的下限单位的十分位一,除非上下文另外明确规定。还应当理解,在本文中陈述一系列数值的情况下,本发明包括与由该系列中的任何两个值限定的任何居间值或范围类似地相关的实施方案,并且最低值可被视为最小,并且最大值可视为最大。如本文所用,数值包括以百分比表示的值。对于其中数值以“约”或“大约”开头的本发明的任何实施方案,本发明包括其中叙述了精确值的实施方案。对于其中数值不以“约”或“大约”开头的本发明的任何实施方案,本发明包括其中数值以“约”或“大约”开头的实施方案。
“大约”或“约”通常包括在任一方向落入数字的1%的范围或在某些实施方案中落入数字的5%的范围或在某些实施方案中落入数字的10%的范围内(大于或小于该数)的数,除非另外说明或者从上下文中显而易见(当这样的数字不被许可地超过可能值的100%时除外)。应当理解,除非另外明确相反地指明,否则在本文中要求保护的包括超过一个动作的任何方法中,所述方法的动作的顺序不必限于列举所述方法的动作的顺序,但是本发明包括顺序被如此限制的实施方案。还应当理解,除非另外指明或者从上下文中显而易见,否则本文所述的任何产物或组合物都可被视为“分离的”。
实施例:
实施例1
基因组修饰酶的体内递送对于治疗应用和功能基因筛选具有重要的前景。在这种情况下,特别令人关注的是向内源性组织干细胞的递送,所述内源性组织干细胞在稳态中提供了持久的细胞替换来源,并响应了再生线索。在这里,由Cre重组酶激活的敏感的荧光报告系统被用来测试内源性组织干细胞中腺相关病毒(AAV)体内转导后基因组修饰的效率。我们将免疫表型分析与稳健的体外和体内干细胞功能测定相结合,以揭示使用多种AAV血清型对组织定位的骨骼肌卫星细胞、间充质祖细胞和造血干细胞的有效靶向。通过这种方法实现的基因组修饰率高达65%,并且修饰的细胞保留了关键的功能特性。这项研究建立了一种强大的新平台,所述新平台可在组织干细胞的生理生态位内遗传改变组织干细胞,同时保留其天然干细胞特性和调控相互作用。
如本文所述,研究全身AAV施用是否可转导成年动物的卫星细胞,以及是否可将此方法扩展到其他AAV血清型以及不同的组织干细胞和祖细胞群。发现在体内全身递送AAV-Cre后成年小鼠卫星细胞的有效转导,达到总卫星细胞池的>60%,是我们之前在新生小鼠中进行的研究的6倍(Tabebordbar等人,2016)。这种转导能力不限于AAV9,还可扩展到其他AAV血清型,包括AAV8和Anc80L65(在下文中称为Anc80)。本文还公开了对多种非生肌干细胞和祖细胞,包括骨骼肌和真皮中的间充质祖细胞,以及骨髓中的造血干细胞和祖细胞的转导和基因组修饰。后续分离、分化和移植研究证实,靶向组织干细胞在原位AAV转导和基因组修饰后保留了其再生功能。总的来说,这些研究证明了在成年哺乳动物中使用AAV递送对跨多个解剖生态位的干细胞和祖细胞的不同谱系的有效体内基因组修饰。该系统实现了出于治疗目的在组织驻留肝细胞中进行的体内基因激活、破坏和编辑策略,以及诱导或灭活转基因或内源性等位基因从而揭示干细胞和祖细胞在其天然生态位内的新颖分子调节剂的方法。
结果
先前已证明了通过AAV9介导的基因组修饰酶的递送在骨骼肌干细胞(卫星细胞)中进行体内基因修饰的可行性(Tabebordbar等人,2016)。在该研究中,观察到成年小鼠肌内递送AAV9-Cre后卫星细胞的大量转导(34%-37%),但静脉内注射后未测量到成年卫星细胞的转导率(Tabebordbar等人,2016)。
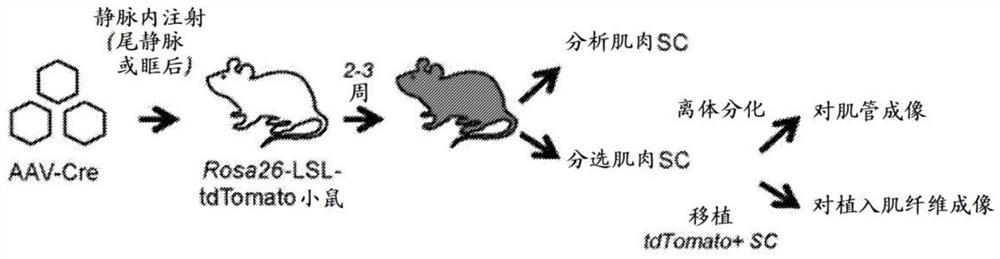
在此,制备编码CMV启动子下游的Cre重组酶的AAV颗粒(AAV-Cre)和封装有血清型8、9或Anc80的嵌合内含子(Zinn等人,2015),将它们静脉注射到年轻成年(6周龄)Ai9小鼠(以mdx背景:mdx;Ai9小鼠,图1A)。Ai9等位基因编码Rosa26-Lox-Stop-Lox-tdTomato报告子,其使得能够在Cre介导的Stop盒切除后,以tdTomato荧光对靶向细胞进行不可逆标记,所述荧光可通过单细胞分辨率检测到(Madisen等人,2010)。通过尾静脉或眶后窦以两种剂量(每只小鼠5.5-8x10
在所有注射AAV-Cre的动物(N=24只小鼠)中以8%-62%范围内的频率检测到tdTomato
接下来研究体内AAV转导和基因组修饰的卫星细胞是否保持其生肌能力(图1A)。从注射AAV-Cre的小鼠的肌肉中分选出的卫星细胞在离体培养时仍保留增殖、分化和融合形成表达tdTomato
除卫星细胞区室之外,还在以下细胞中中检测到tdTomato
表S1.全身注射AAV-Cre后,肌肉和血液中tdTomato
最后,评定使用AAV-Cre靶向肌肉祖细胞的局部递送方法。在这些研究中,使用携带Pax7-ZsGreen等位基因的mdx;Ai9动物转基因标记肌肉卫星细胞(图6A)(Arpke等人,2013;Bosnakovski等人,2008;Maesner等人,2016)。使用血清型1、8或9将6x10
为了确定全身AAV施用是否可类似地靶向其他解剖生态位中的其他干细胞群,还分析了从静脉内注射编码Cre重组酶的AAV8、AAV9或Anc80的小鼠收获的骨髓细胞(图3A)。在免疫表型鉴定的造血干细胞(HSC;定义为Lin
除HSC之外,还研究了全身递送的AAV-Cre对骨髓中更定型的造血前体的靶向。在髓系祖细胞的多个亚群中检测到tdTomato荧光,包括普通髓系祖细胞(CMP;Lin
要确定通过免疫表型检测到的体内转导的tdTomato
接下来进行来自先前植入的初级接受者小鼠的子组的骨髓细胞的二次移植(图3A)。对次级接受者内供体嵌合性水平的分析揭示了外周血细胞中大约20%-80%的范围(图4A)。在这些次级接受者中,大多数在移植后16周显示出tdTomato
表S2.
局部注射AAV-Cre后tdTomato
总之,这些数据提供了有力的证据,表明对编码序列特异性DNA修饰酶的多种AAV血清型中的任一种进行局部或全身注射可允许转导内源性骨髓干细胞和祖细胞的多个亚群,包括最原始的长期重构的HSC。这种策略可实现不可逆的基因组修饰,如在移植测定中所测定的,这种修饰可通过多轮造血再生驻留在其天然生态位中的长期重构HSC来维持。
最后,为了将分析范围扩展到骨骼肌和造血组织之外,从注射高剂量AAV8-Cre的动物的子组收集皮肤组织并评估了全身递送AAV是否也可转导这种明确定义的解剖区室内的离散前体细胞群。如骨髓分析所预期的,还观察到位于皮肤中的造血细胞内的tdTomato荧光(CD45
论述
在这项研究中,记录了通过AAV有效递送DNA修饰酶以实现体内组织干细胞群内的永久基因组修饰。这种高度可编程的方法证明了在三个不同的解剖生态位(骨骼肌、皮肤和骨髓)中的干细胞/祖细胞的四个不同谱系(生肌细胞、造血细胞、纤维/成脂细胞和成骨细胞)中的有效性,并且极有可能被推广至其他DNA修饰酶,包括基于CRISPR/Cas的系统(Tabebordbar等人,2016),以及其他器官系统和物种中的其他肝细胞/祖细胞群。
这种方法的独特优势在于,它允许原位操纵干细胞基因组,而无需进行细胞分离、培养或后续移植,从而保留了天然的调控相互作用和现有的干细胞特性。这种系统还减轻了与离体干细胞修饰和后续移植相关的挑战和毒性,例如体外条件无法维持稳健的干细胞功能,必需使用去髓性预处理,以及移植失败风险不可避免(Morgan等人,2017)。预期的是,利用DNA修饰酶直接转导内源性组织干细胞的机会将与当前正在进行的旨在于干细胞中进行治疗性基因编辑的学术和商业努力有着直接和特定的联系,至此,所有这些都已被考虑在内,有必要纯化干细胞以进行离体修饰和再输注(Morgan等人,2017)。
这项工作的关键发现是AAV可在体内有效转导多种成年组织干细胞和祖细胞类型。这些结果在一定程度上与先前的报告相反,后者认为AAV在局部或全身施用后不能有效地转导成年动物的骨骼肌卫星细胞(Arnett等人,2014;Chamberlain和Chamberlain,2017;Chang等人,2016)。在先前研究中的一项研究中(Arnett等人,2014),将编码CMV驱动的eGFP的AAV6全身施用到四周龄的小鼠体内,注射后四周未导致可检测的Pax7
除了靶向肌肉卫星细胞和HSC之外,AAV还在体内转导间充质祖细胞,这些发现对这些细胞群具有重要的潜在应用。间充质祖细胞是公认的肌生成调节剂(Joe等人,2010),是衰老和肌肉疾病中纤维化和脂肪沉积的主要来源(Joe等人,2010;Lounev等人,2009;Uezumi等人,2014;Uezumi等人,2010)。因此,这些细胞是抗纤维化干预或将促进其促生肌活性的操作的潜在靶标。此外,当前对于控制这些细胞的作用的机制(包括其增殖、分化的调节剂或对肌肉的营养支持作用)知之甚少,因此预期靶向这种细胞群可能有助于揭示这样的机制,以及增进我们对肌肉维持和再生的了解。这继而可导致减轻这些细胞的有害影响并促进其促生肌活性的治疗性干预。鉴于已经有大量研究出于此类目的利用Cre模型来操纵这些细胞中基因的表达(Heredia等人,2013;Kopinke等人,2017;Lees-Shepard等人,2018;Roberts等人,2013),预期这种系统将为基因操作提供替代的且在一些情况下更简便的系统。
本文所述的体内AAV系统克服了与当前用于研究干细胞功能的实验系统相关的关键技术和实践限制。特别地,常用的基于转基因和基因敲除的模型经常需要复杂的繁育方案来引入多个等位基因,这需要大量的时间和资源投入。当评定老年动物中、非标准遗传背景下或组合方式的基因靶向效果时,此类方法变得更具挑战性。相比之下,AAV介导的可编程的DNA修饰酶递送可应用于一系列动物年龄和品系以及各种单独的和多重的基因座。此外,此处使用的AAV-Cre策略为他莫昔芬诱导型Cre-(CreER)依赖性基因激活/灭活策略提供了替代和补充方法,使得研究人员能够绕开激素施用的潜在混杂效应(Patel等人,2017)。因此,这项技术可能在加速体内和组织祖细胞中基因功能和相互作用可被询问的速度方面有重要的应用。本文显示的结果还指示,多种AAV血清型对组织干细胞和祖细胞展现趋向性,为将来开发更具特异性和选择性的系统奠定了基础,包括鉴定可转导特定干细胞群的AAV衣壳变体和将AAV编码基因的表达仅限于这些细胞类型的天然存在的或合成的基因调控元件。最终,这种系统可能适用于使得能够对可能特异性地影响干细胞表型的候选和未知基因靶标进行快速的且直接的体内筛查。
STAR方法
关键资源表
实验模型和受试者细节
小鼠
将小鼠安放在哈佛大学/文理学院生物研究基础设施的动物设施中,所述设施获得了实验室动物护理评估和认可协会(AALAC)的认可。所有程序均按照机构动物护理和使用委员会(IACUC)批准的协议进行。将小鼠以每笼5只小鼠的最大密度安放在标准通风架中。室温保持在22℃±1℃,湿度为30%-70%。将小鼠保持在12小时光照/黑暗周期中,并随意提供食物和水。将繁育小鼠保持照射的PicoLab小鼠饮食20 5058(LabDiet,St.Louis,MO),将非繁育小鼠保持照射的LabDiet Prolab Isopro RMH 3000 5P75(LabDiet,St.Louis,MO)。笼子中装有1/4英寸Anderson Bed o Cob床上用品(The Andersons,Inc.,Maumee,OH),并且每个笼子都含有一个筑巢(2x2英寸方形压缩棉,Ancare,Bellmore,NY)和一个红色小鼠棚(经过认证的聚碳酸酯;3
将C57BL/10ScSn-Dmd
对于股内注射实验,向6-9个月大的雄性和雌性Ai9纯合动物注射AAV-Cre或媒介物。注射后6周,对小鼠实施安乐死并分离造血细胞用于流式细胞术分析和FACS。对于全身注射实验,向6周龄的雄性mdx;Ai9纯合小鼠通过尾静脉或眶后注射注射AAV-Cre或媒介物。注射后2周,收获小鼠并收集肝、骨骼肌和造血细胞用于分析。由熟练的小鼠病理学家(R.Bronson)以盲目方式对来自注射AAV-Cre和对照的动物的子组的苏木精和曙红染色的肝组织切片的组织病理学评定未显示出组织病理学的迹象(图10B)。
对于造血细胞移植实验,收集来自纯合CD45.1小鼠的骨髓细胞,并耗竭Sca-1以用于辅助骨髓。将纯合CD45.1小鼠用作初级和次级造血干细胞和祖细胞(HSPC)移植的接受者。HSPC移植后,使接受者动物保持含有0.67mg/mL磺胺嘧啶甲氧苄啶的抗生素水持续4周。
方法细节
AAV选择和生产
使用多种AAV血清型,特别强调具有广泛生物分布的血清型(Zincarelli等人,2008)。对于股内注射实验,我们评估了一组7种AAV血清型(1、2、5、6、8、9和10),并确定了以最高效率靶向HSC的那些。较小的一组3种AAV血清型(1、8、9)用于肌内注射实验。我们并未在全身注射实验中采用AAV1,因为已知它会比其他AAV血清型引起更大的炎症反应(Lu和Song,2009),这可能会限制其在临床前测试或疾病模型化应用中的有效性。用于全身注射实验的AAV血清型的选择是基于我们以前的作品,即AAV9在体内有效转导肌肉卫星细胞(Tabebordbar等人,2016)。对于我们的初步分析(表S1),我们通过尾静脉注射施用AAV9以及另外两种血清型:AAV6和AAV8,这两种血清型均已显示在体内递送后靶向骨骼肌(Blankinship等人,2004;Wang等人,2005)。基于这些结果,我们接下来经由尾静脉全身施用AAV8和AAV9,并且还包括Anc80L65(一种祖先AAV,对骨骼肌和其他器官具有强烈的趋向性)(Zinn等人,2015),以在CMV启动子和嵌合内含子下游表达Cre重组酶。对于全身眶后AAV施用,我们特别聚焦于Anc80和AAV8,它们在尾静脉注射实验中对血液和肌肉干细胞的靶向效率更高。此外,我们包括了两种AAV8剂量,以评定注射更高浓度的AAV是否导致更大的转导效率。
对于使用AAV8、AAV9和Anc80L65进行的全身注射实验,如先前所述由Schepens眼科学研究所和马萨诸塞州眼耳医院(Grousbeck Gene Therapy Center at the SchepensEye Research Institute and Massachusetts Eye and Ear Infirmary,SER/MEEI)的Grousbeck基因治疗中心的基因转移矢量核心(Gene Transfer Vector Core,GTVC)进行AAV生产(Lock等人,2010;Zinn等人,2015)。对于使用AAV血清型1、2、5、6、8、9和10的股内注射实验,在宾夕法尼亚大学宾夕法尼亚矢量中心(University of Pennsylvania PennVector Core)生产AAV。对于使用AAV6、AAV8和AAV9的全身注射实验,由UMASS医学院矢量核心完成AAV生产。
肌肉干细胞分离和体外分化
如先前所述(Cerletti等人,2008;Sherwood等人,2004),从全身注射AAV-Cre的mdx;Ai9小鼠分离肌肉干细胞。简而言之,用胶原酶和分散酶消化胫骨前肌(TA)、腓肠肌、肱三头肌、股四头肌和腹肌,并通过离心分离与肌纤维相关的细胞。将细胞用抗体混合物(APC-Cy7抗CD45(1:200)、APC-Cy7抗CD11b(1:200)、APC-Cy7抗TER119(1:200)、APC抗Sca-1(1:200)、FITC抗CD29(β1-整联蛋白)(1:100)、生物素抗CD184(CXCR4)(1:100))在冰上染色30分钟,随后用链霉亲和素-PE-Cy7(1:100)在冰上进行二次染色持续15分钟。碘化丙锭(PI)和钙黄绿素蓝分别用于区分死细胞和活细胞。通过FACS将CD45
如先前所述(Tabebordbar等人,2016)从mdx;Pax7-ZsGreen
肌肉Sca-1
如先前所述(Hettmer等人,2011;Schulz等人,2011;Tan等人,2011)从全身注射AAV-Cre的mdx;Ai9小鼠分离Sca-1
肌肉卫星细胞移植
移植前一天,将25μL的10μM来自红颈喷毒眼镜蛇的心脏毒素γ注射到经麻醉的7-8周龄雄性mdx接受者小鼠的胫骨前肌(TA)。将多达50,000个单分选的tdTomato
免疫荧光
为了对体外分化的肌管进行肌球蛋白重链(MHC)染色,在室温下使用0.5%TritonX-100将肌管透化15分钟,用DPBS洗涤2x5分钟,并用5%正常山羊血清、2%BSA、2%浓缩蛋白(来自M.O.M.
为了将骨骼肌组织染色,将胫骨前肌(TA)切开并立即在室温下在1%PFA中固定一小时,用DPBS洗涤,并在30%蔗糖中在4℃下低温保存过夜。接着将组织包埋在O.C.T.化合物中,在过冷的异戊烷中低温保存,然后使用Leica CM1860低温恒温器(LeicaBiosystems)进行切片。将切片在2%PFA中后固定5分钟,在0.1M甘氨酸缓冲液中孵育5分钟,并在0.3%Triton X-100/DPBS中透化20分钟。将切片用10%M.O.M.IgG封闭剂封闭,并用1%M.O.M.IgG封闭剂、3%BSA、8%M.O.M浓缩蛋白和5%正常山羊血清进一步封闭。使用抗Pax7(15μg/mL)和兔抗层粘连蛋白(1:200)在4℃下过夜进行一抗染色。第二天,将切片洗涤并用山羊抗小鼠IgG1 Alexa Fluor 488(1:250)和山羊抗兔IgG H+L Alexa Fluor 647(1:250)染色。用含有DAPI的Vectashield HardSet抗荧光淬灭封片剂固定载玻片,并使用Zeiss LSM 880倒置共聚焦显微镜捕获图像。为了通过免疫荧光分析定量Pax7
为了对皮肤组织进行染色,在室温下使用4%PFA将背部皮肤样品固定15分钟,用PBS充分洗涤,在4℃下浸入30%蔗糖中过夜,并包埋在O.C.T(Sakura Finetek)中。将30μM切片封闭1-2小时(5%驴血清、1%BSA、2%冷水鱼明胶,溶于含0.3%Triton的PBS中),与抗CD140a(1:200)和抗RFP(1:1000)抗体在4℃下孵育过夜,并与驴抗山羊IgG Alexa 488(1:400)或驴抗兔Cy3(1:400)二抗在室温下孵育2-4小时。DAPI用于复染。
RNA分离、cDNA合成和实时PCR
将卫星细胞直接分选到Trizol LS中,并储存在-80℃下。根据制造商的说明分离总RNA。使用SuperScript IV VILO预混合物与ezDNase酶试剂盒合成cDNA。在QuantStudio6Flex实时PCR系统上进行定量PCR。使用以下TaqMan测定评估相对基因表达:Pax7(Mm01354484_m1)、Myf5(Mm00435125_m1)、Myod1(Mm00440387_m1)、Myog(Mm00446194_m1)和Gapdh(Mm99999915_g1)。
HSPC分离和流式细胞术分析/FACS
用21号针头从所有4个长骨(2个股骨和2个胫骨)冲洗骨髓细胞至染色培养基(含有2%FBS的HBSS)中,重悬,并通过40μm细胞滤网过滤。沉淀细胞并在冰上进行ACK裂解5分钟(分析类红细胞前体细胞时除外),通过40μm滤网重新过滤,并用染色培养基洗涤。
为了鉴定来自注射AAV的小鼠的HSC,在冰上用以下抗体将细胞染色45分钟:CD3-ef450或CD3-生物素(1:100)、B220-ef450或B220-生物素(1:200)、Ter119-ef40或Ter119-生物素(1:100)、Gr-1-ef450或Gr-1-生物素(1:400)、CD11b-APCCy7(1:200)、c-Kit-APC(1:200)、Sca-1-PECy7(1:200)、CD48-FITC(1:200)和CD150-BV510(1:50)。当使用生物素化抗体时,将细胞洗涤并与链霉亲和素-ef450(1:200)在冰上孵育30分钟。
为了鉴定来自移植的小鼠的HSC,在冰上用以下抗体将细胞染色45分钟:谱系Cocktail-Pacific Blue(1:20)、c-Kit-APC(1:200)、Sca-1-PECy7(1:200)、CD48-FITC(1:200)、CD150-BV510(1:50)和CD45.2-AF700(1:100)。
为了鉴定来自注射AAV的小鼠的髓系祖细胞,在冰上用以下抗体将细胞染色60分钟:CD3-ef450或CD3-生物素(1:100)、B220-ef450或B220-生物素(1:200)、Ter119-ef40或Ter119-生物素(1:100)、Gr-1-ef450或Gr-1-生物素(1:400)、CD11b-APCCy7(1:200)、c-Kit-APC(1:200)、Sca-1-PECy7(1:200)、CD34-FITC(1:25)和CD16/CD32-AF700(1:100)。对于生物素化抗体,将细胞洗涤并与链霉亲和素-ef450(1:200)在冰上孵育30分钟。
为了鉴定来自注射AAV的小鼠的红细胞前体细胞,在冰上用以下抗体将细胞染色30分钟:CD71-FITC(1:200)和Ter119-APC(1:200)。对于所有HSPC染色组,将细胞在抗体/链霉亲和素孵育后洗涤,并重悬于染色培养基中,并添加Sytox Blue(1:1,000),之后立即进行FACS以标记死细胞。在BD LSR II流式细胞仪上分析细胞,并在BD FACS Aria II上进行分选。使用BD FACS Diva和FlowJo软件进行数据分析。
HSPC移植
对于每只动物,将Lin
通过在冰上用Sca-1-APC(1:200)将ACK裂解的CD45.1骨髓细胞染色10分钟,洗涤并与抗APC微珠在冰上孵育20分钟来进行Sca-1耗竭。将细胞洗涤并使用AutoMACS分离器(Depletes程序)进行耗竭。通过流式细胞术分析确认耗竭效率。将7-AAD(1:20)用作生存力染料并将其添加到细胞中,之后立即进行分析。
外周血收集和流式细胞术分析
在移植后第4、8、12和16周,根据初级和次级移植接受者的外周血样品进行供体嵌合性和tdTomato分析。通过尾静脉将外周血收集到含有100μL PBS/10mM EDTA的1.5mL试管中,并储存在冰上。向样品中添加1mL 2%葡聚糖/PBS,混合并在37℃下孵育30分钟以沉降红细胞。洗涤剩余的细胞,并使其在冰上经历ACK裂解5分钟。洗涤细胞,通过40μm细胞滤网过滤,并在冰上重悬于含有抗CD16/CD32(1:50)的HBSS/2%FBS/10mM EDTA中持续5分钟。在冰上用以下抗体将细胞染色30分钟:CD3-PECy7(1:65)、B220-FITC(1:100)、CD11b-APC-Cy7(1:200)、Gr-1-生物素(1:400)、CD45.1-Pacific Blue(1:100)和CD45.2-APC(1:100)。洗涤细胞,并在冰上用链霉亲和素-Pacific Orange(1:500)染色30分钟。洗涤细胞,重悬于HBSS/2%FBS/10mM EDTA中,并添加7-AAD(1:20),之后立即进行分析。在BD LSR II流式细胞仪上分析细胞,并使用BD FACS Diva和FlowJo软件进行数据分析。
肝组织学
收获肝组织,并将其在4%低聚甲醛中固定大约24小时,接着转移到70%乙醇中。将样品送入位于Dana-Farber/哈佛癌症中心的啮齿动物组织病理学核心,用石蜡包埋,切片并用苏木精和曙红染色。由啮齿动物组织病理学家以盲方式法对载玻片进行分析并对其组织病理学评分。
皮肤细胞分离和流式细胞术分析
切开小鼠背部皮肤。将切开的皮肤(真皮朝下)在含0.25%胶原酶的HBSS中于37℃下孵育40-60分钟。然后使用手术刀刮除真皮。将收集的细胞在4℃下以350xg离心8分钟。通过与胰蛋白酶-EDTA在37℃下孵育10分钟并通过70μM和40μM过滤器过滤,获得单细胞悬浮液。然后将单细胞悬浮液在4℃下以350xg离心8分钟,重悬于含5%FBS的PBS中,并染色30分钟。使用了以下抗体:CD45-ef450(1:250)、CD140a-生物素(1:250)、链霉亲和素-APC(1:500)、CD24-FITC(1:200)和Sca-1-PerCPCy5.5(1:1000)。DAPI用于排除死细胞。将血液谱系细胞门控为CD45
定量和统计分析
使用GraphPad Prism软件来执行统计分析。对于实时PCR分析,使用配对t检验来计算两组之间的统计学显著性。重复测量ANOVA用于供体嵌合性的纵向分析。p值<0.05的结果被认为具有统计学显著性。图例中报告了有关复制品的信息。
参考文献
Amoasii,L.,Hildyard,J.C.W.,Li,H.,Sanchez-Ortiz,E.,Mireault,A.,Caballero,D.,Harron,R.,Stathopoulou,T.R.,Massey,C.,Shelton,J.M.,et al.(2018).Gene editing restores dystrophin expression in a canine model of Duchennemuscular dystrophy.Science 362,86-91.
Arnett,A.L.,Konieczny,P.,Ramos,J.N.,Hall,J.,Odom,G.,Yablonka-Reuveni,Z.,Chamberlain,J.R.,and Chamberlain,J.S.(2014).Adeno-associated viral(AAV)vectors do not efficiently target muscle satellite cells.Mol Ther MethodsClin Dev 1.
Arpke,R.W.,Darabi,R.,Mader,T.L.,Zhang,Y.,Toyama,A.,Lonetree,C.L.,Nash,N.,Lowe,D.A.,Perlingeiro,R.C.,and Kyba,M.(2013).A new immuno-,dystrophin-deficient model,the NSG-mdx(4Cv)mouse,provides evidence forfunctional improvement following allogeneic satellite celltransplantation.Stem Cells 31,1611-1620.
Bengtsson,N.E.,Hall,J.K.,Odom,G.L.,Phelps,M.P.,Andrus,C.R.,Hawkins,R.D.,Hauschka,S.D.,Chamberlain,J.R.,and Chamberlain,J.S.(2017).Muscle-specific CRISPR/Cas9 dystrophin gene editing ameliorates pathophysiology in amouse model for Duchenne muscular dystrophy.Nat Commun 8,14454.
Blankinship,M.J.,Gregorevic,P.,Allen,J.M.,Harper,S.Q.,Harper,H.,Halbert,C.L.,Miller,A.D.,Miller,D.A.,and Chamberlain,J.S.(2004).Efficienttransduction of skeletal muscle using vectors based on adeno-associated virusserotype 6.Mol Ther 10,671-678.
Bosnakovski,D.,Xu,Z.,Li,W.,Thet,S.,Cleaver,O.,Perlingeiro,R.C.,andKyba,M.(2008).Prospective isolation of skeletal muscle stem cells with a Pax7reporter.Stem Cells 26,3194-3204.
Busch,K.,Klapproth,K.,Barile,M.,Flossdorf,M.,Holland-Letz,T.,Schlenner,S.M.,Reth,M.,
Cerleti,M.,Jurga,S.,Witczak,C.A.,Hirshman,M.F.,Shadrach,J.L.,Goodyear,L.J.,and Wagers,A.J.(2008).Highly efficient,functional engraftmentof skeletal muscle stem cells in dystrophic muscles.Cell 134,37-47.
Chamberlain,J.R.,and Chamberlain,J.S.(2017).Progress toward GeneTherapy for Duchenne Muscular Dystrophy.Mol Ther 25,1125-1131.
Chang,N.C.,Chevalier,F.P.,and Rudnicki,M.A.(2016).Satellite Cells inMuscular Dystrophy-Lost in Polarity.Trends Mol Med 22,479-496.
Colella,P.,Ronzitti,G.,and Mingozzi,F.(2018).Emerging Issues in AAV-Mediated.Mol Ther Methods Clin Dev 8,87-104.
Collins,C.A.,Kretzschmar,K.,and Watt,F.M.(2011).Reprogramming adultdermis to a neonatal state through epidermal activation ofβ-catenin.Development 138,5189-5199.
Driskell,R.R.,Jahoda,C.A.,Chuong,C.M.,Watt,F.M.,and Horsley,V.(2014).Defining dermal adipose tissue.Exp Dermatol 23,629-631.
Filareto,A.,Rinaldi,F.,Arpke,R.W.,Darabi,R.,Belanto,J.J.,Toso,E.A.,Miller,A.Z.,Ervasti,J.M.,McIvor,R.S.,Kyba,M.,et al.(2015).Pax3-inducedexpansion enables the genetic correction of dystrophic satellite cells.SkeletMuscle5,36.
Heredia,J.E.,Mukundan,L.,Chen,F.M.,Mueller,A.A.,Deo,R.C.,Locksley,R.M.,Rando,T.A.,and Chawla,A.(2013).Type2innate signals stimulate fibro/adipogenic progenitors to facilitate muscle regeneration.Cell 153,376-388.
Hettmer,S.,Liu,J.,Miller,C.M.,Lindsay,M.C.,Sparks,C.A.,Guertin,D.A.,Bronson,R.T.,Langenau,D.M.,and Wagers,A.J.(2011).Sarcomas induced in discretesubsets of prospectively isolated skeletal muscle cells.Proc Natl Acad Sci US A108,20002-20007.
Hinderer,C.,Katz,N.,Buza,E.L.,Dyer,C.,Goode,T.,Bell,P.,Richman,L.K.,and Wilson,J.M.(2018).Severe Toxicity in Nonhuman Primates and PigletsFollowing High-Dose Intravenous Administration of an Adeno-Associated VirusVector Expressing Human SMN.Hum Gene Ther 29,285-298.
Joe,A.W.,Yi,L.,Natarajan,A.,Le Grand,F.,So,L.,Wang,J.,Rudnicki,M.A.,and Rossi,F.M.(2010).Muscle injury activates resident fibro/adipogenicprogenitors that facilitate myogenesis.Nat Cell Biol 12,153-163.
Kiel,M.J.,Yilmaz,O.H.,Iwashita,T.,Terhorst,C.,and Morrison,S.J.(2005).SLAM family receptors distinguish hematopoietic stem and progenitorcells and reveal endothelial niches for stem cells.Cell 121,1109-1121.
Kopinke,D.,Roberson,E.C.,and Reiter,J.F.(2017).Ciliary HedgehogSignaling Restricts Injury-Induced Adipogenesis.Cell 170,340-351.e312.
Lees-Shepard,J.B.,Yamamoto,M.,Biswas,A.A.,Stoessel,S.J.,Nicholas,S.E.,Cogswell,C.A.,Devarakonda,P.M.,Schneider,M.J.,Cummins,S.M.,Legendre,N.P.,et al.(2018).Activin-dependent signaling in fibro/adipogenic progenitorscauses fibrodysplasia ossificans progressiva.Nat Commun 9,471.
Lock,M.,Alvira,M.,Vandenberghe,L.H.,Samanta,A.,Toelen,J.,Debyser,Z.,and Wilson,J.M.(2010).Rapid,simple,and versatile manufacturing of recombinantadeno-associated viral vectors at scale.Hum Gene Ther 21,1259-1271.
Long,C.,Amoasii,L.,Mireault,A.A.,McAnally,J.R.,Li,H.,Sanchez-Ortiz,E.,Bhattacharyya,S.,Shelton,J.M.,Bassel-Duby,R.,and Olson,E.N.(2016).Postnatal genome editing partially restores dystrophin expression in a mousemodel of muscular dystrophy.Science 351,400-403.
Lounev,V.Y.,Ramachandran,R.,Wosczyna,M.N.,Yamamoto,M.,Maidment,A.D.,Shore,E.M.,Glaser,D.L.,Goldhamer,D.J.,and Kaplan,F.S.(2009).Identification ofprogenitorcells that contribute to heterotopic skeletogenesis.J Bone JointSurg Am 91,652-663.
Lu,Y.,and Song,S.(2009).Distinct immune responses to transgeneproducts from rAAV1 and rAAV8 vectors.Proc Natl Acad Sci U S A 106,17158-17162.
Madisen,L.,Zwingman,T.A.,Sunkin,S.M.,Oh,S.W.,Zariwala,H.A.,Gu,H.,Ng,L.L.,Palmiter,R.D.,Hawrylycz,M.J.,Jones,A.R.,et al.(2010).A robust and high-throughput Cre reporting and characterization system for the whole mousebrain.Nat Neurosci 13,133-140.
Maesner,C.C.,Almada,A.E.,and Wagers,A.J.(2016).Established cellsurface markers efficiently isolate highly overlapping populations ofskeletal muscle satellite cells by fluorescence-activated cellsorting.Skeletal muscle 6,35.
Mendell,J.R.,Al-Zaidy,S.,Shell,R.,Arnold,W.D.,Rodino-Klapac,L.R.,Prior,T.W.,Lowes,L.,Alfano,L.,Berry,K.,Church,K.,et al.(2017).Single-DoseGene-Replacement Therapy for Spinal Muscular Atrophy.N Engl J Med 377,1713-1722.
Mingozzi,F.,and High,K.A.(2011).Therapeutic in vivo gene transfer forgenetic disease using AAV:progress and challenges.Nat Rev Genet 12,341-355.
Morgan,R.A.,Gray,D.,Lomova,A.,and Kohn,D.B.(2017).Hematopoietic StemCell Gene Therapy:Progress and Lessons Learned.Cell Stem Cell 21,574-590.
Nelson,C.E.,Hakim,C.H.,Ousterout,D.G.,Thakore,P.I.,Moreb,E.A.,Castellanos Rivera,R.M.,Madhavan,S.,Pan,X.,Ran,F.A.,Yan,W.X.,et al.(2016).Invivo genome editing improves muscle function in a mouse model of Duchennemuscular dystrophy.Science 351,403-407.
Patel,S.H.,O′Hara,L.,Atanassova,N.,Smith,S.E.,Curley,M.K.,Rebourcet,D.,Darbey,A.L.,Gannon,A.L.,Sharpe,R.M.,and Smith,L.B.(2017).Low-dosetamoxifen treatment in juvenile males has long-term adverse effects on thereproductive system:implications for inducible transgenics.Sci Rep 7,8991.
Randall,T.D.,and Weissman,I.L.(1997).Phenotypic and functionalchanges induced at the clonal level in hematopoietic stem cells after 5-fluorouracil treatment.Blood 89,3596-3606.
Roberts,E.W.,Deonarine,A.,Jones,J.O.,Denton,A.E.,Feig,C.,Lyons,S.K.,Espeli,M.,Kraman,M.,McKenna,B.,Wells,R.J.,et al.(2013).Depletion of stromalcells expressing fibroblast activation protein-αfrom skeletal muscle and bonemarrow results in cachexia and anemia.J Exp Med 210,1137-1151.
Sawai,C.M.,Babovic,S.,Upadhaya,S.,Knapp,D.J.H.F.,Lavin,Y.,Lau,C.M.,Goloborodko,A.,Feng,J.,Fujisaki,J.,Ding,L.,et al.(2016).Hematopoietic StemCells Are the Major Source of Multilineage Hematopoiesis in AdultAnimals.Immunity 45,597-609.
Schulz,T.J.,Huang,T.L.,Tran,T.T.,Zhang,H.,Townsend,K.L.,Shadrach,J.L.,Cerletti,M.,McDougall,L.E.,Giorgadze,N.,Tchkonia,T.,et al.(2011).Identification of inducible brown adipocyte progenitors residing in skeletalmuscle and white fat.Proc Natl Acad Sci U S A 108,143-148.
Seale,P.,Sabourin,L.A.,Girgis-Gabardo,A.,Mansouri,A.,Gruss,P.,andRudnicki,M.A.(2000).Pax7 is required for the specification of myogenicsatellite cells.Cell 102,777-786.
Sherwood,R.I.,Christensen,J.L.,Conboy,I.M.,Conboy,M.J.,Rando,T.A.,Weissman,I.L.,and Wagers,A.J.(2004).Isolation of adult mouse myogenicprogenitors:functional heterogeneity of cells within and engrafting skeletalmuscle.Cell 119,543-554.
Smith,L.J.,U1-Hasan,T.,Carvaines,S.K.,Van Vliet,K.,Yang,E.,Wong,K.K.,Agbandje-McKenna,M.,and Chatterjee,S.(2014).Gene transfer properties andstructural modeling of human stem cell-derived AAV.Mol Ther 22,1625-1634.
Sun,J.,Ramos,A.,Chapman,B.,Johnnidis,J.B.,Le,L.,Ho,Y.J.,Klein,A.,Hofmann,O.,and Camargo,F.D.(2014).Clonal dynamics of nativehaematopoiesis.Nature 514,322-327.
Tabebordbar,M.,Zhu,K.,Cheng,J.K.W.,Chew,W.L.,Widrick,J.J.,Yan,W.X.,Maesner,C.,Wu,E.Y.,Xiao,R.,Ran,F.A.,et al.(2016),In vivo gene editing indystrophic mouse muscle and muscle stem cells.Science 351,407-411.
Tan,K.Y.,Eminli,S.,Hettmer,S.,Hochedlinger,K.,and Wagers,A.J.(2011).Efficient generation of iPS cells from skeletal muscle stem cells.PLoS One6,e26406.
Uezumi,A.,Fukada,S.,Yamamoto,N.,Ikemoto-Uezumi,M.,Nakatani,M.,Morita,M.,Yamaguchi,A.,Yamada,H.,Nishino,I.,Hamada,Y.,et al.(2014).Identificationand characterization of PDGFRα+ mesenchymal progenitors in human skeletalmuscle.Cell Death Dis 5,e1186.
Uezumi,A.,Fukada,S.,Yamamoto,N.,Takeda,S.,and Tsuehida,K.(2010).Mesenchymal progenitors distinct from satellite cells contribute to ectopicfat cell formation in skeletal muscle.Nat Cell Biol 12,143-152.
Wagers,A.J.(2012).The stem cell niche in regenerative medicine.CellStem Cell 10,362-369.
Wang,Z.,Zhu,T.,Qiao,C.,Zhou,L.,Wang,B.,Zhang,J.,Chen,C.,Li,J.,andXiao,X.(2005).Adeno-associated virus serotype 8 efficiently delivers genes tomuscle and heart.Nat Biotechnol 23,321-328.
Yang,Y.,Wang,L.,Bell,P.,McMenamin,D.,He,Z.,White,J.,Yu,H.,Xu,C.,Morizono,H.,Musunuru,K.,et al.(2016).A dual AAV system enables the Cas9-mediated correction of a metabolic liver disease in newborn mice.NatBiotechnol 34,334-338.
Zhang,B.,Tsai,P.C.,Gonzalez-Celeiro,M.,Chung,O.,Boumard,B.,Perdigoto,C.N.,Ezhkova,E.,and Hsu,Y.C.(2016).Hair follicles′transit-amplifying cellsgovern concurrent dermal adipocyte production through Sonic Hedgehog.GenesDev 30,2325-2338.
Zinearelli,C.,Soltys,S.,Rengo,G.,and Rabinowitz,J.E.(2008).Analysisof AAV serotypes 1-9 mediated gene expression and tropism in mice aftersystemic injection.Mol Ther 16,1073-1080.
Zinn,E.,Pacouret,S.,Khaychuk,V.,Turunen,H.T.,Carvalho,L.S.,Andres-Mateos,E.,Shah,S.,Shelke,R.,Maurer,A.C.,Plovie,E.,et al.(2015).In SilicoReconstruction of the Viral Evolutionary Lineage Yields a Potent Gene TherapyVector.Cell Rep 12,1056-1068.
实施例2
将携带金黄色葡萄球菌Cas9(saCas9)+靶向Dnmt3a或对照基因座(Jak2)的gRNA的AAV注射到2个月大的C57BL/6小鼠中。四个月后,在每个治疗组中从一只小鼠中收获肝和骨髓。造血干细胞(HSC)和多能祖细胞(MPP)是从骨髓分离的FACS。此外,从这些群体/器官(肝、骨髓、HSC和MPP)中的每一个扩增Dnmt3a基因座处的基因组DNA并进行测序。
结果
图11A示出了经编辑的读段的百分比,即,含有gRNA靶向位点的扩增Dnmt3a序列中含有插入缺失的测序读段的百分比。图11B示出了%WT读段的百分比,即,映射到野生型Dnmt3a序列的测序读段的百分比。如图11A所示,靶向gRNA的Dnmt3a在肝中引入了约30%的Dnmt3a基因座编辑。在骨髓以及HSC和MPP群体中在约0.5%的读段中也检测到插入缺失。这些插入缺失在切割位点周围显示特征性的Cas9诱导的插入缺失峰(图11C至图11F)。靶向Jak2的gRNA不诱导Dnmt3a编辑,指示所述方法的特异性。
- 原位基因编辑
- 一种豌豆CRISPR/Cas9基因编辑载体、基因编辑系统及基因编辑方法
